修回日期: 2013-11-10
接受日期: 2013-11-19
在线出版日期: 2014-01-28
目的: 探讨SB203580对肝纤维化大鼠肝脏Ⅰ、Ⅲ型胶原蛋白表达的影响.
方法: 将32只♀SD大鼠分为4组: 正常组(N组)8只、肝纤维化组(HF组)8只、DMSO溶剂干预组(D组)8只、P38MAPK抑制剂SB203580干预组(SB组)8只. 采用四氯化碳复合因素法复制肝纤维化模型, 肝纤维化模型制作结束后, D组给予2‰DMSO溶液3 mL/(kg·d), SB组给予SB203580溶液10 mg/(kg·d), N组、HF组给予同等剂量0.9%生理盐水3 mL/(kg·d)腹腔注射, 连续注射4 d. 干预结束后, 宰杀大鼠留取肝脏, 行肝组织病理切片HE染色评价肝纤维化分期, 行Masson染色观察胶原纤维沉积情况, 采用SP免疫组织化学法检测肝脏Ⅰ、Ⅲ型胶原蛋白表达, 应用逆转录PCR法检测肝脏中Ⅰ、Ⅲ型胶原 mRNA表达.
结果: 正常对照组(N组)、肝纤维化组(HF组)、SB203580溶剂组(DMSO组)和P38MAPK通路特异性抑制剂组(SB203580组)的肝纤维化分期平均秩分别为4.50、22.50、24.00和15.00; SSS评分分别为2.750±0.707、15.875±0.835、16.000±0.926和11.625±0.916; Ⅰ型胶原显色指数分别为1.575±0.249、7.650±0.621、7.725±0.501和4.625±0.495; Ⅲ型胶原显色指数分别为2.375±0.518、4.025±0.446、4.075±0.544和3.375±0.167; Ⅰ型胶原mRNA表达分别为0.020±0.003、0.012±0.002、0.009±0.002和0.016±0.005; Ⅲ型胶原mRNA表达分别为0.412±0.772、0.773±0.137、0.799±0.116和0.572±0.862. HF组与N组相比, Ⅰ、Ⅲ型胶原及其mRNA表达升高(均P<0.001), 与肝纤维化分期结果一致(P<0.001); D组与HF组无明显差异(均P>0.05); SB组与HF组相比, Ⅰ、Ⅲ型胶原表达降低(Ⅰ型胶原显色指数P<0.001, Ⅲ型胶原显色指数P = 0.041); Ⅰ型胶原mRNA表达降低(P = 0.005), 同时Ⅲ型胶原mRNA表达亦降低(P = 0.005), 肝纤维化分期下降(P = 0.015).
结论: P38MAPK抑制剂SB203580阻断P38MAPK通路具有降低肝脏Ⅰ、Ⅲ型胶原表达的作用, 能够延缓肝纤维化的发生发展.
核心提示: P38MAPK在细胞的炎症反应、细胞凋亡等各种反应和免疫调节等过程中起重要作用, 其活化与肝纤维化有密切关系. 本研究表明, P38MAPK抑制剂SB203580阻断P38MAPK通路具有降低肝脏Ⅰ、Ⅲ型胶原表达的作用, 能够延缓肝纤维化的发生发展. 为阐述肝纤维化的分子机制提供理论基础.
引文著录: 杨新疆, 齐翠花, 郑勇, 曹玉文, 李睿, 宋丽秀, 赵强, 陈卫刚. SB203580对肝纤维化大鼠肝脏Ⅰ、Ⅲ型胶原蛋白表达的影响. 世界华人消化杂志 2014; 22(3): 310-318
Revised: November 10, 2013
Accepted: November 19, 2013
Published online: January 28, 2014
AIM: To investigate the effect of P38MAPK inhibitor SB203580 on collagen Ⅰ and collagen Ⅲ expression in the liver of rats with experimental hepatic fibrosis.
METHODS: Thirty-two female SD rats were randomly divided into four groups: a normal control group, a hepatic fibrosis group, a dimethyl sulfoxide (DMSO) group and a SB203580 group. Except the normal control group, rats in other groups were subcutaneously injected with carbon tetrachloride to induce hepatic fibrosis. The DMSO group was intraperitoneally injected with 2‰ DMSO [3 mL/(kg·d)]. Rats in the SB203580 group were intraperitoneally injected with SB203580 [10 mg/(kg·d), dissolved in DMSO]. Fibrosis was staged using histopathological methods. The expression of collagen Ⅰ and collagen Ⅲ was detected by immunohistochemistry and RT-PCR.
RESULTS: In the normal control group, hepatic fibrosis group, DMSO group and SB203580 group, mean rank of liver fibrosis stage was 4.50, 22.50, 24.00 and 15.00, respectively; SSS scores were 2.750 ± 0.707, 15.875 ± 0.835, 16.000 ± 0.926 and 11.625 ± 0.916, respectively; color rendering indexes of collagen Ⅰ were 1.575 ± 0.249, 7.650 ± 0.621, 7.725 ± 0.501 and 4.625 ± 0.495, respectively; color rendering indexes of collagen Ⅲ were 2.375 ± 0.518, 4.025 ± 0.446, 4.075 ± 0.544 and 3.375 ± 0.167, respectively; the relative expression levels of collagen Ⅰ were 0.020 ± 0.003, 0.012 ± 0.002, 0.009 ± 0.002 and 0.016 ± 0.005, respectively; the relative expression levels of collagen Ⅲ were 0.412 ± 0.772, 0.773 ± 0.137, 0.799 ± 0.116 and 0.572 ± 0.862, respectively. Compared to the normal control group, the stage of fibrosis was elevated (P < 0.001) and the expression of collagen Ⅰ and collagen Ⅲ was increased (both P < 0.001) in the hepatic fibrosis group. Compared to the hepatic fibrosis group, the stage of fibrosis declined (P = 0.015) and the expression of collagen Ⅰ (P < 0.001) and collagen Ⅲ (P = 0.041) was decreased in the SB203580 group.
CONCLUSION: P38MAPK inhibitor SB203580 decreases the expression of collagen Ⅰ and collagen Ⅲ and inhibits the progression of hepatic fibrosis in rats.
- Citation: Yang XJ, Qi CH, Zheng Y, Cao YW, Li R, Song LX, Zhao Q, Chen WG. SB203580 decreases collagen Ⅰ and collagen Ⅲ expression in the liver of rats with experimental hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2014; 22(3): 310-318
- URL: https://www.wjgnet.com/1009-3079/full/v22/i3/310.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i3.310
肝纤维化(hepatic fibrosis, HF)是肝脏对各种慢性刺激进行损伤修复反应时, 以胶原为主的细胞外基质(extracellular matrix, ECM)在肝内大量沉积的病理过程. 因其发生机制尚未完全明确, 故已成为目前国内外学者研究的热点. 近年来, HF形成过程中信号传导通路作为研究热点受到越来越多的关注. 其中丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)级联是细胞内重要的信号传导系统之一, 其将细胞外刺激信号传递到细胞核引起一系列细胞生物学反应. 而P38MAPK作为MAPK家族的重要信号通路, 在细胞炎症、增殖、应激、凋亡、细胞周期和生长等多种生理和病理过程中起着重要作用[1]. 因此, 本实验复制肝纤维化模型, 通过P38MAPK特异性抑制剂SB203580的干预, 观察肝脏组织病理学变化, 检测与肝纤维化进程中关系最为密切的Ⅰ、Ⅲ型胶原沉积情况, 探讨其对肝纤维化的影响, 为进一步研究P38MAPK通路与肝纤维化的关系提供理论基础.
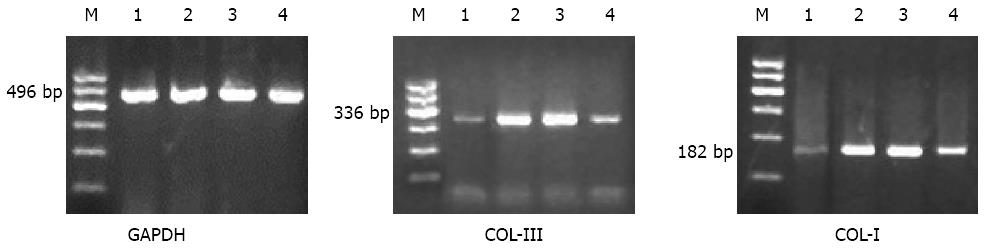
32只实验大鼠购自新疆医科大学实验动物中心, 均为同期出生、纯种系、SPF级4-5周龄的健康♀SD大鼠, 体质量约180-220 g. DMSO为韩国BIOSHARP公司产品, 兔抗大鼠Ⅰ型胶原蛋白多克隆抗体、兔抗大鼠Ⅲ型胶原蛋白多克隆抗体为美国Abcam公司产品; 免疫组织化学染色SP试剂盒为北京中杉公司产品; DAB显色剂为DAKO公司产品; RNA提取试剂TRIzol为美国Invitrogen公司产品; 逆转录酶试剂盒为美国Fermentas公司产品; 四氯化碳、无水乙醇、胆固醇粉均为国产分析纯. PCR引物由上海生物工程公司合成, COL-Ⅰ mRNA引物序列[2]: Forward: 5'-GGTCCCAAAGGTGCTGATGG-3', Reverse: 5'-GACCAGCCTCACCACGGTCT-3', 扩增长度为182 bp; COL-Ⅲ mRNA引物序列[2]: Forward: 5'-CGAGGTGACAGAGGTGAAAGA-3', Reverse: 5'-AACCCAGTATTCTCCGCTCTT-3', 扩增长度为336 bp; GAPDH引物序列: Forward: 5'-CAAGGTCATCCATGACAACTTTG-3', Reverse: 5'-CAAGGTCATCCATGACAACTTTG-3', 扩增长度为496 bp.
1.2.1 制备模型及实施干预: 根据本课题组前期实验经验, 采用四氯化碳复合因素法复制肝纤维化大鼠模型. 将44只大鼠随机分为4组: N组(正常对照组)8只, HF组(肝纤维化组)12只, DMSO组(SB203580溶剂组)12只和SB203580组(P38MAPK通路特异性抑制剂组)12只. 给予HF组、DMSO组和SB203580组大鼠背部皮下注射40%四氯化碳棉籽油溶液, 首剂5 mL/kg体质量, 后每隔4 d注射一次, 剂量为3 mL/kg体质量, 共注射12次; 以100 mL/L乙醇溶液为唯一饮用液体; 前2 wk喂以20%猪油高脂肪饲料, 以后喂以0.5%高胆固醇饲料; N组同期给予相同剂量的生理盐水背部皮下注射, 喂正常复合饲料, 饮清洁饮用水. 肝纤维化模型制作结束后, D组给予2‰DMSO溶液3 mL/(kg·d), SB组给予SB203580溶液10 mg/(kg·d), N组、HF组给予同等剂量0.9%生理盐水3 mL/(kg·d)腹腔注射, 连续注射4 d. 干预治疗后实验各组大鼠的数量均为8只.
1.2.2 标本留取: 模型复制及干预剂实施结束后,乙醚麻醉后处死大鼠, 取大鼠肝左叶以40 g/L中性甲醛溶液固定, 其余肝脏投入液氮速冻后置于-80 ℃备用.
1.2.3 肝组织形态学观察: 石蜡包埋组织制作切片(4 µm), 行HE染色观察肝纤维化分期, 分期标准符合《病毒性肝炎肝炎防治方案》[3]; 行Masson染色观察肝组织胶原沉积情况, 评价标准依照《肝纤维化诊断及疗效评估共识》[4]中纤维化半定量评分系统(SSS).
1.2.4 SP免疫组织化学法检测肝组织COL-Ⅰ、COL-Ⅲ表达: 石蜡切片常规脱蜡至水; 3%H2O2甲醇溶液室温孵育10 min以阻断内源性过氧化物酶; PBS浸洗3遍, 0.01 mol/L枸橼酸盐缓冲液(pH 6.0)高温修复8 min; 自然冷却至室温后PBS浸洗5 min×3次, 滴加适量山羊血清工作液, 37 ℃封闭20 min; 甩去多余血清, 滴加COL-Ⅰ一抗(1:200)或COL-Ⅲ一抗(1:200), 4 ℃过夜. 次日PBS浸洗5 min×3次, 滴加生物素化山羊抗兔二抗工作液, 37 ℃孵育20 min; PBS浸洗5 min×3次, 滴加辣根酶标记链霉卵白素工作液, 37 ℃孵育20 min后PBS浸洗5 min×3次. DAB显色, 镜下观察以控制显色时间. 显色满意后, 自来水冲去DAB, 苏木素复染, 0.1%盐酸乙醇分化, 自来水中返蓝, 脱水、透明、中性树脂封片. 选取人正常皮肤组织作为阳性对照; 阴性对照为N组大鼠肝脏, 以滴加PBS代替一抗. COL-Ⅰ、COL-Ⅲ结果以细胞外基质着棕黄色为阳性染色. 请石河子大学医学院病理教研室曹玉文副教授阅片, 每张切片随机观察10个高倍视野(×200), 以显色指数代表目的蛋白的表达水平, 显色指数越大则目的蛋白越多, 反之则越少.
1.2.5 RT-PCR法检测肝组织中COL-Ⅰ mRNA和COL-Ⅲ mRNA的表达: 使用TRIzol法提取肝脏总RNA, 用紫外分光光度仪行RNA浓度及纯度测定, A260/280为1.9-2.0. 说明RNA纯度较高, 并将总RNA调至相同浓度. 使用RevertAidTMH Minus First Strand cDNA Synthesis kit试剂盒将总RNA逆转录为cDNA, 然后进行PCR扩增. COL-Ⅰ mRNA扩增条件: 95 ℃ 5 min, 95 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 30 s, 共36个循环; 72 ℃延伸10 min. COL-Ⅲ mRNA扩增条件: 95 ℃ 5 min, 95 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 30 s, 共36个循环; 72 ℃延伸10 min. GAPDH扩增条件: 95 ℃ 5 min, 95 ℃ 30 s, 58 ℃ 30 s, 72 ℃ 30 s, 共36个循环; 72 ℃延伸10 min. 反应结束后, PCR产物用2%琼脂糖凝胶进行电泳分析, 采用Quantity one凝胶成像分析系统测定各相应条带的灰度值, 选取GAPDH作为内参照, 以COL-Ⅰ/GAPDH和COL-Ⅲ/GAP-DH的比值作为目的基因的相对表达水平.
统计学处理 采用SPSS17.0统计软件进行分析. 计量资料数据以mean±SD表示, 选择单因素方差分析进行均数差异性比较, 多样本两两比较选择Bonferroni法; 肝纤维化分期半定量资料的比较采用多样本比较的秩和检验(Kruskal-Wallis法), 多样本间两两比较时选择Mann-Whitney U法. P<0.05为差异有统计学意义.
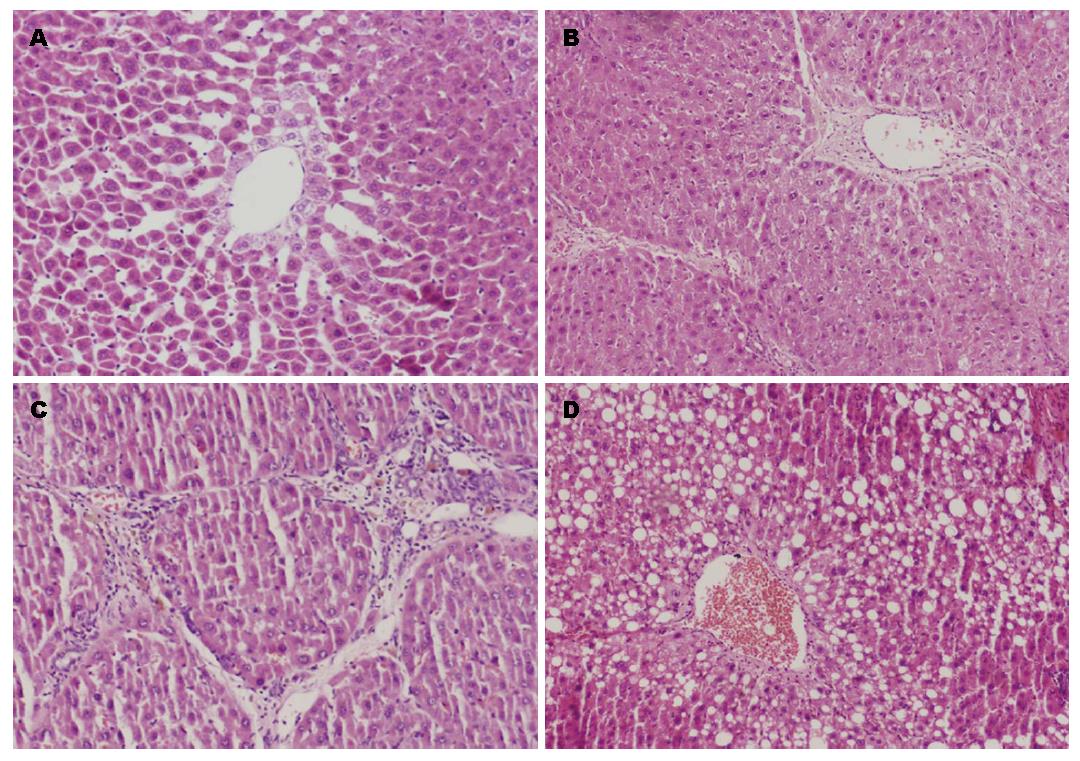
肝组织HE染色可知(图1): N组肝小叶结构清晰, 小叶内肝细胞无脂肪变性、坏死, 无炎症细胞浸润及纤维组织增生. HF组肝小叶结构紊乱, 纤维组织增生、假小叶形成, 肝细胞变性、坏死明显, 部分细胞可见气球样变, 有大量炎细胞浸润. D组与HF组所见无明显差异. SB组肝组织仍可见假小叶结构, 但部分区假小叶纤维间隔变窄或局灶模糊不清, 肝细胞脂肪变性、坏死较HF组为轻. HF组、D组肝纤维化分期较N组明显升高(P<0.001), 给予SB203580干预的SB组其肝纤维化分期较HF组降低(P = 0.015), 差异均具有统计学意义(表1).
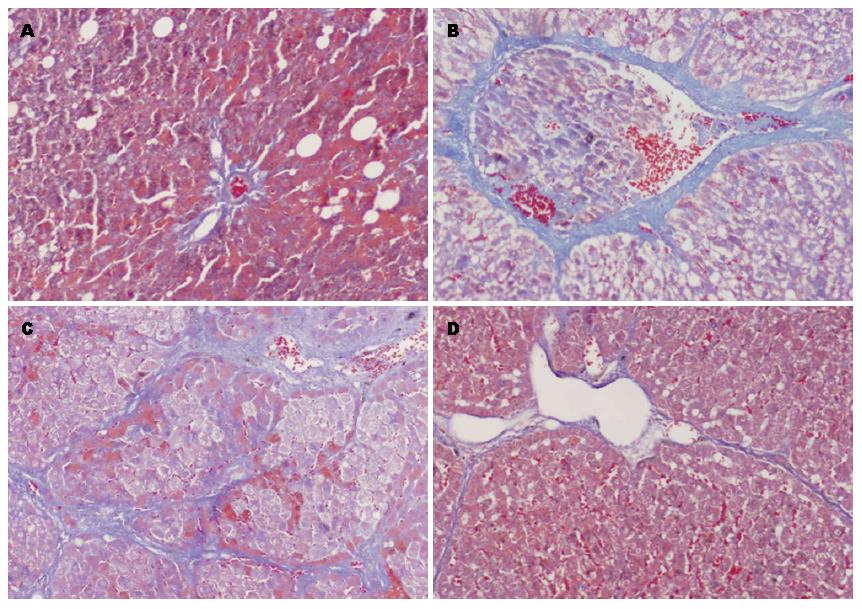
肝组织Masson染色可知(图2): N组肝小叶结构完整, 仅中央静脉和汇管区有少量胶原纤维; F组肝小叶结构破坏, 胶原纤维增多增粗, 呈弥漫分布; D组与HF组所见无明显差异; SB组仍可见部分假小叶结构, 但胶原纤维沉积减少, 纤维间隔纤细菲薄. HF组SSS评分较N组明显升高(P<0.001), SB组其SSS评分较HF组降低(P<0.001), 差异均具有统计学意义(表2).
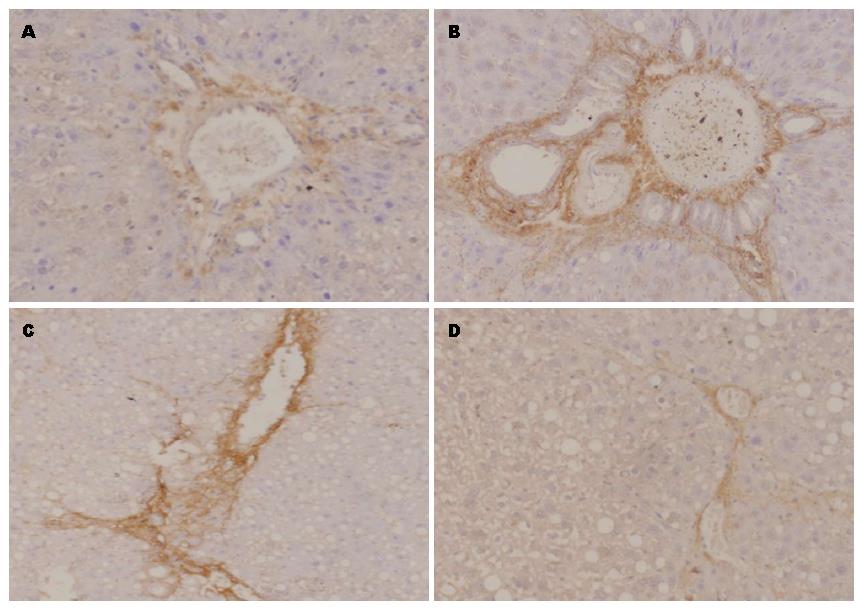
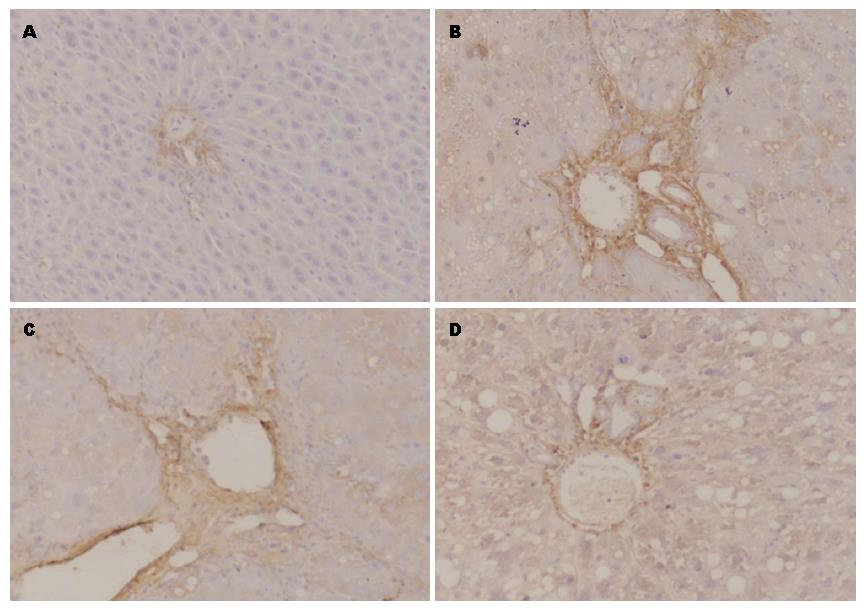
免疫组织化学染色示: N组肝组织中央静脉、汇管区中可见少量Ⅰ型(图3)、Ⅲ型(图4)胶原表达. HF组肝组织Ⅰ型、Ⅲ型胶原成条索状或小片状广泛分布, 主要表达于中央静脉、汇管区以及肝窦Disse间隙中, 显色指数均较N组显著升高(均P<0.001). SB203580干预的SB组Ⅰ型、Ⅲ型胶原表达部位基本同HF组, 但显色面积减少、显色强度降低, 且显色指数较HF组降低(COL-Ⅰ显色指数P<0.001, COL-Ⅲ显色指数P = 0.041). 差异均具有统计学意义(表2).
与N组相比, HF组肝脏COL-ⅠmRNA及COL-Ⅲ mRNA表达均明显升高(均P<0.001), 而SB组肝脏COL-ⅠmRNA及COL-Ⅲ mRNA表达均较HF组降低(分别P = 0.005、0.005). 差异均具有统计学意义(表3, 图5).
肝纤维化是肝组织损害后的一种损伤修复反应, 以细胞外基质(extracellular matrix, ECM)的过度沉积为特点. 如果慢性炎症和ECM沉积持续存在, 会导致肝实质结构逐渐被破坏, 由瘢痕组织代替, 从而形成肝硬化, 预后较差[5]. 目前尚无特效药物能将肝硬化治愈, 但肝纤维化作为各种慢性肝病进展为肝硬化的一个必经阶段, 已被证实是可逆的[6]. 肝纤维化的发生发展是一个复杂的全身病理生理过程, 涉及多种细胞因子及细胞内信号分子网络. 肝纤维化的形成机制中, 肝星状细胞(hepatic stellate cell, HSC)活化是公认的中心环节. 其活化后向肌成纤维细胞转变, 可分泌大量细胞外基质成分, 包括Ⅰ、Ⅲ型胶原、透明质酸和层黏连蛋白, 同时使胶原酶活性下降, 胶原降解减少, 造成细胞外基质产生与降解失平衡, 纤维化形成[7]. 目前[8]认为活化的HSC有2个去向: (1)由激活态转变回静止态; (2)发生凋亡而死亡. 且大多数研究表明, 活化的HSC主要通过凋亡途径消除, 是肝纤维化消退的主要机制.
近年来, 肝纤维化形成过程中信号传导通路作为研究热点受到越来越多的关注. 其中丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)级联是细胞内重要的信号传导系统之一, 其将细胞外刺激信号传递到细胞核引起一系列细胞生物学反应[9]. 主要成员包括细胞外信号调节激酶、C-jun氨基末端激酶和P38MAPK. P38MAPK通路在MAPK信号通路中占重要地位[10], 是近年信号传导领域研究的热点之一. P38MAPK在细胞的炎症反应、细胞凋亡等各种反应和免疫调节等过程中起重要作用[11]. 叶平等[12]发现, P38MAPK的活化与肝纤维化有密切关系, 因此他在肝纤维化形成过程中的作用受到众多研究者的关注. SB203580是一种P38MAPK的特异性抑制剂, 他可以通透细胞抑制P38MAPK, 抑制后续MAPKAPK-2和MAPKAPK-3的激活. 通过抑制P38MAPK, SB203580可以有效抑制一些炎症因子(如IL-1β、TNF-α)诱导的部分信号转导. 研究显示[13], SB203580可阻断P38MAPK通路的活化, 进而激活Caspase3引起HSC-T6的凋亡. 有报道称[14], SB203580阻断P38MAPK信号通路后肝星状细胞增殖明显受到抑制, 且增殖抑制程度与药物浓度有剂量依赖关系. 崔巍等[15]研究发现, 血管紧张素Ⅱ通过P38MAPK通路促进HSC分泌TGF-β1, 进而增加HSC活化以及细胞外基质合成. 肝星状细胞的活化增殖与肝纤维化的形成密切相关, 吴文娟等[16]证明, P38MAPK表达水平与肝纤维化程度呈显著正相关. 说明在肝纤维化形成中, P38MAPK被激活, 活化的P38MAPK转移入核内, 磷酸化下游转录因子, 调节目的基因的表达, 从而可能由此参与了大鼠肝纤维化形成.
因此, 本实验复制肝纤维化模型, 通过P38MAPK特异性抑制剂SB203580的干预, 观察肝脏组织病理学变化, 检测与肝纤维化进程中关系最为密切的Ⅰ、Ⅲ型胶原沉积情况, 探讨其对肝纤维化的影响, 为进一步研究P38MAPK通路与肝纤维化的关系提供理论基础.
本实验表明: 正常大鼠肝脏内Ⅰ、Ⅲ型胶原表达很少, 肝纤维化组大鼠肝脏纤维化分期及Ⅰ、Ⅲ型胶原的表达较正常组明显升高, 说明肝纤维化模型复制成功; 肝纤维化大鼠在给予P38MAPK通路特异性抑制剂SB203580后肝内Ⅰ、Ⅲ型胶原的表达降低, 同时从组织病理学观察肝纤维化分期下降, 表明SB203580能够减少胶原沉积, 改善肝脏损害.
肝脏内HSC是分泌ECM的主要细胞[17]. 多篇文献证实[18-20], 肝脏受到损伤刺激时, 位于窦周Disse间隙内静止态的HSC活化, 转变成具有增殖、收缩、迁移、促进炎症和纤维生成活性的表型-肌成纤维细胞(myofibroblasts, MFBs), MFBs能调节组织损伤修复, 通过合成胶原促进ECM累积, 表达α-平滑肌肌动蛋白(alpha smooth muscle actin, α-SMA), 表现收缩功能[21]. 而肝纤维化的持续存在主要是由肝脏MFBs维持[22]. P38MAPK信号通路参与了细胞的生长发育及细胞间功能同步等多种生理过程, 与炎症及细胞周期调控密切相关, MAPK信号通路能够通过调控HSC的活化、增殖、凋亡等参与肝纤维化的形成[23]. 陈辉等[24]发现, 激活肝星状细胞p38MAPK信号通路可调节肝纤维化相关因子MMP-13和TIMP-1的表达. 徐霞等[25]研究发现, H2S激活P38MAPK信号通路, 同时加用SB203580阻断P38MAPK信号通路后, 可促进H2S刺激的HSC的凋亡. 亦有研究发现[26], 用阻断剂SB203580阻断P38MAPK可以降低静息HSC的α-SMA蛋白表达, 并可调节其细胞周期, 改变HF的进程. 姚希贤等[27]发现: 阻断P38MAPK通路可以明显抑制IL-1b促大鼠HSCⅠ型胶原合成的作用. Tsukada[28]研究发现, 阻断P38MPAK通路可降低培养活化的和TGFp诱导活化的HSCα1(Ⅰ)胶原基因的表达. Adachi等[29]研究者发现, 在PDGF诱导HSC增殖过程中, HSC细胞NAD(P)H氧化酶的表达可以被PDGF-BB可诱导, 并生成活性氧, 进而通过P38MAPK信号通路产生促进HSC增殖作用, 而用SB203580阻断P38MAPK信号通路能明显抑制增殖, 促进凋亡. 李政通等[30]进一步研究发现, P38MAPK的表达增多能够促进HF形成, 反之在其表达减少时则可促进HF的逆转.
总之, 抑制 P38MAPK通路能减, 少肝细胞的损伤和凋亡而间接抑制HSC的激活, 或者直接抑制HSC增殖, 使Ⅰ、Ⅲ型胶原的合成来源减少; 亦通过增加Ⅰ、Ⅲ型胶原的降解, 使ECM的沉积减少. 我们的研究表明, 抑制P38MAPK通路能够减少肝内Ⅰ、Ⅲ型胶原表达, 延缓肝纤维化的进程, 这为进一步研究P38MAPK通路与肝纤维化的关系提供理论基础.
目前尚无特效药物能将肝硬化治愈, 但肝纤维化作为各种慢性肝病进展为肝硬化的一个必经阶段, 已被证实是可逆的. P38MAPK信号通路在细胞的炎症反应、细胞凋亡等各种反应和免疫调节等过程中起重要作用. 研究发现, P38MAPK的活化与肝纤维化有密切关系, 因此他在肝纤维化形成过程中的作用受到众多研究者的关注.
李淑德, 教授, 第二军医大学长海医院消化内科
近年来, 肝纤维化形成过程中的信号传导通路作为研究热点受到越来越多的关注.其中丝裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)级联是细胞内重要的信号传导系统之一, 其主要之一P38MAPK通路在MAPK信号通路中占重要地位, 是近年信号传导领域研究的热点之一.
MAPK级联是细胞内重要的信号传导系统之一, 其将细胞外刺激信号传递到细胞核引起一系列细胞生物学反应. 本实验复制肝纤维化模型, 通过P38MAPK特异性抑制剂SB203580的干预, 发现肝纤维化大鼠在给予SB203580后肝内Ⅰ、Ⅲ型胶原的表达降低, 同时从组织病理学观察肝纤维化分期下降, 表明SB203580能够减少胶原沉积, 改善肝脏损害.
本实验通过P38MAPK特异性抑制剂SB203580的干预, 观察肝脏组织病理学变化, 检测与肝纤维化进程中关系最为密切的Ⅰ、Ⅲ型胶原沉积情况, 探讨其对肝纤维化的影响, 为进一步研究P38MAPK通路与肝纤维化的关系提供理论基础.
P38MAPK在细胞的炎症反应、细胞凋亡等各种反应和免疫调节等过程中起重要作用. 目前肝硬化的治疗尚为世界性难题, 只有在深入明确其具体机制后, 才能为临床应用提供指导依据. 本研究为肝纤维化的基础研究, 仅为肝纤维化研究提供进一步的理论基础.
本文通过P38MAPK通路抑制剂SB203580干预大鼠肝脏Ⅰ、Ⅲ型胶原蛋白表达,并探讨肝纤维化发生的分子机制, 具有重要临床指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Tsukada S, Parsons CJ, Rippe RA. Mechanisms of liver fibrosis. Clin Chim Acta. 2006;364:33-60. [PubMed] |
| 2. | Fang HL, Lai JJ, Lin WL, Lin WC. A fermented substance from Aspergillus phoenicis reduces liver fibrosis induced by carbon tetrachloride in rats. Biosci Biotechnol Biochem. 2007;71:1154-1161. [PubMed] [DOI] |
| 5. | Hernandez-Gea V, Friedman SL. Pathogenesis of liver fibrosis. Annu Rev Pathol. 2011;6:425-456. [PubMed] [DOI] |
| 6. | Ramachandran P, Iredale JP. Reversibility of liver fibrosis. Ann Hepatol. 2009;8:283-291. [PubMed] |
| 7. | Iwaisako K, Brenner DA, Kisseleva T. What's new in liver fibrosis? The origin of myofibroblasts in liver fibrosis. J Gastroenterol Hepatol. 2012;27 Suppl 2:65-68. [PubMed] [DOI] |
| 9. | Wen J, Watanabe K, Ma M, Yamaguchi K, Tachikawa H, Kodama M, Aizawa Y. Edaravone inhibits JNK-c-Jun pathway and restores anti-oxidative defense after ischemia-reperfusion injury in aged rats. Biol Pharm Bull. 2006;29:713-718. [PubMed] |
| 10. | Deng ZY, Li J, Jin Y, Chen XL, Lü XW. Effect of oxymatrine on the p38 mitogen-activated protein kinases signalling pathway in rats with CCl4 induced hepatic fibrosis. Chin Med J (Engl). 2009;122:1449-1454. [PubMed] |
| 11. | Jameel NM, Thirunavukkarasu C, Wu T, Watkins SC, Friedman SL, Gandhi CR. p38-MAPK- and caspase-3-mediated superoxide-induced apoptosis of rat hepatic stellate cells: reversal by retinoic acid. J Cell Physiol. 2009;218:157-166. [PubMed] [DOI] |
| 13. | 卓 强, 蒋 明德, 梅 浙川. P38MAPK信号通路对大鼠肝星状细胞凋亡的影响. 吉林大学学报(医学版). 2011;4:6. |
| 14. | 郑 人源, 蒋 明德, 梅 浙川, 卓 强, 叶 平, 唐 文. 肝星状细胞增殖与p38丝裂原活化蛋白激酶信号传导通路的关系. 中国组织工程研究与临床康复. 2011;15:3711-37. |
| 16. | 吴 文娟, 杨 妙芳, 许 小兵, 张 晓华, 季 洪赞, 袁 柏思, 朱 人敏. p38 MAPK在大鼠实验性肝纤维化发生中的表达及其意义. 世界华人消化杂志. 2008;16:3822-3827. [DOI] |
| 17. | Gressner AM, Weiskirchen R. Modern pathogenetic concepts of liver fibrosis suggest stellate cells and TGF-beta as major players and therapeutic targets. J Cell Mol Med. 2006;10:76-99. [PubMed] |
| 18. | Choi SS, Syn WK, Karaca GF, Omenetti A, Moylan CA, Witek RP, Agboola KM, Jung Y, Michelotti GA, Diehl AM. Leptin promotes the myofibroblastic phenotype in hepatic stellate cells by activating the hedgehog pathway. J Biol Chem. 2010;285:36551-36560. [PubMed] |
| 20. | Ikeda N, Murata S, Maruyama T, Tamura T, Nozaki R, Kawasaki T, Fukunaga K, Oda T, Sasaki R, Homma M. Platelet-derived adenosine 5'-triphosphate suppresses activation of human hepatic stellate cell: In vitro study. Hepatol Res. 2012;42:91-102. [PubMed] [DOI] |
| 21. | Hinz B, Phan SH, Thannickal VJ, Prunotto M, Desmoulière A, Varga J, De Wever O, Mareel M, Gabbiani G. Recent developments in myofibroblast biology: paradigms for connective tissue remodeling. Am J Pathol. 2012;180:1340-1355. [PubMed] [DOI] |
| 22. | Parola M, Marra F, Pinzani M. Myofibroblast - like cells and liver fibrogenesis: Emerging concepts in a rapidly moving scenario. Mol Aspects Med. 2008;29:58-66. [PubMed] |
| 23. | Schwer CI, Guerrero AM, Humar M, Roesslein M, Goebel U, Stoll P, Geiger KK, Pannen BH, Hoetzel A, Schmidt R. Heme oxygenase-1 inhibits the proliferation of pancreatic stellate cells by repression of the extracellular signal-regulated kinase1/2 pathway. J Pharmacol Exp Ther. 2008;327:863-871. [PubMed] [DOI] |
| 26. | Schnabl B, Bradham CA, Bennett BL, Manning AM, Stefanovic B, Brenner DA. TAK1/JNK and p38 have opposite effects on rat hepatic stellate cells. Hepatology. 2001;34:953-963. [PubMed] |
| 28. | Tsukada S, Westwick JK, Ikejima K, Sato N, Rippe RA. SMAD and p38 MAPK signaling pathways independently regulate alpha1(I) collagen gene expression in unstimulated and transforming growth factor-beta-stimulated hepatic stellate cells. J Biol Chem. 2005;280:10055-10064. [PubMed] |
| 29. | Adachi T, Togashi H, Suzuki A, Kasai S, Ito J, Sugahara K, Kawata S. NAD(P)H oxidase plays a crucial role in PDGF-induced proliferation of hepatic stellate cells. Hepatology. 2005;41:1272-1281. [PubMed] |