修回日期: 2014-05-10
接受日期: 2014-05-29
在线出版日期: 2014-07-18
目的: 探讨选择性c-Jun氨基末端激酶(Jun N-terminal kinase, JNK)抑制剂SP600125对大鼠非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)的保护作用及机制.
方法: 48只♂SD大鼠随机分为正常对照组(NC, 18只)、模型组(HF组, 15只)和SP600125干预组(SP干预组, 15只). HF组及SP干预组大鼠高脂饮食12 wk, 建立高脂诱导的NASH模型, 12 wk时分别处死NC组大鼠6只, HF组及SP干预组各3只, 用于NASH模型病理学鉴定. 最终NC组、HF组及SP干预组大鼠数目均为12只. HF组及SP干预组大鼠建立经皮肠系膜上静脉给药途径, HF组给予二甲基亚砜, SP干预组给予SP600125(50 mg/kg), 1次/d, 连续4 wk. 第16周处死全部大鼠, 采用ELISA法测定匀浆液的肿瘤坏死因子α、白介素-6含量; HE染色观察肝组织普通病理变化. Masson染色观察肝组织纤维化程度. 苏丹Ⅳ染色观察肝组织脂肪变的程度. 采用RT-PCR方法检测JNK mRNA. 采用免疫印迹(Western blot)法检测c-Jun蛋白和磷酸化蛋白水平.
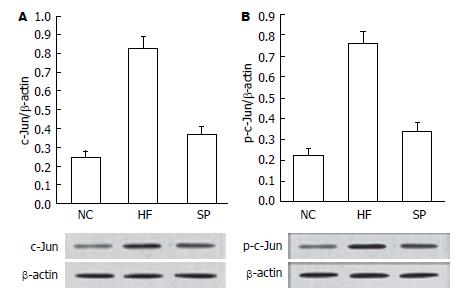
结果: 高脂饮食16 wk后, SD大鼠肝组织呈弥漫性脂肪变性, 炎性细胞浸润及小叶内坏死灶增多, 可见明显的窦周纤维化及中央静脉周围纤维化. SP干预组大鼠肝组织炎性反应、脂肪变性及纤维化程度均较模型对照组改善, 差异具有统计学意义; RT-PCR结果显示: 正常大鼠肝脏组织内JNK mRNA表达量少, HF组表达量增加, 差异具有统计学意义. 而SP干预组较模型JNK mRNA表达量减少, 差异具有统计学意义. Western blot结果显示: HF组较NC组大鼠肝组织中c-Jun蛋白及p-c-Jun升高, 差异具有统计学意义. 而SP干预组c-Jun蛋白及p-c-Jun较HF组明显减少, 差异具有统计学显著性意义.
结论: SP600125可能通过抑制JNK通路阻止NASH发生, 有望成为治疗NASH的新型药物.
核心提示: 非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)以胰岛素抵抗(insulin resistance, IR)和炎症反应为特征. c-Jun氨基末端激酶(Jun N-terminal kinase, JNK)信号转导通路参与到NASH发病机制中IR和炎症反应这两个关键环节, 因此抑制JNK的活性有可能成为治疗NASH的有效方法. 本研究采用新型JNK抑制剂-SP600125, 建立肠系膜上静脉置管给药通路, 采用饮食诱导NASH大鼠动物模型, 初步探讨JNK抑制剂防治NASH的作用, 为新药研究奠定实验基础.
引文著录: 王珣, 鲁新耀, 张鹏, 王明林, 于红刚, 胡义奎. c-Jun氨基末端激酶抑制剂对大鼠非酒精性脂肪性肝炎的防治及机制. 世界华人消化杂志 2014; 22(20): 2881-2886
Revised: May 10, 2014
Accepted: May 29, 2014
Published online: July 18, 2014
AIM: To investigate the potentially protective effect of SP600125, a selective c-Jun N-terminal kinase inhibitor, in a rat model of nonalcoholic steatohepatitis (NASH) induced with a high fat diet.
METHODS: Forty-eight Sprague-Dawley rats were randomly divided into three groups: a normal control group (NC group), a high-fat model group (HF group) and an SP600125 treatment group (SP group). All rats were subjected to a percutaneous superior mesenteric vein retention catheter operation and fed a standard diet for 4 wk. The HF group was then fed an HF diet and treated with dimethyl sulfoxide, while the SP group was fed an HF diet and treated with SP600125 (50 mg/kg) once per day.
RESULTS: Feeding an HF diet successfully induced NASH in rats, with varying degrees of hepatic steatosis and hepatic inflammation. SP600125 treatment substantially decreased the level of inflammation and the expression of c-Jun and p-cJun proteins.
CONCLUSION: SP600125 has the potential to remarkably attenuate steatosis and inflammation and may be a novel therapeutic drug against NASH.
- Citation: Wang X, Lu XY, Zhang P, Wang ML, Yu HG, Hu YK. Protective effect of SP600125, a JNK inhibitor, against nonalcoholic steatohepatitis. Shijie Huaren Xiaohua Zazhi 2014; 22(20): 2881-2886
- URL: https://www.wjgnet.com/1009-3079/full/v22/i20/2881.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i20.2881
非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)以炎症反应为特征. c-Jun氨基末端激酶(Jun N-terminal kinase, JNK)信号转导通路参与到NASH发病机制中炎症反应这一关键环节. 因此抑制JNK的活性将有可能成为防治NASH的潜在方法. 本研究采用新型透细胞性的肽类JNK抑制剂SP600125, 建立肠系膜上静脉置管给药通路(ercutaneous superior mesenteric vein, PSMV), 作用于高脂饮食诱导NASH动物模型, 旨在阐明JNK抑制剂防治NASH的可能作用机制, 为新药研究奠定实验基础.
♂SD大鼠48只, 体质量150 g±20 g, 由武汉大学动物实验中心提供. 胆固醇试剂购自上海研生实业有限公司; 猪油自备; SP600125试剂(产品编号: S1876, 规格: 5 mg/支)购自上海浩然生物技术有限公司; 丙氨酸转移酶(alanine transaminase, ALT)、天冬氨酸转移酶(aspartate aminotransferase, AST)测定试剂盒购自德国Centronlc公司. 肿瘤坏死因子α(tumor necrosis factor alpha, TNF-α)、白介素-6(interleukin, IL-6)含量测定试剂盒购自美国Santa公司; 用于提取RNA的TRIzol试剂盒和逆转录试剂盒均购自北京中杉生物公司; JNK引物由上海Invitrogen公司合成; Western blot试剂盒购自深圳晶美生物公司.
1.2.1 动物模型建立及分组: 48只♂SD大鼠正常喂养1 wk后, 随机分为正常对照组(NC, 18只)、模型组(HF组, 15只)和SP600125干预组(SP干预组, 15只). HF组及SP干预组大鼠给予高脂饮食(high-fat: 标准饲料加2%胆固醇、10%猪油和2%玉米油)喂养12 wk, 12 wk末隔夜空腹处死NC组大鼠各6只和HF组及SP干预组大鼠各3只, 病理学检查显示12 wk末形成NASH模型. 最终NC组、HF组及SP干预组大鼠数目均为12只. HF组及SP干预组大鼠建立经PSMV给药途径. HF组继续喂养高脂饮食4 wk, 并经PSMV途径给予溶媒DMSO; SP干预组在继续高脂饲料喂养的基础经PSMV途径给予SP600125(50 mg/kg, 1次/d, 持续4 wk). 16 wk处死全部大鼠. 具体方法为隔夜禁食, 次日以25%戊巴比妥钠溶液按15 mL/kg腹腔内注射麻醉, 下腔静脉采血后再处死, 并快速取出大鼠肝脏, 按常规制备血清和肝组织石蜡切片.
1.2.2 检测及观察指标: (1)用日本日立7020型全自动生化分析仪检测血清总胆固醇(total cholesterol, TC)、总甘油三酯(total triglyceride, TG)水平; (2)德国Centronlc试剂盒检测ALT、AST水平; (3)TNF-α、IL-6含量测定: 取大鼠肝脏组织制成5%匀浆液, -20 ℃保存. ELISA法测定匀浆液的TNF-α、IL-6含量, 严格按照试剂盒(美国Santa公司)说明书操作; (4)HE染色观察肝组织普通病理变化. Masson染色观察肝组织纤维化程度. 苏丹Ⅳ染色观察肝组织脂肪变的程度; (5)JNK mRNA检测: 采用RT-PCR方法进行检测. 具体步骤: 以TRIzol试剂盒提取胰腺组织总RNA, 分光光度计检测总RNA的纯度及浓度. 运用逆转录试剂盒逆转录合成cDNA. JNK上游引物: 5'-ATTTGGAGGAGCGAACTAAG-3'; 下游引物: 5'-ATTGACAGACGGCGAAGA-3', 扩增片段为112 bp; 内参β-actin上游引物: 5'-TCGTGCGTGACATTAAAGAG-3'. 下游引物: 5'-ATTGCCGATAGTGATGACCT-3', 扩增片段为134 bp. 在PCR仪上进行扩增反应. PCR反应条件为: 95 ℃ 10 s, 95 ℃ 5 s, 60 ℃ 34 s, 35个循环; 溶解曲线分析: 95 ℃ 15 s, 60 ℃ 60 s, 95 ℃ 15 s; (6)c-Jun蛋白和磷酸化(p-c-Jun)蛋白检测: 采用免疫印迹(Western blot)法检测. 肝脏组织100 mg剪碎后研磨, 按照试剂盒操作说明抽提胞质蛋白, 蛋白定量采用BCA法. 取50 μg样品常规进行SDS-PAGE电泳后, 转移至PVDF膜, 5%BSA溶液中室温封闭. 加入一抗(c-JNK单克隆抗体, p-c-Jun单克隆抗体及内参β-actin单克隆抗体)4 ℃过夜后加入HRP标记的二抗(山羊抗小鼠IgGHRPC)孵育. ECL显色, X线片曝光、显影、定影、扫描. 并用Quantity One分析软件将图片上每个特异条带密度进行测量. 测得的c-Jun及p-c-Jun阳性条带的密度与相应的β-actin条带密度的比值作为其蛋白的相对表达量.
1.2.3 NASH判断标准: 常规苏木精-伊红染色, 在光镜下观察大鼠肝组织病理变化. 马拉松三色染色观察大鼠肝脏组织纤维化的程度. 新鲜大鼠肝脏组织于-20 ℃快速冰冻切片并行苏丹Ⅳ染色观察肝脏细胞脂肪变性的程度. 肝脏脂肪变性程度根据中华医学会肝脏病学分会脂肪肝和酒精肝病学组制定的NAFLD诊断标准进行评价[1].
统计学处理 使用SPSS21.0统计软件包处理数据. 所有资料分析前行正态性检验, 正态资料用mean±SD表示; 偏态资料中位数表示. 正态资料方差齐时, 采用单因素多水平定量资料的方差分析, 两两比较采用LSD检验. 如是偏态资料使用秩和检验. P<0.05为差异具有统计学意义.
实验中模型组大鼠较健康对照组体质量增长迅速, 性情温顺, 活动减少, 各组均无动物死亡. 实验结束时(16 wk)HF组大鼠体质量、肝指数(肝湿质量/体质量×100%)比NC组增高, 差异具有显著性意义(P<0.05). SP干预组与HF组比较, 体质量及肝指数下降, 差异具有显著性意义(P<0.05)(表1).
HF组大鼠TC、TG、ALT、AST、TNF-α、IL-6水平均高于NC组(均P<0.05), SP干预组大鼠上述指标水平均低于模型对照组(均P<0.05)(表2).
| 指标 | NC组 | HF组 | SP干预组 |
| TC | 184.6±18.6 | 303.2±7.6a | 227.8±10.8c |
| TG | 519.7±44.0 | 303.2±7.6a | 227.8±10.8c |
| ALT | 0.87±0.25 | 1.30±0.04a | 1.01±0.02c |
| AST | 0.87±0.25 | 1.89±0.16a | 0.96±0.10c |
| TNF-α(pg/mL) | 184.6±18.6 | 303.2±7.6a | 227.8±10.8c |
| IL-6(pg/mL) | 519.7±44.0 | 303.2±7.6a | 227.8±10.8c |
| JNK mRNA | 0.87±0.25 | 1.30±0.04a | 1.01±0.02c |
| c-Jun protein | 0.87±0.25 | 1.89±0.16a | 0.96±0.10c |
| p-c-Jun protein | 0.87±0.25 | 1.82±0.18a | 1.01±0.12c |
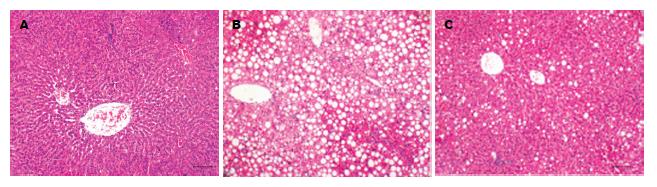
健康对照组大鼠肝小叶结构完整, 肝细胞大小一致, 呈多边形围绕中央静脉放射状分布. 高脂喂养16 wk时大鼠肝组织呈弥漫性脂肪变性, 炎性细胞浸润及小叶内坏死灶增多, 可见明显的窦周纤维化及中央静脉周围纤维化. SP干预组大鼠肝组织炎性反应、脂肪变性及纤维化程度均较HF组明显改善(图1).
正常大鼠肝脏组织内JNK mRNA表达量少, HF组表达量增加, 差异具有统计学意义. 而SP干预组较模型JNK mRNA表达量下降, 差异具有统计学意义(P<0.05)(表2).
NAFLD是一组缺乏饮酒史, 以脂肪沉积为特征与代谢综合症相关的新疾病. 他包括单纯性脂肪肝及NASH, 后者还可进一步发展为终末期肝病. 早期单纯性脂肪肝患者往往缺乏典型的临床表现, 偶尔在体检时才发现. 而有临床表现来就诊的患者, 此时绝大多数已经发展为NASH. 所以NASH的防治是临床上阻断疾病进展的关键阶段[2-5].
目前许多研究都认为NASH的发病机制与胰岛素抵抗(insulin resistance, IR)及炎症反应密切相关[3-5]. TNF-α和IL-6在NASH发病中的作用是研究的热点. 本实验结果提示: NASH模型中TNF-α、IL-6含量较对照组大鼠下降, 差异具有统计学意义, 和报道一致[6-10], 提示炎症因子TNF-α、IL-6在NASH发病过程中起作用.
JNK是促分裂原活化蛋白激酶(mitogen activated protein kinases, MAPKs)超家族成员中的一员[12-14]. JNK包含双磷酸化功能区Thr-Pro-Tyr与c-Jun氨基末端的活化区结合并使其第63、73位丝氨酸(Ser)残基磷酸化. 我们通过PSMV给药途径, JNK抑制剂SP600125作用NASH模型大鼠4 wk后, SP干预组大鼠TNF-α、IL-6含量较高质饮食组下降, 差异具有统计学意义, 提示NASH发病过程中炎症相关因子的表达有JNK的参与.
研究发现, JNK信号通路参与细胞因子、应激、药物等诱导的细胞凋亡[15-18]. 目前大多JNK信号通路研究集中在神经系统退行性疾病及肿瘤中[19-26]. JNK信号通路在NASH中的研究鲜有报道. 本研究应用JNK抑制剂SP600125作用下SD大鼠NASH模型JNK及其下游c-Jun磷酸化水平的改变, 我们发现: NASH组大鼠Western blot结果显示c-Jun蛋白及磷酸化p-c-Jun蛋白均较对照组升高. 经JNK抑制剂-SP600125干预治疗后JNK蛋白及磷酸化JNK蛋白水平下降, 结果提示SP600125对NASH有治疗作用, 其作用机制与抑制JNK通路有关, 为JNK抑制剂-SP600125成为治疗NASH的新型药物奠定实验基础.
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是一组缺乏饮酒史, 以脂肪沉积为特征, 与代谢综合症相关的新疾病. 他包括单纯性脂肪肝及非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH), 后者还可进一步发展为终末期肝病. NASH的防治是临床上阻断该疾病进展的关键. 阻断NASH发病通路的药物研发迫在眉睫.
高泽立, 副教授, 上海交大医学院九院周浦分院
中药由于其有效成分的多样性和不确定性, 加上提取和筛选的困难, 一直不能被国际社会完全认可. 而基因治疗虽然取得了日新月异的进展, 但是对于一些疾病而言, 基因突变的阴影限制了其作为首选治疗方案. SP600125是采用高通量药物筛选技术所合成的JNK抑制剂, 已经应用于治疗脑血管疾病, 纤维化疾病以及缺血再灌注损伤等方面, 但是其在NASH中的防治作用尚不清楚. 所以本课题将理论与应用相结合, 为新药研究奠定基础.
本文选题紧密联系当前常见病和多发病, 设计合理, 数据及统计分析可靠, 具有一定指导意义.
编辑 田滢 电编 都珍珍
| 2. | Cortez-Pinto H, Baptista A, Camilo ME, De Moura MC. Nonalcoholic steatohepatitis--a long-term follow-up study: comparison with alcoholic hepatitis in ambulatory and hospitalized patients. Dig Dis Sci. 2003;48:1909-1913. [PubMed] [DOI] |
| 3. | Hjelkrem M, Stauch C, Shaw J, Harrison SA. Validation of the non-alcoholic fatty liver disease activity score. Aliment Pharmacol Ther. 2011;34:214-218. [PubMed] [DOI] |
| 5. | Kukla M, Zwirska-Korczala K, Hartleb M, Waluga M, Chwist A, Kajor M, Ciupinska-Kajor M, Berdowska A, Wozniak-Grygiel E, Buldak R. Serum chemerin and vaspin in non-alcoholic fatty liver disease. Scand J Gastroenterol. 2010;45:235-242. [PubMed] [DOI] |
| 7. | Barbuio R, Milanski M, Bertolo MB, Saad MJ, Velloso LA. Infliximab reverses steatosis and improves insulin signal transduction in liver of rats fed a high-fat diet. J Endocrinol. 2007;194:539-550. [PubMed] [DOI] |
| 8. | Ofei F, Hurel S, Newkirk J, Sopwith M, Taylor R. Effects of an engineered human anti-TNF-alpha antibody (CDP571) on insulin sensitivity and glycemic control in patients with NIDDM. Diabetes. 1996;45:881-885. [PubMed] [DOI] |
| 9. | Skroza N, Proietti I, Bernardini N, La Viola G, Nicolucci F, Pampena R, Tolino E, Zuber S, Mancini MT, Soccodato V. Efficacy of food supplement to improve metabolic syndrome parameters in patients affected by moderate to severe psoriasis during anti-TNFα treatment. G Ital Dermatol Venereol. 2013;148:661-665. [PubMed] |
| 10. | Nakamura MT, Yudell BE, Loor JJ. Regulation of energy metabolism by long-chain fatty acids. Prog Lipid Res. 2014;53:124-144. [PubMed] [DOI] |
| 11. | de Carvalho TM, Miguel Marin D, da Silva CA, de Souza AL, Talamoni M, Lima CS, Monte Alegre S. Evaluation of patients with head and neck cancer performing standard treatment in relation to body composition, resting metabolic rate, and inflammatory cytokines. Head Neck. 2013; Dec 13. [Epub ahead of print]. [PubMed] [DOI] |
| 12. | Rosenvinge A, Krogh-Madsen R, Baslund B, Pedersen BK. Insulin resistance in patients with rheumatoid arthritis: effect of anti-TNFalpha therapy. Scand J Rheumatol. 2007;36:91-96. [PubMed] [DOI] |
| 13. | Ozcan U, Yilmaz E, Ozcan L, Furuhashi M, Vaillancourt E, Smith RO, Görgün CZ, Hotamisligil GS. Chemical chaperones reduce ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes. Science. 2006;313:1137-1140. [PubMed] [DOI] |
| 14. | Paredes AH, Torres DM, Harrison SA. Nonalcoholic fatty liver disease. Clin Liver Dis. 2012;16:397-419. [PubMed] [DOI] |
| 15. | Kim MS, Yamamoto Y, Kim K, Kamei N, Shimada T, Liu L, Moore K, Woo JR, Shoelson SE, Lee J. Regulation of diet-induced adipose tissue and systemic inflammation by salicylates and pioglitazone. PLoS One. 2013;8:e82847. [PubMed] [DOI] |
| 16. | Carvalho-Filho MA, Ropelle ER, Pauli RJ, Cintra DE, Tsukumo DM, Silveira LR, Curi R, Carvalheira JB, Velloso LA, Saad MJ. Aspirin attenuates insulin resistance in muscle of diet-induced obese rats by inhibiting inducible nitric oxide synthase production and S-nitrosylation of IRbeta/IRS-1 and Akt. Diabetologia. 2009;52:2425-2434. [PubMed] [DOI] |
| 17. | Krysiak R, Zmuda W, Okopien B. The effect of ezetimibe, administered alone or in combination with simvastatin, on lymphocyte cytokine release in patients with elevated cholesterol levels. J Intern Med. 2012;271:32-42. [PubMed] [DOI] |
| 18. | Forst T, Pfützner A, Lübben G, Weber M, Marx N, Karagiannis E, Koehler C, Baurecht W, Hohberg C, Hanefeld M. Effect of simvastatin and/or pioglitazone on insulin resistance, insulin secretion, adiponectin, and proinsulin levels in nondiabetic patients at cardiovascular risk--the PIOSTAT Study. Metabolism. 2007;56:491-496. [PubMed] [DOI] |
| 19. | Nissen SE, Wolski K. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. N Engl J Med. 2007;356:2457-2471. [PubMed] [DOI] |
| 20. | Lago RM, Singh PP, Nesto RW. Congestive heart failure and cardiovascular death in patients with prediabetes and type 2 diabetes given thiazolidinediones: a meta-analysis of randomised clinical trials. Lancet. 2007;370:1129-1136. [PubMed] [DOI] |
| 21. | 魏 娜, 贺 海波, 张 长城, 袁 丁, 王 婷. JNK信号通路与细胞凋亡关系的研究进展. 中国临床药理学与治疗学. 2013;18:807-812. |
| 22. | Malhi H, Bronk SF, Werneburg NW, Gores GJ. Free fatty acids induce JNK-dependent hepatocyte lipoapoptosis. J Biol Chem. 2006;281:12093-12101. [PubMed] [DOI] |
| 23. | 王 龙, 李 兵兵, 陈 维雄, 朱 金水. 姜黄素与吡格列酮对大鼠非酒精性脂肪性肝炎作用的对照研究. 胃肠病学和肝病学杂志. 2013;22:1251-1255. |
| 25. | Singh R, Wang Y, Xiang Y, Tanaka KE, Gaarde WA, Czaja MJ. Differential effects of JNK1 and JNK2 inhibition on murine steatohepatitis and insulin resistance. Hepatology. 2009;49:87-96. [PubMed] [DOI] |
| 26. | Bogoyevitch MA, Arthur PG. Inhibitors of c-Jun N-terminal kinases: JuNK no more? Biochim Biophys Acta. 2008;1784:76-93. [PubMed] |