修回日期: 2013-03-11
接受日期: 2013-03-29
在线出版日期: 2013-04-28
目的: 对广西婴儿特发性肝内胆汁淤积的患者进行SLC25A13基因筛查, 了解有无突变.
方法: 收集2010-09/2012-06就诊于广西医科大学第一附属医院的婴儿特发性肝内胆汁淤积的患者63例作为病例组, 另选取50例无肝内胆汁淤积, 肝功能正常的婴儿为对照组. 病例组患者送检血串联质谱、尿气相质谱分析筛查, 对串联质谱怀疑为Citrin病的病例全部直接进行DNA测序分析. 同时对阴性病例组及对照组采用聚合酶链反应-单链构象多态性(polymerase chain reaction-single strand conformation polymorphism, PCR-SSCP)联合DNA测序技术对SLC25A13基因国内外报道最常见的12种热点突变进行筛查, 了解有无SLC25A13基因突变.
结果: 在病例组进行蛋白质串联质谱分析有5例考虑为Citrin缺陷病, 在进一步的DNA序列直接测序当中, 未发现SLC25A13基因的12种常见突变. 在其余病例组和正常组当中, PCR-SSCP筛查当中, 均未发现相关的12种常见突变.
结论: 串联质谱分析考虑为Citrin缺陷病的5例患者、其余病例组患者及正常对照组当中均未发现SLC25A13基因常见的12种突变, 广西婴儿特发性肝内胆汁淤积是否会存在SLC25A13基因的其他少见突变, 仍需进一步的研究证实, 包括纳入更多的样本研究及对其他未报道过的外显子进行研究.
核心提示: 本文对5例高度怀疑为Citrin缺陷病的患者进行研究, 其他病例组及对照组在经过聚合酶链反应-单链构象多态性(polymerase chain reaction-single strand conformation polymorphism)和DNA直接测序突变筛查研究中都没有发现SLC25A13基因12种常见突变, 这可能与地域和种族差异有关.
引文著录: 伍秋频, 王琳琳, 陈秀奇, 唐清, 单庆文, 黄丽, 连淑君, 云翔, 高国鹏, 陈允. 广西婴儿特发性肝内胆汁淤积SLC25A13基因突变的筛查. 世界华人消化杂志 2013; 21(12): 1120-1125
Revised: March 11, 2013
Accepted: March 29, 2013
Published online: April 28, 2013
AIM: To screen SLC25A13 gene mutations in idiopathic infantile hepatitis cholestasis in Guangxi, China.
METHODS: Sixty-three patients with idiopathic infantile cholestasis, who were hospitalized in the Department of Pediatrics of the First Affiliated Hospital of Guangxi Medical University from September 2010 to June 2012, and 50 infants without intrahepatic cholestasis were included in this study. Genomic DNA was prepared from peripheral blood of all subjects for further analysis. For the case group, Citrin deficiency was screened using the tandem mass spectrometry (MS-MS, using blood samples) and gas chromatography mass spectrometry (GC-MS, using urine samples). Direct gene sequencing was performed in patients who were suspected to have Citrin deficiency. Twelve common SLC25A13 gene hot-spot mutations were screened by polymerase chain reaction-single strand conformation polymorphism (PCR-SSCP) in the remaining patients and controls.
RESULTS: MS-MS and GC-MS analyses suggested that five patients were suspected to have Citrin deficiency, but the 12 common SLC25A13 gene hot-spot mutations were not detected in these patients in a further DNA sequencing analysis. The 12 common SLC25A13 gene hot-spot mutations were also not detected by PCR-SSCP in the remaining patients and controls.
CONCLUSION: The 12 common SLC25A13 gene hot-spot mutations were not found in patients who were suspected to have Citrin deficiency and the other patients and controls. Other rare SLC25A13 gene mutations should be screened in more patients.
- Citation: Wu QP, Wang LL, Chen XQ, Tang Q, Shan QW, Huang L, Lian SJ, Yun X, Gao GP, Chen Y. Screening of SLC25A13 gene mutations in infants with idiopathic intrahepatic cholestasis in Guangxi. Shijie Huaren Xiaohua Zazhi 2013; 21(12): 1120-1125
- URL: https://www.wjgnet.com/1009-3079/full/v21/i12/1120.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i12.1120
婴儿肝内胆汁淤积发病率约为1/2 500-1/5 000, 是儿童最常见的肝病类型之一. 我国一些地区进行的遗传代谢选择性筛查研究结果[1]表明, 在中国遗传代谢病高危患者中阳性率居第2位, 仅次于甲基丙二酸尿症. 尽管新的诊断技术不断发展, 大概有70%的婴儿肝内胆汁淤积目前仍找不到确切的发病原因, 被称为特发性婴儿肝内胆汁淤积, 相关研究认为遗传代谢扮演一定的作用, 随着技术发展将来可能被逐渐阐明. Ohura等在2001年首先在日本对婴儿肝内胆汁淤积症患者进行遗传代谢病筛查发现存在SLC25A13基因突变, 目前证实SLC25A13突变可导致Ⅱ型瓜氨酸血症(adult-onset-type Ⅱ citrullinemia, CTLN2)及柠檬素(Citrin, SLC25A13基因编码产物)缺乏性新生儿肝内胆汁淤积症(neonatal intrahepatic cholestasis caused by Citrin deficiency, NICCD)两大类常染色体隐性遗传病[2,3]. 国内外相关研究表明, SLC25A13基因的热点突变呈现明显的地域和种族差异[4]. 不同人群中SLC25A13基因的突变形式和频率有很大差别, 日本的报道以突变[Ⅰ]85ldel4和[Ⅱ]ⅣSll+1G>A居多, 中国人群常见的突变类型为[Ⅰ]851-854del4、[Ⅲ]1638ins23、[Ⅹ]ⅣS6+5G>A. 日本健康人群中SLC25A13基因突变携带者率为1/65; 韩国健康人群中突变携带者率为1/108; 中国健康人群中突变携带者率1/63[5]. Lu等[6]对正常中国人突变筛查显示851del4(70%), 1638ins23(3%)和ⅣS6+5G>A(23%)突变在中国人中多见. 此外, 以长江为界, 南方人群的突变携带率明显高于北方人群[7]. 其中南方人群中以湖南、广东、香港多见. 本研究通过PCR-单链构象多态性(polymerase chain reaction-single strand conformation polymorphism, PCR-SSCP)和DNA直接测序技术, 对广西患者的特发性婴儿肝内胆汁淤积患者进行SLC25A13基因的常见12种热点突变筛查研究, 了解广西患者特发性婴儿肝内胆汁淤积有无SLC25A13基因突变情况.
收集2010-09/2012-06在广西医科大学第一附属医院儿科住院的特发性婴儿肝内胆汁淤积性肝炎患者63例. 病例组纳入标准[8]: 婴儿期(包括新生儿期)起病; 黄疸难消退或退而复升, 黄疸属于肝细胞性, 血清结合胆红素和未结合胆红素均可升高, 但以结合胆红素增高为主; 肝大和/或脾大, 质地改变; 肝功能损害: 以丙氨酸转氨酶、门冬氨酸转移酶及胆汁酸升高为主; 除外胆道闭锁, 肝炎病毒、巨细胞病毒、梅毒螺旋体、结核杆菌、弓形虫及人类免疫缺陷病毒感染等. 病例组全部进行串联质谱检查; 所有患者均进行上述检查, 纳入研究对象严格参照上述标准执行. 同期随机在广西医科大学第一附属医院选取相同年龄段且肝功能正常且家属无肝炎病史的患者50例为对照组. 所有受检对象均签署由医院伦理委员会批准的知情同意书.
1.2.1 血串联质谱分析: 患者全血标本采集用干血滤纸片法, 滴于专用采血滤纸(S&S903#)上晾干后送检. 样品处理: 采用文献报道的方法, 干血滤纸片经含酰基肉碱和氨基酸内标的甲醇萃取, 盐酸正丁醇衍生后, 加入80%乙腈100 μL溶解, 即可上样检测. 仪器采用美国生物应用系统公司串联质谱仪(API 200型), 高效液相仪采用美国安捷仑公司(Agilent 1100)产品. 定量分析采用美国应用生物系统公司软件ChemoView 1.2版本. 采用美国疾病控制和预防中心(Centers for Disease Control and Prevention, CDC)新生儿筛查质控部门提供的串联质谱酰基肉碱血滤纸片. 串联质谱检测的肉碱和氨基酸正常上、下限值取1 480例健康儿童的第99.8和0.002百分位, 参考美国CDC报告的参考值设定.
1.2.2 尿气相色谱质谱有机酸分析: 收集63例患者新鲜尿液5-10 mL. 样品处理: 采用文献报道的方法, 尿样中加入尿素酶后, 37 ℃温育30 min, 加入托品酸、17烷酸、24酸, 加入盐酸羟胺、氢氧化钠, 混匀后室温静置60 min. 加入盐酸, 离心分取上清液, 加入乙酸乙酯, 离心分取上清液,再加入乙酸乙酯5 mL, 分取上清液. 加入无水硫酸, 离心除去水分, 再次分取上清液, 60 ℃下用氮气仪吹干. 最后加入BSTFA与TMCS混合物80 ℃衍生30 min, 移至日本岛津GCMS2QP 2010分析仪分析.
1.2.3 基因组DNA提取: 在清晨空腹状态下受试者分别抽取外周血2 mL, EDTA抗凝, 用DNA提取试剂盒(天根生物科技北京有限公司), 严格按照说明书操作, 提取DNA.
1.2.4 SLC25A13基因的扩增: 选择亚洲人中最常见的12种SLC25A13基因突变并设计引物, 引物均来源于文献[9,10], 引物见表1(引物由上海生工生物工程有限公司合成). PCR反应体系为; Premix Tap(CWBIO)13 μL, DNA模板1 μL, 上下游引物各0.5 μmol/L, ddH2O补充体积至25 μL, 具体扩增条件见表2.
| 突变类型 | 引物序列 外显子 | 产物长度(bp) | |
| [Ⅰ]851-854del | 上游5'-AAAGGAGGTTAGGAGGAGGGC-3' | 9 | 321 |
| 下游5'-GGCAACTGCAAGTGGAACAGG-3' | |||
| [Ⅱ]IVS11+1G>A | 上游 5'-TGCAGAACCAACGATCAACTG-3' | 11 | 205 |
| 下游 5'-ACGCAGTCTTGCTAATTCATGT-3' | |||
| [Ⅲ]1638-1660dup23 | 上游 5'-TGTTGTGTCTCTCCTGCAGG-3' | 16 | 123 |
| 下游 5'-GCAGTCTATCACTCCGCTGT-3' | |||
| [Ⅳ]S225X | 上游 5'-GGAGAGTACAAGTTCTGGTC-3' | 7 | 426 |
| 下游 5'-ACTAGTTGCCTTCTTCACCC-3' | |||
| [V]ⅣS13+1G>A | 上游 5'-GTGAACGATTTTGTGAGGGATA-3' | 13 | 210 |
| 下游 5'-CCTAGTAGACTCTGCCCTTG-3' | |||
| [Ⅵ]1800-1801insA | 上游 5'-CTAATTATATCTGTGATTTCTCCA-3' | 17 | 307 |
| 下游 5'-GGAGTTGATACATTCTCATCAG-3' | |||
| [Ⅶ]R605X | 上游 5'-CTAATTATATCTGTGATTTCTCCA-3' | 17 | 307 |
| 下游 5'-GGAGTTGATACATTCTCATCAG-3' | |||
| [Ⅷ]E601X | 上游 5'-CTAATTATATCTGTGATTTCTCCA-3' | 17 | 307 |
| 下游 5'-GGAGTTGATACATTCTCATCAG-3' | |||
| [Ⅸ]E601K | 上游 5'-CTAATTATATCTGTGATTTCTCCA-3' | 17 | 307 |
| 下游 5'-GGAGTTGATACATTCTCATCAG-3' | |||
| [Ⅹ]ⅣS6+5G>A | 上游5'-TGAGGGCTTGTTAGATCAAGAT -3' | 6 | 467 |
| 下游 5'-TTACCCAGACAACAAATTAACCT-3' | |||
| [Ⅺ]R184X | 上游 5'-TGAGGGCTTGTTAGATCAAGAT -3' | 6 | 467 |
| 下游 5'-TTACCCAGACAACAAATTAACCT-3' | |||
| [ⅪⅤ]Ⅳ+1G>C | 上游 5'-TGAGGGCTTGTTAGATCAAGAT -3' | 6 | 467 |
| 下游 5'-TTACCCAGACAACAAATTAACCT-3' | |||
| 扩增子 | 预变性(℃, min) | 变性(℃, s) | 退火(℃) | 延伸(℃, min) | 循环次数 |
| 外显子6 | 94, 3 | 94, 30 | 55 | 72, 1 | 35 |
| 外显子7 | 94, 3 | 94, 30 | 56 | 72, 1 | 35 |
| 外显子9 | 94, 3 | 94, 30 | 62 | 72, 1 | 30 |
| 外显子11 | 94, 3 | 94, 30 | 50 | 72, 1 | 40 |
| 外显子13 | 94, 3 | 94, 30 | 57 | 72, 1 | 35 |
| 外显子16 | 94, 3 | 94, 30 | 60 | 72, 1 | 35 |
| 外显子17 | 94, 3 | 94, 30 | 54 | 72, 1 | 35 |
1.2.5 PCR-SSCP: 取PCR产物3 μL加入上样缓冲液9 μL混匀, 经98 ℃变性10 min后迅速放入散冰中5-10 min, 室温条件下在非变性聚丙烯酰胺凝胶(39:1)下进行电泳5-7 h. 聚丙烯酰胺凝胶的染色与显色分析; 电泳后的聚丙烯酰胺凝胶用固定液浸泡5-10 min, 用染色液(0.2%的AgNO3、1%的冰醋酸、10%的无水乙醇)进行银染10 min, 蒸馏水漂洗2次, 加入显影液(3%的无水NaOH, 每200 mL溶液加1 mL甲醛)进行显色, 最后直接用蒸馏水直接终止显色[11].
1.2.6 Citrin缺陷病基因测序分析: 病例组患者送检血串联质谱、尿气相质谱分析筛查, 对串联质谱筛查怀疑为Citrin病的病例直接进行测序分析. 其余经PCR-SSCP分析. PCR产物用ABI-PRISM3730进行测序分析. 所得的序列结果与GenBank基因库上所提供的SLC25A13基因正常序列进行比对, 以发现突变位点, 并验证PCR扩增产物均为目的基因片段. PCR-SSCP未发现异常条带的外显子也分别进行直接测序, 以验证PCR扩增的产物均为目的基因片段.
| 项目 | 1 | 2 | 3 | 4 | 5 | mean±SD | 参考范围 |
| 总胆红素(μmol/L) | 153.9 | 118.7 | 91.8 | 230.8 | 115.6 | 143.24±54.62 | 3.00-22.00 |
| 直接总胆汁酸(μmol/L) | 57.7 | 68 | 71.9 | 171.1 | 70.3 | 87.80±46.80 | 0.00-6.00 |
| 胆红素(μmol/L) | 244.8 | 196.7 | 103.5 | 226.8 | 211 | 196.56±55.02 | 0.00-10.00 |
| 谷丙转氨酶(U/L) | 22 | 78 | 88 | 42 | 25 | 51.00±30.39 | 5.00-40.00 |
| 谷草转氨酶(U/L) | 98 | 201 | 117 | 118 | 132 | 133.20±39.78 | 8.00-45.00 |
| 谷氨酰转肽酶(U/L) | 183 | 343 | 1007 | 58 | 94 | 337.00±390.36 | 0.00-50.00 |
| 血乳酸(mmol/L) | 3.04 | 4.69 | - | 3.19 | 4.9 | 3.95±0.97 | 0.63-2.44 |
| 血氨(μg/dL) | 183 | 101 | 130 | 177 | 151 | 148.40±33.93 | 0.00-75.00 |
| 项目 | 1 | 2 | 3 | 4 | 5 | mean±SD | 参考范围 | |
| 血串联质谱 | ||||||||
| 甲硫氨酸 | 107.44 | 90.4 | 58.5 | 54.54 | 98.7 | 81.91±23.99 | 8-35 | |
| 酪氨酸 | 114.17 | 53.57 | 195.34 | 142.25 | 132.7 | 127.54±51.20 | 20-100 | |
| 瓜氨酸 | 127.36 | 101.0 | 71.06 | 75.09 | 90.53 | 93.00±22.64 | 7-35 | |
| 苏氨酸 | 117.7 | 115.18 | 106.34 | 108.74 | 121.2 | 113.83±6.18 | 15-100 | |
| C14-1 | 0.29 | 0.37 | 0.39 | 0.38 | 0.31 | 0.34±0.04 | 0.02-0.25 | |
| C16-1 | 3.57 | 2.84 | 5.27 | 2.4 | 4.13 | 3.64±1.12 | 0.3-2 | |
| C18-1 | 1.23 | 0.68 | 1.67 | 0.56 | 0.76 | 0.98±0.46 | 0.2-1.2 | |
| 尿气相质谱分析 | ||||||||
| 苯乳酸-2 | 17.98 | 8.92 | 32.61 | 7.74 | 13.25 | 16.1±10.07 | 0-4.9 | |
| 4-羟基苯乙酸 | 326.03 | 87.9 | 465.8 | 62.95 | 97.5 | 208.03±178.93 | 8.6-73.2 | |
| 4-羟基苯乳酸-2 | 2 656.56 | 963.02 | 487.53 | 2218.3 | 1784.3 | 1 621.9±890.7 | 0-7 | |
| 4-羟基苯丙酮酸 | 12.55 | - | 26.83 | 2.78 | 4.75 | 11.72±10.91 | 0-0.9 | |
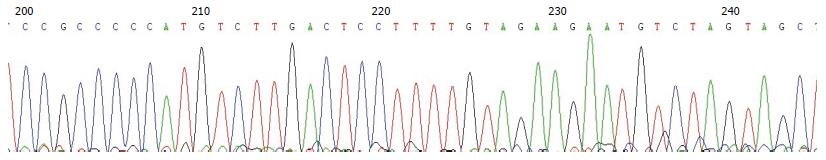
5例患者血串联质谱检测氨基酸和酰基肉碱结果(μmol/L)及尿气相质谱分析. 经血串联质谱检测, 所有患者甲硫氨酸、瓜氨酸、苏氨酸均升高, 除2号外酪氨酸都升高, 并有长链C14-1、C16-1升高. C18-1有2例患者增高. 经尿气相质谱分析, 所有患者的苯乳酸-2、4-羟基苯乳酸都升高, 除4号外4-羟基苯乙酸-2都升高, 2号患者未测到4-羟基苯丙酮酸, 其余均升高(表4). 其余病例组及正常组儿童的7个外显子PCR产物均进行 SSCP筛查, 7个外显子均未发现异常条带. 未发现异常条带的外显子也分别抽取进行测序. 均未发现相关的12种常见突变, 测序结果见图1.
人类SLC25A13基因位于染色体7q21.3, 此基因含18个外显子, 长度约为200 kb. 由675个氨基酸组成, 编码的蛋白质称希特林蛋白(Citrin)[12], 相对分子质量为74 000. 研究表明, Citrin是主要表达于肝细胞线粒体内膜的一种钙调节蛋白, 含有4个EF手模体和6个跨膜结构域, 其功能主要是作为线粒体中天冬氨酸/谷氨酸载体, 将线粒体内合成的天冬氨酸转运到胞质, 同时把胞质中的谷氨酸和质子转运进线粒体内.
研究证实Citrin缺陷症是我国婴儿肝内胆汁淤积症的重要原因之一[13], 大部分合并多种氨基酸谱异常的肝内胆汁淤积症均因Citrin缺陷引起[14]. 到2010年为止SLC25A13基因已经报道了54种突变, 包括17种错义, 14种剪切突变, 13种无义5种插入, 5种缺失[15,16]. 其中12种突变为热点突变, 国内外相关研究表明, SLC25A13基因的热点突变呈现明显的地域和种族差异. 目前国内文献报道851del4、1638ins23和ⅣS6+5G>A突变在中国人中多见. 本研究中, 病例组行血串联质谱分析、尿气相质谱分析筛查出5例怀疑为Citrin蛋白缺陷症, DNA测序直接分析报道的最常见的12种常见热点均未发现突变. 患者临床体征、血生化和蛋白质酰基肉碱谱分析对诊断NICCD有重要的作用[17], 但NICCD的确诊仍然只有依赖基因诊断, 即检测SLC25A13基因有无突变, 但有文献报道大约仍有5%-6%的病例监测不到突变. 与有关的文献报道相似, 并不是全部怀疑为Citrin缺陷的患者都存在SLC25A13基因突变. 邱文娟等[18]在2007年对就诊于上海交通大学医学院附属新华医院和上海儿童医学中心治疗并随访的NICCD患者12例进行基因测序, 结果12例患者只发现5例携带有SLC25A13基因的致病突变.
本研究从亚洲人群中报道的SLC25A13常见的12种热点突变着手探讨特发性婴儿肝内胆汁淤积SLC25A13基因突变情况, 对经串联质谱分析结果: 1号患者甲硫氨酸、酪氨酸级瓜氨酸显著增高, 伴多种长链酰基肉碱增高, 4-羟基苯乳酸、4-羟基苯丙酮酸增高, 提示Citrin蛋白缺乏, 提示酪氨酸尿; 2号患者蛋氨酸、亮氨酸、缬氨酸、瓜氨酸、苏氨酸升高, 需除外Citrin缺乏症(NICCD), 进一步可行基因明确诊断. 4-羟基苯乳酸显著增高, 结合串联质谱结果提示Citrin蛋白缺乏; 3号患者蛋氨酸、瓜氨酸、酪氨酸、苏氨酸增高, 多种长链酰基肉碱偏高, 考虑Citrin蛋白缺陷所致新生儿肝内胆汁淤积症可能. 苯乳酸、4-羟基苯乳酸、4-羟基苯丙酮酸增高, 结合串联质谱, 提示NICCD; 4号患者蛋氨酸、酪氨酸、瓜氨酸、苏氨酸明显升高, 结合病史, 考虑Citrin蛋白缺陷症. 4-羟基苯乳酸明显升高, 结合串联质谱结果, 符合Citrin蛋白缺陷症; 5号患者蛋氨酸、酪氨酸、瓜氨酸、苏氨酸明显升高, 考虑Citrin蛋白缺乏症. 苯乳酸、4-羟基苯乳酸, 结合串联质谱分析, 符合Citrin缺乏症. 对高度怀疑为Citrin缺陷病的5例患者进行DNA直接测序分析, 未发现SLC25A13基因的12种常见突变, 同时在正常患者对照组及其他黄疸患者的DNA突变筛查研究也没有发现SLC25A13基因突变. 这可能与地域和种族差异有关. SLC25A13基因常见的12种热点突变可能并非本地区的常见突变位点, 突变位点可能存在于其他外显子和/或内含子邻近区域突变. 因此, 广西特发性婴儿肝内胆汁淤积患者是否存在其他SLC25A13基因突变需要进一步的研究证实. 我们将进一步扩大研究, 对SLC25A13基因全部外显子进行筛查, 同时用更大的样本量来证实这一观点.
目前证实SLC25A13突变可导致成人发病Ⅱ型瓜氨酸血症(adult-onset-type Ⅱ citrullinemia, CTLN2))及柠檬素(Citrin, SLC25A13基因编码产物)缺乏性新生儿肝内胆汁淤积症(neonatal intrahepatic cholestasis caused by Citrin deficiency, NICCD)两大类常染色体隐性遗传病. 国内外相关研究表明, SLC25A13基因的热点突变呈现明显的地域和种族差异, 不同人群中SLC25A13基因的突变形式和频率有很大差别.
樊红, 教授, 东南大学医学院发育与疾病相关基因教育部重点实验室; 莫发荣, 副教授, 广西医科大学组织学与胚胎学教研室
邱文娟等在2007年对就诊于上海交通大学医学院附属新华医院和上海儿童医学中心治疗并随访的NICCD患者12例进行基因测序, 结果12例患者只发现5例携带有SLC25A13基因的致病突变.
SLC25A13基因的热点突变呈现明显的地域和种族差异. 不同人群中SLC25A13基因的突变形式和频率有很大差别. 本研究采用PCR-SSCP和DNA直接测序技术探讨广西婴儿特发性肝内胆汁淤积症患者有无SLC25A13基因的12种常见热点突变.
本文可为婴儿肝内胆汁淤积的病因提供实验室数据. SLC25A13基因常见的12种热点突变可能并非本地区的常见突变位点, 突变位点可能存在于其他外显子和/或内含子邻近区域突变.
本文针对广西婴儿特发性肝内胆汁淤积的患者进行SLC25A13基因筛查, 具有地域和种族特色, 结果提示并不是全部怀疑为Citrin缺陷的患者都存在SLC25A13基因突变. 实验方法可靠, 实验数据可信, 可为婴儿肝内胆汁淤积的病因提供实验室数据.
编辑: 田滢 电编:闫晋利
| 1. | Song YZ, Li BX, Hao H, Xin RL, Zhang T, Zhang CH, Kobayashi K, Wang ZN, Zheng XY. Selective screening for inborn errors of metabolism and secondary methylmalonic aciduria in pregnancy at high risk district of neural tube defects: a human metabolome study by GC-MS in China. Clin Biochem. 2008;41:616-620. [PubMed] [DOI] |
| 2. | Ohura T, Kobayashi K, Tazawa Y, Nishi I, Abukawa D, Sakamoto O, Iinuma K, Saheki T. Neonatal presentation of adult-onset type II citrullinemia. Hum Genet. 2001;108:87-90. [PubMed] [DOI] |
| 3. | Saheki T, Kobayashi K. Mitochondrial aspartate glutamate carrier (citrin) deficiency as the cause of adult-onset type II citrullinemia (CTLN2) and idiopathic neonatal hepatitis (NICCD). J Hum Genet. 2002;47:333-341. [PubMed] [DOI] |
| 5. | Yasuda T, Yamaguchi N, Kobayashi K, Nishi I, Horinouchi H, Jalil MA, Li MX, Ushikai M, Iijima M, Kondo I. Identification of two novel mutations in the SLC25A13 gene and detection of seven mutations in 102 patients with adult-onset type II citrullinemia. Hum Genet. 2000;107:537-545. [PubMed] [DOI] |
| 6. | Lu YB, Kobayashi K, Ushikai M, Tabata A, Iijima M, Li MX, Lei L, Kawabe K, Taura S, Yang Y. Frequency and distribution in East Asia of 12 mutations identified in the SLC25A13 gene of Japanese patients with citrin deficiency. J Hum Genet. 2005;50:338-346. [PubMed] [DOI] |
| 7. | Tabata A, Sheng JS, Ushikai M, Song YZ, Gao HZ, Lu YB, Okumura F, Iijima M, Mutoh K, Kishida S. Identification of 13 novel mutations including a retrotransposal insertion in SLC25A13 gene and frequency of 30 mutations found in patients with citrin deficiency. J Hum Genet. 2008;53:534-545. [PubMed] [DOI] |
| 10. | 温 鹏强, 王 国兵, 陈 占玲, 崔 冬, 袁 泉, 宋 萍, 陈 淑丽, 廖 建湘, 李 成荣. Citrin缺陷导致的新生儿肝内胆汁淤积症SLC25A13基因分析. 中国当代儿科杂志. 2011;13:330-338. |
| 12. | Kobayashi K, Sinasac DS, Iijima M, Boright AP, Begum L, Lee JR, Yasuda T, Ikeda S, Hirano R, Terazono H. The gene mutated in adult-onset type II citrullinaemia encodes a putative mitochondrial carrier protein. Nat Genet. 1999;22:159-163. [PubMed] [DOI] |
| 13. | Fu HY, Zhang SR, Yu H, Wang XH, Zhu QR, Wang JS. Most common SLC25A13 mutation in 400 Chinese infants with intrahepatic cholestasis. World J Gastroenterol. 2010;16:2278-2282. [PubMed] [DOI] |
| 14. | Fu HY, Zhang SR, Wang XH, Saheki T, Kobayashi K, Wang JS. The mutation spectrum of the SLC25A13 gene in Chinese infants with intrahepatic cholestasis and aminoacidemia. J Gastroenterol. 2011;46:510-518. [PubMed] [DOI] |
| 15. | 宋 元宗, 牛 饲美晴, 盛 建胜, 胡 務亮, 张 春花, 小 林圭子. Citrin缺陷导致的新生儿肝内胆汁淤积症SLC25A13基因三个新突变的识别及诊断. 中华儿科杂志. 2008;46:411-415. |
| 16. | Dimmock D, Kobayashi K, Iijima M, Tabata A, Wong LJ, Saheki T, Lee B, Scaglia F. Citrin deficiency: a novel cause of failure to thrive that responds to a high-protein, low-carbohydrate diet. Pediatrics. 2007;119:e773-e777. [PubMed] [DOI] |
| 17. | Ohura T, Kobayashi K, Tazawa Y, Abukawa D, Sakamoto O, Tsuchiya S, Saheki T. Clinical pictures of 75 patients with neonatal intrahepatic cholestasis caused by citrin deficiency (NICCD). J Inherit Metab Dis. 2007;30:139-144. [PubMed] [DOI] |