修回日期: 2025-04-11
接受日期: 2025-04-22
在线出版日期: 2025-04-28
舟山海岛地区由于其独特的生活环境, 尤其对青少年肥胖的研究报道较少, 在个性化医疗的今天, 更加精细化的诊断对患者疾病的治疗效果更有意义, 且我国有广阔的海岸线, 同时目前临床尚缺少氢质子磁共振波谱(1H-magnetic resonance spectroscopy, 1H-MRS)、血清胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)联合在非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)病情评估中的相关研究.
探讨海岛地区青少年腹部脂肪定量1H-MRS联合 IGF-1对NAFLD严重程度的评估价值.
选取2022-01/2024-06舟山市妇女儿童医院收治的99例疑似NAFLD青少年患者, 根据病理诊断分为非NAFLD组(41例), 轻度NAFLD组(37例), 中重度NAFLD组(21例). 比较三组代谢相关指标[体质量指数(body mass index, BMI)、餐后2 h血糖(2-hour postprandial glucose, 2HPG)、甘油三酯(triglycerides, TG)、总胆固醇(total cholesterol, TC)、谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)]. 比较三组1H-MRS波谱值、波谱内肝脏脂肪(intrahepatic lipid, IHL)、血清IGF-1, 以Pearson相关系数法分析IHL、血清IGF-1与代谢相关指标、1H-MRS波谱值的相关性, 采用点二列相关性分析IHL、血清IGF-1与病情严重程度的相关性, 分析IHL、血清IGF-1对NAFLD严重程度的评估价值.
中重度NAFLD组HDL-C低于非NAFLD组、轻度NAFLD组, BMI、2HPG、ALT、AST、TG、TC、LDL-C均高于非NAFLD组、轻度NAFLD组(P<0.05); 相比于非NAFLD组、轻度NAFLD组, 中重度NAFLD组水峰峰值较低, 脂峰峰值较高(P<0.05); 中重度NAFLD组IHL水平高于非NAFLD组、轻度NAFLD组, IGF-1低于非NAFLD组、轻度NAFLD组(P<0.05); BMI、2HPG、ALT、AST、TG、TC、LDL-C与IHL呈正相关, 与IGF-1呈负相关(P<0.05), HDL-C、水峰峰值、脂峰峰值与IHL呈负相关, 与IGF-1呈正相关(P<0.05); NAFLD病情严重程度与IHL呈正相关, 与血清IGF-1呈负相关(P<0.05); 受试者工作特征曲线结果显示, IHL、血清IGF-1评估NAFLD严重程度的受试者工作特征曲线及曲线下面积(area under the curve, AUC)分别为0.740(95%CI: 0.608-0.846)、0.721(95%CI: 0.588-0.831), 二者联合评估的AUC最大, 为0.896(95%CI: 0.787-0.961) (P<0.05); IHL高水平(>18.51%)、血清IGF-1低水平(≤0.24 μg/L)可显著区分中重度NAFLD发生风险(P<0.05).
腹部脂肪定量1H-MRS、血清IGF-1与青少年机体代谢密切相关, IHL、血清IGF-1联合对NAFLD严重程度有较高评估价值.
核心提要: 目前临床尚缺少氢质子磁共振波谱(1H-magnetic resonance spectroscopy, 1H-MRS)、血清胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)联合在非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)病情评估中的相关研究. 故本研究尝试探讨腹部脂肪定量1H-MRS与血清IGF-1联合在NAFLD严重程度评估中的应用价值, 以期为临床诊治提供参考.
引文著录: 吴帆, 章杰, 孙文, 李嘉霖, 张文奇, 白敏. 浙江省舟山海岛地区青少年腹部脂肪定量1H-MRS联合血清IGF-1对NAFLD严重程度的评估价值. 世界华人消化杂志 2025; 33(4): 308-315
Revised: April 11, 2025
Accepted: April 22, 2025
Published online: April 28, 2025
The Zhoushan Island area, characterized by its unique living environment, has limited reported data on obesity and related metabolic disorders. In the era of personalized medical care, more refined diagnosis is critical for the treatment of patients' diseases. Despite China's extensive coastline, there is still a lack of relevant research exploring the combined use of 1H-magnetic resonance spectroscopy (1H-MRS) and insulin-like growth factor-1 (IGF-1) in the evaluation of non-alcoholic fatty liver disease (NAFLD) in adolescents.
To explore the utility of quantitative 1H-MRS of adolescent abdominal fat combined with serum IGF-1 in evaluating the severity of NAFLD in adolescents from the Zhoushan Island area.
A total of 99 adolescent patients with suspected NAFLD who were admitted to Zhoushan Women's and Children's Hospital from January 2022 to June 2024 were selected. They were divided into a non-NAFLD group (41 cases), a mild NAFLD group (37 cases), and a moderate to severe NAFLD group (21 cases) according to pathological diagnosis. Metabolic-related indicators [body mass index (BMI), 2-hour postprandial glucose (2HPG), triglycerides (TG), total cholesterol (TC), alanine aminotransferase (ALT), aspartate aminotransferase (AST), high-density lipoprotein cholesterol (HDL-C), and low-density lipoprotein cholesterol (LDL-C)] were compared among the three groups. The 1H-MRS spectral values, intrahepatic lipid (IHL), and serum IGF-1 were also compared among the three groups. The correlation between IHL, serum IGF-1, metabolic related indicators, and 1H-MRS spectral values was analyzed using Pearson correlation. The correlation between IHL, serum IGF-1, and disease severity was analyzed by point-biserial correlation. The value of IHL and serum IGF-1 for evaluating the severity of NAFLD was analyzed.
In the moderate to severe NAFLD group, HDL-C levels were lower than those of the other two groups, while BMI, 2HPG, ALT, AST, TG, TC, and LDL-C levels were higher than those of the other two groups (P < 0.05). Compared to the non-NAFLD group and the mild NAFLD group, the moderate to severe NAFLD group had lower water peak values and higher lipid peak values (P < 0.05). The level of IHL in the moderate and severe NAFLD group was higher than those of the other two groups, while the level of IGF-1 was lower than those of the other two groups (P < 0.05). BMI, 2HPG, ALT, AST, TG, TC, and LDL-C were positively correlated with IHL and negatively correlated with IGF-1 (P < 0.05). HDL-C, water peak, and lipid peak were negatively correlated with IHL and positively correlated with IGF-1 (P < 0.05). The severity of NAFLD was positively correlated with IHL and negatively correlated with serum IGF-1 (P < 0.05). Receiver operating characteristic curve analysis showed that the area under the curve (AUC) values of IHL and serum IGF-1 for evaluating the severity of NAFLD were 0.740 (95% confidence interval [CI]: 0.608-0.846) and 0.721 (95%CI: 0.588-0.831), respectively. The combined evaluation of the two had the highest AUC of 0.896 (95%CI: 0.787-0.961) (P < 0.05). High levels of IHL (> 18.51%) and low levels of serum IGF-1 (≤ 0.24 μg/L) can significantly distinguish the risk of developing moderate to severe NAFLD (P < 0.05).
Abdominal fat quantified by 1H-MRS and serum IGF-1 are closely related to the metabolism of adolescents, and the combination of the two has high value for evaluaing the severity of NAFLD.
- Citation: Wu F, Zhang J, Sun W, Li JL, Zhang WQ, Bai M. Value of 1H-MRS abdominal fat quantification combined with serum IGF-1 in assessing severity of NAFLD in adolescents in Zhoushan Island area. Shijie Huaren Xiaohua Zazhi 2025; 33(4): 308-315
- URL: https://www.wjgnet.com/1009-3079/full/v33/i4/308.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i4.308
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是青少年常见的肝脏内脂肪异位沉积的慢性肝病, 相关数据显示, 我国青少年超重率、肥胖率分别达11.1%、7.9%, 随着超重、肥胖率增加, NAFLD成为影响青少年健康的重要问题[1,2]. 对于NAFLD若未及时干预, 其病情可持续发展为非酒精性脂肪性肝炎甚至肝硬化. 因此, 早期诊断、病情评估对NAFLD的临床防治具有积极意义. 氢质子磁共振波谱(1H-magnetic resonance spectroscopy, 1H-MRS)是医学影像学的新型检查方式, 可无创评价机体器官组织的代谢、生化改变, 在脂肪性肝病腹部肝脏脂肪含量定量分析方面发挥重要作用, 有利于评估NAFLD病情程度、选择临床治疗方案[3,4]. NAFLD属代谢性疾病, 与2型糖尿病关系密切, 胰岛素抵抗是其共同的病理生理特征[5,6]. 胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)主要分泌于肝脏, 其水平受肝病影响, 研究表明IGF-1在炎症反应、糖脂代谢等过程中发挥重要作用; 有研究显示IGF-1可参与NAFLD病情发展[7,8]. 海岛地区由于其独特的生活环境, 尤其对青少年肥胖的研究报道较少, 在个性化医疗的今天, 更加精细化的诊断对患者疾病的治疗效果更有意义, 且我国有广阔的海岸线, 同时目前临床尚缺少1H-MRS、IGF-1联合在NAFLD病情评估中的相关研究. 故本研究尝试探讨海岛地区青少年腹部脂肪定量1H-MRS与血清IGF-1联合在NAFLD严重程度评估中的应用价值, 以期为沿海地区人群的临床诊治提供参考. 报告如下.
本文研究征得医院伦理委员会、患者和家属签字同意. 选取浙江舟山海岛地区2022-01/2024-06舟山市妇女儿童医院收治的99例疑似NAFLD青少年患者, 年龄6-18岁, 平均(10.85±2.29)岁, 男56例, 女43例. 纳入标准: 年龄≤18岁; 存在以下单项或多项风险因素: 体质量指数(body mass index, BMI)≥同年龄、性别第85百分位, 血脂/空腹血糖异常, 胰岛素抵抗, 影像学提示肝脂肪变(肝脏超声回声增强、肝-肾回声对比增强等); 有明确NAFLD诊断结果. 排除标准: 伴有病毒性肝病、药物性肝损伤、自身免疫性肝炎等可致NAFLD的特定疾病; 内分泌疾病、药物等原因引起的继发性肥胖; 存在恶性肿瘤存在磁共振检查禁忌.
99例疑似NAFLD青少年患者中根据《非酒精性脂肪性肝病诊疗指南》[9]确诊58例NAFLD, 诊断标准: 无饮酒史, 且具备任意2项腹部超声表现即可判定为NAFLD: (1)肝脏远场回声逐渐衰减; (2)肝内管道结构显示不清; (3)肝脏近场回声强于肾脏, 弥漫性增强. 41例未确诊NAFLD的患者计入非NAFLD组. 58例NAFLD患者根据SAF评分评估病情严重程度: (1)轻度: 单纯脂肪变, 无/轻度炎症, 无纤维化; (2)中度: 中重度脂肪变, 明显炎症, 且轻度纤维化; (3)重度: 重度脂肪变, 显著炎症, 且进展性纤维化. 37例计入轻度NAFLD组, 21例计入中重度NAFLD组(因例数较少, 中、重度合并分析).
轻度NAFLD组男20例, 女17例, 年龄6-18岁, 平均(10.98±2.11)岁; Tanner分期: Ⅰ期21例, Ⅱ-Ⅴ期16例; 中重度NAFLD组男13例, 女8例, 年龄6-16岁, 平均(10.02±1.97)岁; Tanner分期: Ⅰ期11例, Ⅱ-Ⅴ期10例; 非NAFLD组男23例, 女18例, 年龄6-17岁, 平均(11.16±2.14)岁; Tanner分期: Ⅰ期20例, Ⅱ-Ⅴ期21例; 三组性别、年龄、Tanner分期均衡可比(P>0.05).
1.2.1 临床、实验室检查: 体格测量: 清晨空腹状态下进行体格检查, 并计算BMI. 取受检者4 mL空腹静脉血, 离心(3500 r/min, 10 min)分离血清, 以全自动生化分析仪(美国贝克曼, AU5800型)检测高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)、谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、甘油三酯(triglycerides, TG)、总胆固醇(total cholesterol, TC), 同样以全自动生化分析仪检测餐后2 h血糖(2-hour postprandial glucose, 2HPG); 采用全自动电化学发光仪(DXI800)检测血清IGF-1.
1.2.2 1H-MRS检查: 先行常规磁共振成像(magnetic resonance imaging, MRI)扫描, MRI三平面定位, 采用腹部线圈, 嘱患者检查过程中屏气, 均在吸气末开始扫描, 分段屏气扫描. 所有受检者1H-MRS检查均由同一磁共振医师操作. 扫描序列: T2WI序列、同相/反相位和点分辨波谱成像序列, TE 50 ms, TR 2000 ms, T2WI感兴趣区选择肝右后叶胆管区域, 扫描时间3 min 50 s, 激励次数 = 6. 扫描参数: TR 99 ms, TE 4.6 ms, 层厚7 mm, 层间距0.7 mm, 矩阵256×128, 视野390 mm, 翻转角15°, 激励次数 = 1. T2WI采用抑脂快速恢复快速自旋回波序列, TR 3499 ms, TE 94.6 ms, 呼吸门控. 同相/反相位完成全肝扫描, 获得正相位图、反相位图. 采用仪器配套spectroview波谱后处理软件进行图像后处理, 获取1H-MRS波谱值(水峰峰值、脂峰峰值), 并计算波谱内肝脏脂肪(intrahepatic lipid, IHL), IHL = 脂峰下面积/(水峰下面积+脂峰下面积)×100%.
(1)比较三组代谢相关指标; (2)比较三组1H-MRS波谱值; (3)比较三组IHL、血清IGF-1; (4)分析IHL、血清IGF-1与代谢相关指标、1H-MRS波谱值的相关性; (5)分析IHL、血清IGF-1与病情严重程度的相关性; (6)分析IHL、血清IGF-1对NAFLD严重程度的评估价值.
统计学处理 采用SPSS 27.0对数据进行分析, 计量资料以(mean±SD)表示, 多组间比较以单因素方差进行分析, 组间两两对比采用LSD-t检验, 以Pearson相关系数法、点二列进行相关性分析; 计数资料以n(%)表示, 差异行χ2检验; 采用受试者工作特征(receiver operating characteristic, ROC)曲线分析IHL、血清IGF-1对NAFLD严重程度的评估价值, 采用相对危险度(RR)分析不同IHL、血清IGF-1对NAFLD患者严重程度的危险度, 均采用双侧检验, 检验水准α = 0.05.
中重度NAFLD组BMI、2HPG、ALT、AST、TG、TC、LDL-C均高于非NAFLD组、轻度NAFLD组, HDL-C低于非NAFLD组、轻度NAFLD组(P<0.05), 见表1.
| 指标 | 非NAFLD组(41例) | 轻度NAFLD组(37例) | 中重度NAFLD组(21例) | F | P值 |
| BMI(kg/m2) | 25.43±1.14 | 28.67±1.43a | 29.51±1.50ab | 87.550 | <0.001 |
| 2HPG(mmol/L) | 6.25±0.67 | 6.41±0.62 | 6.78±0.75ab | 4.360 | 0.015 |
| ALT(U/L) | 25.45±4.49 | 38.50±4.70a | 53.13±5.82ab | 230.680 | <0.001 |
| AST(U/L) | 26.54±4.73 | 39.22±5.58a | 44.78±6.11ab | 97.301 | <0.001 |
| TG(mmol/L) | 1.09±0.34 | 2.65±0.77a | 3.73±0.56ab | 159.392 | <0.001 |
| TC(mmol/L) | 4.03±0.61 | 4.85±0.84a | 5.96±0.60ab | 52.936 | <0.001 |
| HDL-C(mmol/L) | 1.40±0.28 | 1.26±0.21a | 1.17±0.14ab | 7.731 | 0.002 |
| LDL-C(mmol/L) | 25.58±4.12 | 38.64±4.59a | 41.42±5.36ab | 115.856 | <0.001 |
| 生活习惯 | |||||
| 每周吃海鲜次数≥5次 | 36(87.80) | 32(86.49) | 18(85.71) | 0.061 | 0.970 |
| 喜欢甜食 | 15(36.59) | 15(40.54) | 10(47.61) | 0.703 | 0.704 |
| 农村人口 | 19(46.34) | 16(43.24) | 8(38.10) | 0.385 | 0.825 |
| 维生素D(ng/mL) | 42.12±5.38 | 39.87±6.02 | 40.44±5.88 | 1.593 | 0.209 |
中重度NAFLD组水峰峰值低于非NAFLD组、轻度NAFLD组, 脂峰峰值高于非NAFLD组、轻度NAFLD组(P<0.05), 见表2.
中重度NAFLD组IHL水平高于非NAFLD组、轻度NAFLD组, IGF-1低于非NAFLD组、轻度NAFLD组(P<0.05), 见表3.
以Pearson相关系数法分析, BMI、2HPG、ALT、AST、TG、TC、LDL-C与IHL呈正相关, 与IGF-1呈负相关(P<0.05), HDL-C、水峰峰值、脂峰峰值与IHL呈负相关, 与IGF-1呈正相关(P<0.05), 见表4.
| 指标 | IHL | IGF-1 | ||
| r | P值 | r | P值 | |
| BMI | 0.796 | <0.05 | -0.638 | <0.05 |
| 2HPG | 0.572 | <0.05 | -0.565 | <0.05 |
| ALT | 0.695 | <0.05 | -0.657 | <0.05 |
| AST | 0.724 | <0.05 | -0.681 | <0.05 |
| TG | 0.623 | <0.05 | -0.617 | <0.05 |
| TC | 0.682 | <0.05 | -0.579 | <0.05 |
| HDL-C | -0.741 | <0.05 | 0.638 | <0.05 |
| LDL-C | 0.680 | <0.05 | -0.633 | <0.05 |
| 水峰峰值 | -0.796 | <0.05 | 0.638 | <0.05 |
| 脂峰峰值 | -0.802 | <0.05 | 0.651 | <0.05 |
采用点二列相关性分析, 结果显示NAFLD病情严重程度(赋值: 轻度脂肪肝 = 1, 中重度脂肪肝 = 2)与IHL呈正相关(r = 0.609), 与血清IGF-1呈负相关(r = -0.562) (P<0.05).
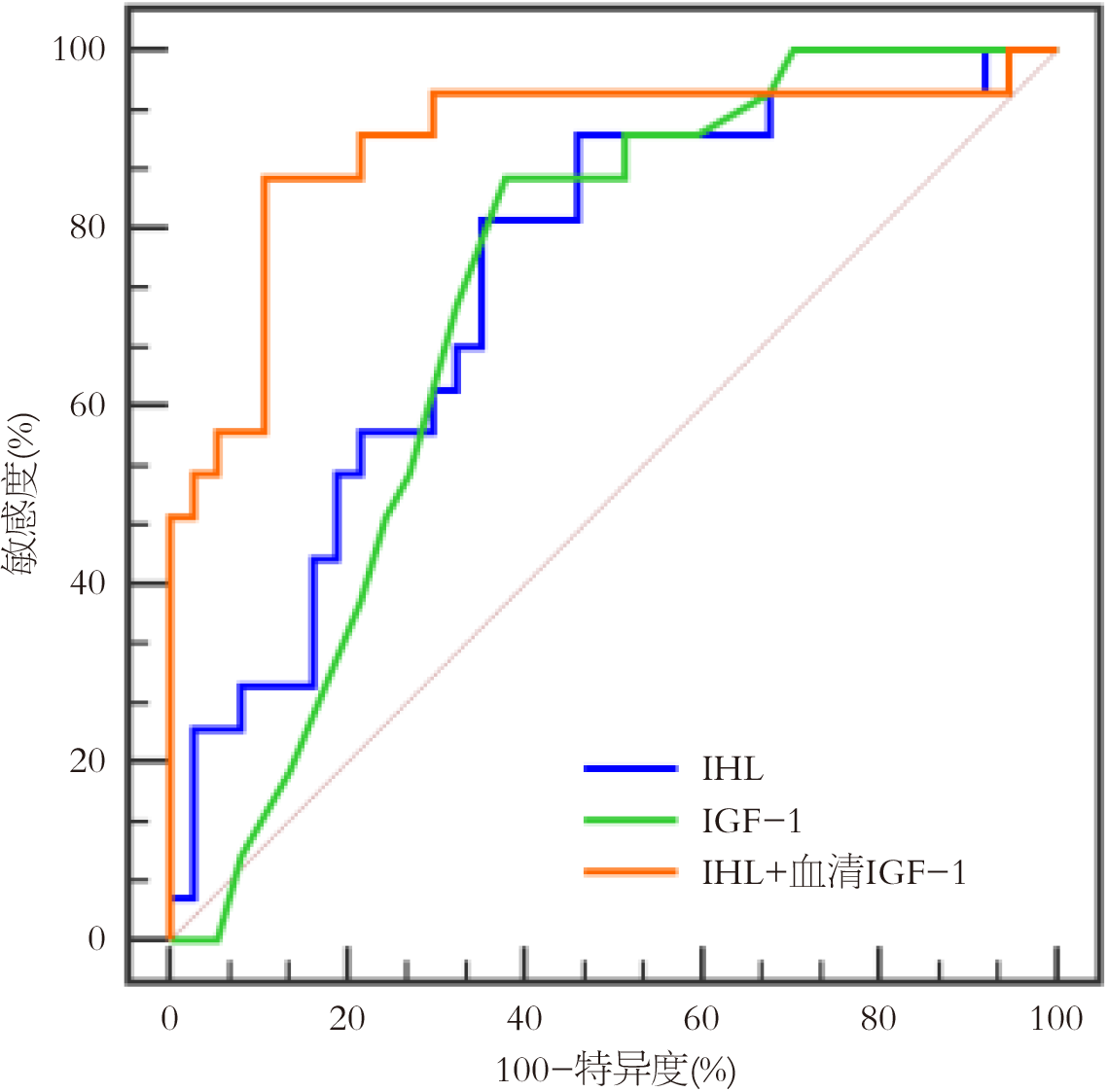
以NAFLD严重程度为状态变量, 中重度NAFLD组为阳性样本, 轻度NAFLD组为阴性样本, 以IHL、血清IGF-1为检验变量, 绘制ROC曲线结果显示, IHL、血清IGF-1评估NAFLD严重程度的AUC分别为0.740(95%CI: 0.608-0.846)、0.721(95%CI: 0.588-0.831), 二者联合评估的AUC最大, 为0.896(95%CI: 0.787-0.961)(P<0.05). 见表5和表6, 图1.
| 指标 | AUC | 95%CI | Z统计 | 截断值 | 敏感度(%) | 特异度(%) | P值 |
| IHL | 0.740 | 0.608-0.846 | 3.546 | 18.51% | 80.95 | 64.86 | <0.001 |
| 血清IGF-1 | 0.721 | 0.588-0.831 | 3.319 | 0.24 μg/L | 85.71 | 62.16 | <0.001 |
| IHL+血清IGF-1 | 0.896 | 0.787-0.961 | 7.826 | - | 85.71 | 89.19 | <0.001 |
| 成对对比 | AUC差异 | 标准误差 | 95%CI | Z | P值 |
| IHL vs 血清IGF-1 | 0.019 | 0.089 | -0.156-0.194 | 0.209 | 0.834 |
| IHL+血清IGF-1 vs IHL | 0.156 | 0.079 | 0.002-0.310 | 1.980 | 0.048 |
| IHL+血清IGF-1 vs 血清IGF-1 | 0.174 | 0.088 | 0.003-0.346 | 1.989 | 0.047 |
以ROC曲线中的cut-off值为界值, 将IHL、血清IGF-1分为高水平、低水平, 进行RR危险度分析, 结果显示IHL高水平(>18.51%)、血清IGF-1低水平(≤0.24 μg/L)可显著区分中重度NAFLD发生风险(P<0.05), 见表7.
| 指标 | 例数 | 中重度NAFLD组(21例) | 轻度NAFLD组(37例) | RR(95%CI) | P值 |
| CKAP4 | 3.967(1.519-10.357) | 0.007 | |||
| 高水平 | 30 | 17 | 13 | ||
| 低水平 | 28 | 4 | 24 | ||
| IL-37 | 0.205(0.068-0.621) | 0.005 | |||
| 高水平 | 26 | 3 | 23 | ||
| 低水平 | 32 | 18 | 14 |
随着城镇化建设的加速, 海岛地区的生活饮食也逐渐发生了变化, 青少年的NAFLD的发病率呈逐年上升趋势. NAFLD的发病机制复杂, 现阶段尚无统一定论, 其病情进展过程中从单纯性肝脂肪变性到非酒精性脂肪性肝炎, 还可进一步发展为肝硬化[10]. 目前普遍认为NAFLD发病主要由于胰岛素抵抗引起肝细胞内脂质过度沉积, 增加了肝脏易感性, 导致单纯性脂肪肝, 且受氧化应激反应出现肝细胞脂肪变性, 包括肝细胞炎症坏死、变性及肝组织纤维化等病理异常[11-13].
1H-MRS应用于NAFLD主要利用脂肪和水中质子群共振频率的差异, 获得肝脏内脂肪和水中质子的MRS信息, 进而分析肝脏脂肪含量[14,15]. 1H-MRS量化评估NAFLD患者肝脏脂肪含量结果与病理学检测的脂肪变性程度有高度一致性[16]. 本研究结果显示, 中重度NAFLD组BMI、2HPG、ALT、AST、TG、TC、LDL-C均高于非NAFLD组、轻度NAFLD组, HDL-C低于非NAFLD组、轻度NAFLD组, 且中重度NAFLD组水峰峰值较低, 脂峰峰值较高, 相关性分析显示BMI、2HPG、ALT、AST、TG、TC、LDL-C与IHL呈正相关, HDL-C、水峰峰值、脂峰峰值与IHL呈负相关, NAFLD病情严重程度与IHL呈正相关. IHL是经1H-MRS定量分析, 水峰下面积、脂峰下面积计算所得[17]. 上述结果提示, 1H-MRS测量所得IHL与NAFLD患者机体各代谢指标联系密切, 可反映NAFLD患者代谢状态及病情严重程度, 在NAFLD临床诊断评估中具有较高价值.
胰岛素抵抗通过增强脂肪分解代谢, 促进游离脂肪酸转运, 是贯穿NAFLD发生发展过程的重要病理机制[18]. IGF-1主要产生于肝脏, 属IGF家族, 有多种内分泌、旁分泌作用[19,20]. IGF-1可作用于生长激素(GH), 负反馈作用于GH分泌, 通过影响GH/IGF-1轴降低肝内脂肪含量; GH通过其受体作用于肝细胞, 产生IGF-1, IGF-1可能通过GH/IGF-1轴影响NAFLD病情[21,22]. 本研究结果显示, 中重度NAFLD组IGF-1低于非NAFLD组、轻度NAFLD组, 且BMI、2HPG、ALT、AST、TG、TC、LDL-C与IGF-1呈负相关, NAFLD病情严重程度与血清IGF-1呈负相关. 上述提示IGF-1在不同病情程度NAFLD中表达存在明显差异, 与NAFLD患者机体代谢状态及病情程度有密切联系. 经分析, 检测IGF-1可反映NAFLD发病过程中的氧化应激反应与胰岛素抵抗, 有利于评估NAFLD病情. IGF-1具有改善线粒体功能及抗氧化作用, IGF-1水平降低可能加剧氧化应激反应, 减少脂肪酸氧化、脂肪分解[23]. 此外, IGF-1可通过干扰miR-379等基因靶点转录, 上调过氧化氢酶等抗凋亡基因表达, 可发挥抗脂肪变性的作用[24]. NAFLD患者GH/IGF-1受抑制, 表现出IGF-1水平下调, 中重度NAFLD组的低水平IGF-1可能通过调控体内过氧化物酶体增殖物激活受体γ(PPAR-γ)表达, 介导脂肪酸合成酶转录增加, 进而促进肝细胞内脂质合成[25].
NAFLD患者脂肪沉积导致肝细胞功能受损, 减少IGF-1合成, 且白介素-6、肿瘤坏死因子-α等促炎细胞因子可抑制GH受体表达, 从而减少IGF-1产生[26]. 同时, IGF-1具有胰岛素样作用, 可抑制脂肪组织脂解, IGF-1缺乏可导致脂肪分解增加, 造成游离脂肪酸大量释放并进入肝脏, 进而加剧肝脏脂肪沉积, 因此表现为1H-MRS中IHL升高. 本研究尝试绘制IHL、血清IGF-1评估NAFLD严重程度的ROC曲线, 结果显示IHL、血清IGF-1评估NAFLD严重程度的AUC分别为0.740、0.721, 二者联合评估的AUC最大, 为0.896, 且IHL高水平(>18.51%)、血清IGF-1低水平(≤0.24 μg/L)可显著区分中重度NAFLD发生风险, 展现出较高评估效能, 对NAFLD临床诊治具有积极指导意义.
综上所述, 海岛地区青少年腹部脂肪定量1H-MRS、血清IGF-1与机体代谢密切相关, 1H-MRS参数IHL联合血清IGF-1在NAFLD严重程度评估中的效能较高. 但本研究为单中心研究, 由于海岛人数及样本量有限, 重度脂肪肝患者较少, 为了满足统计学要求, 将中度与重度脂肪肝患者合并为中重度NAFLD组, 可能存在一定偏倚性, 未来有待临床增加样本选取, 进一步研究证实, 同时本研究的主要对象为海岛地区, 是否对内陆地区的人群同样适用, 也需要进一步研究探讨.
舟山海岛地区由于其独特的生活环境, 尤其对青少年肥胖的研究报道较少, 在个性化医疗的今天, 更加精细化的诊断对患者疾病的治疗效果更有意义, 且我国有广阔的海岸线, 同时目前临床尚缺少氢质子磁共振波谱(1H-magnetic resonance spectroscopy, 1H-MRS)、血清胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)联合在非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)病情评估中的相关研究.
我国青少年超重率、肥胖率分别达11.1%、7.9%, 随着超重、肥胖率增加, NAFLD成为影响青少年健康的重要问题. 对于NAFLD若未及时干预, 其病情可持续发展为非酒精性脂肪性肝炎甚至肝硬化. 因此, 早期诊断、病情评估对NAFLD的临床防治具有积极意义.
探讨海岛地区青少年腹部脂肪定量氢质子磁共振波谱联合血清胰岛素样生长因子-1对非酒精性脂肪性肝病严重程度的评估价值.
选取2022-01/2024-06舟山市妇女儿童医院收治的99例疑似NAFLD青少年患者, 根据病理诊断分为非NAFLD组, 轻度NAFLD组, 中重度NAFLD组(21例). 比较三组代谢相关指标、甘油三酯、总胆固醇、谷丙转氨酶、谷草转氨酶、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇. 比较三组1H-MRS波谱值、波谱内肝脏脂肪、血清IGF-1, 以Pearson相关系数法分析波谱内肝脏脂肪(intrahepatic lipid, IHL)、血清IGF-1与代谢相关指标、1H-MRS波谱值的相关性, 采用点二列相关性分析IHL、血清IGF-1与病情严重程度的相关性, 分析IHL、血清IGF-1对NAFLD严重程度的评估价值.
结果显示IHL、血清IGF-1评估NAFLD严重程度的受试者工作特征曲线及曲线下面积(area under the curve, AUC)分别为0.740、0.721, 二者联合评估的AUC最大, 为0.896, 且IHL高水平(>18.51%)、血清IGF-1低水平(≤0.24 μg/L)可显著区分中重度NAFLD发生风险, 展现出较高评估效能, 对NAFLD临床诊治具有积极指导意义.
腹部脂肪定量1H-MRS、血清IGF-1与青少年机体代谢密切相关, IHL、血清IGF-1联合对NAFLD严重程度有较高评估价值.
未来有待临床增加样本选取, 进一步研究证实, 同时本研究的主要对象为海岛地区, 是否对内陆地区的人群同样适用, 也需要进一步研究探讨.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:郑晓梅
| 1. | 戴 文, 姚 珍珍, 欧阳 思思, 徐 宁安, 周 海湘, 李 雄伟, 钟 燕, 罗 家有. 超重/肥胖儿童非酒精性脂肪肝病患病率及其影响因素的横断面研究. 中国当代儿科杂志. 2023;25:448-456. [DOI] |
| 3. | Kim JW, Lee CH, Yang Z, Kim BH, Lee YS, Kim KA. The spectrum of magnetic resonance imaging proton density fat fraction (MRI-PDFF), magnetic resonance spectroscopy (MRS), and two different histopathologic methods (artificial intelligence vs. pathologist) in quantifying hepatic steatosis. Quant Imaging Med Surg. 2022;12:5251-5262. [PubMed] [DOI] |
| 4. | Smith LM, Pitts CB, Friesen-Waldner LJ, Prabhu NH, Mathers KE, Sinclair KJ, Wade TP, Regnault TRH, McKenzie CA. In Vivo Magnetic Resonance Spectroscopy of Hyperpolarized [1-(13) C]Pyruvate and Proton Density Fat Fraction in a Guinea Pig Model of Non-Alcoholic Fatty Liver Disease Development After Life-Long Western Diet Consumption. J Magn Reson Imaging. 2021;54:1404-1414. [PubMed] [DOI] |
| 6. | Fujii H, Kawada N, Japan Study Group Of Nafld Jsg-Nafld. The Role of Insulin Resistance and Diabetes in Nonalcoholic Fatty Liver Disease. Int J Mol Sci. 2020;21:3863. [PubMed] [DOI] |
| 8. | Kundu D, Kennedy L, Zhou T, Ekser B, Meadows V, Sybenga A, Kyritsi K, Chen L, Ceci L, Wu N, Wu C, Glaser S, Carpino G, Onori P, Gaudio E, Alpini G, Francis H. p16 INK4A drives nonalcoholic fatty liver disease phenotypes in high fat diet fed mice through biliary E2F1/FOXO1/IGF-1 signaling. Hepatology. 2023;78:243-257. [PubMed] [DOI] |
| 10. | De A, Bhagat N, Mehta M, Taneja S, Duseja A. Metabolic dysfunction-associated steatotic liver disease (MASLD) definition is better than MAFLD criteria for lean patients with NAFLD. J Hepatol. 2024;80:e61-e62. [PubMed] [DOI] |
| 11. | Wei S, Wang L, Evans PC, Xu S. NAFLD and NASH: etiology, targets and emerging therapies. Drug Discov Today. 2024;29:103910. [PubMed] [DOI] |
| 12. | Guo X, Yin X, Liu Z, Wang J. Non-Alcoholic Fatty Liver Disease (NAFLD) Pathogenesis and Natural Products for Prevention and Treatment. Int J Mol Sci. 2022;23:15489. [PubMed] [DOI] |
| 14. | Qadri S, Vartiainen E, Lahelma M, Porthan K, Tang A, Idilman IS, Runge JH, Juuti A, Penttilä AK, Dabek J, Lehtimäki TE, Seppänen W, Arola J, Arkkila P, Stoker J, Karcaaltincaba M, Pavlides M, Loomba R, Sirlin CB, Tukiainen T, Yki-Järvinen H. Marked difference in liver fat measured by histology vs. magnetic resonance-proton density fat fraction: A meta-analysis. JHEP Rep. 2024;6:100928. [PubMed] [DOI] |
| 15. | 黎 永滨, 钟 洁愉, 谢 婷婷, 梁 立洲, 林 晓娜, 孙 德胜, 胡 正明. 瞬时弹性成像受控衰减参数与磁共振成像质子密度脂肪分数在肝脏脂肪变评估的相关性及一致性研究. 中国CT和MRI杂志. 2023;21:110-112. [DOI] |
| 16. | Thiagarajan P, Bawden SJ, Aithal GP. Metabolic Imaging in Non-Alcoholic Fatty Liver Disease: Applications of Magnetic Resonance Spectroscopy. J Clin Med. 2021;10:632. [PubMed] [DOI] |
| 17. | Hiruma S, Shigiyama F, Kumashiro N. Empagliflozin versus sitagliptin for ameliorating intrahepatic lipid content and tissue-specific insulin sensitivity in patients with early-stage type 2 diabetes with non-alcoholic fatty liver disease: A prospective randomized study. Diabetes Obes Metab. 2023;25:1576-1588. [PubMed] [DOI] |
| 18. | Smith GI, Shankaran M, Yoshino M, Schweitzer GG, Chondronikola M, Beals JW, Okunade AL, Patterson BW, Nyangau E, Field T, Sirlin CB, Talukdar S, Hellerstein MK, Klein S. Insulin resistance drives hepatic de novo lipogenesis in nonalcoholic fatty liver disease. J Clin Invest. 2020;130:1453-1460. [PubMed] [DOI] |
| 19. | Haldrup D, Wei C, Holland-Fischer P, Kristensen K, Rittig S, Lange A, Hørlyck A, Solvig J, Grønbæk H, Birkebæk NH, Frystyk J. Effects of lifestyle intervention on IGF-1, IGFBP-3, and insulin resistance in children with obesity with or without metabolic-associated fatty liver disease. Eur J Pediatr. 2023;182:855-865. [PubMed] [DOI] |
| 20. | Stanley TL, Fourman LT, Zheng I, McClure CM, Feldpausch MN, Torriani M, Corey KE, Chung RT, Lee H, Kleiner DE, Hadigan CM, Grinspoon SK. Relationship of IGF-1 and IGF-Binding Proteins to Disease Severity and Glycemia in Nonalcoholic Fatty Liver Disease. J Clin Endocrinol Metab. 2021;106:e520-e533. [PubMed] [DOI] |
| 21. | Eroğlu İ, Iremli BG, Idilman IS, Yuce D, Lay I, Akata D, Erbas T. Nonalcoholic Fatty Liver Disease, Liver Fibrosis, and Utility of Noninvasive Scores in Patients With Acromegaly. J Clin Endocrinol Metab. 2023;109:e119-e129. [PubMed] [DOI] |
| 22. | Dichtel LE, Corey KE, Haines MS, Chicote ML, Lee H, Kimball A, Colling C, Simon TG, Long MT, Husseini J, Bredella MA, Miller KK. Growth Hormone Administration Improves Nonalcoholic Fatty Liver Disease in Overweight/Obesity: A Randomized Trial. J. Clin Endocrinol Metab. 2023;108:e1542-e1550. [PubMed] |
| 24. | Okamoto K, Koda M, Okamoto T, Onoyama T, Miyoshi K, Kishina M, Matono T, Kato J, Tokunaga S, Sugihara T, Hiramatsu A, Hyogo H, Tobita H, Sato S, Kawanaka M, Hara Y, Hino K, Chayama K, Murawaki Y, Isomoto H. Serum miR-379 expression is related to the development and progression of hypercholesterolemia in non-alcoholic fatty liver disease. PLoS One. 2020;15:e0219412. [PubMed] [DOI] |