修回日期: 2025-01-19
接受日期: 2025-03-16
在线出版日期: 2025-03-28
胃肝样腺癌是胃癌罕见分类, 无特异性表现, 特征为肿瘤组织兼具胃腺癌与肝细胞癌样分化, 临床罕见, 易造成误诊.
64岁女性患者, 体检发现甲胎蛋白升高入院. 检查示血红蛋白略低, 甲胎蛋白、癌胚抗原升高, 其他指标正常. 影像检查发现肝胃间隙及肝门区多发淋巴结, 胃镜见胃角溃疡. 活检诊断为低分化腺癌. 正电子发射断层-X线计算机断层组合系统提示胃原发恶性病变及转移性淋巴结.
胃肝样腺癌罕见且高度侵袭性, 易误诊, 本例同时伴肠母细胞分化, 更为罕见. 经胃大部切除+化疗有效, 患者预后良好, 甲胎蛋白、癌胚抗原下降, 未见复发转移.
核心提要: 胃肝样腺癌伴肠母细胞分化极为罕见, 临床表现无特异性, 确诊依赖病理. 本文报道1例老年女性患者, 结合文献探讨其诊疗. 旨在提高临床医生对胃肝样腺癌伴肠母细胞分化的认识, 优化诊断策略, 探讨有效治疗方案.
引文著录: 冯籽言, 汪安江, 刘广宇, 胡珊, 许翠, 许雯. 胃肝样腺癌伴肠母细胞分化1例. 世界华人消化杂志 2025; 33(3): 245-250
Revised: January 19, 2025
Accepted: March 16, 2025
Published online: March 28, 2025
Hepatoid adenocarcinoma of the stomach (HAS) is a rare subtype of stomach carcinoma without specific clinical or endoscopic manifestations. The pathology is characterized by the presence of both gastric adenocarcinoma and hepatocellular carcinoma differentiation regions in the tumor tissue with some characteristic immunohistochemical markers. Here, we report a rare case of HAS with enteroblast differentiation in an elderly woman.
A patient was found to have elevated alpha-fetoprotein during a physical examination. The patient was pathologically confirmed to have HAS with enteroblast differentiation after subtotal gastrectomy.
HAS represents an uncommon subclassification of gastric cancer devoid of distinctive clinical manifestations. It is distinguished by the coexistence of gastric adenocarcinoma and hepatocellular carcinomatoid differentiation within the tumor tissue, presenting a unique histopathological profile. Given its scarcity in clinical practice, pathological diagnosis remains the definitive gold standard for identifying this entity.
- Citation: Feng ZY, Wang AJ, Liu GY, Hu S, Xu C, Xu W. Hepatoid adenocarcinoma of the stomach with enteroblast differentiation: A case report. Shijie Huaren Xiaohua Zazhi 2025; 33(3): 245-250
- URL: https://www.wjgnet.com/1009-3079/full/v33/i3/245.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i3.245
胃癌为人类第五大常见的恶性肿瘤, 其中胃肝样腺癌是一种罕见且具有高度侵袭性的胃癌亚型, 其发病率低, 约占所有胃癌0.3%-2.0%. 这种肿瘤组织学和形态学上以肝癌样分化及腺癌样分化共存为特征, 临床上常易与原发性肝癌胃转移及产甲胎蛋白胃癌混淆, 导致误诊. 本病例报告将全方面描述一例病理学上同时具有胃肝样腺癌及肠母细胞分化特点的老年女性病例的临床表现、病理学特点、免疫表型以及治疗过程和预后, 旨在提高临床医生对这一罕见肿瘤的认识, 并探讨其诊断和治疗策略.
体检发现甲胎蛋白升高1月余.
患者1月余前在外院体检发现甲胎蛋白升高, 遂至我院复查示, 甲胎蛋白定量(alpha-fetoprotein, AFP): 663.00 ng/mL, 癌胚抗原定(carcinoembryonic antigen, CEA): 36.90 ng/mL, 上腹部磁共振平扫+增强扫描: 肝胃间隙及肝门区多发淋巴结可见, 较大者直径约11 mm, 余上腹部MRI增强检查未见明确异常. 患者无腹痛、腹胀, 无纳差、消瘦, 无便血、黑便, 为求进一步诊治, 门诊以"甲胎蛋白异常"收入我科.
既往史无特殊.
生于原籍, 否认长期外地居住史, 否认毒物接触史. 无吸烟、饮酒史. 家族中否认遗传性疾病及类似病史.
腹平坦, 未见腹壁静脉曲张, 未见胃型蠕动波, 未见肠蠕动波. 腹部柔软, 全腹无明显压痛、反跳痛. 肝脏肋下未触及, 脾脏肋下未触及, Murphy氏征阴性, 胆囊无叩痛, 腹部移动性浊音阴性. 肠鸣音未见异常. 直肠指检未见明显异常.
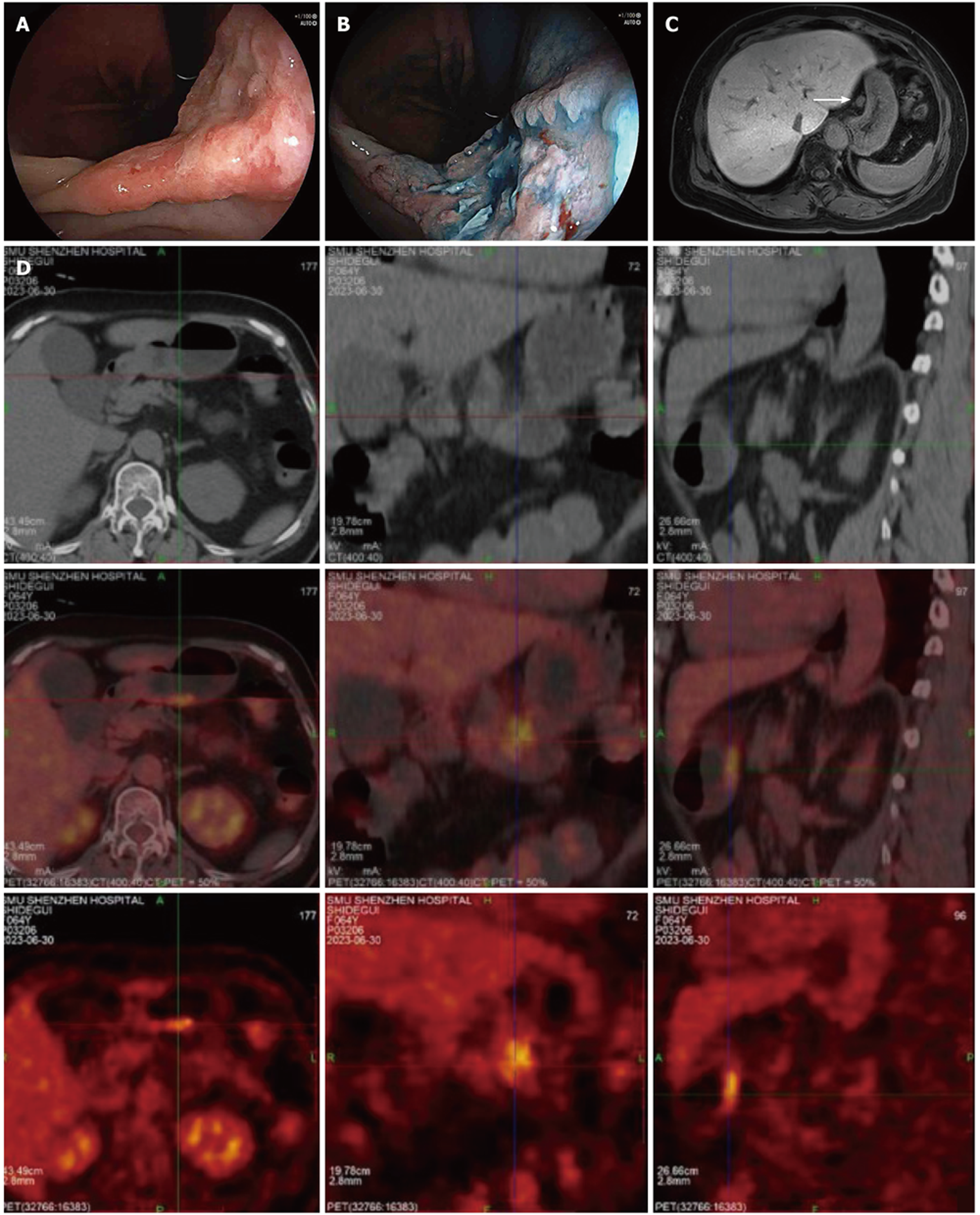
血红蛋白111 g/L, 甲胎蛋白: 663.00 ng/mL, 癌胚抗原: 36.90 ng/mL, 糖类抗原19-9、糖类抗原12-5、糖类抗原72-4正常. 肝肾功能和凝血功能等无明显异常. 上腹部磁共振平扫+增强扫描: 肝胃间隙及肝门区多发淋巴结可见, 较大者直径约11 mm. 胃镜提示: 胃角后壁见一处溃疡, 直径约3.0 cm×2.5 cm, 基底凹凸不平, 边缘呈虫蚀状, 靛胭脂染色边界清晰. 活检组织病理诊断: (胃角)低分化腺癌. 免疫组化提示: 细胞角蛋白(CK)(+)、细胞角蛋白7(CK7)(-)、尾型同源框转录因子2(CDX2)(+)、绒毛蛋白(Villin)(+)、人类表皮生长因子受体-2(Her2)(0)、增殖指数(Ki67)(90%+).
PET-CT提示: (1)胃体下部小弯侧近胃窦区胃壁增厚伴糖代谢增高, 倾向胃原发恶性病变; (2)肝门区、肝胃韧带间、胃小弯侧多枚淋巴结伴糖代谢, 倾向转移性淋巴结. 图1.
胃肝样腺癌伴肠母细胞分化.
患者接受腹腔镜下胃大部切除术伴胃空肠吻合术+腹腔淋巴结清扫术, 术后接受XELOX(奥沙利铂+卡培他滨)方案化疗.
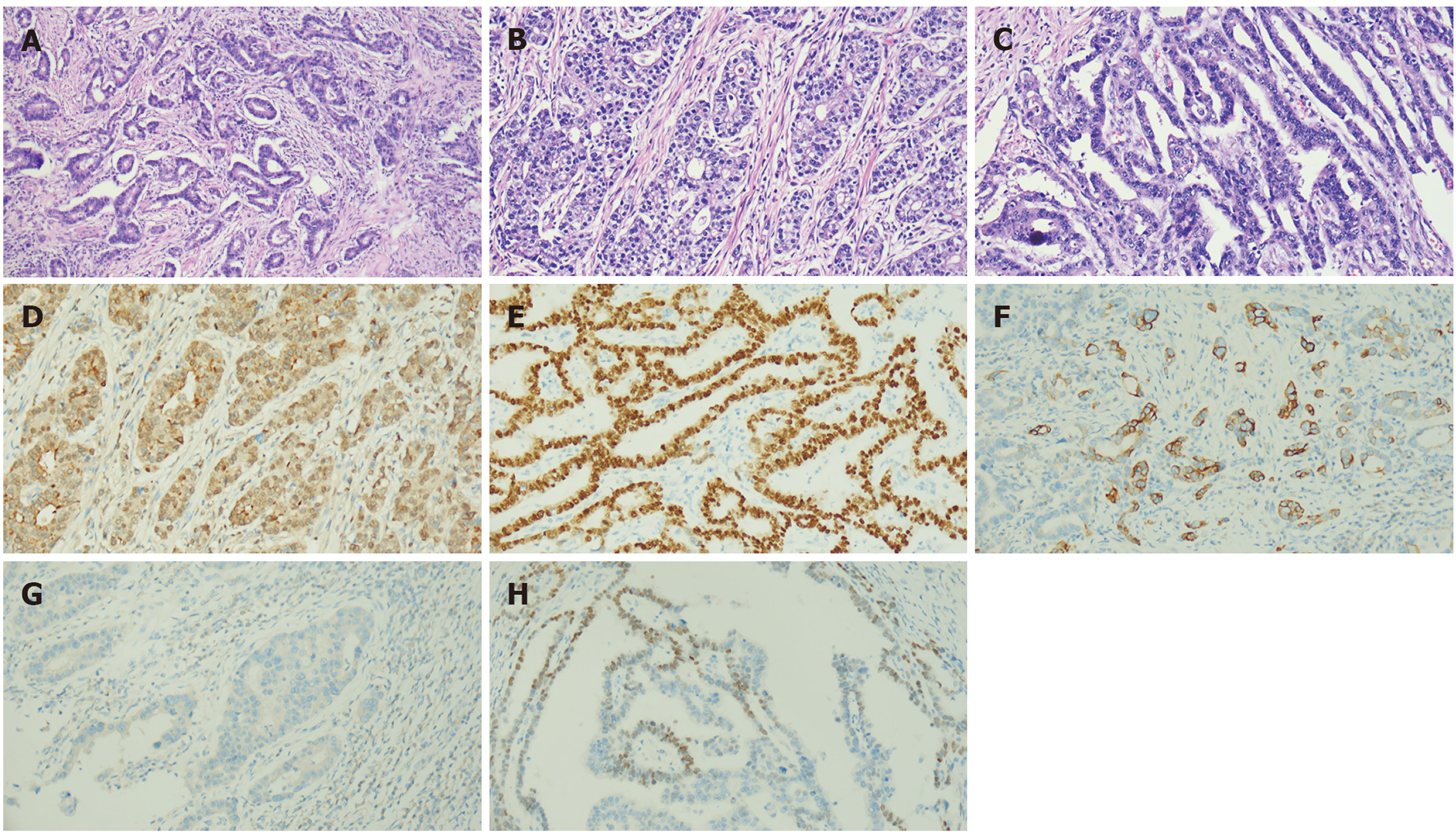
术后病理提示: 癌组织呈不规则腺管状、筛状排列, 浸润性生长, 部分区域细胞胞浆较丰富, 嗜酸性/双色性, 核大、核膜清晰、核仁明显, 核分裂象易见, 部分区域形成管状乳头状结构, 细胞呈柱状, 胞浆淡粉染或透明. 癌组织浸润至肠管浆膜下层, 浆膜面可见少量炎性渗出. 可见脉管内癌栓. 胃周淋巴结可见癌转移. 网膜组织未见癌. 免疫组化: 细胞角蛋白18(CK18)(+)、细胞角蛋白20(CK20)(-)、CK7(部分+)、CDX2(+)、特异AT序列结合蛋白2(SATB2)(部分弱+)、错配修复蛋白MLH1(+)、MSH2(+)、MSH6(+)、PMS2(+)、Her2(-)、抑癌基因P53(-, 突变型)、原癌基因BRAF-V600E突变(-)、Ki67(90%+)、肝细胞抗原(Heppar-1)(灶+)、AFP(部分+)、婆罗双树样基因4(Sall4)(部分+)、肝型精氨酸酶-1(Arginase-1)(-)、磷脂酰肌醇蛋白聚糖-3(Glypican-3)(灶+)、突触素(SYN)(-)、嗜铬素 A(CgA)(-)、神经细胞粘附因子(CD56)(-). 原位杂交: EBER(-). 结合形态学及免疫组化所见, 病理最终诊断: (胃)肝样腺癌, 伴肠母细胞分化; 浸润深度: 浆膜下层; 神经侵犯(未见明确), 脉管癌栓(+); 两侧切缘: (-); 胃周淋巴结: 可见转移癌(10/19). 病理分期: pT3N3aMx. 图2.
截至目前, 患者术后7 mo, 已完成6次化疗, 未诉明显不适, 末次复查AFP下降至4.24 ng/mL, CEA下降2.98 ng/mL, 复查全腹部平扫+增强CT未见肿瘤复发及转移表现. 术后随访至今, 患者无腹痛、腹胀、便血、黑便等不适, 甲胎蛋白一直正常, 胃镜复查未见复发.
胃癌为人类第五大常见的恶性肿瘤, 约占恶性肿瘤的5.6%, 也是全球癌症相关死亡的第四大原因(7.7%)[1]. 胃肝样腺癌(hepatoid adenocarcinoma of the stomach, HAS)是胃癌的一种罕见亚型, 仅占胃癌0.3%-1.0%[2], 其侵袭性强, 易发生远处转移, 因此预后极差. HAS组织学和形态学上以肝癌样分化及腺癌样分化共存为特征, 临床上常易与原发性肝癌(hepatocellular carcinoma, HCC)胃转移及产甲胎蛋白胃癌(alpha-fetoprotein producing gastric cancer, AFPGC)混淆, 导致误诊.
HAS是一种罕见的恶性肿瘤, 且目前还没有被包括在由癌症基因组图谱研究网络基于分子评估定义的四种胃癌亚型(包括EB病毒阳性、染色体不稳定性肿瘤、微卫星不稳定肿瘤以及基因组稳定性肿瘤)[3]: 包括EB病毒阳性、染色体不稳定性肿瘤、微卫星不稳定肿瘤以及基因组稳定性肿瘤. HAS的年发病率约为0.58-0.83/百万人, 以65岁左右的老年男性为好发人群, 且绝大多数病例来源于中国和日本[2-4]. 所有年龄段的男性约占所有病例的70%. 平均发病年龄为63.5岁, 与以前的报道相似[5]. 该病的预后极差, 容易出现血管侵犯、肝脏和淋巴结转移, 接受综合治疗后, 中位无进展生存期仅为5.0 mo-18.25 mo, 中位总生存期仅为16.0 mo-24.8 mo[6]. 目前无相关研究报道阐述HAS发生的相关危险因素, 发病机制也尚不明确. 一种假说指出, 胃和肝脏有着相同的胚胎和组织来源, 在胚胎发育过程中均来自内胚层及原始前肠, 因此腺癌和肝细胞样分化的肿瘤均有相同的来源, 其中TP53的变异在HAS的表型转化中起到重要作用[7].
HAS无特异性临床表现, 患者多因腹痛、上腹不适为主诉就诊, 内镜下以胃窦部溃疡型病变为主, 约45%, 其次为胃体病变, 约31%[8], 影像学检查如增强CT、PET-CT等可用于评估是否存在淋巴结及其他器官转移, 以确定治疗方案、评价治疗效果及预后. 70%-80%患者存在血清AFP升高, 可以作为判断预后的标志物, 研究表明血清AFP升高的患者术后复发率达80.56%, 而血清AFP阴性患者术后复发率为60.98%[9], 但并不是HAS的确诊依据. 一项回顾性研究揭示: 胃肝样腺癌患者中, AFP高水平组(>300 ng/mL)展现出更高的IV期疾病比例及肝转移率. 具体而言, 该组患者1年、3年及5年的无进展生存期率分别为41%、18%和0%, 而总生存率则分别为64%、26%和21%. 生存分析进一步表明, 相较于AFP低水平组(≤300 ng/mL), 高水平AFP组的肝样腺癌患者总生存期显著缩短. HAS患者的生存状况与肿瘤部位、病理肿瘤-淋巴结-转移分期、淋巴结转移情况、是否接受手术切除以及血清AFP水平超过300 ng/mL密切相关[10].
病理学是HAS诊断的金标准, 在常规镜下观察见胃腺癌样分化区及肝细胞癌样分化区共存, 它们在形态学上有区别, 但相互邻近, 并相互移行. 腺癌区表现为管状、乳头状结构, 肝细胞癌区表现为巢状、小梁状以及腺样排列, 肿瘤细胞体积大、呈多边形、细胞浆呈强嗜酸性[11]. HAS常需与HCC伴胃转移相鉴别, 增强CT可见HAS的肝脏转移灶为逐渐强化, HCC的肝脏原发灶则为"快进快出"表现. 当活检取材组织局限时, 组织学仅发现肝癌样表现容易将两者混淆, 但同时发现髓样分化和管状或乳头状分化区域有助于诊断HAS, 因此多点活检可以提高诊断准确率. 免疫组化方面, Glypican-3、AFP、HepPar-1、CEA、Sall4和CK19在HAS和HCC中均有表达, CK7、CK18、CK20、CDX2、α1-抗胰蛋白酶(α1-AT)以及CD10阳性可将HAS与HCC相鉴别[12].
另外临床上还需区分HAS和AFPGC的定义. Motoyama等[13]将AFPGC分为三种亚型, 包括肝样分化型、胎儿胃肠道型(亦称肠母细胞分化型)以及卵黄囊瘤型. 因此, HAS和AFPGC既有交叉, 又不完全等同, 即HAS的本质是存在肝细胞癌样分化区域, 但免疫组化或血清AFP表达并不一定升高, AFPGC则定义为免疫组化可检测出AFP表达或血清AFP升高的胃癌, 但由于AFPGC的高度异质性及争议性, 目前并未将其列入单独的胃癌亚型[14]. 结合本病例, 患者影像学检查未见肝脏病灶, 胃术后病理学可见胃腺癌及肝细胞癌分化区共存, 免疫组化可见腺癌及肝细胞癌的标志物表达, EBER阴性排除EB病毒感染, 综合所见, 可明确诊断胃肝样腺癌.
该病例另一特殊之处在于患者同时存在胃肝样腺癌和肠母细胞分化. 目前, 尚未见相关病例报道同时两种亚型共存的胃癌. 胃癌伴肠母细胞作为AFPGC的其中一种亚型, 既可分泌CEA, 也可分泌AFP, 可解释患者血清CEA及AFP升高. 组织学上表现为由含有透明细胞质的立方体或柱状细胞组成的腺癌结构, 免疫组化染色多可见Glypican-3(83%)及Sall4(72%)阳性, 部分可见AFP阳性(45%), 与其来源于原始前肠相关. 与传统胃腺癌相比, 胃癌伴肠母细胞分化有着更高的淋巴结及血管侵袭性(72%-79% vs 10%-56%), 33%的患者存在肝脏转移, 因此预后也较传统胃腺癌差, 术后平均生存时间为14.6 mo[15].
对于HAS的治疗, 外科手术仍是完整清除原发病灶及清扫邻近淋巴结的主要方法, 胃大部切除术联合辅助化疗可以显著提高患者的生存率[8]. 由于病例较少, 现仍无HAS化疗的推荐指南, 有研究认为含顺铂的综合化疗是针对进展期的HAS的一线系统治疗方案, 诱导缓解率能达到75%. XELOX(奥沙利铂+卡培他滨)方案不仅是普通胃腺癌的化疗方案, 也可应用于HAS. 化疗联合曲妥珠单抗的治疗可应用于Her-2表达的患者, 目前有报道指出, VEGR-2受体抑制剂雷莫芦单抗也可应用于化疗失应答的HAS患者[6], 但由于缺乏前瞻性研究, 上述治疗方案的远期疗效仍待更多研究报道证实.
HAS总体预后较差, 有研究报道[8], 诊断时TNM分期、是否合并门脉癌栓和/或血管侵犯、外科手术是否完整切除及是否辅助化疗是影响预后的独立危险因素. 本例患者为HAS合并胃周及肝门部淋巴结转移, 行外科根治术治疗后接受XELOX方案化疗, 术后AFP维持在正常范围, 提示近期治疗效果良好, 远期预后仍待进一步观察.
胃肝样腺癌伴肠母细胞分化是一种极为罕见且具有高度侵袭性的胃癌亚型, 由于缺乏特异的临床表现及内镜下表现, 确诊同样依赖于组织病理学. 当前, 外科手术仍是完整清除原发病灶及清扫邻近淋巴结的主要方法, 胃大部切除术联合辅助化疗可以显著提高患者的生存率. 然而, 由于病例数量极少, 关于化疗方案的选择及疗效评估尚缺乏统一的标准. 鉴于其罕见性和复杂性, 需进一步积累病例并开展深入的系统性研究, 以阐明其发病机制、优化治疗方案, 并制定更为规范的诊疗指南, 从而提高患者的生存率和生活质量.
学科分类: 胃肠病学和肝病学
手稿来源地: 广东省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71:209-249. [PubMed] [DOI] |
| 2. | Zhang ZR, Wu J, Li HW, Wang T. Hepatoid adenocarcinoma of the stomach: Thirteen case reports and review of literature. World J Clin Cases. 2020;8:1164-1171. [PubMed] [DOI] |
| 3. | Zhao R, Li H, Ge W, Zhu X, Zhu L, Wan X, Wang G, Pan H, Lu J, Han W. Comprehensive Analysis of Genomic Alterations in Hepatoid Adenocarcinoma of the Stomach and Identification of Clinically Actionable Alterations. Cancers (Basel). 2022;14:3849. [PubMed] [DOI] |
| 4. | Søreide JA. Therapeutic Approaches to Gastric Hepatoid Adenocarcinoma: Current Perspectives. Ther Clin Risk Manag. 2019;15:1469-1477. [PubMed] [DOI] |
| 5. | Qu BG, Bi WM, Qu BT, Qu T, Han XH, Wang H, Liu YX, Jia YG. PRISMA-Compliant Article: Clinical Characteristics and Factors Influencing Prognosis of Patients With Hepatoid Adenocarcinoma of the Stomach in China. Medicine (Baltimore). 2016;95:e3399. [PubMed] [DOI] |
| 6. | Xia R, Zhou Y, Wang Y, Yuan J, Ma X. Hepatoid Adenocarcinoma of the Stomach: Current Perspectives and New Developments. Front Oncol. 2021;11:633916. [PubMed] [DOI] |
| 7. | Liu Z, Wang A, Pu Y, Li Z, Xue R, Zhang C, Xiang X, E JY, Bu Z, Bai F, Ji J. Genomic and transcriptomic profiling of hepatoid adenocarcinoma of the stomach. Oncogene. 2021;40:5705-5717. [PubMed] [DOI] |
| 8. | Zeng XY, Yin YP, Xiao H, Zhang P, He J, Liu WZ, Gao JB, Shuai XM, Wang GB, Wu XL, Tao KX. Clinicopathological Characteristics and Prognosis of Hepatoid Adenocarcinoma of the Stomach: Evaluation of a Pooled Case Series. Curr Med Sci. 2018;38:1054-1061. [PubMed] [DOI] |
| 10. | Li L, Yang X, Ji W, Zhu Q, Yang X, Niu J, Li W. Emphasis on the clinical relationship between alpha-fetoprotein and hepatoid adenocarcinoma of the stomach: a retrospective study. BMC Gastroenterol. 2023;23:142. [PubMed] [DOI] |
| 11. | Baek SK, Han SW, Oh DY, Im SA, Kim TY, Bang YJ. Clinicopathologic characteristics and treatment outcomes of hepatoid adenocarcinoma of the stomach, a rare but unique subtype of gastric cancer. BMC Gastroenterol. 2011;11:56. [PubMed] [DOI] |
| 12. | Su JS, Chen YT, Wang RC, Wu CY, Lee SW, Lee TY. Clinicopathological characteristics in the differential diagnosis of hepatoid adenocarcinoma: a literature review. World J Gastroenterol. 2013;19:321-327. [PubMed] [DOI] |
| 13. | Motoyama T, Aizawa K, Watanabe H, Fukase M, Saito K. alpha-Fetoprotein producing gastric carcinomas: a comparative study of three different subtypes. Acta Pathol Jpn. 1993;43:654-661. [PubMed] [DOI] |
| 15. | Murakami T, Yao T, Mitomi H, Morimoto T, Ueyama H, Matsumoto K, Saito T, Osada T, Nagahara A, Watanabe S. Clinicopathologic and immunohistochemical characteristics of gastric adenocarcinoma with enteroblastic differentiation: a study of 29 cases. Gastric Cancer. 2016;19:498-507. [PubMed] [DOI] |