修回日期: 2025-03-19
接受日期: 2025-03-25
在线出版日期: 2025-03-28
腹部手术后患者常出现胃肠道不良反应, 影响术后恢复. 膳食纤维在调节胃肠功能方面具有潜在作用, 但其在围术期的应用效果尚不明确. 因此, 系统评价膳食纤维对腹部手术患者术后胃肠道功能的影响具有重要意义.
本研究旨在评估围术期使用含膳食纤维的肠内营养对腹部手术患者术后胃肠道不良事件的效果.
检索PubMed、The Cochrane Library、Embase数据库, 时限为从2000-01/2023-05, 根据纳排标准筛选文献后提取数据, 用Cochrane偏倚风险评价工具进行文献质量评价, 使用RevMan5.4和Stata 12.0进行统计分析.
共纳入9项随机对照试验(randomized controlled trial, RCT), 涉及833例患者. 其中6项RCT用于膳食纤维补充对术后腹腔感染的Meta分析, 有5项RCT用于术后腹泻的Meta分析, 5项RCT用于术后首次排气时间的Meta分析, 结果显示膳食纤维补充能减少腹腔感染[危险度比(risk ratio, RR) = 0.46; 95%置信区间(confidence interval, CI): 0.26-0.80; P = 0.006], 腹泻(RR = 0.48; 95%CI: 0.32-0.71; P = 0.0003)的发生风险, 并且促进术后胃肠道功能恢复, 缩短排气排便时间(MD = -0.16; 95%CI: -0.24至-0.09; P<0.001). 而对于腹部手术患者而言, 膳食纤维补充没有减少术后肠梗阻, 吻合口瘘及恶心呕吐的发生风险(P>0.05).
腹部手术患者可使用富含膳食纤维的肠内营养, 降低术后腹腔感染及腹泻的发生风险, 促进胃肠道功能恢复, 并且不会增加恶心、呕吐等喂养不耐受的情况.
核心提要: 本研究通过Meta分析9项随机对照试验(833例患者)发现, 围手术期使用含膳食纤维的肠内营养可显著降低腹部手术患者术后腹腔感染和腹泻的发生风险, 并促进胃肠道功能恢复, 缩短术后排气时间. 此外, 富含膳食纤维的肠内营养不会增加术后恶心呕吐的发生. 研究支持在腹部手术患者中使用富含可溶性膳食纤维的肠内营养以改善术后恢复, 且不增加喂养不耐的风险.
引文著录: 王思思, 王婷文, 黄著瑛, 浦东, 胡婧文, 顿文亮. 腹部手术患者围术期进行膳食纤维补充对术后胃肠道不良反应的系统评价及Meta分析. 世界华人消化杂志 2025; 33(3): 235-244
Revised: March 19, 2025
Accepted: March 25, 2025
Published online: March 28, 2025
Patients undergoing abdominal surgery often experience gastrointestinal adverse reactions, which can hinder postoperative recovery. Dietary fiber has potential benefits in regulating gastrointestinal function, but its effectiveness during the perioperative period remains unclear. Therefore, a systematic evaluation of the impact of dietary fiber on postoperative gastrointestinal function in abdominal surgery patients is of significant importance.
To assess the effects of perioperative dietary fiber-enriched enteral nutrition on postoperative gastrointestinal adverse events in patients undergoing abdominal surgery.
Articles published between January 2000 and May 2023 were searched. The occurrence of postoperative gastrointestinal adverse reactions (abdominal infection, intestinal obstruction, diarrhea, nausea and vomiting, anastomotic leak, and time to first flatus) were used as outcomes for systematic review.
A total of 9 randomized controlled trials reporting 833 participants were included. Using meta-analysis, the results showed that perioperative dietary fiber supplement was associated with a lower abdominal infection incidence [risk ratio (RR) = 0.46; 95% confidence interval (CI): 0.26-0.80, P = 0.006] and lower diarrhea incidence (RR = 0.48; 95%CI: 0.32-0.71, P < 0.001), promoted postoperative gastrointestinal function recovery, and shortened the time to first flatus [mean difference (MD) = -0.16; 95%CI: -0.24 to -0.09, P < 0.001]. However, dietary fiber supplementation did not reduce the risk of postoperative intestinal obstruction, nausea and vomiting, or anastomotic leak (P > 0.05).
Dietary fiber-rich enteral nutrition can reduce the risk of postoperative abdominal infections and diarrhea, and promote recovery of gastrointestinal function in patients undergoing abdominal surgery, without increasing feeding intolerance such as nausea and vomiting.
- Citation: Wang SS, Wang TW, Huang ZY, Pu D, Hu JW, Dun WL. Impact of perioperative dietary fiber intake on gastrointestinal adverse events in adults undergoing abdominal surgery: A systematic review and meta-analysis. Shijie Huaren Xiaohua Zazhi 2025; 33(3): 235-244
- URL: https://www.wjgnet.com/1009-3079/full/v33/i3/235.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i3.235
膳食纤维(Dietary fiber)是指一类不能被人体小肠消化吸收, 而能部分或完全在大肠中发酵的可食用植物性成分、碳水化合物及其类似物质的总称, 其具有三个及以上的聚合度[1]. 膳食纤维与各种疾病的发展、管理以及死亡率有重要联系. 一项英国的流行病学调查[2]结果显示, 随着食物中膳食纤维补充量的增加, 心血管疾病、结直肠癌、糖尿病的发生风险降低. 此外, 摄入膳食纤维还有益于老年人认知功能改善[3]. 当食物中膳食纤维摄入量为(25-29) g/d时全因死亡率降低幅度最大[4]. 根据年龄和性别的不同, 成人推荐每日膳食纤维摄入量为(25-34) g[5].
膳食纤维具有能改变肠道环境、影响肠道微生物群、肠道屏障和调节胃肠道免疫等作用, 从而可以改善机体的排便及对营养素的吸收情况[6], 由于膳食纤维溶解度、粘度和发酵性的不同, 对胃肠道的影响也不同[7]. 根据溶解度将纤维分为两类: (1)可溶性纤维(例如例如菊粉、低聚果糖和小麦糊精)能在肠道内形成胶状物质, 减缓营养物质的消化和吸收, 从而延长饱腹感并降低食欲, 有助于减肥及控制血糖, 同时其对大便起到双向调节的作用, 能改善便秘与腹泻[8]; (2)不可溶性纤维(例如麦麸)通过刺激肠粘膜分泌水和粘液, 增加粪便的体积, 使大便易于排出[8].
腹部手术后消化系统会受到一定程度影响, 常见的并发症有: 腹腔感染、吻合口瘘、肠梗阻等[9]. 加速康复外科(enhanced recovery after surgery, ERAS)的理念及应用对上消化道手术节约医疗资源及促进患者康复做出突出贡献[10], 营养治疗特别是术后早期肠内营养(enteral nutrition, EN)是ERAS的关键组成部分. EN能够维持肠道粘膜的完整性、减少细菌从肠腔向血流的转移从而预防感染[11], EN虽然能够使患者获益, 但也可能导致腹胀、呕吐、反流等胃肠道问题, 影响患者的术后恢复和机体健康, 膳食纤维的应用理论上能减少术后胃肠道相关并发症的出现. 有学者进行了相关的研究, 结果显示, 膳食纤维补充能减少住院患者腹泻[12]及肾移植患者胃肠道症状发生率[13].
近年来, 围术期膳食纤维补充因其潜在益处备受关注, 但临床应用仍存在争议. 2023年中国成人肠内肠外营养指南[14]推荐一般患者可使用含膳食纤维的肠内营养, 有助于促进肠道蠕动及改善粪便性状, 但在严重胃肠动力障碍的患者中, 纤维发酵可能增加腹胀或肠梗阻风险. 也可能加重危重患者肠道缺血风险, 应谨慎应用. 目前, 对于腹部手术患者缺乏膳食纤维摄入标准的临床应用指南, 亟需重点关注适用人群筛选、补充时机及剂量标准化等问题. 本研究对随机对照试验进行了系统回顾和荟萃分析, 评估腹部手术患者围术期补充膳食纤维能否减少术后胃肠道不良事件的发生, 为临床实践应用提供循证医学证据.
纳入标准: (1)研究对象: 18-80岁行腹部手术的患者; (2)对照与干预措施: 干预组患者在围术期使用含膳食纤维的肠内营养或膳食纤维补充剂; 对照组不进行含膳食纤维的肠内营养补充; (3)观察指标: 术后胃肠道不良反应发生事件(腹腔感染, 肠梗阻, 腹泻, 恶心呕吐, 吻合口瘘)及术后首次排气时间; (4)研究类型: 随机对照试验(randomized controlled trial, RCT); (5)对于基于同一个临床试验的多个研究, 只纳入报道数据最详细的文献.
排除标准: (1)患者合并严重心肝肾器官功能不全; (2)无法获取全文或数据不全的会议摘要; (3)怀孕、哺乳、有生育能力但未有效避孕的患者.
1.2.1 文献检索: 本研究遵循《系统综述和荟萃分析优先报告的条目》指南, 研究方案已在PROSPERO网站注册(https://www.crd.york.ac.uk/PROSPERO/), 注册号为CRD42023432372. 使用计算机检索PubMed、Embase、The Cochrane Library这三个数据库, 对综述、纳入研究的参考文献及试验注册数据库(clinicaltrials.gov)同时进行了手工检索, 以补充获得相关资料, 检索时间均限制为2000-01/2023-05. 采用"PICOS"原则, 检索策略包含四个核心部分, 使用"AND"和"OR"运算符连接: (1)Abdominal Surgery; (2)Dietary Fiber; (3)Gastrointestinal adverse events; (4)Randomized controlled trials.
1.2.2 文献筛选和质量评价: 检索出的文献由两名研究人员按照纳排标准独立进行筛选, 不一致的文献由第三名研究者定夺. 首先根据文章标题及摘要, 剔除明显不相关及重复的文献. 之后阅读全文以确定是否符合纳入标准, 需记录剔除文献的具体原因, 最终决定予以纳入的文献. 本文纳入的试验均为RCT, 采用Cochrane偏倚风险评估工具, 对纳入的RCT进行文献质量评价(作者对每个纳入研究的每个偏倚风险项目的判断回顾), 做出"低风险"、"高风险"、"不清楚"的判断.
统计学处理 胃肠道不良反应发生情况使用比值比(risk ratio, RR)作为效应值, 住院时长采用均值差(mean difference, MD), 95%置信区间(confidence interval, CI), 检验水准α = 0.05, P<0.05时认为试验组与对照组差异具有统计学意义. 异质性检验使用I2检验, 若I2≤50%, 则研究合并后各试验间统计学异质性可接受, 选择固定效应模型(Fixed effect model)为分析模型. 若存在高度异质性(I2>50%), 则采用随机效应模型(Random effect model), 并进行异质性原因分析. 如有10个及以上研究数, 使用漏斗图检验发表偏倚; 若研究数较少(RCT<10), 采用Begg和Egger test检验发表偏倚, 若P<0.05说明存在发表偏倚, 采用剪补法(Trim and fill computation)评估发表偏倚对合并效应值的影响. 采用RevMan 5.4和Stata 12.0进行数据分析. 使用GRADEpro 3.6对Meta分析结果质量进行评价, 最终得出证据质量为高、中、低、极低的其中一级.
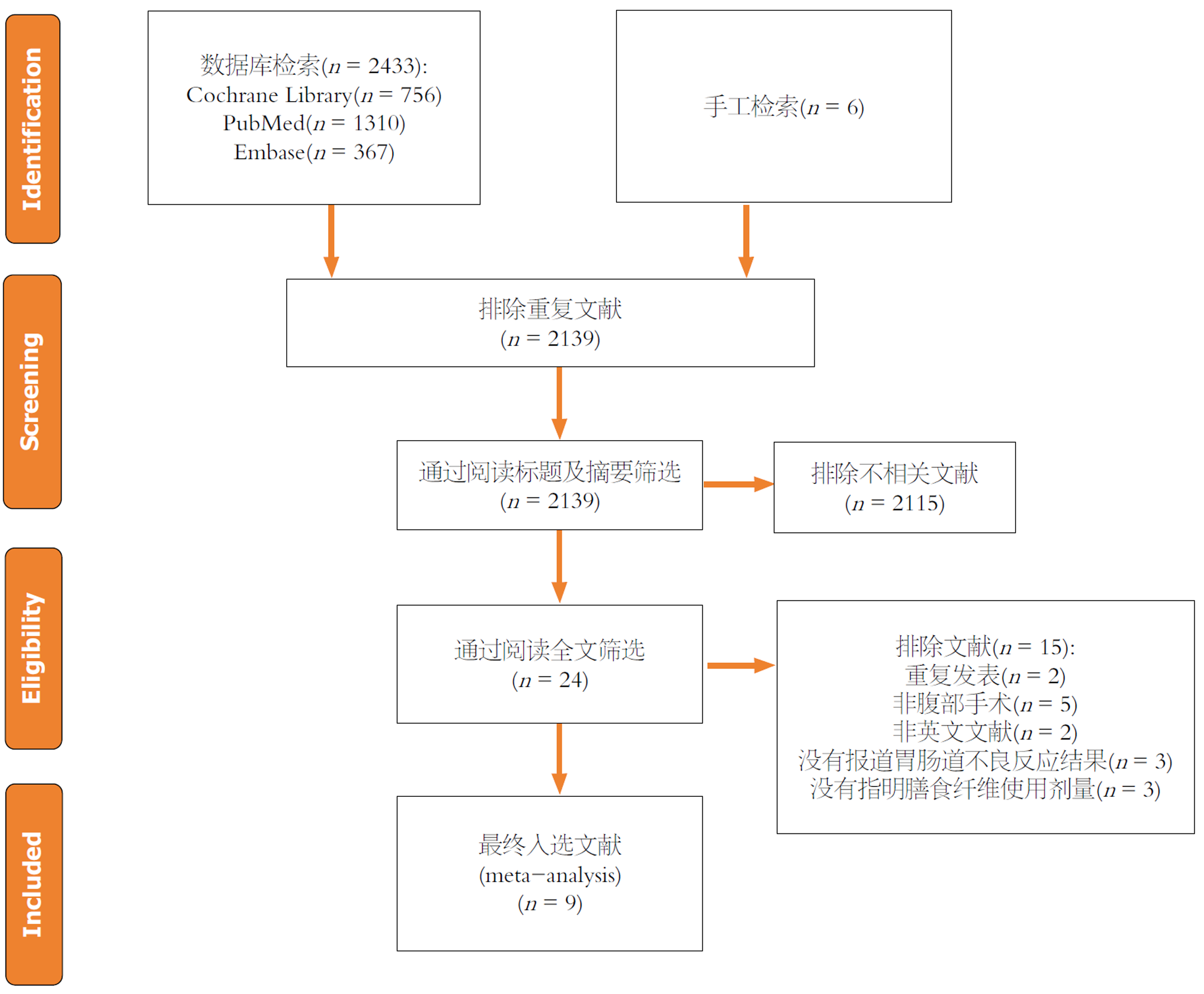
共检索出相关文献2439篇, 首先剔除重复文献共300篇, 之后通过阅读标题和摘要排除了2115篇. 进一步阅读原文后因胃肠道不良事件报告数据不全, 未进行腹部手术, 研究发表语言非英文, 文章为同一临床研究以及未明确膳食纤维补充剂量共剔除15篇, 最终纳入9篇进行系统评价及Meta分析, 文献筛选过程见图1.
纳入的9篇文献[15-23]均为英文文献, 发表时间为2002至2017年, 涉及6个国家. 选择腹部手术后常见并发症腹腔感染、肠梗阻、吻合口瘘、腹泻及恶心呕吐及术后首次排气时间作为结局观察指标. 共有833例患者纳入到荟萃分析中(干预组患者494例, 对照组患者339例), 其中6项RCT[15-18,20,21]干预措施使用的是半乳甘露聚糖(partially hydrolyzed guar gum, PHGG), 2项RCT[22,23]使用的是可溶性纤维(Shen jia), 1项RCT[19]使用的是燕麦纤维(包含可溶性和不可溶性纤维), 干预时间不少于4天, 膳食纤维补充剂量每天(7.5-27) g不等, 表1概述了所纳入的研究的设计及基本特征.
| 研究 | 国家 | 样本量(EG:CG) | 手术类型 | 干预措施 | |
| 疗程和剂量 | 纤维种类 | ||||
| Gianotti et al, 2002[17] | Italy | 305(203:102) | Gastroesophageal/Pancreatic/Colorectal resections | 术前10 g/d×5 d | PHGG(Oral Impact) |
| 术前10 g/d×5 d; 术后15 g/d | |||||
| Rayes et al, 2002[19] | German Sweden | 90(30:60) | Elective laparotomy and resection of the liver, stomach, colon or pancreas | 术后11.3 g/(L·d)×4 d | 燕麦纤维+乳酸菌; 燕麦纤维+热杀乳酸菌 |
| Homann et al, 2004[18] | German | 100(50:50) | Upper gastrointestinal surgery | 术前20 g/(L·d)×5-10 d | PHGG |
| Xu et al, 2006[21] | China | 60(30:30) | Radical gastrectomy/colectomy/proctocolectomy | 术前10 g/d×7 d | PHGG(Oral Impact) |
| Finco et al, 2007[15] | Italy | 28(14:14) | Laparoscopic colorectal surgery | 术前7.5 g/d×6 d; 术后7.5 g/d×3 d | PHGG(Oral Impact) |
| Xu et al, 2016[22] | China | 60(30:30) | Colon cancer with surgery | 术后25 g/d×7 d | 可溶性膳食纤维(Beijing yikang Biotechnology Corp) |
| Seguin et al, 2016[20] | France | 35(18:17) | Hepatectomy | 术前9 g/d×7 d; 术后9 g/d×3 d | PHGG(Oral Impact, Sachet of powder) |
| Gade et al, 2016[16] | Denmark | 35(19:16) | Pancreaticoduodenectomy, total/distal pancreatectomy, surgical palliation | 术前12 g/d×7 d | PHGG(Oral Impact, Sachet of powder) |
| Zhao et al, 2017[23] | China | 120(40:80) | Gastrectomy | 术后27 g/d×7 d | 溶性膳食纤维(Shen Jia, Beijing yikang Biotechnology Corp); 可溶性纤维+益生菌 |
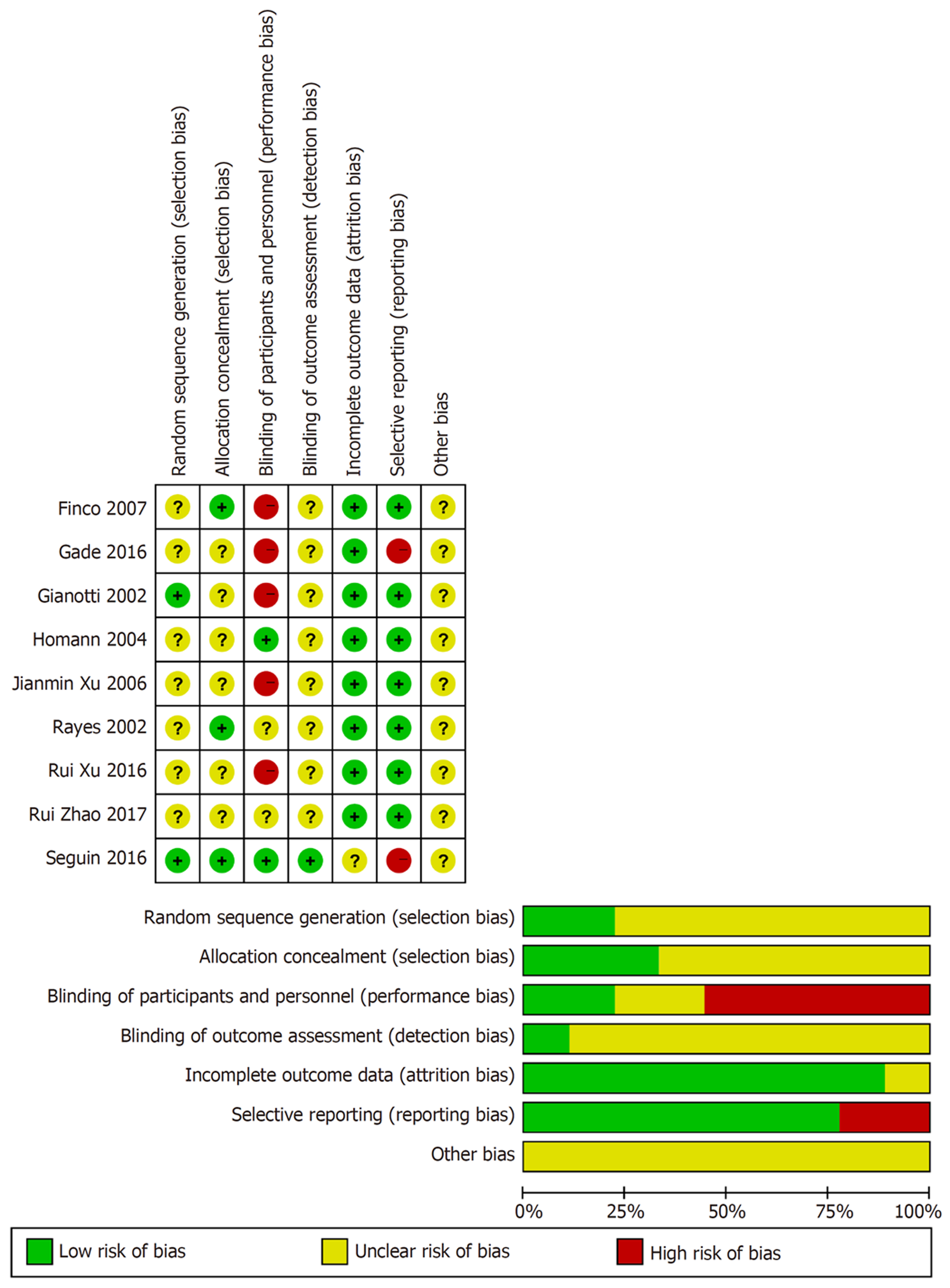
研究质量和偏倚风险的详细描述见图2. 纳入的研究均表示对样本使用了随机分配, 但仅两项研究描述了具体方法为计算机生成随机数方法, 因此评为低风险. 3项研究描述了分配隐藏的方法为采用密闭信封系统, 评为低风险. 有5项研究未对参与者及研究者设盲, 评为高风险. 有两项研究在临床试验登记网站中没有公开全部数据, 因此可能存在选择性报道, 评为高风险.
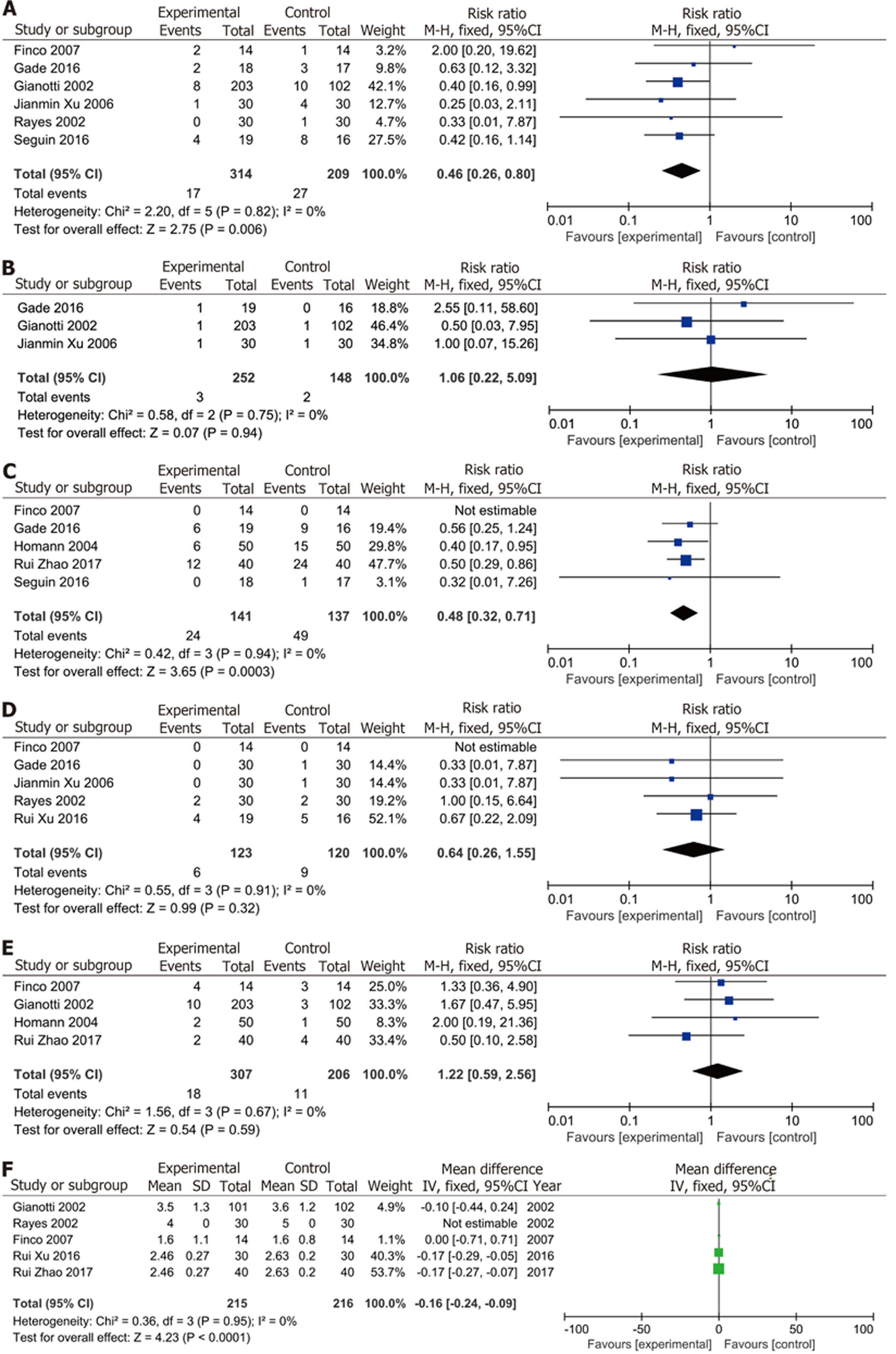
2.4.1 腹腔感染: Meta分析以术后腹腔内感染发生率为指标. 纳入6项随机对照试验[15-17,19-21], 涉及523例患者, 干预组共314例, 对照组209例患者. 有44人出现腹部脓肿, 其中干预组17例(5.4%), 对照组27例(12.9%), 结果显示, 腹部手术后补充膳食纤维的干预组术后腹腔内感染的风险显著降低(RR = 0.46; 95%CI: 0.26-0.80; P = 0.006, I2 = 0%), 如图3A所示.
2.4.2 肠道梗阻: 共有3项研究[16,17,21]报道了肠梗阻的结局指标, 共涉及400例患者, 干预组252人, 共3例(1.2%)出现肠梗阻; 对照组148人中有2人(1.4%)出现. Meta分析结果显示干预组与对照组术后出现肠梗阻的风险差异无统计学意义(RR = 1.06; 95%CI: 0.22-5.09; P = 0.94, I2 = 0%).
2.4.3 腹泻: 5项研究[15,16,18,20,22]报道了278例患者术后腹泻的数据, 干预组141例, 对照组137例. 膳食纤维补充组有24人(17.0%)出现腹泻, 对照组中有49人(35.8%)出现腹泻. 没有观察到研究间的异质性(I2 = 0%). Meta分析结果显示膳食纤维补充组术后出现腹泻的风险低于对照组(RR = 0.48; 95%CI: 0.32-0.71; P = 0.0003).
2.4.4 吻合口瘘: 共有5项RCT[15,16,19,21,22]报道了术后吻合口瘘的发生情况. 其中干预组123例患者中有6例出现(4.88%), 对照组120例患者中有9例(7.5%)发生吻合口瘘, 分析结果显示腹部手术后进行膳食纤维补充并没有降低吻合口瘘的发生风险(RR = 0.64; 95%CI: 0.26-1.55; P = 0.32, I2 = 0%), 如图3D所示.
2.4.5 恶心呕吐: 所有纳入研究的汇总分析结果如图3E所示, 4项RCT[15,17,18,23]共纳入513例参与者, 报告了术后恶心和呕吐的发生, 干预组患者307例, 对照组206例, 两组分别有18(5.86%), 11(5.34%)例患者出现恶心呕吐症状. 荟萃分析结果显示腹部手术后进行膳食纤维补充组与对照组出现恶心呕吐的风险没有统计学差异(RR = 1.22; 95%CI: 0.59-2.56; P = 0.59, I2 = 0%).
2.4.6 术后首次排气时间: 在术后首次排气时间的Meta分析中, 共纳入了RCT[15,16,19,21,22]研究, 干预组患者215例, 对照组患者216例. 部分文章对术后排气排便时间均有报道, 本研究仅分析了首次排气时间. 结果显示, 膳食纤维补充能缩短术后首次排气时间(MD = -0.16; 95%CI: -0.24至-0.09; P<0.001), 促进胃肠道功能恢复, 如图3F所示.
采用Begg或Egger检验对腹部感染、肠梗阻、腹泻、吻合口漏、恶心和呕吐进行Meta分析, 未发现发表偏倚(Egger检验, P>0.05). 但术后首次排气时间的Meta分析结果显示存在发表偏倚, 使用剪补法评价发现发表偏倚不影响最终效应值(P<0.0001), 结果如表2.
| Meta分析 | Begg | Egger |
| 腹部感染 | 0.707 | 0.545 |
| 吻合口瘘 | 0.497 | 0.399 |
| 肠道梗阻 | 1.0 | 0.358 |
| 腹泻 | 0.734 | 0.485 |
| 恶心、呕吐 | 0.734 | 0.909 |
| 术后首次排气时间 | - | 0.005 |
本研究采用逐一排除单个研究的敏感性分析方法, 结果显示对于各个Meta分析合并结果统计学意义均未发生改变, 结果稳定性较好.
对于胃肠道不良反应事件Meta分析的GRADE评价结果显示证据质量级别为中至低, 降级原因包括部分RCT研究方法没有设盲, 研究样本不够大及纳入的RCT研究结果不一致. 其中膳食纤维补充对腹部手术后吻合口瘘、肠梗阻发生风险及术后首次排气时间的Meta分析结果为低质量证据; 膳食纤维补充对腹部手术后腹腔感染、恶心呕吐及腹泻发生风险的Meta分析结果为中等质量证据.
本研究结果显示, 在腹部感染、腹泻、术后首次排气时间、肠梗阻、吻合口漏和恶心呕吐6个Meta分析的术后结局中, 胃肠道手术患者使用含有膳食纤维的肠内营养能有效减少术后并发症的发生, 且前3个结局的结果有统计学意义(P<0.05). 膳食纤维的摄入没有提高患者恶心呕吐的发生风险, 耐受性较好(RR = 1.22; 95%CI: 0.59-2.56; P = 0.59, I2 = 0%; 中等质量). 在腹腔感染的Meta分析中(中等质量), 纳入的6项RCT中有5项[15-17,20,21]口服营养补充中除了PHGG还含有免疫营养素(精氨酸、核苷酸、ω-3脂肪酸), 因此不能排除患者腹腔感染发生风险下降与以上成分相关. 在Jakobsen等[24]的研究中发现, 管饲富含膳食纤维、鱼油和类胡萝卜素的肠内营养能降低腹泻发生风险, 提高住院患者胃肠道耐受性, 这与本研究结论一致(RR = 0.48; 95%CI: 0.32-0.71; P = 0.0003; 中等质量). 分析结果显示, 膳食纤维补充能缩短术后首次排气时间(MD = -0.16; 95%CI: -0.24至-0.09; P<0.001; 低质量), 有研究表明[25]在部分疾病状态下, 补充可溶性膳食纤维能减少肠内容物的转运时间并促粪便排出, 对胃肠道功能产生调节作用. 但Meta分析显示膳食纤维补充未能减少术后肠梗阻、恶心呕吐及吻合口瘘的发生风险, 这可能与纳入研究的样本量不足导致的Ⅱ类错误, 患者的肠道功能状态及术后早期活动等其他因素的干扰相关, 如部分研究显示[26]术后早期补充高剂量不可溶性纤维(如麦麸)会加重肠道负担, 反而诱发腹胀或机械性梗阻, 故临床应用时需联合外科及康复科室进行多模态干预制定个体化方案, 不应仅依赖膳食纤维补充来预防这些并发症.
目前临床上常用的富含膳食纤维的肠内营养制剂包括肠内营养乳剂: 瑞能(TPF-T)和瑞先(TPF); 肠内营养混悬液: 能全力(TPF)和佳维体(TPF-FOS)等, 一般使用PHGG、低聚果糖、菊粉、大豆纤维或燕麦纤维等作为膳食纤维来源[27]. 本研究纳入的文献中使用的纤维是可溶性纤维(PHGG、Shenjia)和混合纤维(Oat fiber). PHGG因安全及性质稳定, 被广泛用于食品、酸奶及肠内营养等, 作为膳食纤维的来源[28]. PHGG有利于肠道有益菌的增殖, 能促进丁酸梭菌增殖从而产生丁酸等短链脂肪酸, 增加对人体有益的丁酸产量, 从而缓解肠道屏障受损及炎症[29,30], 并且还具有增强矿物质吸收的作用[31]; 而燕麦纤维由可溶性和不溶性β-葡聚糖构成, 对免疫调节及抗氧化等方面具有重要作用[32]. 在小鼠实验中观察到食用燕麦能减少结肠癌细胞增殖[33], 并且能调节肠道菌群, 抑制有害微生物生长[34].
膳食纤维在术后恢复过程中的作用涉及多种机制, 有研究表明, 其主要与调节肠道菌群和增强肠道屏障功能密切相关: (1)调节肠道菌群: 膳食纤维经菌群发酵生成短链脂肪酸(SCFAs, 如丁酸), 通过激活GPR43受体抑制NF-κB通路, 降低炎症因子的水平, 同时促进调节性T细胞分化, 改善术后免疫失衡[35]; (2)强化肠道屏障: SCFAs刺激杯状细胞分泌黏蛋白MUC2, 增厚黏液层, 并通过上调闭锁蛋白表达修复紧密连接, 减少内毒素移位的风险, 综合增强肠道屏障功能[36]. 综上, 膳食纤维有望通过"菌群-屏障-免疫"轴的多靶点调控机制, 成为影响患者术后康复的关键营养干预因子.
So等[37]的研究显示, 与低纤维对照组相比, 膳食纤维补充能使健康成人粪便中双歧杆菌的丰度更高, 在一项RCT[38]中也观察到类似结论, 双歧杆菌是维持人体稳态的重要益生菌, 但补充剂量的差异对双歧杆菌丰度没有影响. Homann等[39]的研究发现全肠内营养支持患者补充20 g/d PHGG能减少腹泻发生率, 但腹胀情况加重, 因此对于胃肠道症状严重的患者应避免高纤维的摄入(有胃肠道症状的患者纤维负荷较高), 该结果提示此类患者低剂量(<5 g/d)补充也许是有利的. 一项纳入了3项RCT的系统评价[40]结果显示, 富含纤维的肠内营养可用于胃肠道手术患者, 未发现安全风险及对术后感染的影响, 而本研究中发现膳食纤维的补充能减少术后腹腔感染的发生, 对临床腹部术后感染控制预防有一定作用.
本研究局限: 由于纳入的研究数较少, 且部分RCT研究样本量小, 且纳入的研究采用了不同的治疗时间(4 d-10 d), 一致性较低, 因此未进行补充膳食纤维的时机(如术前、术后或全围术期)、使用周期、种类及剂量对患者术后胃肠道不良事件影响的分层分析. 且由于纳入的部分研究证据质量较低, 导致术后首次排气时间的Meta分析存在发表偏倚, 虽使用剪补法后得知此对最终结果无影响, 但未来需通过前瞻性大样本研究(如多中心RCT)优化证据等级, 结合肠道菌群基因组学与代谢组学动态监测, 进一步解析患者对膳食纤维应答差异的分子基础, 为制定精准的营养干预策略提供依据, 改善腹部手术患者短期预后的同时, 更通过优化肠道微生态环境为长期康复奠定基础.
对于接受腹部手术的患者, 围手术期补充膳食纤维配合口服或肠内营养具有多重临床效益. 研究表明, 这种干预措施不仅能有效降低术后腹部感染和腹泻的发生风险, 还能促进胃肠道功能恢复, 从而改善患者预后并提高其生存质量. 这些发现为制定标准化的围术期膳食纤维补充方案(包括纤维类型、来源、剂量和治疗持续时间)提供了重要的循证医学依据. 然而, 尽管现有的动物实验和临床试验已证实补充膳食纤维在减少胃肠道不良事件方面具有潜在优势, 但由于研究中存在较多混杂因素, 仍需开展大规模、高质量的多中心研究来进一步验证其有效性和安全性, 并为临床实践提供更可靠的指导.
围术期补充膳食纤维的潜在临床价值引起广泛关注, 但在腹部手术患者中的应用尚未形成统一的临床实践指南. 其应用时机、适宜人群及剂量优化等关键问题仍存争议, 亟需研究深入探讨, 以建立基于循证医学的精准营养支持方案.
旨在评估围术期使用含膳食纤维的肠内营养制剂对行腹部手术患者的术后胃肠道不良事件的效果.
对随机对照试验进行了系统回顾和荟萃分析, 评估腹部手术患者围术期补充膳食纤维能否减少术后胃肠道不良事件的发生, 为制定基于肠道功能分级的个体化营养干预策略提供循证依据.
本研究基于PRISMA指南, 筛选文献后提取数据, 用Cochrane偏倚风险评价工具进行文献质量评价, 对围手术期膳食纤维干预在腹部手术患者中的随机对照试验(randomized controlled trial, RCT)进行系统评价与Meta分析, 通过GRADE系统评估证据质量, 使用RevMan5.4和Stata12.0软件进行统计分析, 量化膳食纤维对术后肠梗阻、恶心呕吐等术后不良胃肠道终点事件的效应量.
本研究通过Meta分析9项RCT发现, 围术期补充含膳食纤维的肠内营养可显著降低腹部手术患者术后腹腔感染和腹泻的发生风险, 并且促进胃肠道功能恢复, 缩短术后首次排气时间, 且不增加术后恶心呕吐及喂养不耐的发生风险.
腹部手术患者补充富含可溶性膳食纤维的肠内营养可以改善术后恢复, 降低部分术后不良事件的发生率.
在本研究的基础上, 开展前瞻性大样本研究优化证据等级, 结合肠道菌群基因组学与代谢组学动态监测, 进一步解析不同患者对膳食纤维应答差异的分子基础, 为制定精准的营养干预策略提供依据, 有助于完善循证医学证据, 不仅改善腹部手术患者的短期预后, 且为长期康复奠定基础.
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | FDA. Questions and Answers on Dietary Fiber. [Cited 2021 December 17] Available from: https://www.fda.gov/food/. |
| 2. | Scientific Advisory Committee on Nutrition. Carbohydrates and Health. 2015. Available from: https://www.gov.uk/government/publications/sacn-carbohydrates-and-health-report. |
| 3. | Prokopidis K, Giannos P, Ispoglou T, Witard OC, Isanejad M. Dietary Fiber Intake is Associated with Cognitive Function in Older Adults: Data from the National Health and Nutrition Examination Survey. Am J Med. 2022;135:e257-e262. [PubMed] [DOI] |
| 4. | Reynolds A, Mann J, Cummings J, Winter N, Mete E, Te Morenga L. Carbohydrate quality and human health: a series of systematic reviews and meta-analyses. Lancet. 2019;393:434-445. [PubMed] [DOI] |
| 6. | Ioniță-Mîndrican CB, Ziani K, Mititelu M, Oprea E, Neacșu SM, Moroșan E, Dumitrescu DE, Roșca AC, Drăgănescu D, Negrei C. Therapeutic Benefits and Dietary Restrictions of Fiber Intake: A State of the Art Review. Nutrients. 2022;14:2641. [PubMed] [DOI] |
| 7. | Gill SK, Rossi M, Bajka B, Whelan K. Dietary fibre in gastrointestinal health and disease. Nat Rev Gastroenterol Hepatol. 2021;18:101-116. [PubMed] [DOI] |
| 8. | McRorie JW, McKeown NM. Understanding the Physics of Functional Fibers in the Gastrointestinal Tract: An Evidence-Based Approach to Resolving Enduring Misconceptions about Insoluble and Soluble Fiber. J Acad Nutr Diet. 2017;117:251-264. [PubMed] [DOI] |
| 9. | Bozzetti F, Gianotti L, Braga M, Di Carlo V, Mariani L. Postoperative complications in gastrointestinal cancer patients: the joint role of the nutritional status and the nutritional support. Clin Nutr. 2007;26:698-709. [PubMed] [DOI] |
| 10. | Bond-Smith G, Belgaumkar AP, Davidson BR, Gurusamy KS. Enhanced recovery protocols for major upper gastrointestinal, liver and pancreatic surgery. Cochrane Database Syst Rev. 2016;2:CD011382. [PubMed] [DOI] |
| 11. | Krezalek MA, Yeh A, Alverdy JC, Morowitz M. Influence of nutrition therapy on the intestinal microbiome. Curr Opin Clin Nutr Metab Care. 2017;20:131-137. [PubMed] [DOI] |
| 12. | Kaewdech A, Sripongpun P, Wetwittayakhlang P, Churuangsuk C. The effect of fiber supplementation on the prevention of diarrhea in hospitalized patients receiving enteral nutrition: A meta-analysis of randomized controlled trials with the GRADE assessment. Front Nutr. 2022;9:1008464. [PubMed] [DOI] |
| 13. | Chan S, Hawley CM, Pascoe EM, Cao C, Campbell SB, Campbell KL, Francis RS, Hale R, Isbel NM, Morrison M, Johnson DW. Prebiotic Supplementation in Kidney Transplant Recipients for Preventing Infections and Gastrointestinal Upset: A Randomized Controlled Feasibility Study. J Ren Nutr. 2022;32:718-725. [PubMed] [DOI] |
| 14. | Chinese Society of Parenteral and Enteral Nutrition (CSPEN). [Guideline for clinical application of parenteral and enteral nutrition in adults patients in China (2023 edition)]. Zhonghua Yi Xue Za Zhi. 2023;103:946-974. [PubMed] [DOI] |
| 15. | Finco C, Magnanini P, Sarzo G, Vecchiato M, Luongo B, Savastano S, Bortoliero M, Barison P, Merigliano S. Prospective randomized study on perioperative enteral immunonutrition in laparoscopic colorectal surgery. Surg Endosc. 2007;21:1175-1179. [PubMed] [DOI] |
| 16. | Gade J, Levring T, Hillingsø J, Hansen CP, Andersen JR. The Effect of Preoperative Oral Immunonutrition on Complications and Length of Hospital Stay After Elective Surgery for Pancreatic Cancer--A Randomized Controlled Trial. Nutr Cancer. 2016;68:225-233. [PubMed] [DOI] |
| 17. | Gianotti L, Braga M, Nespoli L, Radaelli G, Beneduce A, Di Carlo V. A randomized controlled trial of preoperative oral supplementation with a specialized diet in patients with gastrointestinal cancer. Gastroenterology. 2002;122:1763-1770. [PubMed] [DOI] |
| 18. | Homann HH, Senkal M, Kemen M, Lehnhardt M. The beneficial effects of PHGG in enteral nutrition in medical and surgical patients. Clinical Nutrition. 2004;1:59-62. [DOI] |
| 19. | Rayes N, Hansen S, Seehofer D, Müller AR, Serke S, Bengmark S, Neuhaus P. Early enteral supply of fiber and Lactobacilli versus conventional nutrition: a controlled trial in patients with major abdominal surgery. Nutrition. 2002;18:609-615. [PubMed] [DOI] |
| 20. | Seguin P, Locher C, Boudjema K, Hamon C, Mouchel C, Malledant Y, Bellissant E. Effect of a Perioperative Nutritional Supplementation with Oral Impact® in Patients undergoing Hepatic Surgery for Liver Cancer: A Prospective, Placebo-Controlled, Randomized, Double-Blind Study. Nutr Cancer. 2016;68:464-472. [PubMed] [DOI] |
| 21. | Xu J, Zhong Y, Jing D, Wu Z. Preoperative enteral immunonutrition improves postoperative outcome in patients with gastrointestinal cancer. World J Surg. 2006;30:1284-1289. [PubMed] [DOI] |
| 22. | Xu R, Ding Z, Zhao P, Tang L, Tang X, Xiao S. The Effects of Early Post-Operative Soluble Dietary Fiber Enteral Nutrition for Colon Cancer. Nutrients. 2016;8:584. [PubMed] [DOI] |
| 23. | Zhao R, Wang Y, Huang Y, Cui Y, Xia L, Rao Z, Zhou Y, Wu X. Effects of fiber and probiotics on diarrhea associated with enteral nutrition in gastric cancer patients: A prospective randomized and controlled trial. Medicine (Baltimore). 2017;96:e8418. [PubMed] [DOI] |
| 24. | Jakobsen LH, Wirth R, Smoliner C, Klebach M, Hofman Z, Kondrup J. Gastrointestinal tolerance and plasma status of carotenoids, EPA and DHA with a fiber-enriched tube feed in hospitalized patients initiated on tube nutrition: Randomized controlled trial. Clin Nutr. 2017;36:380-388. [PubMed] [DOI] |
| 25. | Ge X, Tian H, Ding C, Gu L, Wei Y, Gong J, Zhu W, Li N, Li J. Fecal Microbiota Transplantation in Combination with Soluble Dietary Fiber for Treatment of Slow Transit Constipation: A Pilot Study. Arch Med Res. 2016;47:236-242. [PubMed] [DOI] |
| 26. | Grabitske HA, Slavin JL. Gastrointestinal effects of low-digestible carbohydrates. Crit Rev Food Sci Nutr. 2009;49:327-360. [PubMed] [DOI] |
| 27. | Klosterbuer A, Roughead ZF, Slavin J. Benefits of dietary fiber in clinical nutrition. Nutr Clin Pract. 2011;26:625-635. [PubMed] [DOI] |
| 28. | Slavin JL, Greenberg NA. Partially hydrolyzed guar gum: clinical nutrition uses. Nutrition. 2003;19:549-552. [PubMed] [DOI] |
| 29. | Hung TV, Suzuki T. Dietary Fermentable Fiber Reduces Intestinal Barrier Defects and Inflammation in Colitic Mice. J Nutr. 2016;146:1970-1979. [PubMed] [DOI] |
| 30. | Kono G, Yoshida K, Kokubo E, Ikeda M, Matsubara T, Koyama T, Iwamoto H, Miyaji K. Fermentation Supernatant of Elderly Feces with Inulin and Partially Hydrolyzed Guar Gum Maintains the Barrier of Inflammation-Induced Caco-2/HT29-MTX-E12 Co-Cultured Cells. J Agric Food Chem. 2023;71:1510-1517. [PubMed] [DOI] |
| 31. | de Cássia Freitas K, Amancio OM, Ferreira Novo N, Fagundes-Neto U, de Morais MB. Partially hydrolyzed guar gum increases intestinal absorption of iron in growing rats with iron deficiency anemia. Clin Nutr. 2006;25:851-858. [PubMed] [DOI] |
| 32. | Paudel D, Dhungana B, Caffe M, Krishnan P. A Review of Health-Beneficial Properties of Oats. Foods. 2021;10:2591. [PubMed] [DOI] |
| 33. | Shen R-L, Wang Z, Dong JL, Xiang QS, Liu YQ. Effects of oat soluble and insoluble β-glucan on 1,2-dimethylhydrazine-induced early colon carcinogenesis in mice. Food and Agricultural Immunology. 2016;27:657-666. [DOI] |
| 34. | Shen RL, Dang XY, Dong JL, Hu XZ. Effects of oat β-glucan and barley β-glucan on fecal characteristics, intestinal microflora, and intestinal bacterial metabolites in rats. J Agric Food Chem. 2012;60:11301-11308. [PubMed] [DOI] |
| 35. | Koh A, De Vadder F, Kovatcheva-Datchary P, Bäckhed F. From Dietary Fiber to Host Physiology: Short-Chain Fatty Acids as Key Bacterial Metabolites. Cell. 2016;165:1332-1345. [PubMed] [DOI] |
| 36. | Liu P, Wang Y, Yang G, Zhang Q, Meng L, Xin Y, Jiang X. The role of short-chain fatty acids in intestinal barrier function, inflammation, oxidative stress, and colonic carcinogenesis. Pharmacol Res. 2021;165:105420. [PubMed] [DOI] |
| 37. | So D, Whelan K, Rossi M, Morrison M, Holtmann G, Kelly JT, Shanahan ER, Staudacher HM, Campbell KL. Dietary fiber intervention on gut microbiota composition in healthy adults: a systematic review and meta-analysis. Am J Clin Nutr. 2018;107:965-983. [PubMed] [DOI] |
| 38. | Yasukawa Z, Inoue R, Ozeki M, Okubo T, Takagi T, Honda A, Naito Y. Effect of Repeated Consumption of Partially Hydrolyzed Guar Gum on Fecal Characteristics and Gut Microbiota: A Randomized, Double-Blind, Placebo-Controlled, and Parallel-Group Clinical Trial. Nutrients. 2019;11:2170. [PubMed] [DOI] |
| 39. | Homann HH, Kemen M, Fuessenich C, Senkal M, Zumtobel V. Reduction in diarrhea incidence by soluble fiber in patients receiving total or supplemental enteral nutrition. JPEN J Parenter Enteral Nutr. 1994;18:486-490. [PubMed] [DOI] |
| 40. | Eleftheriadis K, Davies R. Do patients fed enterally post-gastrointestinal surgery experience more complications when fed a fiber-enriched feed compared with a standard feed? A systematic review. Nutr Clin Pract. 2022;37:797-810. [PubMed] [DOI] |