修回日期: 2025-01-24
接受日期: 2025-02-20
在线出版日期: 2025-02-28
结直肠癌患者化疗后易出现不良反应, 但缺乏早期预测模型, 基于营养状况与消化系统恶性肿瘤化疗、放化疗不良反应具有一定相关性, 推测其可作为预后模型相关因素.
探究结直肠癌患者化疗后不良反应发生影响因素, 并构建含营养指标的预测模型.
选取2017-07/2021-03浙江求是心血管病医院接受化疗的结直肠癌患者210例作为模型建模集, 统计患者化疗后不良反应发生率, 采用Lasso初筛结直肠癌患者化疗后不良反应的特征变量, Logistic分析结直肠癌患者化疗后不良反应因素; 构建列线图模型, 并采用校准曲线、受试者工作特征(receiver operating characteristic, ROC)曲线评价该模型准确度及区分度. 另选取2021-04/2024-03接受化疗的结直肠癌患者90例作为模型验证集, 对构建的列线图模型进行验证.
化疗1个疗程结束后, 建模集210例结直肠癌患者中, 85例(40.48%)发生不良反应(≥Ⅲ级)纳入发生组, 125例(59.52%)未发生不良反应纳入未发生组; Lasso回归分析显示, 当惩罚系数λ = 0.072时模型性能优良且影响因素最少, 最终筛选出6个预测变量为年龄、乳酸脱氢酶、ECOG评分及营养指标白蛋白、总淋巴细胞计数、血红蛋白; Logistic分析显示, 年龄、美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分、乳酸脱氢酶及营养指标白蛋白、血红蛋白、总淋巴细胞计数均为结直肠癌患者化疗后不良反应影响因素(P<0.05); 根据影响因素(年龄、乳酸脱氢酶、ECOG评分及营养指标白蛋白、总淋巴细胞计数、血红蛋白)建立列线图预测模型, 该列线图模型在建模集中的ROC曲线的曲线下面积为0.811(95%CI: 0.754-0.869), 预测结直肠癌患者化疗不良反应发生相关因素的一致性指数为0.839(95%CI: 0.778-0.902), 与实际观察结果相关性较高, 提示该模型具有良好区分度及准确度; 使用验证集患者数据对构成化疗不良反应的列线图模型进行验证, 与实际结果进行比较分析, 该模型预测敏感度为94.44%(34/36), 特异度为92.59%(50/54), 总预测准确率为93.33%(84/90).
年龄、ECOG评分、乳酸脱氢酶及营养指标白蛋白、总淋巴细胞计数、血红蛋白均为结直肠癌患者化疗不良反应发生的影响因素, 基于此构建含营养指标的列线图预测模型可较为准确地预测患者化疗不良反应发生风险, 为临床防治工作提供参考依据.
核心提要: 本研究首次探讨营养指标与结直肠癌患者化疗不良反应发生的相关性, 并构建含营养指标的列线图预测模型, 为临床完善此类患者化疗不良反应发生风险评估提供参考.
引文著录: 陈作伟, 陈彬, 王韩英. 含营养指标的结直肠癌患者化疗后不良反应预测模型构建及验证. 世界华人消化杂志 2025; 33(2): 148-157
Revised: January 24, 2025
Accepted: February 20, 2025
Published online: February 28, 2025
Patients with colorectal cancer are prone to adverse reactions after chemotherapy, but there is a lack of models for early prediction of these adverse reactions. Based on the correlation between nutritional status and chemotherapy and radiochemotherapy adverse reactions in malignant tumors of the digestive system, it is speculated that nutritional status can be used as a factor involved in prognostic models.
To explore the influencing factors of adverse reactions in patients with colorectal cancer after chemotherapy, and establish a prediction model containing nutritional indexes.
A total of 210 patients with colorectal cancer who received chemotherapy in Zhejiang Qiushi Cardiovascular Hospital from July 2017 to March 2021 were selected as a model training set to analyze the incidence of adverse reactions after chemotherapy. The characteristic variables of adverse reactions after chemotherapy in colorectal cancer patients were initially screened by Lasso regression. Logistic regression analysis was performed to identify factors related to the development of adverse reaction in patients with colorectal cancer after chemotherapy. Based on the factors identified, a prediction model was developed. The calibration curve and receiver operating characteristic (ROC) curve were used to evaluate the accuracy and differentiation of the model. In addition, 90 patients with colorectal cancer who received chemotherapy in Zhejiang Qiushi Cardiovascular Hospital from April 2021 to March 2024 were selected as a model validation set to verify the constructed nomogram model.
After one cycle of chemotherapy, of 210 patients with colorectal cancer in the modeling set, 85 (40.48%) patients with colorectal cancer in the model training group had adverse reactions (≥ Grade Ⅲ) and 125 (59.52%) had no adverse reactions and were included in the no-occurrence group. Lasso regression analysis showed that when the penalty coefficient λ = 0.072, the model had good performance and the least influencing factors. Six predictive variables were finally selected, which were age, lactate dehydrogenase, Eastern Cooperative Oncology Group (ECOG) score and the nutrition indexes albumin, total lymphocyte count, and hemoglobin. Logistic analysis showed that age, ECOG score, lactate dehydrogenase, and the nutritional indexes albumin, hemoglobin, and total lymphocyte count were all influencing factors of adverse reactions after chemotherapy in colorectal cancer patients (P < 0.05). Based on these six influencing factors, a nomogram prediction model was established. The area under the ROC curve of the model for predicting chemotherapy adverse reactions in the training set was 0.811 [95% confidence interval (CI): 0.754-0.869], and the consistency index of factors related to predicting the occurrence of chemotherapy adverse reactions in colorectal cancer patients was 0.839 (95%CI: 0.778-0.902), which was highly correlated with the actual observation results, suggesting that the model had good differentiation and accuracy. The validation set patient data was used to verify the nomogram model, and the results were compared with the actual results. The prediction sensitivity of the model was 94.44% (34/36), the specificity was 92.59% (50/54), and the total prediction accuracy was 93.33% (84/90).
Age, ECOG score, lactate dehydrogenase, and the nutri-tional indexes albumin, total lymphocyte count, and hemoglobin are all factors affecting the occurrence of chemotherapy adverse reactions in patients with colorectal cancer. The prediction model developed based on these indexes can accurately predict the risk of chemotherapy adverse reactions in patients, and provide a reference for clinical prevention and treatment.
- Citation: Chen ZW, Chen B, Wang HY. Construction and verification of a nutritional index-containing adverse reaction prediction model in colorectal cancer patients after chemotherapy. Shijie Huaren Xiaohua Zazhi 2025; 33(2): 148-157
- URL: https://www.wjgnet.com/1009-3079/full/v33/i2/148.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i2.148
结直肠癌为消化系统肿瘤常见类型, 据调查, 2020年全球新发结直肠癌约190万例, 约占全部恶性肿瘤发病病例的10%[1,2]. 结直肠癌早期诊断率较低, 约1/3患者就诊时出现转移, 手术切除患者也有1/2将因转移或复发进展为晚期癌, 此类患者主要治疗策略之一为化疗[3,4], 虽改善了患者生存结局, 但化疗药物可能引起消化道反应、神经毒性、骨髓抑制等多种不良反应[5,6]. 结直肠癌患者长期暴露于化疗所致的不良反应中, 持续评估及管理尤为关键. 有文献指出, 约50%结直肠癌患者处于营养风险状况[7]. 结直肠是与营养物质吸收、代谢密切相关的中枢器官, 肿瘤演变及治疗均可结直肠功能造成直接影响, 故营养不良风险较高, 并可能在化疗期间持续恶化, 降低患者化疗耐受性而影响预后[8]. 尽管已有研究证实, 营养状况与胃癌化疗、食管癌同步放化疗不良反应具有一定相关性[9,10], 但关于结直肠癌的研究较少. 基于此, 本研究通过分析结直肠癌化疗患者临床资料及营养指标差异, 并以此构建预测模型, 旨在为结直肠癌化疗提供参考依据.
本研究经浙江求是心血管病医院医学伦理委员会审核批准(批件文号: 326TN669), 选取2017-07/2021-03接受化疗的结直肠癌患者210例作为模型建模集, 其中男108例, 女102例, 年龄18-80(62.44±8.12)岁, 体质量指数18-26(21.45±10.27) kg/m2; 另选取2021-04/2024-03接受化疗的结直肠癌患者90例作为模型验证集, 男47例, 女43例, 年龄18-80(63.10±7.94)岁, BMI: 18-27(21.82±10.27) kg/m2.
纳入标准: (1)均符合结直肠癌诊断标准[11], 并经病理学检查证实均为腺癌; (2)肿瘤分期为Ⅲ期, 均首次接受化疗; (3)年龄≥18岁; (4)自愿签署研究同意书, 且可获取完整病历资料. 排除标准: (1)化疗前接受放疗、手术或靶向治疗者; (2)未进行化疗不良反应评估者; (3)伴有重要脏器严重疾病, 影响化疗者; (4)对化疗药物及其辅料过敏者; (5)预计生存期不足3个月者; (6)DNA测序显示Kras、NRras、BRAF、PIK3C及错配修复基因等突变者; (7)妊娠期、哺乳期女性.
1.2.1 化疗方案: 建模集、验证集患者均采用静脉化疗, 化疗方案包括: (1)FOLFOX方案: 奥沙利铂135 mg/m2, 静脉滴注, 第1天; 氟尿嘧啶400 mg/m2, 静脉滴注第1-2天; 亚叶酸钙200 mg/m2, 静脉滴注第1-2天; (2)XELOX方案: 奥沙利铂130 mg/m2, 静脉滴注, 第1天; 卡培他滨1000 mg/m2, 口服, 2次/d, 第1-14天. 21天为1个疗程.
1.2.2 基本资料收集: 通过病历资料查询等方式收集患者基本资料, 包括性别、肿瘤分期、BMI、肿瘤直径、组织学分级、舒张压、化疗方案、美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分、吸烟史、主观整体营养状况评估量表(Patient-Generated Subjective Global Assessment, PG-SGA)评分、收缩压、年龄.
1.2.3 实验室指标检查: 化疗前, 收集空腹状态下5 mL肘静脉血, 采用LH750型血细胞分析仪测定白蛋白、淋巴细胞、血红蛋白等, 日立7600型生化分析仪测定总胆固醇、空腹血糖、总胆红素、血肌酐水平.
1.2.4 不良反应评价: 化疗1个疗程后, 根据CTCAE5.0确定结直肠癌化疗患者是否发生化疗不良反应, 包括消化道症状(恶心、腹泻、呕吐等)、血液系统反应(血小板、血红蛋白及白细胞降低), 上述不良反应分为0-Ⅳ级, 其中Ⅲ-Ⅳ级属于重度不良反应, 本研究统计结直肠癌化疗患者Ⅲ-Ⅳ级不良反应, 纳入发生组, 其余纳入未发生组.
1.2.5 质量控制: 入选病例严格执行纳入及排除标准, 并由经过统一、专业培训的工作人员进行数据收集, Epidata软件平行双录数据, 确保准确无误.
统计学处理 SPSS 26.0分析, 计量资料(符合正态分布)用(mean±SD)表示, t检验; 计数资料用n(%)表示, χ2检验; 等级资料以秩和检验; 结直肠癌患者化疗后不良反应发生相关因素采用Lasso-Logistic回归分析; 列线图预测模型构建采用R软件, 并分别采用受试者工作特征(receiver operating characteristic, ROC)曲线、校准曲线评价该模型区分度、准确度. 行双侧检验, 检验水准α = 0.05.
化疗1个疗程结束后, 建模集210例结直肠癌患者中, 85例(40.48%)发生不良反应(≥Ⅲ级)纳入发生组, 125例(59.52%)未发生不良反应纳入未发生组, 不良反应见表1.
| 不良反应 | 0级 | Ⅰ级 | Ⅱ级 | Ⅲ级 | Ⅳ级 |
| 消化道反应 | |||||
| 恶心 | 10(4.76) | 81(38.57) | 34(16.19) | 60(28.57) | 25(11.90) |
| 呕吐 | 13(6.19) | 76(36.19) | 50(23.81) | 52(24.76) | 19(90.05) |
| 腹泻 | 27(12.86) | 68(32.38) | 38(18.10) | 57(27.14) | 20(9.52) |
| 血液系统反应 | |||||
| 血小板降低 | 50(23.81) | 90(42.86) | 35(16.67) | 27(12.86) | 8(3.81) |
| 白细胞降低 | 41(19.52) | 98(46.67) | 33(15.71) | 23(10.95) | 15(7.14) |
| 血红蛋白降低 | 65(30.95) | 71(33.81) | 25(11.90) | 32(15.24) | 17(8.10) |
建模集发生组与未发生组在性别、肿瘤分期、肿瘤直径、收缩压、组织学分级、空腹血糖、总胆固醇、化疗方案、吸烟史、总胆红素、舒张压、血肌酐方面比较无明显差异; 发生组与未发生组在年龄、体质量指数、ECOG评分、PG-SGA评分、乳酸脱氢酶及营养指标白蛋白、总淋巴细胞计数、血红蛋白方面差异有统计学意义(P<0.05), 见表2.
| 项目 | 发生组(n = 85) | 未发生组(n = 125) | t/χ2/u | P值 |
| 性别 | ||||
| 男 | 45(52.94) | 63(50.40) | 0.131 | 0.718 |
| 女 | 40(47.06) | 62(49.60) | ||
| 年龄(岁) | 65.84±6.96 | 60.13±8.29 | 5.220 | <0.001 |
| 体质量指数(kg/m2) | 20.59±1.24 | 22.04±1.52 | 7.296 | <0.001 |
| 肿瘤类型 | ||||
| 结肠癌 | 48(56.47) | 71(56.80) | 0.002 | 0.962 |
| 直肠癌 | 37(43.53) | 54(43.20) | ||
| 肿瘤直径(cm) | 4.38±1.05 | 4.12±0.87 | 1.953 | 0.052 |
| 肿瘤分期 | ||||
| Ⅲa期 | 51(60.00) | 82(65.60) | 0.683 | 0.408 |
| Ⅲb期 | 34(40.00) | 43(34.40) | ||
| 组织学分级 | ||||
| 低分化 | 28(32.94) | 37(29.60) | 0.561 | 0.575 |
| 中分化 | 43(50.59) | 66(52.80) | ||
| 高分化 | 14(16.47) | 22(17.60) | ||
| 化疗方案 | ||||
| FOLFOX方案 | 45(52.94) | 69(55.20) | 0.104 | 0.747 |
| XELOX方案 | 40(47.06) | 56(44.80) | ||
| ECOG评分 | ||||
| 0-1分 | 37(43.53) | 73(58.40) | 4.486 | 0.034 |
| 2-3分 | 48(56.47) | 52(41.60) | ||
| PG-SGA评分 | ||||
| 0-1分 | 18(21.18) | 40(32.00) | 3.222 | 0.001 |
| 2-3分 | 20(23.53) | 47(37.60) | ||
| 4-8分 | 20(23.53) | 20(16.00) | ||
| ≥9分 | 27(31.76) | 18(14.40) | ||
| 吸烟史 | 32(37.65) | 44(35.20) | 0.131 | 0.717 |
| 舒张压(mmHg) | 127.82±22.85 | 132.41±25.69 | 1.328 | 0.186 |
| 收缩压(mmHg) | 78.76±13.19 | 82.06±15.47 | 1.609 | 0.109 |
| 营养指标 | ||||
| 白蛋白(g/L) | 29.83±3.25 | 32.41±4.06 | 4.889 | <0.001 |
| 总淋巴细胞计数(×109/L) | 1.12±0.25 | 1.56±0.31 | 10.894 | <0.001 |
| 血红蛋白(g/L) | 98.42±10.26 | 109.41±15.83 | 5.648 | <0.001 |
| 其他生化指标 | ||||
| 空腹血糖(mmol/L) | 6.82±1.13 | 6.57±1.19 | 1.525 | 0.129 |
| 总胆固醇(mmol/L) | 4.82±0.87 | 4.69±1.02 | 0.961 | 0.338 |
| 总胆红素(μmol/L) | 13.87±2.32 | 14.29±3.02 | 1.083 | 0.280 |
| 血肌酐(μmol/L) | 85.85±10.41 | 87.42±11.33 | 1.018 | 0.310 |
| 乳酸脱氢酶(g/L) | 149.84±20.49 | 125.76±23.82 | 7.601 | <0.001 |
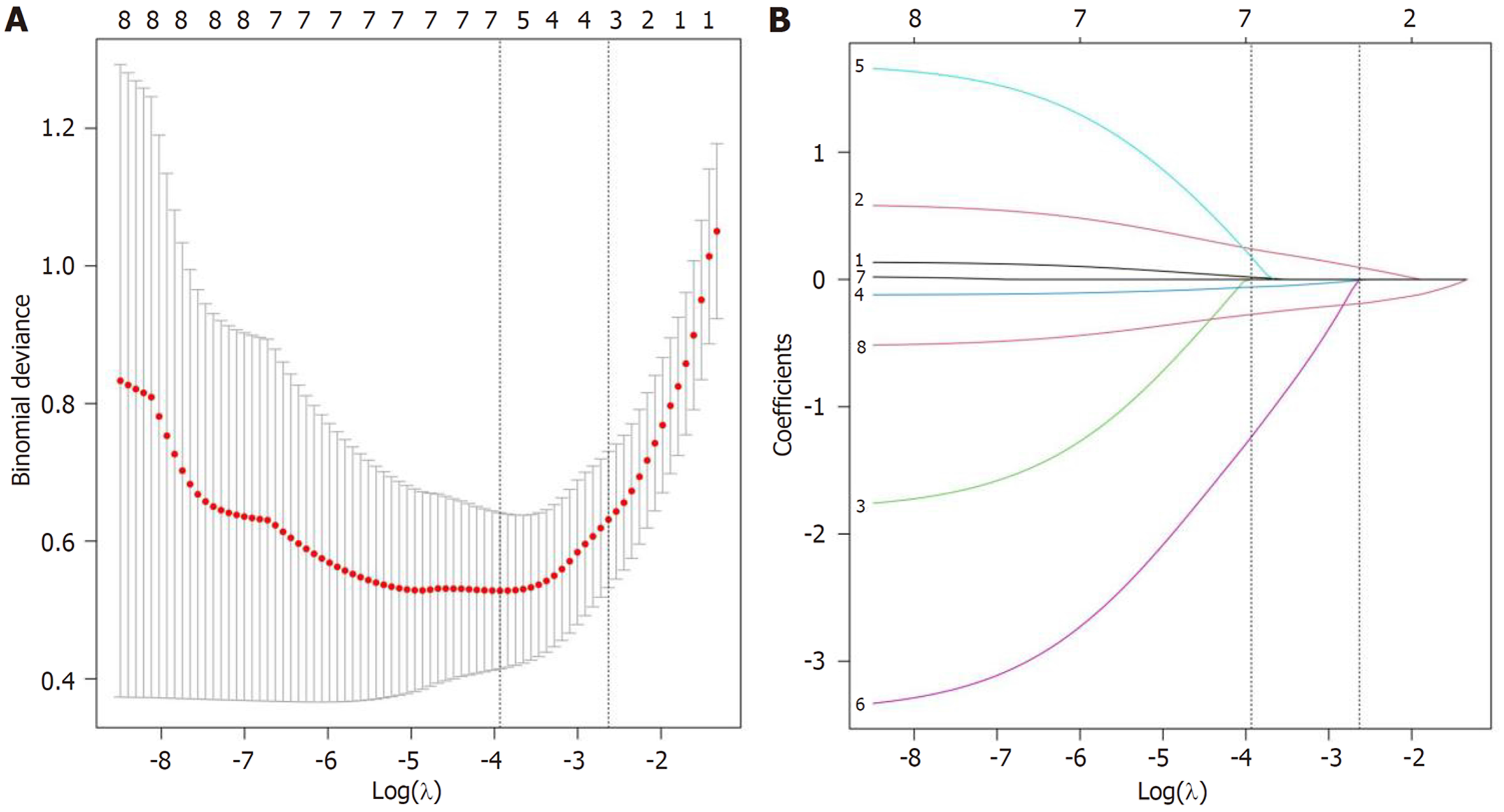
2.3.1 Lasso特征性变量初筛: 以结直肠癌患者化疗后不良反应发生为因变量, 以单因素分析中P<0.05的8个变量作为自变量. Lasso回归分析, 随着惩罚系数λ变化, 体质量指数、PG-SGA评分的系数随着logλ变化被压缩至0, 避免了模型的过度拟合, 结直肠癌患者化疗后不良反应特征变量筛选图见图1. 以交叉验证法绘制均方误差随logλ的变化图, 当惩罚系数λ = 0.072时模型性能优良且影响因素最少, 最终筛选出6个预测变量为年龄、乳酸脱氢酶、ECOG评分及营养指标白蛋白、总淋巴细胞计数、血红蛋白.
2.3.2 多因素Logistic回归分析: 以结直肠癌患者化疗后不良反应发生情况为因变量, 以Lasso初筛出的6个变量: 年龄、ECOG评分、乳酸脱氢酶及营养指标白蛋白、血红蛋白、总淋巴细胞计数作为自变量, 按照表3进行赋值, 纳入Logistic结果显示, 年龄、ECOG评分、乳酸脱氢酶及营养指标白蛋白、血红蛋白、总淋巴细胞计数均为结直肠癌患者化疗后不良反应发生影响因素(P<0.05). 见表4.
| 变量 | 序号 | 变量说明 | 变量赋值 |
| 自变量 | |||
| 年龄 | X1 | 连续变量 | 按照实际值 |
| ECOG评分 | X2 | 分类变量 | 0-1分 = 0, 2-3分 = 1 |
| 乳酸脱氢酶 | X3 | 连续变量 | 按照实际值 |
| 营养指标 | |||
| 白蛋白 | X4 | 连续变量 | 按照实际值 |
| 总淋巴细胞计数 | X5 | 连续变量 | 按照实际值 |
| 血红蛋白 | X6 | 连续变量 | 按照实际值 |
| 因变量 | |||
| 化疗后不良反应 | Y | 分类变量 | 未发生 = 0, 发生 = 1 |
| 因素 | β | S.E. | Wald χ2 | P值 | OR | 95%CI |
| 年龄 | 0.770 | 0.302 | 6.495 | <0.001 | 2.159 | 1.274-7.659 |
| ECOG评分 | 0.959 | 0.324 | 8.752 | <0.001 | 2.608 | 1.037-6.558 |
| 乳酸脱氢酶 | 0.524 | 0.178 | 8.673 | <0.001 | 1.689 | 1.379-3.069 |
| 营养指标 | ||||||
| 白蛋白 | -0.623 | 0.212 | 8.639 | <0.001 | 0.536 | 0.415-0.693 |
| 总淋巴细胞计数 | -0.638 | 0.259 | 6.060 | <0.001 | 0.529 | 0.398-0.702 |
| 血红蛋白 | -0.597 | 0.203 | 8.662 | <0.001 | 0.550 | 0.424-0.714 |
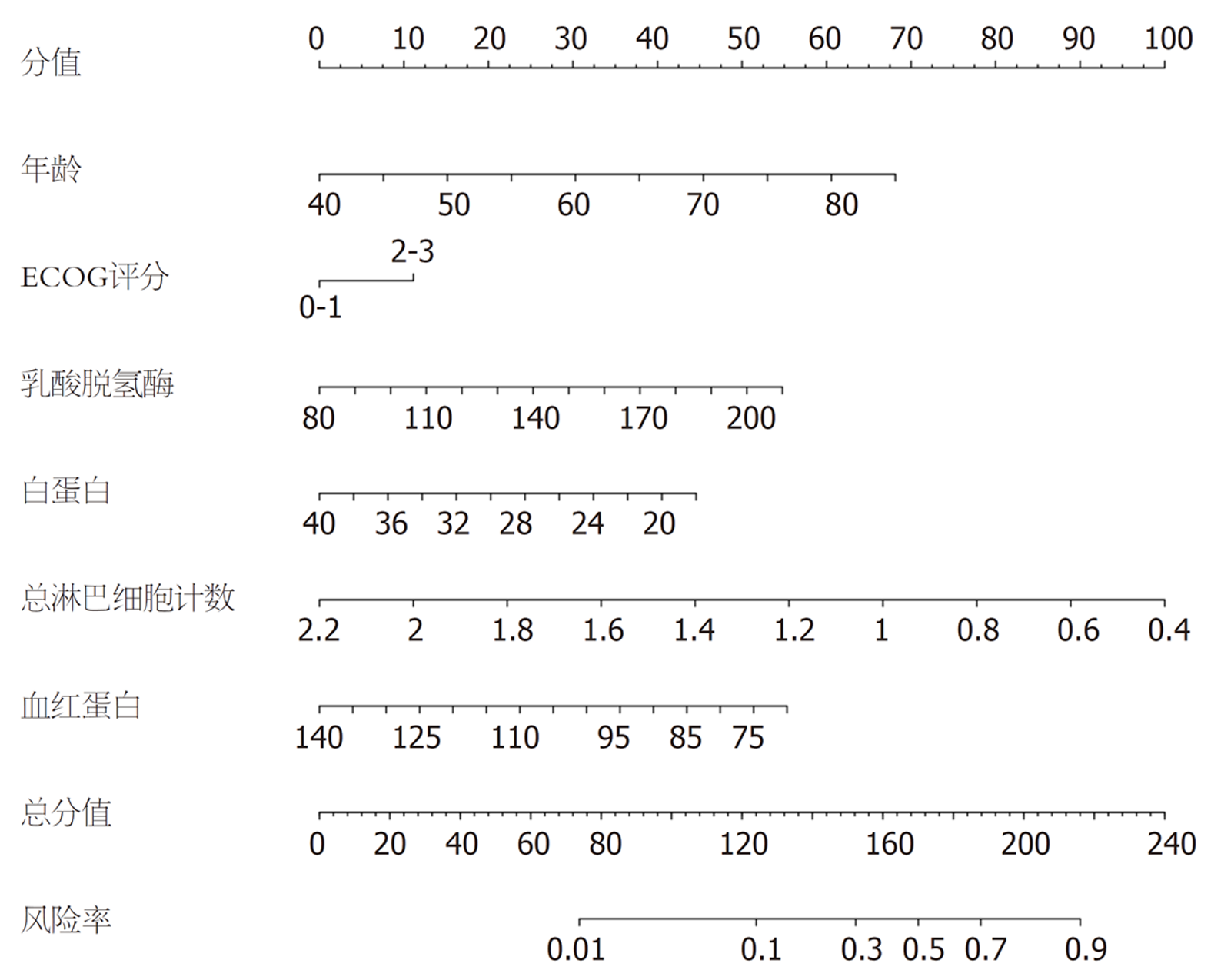
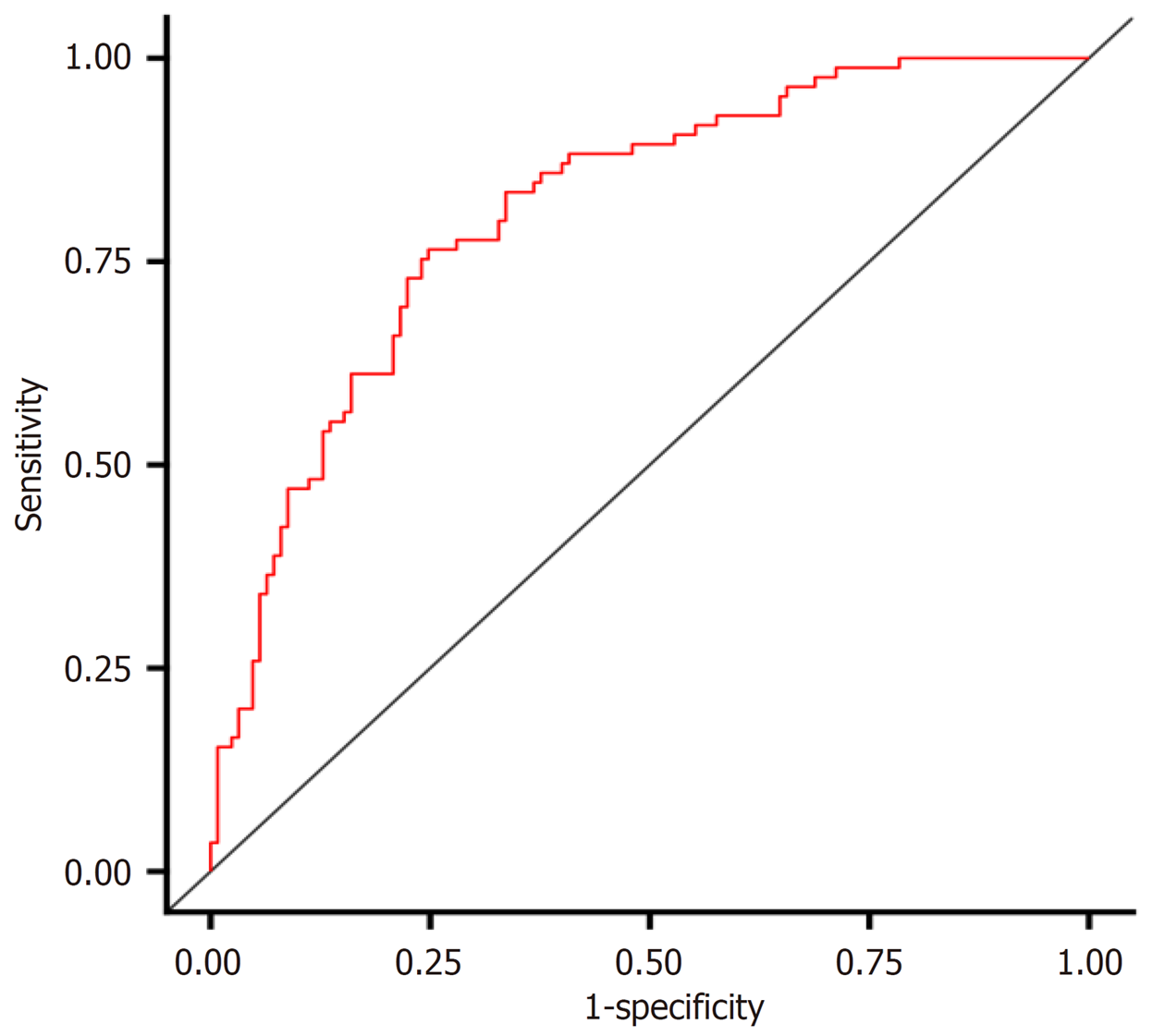
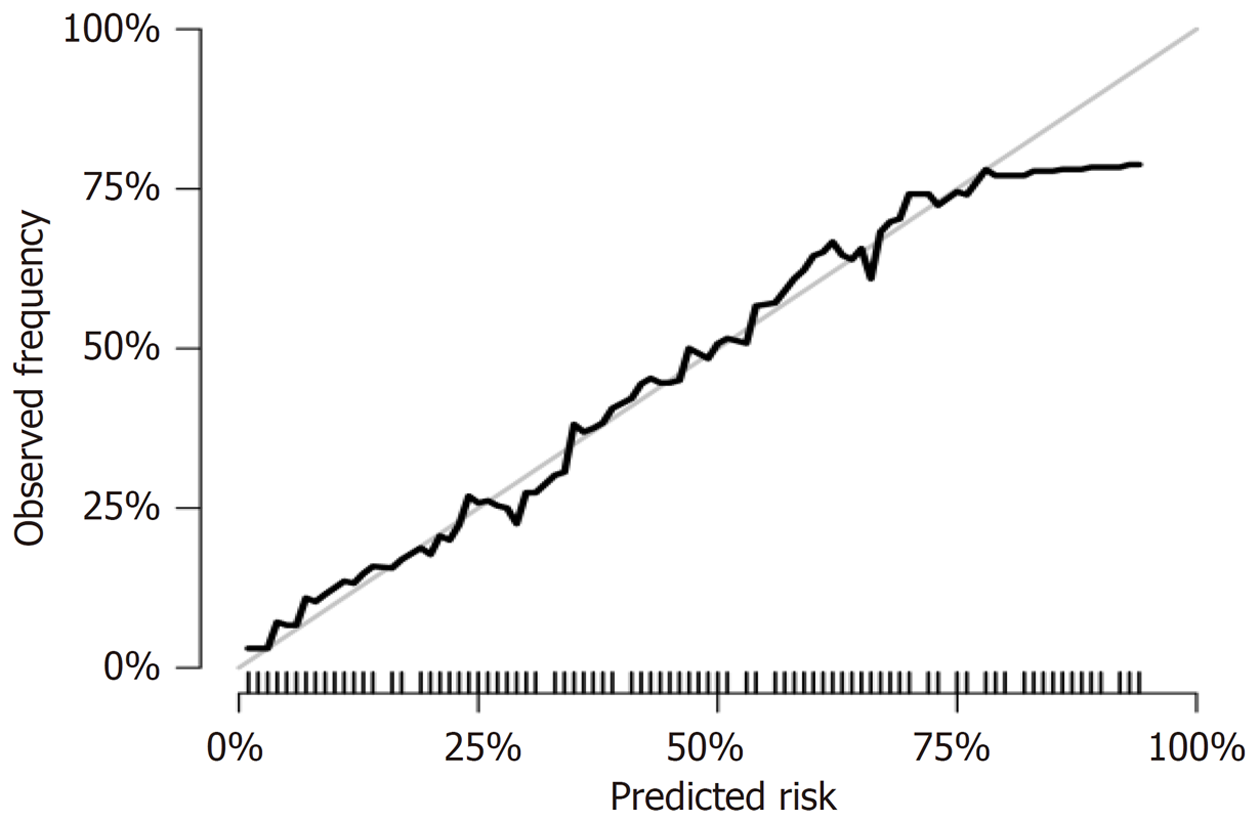
将建模集中结直肠癌患者化疗不良反应发生的影响因素纳入列线图模型, 见图2. 进一步研究显示, 该列线图模型在建模集中的ROC曲线的曲线下面积(area under the curve, AUC)为0.811(95%CI: 0.754-0.869), 预测结直肠癌患者化疗不良反应发生相关因素的一致性指数为0.839(95%CI: 0.778-0.902), 与实际观察结果相关性较高, 提示该模型具有良好区分度及准确度. 见图3和图4.
化疗作为结直肠癌常用治疗手段之一, 具有良好的杀伤肿瘤细胞作用, 但其同时还影响机体其他正常细胞, 可造成胃肠道反应、神经毒性、胃肠道反应等一系列不良反应, 影响患者预后生存质量[12-14]. 本研究结果显示, 210例患者中, 40.48%发生不良反应(≥Ⅲ级), 提示结直肠癌患者化疗不良反应发生率处于较高水平, 因此, 在针对结直肠癌的化疗中, 保证化疗疗效基础上, 如何预测化疗不良反应发生, 进行个性化预防性处理, 从而提高患者生存质量为临床亟待解决问题之一.
本研究分析结直肠癌患者化疗不良反应的影响因素涉及广泛, 包括年龄、ECOG评分、乳酸脱氢酶及营养指标, 其中年龄、ECOG评分在既往关于恶性肿瘤化疗不良反应研究中已有相关说明, 如谷俊杰等[9]在一项胃癌研究中, 指出, ECOG评分≥1分即为≥70岁晚期胃癌患者化疗后不良反应发生的危险因素; 另一项国外研究说明, 相较于ECOG评分为0-1分患者, ECOG评分2分患者血液系统不良反应Ⅲ-Ⅳ级发生率较高, 化疗药物减量及中断或延迟化疗情况更为常见[15]; 邵亚娟等[16]指出, 年龄是非小细胞肺癌患者化疗不良反应发生中较为重要的因素; 另一项预测老年患者化疗毒性风险研究表明[17], 乳酸脱氢酶与化疗不良反应中骨髓毒性密切相关. 但上述研究与本研究人群存在明显差异, 均属于老年群体, 而本研究选取结直肠癌患者年龄范围较广, 结合本研究结果, 充分说明年龄、ECOG评分、乳酸脱氢酶均为影响结直肠癌患者化疗不良反应的危险因素, 且不论是老年人群还是非老年群体. 既往研究中还显示肾功能下降与老年恶性肿瘤化疗不良反应发生有关[18], 但本研究中发生组与未发生组肾功能指标血肌酐水平未见明显异常, 可能与本研究所选病例并非均为老年群体有关, 老年群体伴随多系统功能衰退, 肾功能下降为其重要功能变化之一, 故未纳入Logistic分析.
受肿瘤位置影响, 结直肠癌患者胃肠吸收消化功能减弱, 加之肿瘤细胞恶性进展需消耗大量营养物质, 通常情况下表现为营养风险[19,20]. 传统营养状况评价指标涉及白蛋白、总淋巴细胞计数及血红蛋白, 其中白蛋白、血红蛋白应用较为广泛, 其水平下降提示营养不良风险越高[21]. 既往研究发现[22], 在营养不良筛查中, 总淋巴细胞计数较其他传统营养指标检出率高. 本研究中营养指标白蛋白、总淋巴细胞计数及血红蛋白均为结直肠癌患者化疗不良反应发生的影响因素. 作为药物及人体代谢产物载体, 白蛋白与细胞毒性抗癌药物结合, 对药代动力学发挥作用, 其水平下降, 可化疗不良反应风险[23]. 血红蛋白除与恶性肿瘤患者营养有关外, 还与骨髓抑制等血液不良反应有关[24]. 淋巴细胞计数为机体主要免疫细胞, 其水平异常提示患者免疫功能较差, 而免疫功能差与化疗不良反应发生密切相关[25].
本研究为降低多重共线性对结直肠癌患者化疗不良反应风险预测模型的影响, 采用Lasso-Logistic回归分析筛选影响因素, 最终获取年龄、ECOG评分、乳酸脱氢酶及营养指标白蛋白、总淋巴细胞计数、血红蛋白, 以此构建列线图预测模型, 该模型无需复杂运算, 仅通过作辅助线及简单求和即可快速获取结直肠癌患者化疗不良反应风险. 为保证列线图模型预测准确性, 本研究通过多方面验证, 结果显示该模型预测AUC值为0.811(95%CI: 0.754-0.869), 且该模型结果与实际观察结果具有较高一致性, 充分说明该模型具有良好的区分度及准确度. 此外, 为提高列线图模型的普适性, 本研究选取90例结直肠癌化疗患者进行外部验证, 结果显示该模型敏感度、特异度分别为94.44%、92.59%, 说明该模型可推广应用.
综上所述, 年龄、ECOG评分、乳酸脱氢酶及营养指标白蛋白、总淋巴细胞计数、血红蛋白均为结直肠癌患者化疗不良反应发生的影响因素, 基于此构建含营养指标的列线图预测模型可较为准确地预测患者化疗不良反应发生风险, 为临床防治工作提供参考依据.
结直肠癌患者化疗后易出现不良反应, 但缺乏早期预测模型, 基于营养状况与消化系统恶性肿瘤化疗、放化疗不良反应具有一定相关性, 推测其可作为预后模型相关因素.
结直肠癌早期诊断率较低, 约1/3患者就诊时出现转移, 手术切除患者也有1/2将因转移或复发进展为晚期癌, 此类患者主要治疗策略之一为化疗, 虽改善了患者生存结局, 但化疗药物可能引起消化道反应、神经毒性、骨髓抑制等多种不良反应.
本研究通过分析结直肠癌化疗患者临床资料及营养指标差异, 并以此构建预测模型, 旨在为结直肠癌化疗提供参考依据.
选取2017-07/2021-03浙江求是心血管病医院接受化疗的结直肠癌患者210例作为模型建模集, 统计患者化疗后不良反应发生率, 采用Lasso初筛结直肠癌患者化疗后不良反应的特征变量, Logistic分析结直肠癌患者化疗后不良反应因素; 构建列线图模型, 并采用校准曲线、受试者工作特征曲线评价该模型准确度及区分度. 另选取2021-04/2024-03接受化疗的结直肠癌患者90例作为模型验证集, 对构建的列线图模型进行验证.
年龄、美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分、乳酸脱氢酶及营养指标白蛋白、总淋巴细胞计数、血红蛋白均为结直肠癌患者化疗不良反应发生的影响因素, 基于此构建含营养指标的列线图预测模型可较为准确地预测患者化疗不良反应发生风险.
年龄、ECOG评分、乳酸脱氢酶及营养指标白蛋白、总淋巴细胞计数、血红蛋白均为结直肠癌患者化疗不良反应发生的影响因素, 基于此构建含营养指标的列线图预测模型可较为准确地预测患者化疗不良反应发生风险.
本研究通过分析结直肠癌化疗患者临床资料及营养指标差异, 并以此构建预测模型, 旨在为结直肠癌化疗提供参考依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71:209-249. [PubMed] [DOI] |
| 2. | Barnell EK, Wurtzler EM, La Rocca J, Fitzgerald T, Petrone J, Hao Y, Kang Y, Holmes FL, Lieberman DA. Multitarget Stool RNA Test for Colorectal Cancer Screening. JAMA. 2023;330:1760-1768. [PubMed] [DOI] |
| 3. | Diaz LA, Shiu KK, Kim TW, Jensen BV, Jensen LH, Punt C, Smith D, Garcia-Carbonero R, Benavides M, Gibbs P, de la Fourchardiere C, Rivera F, Elez E, Le DT, Yoshino T, Zhong WY, Fogelman D, Marinello P, Andre T; KEYNOTE-177 Investigators. Pembrolizumab versus chemotherapy for microsatellite instability-high or mismatch repair-deficient metastatic colorectal cancer (KEYNOTE-177): final analysis of a randomised, open-label, phase 3 study. Lancet Oncol. 2022;23:659-670. [PubMed] [DOI] |
| 4. | Fakih M, Sandhu J, Lim D, Li X, Li S, Wang C. Regorafenib, Ipilimumab, and Nivolumab for Patients With Microsatellite Stable Colorectal Cancer and Disease Progression With Prior Chemotherapy: A Phase 1 Nonrandomized Clinical Trial. JAMA Oncol. 2023;9:627-634. [PubMed] [DOI] |
| 6. | André T, Falcone A, Shparyk Y, Moiseenko F, Polo-Marques E, Csöszi T, Campos-Bragagnoli A, Liposits G, Chmielowska E, Aubel P, Martín L, Fougeray R, Amellal N, Saunders MP. Trifluridine-tipiracil plus bevacizumab versus capecitabine plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer ineligible for intensive therapy (SOLSTICE): a randomised, open-label phase 3 study. Lancet Gastroenterol Hepatol. 2023;8:133-144. [PubMed] [DOI] |
| 7. | 李 敏, 漆 凤霞, 鞠 楷, 黄 翠萍, 陈 邱玲. 242例老年结直肠癌术前MNA-SF与NRS2002营养筛查结果及预后分析. 河北医学. 2017;23:1623-1628. [DOI] |
| 9. | 谷 俊杰, 杨 莹, 王 晨宇, 高 洋, 由 婷婷, 白 春梅, 赵 林. 70岁及以上临床晚期胃癌患者化疗相关不良反应的列线图预测模型的构建与验证. 中国肿瘤临床. 2022;49:507-511. [DOI] |
| 10. | 王 倩, 王 军, 王 祎, 景 绍武, 刘 青, 曹 峰, 焦 文鹏, 杨 从容, 程 云杰, 武 亚晶. 营养状况与炎症指标对食管癌同期放化疗急性不良反应的影响. 中华放射肿瘤学杂志. 2017;26:1012-1018. [DOI] |
| 11. | Benson AB, Venook AP, Al-Hawary MM, Cederquist L, Chen YJ, Ciombor KK, Cohen S, Cooper HS, Deming D, Engstrom PF, Garrido-Laguna I, Grem JL, Grothey A, Hochster HS, Hoffe S, Hunt S, Kamel A, Kirilcuk N, Krishnamurthi S, Messersmith WA, Meyerhardt J, Miller ED, Mulcahy MF, Murphy JD, Nurkin S, Saltz L, Sharma S, Shibata D, Skibber JM, Sofocleous CT, Stoffel EM, Stotsky-Himelfarb E, Willett CG, Wuthrick E, Gregory KM, Freedman-Cass DA. NCCN Guidelines Insights: Colon Cancer, Version 2.2018. J Natl Compr Canc Netw. 2018;16:359-369. [PubMed] [DOI] |
| 12. | Thibaudin M, Fumet JD, Chibaudel B, Bennouna J, Borg C, Martin-Babau J, Cohen R, Fonck M, Taieb J, Limagne E, Blanc J, Ballot E, Hampe L, Bon M, Daumoine S, Peroz M, Mananet H, Derangère V, Boidot R, Michaud HA, Laheurte C, Adotevi O, Bertaut A, Truntzer C, Ghiringhelli F. First-line durvalumab and tremelimumab with chemotherapy in RAS-mutated metastatic colorectal cancer: a phase 1b/2 trial. Nat Med. 2023;29:2087-2098. [PubMed] [DOI] |
| 13. | Akdeniz N, Kaplan MA, Uncu D, İnanç M, Kaya S, Dane F, Küçüköner M, Demirci A, Bilici M, Durnalı AG, Koral L, Şendur MAN, Erol C, Türkmen E, Ölmez ÖF, Açıkgöz Ö, Laçin Ş, Şahinli H, Urakçı Z, Işıkdoğan A. The comparison of FOLFOX regimens with different doses of 5-FU for the adjuvant treatment of colorectal cancer: a multicenter study. Int J Colorectal Dis. 2021;36:1311-1319. [PubMed] [DOI] |
| 14. | Raschzok N, Stintzing S, Heinemann V, Rauch G, Ricke J, Guckenberger M, Kurreck A, Alig AHS, Stahler A, Bullinger L, Schmelzle M, Schöning W, Lurje G, Krenzien F, Haase O, Rau B, Gebauer B, Sauer IM, Pratschke J, Modest DP. FIRE-9 - PORT / AIO-KRK-0418: a prospective, randomized, open, multicenter Phase III trial to investigate the efficacy of adjuvant/additive chemotherapy in patients with definitely-treated metastatic colorectal cancer. BMC Cancer. 2022;22:359. [PubMed] [DOI] |
| 15. | Hacibekiroglu I, Kodaz H, Erdogan B, Turkmen E, Esenkaya A, Uzunoglu S, Cicin I. Comparative analysis of the efficacy and safety of oxaliplatin plus 5-fluorouracil/leucovorin (modified FOLFOX6) with advanced gastric cancer patients having a good or poor performance status. Asian Pac J Cancer Prev. 2015;16:2355-2359. [PubMed] [DOI] |
| 17. | Extermann M, Boler I, Reich RR, Lyman GH, Brown RH, DeFelice J, Levine RM, Lubiner ET, Reyes P, Schreiber FJ, Balducci L. Predicting the risk of chemotherapy toxicity in older patients: the Chemotherapy Risk Assessment Scale for High-Age Patients (CRASH) score. Cancer. 2012;118:3377-3386. [PubMed] [DOI] |
| 18. | Wildes TM, Ruwe AP, Fournier C, Gao F, Carson KR, Piccirillo JF, Tan B, Colditz GA. Geriatric assessment is associated with completion of chemotherapy, toxicity, and survival in older adults with cancer. J Geriatr Oncol. 2013;4:227-234. [PubMed] [DOI] |
| 19. | Suzuki S, Goto A, Nakatochi M, Narita A, Yamaji T, Sawada N, Katagiri R, Iwagami M, Hanyuda A, Hachiya T, Sutoh Y, Oze I, Koyanagi YN, Kasugai Y, Taniyama Y, Ito H, Ikezaki H, Nishida Y, Tamura T, Mikami H, Takezaki T, Suzuki S, Ozaki E, Kuriki K, Takashima N, Arisawa K, Takeuchi K, Tanno K, Shimizu A, Tamiya G, Hozawa A, Kinoshita K, Wakai K, Sasaki M, Yamamoto M, Matsuo K, Tsugane S, Iwasaki M. Body mass index and colorectal cancer risk: A Mendelian randomization study. Cancer Sci. 2021;112:1579-1588. [PubMed] [DOI] |
| 20. | Tsilidis KK, Papadimitriou N, Dimou N, Gill D, Lewis SJ, Martin RM, Murphy N, Markozannes G, Zuber V, Cross AJ, Burrows K, Lopez DS, Key TJ, Travis RC, Perez-Cornago A, Hunter DJ, van Duijnhoven FJB, Albanes D, Arndt V, Berndt SI, Bézieau S, Bishop DT, Boehm J, Brenner H, Burnett-Hartman A, Campbell PT, Casey G, Castellví-Bel S, Chan AT, Chang-Claude J, de la Chapelle A, Figueiredo JC, Gallinger SJ, Giles GG, Goodman PJ, Gsur A, Hampe J, Hampel H, Hoffmeister M, Jenkins MA, Keku TO, Kweon SS, Larsson SC, Le Marchand L, Li CI, Li L, Lindblom A, Martín V, Milne RL, Moreno V, Nan H, Nassir R, Newcomb PA, Offit K, Pharoah PDP, Platz EA, Potter JD, Qi L, Rennert G, Sakoda LC, Schafmayer C, Slattery ML, Snetselaar L, Schenk J, Thibodeau SN, Ulrich CM, Van Guelpen B, Harlid S, Visvanathan K, Vodickova L, Wang H, White E, Wolk A, Woods MO, Wu AH, Zheng W, Bueno-de-Mesquita B, Boutron-Ruault MC, Hughes DJ, Jakszyn P, Kühn T, Palli D, Riboli E, Giovannucci EL, Banbury BL, Gruber SB, Peters U, Gunter MJ. Genetically predicted circulating concentrations of micronutrients and risk of colorectal cancer among individuals of European descent: a Mendelian randomization study. Am J Clin Nutr. 2021;113:1490-1502. [PubMed] [DOI] |
| 21. | 毛 俊, 纪 莉莎, 张 子蓉, 唐 华平. 基于血红蛋白、白蛋白、淋巴细胞和血小板评分建立的列线图对非小细胞肺癌患者总生存期的预测价值. 中国临床医生杂志. 2023;51:545-551. [DOI] |
| 25. | Lu C, Liu Y, Chen B, Yang H, Hu H, Liu Y, Zhao Y. Prognostic value of lymphocyte count in severe COVID-19 patients with corticosteroid treatment. Signal Transduct Target Ther. 2021;6:106. [PubMed] [DOI] |