修回日期: 2024-12-30
接受日期: 2025-02-20
在线出版日期: 2025-02-28
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)已成为全球重大公共卫生问题. 探寻生物标志物用于NAFLD的预防监测和临床评估, 对于临床靶向防治具有指导意义. 炎症与NAFLD间关联复杂, 探索NAFLD相关炎症标志物, 有助于阐明致病机制.
本研究基于美国国家健康和营养调查(National Health and Nutrition Examination Survey, NHANES)数据库的数据, 探究炎症标志物中性粒细胞-白蛋白比值(neutrophil to albumin ratio, NAR)与NAFLD的潜在关联.
选取NHANES数据库2017-2018参与者数据集. 根据有无发生NAFLD分为NAFLD组、非NAFLD组. 比较两组临床资料; 采用Logistic多模型回归分析探索NAR与NAFLD相关性; 进一步通过限制性立方样条(restricted cubic spline, RCS)及阈值效应分析探索潜在拐点.
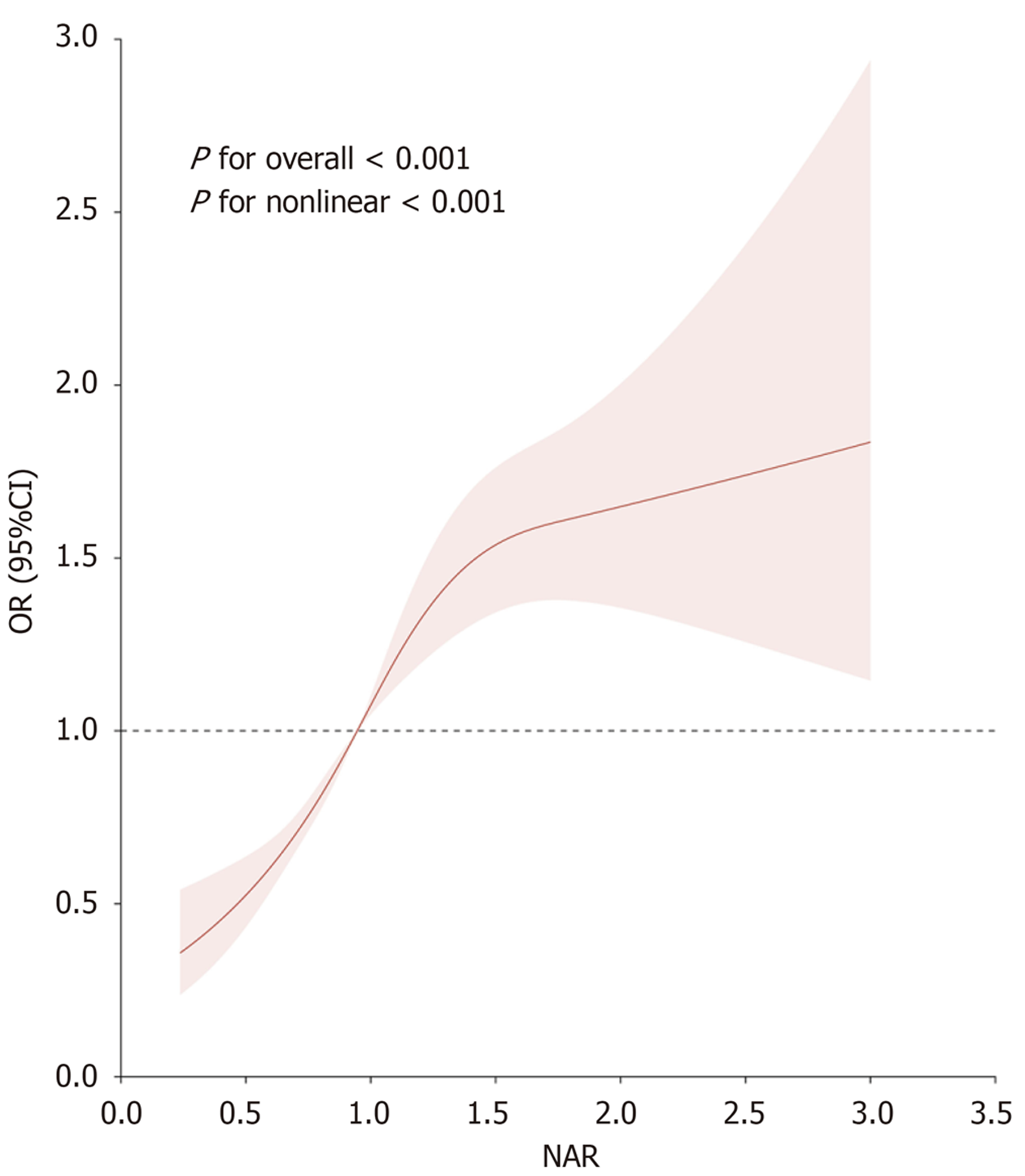
最终纳入了4526名参与者, 其中NAFLD患者有1503例. NAFLD组NAR水平高于非NAFLD组, 差异有统计学意义(P<0.05); 两组间性别、年龄、体质指数、吸烟状况、高血压、降压药使用、糖尿病、降糖药使用、谷丙转氨酶、谷草转氨酶、血尿素氮、肌酸酐、尿酸、甘油三酯、总胆固醇等水平差异均有统计学意义(均P<0.05), 这些变量进入矫正模型. 在无矫正的模型1中, NAR水平与NAFLD的发生风险有关(OR = 2.154); 在矫正不同变量的模型2(OR = 1.375)、模型3(OR = 1.693)、及模型4(OR = 1.817)中, 两者间仍具有独立相关性(均P<0.05). RCS曲线显示, NAR与NAFLD之间存在非线性关系(Pfor overall<0.001, Pfor nonlinear<0.001). 阈值效应分析显示, NAR影响NAFLD的拐点为1.436, 当NAR低于1.436时, NAR每增加一个单位, NAFLD发生风险增加3.304倍(OR = 3.304; 95%CI: 2.649-4.122; P<0.001). 但本研究尚未发现NAR在区别非酒精性脂肪性肝炎中的潜在价值.
NAR与NAFLD发生风险独立相关; 当NAR水平低于1.436时, NAFLD发生风险随NAR水平升高而增加.
核心提要: 本研究探索了炎症营养复合标志物中性粒细胞-白蛋白比值(neutrophil to albumin ratio, NAR)与非酒精性脂肪性肝病的相关性. 结果发现两者间为独立正相关关系, 但相关性受某一拐点影响; 未发现NAR可区别非酒精性脂肪性肝炎的价值.
引文著录: 向芬, 毛华新, 徐宇, 葛新星. 中性粒细胞-白蛋白比值与非酒精性脂肪性肝病的潜在关联: 基于NHANES的横断面研究. 世界华人消化杂志 2025; 33(2): 122-130
Revised: December 30, 2024
Accepted: February 20, 2025
Published online: February 28, 2025
Non-alcoholic fatty liver disease (NAFLD) has become a major public health problem in the world. Exploring objective biomarkers for the prevention, monitoring, and clinical evaluation of NAFLD is of guiding significance for clinical targeted prevention and treatment. There is a complex interaction between inflammation and NAFLD. Exploring NAFLD-related inflammatory markers is helpful for elucidating its pathogenic mechanism.
To explore the potential association between the inflamma-tory marker neutrophil to albumin ratio (NAR) and NAFLD based on the National Health and Nutrition Examination Survey (NHANES) database.
The participant data set of the NHANES database from 2017 to 2018 was selected. They were divided into NAFLD group and non-NAFLD group according to the occurrence of NAFLD or not. The clinical data of the two groups were compared. Logistic regression analysis was used to analyze the relationship between NAR and NAFLD, and restricted cubic spline (RCS) and threshold effect analysis were performed to explore the potential turning point.
A total of 4526 participants were enrolled, including 1503 patients with NAFLD. The NAR level in the NAFLD group was significantly higher than that of the non-NAFLD group (P < 0.05). There were also significant differences in gender, age, body mass index, smoking status, hypertension, antihypertensive drugs, diabetes, hypoglycemic agents, alanine aminotransferase, aspartate aminotransferase, blood urea nitrogen, creatinine, uric acid, triglyceride, and total cholesterol between the two groups (P < 0.05 for), and these variables were therefore included in the adjusted model analyses. In model 1 without any adjustment, NAR levels were associated with the risk of NAFLD (OR = 2.154). In the model 2 (OR = 1.375), model 3 (OR = 1.693), and model 4 (OR = 1.817) adjusting for some variables, their independent association still existed. RCS curve analysis showed that there was a nonlinear relationship between NAR and NAFLD (Pfor overall < 0.001, Pfor nonlinear < 0.001). Threshold effect analysis showed that the inflection point of NAR influencing NAFLD risk was 1.436, and when NAR was lower than 1.436, the risk of NAFLD occurrence increased by 3.304 times for each additional unit of NAR (OR = 3.304; 95% confidence interval: 2.649-4.122; P < 0.001). However, this study did not found the potential value of NAR in distinguishing non-alcoholic steatohepatitis.
The levels of NAR show an independent association with NAFLD. When NAR is lower than 1.436, the risk of NAFLD increases with the increase of NAR level.
- Citation: Xiang F, Mao HX, Xu Y, Ge XX. Potential association of neutrophil-albumin ratio with non-alcoholic fatty liver disease: A cross-sectional study based on NHANES. Shijie Huaren Xiaohua Zazhi 2025; 33(2): 122-130
- URL: https://www.wjgnet.com/1009-3079/full/v33/i2/122.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i2.122
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)的特征是肝脏脂肪过度沉积, 且明确排除酒精及其他损肝因素. 2023年一项针对120多万人的系统研究表明[1], NAFLD影响全球约30%的人口, 并且发病率持续上升. NAFLD可进展为肝硬化、肝癌、肝衰竭, 还可导致各种肝外并发症, 并与代谢性病如代谢综合征、糖尿病等密切相关, 也会增加心血管疾病和死亡率风险[2,3]. 这使其成为全球重大公共卫生问题, 并带来较大的社会经济与医疗负担, 加之NAFLD的治疗选择仍然有限, 预防NAFLD仍是公共卫生战略的重点. 尽管NAFLD的发病率和潜在风险很高, 但该疾病的发病机制仍未完全清楚, 鉴于其发病机制复杂多样, 目前迫切需要进一步探寻其客观生物标志物, 用于NAFLD的预防监测或临床评估, 这对于临床靶向防治也具有指导意义.
近年来研究发现, 炎症与NAFLD之间存在复杂相互作用, 但单一指标对机体状态的反映较为片面, 而将两个指标整合成一个因素更能够多面反映机体状态及预示疾病发生风险[4,5]. 中性粒细胞与白蛋白比值(neutrophil to albumin ratio, NAR)作为新型炎症标志物主要反映全身炎症与营养状况, 具有易于获得、无创、重复性好等多重优势. 既往研究指出NAR是感染、炎症疾病、恶性肿瘤的新型标志物, 较高水平的NAR反映炎症刺激, 预示发病风险增加或治疗反应/预后不佳[6,7]. 有报道还表明中性粒细胞有关的全身炎症标志物与NAFLD发生风险存在密切关联[8], 故推测NAR与NAFLD可能存在相关性. 但目前有关NAR与NAFLD关系的研究尚少, 且国内尚缺乏NAFLD更大样本量的报道.
美国国家健康和营养调查(National Health and Nutrition Examination Survey, NHANES)数据库[9]收集了所有年龄段参与者的健康与营养信息, 是一项定期的、横断面的健康调查项目, 采用分层、多阶段和概率集群设计, 以收集全国范围内具有代表性的非机构化美国公民样本. 该数据库由美国国家卫生统计中心(National center for Health Statistics, NCHS)收集和维护. 参与者接受广泛的评估过程, 包括家庭访谈和在移动检查中心进行的体检, 包括身体检查、特殊测量和实验室检查. 由于数据是为进行研究目的而发布的, 并且研究人员获得了NCHS的许可使用这些数据, 因此NHANES数据库为研究提供了可靠的数据资源. 本研究则基于NHANES大样本数据探讨NAR与NAFLD的潜在关联, 旨在为NAFLD的防治提供依据.
研究人群来自NHANES数据库(https://www.cdc.gov/nchs/nhanes/)中的调查群体, NHANES是一项由NCHS每两年一次定期进行的横断面研究, 是美国定期健康相关数据的重要来源. 研究人群均在多层次、复杂、多阶段的抽样条件下完成选取, 并接受广泛的评估及调查, 涵盖了人口统计学、社会经济、健康相关问题、生理测量、实验室检验等多方面信息. NHANES的研究方案获得了NCHS伦理审查委员会批准, 并获得了所有参与者的知情同意(https://www.cdc.gov/nchs/nhanes/about/erb.html?CDC_AAref_Val=https://www.cdc.gov/nchs/nhanes/irba98.htm).
本研究提取了NHANES 2017-2018年的数据, 该周期共9254名参与者. 排除标准: (1)缺失振动控制瞬时弹性成像(vibration-controlled transient elastography, VCTE)数据(n = 3306); (2)VCTE检查状态不合格、未执行样本(n = 456); (3)病毒性肝炎(乙型或丙型肝炎病毒血清学标志物阳性)(n = 43); (4)过量饮酒(每天超过4或5标准杯)(n = 592); (5)缺失白蛋白或中性粒细胞数据(n = 331). 最终纳入了4526名参与者.
1.2.1 结局变量: 本研究观察的主要结局是NAFLD的发生. 在NHANES移动检查中心, 由经验丰富的医疗技术人员使用FibroScan型号502 V2 Touch(Echosens, Paris, France)的中型/超大型探头进行VCTE弹性成像检查. 通过Fibroscan模型的受控衰减参数(controlled attenuation parameters, CAP)评估肝脏状态, 根据CAP参数诊断NAFLD: CAP≥285 dB/m则判定为发生NAFLD[10]. 根据有无发生NAFLD分为NAFLD组、非NAFLD组.
1.2.2 暴露变量: 本研究观察的暴露变量为NAR. 采用Beckman Coulter自动血液分析仪DxH 900(Beckman-Coulter, Brea, CA, USA)检测血液学参数, 获得中性粒细胞计数; 白蛋白水平由Roche Cobas 6000分析仪测定. 根据中性粒细胞计数与白蛋白计算NAR:NAR = 中性粒细胞计数(1000 cells/uL)/白蛋白(g/dL).
1.2.3 协变量: 本研究提取了以下协变量: 性别、年龄、体质量指数(body mass index, BMI)、吸烟状况、高血压、糖尿病、降压药使用情况、降糖药使用情况、丙氨酸转氨酶(alanine aminotransferase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)、血尿素氮(blood urea nitrogen, BUN)、肌酸酐、尿酸、甘油三酯、总胆固醇, 以及饮食摄入指标包括: 能量、蛋白质、碳水化合物、总糖、膳食纤维、总脂肪、总饱和脂肪酸、总单不饱和脂肪酸、总多不饱和脂肪酸. 其中吸烟状况根据NHANES调查问题确定, 一生中至少吸烟100支但现在不吸烟定义为过去吸烟; 一生中至少吸烟100支且现在仍在吸烟定义为当前吸烟; 少于100支或一生中不吸烟定义为从不吸烟[11].
统计学处理 采用统计软件SPSS 25.0分析数据. 计数资料(性别、吸烟状况等)以[n(%)]表示, 行χ2检验; 计量资料呈正态分布以mean±SD表示、t检验, 偏态分布的计量资料以中位数及四分位数表示, 采用Mann-Whitney U检验(Z值); 采用单因素及多因素Logistic回归分析NAFLD的影响因素, 并计算比值比(odds ratio, OR)及95%可信区间(confidence interval, CI); NAR与NAFLD关系的多模型分析采用Logistic回归分析, 并进一步采用R 4.2.3软件包进行限制性立方样条(restricted cubic spline, RCS)及阈值效应分析. P<0.05为差异有统计学意义(双侧检验, α = 0.05).
本研究最终纳入了4526名参与者, 其中NAFLD患者有1503例(NAFLD组). NAFLD组与非NAFLD组的性别、年龄、BMI、吸烟状况、高血压、糖尿病、ALT、AST、BUN、肌酸酐、尿酸、甘油三酯、总胆固醇比较, 差异均有统计学意义(均P<0.05); 且NAFLD组NAR水平高于非NAFLD组, 差异有统计学意义(P<0.05). 饮食摄入包括能量、蛋白质、碳水化合物、总糖、膳食纤维、总脂肪、总饱和脂肪酸、总单不饱和脂肪酸、总多不饱和脂肪酸等, 在两组间均无差异. 此外, 两组间的降压药、及降糖药使用, 具有统计学差异(均P<0.05). 见表1.
| 项目 | 总计(n = 4526) | NAFLD组(n = 1503) | 非NAFLD组(n = 3023) |
| 性别[n(%)]a | |||
| 男性 | 2088(46.13) | 793(52.76) | 1295(42.84) |
| 女性 | 2438(53.87) | 710(47.24) | 1728(57.16) |
| 年龄[岁]a | 44(24, 62) | 53(37, 64) | 37(20, 60) |
| BMI[kg/m2]a | 27.7(23.7, 32.5) | 32.0(28.3, 37.0) | 25.5(22.1, 29.4) |
| 吸烟状况[n(%)]a | |||
| 从不吸烟 | 3178(70.22) | 950(63.21) | 2228(73.70) |
| 过去吸烟 | 803(17.74) | 350(23.29) | 453(14.99) |
| 当前吸烟 | 545(12.04) | 203(13.51) | 342(11.31) |
| 高血压[n(%)]a | |||
| 有 | 1349(29.81) | 670(44.58) | 679(22.46) |
| 无 | 3177(70.19) | 833(55.42) | 2344(77.54) |
| 服用降压药[n(%)]a | |||
| 否 | 2884(70.239) | 845(58.316) | 2039(76.741) |
| 是 | 1222(29.761) | 604(41.684) | 618(23.259) |
| 糖尿病[n(%)]a | |||
| 有 | 551(12.17) | 328(21.82) | 223(7.38) |
| 无 | 3975(87.83) | 1175(78.18) | 2800(92.62) |
| 服用降糖药[n(%)]a | |||
| 否 | 3997(88.312) | 1177(78.310) | 2820(93.285) |
| 是 | 529(11.688) | 326(21.690) | 203(6.715) |
| ALT[U/L]a | 17(12, 24) | 22(16, 32) | 15(11, 20) |
| AST[U/L]a | 19(16, 23) | 20(17, 26) | 18(16, 22) |
| BUN[mg/dL]a | 13(11, 17) | 14(11, 17) | 13(11, 16) |
| 肌酸酐[mg/dL]a | 0.81(0.67, 0.97) | 0.83(0.69, 0.99) | 0.80(0.67, 0.95) |
| 尿酸[mg/dL]a | 5.20(4.30, 6.20) | 5.70(4.80, 6.80) | 5.00(4.10, 6.00) |
| 甘油三酯[mg/dL]a | 107(75, 158) | 143(102, 203) | 93(68, 134) |
| 总胆固醇[mg/dL]a | 179(153, 207) | 186(159, 215) | 174(150, 203) |
| NARa | 0.946(0.717, 1.216) | 1.026(0.800, 1.333) | 0.897(0.682, 1.158) |
| 能量[kcal] | 10.000(5.000, 15.300) | 10.000(5.000, 18.000) | 10.000(5.000,15.000) |
| 蛋白质[gm] | 0.500(0.270, 1.000) | 0.500(0.200, 1.000) | 0.500(0.270, 1.000) |
| 碳水化合物[gm] | 1.500(0.600, 3.000) | 1.500(0.500, 3.000) | 1.500(0.670, 3.000) |
| 总糖[gm] | 1.500(0.560, 2.670) | 1.500(0.500, 2.670) | 1.500(0.620, 2.670) |
| 膳食纤维[gm] | 1.330(0.500, 3.000) | 1.500(0.670, 4.500) | 1.200(0.400, 2.670) |
| 总脂肪[gm] | 1.000(0.500, 1.500) | 1.000(0.670, 1.500) | 1.000(0.500, 1.500) |
| 总饱和脂肪酸[Mgm] | 0.470(0.250, 1.000) | 0.420(0.170, 0.670) | 0.500(0.250, 1.000) |
| 总单不饱和脂肪酸[gm] | 0.500(0.250, 0.500) | 0.420(0.250, 0.830) | 0.500(0.250, 0.500) |
| 总多不饱和脂肪酸[gm] | 0.500(0.250, 1.000) | 0.500(0.250, 1.000) | 0.500(0.250, 1.000) |
对两组间基线有差异的指标进行单因素Logistic回归分析, 结果显示, 性别、年龄、BMI、吸烟状况、高血压、糖尿病、ALT、AST、BUN、肌酸酐、尿酸、甘油三酯、总胆固醇、NAR、降压药使用、降糖药使用与NAFLD的发生有关(P<0.05). 见表2.
| 变量 | P值 | OR | 95%CI | |
| 下限 | 上限 | |||
| 男性 | <0.001 | 1.490 | 1.316 | 1.688 |
| 年龄 | <0.001 | 1.023 | 1.020 | 1.026 |
| BMI | <0.001 | 1.169 | 1.156 | 1.183 |
| 吸烟状况 | ||||
| 过去吸烟 | <0.001 | 1.812 | 1.546 | 2.124 |
| 当前吸烟 | 0.001 | 1.392 | 1.152 | 1.683 |
| 高血压 | <0.001 | 2.777 | 2.431 | 3.171 |
| 降压药使用 | <0.001 | 2.358 | 2.055 | 2.707 |
| 糖尿病 | <0.001 | 3.505 | 2.918 | 4.210 |
| 降糖药的使用 | <0.001 | 3.848 | 3.188 | 4.643 |
| ALT | <0.001 | 1.041 | 1.036 | 1.047 |
| AST | <0.001 | 1.021 | 1.015 | 1.027 |
| BUN | <0.001 | 1.031 | 1.020 | 1.043 |
| 肌酸酐 | 0.015 | 1.230 | 1.041 | 1.454 |
| 尿酸 | <0.001 | 1.441 | 1.377 | 1.508 |
| 甘油三酯 | <0.001 | 1.008 | 1.007 | 1.009 |
| 总胆固醇 | <0.001 | 1.006 | 1.004 | 1.007 |
| NAR | <0.001 | 2.154 | 1.860 | 2.493 |
在未调整变量的模型(模型1)中显示, NAR水平与NAFLD的发生风险有关(OR = 2.154; 95%CI: 1.860-2.493); 调整了年龄、性别、BMI后, NAR水平与NAFLD发生风险的相关性仍然显著(模型2, OR = 1.392; 95%CI: 1.177-1.647). 在矫正了疾病及用药史的模型3(OR = 1.693; 95%CI: 1.438-1.996)、及矫正实验室指标的模型4(OR = 1.817, 95%CI: 1.550-2.132)中, NAR水平与NAFLD发生风险仍具有独立相关性. 见表3.
| 变量 | P值 | OR | 95%CI | |
| 下限 | 上限 | |||
| 模型1 | <0.001 | 2.154 | 1.862 | 2.495 |
| 模型2 | <0.001 | 1.375 | 1.161 | 1.629 |
| 模型3 | <0.001 | 1.693 | 1.438 | 1.996 |
| 模型4 | <0.001 | 1.817 | 1.550 | 2.132 |
RCS曲线(图1)显示, NAR与NAFLD之间存在非线性关系(Pfor overall<0.001, Pfor nonlinear<0.001). 进一步通过阈值效应分析(表4)显示, NAR影响NAFLD的拐点为1.436, 当NAR低于1.436时, NAR每增加一个单位, NAFLD发生风险增加3.304倍(OR = 3.304; 95%CI: 2.649-4.122; P<0.001).
| 模型 | OR(95%CI) | P值 | |
| 模型Ⅰ | 标准线性效应 | 2.154(1.860, 2.493) | <0.001 |
| 模型Ⅱ | NAR水平的拐点 | 1.436 | |
| NAR水平<1.436 | 3.304(2.649, 4.122) | <0.001 | |
| NAR水平≥1.436 | 0.966(0.692, 1.348) | 0.839 | |
| 效应差 | 0.292(0.183, 0.467) | <0.001 | |
| 对数似然比检验 | - | <0.001 |
本研究进一步探索了NAR在非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)中的潜在价值. 本研究共纳入NAFLD患者1503人, 按照ALT水平, 将大于正常值上限2倍的患者列为NASH组、剩余患者为非NASH组. 经统计, 1503人中, NASH患者36人. NASH与非NASH组间有差异的指标有年龄、AST、BUN、高血压、是否服用降压药、性别(所有P<0.05); 但尚未观察到两组间NAR水平有差异.
由于阳性事件NASH样本量较少, 本研究进一步通过倾向性评分匹配, 按照1:2的比例, 对两组患者进行匹配, 匹配项为匹配前两组间有差异的指标. 匹配后数据分析显示, NAR在NASH与非NASH组间同样无统计学差异. 该结果初步说明, NAR可能对NASH患者进行分层的价值有限.
NAFLD患者症状表现通常不明显, 或者只出现右上腹部不适、疲劳等, 多通过影像学检查、生化检查发现. 也有研究指出, 部分NAFLD即使出现疾病进展, 检测其转氨酶水平也在正常范围内(低于40 U/L)[12]. 因此需加强客观血清指标的监测. 鉴于NAFLD发病机制复杂多样, 而血液学指标是能够反映机体状态的客观生物标志物, 因此探索此类标志物对NAFLD的影响有助于辅助临床评估与防治, 具有重要研究意义. 本研究显示, 4526名参与者中发生NAFLD者1503例, NAFLD发生率33.21%. 与Bao等[13]报道的NAFLD发生率32.58%相接近. 均提示NAFLD发病率较高, 需加强预防.
NAR是根据中性粒细胞与白蛋白比值所得的生物标志物, 更能反映机体状态的改变[14]. Wang等[15]研究即证明, 与单独的白蛋白或中性粒细胞相比, NAR对疾病的反映能力更具优势. 但目前国内有关NAR与NAFLD的关系研究尚少. 而Yao等[16]研究发现, 失代偿期肝硬化90天非幸存者的NAR水平显著高于幸存者, 高NAR水平与不良结局独立相关. 提示NAR与肝病可能有关, 但NAR是否影响NAFLD发生有待探究. 本研究结果显示, NAFLD组NAR水平高于非NAFLD组; 未调整变量时, NAR水平与NAFLD的发生风险有关; 在矫正其他变量的多模型中, NAR水平仍与NAFLD的发生风险独立相关. 提示NAFLD患者NAR水平增高, 且NAR作为危险因素与NAFLD具有独立相关性. 分析在于: (1)中性粒细胞是免疫炎症系统的重要成分, 在NAFLD早期阶段, 中性粒细胞的下调已被证明可降低ALT活性, 减轻肝脏炎症及促炎基因mRNA水平[17]. 提示中性粒细胞水平增高被作为NAFLD的危险因素. Huang等[18]研究中也显示, 中性粒细胞与NAFLD的发病机制有关; (2)白蛋白是主要合成自肝脏的蛋白, 反映营养状态, 同时也与炎症介质有关, 低白蛋白水平可能通过破坏体液分布参与疾病发生. 白蛋白水平降低反映了潜在的炎症状态, 肝脏生成白蛋白减少可能是由炎症介质增加而引起的[19]; (3)NAR水平增高即中性粒细胞水平相比白蛋白水平高出一定范围, 中性粒细胞的募集与黏附分子的上调、中性粒细胞衍生蛋白酶的释放、中性粒细胞清除的失调等均密切相关, 其明显增高促进了慢性炎症状态, 而同时白蛋白水平更低也反映了肝脏状态改变, 意味肝细胞代谢紊乱的风险增加, 故NAR高水平可危及NAFLD的发生[20]. 且白蛋白的抗炎功能、抗氧化能力也提示了其水平更低对疾病的潜在影响, NAR水平增高可介导氧化应激, 破坏线粒体的超微结构, 影响抗氧化系统的平衡, 形成恶性循环[21]. 而Nakanishi等[22]研究表明, 氧化应激反应会引起肝细胞炎症甚至细胞死亡, 参与NAFLD发病. 故NAR可能介导氧化应激反应危及NAFLD的发生. 由此可见, NAR在一定程度上, 可作为炎症相关指标, 参与NAFLD的发生风险. NAR为中性粒细胞数与白蛋白比值, 这两个指标在临床上轻便易得, 具有可行性. 此外, 临床中还包括其他用于评估NAFLD严重程度和进展的评价指标, 如肝功能测试(ALT、AST等)、肝脏影像学检查(如超声、MRI)、以及生物标志物(如纤维化指数、NAFLD纤维化评分等). 研究已发现, ALT在超过50%的病例中不能可靠地排除NAFLD, 还漏诊了45.9%-64.2%的肝纤维化患者[23]. 可见, 单一ALT的使用价值有限. 而ALT/AST比值发现与NAFLD风险正相关, 该比值也与肝脏脂肪变性和肝纤维化程度呈正相关, 其对NAFLD的预测价值优于传统肝酶参数[24]. 因此, 在实际临床工作中, 有必要寻找方便易得、容易检测、费用低廉、效能较好的临床指标, 用于NAFLD的风险预测.
NAFLD病理生理机制复杂, 本研究还显示, NAR与性别、年龄、BMI、高血压、糖尿病、ALT、AST、肌酸酐、甘油三酯、尿酸均是NAFLD的影响因素. 与既往报道[25,26]相似, 提示NAR对NAFLD不仅具有独立影响性, 还与上述因素共同影响NAFLD. 这可能与NAFLD复杂的病理生理机制有关, 而NAR直接来源于血液学检查结果, 为NAFLD评估增加了一种方便且具有成本效益、重复性好的方法, 也为临床防治提供了新方向. 本研究进一步RCS曲线显示, NAR与NAFLD之间存在非线性关系; 阈值效应分析显示NAR影响NAFLD的拐点为1.436, 当NAR低于1.436时, NAR每增加一个单位, NAFLD发生风险增加3.304倍(OR = 3.304; 95%CI: 2.649-4.122). 提示NAR与NAFLD之间存在影响阈值, 在1.436范围时NAFLD发生风险随NAR水平增高而增加. 此外, 阈值效应分析未显示NAR≥1.436时NAFLD发生风险的变化性, 但根据RCS曲线(图1)可知, 当NAR≥1.436时NAFLD发生风险仍处于一个较高的水平, 但相对平稳, 故该阈值范围内对比并不显著, 但同时也提示NAR≥1.436仍具有较高的NAFLD发生风险. 因此, 需加强NAR监测, 辅助临床早期识别NAFLD的危险因素, 制定针对性防治策略.
最后, 本研究仍存在如下局限性. 首先本研究数据来源于美国NHANES数据库, 但NAFLD的流行病学特征可能因地区和种族而异; 本研究分析为回顾性分析, 可能在一定程度上限制了结果的普遍适用性, 并且无法排除潜在的选择偏倚; 此外, NHANES数据为横断面调查数据, 对参与者缺乏动态评估信息, 不能做出因果推断, 因此对于NAR与NAFLD的纵向影响关系有待进一步探究. 尽管本研究已纳入众多协变量, 但未知的混杂因素可能仍然存在, 如遗传背景因素等. 此外NHANES部分数据是基于个人访谈和自我报告问卷, 参与者可能会出现回忆偏倚. 因此, 为证明结果的可外推性, 有必要进一步在国内收集大样本量数据, 论证结果的稳定性及适用性.
综上所述, NAFLD患者NAR水平增高, NAR不仅与其他因素共同影响NAFLD, 而且与NAFLD还具有独立相关性; NAR在1.436范围时NAFLD发生风险随NAR水平增高而增加. 但本研究所用NHANES数据为横断面调查数据, 对参与者缺乏动态评估信息, 因此对于NAR与NAFLD的纵向影响关系有待进一步探究.
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)已成为全球公共卫生问题, 其发病机制尚未完全阐明. 已发现炎症与NAFLD间存在复杂调控作用, 揭示NAFLD相关的关键炎症标志物具有重要临床价值.
中性粒细胞-白蛋白比值(neutrophil to albumin ratio, NAR)为炎症复合标志物之一, 可同时反映炎症与营养的双重状况. 目前尚无研究报道NAR与NAFLD的相关性, 值得进一步研究. 本研究提出对NAR进行监测的建议,可辅助临床早期识别NAFLD的危险因素, 制定针对性防治策略.
本研究旨在探索NAR与NAFLD的相关性, 进一步探索影响NAFLD发生风险的关键截点. 本研究是首次研究两者间的相关性, 因此为NAFLD风险因素的探索贡献了重要一份子. 进一步, 通过识别NAR影响NAFLD发生风险的关键截点, 可通过NAR水平对NAFLD高风险人群进行分层, 以便尽早干预, 实现早期预防. 此外, NAR为临床常用实验室指标所得的复合指标, 简单易得, 在临床上具有应用的可行性.
本研究数据来自于美国国家健康和营养调查(National Health and Nutrition Examination Survey, NHANES)数据库, 该数据库具有随机性、样本量大、指标齐全等优点. 本研究回顾性的分析了NAR与NAFLD的相关性, 所分析数据包含了人口学特征数据、疾病史、服药史、实验室指标、及饮食数据. 指标多样, 尽可能纳入了多方面的潜在因素. 本研究首先通过基线比较, 过滤了部分与NAFLD无关的指标, 已达到指标个数过多进行降维的目的; 进一步通过多模型矫正的回归分析, 探索了NAR与NAFLD的独立相关性, 多模型矫正充分了考虑了不同层面的指标对分析结果的影响. 随后, 通过限制性立方样条(restricted cubic spline, RCS)分析探索了是否存在关键截点影响两者间的相关性, RCS分析不仅可对指标间的相关性进行可视化, 还可初步分析是否存在关键截点, 影响两者间相关性的变化, 可通过RCS分析, 初步判断疾病发生风险的起始截点, 具有重要临床意义; 进而通过阈值效应分析探索了关键截点影响的实际统计学意义, 阈值效应为RCS的进一步补充, 通过统计学分析进一步支持该拐点是否真的有意义. 最后我们更进一步探索了NAR在非酒精性脂肪性肝炎的潜在临床价值.
本研究发现: (1)与非-NAFLD组相比, NAR水平在NAFLD组明显升高; (2)矫正不同因素后, NAR水平与NAFLD发生风险仍独立相关; (3)NAR水平与NAFLD为非线性关系, 尤其是当NAR<1.436时, 随着NAR升高, NAFLD发生风险增加; (4)尚未发现NAR在非酒精性脂肪性肝炎中的临床价值. 本研究揭示了NAR与NAFLD发生风险间的相关性; 发现了NAR影响NAFLD发生风险的关键截点. 本研究结果提示, 临床实践中NAR作为风险因子之一, 提示NAFLD发生风险, 用于筛选NAFLD高危人群.
NAR在NAFLD组人群中水平更高; 本研究首次揭示了NAR与NAFLD发生风险间的独立相关性. 且两者间的相关性呈非线性关系, NAR = 1.436为风险存在的关键截点.
本研究数据来源于公共数据库, 目前仅揭示了相关性, 尚无前瞻性的队列数据进行因果关系的探索. 后续研究中, 可前瞻性收集数据, 进行两者间因果关系的论证. 此外, 本研究可进一步通过分子生物学实验, 进一步探索NAR作为炎症及营养的双重复合指标, 在NAFLD疾病发生发展中的潜在调控机制.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Le MH, Le DM, Baez TC, Wu Y, Ito T, Lee EY, Lee K, Stave CD, Henry L, Barnett SD, Cheung R, Nguyen MH. Global incidence of non-alcoholic fatty liver disease: A systematic review and meta-analysis of 63 studies and 1,201,807 persons. J Hepatol. 2023;79:287-295. [PubMed] [DOI] |
| 2. | Targher G, Byrne CD, Tilg H. MASLD: a systemic metabolic disorder with cardiovascular and malignant complications. Gut. 2024;73:691-702. [PubMed] [DOI] |
| 3. | Badmus OO, Hinds TD, Stec DE. Mechanisms Linking Metabolic-Associated Fatty Liver Disease (MAFLD) to Cardiovascular Disease. Curr Hypertens Rep. 2023;25:151-162. [PubMed] [DOI] |
| 4. | Liu K, Tang S, Liu C, Ma J, Cao X, Yang X, Zhu Y, Chen K, Liu Y, Zhang C, Liu Y. Systemic immune-inflammatory biomarkers (SII, NLR, PLR and LMR) linked to non-alcoholic fatty liver disease risk. Front Immunol. 2024;15:1337241. [PubMed] [DOI] |
| 5. | Lu CF, Cang XM, Liu WS, Wang LH, Huang HY, Sang SM, Wang XQ, Fang XX, Xu F. Association between the platelet/high-density lipoprotein cholesterol ratio and nonalcoholic fatty liver disease: results from NHANES 2017-2020. Lipids Health Dis. 2023;22:130. [PubMed] [DOI] |
| 6. | Mousa N, Salah M, Elbaz S, Elmetwalli A, Elhammady A, Abdelkader E, Abdelsalam M, El-Wakeel N, Mansour M, Hashem M, El-Emam O, Elderiny W, Abdelaziz M, Elgamal A, Habib A. Neutrophil percentage-to-albumin ratio is a new diagnostic marker for spontaneous bacterial peritonitis: a prospective multicenter study. Gut Pathog. 2024;16:18. [PubMed] [DOI] |
| 7. | Chiu TJ, Liu YW, Yong CC, Yin SM, Yeh CH, Chen YY. Combined Serum ALBUMIN with Neutrophil-to-Lymphocyte Ratio Predicts the Prognosis of Biliary Tract Cancer after Curative Resection. Cancers (Basel). 2023;15:5474. [PubMed] [DOI] |
| 8. | Wang G, Zhao Y, Li Z, Li D, Zhao F, Hao J, Yang C, Song J, Gu X, Huang R. Association between novel inflammatory markers and non-alcoholic fatty liver disease: a cross-sectional study. Eur J Gastroenterol Hepatol. 2024;36:203-209. [PubMed] [DOI] |
| 9. | Tan L, Zhou Q, Liu J, Liu Z, Shi R. Association of iron status with non-alcoholic fatty liver disease and liver fibrosis in US adults: a cross-sectional study from NHANES 2017-2018. Food Funct. 2023;14:5653-5662. [PubMed] [DOI] |
| 10. | Liu CF, Chien LW. Predictive Role of Neutrophil-Percentage-to-Albumin Ratio (NPAR) in Nonalcoholic Fatty Liver Disease and Advanced Liver Fibrosis in Nondiabetic US Adults: Evidence from NHANES 2017-2018. Nutrients. 2023;15:1892. [PubMed] [DOI] |
| 11. | Mahemuti N, Jing X, Zhang N, Liu C, Li C, Cui Z, Liu Y, Chen J. Association between Systemic Immunity-Inflammation Index and Hyperlipidemia: A Population-Based Study from the NHANES (2015-2020). Nutrients. 2023;15:1177. [PubMed] [DOI] |
| 12. | Lomonaco R, Godinez Leiva E, Bril F, Shrestha S, Mansour L, Budd J, Portillo Romero J, Schmidt S, Chang KL, Samraj G, Malaty J, Huber K, Bedossa P, Kalavalapalli S, Marte J, Barb D, Poulton D, Fanous N, Cusi K. Advanced Liver Fibrosis Is Common in Patients With Type 2 Diabetes Followed in the Outpatient Setting: The Need for Systematic Screening. Diabetes Care. 2021;44:399-406. [PubMed] [DOI] |
| 13. | Bao B, Xu S, Sun P, Zheng L. Neutrophil to albumin ratio: a biomarker in non-alcoholic fatty liver disease and with liver fibrosis. Front Nutr. 2024;11:1368459. [PubMed] [DOI] |
| 14. | Zawiah M, Khan AH, Abu Farha R, Usman A, AbuHammour K, Abdeen M, Albooz R. Predictors of stroke-associated pneumonia and the predictive value of neutrophil percentage-to-albumin ratio. Postgrad Med. 2023;135:681-689. [PubMed] [DOI] |
| 15. | Wang X, Zhang Y, Wang Y, Liu J, Xu X, Liu J, Chen M, Shi L. The neutrophil percentage-to-albumin ratio is associated with all-cause mortality in patients with chronic heart failure. BMC Cardiovasc Disord. 2023;23:568. [PubMed] [DOI] |
| 16. | Yao J, Xu X, Gong K, Tu H, Xu Z, Ye S, Yu X, Lan Y, Weng H, Shi Y. Prognostic value of neutrophil count to albumin ratio in patients with decompensated cirrhosis. Sci Rep. 2023;13:20759. [PubMed] [DOI] |
| 17. | Zhao X, Yang L, Chang N, Hou L, Zhou X, Yang L, Li L. Neutrophils undergo switch of apoptosis to NETosis during murine fatty liver injury via S1P receptor 2 signaling. Cell Death Dis. 2020;11:379. [PubMed] [DOI] |
| 18. | Huang C, Fan X, Shen Y, Shen M, Yang L. Neutrophil subsets in noncancer liver diseases: Cellular crosstalk and therapeutic targets. Eur J Immunol. 2023;53:e2250324. [PubMed] [DOI] |
| 19. | Lan CC, Su WL, Yang MC, Chen SY, Wu YK. Predictive role of neutrophil-percentage-to-albumin, neutrophil-to-lymphocyte and eosinophil-to-lymphocyte ratios for mortality in patients with COPD: Evidence from NHANES 2011-2018. Respirology. 2023;28:1136-1146. [PubMed] [DOI] |
| 20. | Wang S, Lin X, Zhu C, Dong Y, Guo Y, Xie Z, He X, Ju W, Chen M. Association between nonalcoholic fatty liver disease and increased glucose-to-albumin ratio in adults without diabetes. Front Endocrinol (Lausanne). 2023;14:1287916. [PubMed] [DOI] |
| 21. | Kamal DE, Zaghlol RS, Hussien MHS, Makarm WK. Utility of neutrophil/albumin ratio and C-reactive protein/albumin ratio as novel inflammatory markers in Behcet's disease. Reumatol Clin (Engl Ed). 2023;19:188-196. [PubMed] [DOI] |
| 22. | Nakanishi T, Kawasaki Y, Nakamura Y, Kimura Y, Kawamura K, Shumba MN, Shimokawa N. An implication of the mitochondrial carrier SLC25A3 as an oxidative stress modulator in NAFLD. Exp Cell Res. 2023;431:113740. [PubMed] [DOI] |
| 23. | Condon S, Hu H, Kong M, Cave MC, McClain CJ. ALT poorly predicts Nonalcoholic Fatty Liver Disease (NAFLD) and liver fibrosis as determined by vibration-controlled transient elastography in adult National Health and Nutrition Examination Survey 2017-2018. Am J Med Sci. 2024;367:310-322. [PubMed] [DOI] |
| 24. | Xuan Y, Wu D, Zhang Q, Yu Z, Yu J, Zhou D. Elevated ALT/AST ratio as a marker for NAFLD risk and severity: insights from a cross-sectional analysis in the United States. Front Endocrinol (Lausanne). 2024;15:1457598. [PubMed] [DOI] |
| 25. | Sookoian S, Pirola CJ. The serum uric acid/creatinine ratio is associated with nonalcoholic fatty liver disease in the general population. J Physiol Biochem. 2023;79:891-899. [PubMed] [DOI] |
| 26. | Golabi P, Paik JM, Harring M, Younossi E, Kabbara K, Younossi ZM. Prevalence of High and Moderate Risk Nonalcoholic Fatty Liver Disease Among Adults in the United States, 1999-2016. Clin Gastroenterol Hepatol. 2022;20:2838-2847.e7. [PubMed] [DOI] |