修回日期: 2024-12-20
接受日期: 2024-12-27
在线出版日期: 2025-01-28
黏液样脂肪肉瘤(myxoid liposarcoma, MLS)是一种罕见的起源于间充质组织的恶性肿瘤, 常发生于四肢和腹膜后, 极少发生在肝脏. 通常缺乏特异性临床症状和影像学表现, 尚无明确的治疗策略.
本例患者因"反复右上腹痛12天, 加重3天"就诊, 结合术前检查资料,考虑为肝占位性病变, 囊腺癌考虑. 排除手术禁忌症后行腹腔镜中转开腹复杂肝肿瘤切除术, 术后病理诊断为肝MLS, 术后予EIM方案化疗. 患者术后随访无复发, 治疗效果满意.
肝MLS是一种极为罕见且复杂的恶性肿瘤, 由于其缺乏特异性临床症状和影像学表现, 术前诊断困难, 易与囊性病变相混淆, 术后病理是明确诊断的主要方法. 手术切除联合辅助化疗是其主要的治疗方法. 由于其罕见性, 肝MLS的早期诊断和有效治疗有待进一步研究.
核心提要: 本文报道1例罕见肝黏液样脂肪肉瘤病例. 该病缺乏特异性临床表现和影像学特征. 通过手术切除联合辅助化疗, 患者5年随访未见复发. 本例诊疗经验对提高临床医师对肝黏液样脂肪肉瘤的认识和诊治水平具有重要参考价值.
引文著录: 杜程飞, 吕键宇, 张军港. 肝巨大黏液样脂肪肉瘤1例并文献复习. 世界华人消化杂志 2025; 33(1): 70-74
Revised: December 20, 2024
Accepted: December 27, 2024
Published online: January 28, 2025
Myxoid liposarcoma (MLS) is a rare malignant tumor originating from mesenchymal tissue. It commonly occurs in the extremities and retroperitoneum but is extremely rare in the liver. Typically, it lacks specific clinical symptoms and imaging features, and no definitive treatment strategies have been established.
A patient presented with "recurrent right upper abdominal pain for 12 days with worsening symptoms for 3 days". Based on preoperative examination data, a liver space-occupying lesion was suspected, with cystadenocarcinoma being a consideration. After excluding surgical contraindications, a laparoscopic conversion to open surgery for complex liver tumor resection was performed. The postoperative pathological diagnosis was liver MLS. The patient underwent postoperative chemotherapy with the AIM regimen consisting of ifosfamide, rpirubicin hydrochloride, and Mesna. Postoperative follow-up showed no recurrence, and the treatment outcome was satisfactory.
Hepatic MLS is an extremely rare and complex malignant tumor. Due to its lack of specific clinical symptoms and imaging manifestations, preoperative diagnosis is challenging and it is easily confused with cystic lesions. Postoperative pathology remains the primary method for definitive diagnosis. Surgical resection combined with adjuvant chemotherapy constitutes the main treatment approach. Due to its rarity, further research is needed for early diagnosis and effective treatment of hepatic MLS.
- Citation: Du CF, Lv JY, Zhang JG. Huge hepatic myxoid liposarcoma: A case report and literature review. Shijie Huaren Xiaohua Zazhi 2025; 33(1): 70-74
- URL: https://www.wjgnet.com/1009-3079/full/v33/i1/70.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v33.i1.70
黏液样脂肪肉瘤(myxoid liposarcoma, MLS)是一种罕见的起源于间充质组织的恶性肿瘤, 一般发生四肢和腹膜后, 极少发生在肝脏[1,2]. 肝MLS缺乏特异的临床症状和影像学表现, 术前诊断困难. 由于其罕见性, 肝MLS尚无明确的治疗策略. 因此, 针对这种罕见肿瘤的早期诊断和有效治疗仍是临床和研究的重点. 本文报道1例肝MLS的临床诊疗流程, 提供本中心对肝MLS的诊疗经验.
患者, 男, 48岁. 因"反复右上腹痛12天, 加重3天"于2019-10-07入院.
患者于2019-09-25无明显诱因下出现右上腹胀痛, 随体位改变, 卧位时疼痛加重, 坐立位缓解, 疼痛可忍受, 无伴随黄疸、发热、恶心呕吐、呕血或黑便等症状. 2019-09-30腹痛较前加重, 遂至外院检查, 腹部计算机断层扫描(computerized tomography, CT)提示右肝巨大占位. 为进一步诊治, 以"肝占位性病变"收治入院. 患者自发病以来, 神志清, 精神尚可, 体力、食欲、睡眠正常, 体重无明显变化, 大小便无特殊.
无肝胆胰疾病病史.
患者饮酒30年(每日约150 mL), 吸烟30年(每日约10支). 无相关遗传性疾病史.
体温36.8 ℃, 心率80次/分, 呼吸18次/分, 血压130/89 mmHg. 神志清楚, 精神状态良好, 全身浅表淋巴结未触及肿大, 巩膜无黄染. 腹平软, 无胃肠型及蠕动波, 无腹壁静脉曲张, 右上腹压痛, 无反跳痛及腹肌紧张, 肝肋下2 cm, 剑突下1 cm可触及, 质地韧, 边缘锐利, 表面光滑, 无波动感. 脾肋下未触及, Murphy征阴性. 肠鸣音4次/分, 无移动性浊音, 双肾区无叩击痛, 双下肢无水肿.
血常规、凝血功能未见明显异常; 生化: 白蛋白(albumin, Alb): 43.4 g/L, 谷丙转氨酶(alanine aminotransferase, ALT): 59 U/L, 谷草转氨酶(aspartate aminotransferase, AST): 45 U/L; 谷氨酰转肽酶(gamma-glutamyl transpeptidase, GGT): 193 U/L; 碱性磷酸酶(alkaline phosphatase, ALP): 155 U/L; 总胆红素(total bilirubin, TBil): 15 μmol/L; 肿瘤标志物: 甲胎蛋白(alpha-fetoprotein, AFP): 2.4 μg/L; 糖类抗原199(carbohydrate antigen199, CA19-9): 4.8 U/mL; 糖类抗原125(carbohydrate antigen125, CA12-5): 60.2 U/mL; 癌胚抗原(carcinoembryonic antigen, CEA): 1.4 μg/L.
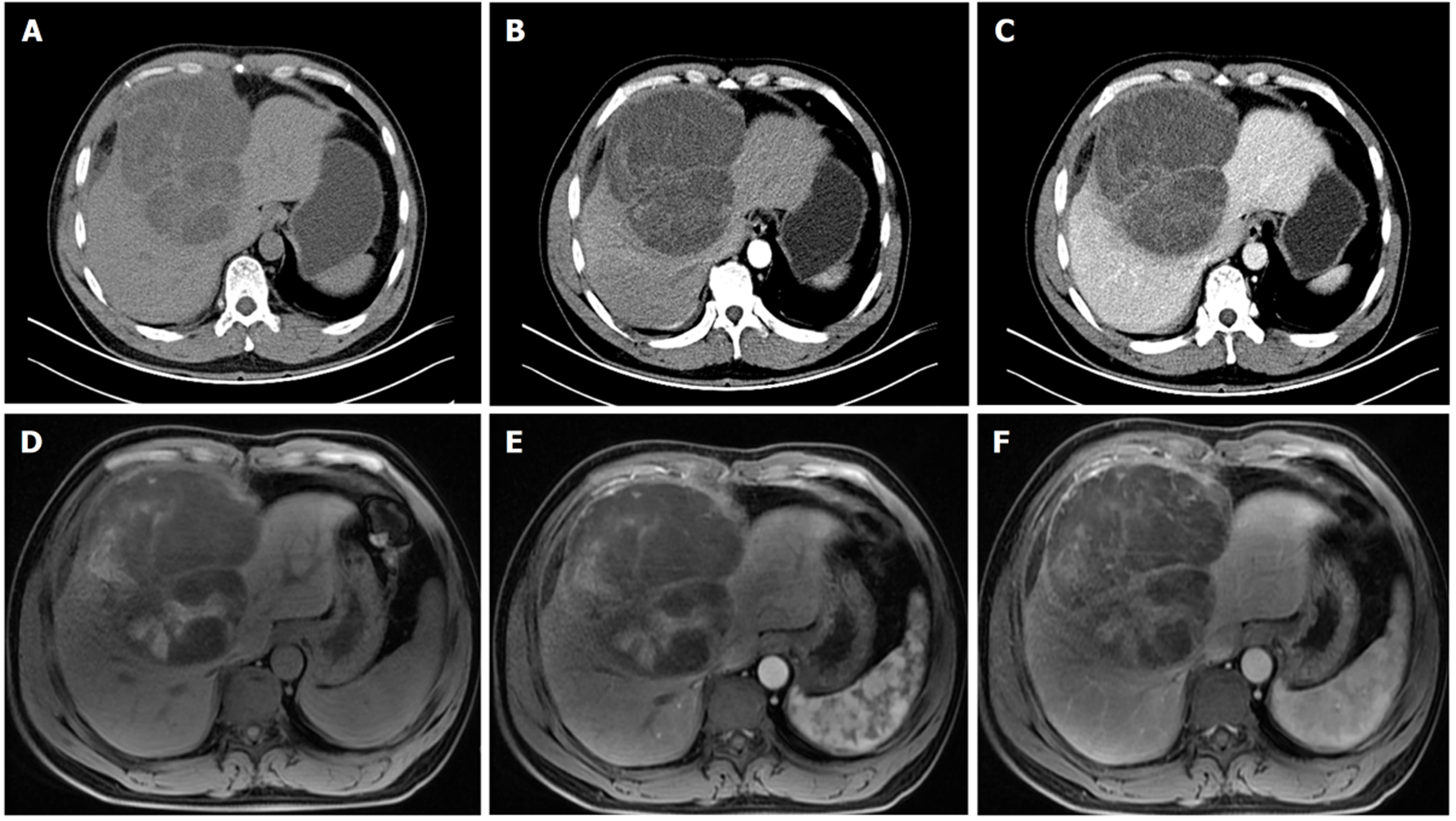
腹部增强CT: 肝右叶及肝前间隙见团块状混杂低密度灶, 大小约127 mm×131 mm, 内可见分隔及条索状高密度影, 增强扫描分隔及条索强化, 肝内血管分布走行正常, 腔内未见充盈缺损(图1). 考虑肝脏来源肿瘤性病变, 囊腺癌可能. 不完全除外腹腔肿瘤性病变侵犯肝内. 腹部增强核磁共振成像(magnetic resonance imaging, MRI): 右隔下至肝左右交界处见一团块状混杂异常信号, T2加权成像呈高信号, 内见低信号液平, 并见低信号分隔影, T1加权成像呈低信号, 其内混杂高信号, 弥散加权成像呈高低混杂信号, 大小约127 mm×131 mm, 增强扫描分隔及实性成分强化, 肝右静脉显示不清(图1). 考虑偏恶性肿瘤, 肝脏来源囊腺癌可能, 不除外膈下间叶源性肿瘤.
肝占位性病变, 囊腺癌考虑.
结合术前检查资料, 肝内占位性病变首先考虑囊腺癌可能. 术前肝功能Child-Pugh A级, 手术指征明确. 排除手术禁忌症后于2019-10-11行腹腔镜中转开腹复杂肝肿瘤切除术治疗, 术中见腹腔内陈旧性血液, 约100 mL, 大网膜包绕肿瘤, 致密粘连, 肿瘤位于左肝内叶, 外生性生长, 大小约15 cm×12 cm, 质软, 部分包膜可见破口, 少量胆汁样及暗血性液体流出. 术中冰冻提示: 左肝内叶肿瘤: 恶性肿瘤, 间叶源性可能性大. 术后予抗感染、护肝、补液等对症支持治疗后恢复良好出院.
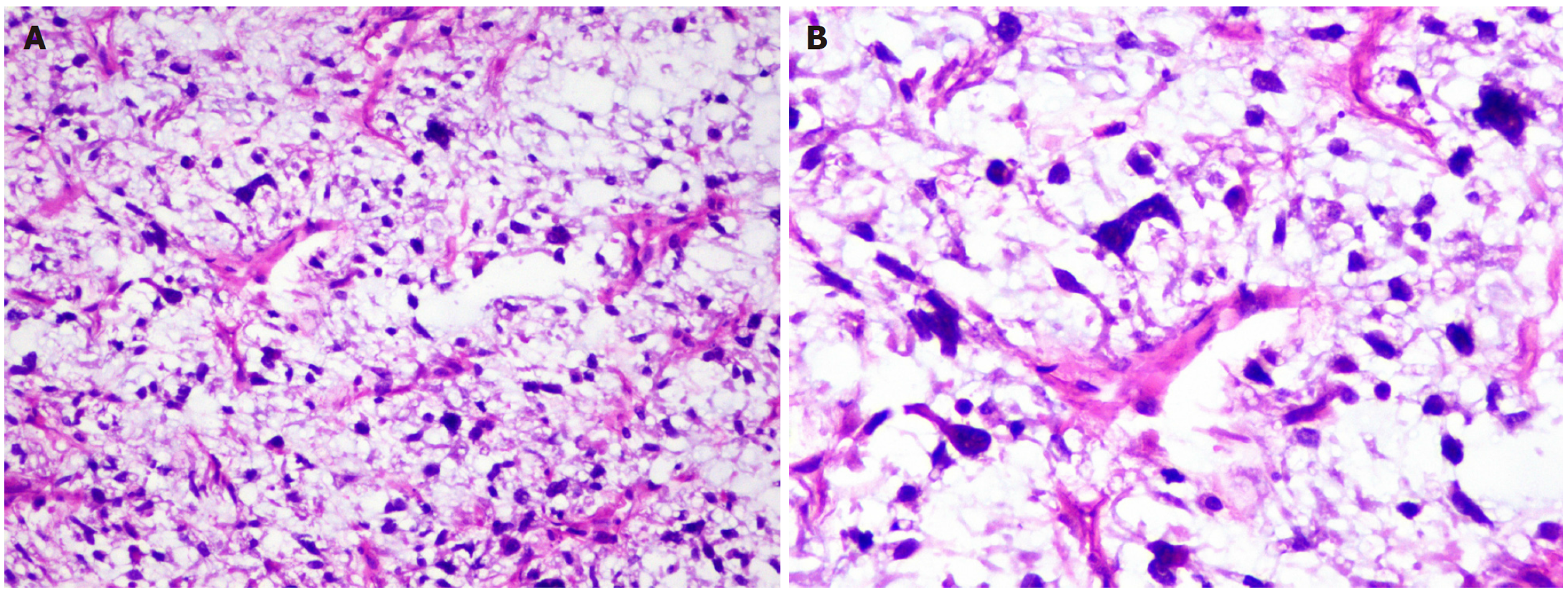
术后病理显示: 左肝内叶肿瘤, 灰黄灰红结节样肿物, 大小13 cm×11 cm×9 cm, 切面灰黄, 局部青色伴坏死, 质软, 肿物被膜完整. "左肝内肿物"间叶源性恶性肿瘤, 大小13 cm×11 cm×9 cm. 免疫组化染色结果: A6-4: MDM2(-)、P16(+)、CKD4(-)、Ki67(+10%)、HMB45(Melanoma)(-)、CK(Pan)(-)、CK34(-)、MyoDl(-)、Myogenin(-)、Caldesmon(-)、Bcl-2(-). 结合形态学与免疫组化, 倾向黏液样脂肪肉瘤(图2).
术后第2天开始进食流质饮食, 第3天逐步过渡至半流质饮食, 随后逐渐恢复至正常饮食. 患者术后早期活动良好, 动态监测血常规及肝功能指标均未见明显异常. 术后第5天复查腹部CT显示腹腔内无明显积液, 拔除腹腔引流管后恢复顺利, 于术后第8天出院. 患者从2019-11开始在外院接受了6个周期的EIM方案化疗(异环磷酰胺/盐酸表柔比星/美斯纳).
出院后每年电话随诊, 随访截止2024-11-20, 术后近5年未见复发和转移.
脂肪肉瘤是一种罕见的起源于间充质组织的恶性肿瘤, 约占所有成人软组织肉瘤的25%[1]. 根据2020版世界卫生组织软组织肿瘤分类, 脂肪肉瘤共有5个亚型: 高分化脂肪肉瘤、去分化脂肪肉瘤、MLS、多形性脂肪肉瘤、黏液样多形性脂肪肉瘤[1]. MLS通常位于四肢和腹膜后, 极少发生在肝脏[2]. MLS患者通常起病隐匿, 缺乏特异性临床表现, 往往因肿块巨大压迫邻近组织而出现上腹部疼痛前来就诊, 因此肿瘤直径通常超过10 cm[3].
目前文献报道显示, 原发性肝MLS的发病年龄范围为2岁至86岁, 平均47岁, 无明显性别差异[4,5]. 其临床症状多与肿瘤的压迫效应有关, 包括腹痛、恶心、呕吐、黄疸和体重下降等, 但这些症状缺乏特异性, 易与其他肝脏占位性病变混淆[4]. 实验室检查提示肝功能指标(如ALT、AST、GGT和TBil)异常, 但肿瘤标志物未显示明显诊断价值, 仅个别病例出现CA199水平升高[4]. 本例患者年龄48岁, 符合脂肪肉瘤的平均发病年龄特点, 其主要症状为反复右上腹痛, 这与文献中因肿块压迫周围神经、血管和器官而引发腹痛的报道一致, 实验室检查中, 患者肝功能异常, ALT、AST、GGT和ALP均升高, 但肿瘤标志物(AFP、CA199)无显著变化, 这也与既往研究中肿瘤标志物缺乏特异性一致.
术前影像学检查对于评估肿瘤位置、大小、邻近组织侵袭程度及转移情况具有重要价值. 腹部增强CT扫描通常显示为边界清晰的低密度与软组织密度混杂肿块, 内部偶尔可见分隔[6]. 与CT相比, 增强MRI能够提供更高的软组织对比度, 是评估MLS的首选影像学检查方法. MLS往往具有较高含水量, 其在T1加权成像序列通常呈低信号, 在T2加权成像序列呈高信号, 可能与囊性病变相似, 需进一步鉴别[7]. 肿瘤内含有的黏液样成分以及其他非脂肪、非黏液样成分在增强后可表现出异质性强化[4]. 此外, MLS的特征性影像学表现还包括多叶状边界、病灶周围T2信号增强以及内部分隔, 这些特征在鉴别诊断中具有一定价值[8].
肝MLS的诊断主要依赖于组织病理学检查. 镜下可见MLS通常由黏液样基质中非脂肪生成的梭形细胞组成, 并伴有独特的树枝状毛细血管网络. 组织中偶见散在的多空泡成脂细胞[9]. 部分MLS组织内可见圆形细胞区域, 当圆形细胞比例超过5%时, 即定义为高级别MLS[7]. 这些圆形细胞的细胞核通常比纯MLS中的梭形细胞更大且更深染. 此外, 高级别MLS中有丝分裂像增多、核仁显著及肿瘤坏死等特征较纯MLS更常见[10]. 本病例术后病理确诊为MLS, 其肿瘤切面呈灰黄色, 伴局部坏死, 组织学特点为大量黏液样基质中分布梭形细胞及圆形细胞, 并形成特征性的树枝状毛细血管网络. 免疫组化显示Ki-67增殖指数为10%, 提示增殖活跃. 虽然文献报道中[5], 当圆形细胞的比例超过5%时被定义为高级别MLS, 本病例未检测到显著比例的圆形细胞, 仍倾向为纯MLS. 这与患者术后近5年随访未见复发和转移的良好预后相符. 遗传学研究显示, MLS的特征性改变是t(12;16)(q3;p11)易位, 这导致95%以上的病例形成FUS-DDIT3融合基因. 其余5%的病例中, 发生t(12;22)(q13;q12)易位, 形成EWSR1-DDIT3融合基因[11]. 在肝MLS中, DDIT3通常呈弥漫性过表达, 利用DDIT3免疫组织化学可作为诊断MLS的重要工具[10].
MLS是一种恶性程度较低的肿瘤, 发生复发转移的风险低, 10年总生存率接近70%[12]. 圆形细胞被认为是MLS的一种高级别、细胞特异性变体, 与不良的预后相关[1]. 据报道高级别MLS复发和转移的风险较高, 生存率可低至20%[13].
肝MLS由于极为罕见, 目前尚无统一的临床指南. 根治性手术切除是肝MLS的主要治疗方式. 本病例患者因肿瘤局限于肝脏, 手术切除具备较高的根治性. 对于晚期不可切除或转移性MLS患者, 化疗仍是首选. 对于MLS, 以蒽环类药物为基础的化疗方案被视为标准的一线治疗[14]; 此外, 研究表明MLS对曲贝替定具有较高的敏感性[15], 这为晚期患者提供了额外的治疗选择. 但由于肝MLS病例的罕见性, 目前关于辅助治疗的报道较为有限, 其对长期生存获益的影响尚未明确. 术后患者接受了6个周期的EIM方案化疗(异环磷酰胺/盐酸表柔比星/美斯纳), 该方案是脂肪肉瘤常用的化疗方案之一, 主要针对具有较高复发或转移风险的病例[4]. MLS具有高度的放疗敏感性[15], 但由于肝脏的总体积对辐射剂量的耐受性有限, 并且由于肿瘤体积通常较大, 因此放射治疗并不推荐用于肝MLS.
本病例患者术后恢复良好, 随访近5年未见复发或转移. 文献报道显示, MLS的10年生存率可达70%, 但预后与多种因素相关, 如年龄较大(>45岁)、组织学分级高、肿瘤坏死及圆形细胞比例升高均提示较差的预后[6]. 本例患者年龄接近高危范围, 但因病理未显示明显高级别特征, 且术后治疗及时, 可能是其预后良好的关键因素.
肝MLS是一种极为罕见且复杂的恶性肿瘤, 由于缺乏特异的临床症状和影像学表现, 确诊依赖于组织病理学. 当前, 根治性手术切除联合辅助化疗是主要的治疗手段, 但由于患者数量少的限制, 关于辅助治疗的疗效尚未明确. 鉴于其罕见性, 需进一步积累病例并开展系统性研究, 以制定更为规范的诊疗指南.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): 0
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Sbaraglia M, Bellan E, Dei Tos AP. The 2020 WHO Classification of Soft Tissue Tumours: news and perspectives. Pathologica. 2021;113:70-84. [PubMed] [DOI] |
| 2. | Lee ATJ, Thway K, Huang PH, Jones RL. Clinical and Molecular Spectrum of Liposarcoma. J Clin Oncol. 2018;36:151-159. [PubMed] [DOI] |
| 3. | Muhsen BA, Ghzawi A, Fares AS, Al-Hussaini M, Salah S. Metastatic myxoid liposarcoma of the brain: a case report and review of the literature. Future Sci OA. 2021;7:FSO756. [PubMed] [DOI] |
| 4. | Liu W, Liang W, Peng Z. Positron emission tomography/computed tomography manifestations of primary hepatic myxoid liposarcoma: A case report. Medicine (Baltimore). 2018;97:e12307. [PubMed] [DOI] |
| 5. | Binesh F, Akhavan A, Kargar S, Navabii H. Primary liposarcoma of liver: a rare case and literature review. BMJ Case Rep. 2012;2012. [PubMed] [DOI] |
| 6. | 刘 云, 肖 新广. 黏液样脂肪肉瘤的影像学诊断并文献复习. 中国中西医结合影像学杂志. 2021;19:282-285. [DOI] |
| 7. | Encinas Tobajas VM, Almeida González C, Marcilla D, Vallejo M, Cano Rodríguez A, Reina Sánchez de Movellán JI, Morales Pérez JM. Myxoid liposarcoma: MRI features with histological correlation. Radiologia (Engl Ed). 2023;65 Suppl 2:S23-S32. [PubMed] [DOI] |
| 8. | Gimber LH, Montgomery EA, Morris CD, Krupinski EA, Fayad LM. MRI characteristics associated with high-grade myxoid liposarcoma. Clin Radiol. 2017;72:613.e1-613.e6. [PubMed] [DOI] |
| 9. | de Vreeze RS, de Jong D, Koops W, Nederlof PM, Ariaens A, Haas RL, van Coevorden F. Oncogenesis and classification of mixed-type liposarcoma: a radiological, histopathological and molecular biological analysis. Int J Cancer. 2011;128:778-786. [PubMed] [DOI] |
| 10. | Scapa JV, Cloutier JM, Raghavan SS, Peters-Schulze G, Varma S, Charville GW. DDIT3 Immunohistochemistry Is a Useful Tool for the Diagnosis of Myxoid Liposarcoma. Am J Surg Pathol. 2021;45:230-239. [PubMed] [DOI] |
| 11. | Ibstedt S, de Mattos CBR, Köster J, Mertens F. A cryptic EWSR1::DDIT3 fusion in myxoid liposarcoma: Potential pitfalls with FISH and cytogenetics. Genes Chromosomes Cancer. 2023;62:167-170. [PubMed] [DOI] |
| 12. | Dürr HR, Rauh J, Baur-Melnyk A, Knösel T, Lindner L, Roeder F, Jansson V, Klein A. Myxoid liposarcoma: local relapse and metastatic pattern in 43 patients. BMC Cancer. 2018;18:304. [PubMed] [DOI] |
| 13. | Muratori F, Bettini L, Frenos F, Mondanelli N, Greto D, Livi L, Franchi A, Roselli G, Scorianz M, Capanna R, Campanacci D. Myxoid Liposarcoma: Prognostic Factors and Metastatic Pattern in a Series of 148 Patients Treated at a Single Institution. Int J Surg Oncol. 2018;2018:8928706. [PubMed] [DOI] |
| 14. | Dalal S, Shan KS, Thaw Dar NN, Hussein A, Ergle A. Role of Immunotherapy in Sarcomas. Int J Mol Sci. 2024;25:1266. [PubMed] [DOI] |
| 15. | Sanfilippo R, Hindi N, Cruz Jurado J, Blay JY, Lopez-Pousa A, Italiano A, Alvarez R, Gutierrez A, Rincón-Perez I, Sangalli C, Pérez Aguiar JL, Romero J, Morosi C, Sunyach MP, Fabbroni C, Romagosa C, Ranchere-Vince D, Dei Tos AP, Casali PG, Martin-Broto J, Gronchi A. Effectiveness and Safety of Trabectedin and Radiotherapy for Patients With Myxoid Liposarcoma: A Nonrandomized Clinical Trial. JAMA Oncol. 2023;9:656-663. [PubMed] [DOI] |