修回日期: 2024-08-26
接受日期: 2024-09-19
在线出版日期: 2024-09-28
一线核苷(酸)类似物(nucleos(t)ide analogues, NAs)经治后发生低病毒血症(low-level viremia, LLV)的慢乙肝患者, 继续使用NAs治疗的远期临床结局的研究尚缺乏.
采用系统评价和Meta分析对慢乙肝经一线NAs治疗的LLV患者继续原NAs治疗和更换不同NAs治疗方案远期临床结局情况进行评价.
经计算机检索PubMed、Embase、Web of Science、Cochrane Library数据库和中国知网(CNKI)、万方数据库, 选取符合纳入标准的研究, 使用R 4.3.1软件对纳入研究数据进行Meta分析.
最终纳入11篇文献, 涉及3153例慢乙肝LLV患者, 其中7篇文献进行HBV DNA阴转率定量Meta分析, 结果提示更换NAs方案组继续治疗24 wk[RR = 4.23, 95%CI(2.47, 7.24), P<0.01]和48 wk [RR = 2.90, 95%CI(1.75, 4.81), P<0.01]后HBV DNA阴转率明显高于继续原NAs方案组; 纳入6篇文献进行HBeAg阴转率的定量Meta分析, 更换NAs治疗方案组24 wk HBeAg阴转率高于继续原方案组[RR = 2.31, 95%CI(1.28, 4.19), P<0.01], 但48 wk两组HBeAg阴转率差异无统计学意义[RR = 1.50, 95%CI(0.88, 2.54), P = 0.13]; 纳入3篇文献进行终末期肝病发生率的定性系统评价, 结果显示继续NAs治疗的LLV组患者远期终末期肝病发生率均高于维持病毒学应答(maintain virological response, MVR)组, 差异均具有统计学意义(P<0.05).
更换NAs治疗方案可提高慢乙肝LLV患者HBV DNA阴转率和HBeAg阴转率, 但继续NAs方案治疗的慢乙肝LLV患者远期终末期肝病发生率较MVR患者高.
核心提要: 临床上对于慢乙肝低病毒血症(low-level viremia, LLV)患者继续行一线核苷(酸)类似物(nucleos(t)ide analogues, NAs)治疗远期临床结局情况的研究相对缺乏, 但真实世界存在大量慢乙肝LLV患者长期使用NAs治疗的情况, 对于此类患者远期临床结局的研究尤为必要. 顾本文行系统评价和Meta分析评估慢乙肝经LLV患者继续原NAs治疗和更换不同NAs治疗方案远期临床结局情况.
引文著录: 陈和敏, 夏明, 郑旭锋, 郑积才. 慢乙肝低病毒血症患者继续核苷(酸)类似物治疗的远期临床结局: 一项系统评价和Meta分析. 世界华人消化杂志 2024; 32(9): 686-694
Revised: August 26, 2024
Accepted: September 19, 2024
Published online: September 28, 2024
For chronic hepatitis B patients who develop low-level viremia (LLV) after treatment with first-line nucleos(t)ide analogues (NAs), there is still a lack of research on the long-term clinical outcomes of continuing NAs therapy.
To evaluate the long-term clinical outcomes of continuing the original NAs therapy vs switching to a different NAs regimen in patients with chronic hepatitis B experiencing LLV after first-line NAs treatment through a systematic review and meta-analysis.
Relevant studies were selected through computer searches of PubMed, Embase, Web of Science, Cochrane Library, Chinese National Knowledge Infrastructure (CNKI), and Wanfang databases. R4.3.1 software was used for meta-analysis of the included studies.
A total of 11 articles involving 3153 chronic hepatitis B patients with LLV were included. Among them, 7 articles conducted quantitative meta-analysis of HBV DNA seroconversion rate, indicating that the HBV DNA seroconversion rate in the group switching to a new NAs regimen after 24 wk [relative risk (RR) = 4.23, 95% confidence interval (CI): 2.47-7.24), P < 0.01] and 48 wk (RR = 2.90, 95%CI: 1.75-4.81, P < 0.01) of continued treatment was significantly higher than that of the group continuing the original NAs regimen. Six articles conducted quantitative meta-analysis of HBeAg seroconversion rate, showing that the HBeAg seroconversion rate of the group switching to a new NAs treatment regimen after 24 wk was higher than that of the group continuing the original regimen (RR = 2.31, 95%CI: 1.28-4.19, P < 0.01), but there was no significant difference between the two groups when switching occured at 48 wk (RR = 1.50, 95%CI: 0.88-2.54, P = 0.13). Qualitative systematic evaluation of the incidence of end-stage liver disease was conducted in 3 articles, showing that the LLV group continuing NAs treatment had a significantly higher incidence of long-term end-stage liver disease compared to the maintained virological response (MVR) group (P < 0.05).
Switching to a new NAs regimen can improve the long-term HBV DNA and HBeAg seroconversion rates in chronic hepatitis B patients with LLV, but the incidence of end-stage liver disease in patients continuing NAs treatment is significantly higher than that of patients with MVR.
- Citation: Chen HM, Xia M, Zheng XF, Zheng JC. Long-term clinical outcomes of maintenance therapy with nucleos(t)ide analogues in chronic hepatitis B patients with low-level viremia: A systematic review and meta-analysis. Shijie Huaren Xiaohua Zazhi 2024; 32(9): 686-694
- URL: https://www.wjgnet.com/1009-3079/full/v32/i9/686.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i9.686
2016年, 第69届世界卫生大会提出2030年消除病毒性肝炎公共卫生危害的目标, 各国陆续出台了有关控制乙型肝炎病毒(hepatitis B virus, HBV)感染及加强HBV感染人群筛查和诊治的相关政策, 目前全世界范围内乙肝的控制取得了明显的成效, 但慢乙肝相关终末期肝病死亡率仍居高不下, 目前乙型肝炎防治形势仍然严峻[1]. 当前慢乙肝治疗方式主要以口服一线核苷(酸)类似物(nucleos(t)ide analogues, NAs)及注射聚乙二醇干扰素为主, 但是大量的临床数据发现口服NAs药物48 wk以后仍有一部分患者持续或间断可检出HBV DNA在20-2000 IU/mL, 目前有关研究把这种情况定义为低病毒血症(low-level viremia, LLV)[2]. LLV的发生与患者的治疗基础情况有关, 但是对于继续行NAs治疗的LLV患者临床结局情况的研究目前还很少, 本研究就LLV慢乙肝患者继续行NAs治疗远期临床结局做一项系统评价和Meta分析, 希望相关结果能对临床工作提供一定的参考.
纳入标准: (1)研究对象为: 慢乙肝合并LLV并且继续使用NAs治疗的患者, 年龄≥18岁; (2)LLV定义为: 接受一线NAs治疗, 如恩替卡韦(entecavir, ETV)、富马酸替诺福韦二吡呋酯(tenofovir disoproxil fumarate, TDF)、丙酚替诺福韦(tenofovir alafenamide fumarate, TAF)或艾米替诺福韦(tenofovir amibufenamide, TMF)且依从性好的慢乙肝患者, 治疗48 wk或1年及以上, 仍可检测到HBV DNA并且定量<2000 IU/mL者定义为LLV[2], 检测下线至少≤20 IU/mL; (3)发生LLV患者继续行NAs治疗, NAs方案不做限制; (4)结局指标: HBV DNA阴转率、HBeAg血清阴转率以及终末期肝病事件发生率. (5)良好的药物依从性定义为服用NAs药物的患者中每个研究周期的累积依从性≥90%[3,4].
排除标准: (1)非NAs治疗后引起的低病毒载量患者; (2)纳入患者基线已患有终末期肝病事件(如肝细胞癌、失代偿期肝硬化)以及其他恶性肿瘤; (3)合并其他病毒感染(甲型肝炎病毒、丙型肝炎病毒、丁型肝炎病毒、戊型肝炎病毒、巨细胞病毒、EB病毒、人类免疫缺陷病毒等), 合并自身免疫性肝病、系统性自身免疫性疾病及其他严重疾病(严重心、肺、肾疾患, 精神类疾病等); (4)孕妇、哺乳期妇女、未成年等; (5)研究类型为动物研究、综述、Meta分析、会议类文献, 资料不全、无法获取结局指标的文献, 中英文重复类文献等.
分组: 本研究对照组定义为: 慢乙肝患者发生LLV后继续使用原NAs方案治疗组; 实验组定义为: 研究中发生LLV后更换NAs方案, 包括更换或联合另一种NAs的联合治疗组.
本研究已在PRISMA网站注册, 注册ID为: CRD42024530183.
1.2.1 文献检索策略: 采用主题词检索和自由词检索相结合方式, 经计算机检索PubMed、Embase、Web of Science、Cochrane Library数据库和中国知网(CNKI)、万方数据库, 检索时间从建库至2024-03-14. 中文数据库检索词主要为: "乙肝"、"乙型肝炎"、"低病毒血症"; 英文数据库检索词主要为: "Hepatitis B"、"Hepatitis B Virus Infection"、"low-level viremia"、LLV等.
1.2.2 文献筛选与提取: 文献的筛选和提取均有2名研究者严格按照文献的纳入和排除标准完成, 产生分歧或结果不一致时共同商量决定, 如遇到分歧则由第3名专业人员决定. 采用文献管理器Endnote自动剔除重复文献, 然后根据题目、摘要进行初筛, 最后获取全文进一步判断是否纳入文献. 数据提取采用Excel软件进行输入和管理, 主要纳入文献信息包括: 作者、发表年份、国家、用药方案、基线资料、结局指标.
1.2.3 文献质量评估: 所有纳入的研究均通过(Newcastle-Ottawa Scale, NOS)量表进行质量评估. 该量表通过三大模块共八个条目的方法评价队列研究, 具体包括研究对象选择(selection)、组间可比性(comparability)、暴露(exposure)/结果(outcome)评价[5]. NOS对文献质量的评价采用了星级系统的半量化原则, 除comparability最高可评2星外, 其余条目最高可评1星, 满分为9星, 分值越高提示研究质量越高, 其中0-3分、4-6分和7-9分定义为低质量、中等质量和高质量. 研究的质量由2位研究员独立完成, 若有歧义则经过商议达成一致意见.
统计学处理 使用R 4.3.1软件对最终纳入文献进行Meta分析, 根据I2和Q检验评估检验异质性大小, I2值为25%、50%和75%分别代表低、中、高异质性. 当I2>50%, P<0.05, 采用随机效应模型(Random effects model)计算合并效应值, 相反则使用固定效应模型(Fixed effects model), 采用R语言中的Meta包进行Meta分析、发表偏倚、敏感性分析, 采用forestplot包进行森林图的绘制. 发表偏倚在系统综述和Meta分析中是影响分析结果有效性的主要因素之一, 本文采用Egger检验评估潜在的发表偏倚, 采用敏感性分析来评估Meta分析结果的稳健性和可靠性. 双侧P<0.05认为有统计学意义.
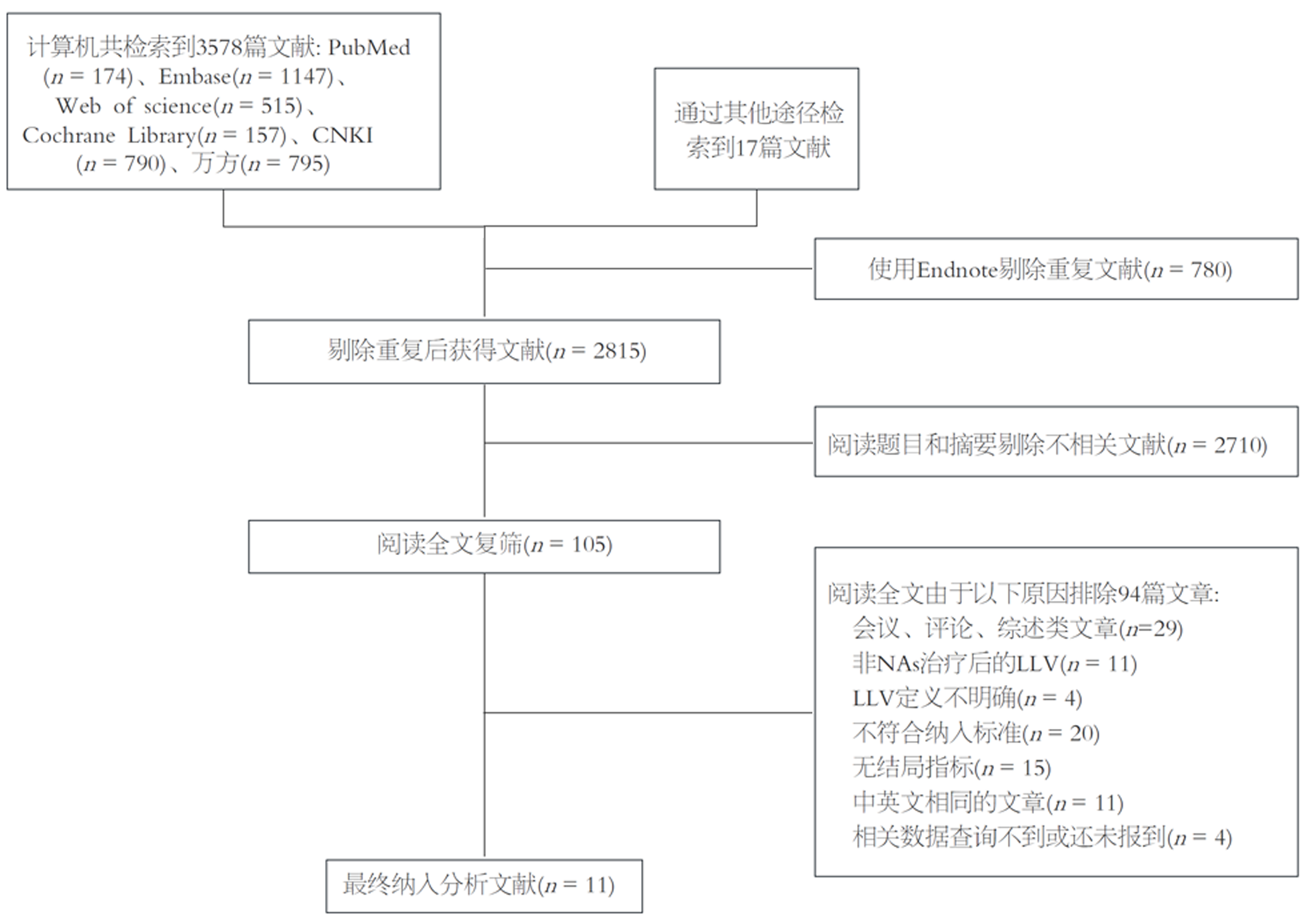
我们使用计算机最终检索到3578篇文献, 手动检索到17篇文献, 通过Endnote软件去除重复文献780篇, 再通过阅读标题和摘要排除2710文献. 剩下的文献中, 经过阅读全文由于以下原因排除94篇文章: 会议、评论、综述类文章(n = 29), 非NAs治疗后的LLV(n = 11), LLV定义不明确(n = 4), 不符合纳入标准(n = 20), 无法获取结局指标(n = 15), 中英文相同的文章(n = 11), 相关数据查询不到或还未报到(n = 4). 最终纳入11篇文献, 其中7篇为中文, 4篇为英文, 具体见图1. 纳入研究的基本信息见表1.
| 作者/年份 | 国家 | 样本量(n) | 年龄/岁 | 性别(男/女) | HBeAg阳性人数 | 代偿期肝硬化人数 | 治疗周期 | |||||
| T | C | T | C | T | C | T | C | T | C | |||
| 陈文辉等[7], 2021 | 中国 | 45 | NA | 39.4±7.2 | NA | Nov-34 | NA | NA | NA | NA | NA | 48周 |
| 程海林等[8], 2022 | 中国 | 80 | 80 | 35.6±8.5 | 35.8±8.3 | 47/33 | 48/32 | NA | NA | NA | NA | 24周 |
| 张娟[10], 2022 | 中国 | 145 | 333 | 40.2±1.3 | 41.3±0.6 | 107/38 | 261/72 | 105 | 212 | 38 | 102 | 96周 |
| 高扬[11], 2023 | 中国 | 160 | 86 | 43.7±9.2 | 42.1±10.6 | 127/42 | 62/24 | 120 | 55 | 48 | 26 | 48周 |
| 李光海[12], 2023 | 中国 | 108 | 76 | 42.5±9.6 | 40.5±7.8 | 71/37 | 45/31 | 75 | 55 | 35 | 28 | 48周 |
| 刘丽萍等[13], 2023 | 中国 | 25 | 17 | 31.0(27.0, 39.0) | 27/15 | 36 | NA | NA | 48周 | |||
| 王玉珊[9], 2022 | 中国 | 63 | 74 | 38.6(30.0, 47.0) | 41.8(32.0, 50.0) | 35/28 | 42/32 | 47 | 49 | NA | NA | 48周 |
| Li等[6], 2021 | 中国 | 102 | 109 | 46.9±13.0 | 47.8±10.6 | 79/23 | 89/20 | 63 | 77 | 37 | 27 | 24周 |
| Lee等[14], 2020a | 韩国 | 108 | 509 | 51.1±11.7 | 52.9±11.0 | 87/21 | 313/196 | 81 | 281 | 40 | 257 | 11年 |
| Zhang等[16], 2021a | 中国 | 203 | 471 | 44.0(35.0, 52.0) | 44.0(34.0, 52.0) | 153/50 | 335/136 | 136 | 244 | 60 | 140 | 10年 |
| Shin等[15], 2021a | 韩国 | 35 | 324 | 54.0±11.0 | 53.0±9.0 | 28/7 | 203/121 | NA | NA | 35 | 324 | 2年 |
本文共纳入11篇文献, 均为队列研究, 共涉及3153例慢乙肝LLV患者, 9篇研究来自中国, 2篇来自韩国. 其中有8篇文献报道了HBV DNA阴转率、HBeAg血清阴转率[6-13], 研究周期在48 wk左右; 3篇文献报道了终末期肝病事件发生率[14-16], 研究周期均超过1年. 利用NOS量表对上述纳入研究进行质量评价, 所有研究评分均≥6分, 具体见表2.
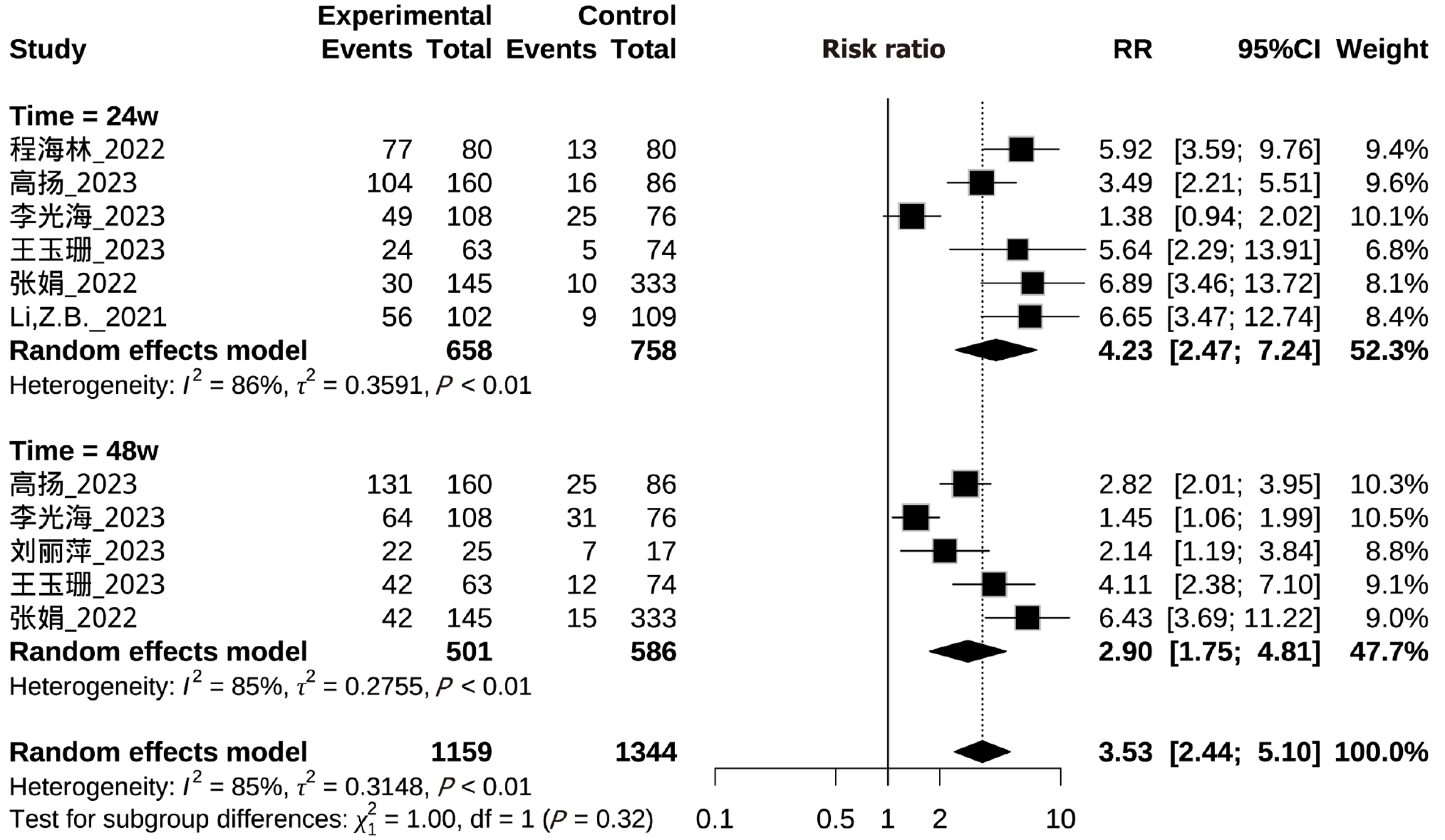
共纳入7项研究, 其中有4项研究同时包含了研究周期24 wk和48 wk HBV DNA阴转率[9-12], 有2项研究只包含24 wk HBV DNA阴转率[6,8], 有1项研究只包含48 wk HBV DNA阴转率[13]. 另外有1项研究无对照组, 只有试验组, 只进行定性描述[7]. 纳入Meta分析的7项研究, 研究周期24 wk异质性检验I2为86%, 48 wk异质性检验I2为85%, P<0.01, 均采用随机效应模型进行Meta分析. 结果显示LLV患者继续NAs治疗后, 试验组HBV DNA阴转率在24 wk [RR = 4.23, 95%CI(2.47, 7.24), P<0.01]和48 wk [RR = 2.90, 95%CI(1.75, 4.81), P<0.01]的均高于对照组, 总体HBV DNA阴转率也高于对照组[RR = 3.53, 95%CI(2.44, 5.10), P<0.01], 两亚组之间差异不具有统计学意义(P = 0.32). 陈文辉[7]研究无对照组, 研究结果提示更换方案后慢乙肝LLV患者24 wk和48 wk的HBV DNA阴转率分别为73.33%和91.11%. 具体见图2.
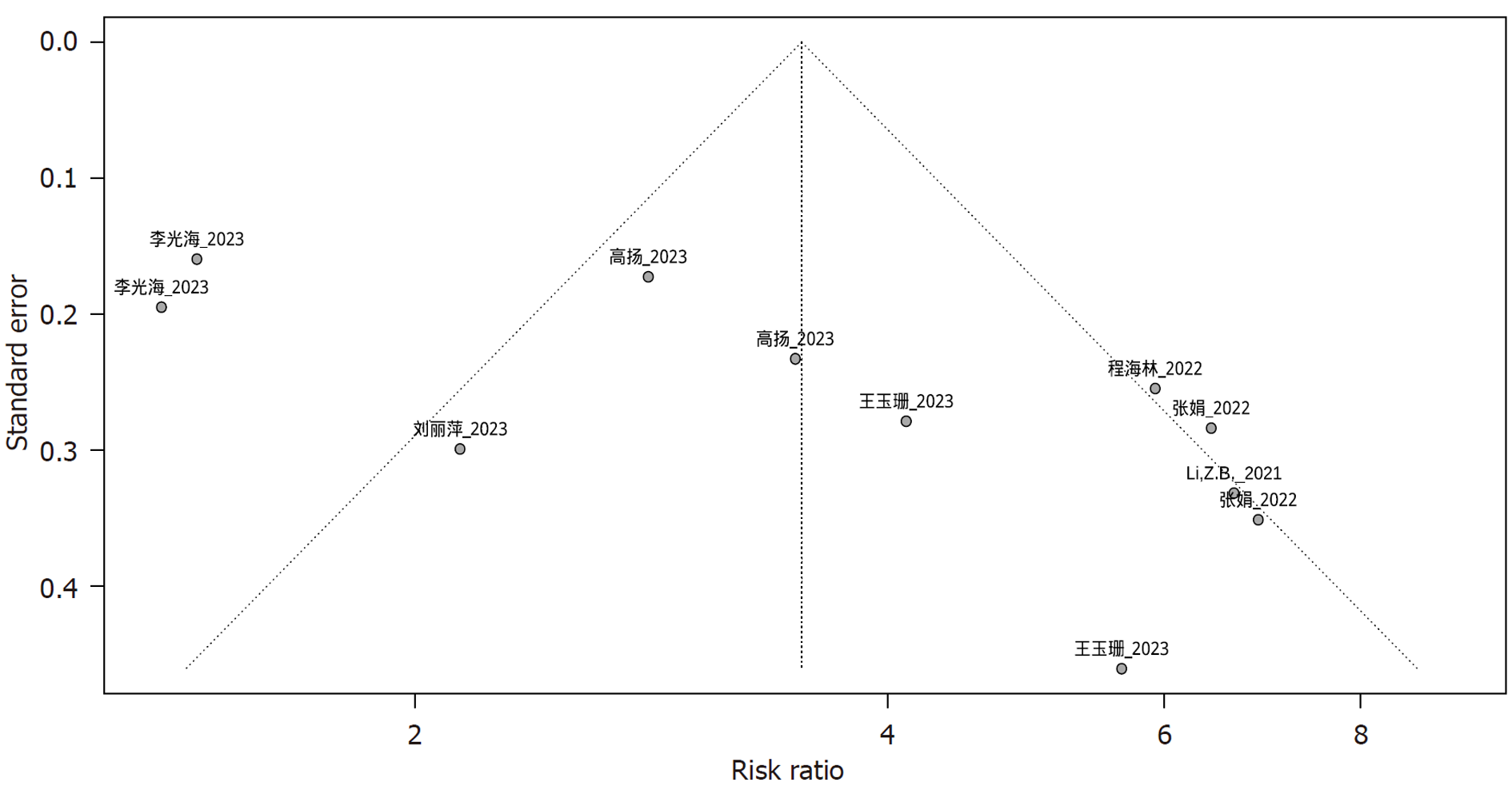
2.3.1 发表偏倚: 纳入HBV DNA阴转率Meta分析研究的漏斗图显示两侧不对称, 继续性Egger检验结果提示P = 0.01, 表示纳入行HBV DNA阴转率Meta分析的研究可能存在发表偏倚. 具体见图3.
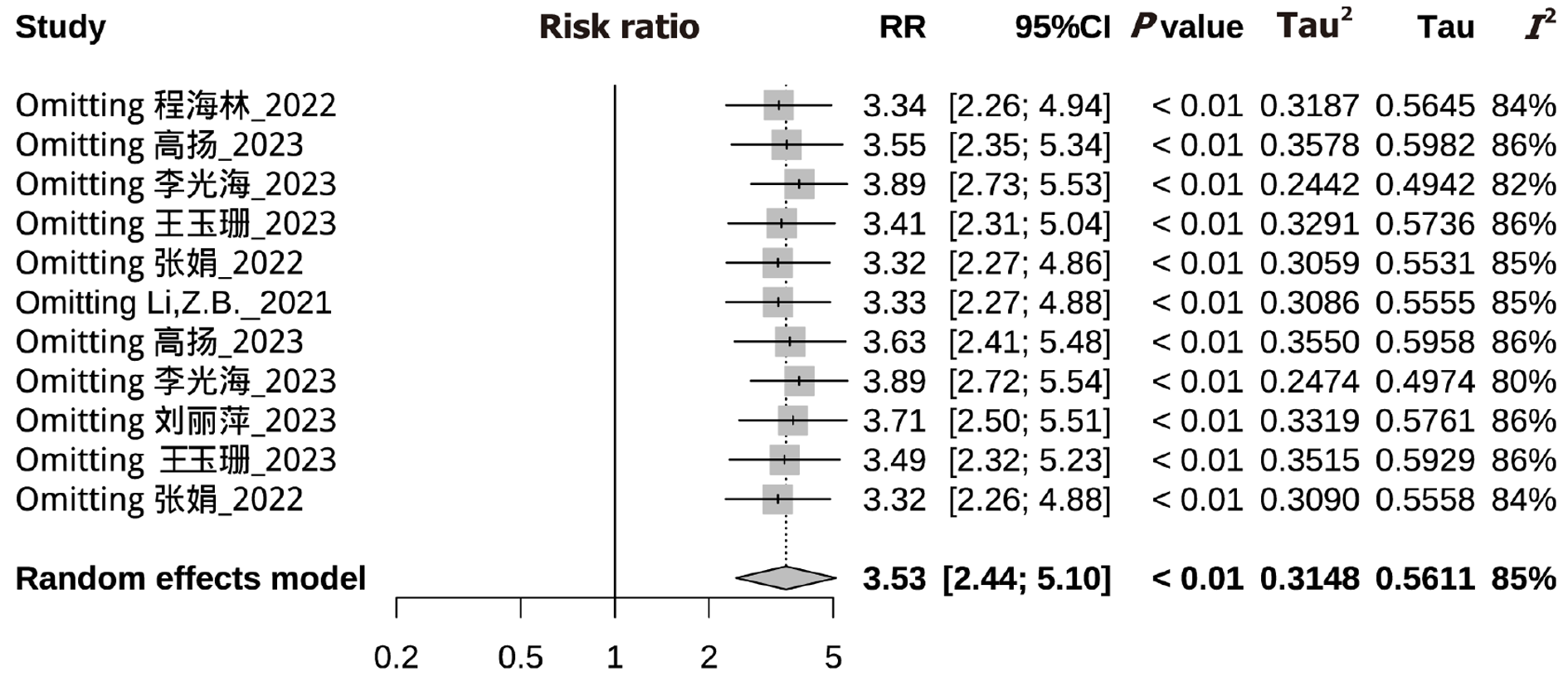
2.3.2 敏感性分析: 采用逐一剔除法评估上述Meta分析合并结果的稳健性和可靠性, 从下图可以看出依次剔除1项研究, 剩余研究的合并结果没有发生明显方向性的改变, 说明上述纳入研究的Meta分析合并结果稳健、可靠. 具体见图4.
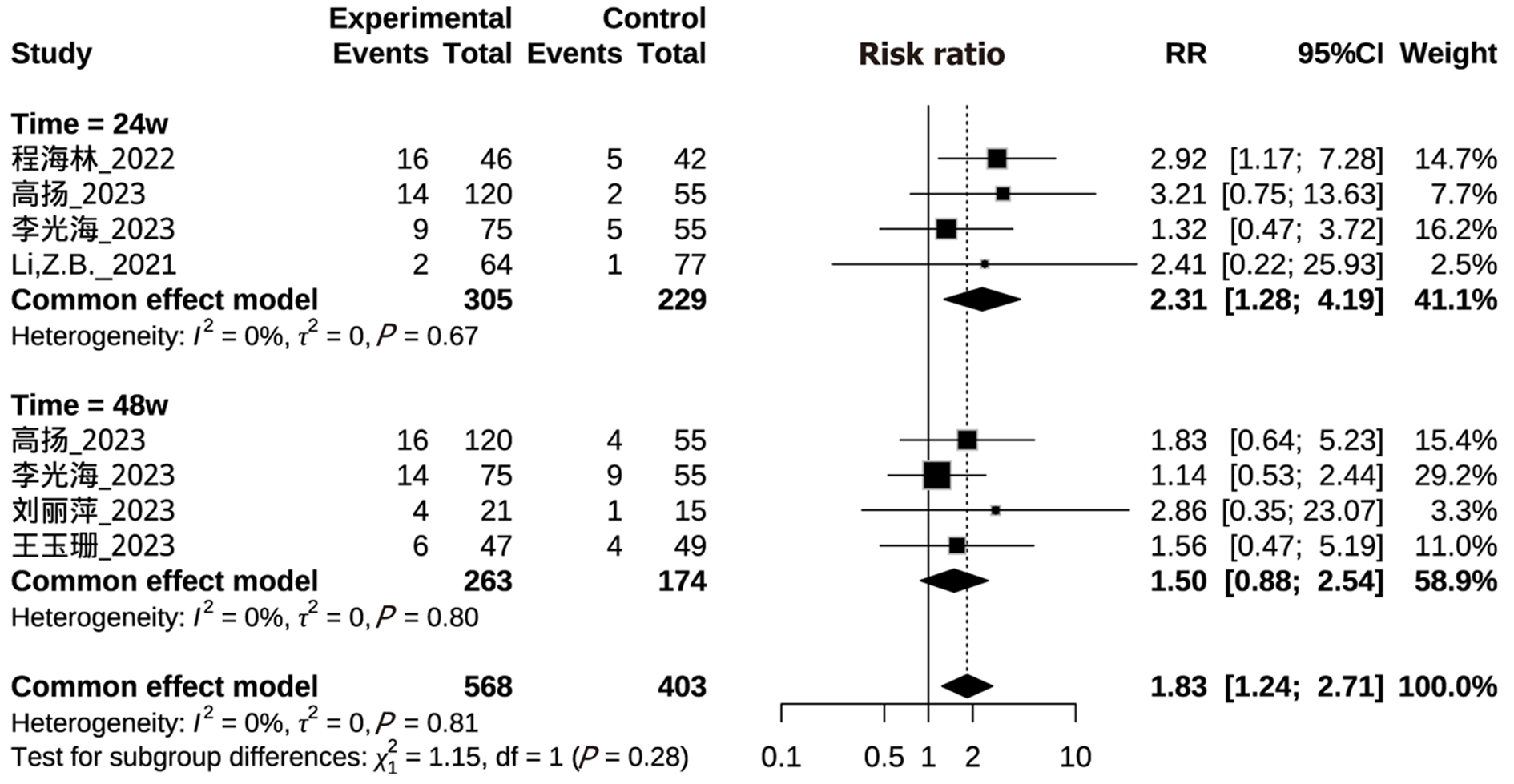
纳入6项研究, 有2项研究内容同时包含了研究周期24 wk和48 wk HBeAg血清阴转率[11,12], 有2项研究只包含24 wk HBeAg血清阴转率[6,8], 有2项研究只包含48 wk HBeAg血清阴转率[9,13]. 纳入研究周期24 wk和48 wk组异质性检验I2均为0%, 采用固定效应模型进行Meta分析. 结果显示LLV患者继续NAs治疗后, 试验组24 wk HBeAg阴转率高于对照组, 差异有统计学意义[RR = 2.31, 95%CI(1.28, 4.19), P<0.01]; 试验组48 wk HBeAg阴转率与对照组差异无统计学意义[RR = 1.50, 95%CI(0.88, 2.54), P = 0.13]. 研究周期24 wk和48 wk之间HBeAg血清阴转率亚组之间差异无统计学意义(P = 0.28). 具体见图5.
纳入3项研究基线都包含代偿期肝硬化病人, 由于纳入研究无原始数据, 只做定性系统评价. 在Zhang等[16]研究中, LLV组与MVR组继续NAs治疗5年终末期肝病发生率分别为7.73% vs 0.77%, 其中失代偿期肝硬化累计发生率为3.27% vs 0.44%, 肝癌的累计发生率为4.49%和0.33%; LLV组与MVR组10年终末期肝病发生率分别为15.85% vs 5.52%, 其中失代偿期肝硬化累计发生率为和3.27% vs 0.44%, HCC的累计发生率为和12.44% vs 5.11%. Shin等[15]研究中LLV组与MVR组HCC累积发病率在5年时分别为39.5% vs 13.0%, 在9年时分别为50.2% vs 29.7%. Lee等[14]研究中MVR组与LLV相比HCC的5年和10年累计发生率为7.8% vs 11.5% 和12.8% vs 20.1%, 11年的随访中失代偿期肝硬化发生率MVR组和LLV组分别为4.9%和7.1%. 上述研究结果提示继续NAs治疗的LLV组患者远期终末期肝病发生率均高于MVR组, 差异均具有统计学意义(P<0.05).
近些年慢乙肝LLV患者远期临床结局问题受到了广泛的关注, 很多研究结果显示LLV的形成是多因素的[10,17-20]: 男性、年龄小、基线高HBV DNA载量、HBeAg阳性、高HBsAg水平、同时合并有家族史、代谢性肝病史以及依从性差是慢乙肝患者NAs治疗后发生LLV的高危因素. 有研究提出持续性LLV可能是由于先天病毒和宿主因素所致, 而大多数间歇性LLV病例可能与治疗依从性有关[15], 故本文纳入研究过程中都明确治疗依从性. 美国和欧洲指南均指出, 即使采用一线抗病毒治疗, HBeAg阳性、初治慢乙肝患者的HBV DNA完全抑制率也仅为70%左右[21,22]. 对于经NAs治疗后的LLV患者继续NAs治疗方案或是换用不同的治疗方案仍然争议不断, 并且对于其远期临床结局情况也缺乏真实世界数据的反馈.
本研究就慢乙肝LLV患者继续NAs治疗临床结局情况进行了Meta分析, 结果显示继续维持原NAs治疗方案的患者HBV DNA阴转率以及HBeAg血清阴转率均低于更换NAs方案的患者, 其中在治疗24 wk后两组差异最大, 48 wk后两组差异逐渐减小. 两组之间HBeAg血清阴转率在24 wk差异最大, 但随着治疗周期的延长, 到48 wk两组之间差异无统计学意义. 这提示随着治疗周期的延长, 目前一线NAs药物远期治疗效果差异可能逐渐减小, 更换NAs治疗方案HBV DNA短期下降速度相对较快, 总体来看换用或加用NAs方案可进一步获得MVR.
但是本研究结果显示慢乙肝患者和乙肝相关代偿期肝硬化LLV患者继续NAs治疗远期终末期肝病发生率都明显高于MVR组, 这也与其他研究结果一致. 有研究显示ETV单药治疗期间, 在肝硬化患者中, LLV患者的HCC风险显着高于MVR, 而对于非肝硬化患者, LLV和MVR之间的HCC风险没有显着差异[23]. 而乙肝相关肝硬化患者接受≥1年NAs药物抗病毒治疗后, LLV占比为41.5%, LLV占比也相对较高[17]. 另外一项研究提示慢乙肝患者持续低病毒载量仍可能促进纤维化进展[24], 并且LLV年轻病例也可能发生明显的纤维化[25]. 在未治患者中, 与HBV DNA检测不到的患者相比, 代偿性肝硬化和低病毒载量患者发生HCC的风险也更高[26]. 但韩国一项研究显示慢乙肝患者接受ETV治疗5年前后, HCC发生率没有显著变化[27], 这可能与患者用药依从性密切相关. 对于肝硬化患者, 服药依从性差与较高的死亡率以及较高的HCC和肝硬化并发症风险相关[3].
本文纳入的大部分研究都明确纳入依从性好的患者, 长期随访结果提示继续NAs治疗可以提高HBV DNA阴转率和HBeAg阴转率, 但是LLV患者的远期终末期肝病发生率仍明显高于MVR患者. 这也提示即使患者具备良好的用药依从性, 但是经NAs治疗后仍然发生LLV的患者, 若继续长期使用NAs方案治疗, 应该密切监视肝硬化、肝癌等终末期肝病的发生, 并且在诊治条件允许的情况下, 可以尝试其他治疗方案以追求尽快达到临床治愈的可能.
有关经治慢乙肝低病毒血症(low-level viremia, LLV)患者继续行核苷(酸)类似物(nucleos(t)ide analogues, NAs)治疗的远期临床结局研究数据缺乏, 但真实世界此类患者数量不容忽视.
对于慢乙肝LLV患者继续NAs治疗的远期临床结局的研究很有必要, 可以为临床工作提供一定的参考.
本研究利用系统评价和Meta分析评估慢乙肝LLV患者继续原NAs治疗和更换不同NAs治疗方案的远期临床结局情况, 为继续行NAs治疗的慢乙肝LLV患者后期治疗方案的制定提供参考.
通过检索国内外相关文献, 根据纳入和排除标准, 对符合纳入的研究进行系统评价和Meta分析.
本文最终纳入11篇文献, 其中7篇文献进行HBV DNA阴转率定量Meta分析, 结果提示更换NAs方案组继续治疗24 wk和48 wk后HBV DNA阴转率明显高于继续原NAs方案组; 纳入6篇文献进行HBeAg阴转率的定量Meta分析, 更换NAs治疗方案组24 wk HBeAg阴转率高于继续原方案组, 但48 wk两组HBeAg阴转率差异无统计学意义; 纳入3篇文献进行终末期肝病发生率的定性系统评价, 结果显示继续NAs治疗的LLV组患者远期终末期肝病发生率均高于维持病毒学应答(maintain virological response, MVR)组.
继续NAs治疗可以提高HBV DNA阴转率和HBeAg阴转率, 但是LLV患者的远期终末期肝病发生率仍明显高于MVR患者.
将来, 仍需要更多的研究来评估慢乙肝LLV患者继续NAs治疗的远期临床结局,但是对于此类患者, 建议尽早完善相关评估, 及时更换合适的治疗方案以求尽快达到临床治愈, 减少终末期肝病的发生率.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 2. | 鲁 凤民, 封 波, 郑 素军, 蒋 素贞, 杨 瑞锋, 福 军亮, 纪 冬, 党 双锁, 鲁 晓擘, 陈 红松, 陈 新月, 任 红, 高 志良, 南 月敏, 徐 小元, 俊 奇, 张 文宏, 庄 辉. 核苷(酸)类似物经治的慢性乙型肝炎患者低病毒血症的研究现状. 临床肝胆病杂志. 2021;37:1268-1274. [DOI] |
| 3. | Shin JW, Jung SW, Lee SB, Lee BU, Park BR, Park EJ, Park NH. Medication Nonadherence Increases Hepatocellular Carcinoma, Cirrhotic Complications, and Mortality in Chronic Hepatitis B Patients Treated With Entecavir. Am J Gastroenterol. 2018;113:998-1008. [PubMed] [DOI] |
| 4. | Chotiyaputta W, Peterson C, Ditah FA, Goodwin D, Lok AS. Persistence and adherence to nucleos(t)ide analogue treatment for chronic hepatitis B. J Hepatol. 2011;54:12-18. [PubMed] [DOI] |
| 5. | Wells GA, Wells G, Shea B, Shea B, O'connell D, Peterson J, Welch, Losos M, Tugwell P, Ga SW, Zello GA, Petersen JA. The Newcastle-Ottawa Scale (NOS) for Assessing the Quality of Nonrandomised Studies in Meta-Analyses, Semantic Scholar 2014. Available from: https://api.semanticscholar.org/CorpusID:79550924. |
| 6. | Li ZB, Li L, Niu XX, Chen SH, Fu YM, Wang CY, Liu Y, Shao Q, Chen G, Ji D. Switching from entecavir to tenofovir alafenamide for chronic hepatitis B patients with low-level viraemia. Liver Int. 2021;41:1254-1264. [PubMed] [DOI] |
| 8. | 程 海林, 胡 旭东, 夏 冰, 柏 涛, 卢 斯霞. 富马酸丙酚替诺福韦对恩替卡韦经治后低病毒载量的慢性乙型肝炎患者的临床疗效. 临床肝胆病杂志. 2022;38:537-540. [DOI] |
| 13. | 刘 丽萍, 邬 小萍, 蔡 天盼, 王 亮, 孙 俊, 梁 佳圆, 马 仕鹏, 甘 厦, 阮 宁杭, 葛 善飞. 恩替卡韦经治后低病毒血症的慢性乙型肝炎患者序贯联合富马酸丙酚替诺福韦治疗的疗效及影响因素分析. 中华肝脏病杂志. 2023;31:118-125. [DOI] |
| 14. | Lee SB, Jeong J, Park JH, Jung SW, Jeong ID, Bang SJ, Shin JW, Park BR, Park EJ, Park NH. Low-level viremia and cirrhotic complications in patients with chronic hepatitis B according to adherence to entecavir. Clin Mol Hepatol. 2020;26:364-375. [PubMed] [DOI] |
| 15. | Shin SK, Yim HJ, Kim JH, Lee CU, Yeon JE, Suh SJ, Jung YK, Kim YS, Kim JH, Kwon OS. Partial Virological Response after 2 Years of Entecavir Therapy Increases the Risk of Hepatocellular Carcinoma in Patients with Hepatitis B Virus-Associated Cirrhosis. Gut Liver. 2021;15:430-439. [PubMed] [DOI] |
| 16. | Zhang Q, Peng H, Liu X, Wang H, Du J, Luo X, Ren H, Hu P. Chronic Hepatitis B Infection with Low Level Viremia Correlates with the Progression of the Liver Disease. J Clin Transl Hepatol. 2021;9:850-859. [PubMed] [DOI] |
| 18. | 李 彤, 孔 银, 刘 元元, 刘 天府, 麻 爱娣, 李 龙泉, 裴 志燕, 张 岭漪. 经治慢性乙型肝炎低病毒血症患者人群特征及其相关影响因素: 一项单中心横断面回顾性研究. 中华肝脏病杂志. 2023;31:42-48. [DOI] |
| 19. | 程 齐齐, 杨 丽霞, 蔡 天盼, 王 亮, 孙 俊, 梁 佳圆, 刘 丽萍, 甘 厦, 阮 宁杭, 葛 善飞. 核苷(酸)类似物初治的慢性乙型肝炎患者发生低病毒血症的影响因素及其动态变化分析. 临床肝胆病杂志. 2022;38:2716-2722. [DOI] |
| 20. | Chen H, Fu JJ, Li L, Wang X, Pan XC. Risk factors of low-level viremia in chronic hepatitis B patients receiving Entecavir monotherapy: a retrospective cohort study. J Gastroenterol Hepatol. 2024;39:180-184. [PubMed] [DOI] |
| 21. | European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67:370-398. [PubMed] [DOI] |
| 22. | Terrault NA, Lok ASF, McMahon BJ, Chang KM, Hwang JP, Jonas MM, Brown RS, Bzowej NH, Wong JB. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology. 2018;67:1560-1599. [PubMed] [DOI] |
| 23. | Kim JH, Sinn DH, Kang W, Gwak GY, Paik YH, Choi MS, Lee JH, Koh KC, Paik SW. Low-level viremia and the increased risk of hepatocellular carcinoma in patients receiving entecavir treatment. Hepatology. 2017;66:335-343. [PubMed] [DOI] |
| 24. | Sun Y, Wu X, Zhou J, Meng T, Wang B, Chen S, Liu H, Wang T, Zhao X, Wu S, Kong Y, Ou X, Wee A, Theise ND, Qiu C, Zhang W, Lu F, Jia J, You H. Persistent Low Level of Hepatitis B Virus Promotes Fibrosis Progression During Therapy. Clin Gastroenterol Hepatol. 2020;18:2582-2591.e6. [PubMed] [DOI] |
| 25. | Yenilmez E, Çetinkaya RA, Tural E. Diagnostic Dilemma for Low Viremia with Significant Fibrosis; is Hepatitis B Virus DNA Threshold Level a Good Indicator for Predicting Liver Damage? Balkan Med J. 2018;35:326-332. [PubMed] [DOI] |
| 26. | Yang J, Choi WM, Shim JH, Lee D, Kim KM, Lim YS, Lee HC, Choi J. Low Level of Hepatitis B Viremia Compared With Undetectable Viremia Increases the Risk of Hepatocellular Carcinoma in Patients With Untreated Compensated Cirrhosis. Am J Gastroenterol. 2023;118:1010-1018. [PubMed] [DOI] |