修回日期: 2024-08-23
接受日期: 2024-09-03
在线出版日期: 2024-09-28
微核糖核酸(microRNA, miR)-15a-5p与细胞程序性死亡蛋白配体1(programmed death-ligand 1, PD-L1)在多种肿瘤进展、治疗与预后中发挥重要作用, 但其在食管癌中的作用尚不完全清楚.
研究miR-15a-5p与PD-L1表达对食管癌进展与预后的影响, 并分析二者的靶向关系以及二者调控食管癌细胞生物学行为的机制.
用癌症基因组图谱数据库、基因表达综合数据库和RNA相互作用组百科全书泛癌分析数据库分析食管癌中miR-15a-5p和PD-L1基因的表达, 通过Kaplan-Meier生存分析研究miR-15a-5p和PD-L1的表达与食管癌无病生存期以及总生存期的关系. 信息学和荧光活性实验检测miR-15a-5p与PD-L1的靶向关系. 体外培养食管癌细胞, 转染miR-15a-5p mimics或miR-NC后, 分别用Western blot、流式细胞术、免疫荧光实验检测PD-L1表达. 将转染miR-15a-5p mimics或miR-NC的食管癌细胞与CD8+ T细胞共培养, 流式细胞术检测干扰素-γ(interferon-γ, INF-γ)阳性CD8+ T细胞比例, ELISA检测共培养体系中上清液中INF-γ和白细胞介素(interleukin, IL)-2含量.
miR-15a-5p在食管癌组织中表达水平较癌旁非癌变组织降低(P<0.05). 以miR-15a-5p表达水平的中位数为分界线, 随T分期和肿瘤大小增加和淋巴结转移,miR-15a-5p低表达率增加(P<0.05); 相比于miR-15a-5p低表达的食管癌患者, miR-15a-5p高表达显示出较长的无病生存期和总生存期(P<0.05), miR-15a-5p高表达同时PD-L1低表达的无病生存期和总生存期更长(P<0.05). 在miR-15a-5p 高表达的食管癌患者中PD-L1 mRNA多呈低表达. PD-L1为miR-15a-5p的靶基因. 过表达miR-15a-5p抑制食管癌细胞中总PD-L1及膜PD-L1表达(P<0.05). 在食管癌细胞中过表达miR-15a-5p可促进共培养体系中CD8+ T细胞的激活(即: 共培养体系中INF-γ阳性CD8+ T细胞比例以及共培养体系中上清液中INF-γ和IL-2含量增加).
miR-15a-5p可通过靶向PD-L1增强食管癌细胞的肿瘤免疫反应, 且miR-15a-5p/PD-L1可作为食管癌诊断及预后生物标记物.
核心提要: 微核糖核酸(microRNA, miR)-15a-5p与细胞程序性死亡蛋白配体1(programmed death-ligand 1, PD-L1)不仅是食管癌诊断及预后的潜在生物标记物, miR-15a-5p还能通过靶向PD-L1来增强CD8+ T细胞的活化.
引文著录: 林亭呈, 张婉君. miR-15a-5p靶向PD-L1对食管癌进展、预后与肿瘤免疫反应的影响. 世界华人消化杂志 2024; 32(9): 678-685
Revised: August 23, 2024
Accepted: September 3, 2024
Published online: September 28, 2024
MicroRNA(miR)-15a-5p and programmed death-ligand 1 (PD-L1) are pivotal in the progression, treatment, and prognosis of various cancer types; however, their involvement in esophageal cancer remains incompletely elucidated.
To investigate the effects of the expression of miR-15a-5p and PD-L1 on the progression and prognosis of esophageal cancer, to analyze the targeting relationship between the two, and to explore the mechanism underlying their regulatory effect on the biological behaviors of esophageal cancer cells.
The expression of miR-15a-5p and PD-L1 genes in esophageal cancer was examined utilizing data from The Cancer Genome Atlas database, Gene Expression Omnibus database, and The Encyclopedia of RNA Interactomes pan-cancer analysis database. The relationship between the expression of miR-15a-5p and PD-L1 and disease-free interval and overall survival of esophageal cancer patients was studied by Kaplan-Meier survival analysis. The targeting relationship between miR-15a-5p and PD-L1 was detected by informatics and fluorescence activity experiments. After transfection of esophageal cancer cells with miR-15a-5p mimics or miR-NC, the expression of PD-L1 was detected by Western blot, flow cytometry, and immunofluorescence assay. The esophageal cancer cells transfected with miR-15a-5p mimics or miR-NC were co-cultured with CD8+ T cells. Interferon-γ (INF-γ)-positive CD8+ T cells were detected by flow cytometry, and INF-γ and interleukin (IL)-2 contents in the supernatant of the co-culture system were detected by ELISA.
The expression level of miR-15a-5p in esophageal cancer tissue was lower than that in adjacent non-cancerous tissue (P < 0.05). With the increase in T stage, tumor size, and occurrence of lymph node metastasis, there was a concomitant rise in the rate of low miR-15a-5p expression when using the median expression level of miR-15a-5p as the threshold (P < 0.05). Compared with patients with esophageal cancer with low expression of miR-15a-5p, high expression of miR-15a-5p was associated with longer disease-free survival and overall survival (P < 0.05), and high expression of miR-15a-5p combined with low expression of PD-L1 was also associated with longer disease-free survival and overall survival (P < 0.05). In esophageal cancer patients with high miR-15a-5p expression, PD-L1 mRNA expression was mostly lower. PD-L1 was the target gene of miR-15a-5p. Overexpression of miR-15a-5p inhibited total PD-L1 and membrane PD-L1 expression in esophageal cancer cells (P < 0.05). Overexpression of miR-15a-5p in esophageal cancer cells promoted the activation of CD8+ T cells in the co-culture system (i.e., the proportion of INF-γ-positive CD8+ T cells in the co-culture system and the contents of INF-γ and IL-2 in the superserum in the co-culture system were increased).
miR-15a-5p can enhance the tumor immune response of esophageal cancer cells by targeting PD-L1, and miR-15a-5p/PD-L1 can be used as biomarkers for diagnosis and prognosis of esophageal cancer.
- Citation: Lin TC, Zhang WJ. MicroRNA-15a-5p targets programmed death-ligand 1 to impact progression, prognosis, and tumor immune response in esophageal cancer. Shijie Huaren Xiaohua Zazhi 2024; 32(9): 678-685
- URL: https://www.wjgnet.com/1009-3079/full/v32/i9/678.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i9.678
食管癌是常见的消化道肿瘤, 但其病因仍不清楚, 越来越多的研究表明, 微核糖核酸(microRNA, miR)在食管癌的发病过程中异常表达[1,2]. 但这些大量表达异常的miRs是食管癌进展的伴随效应还是能发挥调控作用, 仍需大量研究来鉴别. 近来研究发现, miR-15a-5p在肝癌、子宫内膜癌癌和肺癌等多数肿瘤细胞中表达下调, 且发挥肿瘤抑制因子的作用[3-5]. 另外, miR-15a-5p的表达还与肿瘤免疫相关[6,7]. 如: miR-15a-5p通过靶向钾内部调整通道亚家族J成员2表达最终促进CD8+T细胞对肝癌细胞的杀伤作用[6]. 神经母细胞瘤细胞miR-15a/15b簇能通过靶向细胞程序性死亡蛋白配体1(programmed death-ligand 1, PD-L1)增强自然杀伤细胞和CD8+ T细胞活化以及抗肿瘤免疫应答[7]. 而miR-15a-5p表达食管癌中的作用并不清楚. 本研究主要用癌症基因组图谱(The Cancer Genome Atlas, TGCA)数据库和基因表达综合数据库(Gene Expression Omnibus, GEO)数据库中获取食管癌中miR-15a-5p表达和临床资料信息, 并以其表达水平的中位数为界限划分为高表达和低表达组, 分析研究了食管癌患者中高、低表达的miR-15a-5p与食管癌患者的进展与预后的关系. 本研究还分析了miR-15a-5p对体外培养的食管癌细胞中PD-L1表达, 以及miR-15a-5p对共培养体系中CD8+ T细胞活化的影响, 并分析miR-15a-5p与PD-L1潜在的关系.
胎牛血清购自浙江天杭生物科技股份有限公司; RPMI-1640培养基购自兰州民海生物工程有限公司; Trizol试剂、双荧光素酶报告基因检测试剂盒、KeygenTrans转染试剂和Western blot用电化学发光试剂盒购自江苏凯基生物技术股份有限公司; miR-NC和miR-15a-5p mimics购自吉满生物科技(上海)有限公司; 兔源PD-L1抗体、PD-L1-PE流式细胞术抗体和羊抗兔IgG(H+L)-PE二抗购自武汉三鹰生物技术有限公司; 兔源甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体、羊抗兔-辣根过氧化酶(horseradish peroxidase, HRP)二抗购自成都正能生物技术有限责任公司; 兔源干扰素-γ(interferon-γ, INF-γ)流式细胞术抗体、羊抗兔IgG(H+L)-Alexa Fluor 488或647二抗和鬼笔环肽(Phalloidin)-iFluor 594试剂购自英国Abcam公司; Histopaque-1077人淋巴细胞分离液购自美国Sigma公司; 人CD8+T细胞分离试剂盒购自北京诺为生物技术有限公司; Dynabeads人T活化剂CD3/CD28购自美国Thermo Fisher Scientific公司; 人INF-γ、白细胞介素(interleukin, IL)-2的酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA)检测试剂盒购自江苏晶美生物科技有限公司.
1.2.1 临床患者入组数据库获取食管癌患者临床资料和mRNA以及miRNA表达矩阵信息: TGCA数据库和GEO数据库下载食管癌患者临床病理资料、mRNA表达矩阵以及miRNA表达表达矩阵信息, 并R语言分析和RNA相互作用组百科全书(The Encyclopedia of RNA Interactomes, ENCORI)泛癌分析数据库分析miR-15a-5p和PD-L1 mRNA在食管癌中表达.
1.2.2 miR-15a-5p和PD-L1 mRNA表达与食管癌患者病理参数以及预后的关系: 以TGCA数据库和GEO数据库中筛选的食管癌组织中miR-15a-5p表达水平的中位数作为分界线, 分为miR-15a-5p高表达组与miR-15a-5p低表达组; 以PD-L1 mRNA表达水平的中位数作为分界线, 分为PD-L1高表达组与PD-L1低表达组; 采用χ2检验分析miR-15a-5p或PD-L1 mRNA表达与年龄、性别、分化程度、美国癌症联合委员会(American Joint Committee on Cancer, AJCC)分期、淋巴结浸润和肿瘤位置等临床参数的关系; 采用Kaplan-Meier生存分析研究miR-15a-5p高表达与低表达对食管癌患者无病生存期以及总生存期的影响. 为了进一步验证miR-15a-5p和PD-L1 mRNA在食管癌患者生存期中的关系, 将PD-L1表达水平的中位数作为分界线, 进一步将食管癌患者分为miR-15a-5p高表达同时PD-L1低表达与miR-15a-5p低表达同时PD-L1高表达两组, 通过Kaplan-Meier生存分析研究miR-15a-5p和PD-L1 mRNA表达对食管癌患者无病生存期以及总生存期的影响.
1.2.3 细胞培养与细胞转染: 食管癌细胞株(ECA109和KYSE-150)购自武汉普诺赛生命科技有限公司, 将细胞接种于含10%(v/v)胎牛血清的RPMI-1640培养基中, 置于细胞培养箱以37 ℃、5% CO2的条件下扩增培养. 将细胞重新接种于无血清的培养基中, 12 h后, 按说明书方法用KeygenTrans转染试剂将miR-NC或miR-15a-5p mimics转入ECA109和KYSE-150细胞, 转染48 h后, 收集细胞用于后续实验.
1.2.4 免疫荧光: 将转染miR-NC或miR-15a-5p mimics后的食管癌细胞重新置于放置盖玻片的激光共聚焦显微镜专用培养皿中培养24 h(细胞铺满皿底)后, 用4%(v/v)多聚甲醛固定玻片上细胞. 用磷酸盐缓冲液(phosphate buffer saline, PBS)冲洗后, 用正常山羊血清室温封闭30 min, 加入PD-L1抗体(1:200)在湿盒里室温避光2 h, 再次用PBS冲洗后, 加入羊抗兔IgG(H+L)-Alexa Fluor 488二抗(1:200)室温避光1 h. PBS冲洗后, 加入Phalloidin-iFluor 594室温避光30 min, 加入DAPI室温5 min. PBS冲洗后, VK-9710激光共聚焦显微镜(日本KEYENCE公司)下观察.
1.2.5 Western Blot检测: 收集转染miR-NC或miR-15a-5p mimics后的食管癌细胞, 并用细胞裂解液提取蛋白, 取等量的蛋白进行Western blot电泳和转印. 用5%(v/v)脱脂奶粉室温封闭30 min, 加入PD-L1(1:1000)和GAPDH(1:10000)抗体室温避光2 h, 用三羟甲基氨基甲烷盐酸-吐温20缓冲盐溶液浸洗后, 加入羊抗兔IgG(H+L)-HRP二抗(1:1000)室温避光1 h. 再次浸洗后, 加入Western blot用电化学发光试剂使得条带显像, 用e-Blot电化学发光压片仪(瑞典Biotage Sweden AB公司)采集图像并以GAPDH为内参对PD-L1的表达进行半定量分析.
1.2.6 CD8+T细胞分离、激活和共培养: 用Histopaque-1077人淋巴细胞分离液提取正常外周血单核细胞, 按照说明书步骤用人CD8+T细胞分离试剂盒分离出CD8+ T细胞. 用Dynabeads人T细胞活化剂CD3/CD28在含10%(v/v)FBS的RPMI-1640培养基中以1:1的比例刺激CD8+T细胞48 h, 收集细胞, 并用流式细胞术以CD3、CD8和CD4抗体分析CD8+ T细胞的纯度. 将纯度>90%的CD8+ T细胞用于食管癌细胞共培养体系的构建. 在共培养系统中, 将CD3/CD28处理后的CD8+ T细胞与已转染miR-NC或miR-15a-5p mimics后的ECA109和KYSE-150细胞的比例均为1:1, 共培养时间为48 h.
1.2.7 流式细胞术分析: 收集转染miR-NC或miR-15a-5p mimics后的食管癌细胞, 用PBS重悬2次后, 加入PD-L1-PE流式细胞术抗体(1:200)在湿盒里室温避光2 h. 或, 收集共转染体系中的细胞, 用0.1%(v/v)Triton X-100室温透化细胞5 min, 用PBS重悬2次后, 加入INF-γ流式细胞术抗体(1:200)在湿盒里室温避光2 h, 用PBS重悬2次, 加入羊抗兔IgG(H+L)-PE二抗(1:200)在湿盒里室温避光1 h. 将上述处理好的细胞, 用PBS冲洗后, LSRII流式细胞仪(美国BD公司)检测.
1.2.8 ELISA检测: 收集共转染体系中的细胞上清液, 按说明书步骤, 用ELISA法检测INF-γ和IL-2含量.
1.2.9 目标靶点预测与验证: 通过TargetScan Human 7.2预测miR-15a-5p与PD-L1在PD-L1-3`非翻译区(untranslated region, UTR)区有互补结合序列. 将PD-L1-3`-UTR区预测的结合位点以及突变后的碱基序列克隆到pEZX-MT06荧光素酶报告基因载体的下游. 然后将PD-L1突变/野生型荧光素酶报告基因质粒与miR-NC或miR-15a-5p mimics转入细胞中. 48 h后, 用双荧光素酶报告基因检测试剂盒按说明书步骤以细胞裂解物中的荧光素酶活性评估miR-15a-5p与PD-L1的靶向关系.
统计学处理 采用GraphPad Prism 9.0软件进行统计分析. 生存分析采用Kaplan-Meier法和Log-Rank检验. 计数资料表示为例数(n), 采用χ2检验. 符合正态分布的计量资料表示为均数±标准差(mean±SD), 多组间比较采用one-way ANOVA分析, 两组间比较采用配对t检验, 不符合正态分布的计量资料表示为中位数和四分位数间距[M(P25,P75)] , 比较采用u检验. 以P<0.05认为差异具有统计学意义.
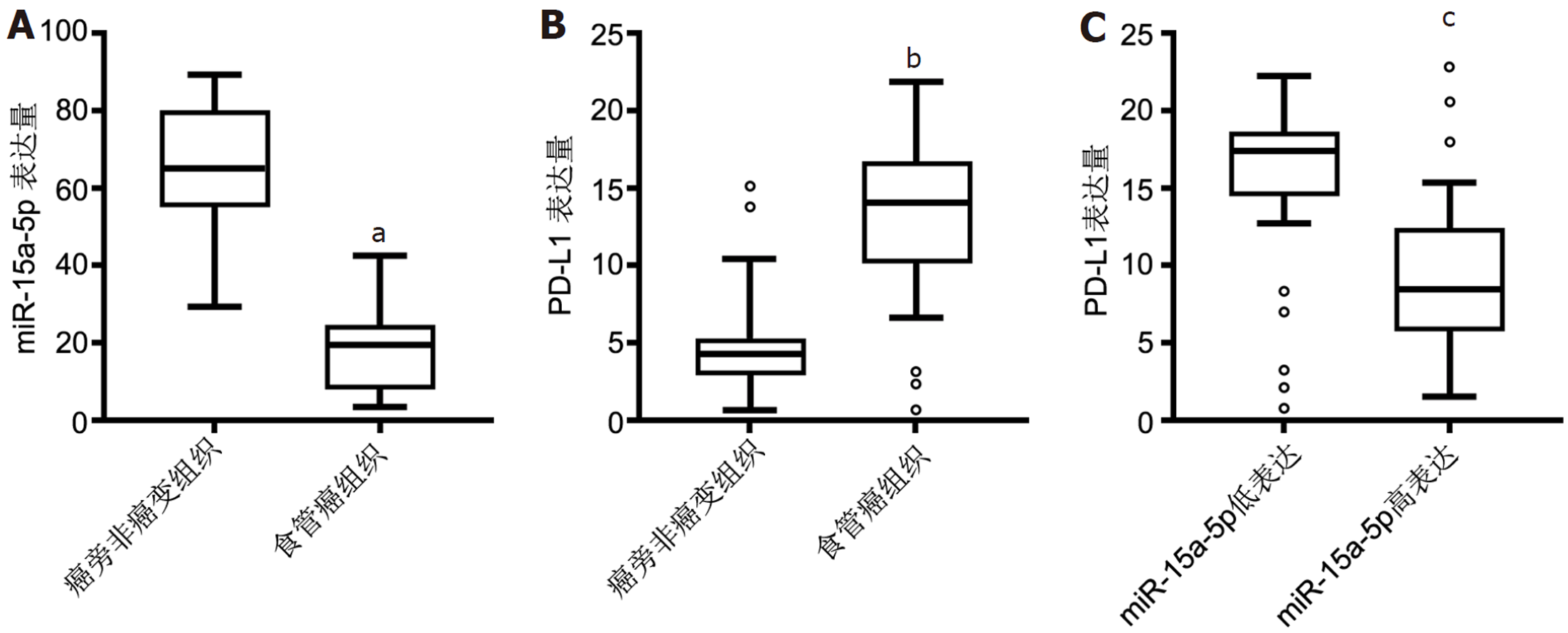
食管癌组织中miR-15a-5p表达水平明显低于癌旁非癌变组织(P<0.05, 图1A), 而PD-L1表达水平明显高于癌旁非癌变组织(P<0.05, 图1B), 且miR-15a-5p高表达组的PD-L1 mRNA表达水平明显低于miR-15a-5p低表达组(P<0.05, 图1C). miR-15a-5p和PD-L1 mRNA的表达与临床病理参数的年龄、性别、肿瘤位置和分化程度无关; 但随着肿瘤体积增大、AJCC分期中的T分期增加以及淋巴结转移, miR-15a-5p低表达以及PD-L1高表达均增多(P<0.05), 见表1.
| 临床特征 | miR-15a-5p表达 | χ2值 | P值 | PD-L1表达 | χ2值 | P值 | ||
| 低表达 (n) | 高表达 (n) | 低表达 (n) | 高表达 (n) | |||||
| 年龄(岁) | 0.154 | 0.695 | 0.008 | 0.929 | ||||
| <60 | 21 | 13 | 15 | 19 | ||||
| >60 | 41 | 30 | 32 | 39 | ||||
| 性别 | 0.057 | 0.811 | 1.198 | 0.274 | ||||
| 男 | 46 | 31 | 32 | 45 | ||||
| 女 | 16 | 12 | 15 | 13 | ||||
| 大小(cm) | 14.818 | <0.001 | 16.829 | <0.001 | ||||
| <3 | 11 | 23 | 25 | 9 | ||||
| >3 | 51 | 20 | 22 | 49 | ||||
| 位置 | 0.887 | 0.642 | 0.454 | 0.797 | ||||
| 上部 | 2 | 1 | 1 | 2 | ||||
| 中部 | 34 | 20 | 23 | 31 | ||||
| 下部 | 26 | 22 | 23 | 25 | ||||
| 分化程度 | 9.206 | 0.002 | 8.106 | 0.004 | ||||
| 高分化 | 14 | 22 | 23 | 13 | ||||
| 低分化 | 48 | 21 | 24 | 45 | ||||
| AJCC分期 | 3.860 | 0.049 | 4.931 | 0.026 | ||||
| T1+T2 | 16 | 19 | 21 | 14 | ||||
| T3+T4 | 46 | 24 | 26 | 44 | ||||
| 淋巴结转移 | 5.520 | 0.019 | 16.698 | <0.001 | ||||
| 是 | 43 | 20 | 18 | 45 | ||||
| 否 | 19 | 23 | 29 | 13 | ||||
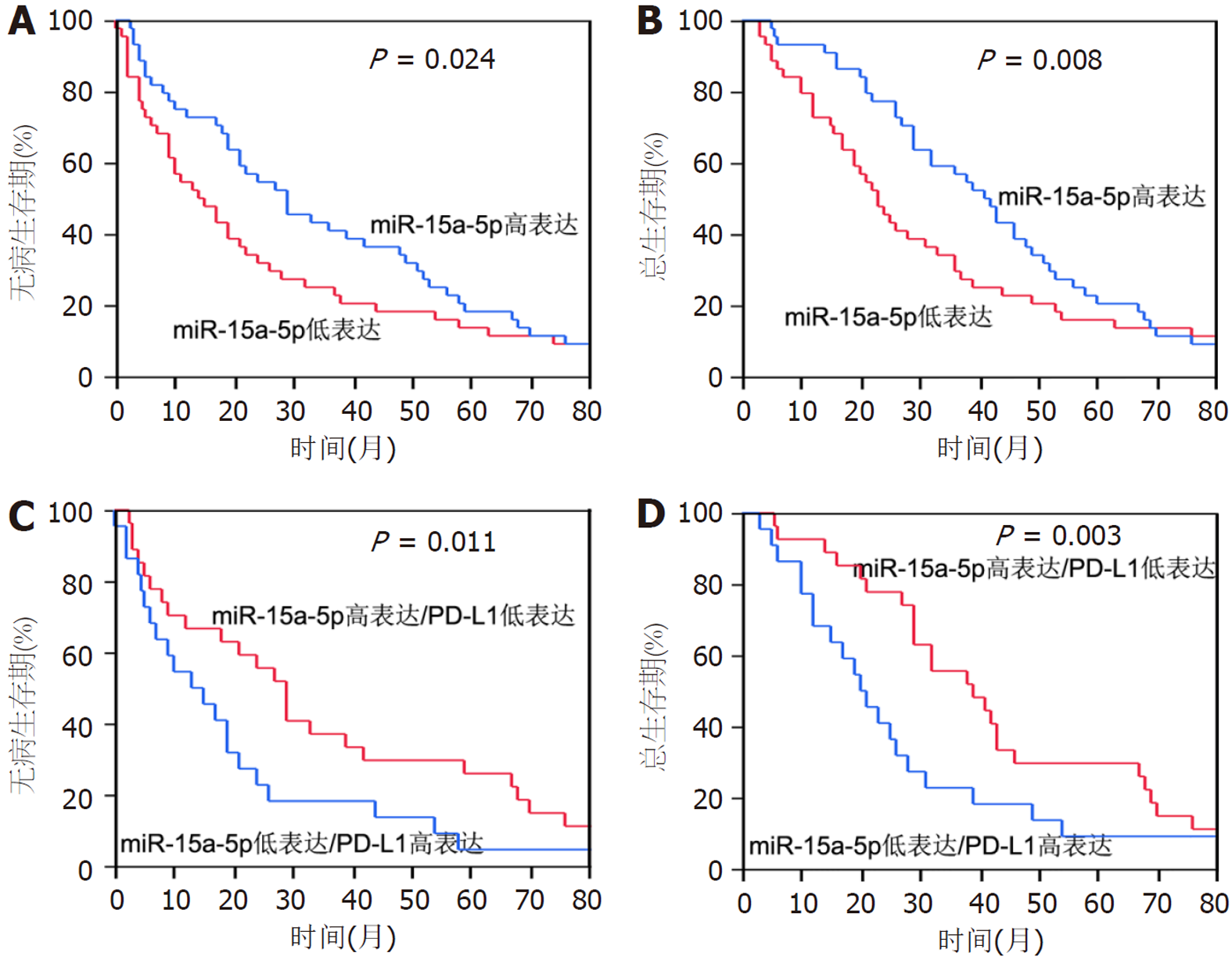
Kaplan-Meier生存分析结果(图1)显示, miR-15a-5p高表达组的食管癌患者显示出较好的预后, 无病生存期以及总生存期相比于miR-15a-5p低表达组的食管癌患者明显延长(均P<0.05). 将食管癌患者分为miR-15a-5p高表达同时PD-L1低表达与miR-15a-5p低表达同时PD-L1高表达两组, Kaplan-Meier生存分析结果(图2)显示miR-15a-5p高表达同时PD-L1低表达的食管癌患者显示更好的预后, 无病生存期与总生存期明显高于miR-15a-5p低表达同时PD-L1高表达食管癌患者.
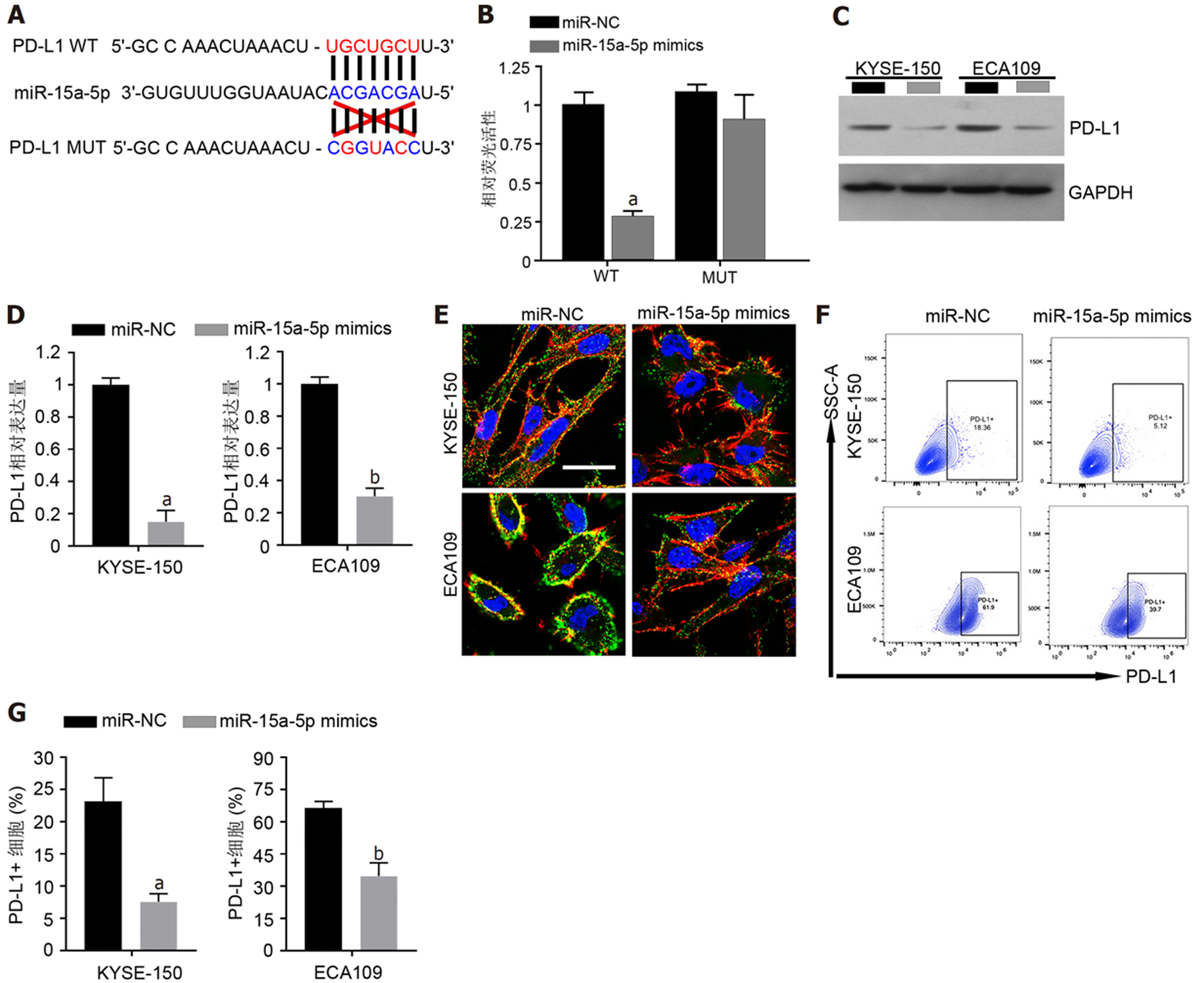
用TargetScan软件预测了miR-15a-5p的靶基因及其可能的结合位点, 预测结果显示, PD-L1的3'UTR区567-573片段具有miR-15a-5p的结合位点(图3A). 通过双荧光素酶活性实验证明了miR-15a-5p与PD-L1的3'UTR(567-573片段)的靶向结合关系(图3B). Western blot实验证明了过表达miR-15a-5p能降低食管癌细胞KYSE-150和ECA109细胞中总PD-L1的表达(均P<0.05; 图3C和F). 另外, 激光共聚焦显微镜下可观察到过表达miR-15a-5p食管癌细胞KYSE-150和ECA109细胞的膜面PD-L1表达的荧光强度均变弱(图3E); 这一结果通过流式细胞术证明, 转染miR-15a-5p mimics的食管癌细胞KYSE-150和ECA109细胞中PD-L1+膜表面阳性细胞比例较转染miR-NC的细胞明显降低(均P<0.05; 图3F和G).
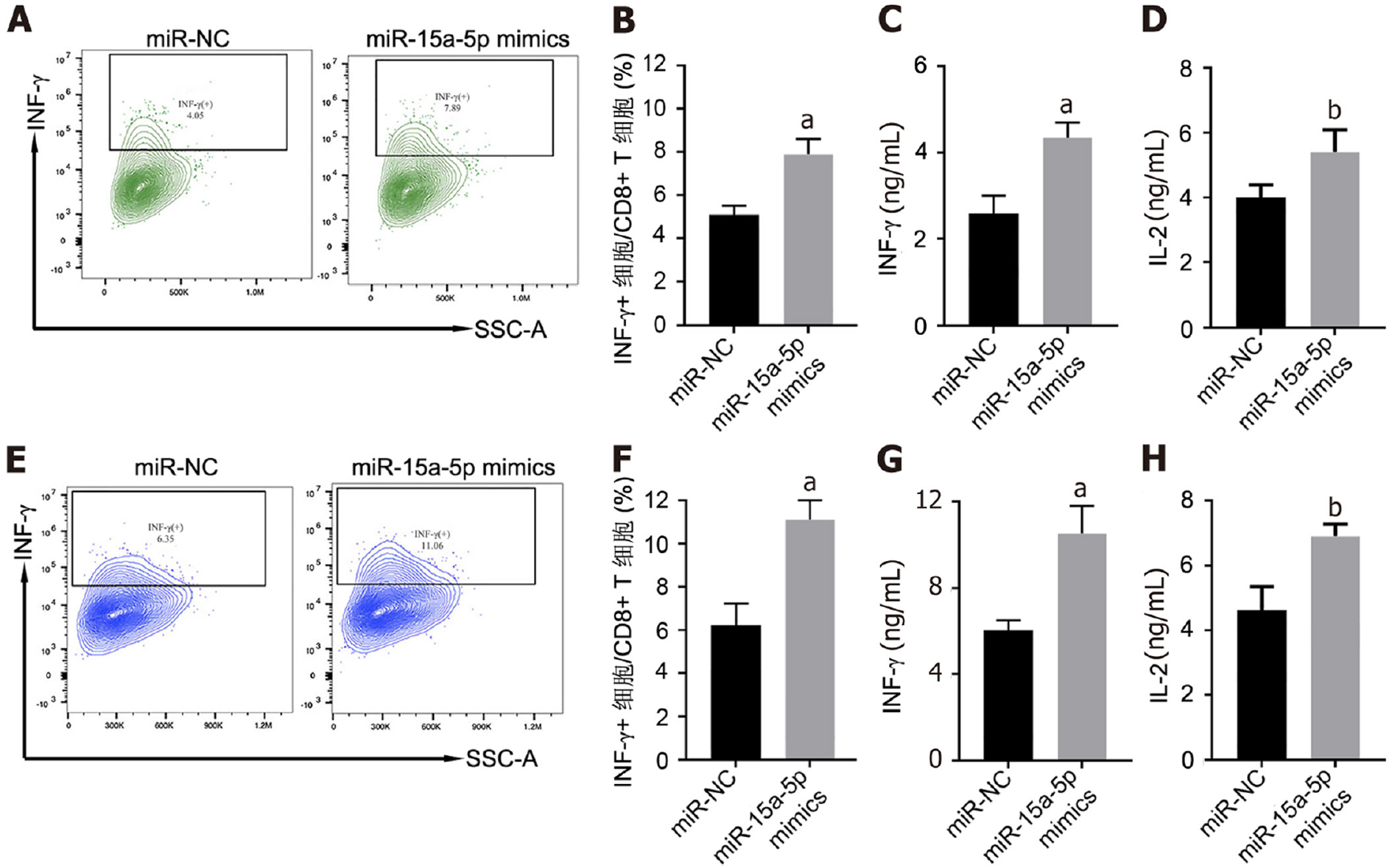
通过体外共培养实验确定miR-15a-5p对食管癌细胞免疫原性的影响. 将经CD3/CD28单抗偶联磁珠处理后的CD8+ T细胞分别与miR-15a-5p mimics或miR-NC转染的KYSE-150和ECA109细胞共培养48 h. 流式细胞术检测CD8+ T细胞内IFN-γ阳性染色比例显示, 与miR-NC组共培养体系相比, 在转染miR-15a-5p mimics的KYSE-150细胞与CD8+ T细胞组建的共培养体系中的IFN-γ阳性染色的CD8+ T细胞比例增多(P<0.05; 图4A和B); ELISA结果显示, 与miR-NC组共培养体系相比, miR-15a-5p mimics组KYSE-150细胞与CD8+ T细胞构建的共培养体系的上清液中的IFN-γ和IL-2水平均明显升高(P<0.05; 图4C和D). 在ECA109细胞中也见到了一致的结果(图4E-H). 以上结果说明, 食管癌细胞过表达miR-15a-5p能增强共培养体系中CD8+ T细胞活化.
miR-15a-5p的异常表达已被证明在多种癌症的发生过程中起到重要作用[3-5,8,9]. 如: miR-15a-5p过表达可显著抑制结直肠癌癌细胞增殖能力、侵袭能力并促进细胞凋亡[8]; Guo等[9]报道敲除miR-15a-5p通过靶向Smad7和抑制上皮-间质细胞转变途径抑制胶质瘤的进展. 在食管癌方面的研究中, 一些学者利用TCGA、GSE106817、GSE113486、GSE122497和GSE112264等数据库发现miR-15a-5p低表达与食管癌较短的生存期有关, 而miR-15a-5p在食管癌中的具体表达情况以及其对食管癌的进展和预后的作用尚不明晰[10]. 本研究通过TGCA数据库和GEO数据库获取食管癌组织中miR-15a-5p表达矩阵和临床资料, 并通过R语言、泛癌分析和χ2检验关联分析得出食管癌组织中miR-15a-5p表达降低与患者的肿瘤体积增大、T分期增加以及淋巴结转移有关. 本研究进一步通过Kaplan-Meier生存分析研究了miR-15a-5p表达与食管癌患者预后的关系, 结果显示, miR-15a-5p低表达与较短的无病生存期和总生存期有关, 且miR-15a-5p高表达可显著改善食管癌患者预后. 以上结果提示了miR-15a-5p低表达与食管癌进展和不良预后有关, 其可作为食管癌预后的标记物.
前人研究显示, 在肝癌与神经母细胞瘤中miR-15a可能通过靶向如程序性死亡受体1(programmed cell death protein 1, PD-1)、PD-L1等调控如CD8+ T细胞和自然杀伤细胞参与抗肿瘤免疫应答[6,7]. 在食管腺癌中, Xu等[11]发现, 相对于PD-L1阴性患者, PD-L1阳性患者中miR-15a的表达明显降低. 上述结果可能预示着miR-15a-5p在食管癌患者中可能通过PD-L1参与调节肿瘤免疫. PD-L1是PD-1的配体, 在包括食管癌在内的不同癌症类型的肿瘤细胞中均有表达, 在肿瘤进展过程中发挥着重要的免疫调节作用. 本研究发现在miR-15a-5p高表达组PD-L1表达水平普遍较低, PD-L1高表达与食管癌患者肿瘤体积增大、T分期增加以及淋巴结转移有关; 且miR-15a-5p高表达同时PD-L1低表达一般预示着患者更长的无病生存期和总生存期; 进一步通过TargetScan软件和荧光活性实验证明了PD-L1为miR-15a-5p作用靶点.
肿瘤免疫治疗是癌症的一种有效的治疗手段[12]. 阻断PD-1/PD-L1通路是在抑制肿瘤的免疫逃匿的主要靶点之一[12,13]. CD8+T细胞为抗肿瘤免疫应答的主要效应细胞[12,13]. 肿瘤细胞膜上PD-L1与CD8+T细胞膜上PD-1结合能抑制CD8+T细胞活化. 效应性CD8+T细胞被激活后可生成IL-2和IFN-γ, IL-2和IFN-γ的水平不仅在一定程度上反映了CD8+T细胞活化程度, 并且此细胞因子还提高CD8+T细靶向杀伤癌细胞的能力[13,14]. 本研究显示, 过表达miR-15a-5p不仅能抑制食管癌细胞总PD-L1的表达, 更重要的它还能抑制膜PD-L1的表达. 并且, 进一步研究显示, 在食管癌细胞中过表达miR-15a-5p还能促进共培养体系中CD8+T细胞的活化, 推测这一结果可能与其抑制食管癌细胞膜上PD-L1的表达, 并进一步降低其与CD8+T细胞膜PD-1结合, 最终抑制PD-1/PD-L1通路有关.
综上, miR-15a-5p在食管癌中表达下调, 且其低表达与食管癌进展和较短的无病生存期与总生存期有关, miR-15a-5p可能是潜在的评估食管癌进展与预后的生物标记物. 另外, miR-15a-5p可能通过靶向PD-L1进而抑制PD-1/PD-L1通路来达到抑制CD8+ T细胞活化.
miR-15a-5p在肿瘤免疫、进展和预后中发挥重要作用, 而其对食管癌的影响尚不完全清楚.
探讨miR-15a-5p在食管癌进展与肿瘤免疫中的作用及机制.
阐明miR-15a-5p在食管癌进展与肿瘤免疫中发挥的作用和机制.
miR-15a-5p预测靶基因为细胞程序性死亡蛋白配体1(programmed death-ligand 1, PD-L1)并验证, 通过生物信息学研究miR-15a-5p及PD-L1在食管癌中的表达情况及与临床参数和预后的关系, 并探讨其对CD8+ T细胞活化的影响.
miR-15a-5p在食管癌中表达下调, 且低表达与T分期、肿瘤大小、淋巴结转移和预后不良相关, 过表达miR-15a-5p能通过靶向PD-L1促进CD8+T细胞的活化.
miR-15a-5p不仅可作为食管癌预后评估的标志物, 还能通过靶向PD-L1促进CD8+T细胞的活化.
miR-15a-5p不仅可作为食管癌进展与预后评估的潜在生物标记物, 同时也具有调节肿瘤免疫反应的潜在策略.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Xue J, Jia E, Ren N, Xin H. Identification of prognostic miRNA biomarkers for esophageal cancer based on The Cancer Genome Atlas and Gene Expression Omnibus. Medicine (Baltimore). 2021;100:e24832. [PubMed] [DOI] |
| 2. | Zarrilli G, Galuppini F, Angerilli V, Munari G, Sabbadin M, Lazzarin V, Nicolè L, Biancotti R, Fassan M. miRNAs Involved in Esophageal Carcinogenesis and miRNA-Related Therapeutic Perspectives in Esophageal Carcinoma. Int J Mol Sci. 2021;22. [PubMed] [DOI] |
| 3. | Li Y, Li D, Yang Y, Wang J. miR-15a-5p Regulates Liver Cancer Cell Migration, Apoptosis and Cell Cycle Progression by Targeting Transcription Factor E2F3. Crit Rev Eukaryot Gene Expr. 2022;32:1-10. [PubMed] [DOI] |
| 4. | Wang ZM, Wan XH, Sang GY, Zhao JD, Zhu QY, Wang DM. miR-15a-5p suppresses endometrial cancer cell growth via Wnt/β-catenin signaling pathway by inhibiting WNT3A. Eur Rev Med Pharmacol Sci. 2017;21:4810-4818. [PubMed] |
| 5. | Ni Y, Yang Y, Ran J, Zhang L, Yao M, Liu Z, Zhang L. miR-15a-5p inhibits metastasis and lipid metabolism by suppressing histone acetylation in lung cancer. Free Radic Biol Med. 2020;161:150-162. [PubMed] [DOI] |
| 6. | Li X, Wu A, Wang Y, Li D, Wu M. Knockdown of circZMIZ1 enhances the anti-tumor activity of CD8(+) T cells to alleviate hepatocellular carcinoma. Funct Integr Genomics. 2024;24:27. [PubMed] [DOI] |
| 7. | Pathania AS, Prathipati P, Olwenyi OA, Chava S, Smith OV, Gupta SC, Chaturvedi NK, Byrareddy SN, Coulter DW, Challagundla KB. miR-15a and miR-15b modulate natural killer and CD8(+)T-cell activation and anti-tumor immune response by targeting PD-L1 in neuroblastoma. Mol Ther Oncolytics. 2022;25:308-329. [PubMed] [DOI] |
| 8. | Li Z, Zhu Z, Wang Y, Wang Y, Li W, Wang Z, Zhou X, Bao Y. hsamiR15a5p inhibits colon cell carcinoma via targeting CCND1. Mol Med Rep. 2021;24. [PubMed] [DOI] |
| 9. | Guo Y, Gao X, An S, Li X, Pan L, Liu H, Liu J, Gao J, Zhao Z, Li G, Han Y, Li Y, Ji Z. Deletion of miR-15a inhibited glioma development via targeting Smad7 and inhibiting EMT pathway. Aging (Albany NY). 2021;13:24339-24348. [PubMed] [DOI] |
| 10. | Zhang X, He Y, Gu H, Liu Z, Li B, Yang Y, Hao J, Hua R. Construction of a Nine-MicroRNA-Based Signature to Predict the Overall Survival of Esophageal Cancer Patients. Front Genet. 2021;12:670405. [PubMed] [DOI] |
| 11. | Xu J, Yin Z, Yang L, Wu F, Fan J, Huang Q, Jin Y, Yang G. Evidence that dysplasia related microRNAs in Barrett's esophagus target PD-L1 expression and contribute to the development of esophageal adenocarcinoma. Aging (Albany NY). 2020;12:17062-17078. [PubMed] [DOI] |
| 12. | Zhang Y, Zhang Z. The history and advances in cancer immunotherapy: understanding the characteristics of tumor-infiltrating immune cells and their therapeutic implications. Cell Mol Immunol. 2020;17:807-821. [PubMed] [DOI] |
| 13. | Budimir N, Thomas GD, Dolina JS, Salek-Ardakani S. Reversing T-cell Exhaustion in Cancer: Lessons Learned from PD-1/PD-L1 Immune Checkpoint Blockade. Cancer Immunol Res. 2022;10:146-153. [PubMed] [DOI] |
| 14. | Wu X, Zhang H, Xing Q, Cui J, Li J, Li Y, Tan Y, Wang S. PD-1(+) CD8(+) T cells are exhausted in tumours and functional in draining lymph nodes of colorectal cancer patients. Br J Cancer. 2014;111:1391-1399. [PubMed] [DOI] |