修回日期: 2024-08-02
接受日期: 2024-08-14
在线出版日期: 2024-08-28
白术内酯Ⅰ(atractylenolide Ⅰ, AT-1)具有抗炎、抗氧化、抑制肠损伤和改善肠屏障功能的作用, 但其对术后肠梗阻(postoperative ileus, POI)的影响和机制并不清楚.
探讨AT-1对POI大鼠的肠功能、炎症反应、细菌移位及肠道屏障的影响, 并探讨初步机制.
60只泼累格·多雷雄性大鼠, 分为5组: 对照组、模型组、及低、中、高剂量AT-1干预组, 每组12只. 用摩擦肠管法构建POI大鼠模型, 低、中、高剂量AT-1干预组分别在造模前1 h和造模后1-3 d通过尾静脉注射20、40和80 mg/kg AT-1, 每天1次. 肠推进实验评估肠推进功能, 异硫氰酸酯-葡聚糖法检测肠通透性; 苏木精-伊红染色观察小肠组织病理形态; 生化分析仪计数外周血白细胞和粒细胞含量, 酶联免疫吸附试验法检测血清中白细胞介素(interleukin, IL)-6、IL-1β、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、内毒素、脂多糖和D-乳酸水平; 免疫组化检测肠组织中溶霉菌(Lysozyme)、绒毛蛋白(Villin)、闭锁小带蛋白1(zonula occludens protein 1, ZO-1)和密封蛋白(Claudin)表达分布情况; 蛋白质免疫印迹法检测肠组织中核因子κB(nuclear factor kappa-B, NF-κB)相关蛋白表达.
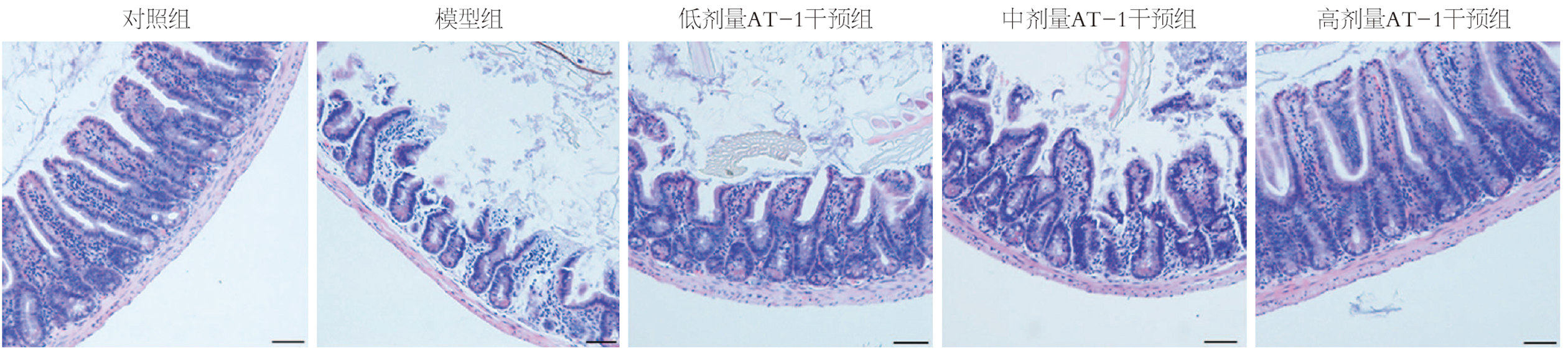
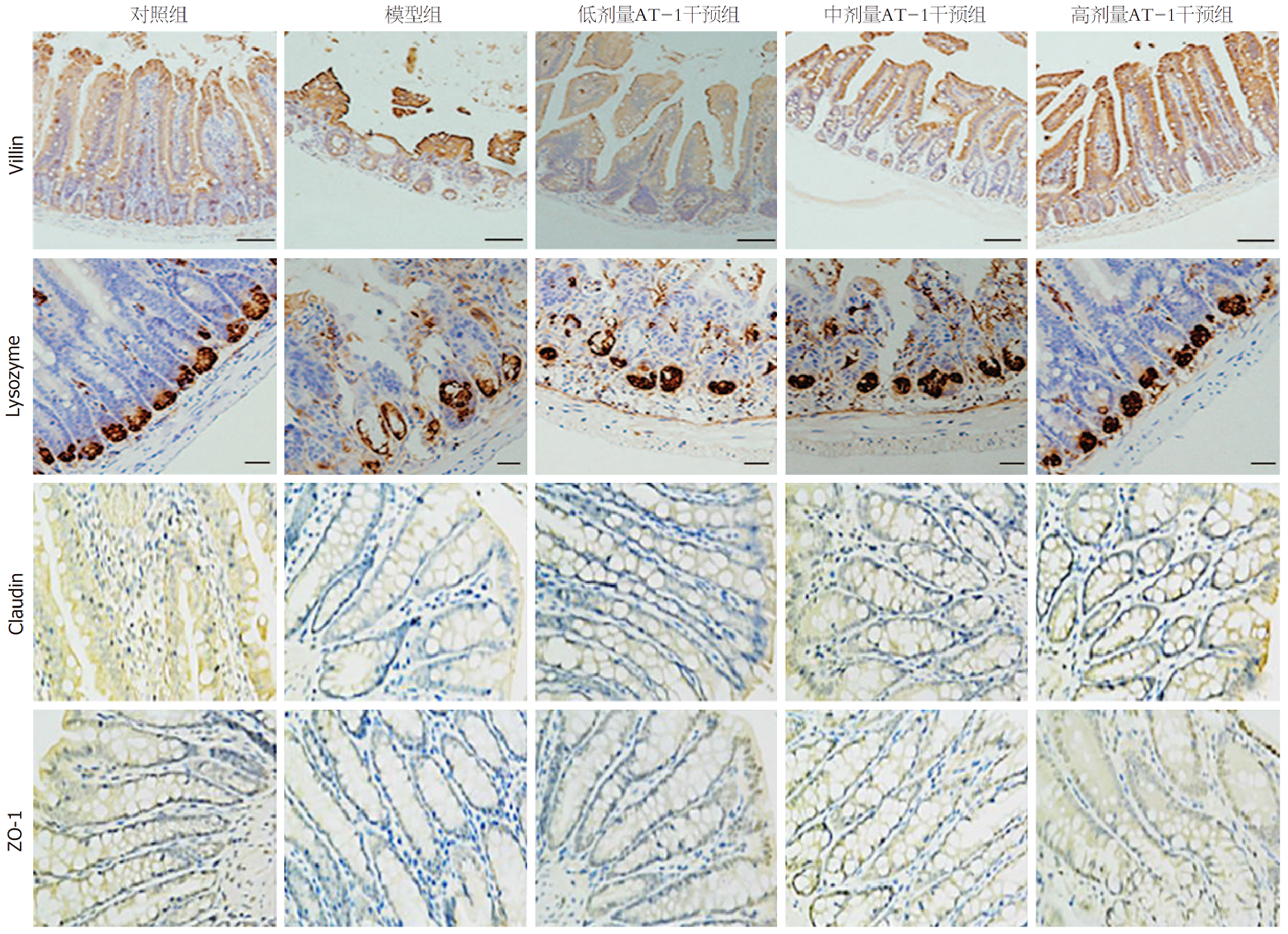
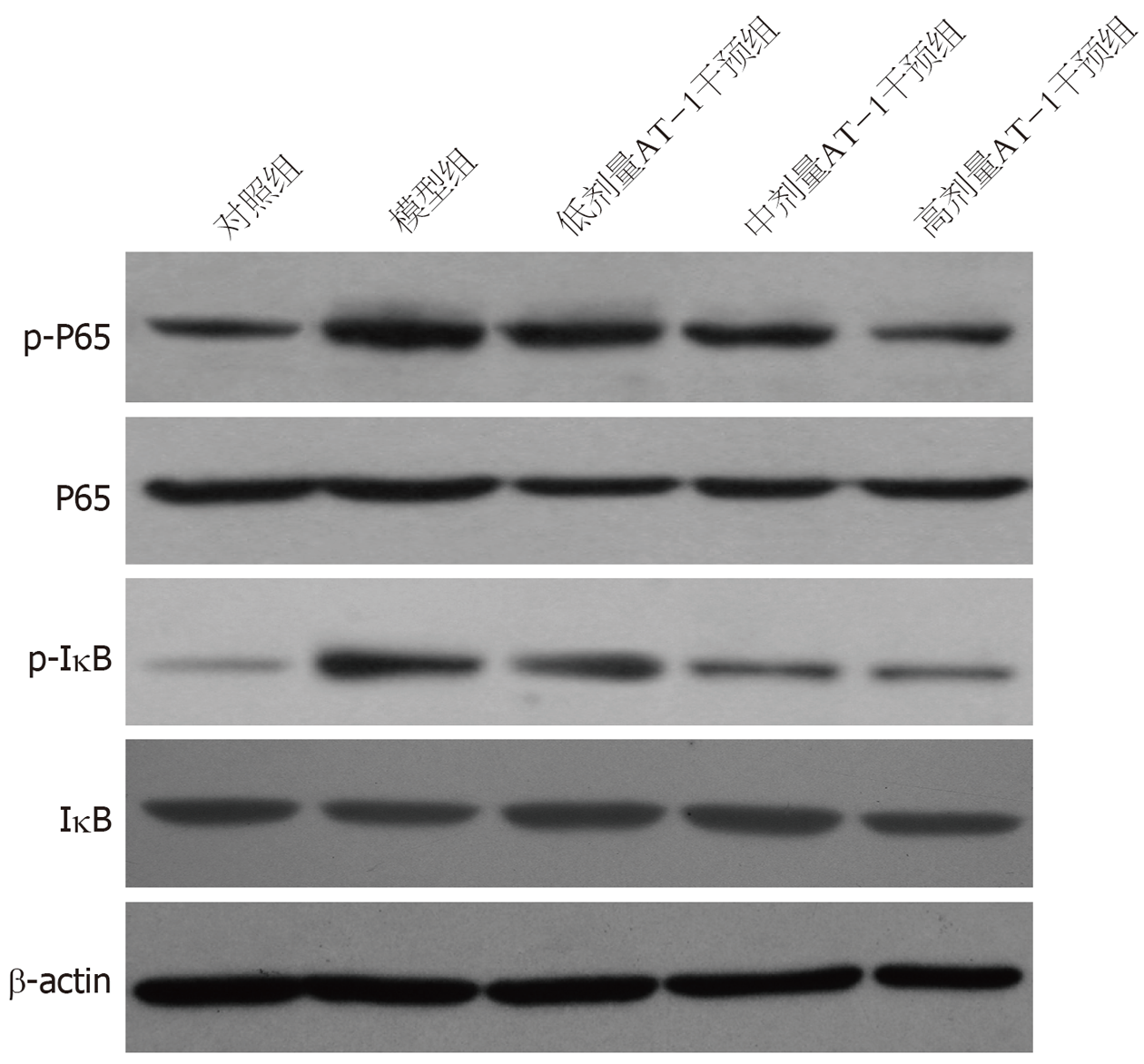
相比于对照组, 模型组小肠绒毛断裂或脱落, 隐窝丢失, 肠推进功能降低, 肠道通透性增加; 相比于模型组, AT-1干预组小肠绒毛变长和隐窝增多, 肠推进功能增高, 肠道通透性降低. 免疫组化结果显示, 相比于对照组, 模型组小肠组织中Lysozyme、Villin、ZO-1和Claudin表达降低, 而AT-1干预组上述蛋白表达增高. 生化检验结果显示, 相比于对照组, 模型组外周血中白细胞和中性粒细胞数增多, 血清中IL-6、IL-1β、TNF-α、内毒素、脂多糖和D-乳酸水平增高; 相比于模型组, AT-1干预组上述血液学指标均降低. 蛋白质免疫印迹法检测结果显示, 相比于对照组, 模型组小肠组织中磷酸化(phospho, p)-P65/P65和磷酸化NF-κB抑制蛋白(phospho-inhibitor of NF-κB, p-IκB)/IκB的表达水平均升高; 相比于模型组, AT-1干预组p-P65/P65和p-IκB/IκB的表达水平均降低. 且以上结果均具有剂量效应.
AT-1可有效抑制POI大鼠肠道损伤、炎症反应和NF-κB信号活性, 同时维持肠屏障功能的完整性并阻止细菌移位.
核心提要: 白术内酯Ⅰ可改善术后肠梗阻模型大鼠的肠组织病理学表现和肠功能, 降低肠道炎症反应, 保持肠屏障功能并抑制细菌移位, 此外, 它还能抑制肠道核因子κB信号通路的活性.
引文著录: 王一昌, 周应. 白术内酯Ⅰ改善术后肠梗阻大鼠的肠功能、炎症反应、细菌移位及肠道屏障. 世界华人消化杂志 2024; 32(8): 616-624
Revised: August 2, 2024
Accepted: August 14, 2024
Published online: August 28, 2024
Atractylenolide I (AT-1) exhibits anti-inflammatory and antioxidant properties, as well as the ability to inhibit intestinal injury while improving intestinal barrier function. However, the effect and mechanism of AT-1 on postoperative ileus (POI) remain unclear.
To investigate the effects of AT-1 on intestinal function, inflammatory response, bacterial translocation, and intestinal barrier function in rats with POI, and to analyze the underlying mechanism.
Sixty male Sprague-Dawley rats were divided into five groups: Control group, model group, and low-, medium-, and high-dose AT-1 intervention groups, with 12 rats in each group. The POI rat model was established using the frictional intestinal method, and the low, medium, and high-dose AT-1 intervention groups were administered 20, 40, and 80 mg/kg of AT-1 via the tail vein 1 h before modeling and once daily for 1-3 d post-modeling. The intestinal propulsion test was utilized for the evaluation of intestinal motility function, while the fluoresceine isothiocyanate-dextran method was employed to assess intestinal permeability. Hematoxylin-eosin staining was conducted to observe the pathological morphology of the small intestine. The levels of white blood cells and neutrophils in peripheral blood were quantified using a biochemical analyzer. Enzyme-linked immunosorbent assay was performed to measure the levels of interleukin (IL)-6, IL-1β, tumor necrosis factor α (TNF-α), endotoxin, lipopolysaccharide, and D-lactate in serum. Immunohistochemistry was applied to detect the expression and distribution of Lysozyme, Villin, zonula occludens protein 1 (ZO-1), and Claudin in intestinal tissues. Western blot analysis was used for detecting the expression of nuclear factor kappa-B (NF-κB) related proteins in intestinal tissue.
Compared to the control group, the model group exhibited disrupted or sloughed intestinal villi, loss of crypts, reduced intestinal motility, and increased intestinal permeability. In contrast to the model group, the AT-1 intervention groups demonstrated elongated villi and increased number of crypts in the small intestine, enhanced intestinal motility, and decreased intestinal permeability. Immunohistochemistry analysis revealed a significant decrease in the expression of Lysozyme, Villin, ZO-1, and Claudin in the small intestinal tissue of the model group compared to the control group. Conversely, the AT-1 intervention groups exhibited an increase in the expression of these proteins. Biochemical tests demonstrated that compared to the control group, the model group displayed elevated levels of white blood cells and neutrophils in peripheral blood as well as increased levels of IL-6, IL-1β, TNF-α, endotoxin, lipopolysaccharide, and D-lactic acid in serum. In contrast, these hematological parameters were significantly reduced in the AT-1 intervention groups when compared to the model group. Western blot analysis revealed that the expression levels of phospho(p)-P65/P65 and phospho-inhibitor of NF-κB (p-IκB)/IκB in the small intestinal tissue of the model group were significantly elevated compared to the control group. In contrast, the intervention groups exhibited reduced expression levels of p-P65/P65 and p-IκB/IκB when compared to the model group. All these findings demonstrated a dose-dependent effect.
AT-1 effectively inhibits intestinal injury, inflammatory response, and NF-κB signaling activity in rats with postoperative ileus (POI), while preserving the integrity of the intestinal barrier function and preventing bacterial translocation.
- Citation: Wang YC, Zhou Y. Atractylenolide I improves intestinal function, inflammatory response, bacterial translocation, and intestinal barrier function in postoperative ileus rats. Shijie Huaren Xiaohua Zazhi 2024; 32(8): 616-624
- URL: https://www.wjgnet.com/1009-3079/full/v32/i8/616.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i8.616
术后肠梗阻(postoperative ileus, POI)为腹部手术常见的一种术后并发症[1,2]. 研究表明, 炎症反应和肠屏障障碍在POI的进展中发挥关键作用, 其不仅能加剧肠损伤、肠黏连和影响肠蠕动, 还能导致细菌移位[3,4]. 因此抑制炎症反应和维持肠屏障完整性可能是治疗POI的关键策略. 白术内酯Ⅰ(atractylenolide Ⅰ, AT-1)为白术干燥根茎提取的具有药理活性内酯类化合物之一, 现代药理学研究表明其具有抗炎、抗氧化和抗肿瘤等多种药理作用[5-7]. 在胃肠道相关疾病的研究表明, AT-1能抑制肠损伤并改善肠屏障功能[8,9]. 而, AT-1对POI的影响和机制并不清楚, 因此, 本研究分析AT-1对POI大鼠肠功能、炎症、肠屏障功能以及细菌移位的影响, 并分析其机制.
1.1.1 主要药物、试剂: AT-1(纯度>98%)购自南京道斯夫生物科技有限公司; 大鼠白细胞介素(interleukin, IL)-6(#900-K86)、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)(#900-T73)及IL-1β(#900-K91)酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)检测试剂盒均购自于派普泰克生物科技(苏州)有限公司; 大鼠内毒素ELISA检测试剂盒(#CS-E01819)购自上海莼试生物技术有限公司; 大鼠D-乳酸ELISA检测试剂盒(#ZK-R3050)购自深圳子科生物科技有限公司; 大鼠脂多糖ELISA检测试剂盒(#J22822)购自武汉吉立德生物科技有限公司; 异硫氰酸酯(fluoresceine isothiocyanate, FITC)-葡聚糖(#ZTC-FD4)购自上海甄准生物科技有限公司; 溶霉菌(Lysozyme)、闭锁小带蛋白1(zonula occludens protein 1, ZO-1)、绒毛蛋白(Villin)、密封蛋白(Claudin)、核因子κB(nuclear factor kappa-B, NF-κB)P65、磷酸化(phospho, p)-P65、NF-κB的抑制蛋白(inhibitor of NF-κB, IκB)及p-IκB抗体购自武汉三鹰生物技术有限公司; β-肌动蛋白(β-actin)抗体及二抗购自上海碧云天生物科技公司.
1.1.2 研究动物: 60只无特定病原体级雄性泼累格·多雷大鼠, 体质量220 g-240 g, 购自杭州启真实验动物科技有限公司, 生产许可证号为SCXK(浙)2022-0005. 遵照实验动物管理与保护中心要求及规定, 对大鼠的进行饲养. 整体环境: 饲养环境22 oC-25 oC; 相对湿度为40%-60%左右, 噪音小于80 dB, 通风换气6次/h, 由实验室工作人员统一管理、饲养, 在进行饲养过程中, 行10 h/d光照, 满足大鼠日常饮水、饮食情况, 维持大鼠健康状态, 在经过7 d的适应性饲养, 随后进行实验. 动物实验获得宁波市第六医院伦理委员会审查, 批件号: 甬六医伦审2023论第73号.
1.2.1 分组与建模: 将12只大鼠作为对照组, 其余48只参照文献[10]建立POI大鼠模型. 术前对大鼠进行12 h禁食不禁水, 次日, 用戊巴比妥腹腔麻醉后, 在大鼠下腹3 cm位置进行切口, 暴露小肠, 取出小肠, 外置两层纱布, 从小肠末端开始, 从下至上的方向, 擦拭肠管至幽闭环, 连续进行6次; 接着将全部的肠管, 置于腹腔内, 理顺小肠, 防止小肠扭转; 最后缝合关腹. 在建模过程中无死亡, 所有大鼠建模成功, 将其分为模型组、及低、中、高剂量AT-1干预组. 低、中、高剂量AT-1干预组分别在造模前1 h和造模后1 d-3 d通过尾静脉注射20、40和80 mg/kg AT-1, 每天1次. 模型组和对照组给予同体积0.9%氯化钠溶液注射. 干预结束后进行后续实验.
1.2.2 血生化检测: 大鼠禁食过夜, 次日收集眼眶静脉血(0.3 mL/只), 取0.1 mL/只分别进行抗凝处理后, 用动物生化分析仪检测血中白细胞和中性粒细胞含量. 剩余以离心法分离血清, 并依照相应试剂盒说明书, 用ELISA法检测血清中IL-6、IL-1β、TNF-α、内毒素、D-乳酸和脂多糖水平.
1.2.3 肠通透性检测: 采用FITC-葡聚糖法检测肠通透性. 每组任选5只大鼠, 禁食过夜, 次日按400 mg/kg灌胃FITC-葡聚糖, 4 h后, 收集静脉血, 荧光酶标仪检测血中FITC-葡聚糖含量.
1.2.4 胃肠动力功能检测: 每组任选5只大鼠, 伊文氏蓝溶液(0.2 mL/只)灌胃, 1 h后, 麻醉大鼠, 开腹取整个小肠, 并计算小肠推进率. 小肠推进率 = 蓝染(小肠)长度/小肠总长度×100%.
1.2.5 病理学观察: 将大鼠麻醉后, 取小肠组织, 用5%多聚甲醛进行24 h固定, 常规步骤用石蜡包埋肠组织. 用切片机将石蜡包埋的小肠组织进行切片(5 μm厚度), 将小肠切片烘干后脱蜡, 采用梯度酒精、蒸馏水行水化及洗涤, 之后使用苏木精-伊红染色, 于光学显微镜下观察大鼠小肠组织病理形态变化情况.
1.2.6 免疫组化染色: 取小肠切片脱蜡、水化后, 用3%H2O2处理30 min. 洗涤后, 切片用5%牛血清白蛋白封闭1 h, 以免疫组化试剂盒步骤, 按链霉菌抗生物素蛋白-过氧化物酶连结法肠组织中Lysozyme、Villin、ZO-1和Claudin, 用DAB显色. 光学显微镜下观察, 并用Image J软件依据阳性细胞数和表达强度值自动统计阳性表达的免疫组化积分, 积分>0代表阳性, 积分越高代表阳性表达越高.
1.2.7 蛋白质免疫印迹法实验: 小肠组织中蛋白质依照组织蛋白提取试剂盒说明进行萃取. 每孔上样20 μg蛋白质进行电泳和转印. 用5%脱脂奶封闭膜上蛋白, 一抗[P65、p-P65、IκB、p-IκB抗体(1:2000稀释), β-actin(1:7000稀释)]于摇床上室温孵育, 共孵育100 min, 进行3次洗膜(3 min/次)后, 滴加辣根过氧化物酶-羊抗兔二抗(1:1000稀释)于摇床上室温孵育, 共孵育45 min, 再进行3次洗膜(10 min/次)后, 利用化学发光成像仪显影, 用Image J软件统计各蛋白印迹光密度值.
统计学处理 采用SPSS 19.0统计软件包进行统计分析处理. 计量资料采用均数±标准差(mean±SD)描述, 多组间比较采用方差分析, P<0.05表示差异有统计学意义.
如图1和表1所示, 对照组大鼠小肠组织肠绒毛完整, 肠上皮细胞排列整齐完整; 模型组小肠组织中肠上皮细胞排列结构破坏, 肠绒毛出现断裂或脱落, 平均绒毛长度较对照组明显缩短(P<0.05), 隐窝数降低(P<0.05); 低、中和高剂量AT-1干预组小肠组织中肠上皮细胞结构逐渐恢复至清晰、完整状态, 肠绒毛完整性得到改善, 肠绒毛长度较模型组明显增长(P<0.05), 隐窝数增多(P<0.05), 且呈现剂量依赖性.
如表2所示, 相比于对照组, 模型组小肠推进率下降(P<0.05); 相比于模型组, 低、中和高剂量AT-1干预组小肠推进率水平上升(P<0.05), 且呈现剂量依赖性.
如表3所示, 相比于正常组, 模型组外周血中白细胞和中性粒细胞含量以及血清中IL-6、IL-1β、TNF-α水平均上升(P<0.05); 相比于模型组, 低、中和高剂量AT-1干预组上述血液学炎症指标水平均降低(P<0.05), 且呈现剂量依赖性.
| 组别 | 白细胞(109/L) | 中性粒细胞(109/L) | IL-6(ng/L) | IL-1β(ng/L) | TNF-α(ng/L) |
| 对照组 | 6.25±1.04 | 5.85±1.13 | 156.74±23.74 | 2.53±0.82 | 14.52±4.42 |
| 模型组 | 44.12±6.68a | 123.46±18.74a | 875.53±102.46a | 35.42±8.12a | 93.23±20.52a |
| 低剂量AT-1干预组 | 30.56±4.02b | 74.52±13.26b | 623.52±75.44b | 23.45±5.78b | 61.45±18.56b |
| 中剂量AT-1干预组 | 23.31±3.56bc | 45.35±4.52bc | 432.24±58.74bc | 13.56±3.58bc | 40.56±7.36bc |
| 高剂量AT-1干预组 | 13.45±2.62bcd | 23.45±5.65bcd | 287.62±43.26bcd | 9.78±1.82bcd | 25.46±5.53bcd |
| F | 63.214 | 86.325 | 56.718 | 98.362 | 83.479 |
| P | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 |
如表4所示, 相比于正常组, 模型组外周血中脂多糖、内毒素和D-乳酸水平均上升(P<0.05); 相比于模型组, 低、中和高剂量AT-1干预组脂多糖、内毒素和D-乳酸水平均降低(P<0.05), 且呈现剂量依赖性. 以上说明AT-1能减轻POI大鼠肠内细菌及其代谢物移位. 细菌移位与肠渗透性和肠屏障完整性有关[11,12]. 本研究进一步检测了肠渗透性和肠屏障相关蛋白表达与分布. 结果如表4, AT-1剂量依赖性抑制小肠对FITC-葡聚糖的渗透性. 免疫组化结果(图2和表5)显示, 相比于正常组, 模型组小肠组织中Lysozyme、Villin、ZO-1和Claudin表达水平均降低(P<0.05); 相比于模型组, 低、中和高剂量AT-1干预组小肠组织中Lysozyme、Villin、ZO-1和Claudin表达水平均增加(P<0.05), 且呈现剂量依赖性.
| 组别 | 脂多糖(μg/L) | 内毒素(μg/L) | D-乳酸(mmol/L) | FITC-葡聚糖 (mg/L) |
| 对照组 | 5.06±1.75 | 4.85±1.04 | 0.68±0.12 | 3.46±0.52 |
| 模型组 | 64.38±12.28a | 33.52±5.38a | 2.43±0.37a | 18.46±2.34a |
| 低剂量AT-1干预组 | 34.44±7.61b | 17.13±3.02b | 1.85±0.24b | 12.38±2.36b |
| 中剂量AT-1干预组 | 26.26±4.02bc | 12.31±2.48bc | 1.34±0.25bc | 6.78±0.54bc |
| 高剂量AT-1干预组 | 17.35±2.43bcd | 7.03±1.84bcd | 0.89±0.16bcd | 4.12±0.73bcd |
| F | 87.526 | 93.302 | 21.146 | 35.412 |
| P | <0.001 | <0.001 | <0.001 | <0.001 |
| 组别 | Villin表达 | Lysozyme表达 | Claudin表达 | ZO-1表达 |
| 对照组 | 6.24±1.02 | 4.36±0.32 | 3.21±0.34 | 3.54±0.47 |
| 模型组 | 1.32±0.17a | 1.47±0.28a | 0.86±0.15a | 0.73±0.12a |
| 低剂量AT-1干预组 | 2.31±0.35b | 1.73±0.24b | 1.43±0.21b | 1.58±0.23b |
| 中剂量AT-1干预组 | 3.42±0.54bc | 2.45±0.36bc | 2.23±0.26bc | 2.43±0.35bc |
| 高剂量AT-1干预组 | 5.46±0.72bcd | 3.58±0.41bcd | 3.04±0.45bcd | 3.12±0.35bcd |
| F | 56.732 | 44.502 | 25.324 | 30.624 |
| P | <0.001 | <0.001 | <0.001 | <0.001 |
NF-κB信号通路在炎症反应中发挥着关键作用[13,14]. 因此, 本研究进一步用Western blot检测了小肠组织中NF-κB信号通路相关蛋白p-P65/P65和p-IκB/IκB的表达, 结果如图3和表6所示, 相比于对照组, 模型组p-P65/P65和p-IκB/IκB的表达水平均增高(P<0.05); 相比于模型组, 低、中和高剂量AT-1干预组p-P65/P65和p-IκB/IκB的表达水平均降低(P<0.05), 且呈现剂量依赖性.
腹部手术后常见的POI会增加患者并发症风险, 并延长术后康复时间[1,2]. 临床上对于POI的认知主要表现为, 腹部手术后患者可能出现不同程度的应激反应, 导致胃肠动力障碍, 进而引起肠道炎症和胃肠功能异常等情况[1,2]. 促进胃肠功能恢复可显著改善肠梗阻情况并缩短术后康复时间[1,2,15]. 目前尚无理想的POI预防和治疗措施, 因此寻找有效药物来预防和治疗POI具有重要意义. 本项研究结果显示AT-1能够改善与肠梗阻相关的症状、增强消化道推进功能, 表明其可能具备改善POI效果的潜力.
过度的肠道炎症反应是导致POI发生和发展的关键因素[3,4]. 腹部手术会引起机体创伤性刺激, 进而导致胃肠道内发生炎症反应、肠道黏连以及对正常胃肠功能运行的影响, 从而使小肠呈现水肿状态, 并随之引发肠梗阻[1,2,15,16]. 在这一过程中, 机体释放大量炎症因子, 触发级联反应, 进一步加重了肠道炎症反应[16,17]. 此外有证据表明[18], 术后增加的肠道内部炎性与肠梗阻严重程度相关联. 因此, 改善肠道炎性可以在一定程度上缓解肠梗阻情况. 白细胞和中性粒细胞含量以及血清中IL-6、IL-1β和TNF-α等多种血液学指标能在某种程度上反映机体内部的炎性状态[16-18]. 本项实验结果显示, AT-1干预治疗的POI模型大鼠的外周血液中白细胞和中性粒细胞含量以及血清中IL-6、IL-1β和TNF-α等多种促发物下降; 这表明AT-1具备抑制POI进展过程中产生的不良免疫反应能力. 并且, 本研究进一步分析了调节炎症的关键信号通路-NF-κB信号通路[13,14]. 已有研究表明[19], 在POI模型的小肠组织中, NF-κB信号信号被激活, 而选择性抑制NF-κB信号能降低POI模型中的肠道炎症. 本研究也发现, AT-1能抑制小肠组织中p-P65/P65和p-IκB/IκB的表达, 即抑制了NF-κB信号活性.
此外, POI发生与进展还与肠通透性密切相关[11,12]. 本研究使用FITC-葡聚糖实验证明了AT-1能改善POI大鼠的肠道通透性. 肠道屏障的完整性直接影响着肠道通透性, 而这一完整性是阻止病原体进入体循环的关键因素[11,12]. 已有证据表明, POI动物模型中的肠道屏障功能和完整性均受损. 细菌及其代谢产物移位是导致POI肠道屏障功能受损的有害后果之一, 当它们进入体循环后会加剧炎症和免疫反应, 并可能引发多种并发症甚至菌血症[20]. 本研究结果表明, AT-1能有效降低POI大鼠外周血中脂多糖、内毒素和D-乳酸含量, 从而显示出抑制细菌及其代谢物移位的潜力. 肠道黏膜屏障是肠道屏障防御的首要物理屏障, 其包括黏膜完整性和上皮细胞紧密连接相关蛋白(如ZO-1和Claudin)的丰度[11,12,21]. 本研究结果表明, POI可引起绒毛断裂或脱落、Villin表达下调以及黏膜上皮损伤, 并导致ZO-1和Claudin表达水平降低; 而AT-1干预能够保持绒毛和黏膜上皮完整性, 并提高ZO-1和Claudin的表达水平. 此外, 肠道屏障还与小肠隐窝和潘氏细胞等因素相关联[22]. 小肠隐窝中存在着肠干细胞, 其对小肠黏膜修复至关重要[22]. 潘氏细胞则分泌具有杀菌和溶菌作用的防御素以及溶菌酶, 从而发挥着保护肠道屏障功能的作用[22,23]. 本研究显示, 在POI大鼠小肠组织中, 隐窝数量减少并且潘氏细胞(Lysozyme阳性)密度降低; 然而AT-1干预可以抑制POI引起的隐窝以及潘氏细胞丢失现象. 总之, AT-1通过增加ZO-1和Claudin表达水平、抑制POI诱导下的隐窝与潘氏细胞丢失、保护肠粘膜免受损伤等机制, 有效地维持了肠屏障作用并抑制了细菌及其代谢产物移位现象.
经综合分析, 本研究发现AT-1可能通过削弱NF-κB信号途径来降低POI大鼠肠道炎症的程度, 其还能通过上调ZO-1和Claudin的表达, 并抑制POI引起的隐窝和潘氏细胞丧失以及肠黏膜损伤, 从而保持肠屏障功能并抑制细菌及其代谢物移位. 这些结果提示了AT-1可作为一种潜在有效的POI治疗药物.
术后肠梗阻(postoperative ileus, POI)是腹部手术常见的并发症, 炎症反应和肠屏障障碍在其进展中起关键作用, 抑制炎症反应和维持肠屏障完整性可能是治疗的关键策略.
白术内酯Ⅰ(attractylenolide Ⅰ, AT-1)具有抗炎和抗氧化的药理作用, 且已被证实能够抑制肠损伤并改善肠屏障功能; 据此推测, 它可能对POI具有治疗潜力.
验证AT-1对POI具有治疗作用并探索其机制.
建立POI大鼠模型, 分别给予低[20 mg/(kg•d)]、中[40 mg/(kg•d)]和高[80 mg/(kg•d)]剂量AT-1治疗3 d. 评估肠功能和肠通透性, 并对肠组织进行形态学、免疫组化学和蛋白质免疫印迹检测, 同时监测血液学指标.
AT-1能剂量依赖性改善肠组织形态学, 提高肠功能, 降低肠通透性, 上调肠屏障相关蛋白表达, 减弱肠核因子κB信号, 降低外周血中白细胞和中性粒细胞含量降低和血清中促炎因子、内毒素、脂多糖和D-乳酸水平.
AT-1治疗可改善POI大鼠的肠组织形态学, 抑制肠通透性、肠道炎症、NF-κB信号活性和细菌移位并增强肠屏障.
AT-1可能是一种POI潜在的治疗药物.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B, B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Wattchow D, Heitmann P, Smolilo D, Spencer NJ, Parker D, Hibberd T, Brookes SSJ, Dinning PG, Costa M. Postoperative ileus-An ongoing conundrum. Neurogastroenterol Motil. 2021;33:e14046. [PubMed] [DOI] |
| 2. | Lin Z, Yang C, Wang Y, Yan M, Zheng H. Comparison of prolonged postoperative ileus between laparoscopic right and left colectomy under enhanced recovery after surgery: a propensity score matching analysis. World J Surg Oncol. 2022;20:68. [PubMed] [DOI] |
| 3. | Buscail E, Deraison C. Postoperative ileus: A pharmacological perspective. Br J Pharmacol. 2022;179:3283-3305. [PubMed] [DOI] |
| 4. | Hellstrom EA, Ziegler AL, Blikslager AT. Postoperative Ileus: Comparative Pathophysiology and Future Therapies. Front Vet Sci. 2021;8:714800. [PubMed] [DOI] |
| 5. | Du Z, Ma Z, Lai S, Ding Q, Hu Z, Yang W, Qian Q, Zhu L, Dou X, Li S. Atractylenolide I Ameliorates Acetaminophen-Induced Acute Liver Injury via the TLR4/MAPKs/NF-κB Signaling Pathways. Front Pharmacol. 2022;13:797499. [PubMed] [DOI] |
| 6. | Qin Y, Yu Y, Yang C, Wang Z, Yang Y, Wang C, Zheng Q, Li D, Xu W. Atractylenolide I Inhibits NLRP3 Inflammasome Activation in Colitis-Associated Colorectal Cancer via Suppressing Drp1-Mediated Mitochondrial Fission. Front Pharmacol. 2021;12:674340. [PubMed] [DOI] |
| 7. | Chan KWK, Chung HY, Ho WS. Anti-Tumor Activity of Atractylenolide I in Human Colon Adenocarcinoma In Vitro. Molecules. 2020;25. [PubMed] [DOI] |
| 8. | Wang A, Xiao Z, Zhou L, Zhang J, Li X, He Q. The protective effect of atractylenolide I on systemic inflammation in the mouse model of sepsis created by cecal ligation and puncture. Pharm Biol. 2016;54:146-150. [PubMed] [DOI] |
| 9. | Song HP, Hou XQ, Li RY, Yu R, Li X, Zhou SN, Huang HY, Cai X, Zhou C. Atractylenolide I stimulates intestinal epithelial repair through polyamine-mediated Ca(2+) signaling pathway. Phytomedicine. 2017;28:27-35. [PubMed] [DOI] |
| 10. | Kim GM, Sohn HJ, Choi WS, Sohn UD. Improved motility in the gastrointestinal tract of a postoperative ileus rat model with ilaprazole. Korean J Physiol Pharmacol. 2021;25:507-515. [PubMed] [DOI] |
| 11. | Tulkens J, Vergauwen G, Van Deun J, Geeurickx E, Dhondt B, Lippens L, De Scheerder MA, Miinalainen I, Rappu P, De Geest BG, Vandecasteele K, Laukens D, Vandekerckhove L, Denys H, Vandesompele J, De Wever O, Hendrix A. Increased levels of systemic LPS-positive bacterial extracellular vesicles in patients with intestinal barrier dysfunction. Gut. 2020;69:191-193. [PubMed] [DOI] |
| 12. | Hu Q, Ren H, Li G, Wang D, Zhou Q, Wu J, Zheng J, Huang J, Slade DA, Wu X, Ren J. STING-mediated intestinal barrier dysfunction contributes to lethal sepsis. EBioMedicine. 2019;41:497-508. [PubMed] [DOI] |
| 13. | Zhou L, Zhu L, Wu X, Hu S, Zhang S, Ning M, Yu J, Chen M. Decreased TMIGD1 aggravates colitis and intestinal barrier dysfunction via the BANF1-NF-κB pathway in Crohn's disease. BMC Med. 2023;21:287. [PubMed] [DOI] |
| 14. | Chen G, Ran X, Li B, Li Y, He D, Huang B, Fu S, Liu J, Wang W. Sodium Butyrate Inhibits Inflammation and Maintains Epithelium Barrier Integrity in a TNBS-induced Inflammatory Bowel Disease Mice Model. EBioMedicine. 2018;30:317-325. [PubMed] [DOI] |
| 15. | Stakenborg N, Gomez-Pinilla PJ, Boeckxstaens GE. Postoperative Ileus: Pathophysiology, Current Therapeutic Approaches. Handb Exp Pharmacol. 2017;239:39-57. [PubMed] [DOI] |
| 16. | Yang NN, Yang JW, Ye Y, Huang J, Wang L, Wang Y, Su XT, Lin Y, Yu FT, Ma SM, Qi LY, Lin LL, Wang LQ, Shi GX, Li HP, Liu CZ. Electroacupuncture ameliorates intestinal inflammation by activating α7nAChR-mediated JAK2/STAT3 signaling pathway in postoperative ileus. Theranostics. 2021;11:4078-4089. [PubMed] [DOI] |
| 17. | Hussain Z, Park H. Inflammation and Impaired Gut Physiology in Post-operative Ileus: Mechanisms and the Treatment Options. J Neurogastroenterol Motil. 2022;28:517-530. [PubMed] [DOI] |
| 18. | Lin SS, Zhang RQ, Shen L, Xu XJ, Li K, Bazhin AV, Fichna J, Li YY. Alterations in the gut barrier and involvement of Toll-like receptor 4 in murine postoperative ileus. Neurogastroenterol Motil. 2018;30:e13286. [PubMed] [DOI] |
| 19. | Liu T, Xu M, Shi Z, Li M, Wang R, Shi Y, Xu X, Shao T, Sun Q. Shenhuang plaster ameliorates the Inflammation of postoperative ileus through inhibiting PI3K/Akt/NF-κB pathway. Biomed Pharmacother. 2022;156:113922. [PubMed] [DOI] |
| 20. | Tahara S, Sakai Y, Katsuno H, Urano M, Kuroda M, Tsukamoto T. Pneumatosis intestinalis and hepatic portal venous gas associated with gas-forming bacterial translocation due to postoperative paralytic ileus: A case report. Medicine (Baltimore). 2019;98:e14079. [PubMed] [DOI] |
| 21. | Wang Y, Wang Y, Ma J, Li Y, Cao L, Zhu T, Hu H, Liu H. YuPingFengSan ameliorates LPS-induced acute lung injury and gut barrier dysfunction in mice. J Ethnopharmacol. 2023;312:116452. [PubMed] [DOI] |
| 22. | Abtahi S, Sailer A, Roland JT, Haest X, Chanez-Paredes SD, Ahmad K, Sadiq K, Iqbal NT, Ali SA, Turner JR. Intestinal Epithelial Digestive, Transport, and Barrier Protein Expression Is Increased in Environmental Enteric Dysfunction. Lab Invest. 2023;103:100036. [PubMed] [DOI] |
| 23. | Jiang S, Miao Z. High-fat diet induces intestinal mucosal barrier dysfunction in ulcerative colitis: emerging mechanisms and dietary intervention perspective. Am J Transl Res. 2023;15:653-677. [PubMed] |