修回日期: 2024-06-29
接受日期: 2024-07-30
在线出版日期: 2024-08-28
胃肠动力障碍是糖尿病常见并发症, 随病情进展, 极易引发胃轻瘫、肠动力下降, 影响胃肠道消化吸收,加重代谢紊乱. 目前, 临床缺乏对糖尿病人群胃肠动力障碍风险因素的研究, 难以对临床诊断及早期防控提供指导意见.
观察2型糖尿病(type 2 diabetes mellitus, T2DM)患者胃肠动力障碍发生情况, 进一步构建风险预测模型, 为临床防控提供指导.
选取2022-10/2023-04我院T2DM患者468例, 统计胃肠动力障碍发生情况, Logistic回归分析T2DM发生胃肠动力障碍的影响因素, 进一步建立列线图预测模型, 采用受试者工作特征(receiver operating characteristic, ROC)曲线、校准曲线及决策曲线(decision curve analysis, DCA)评价列线图预测模型的临床效用.
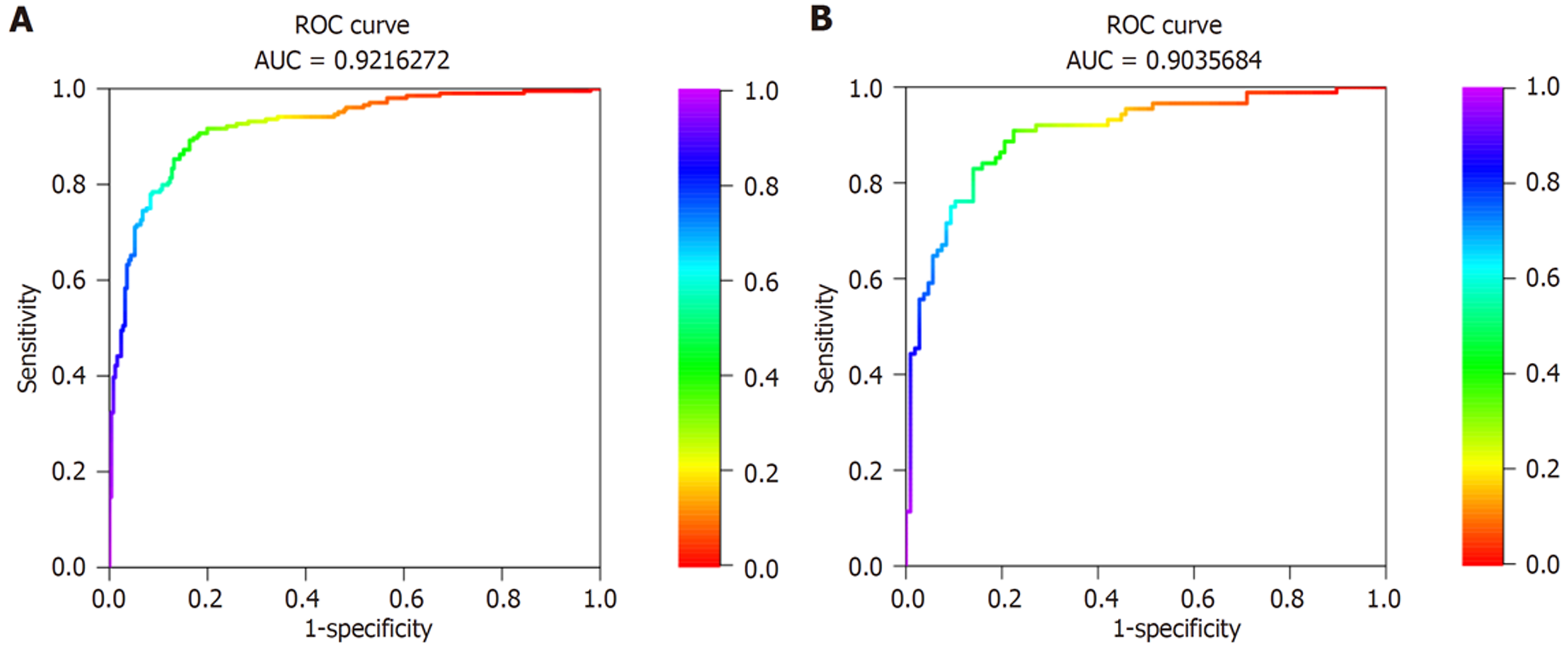
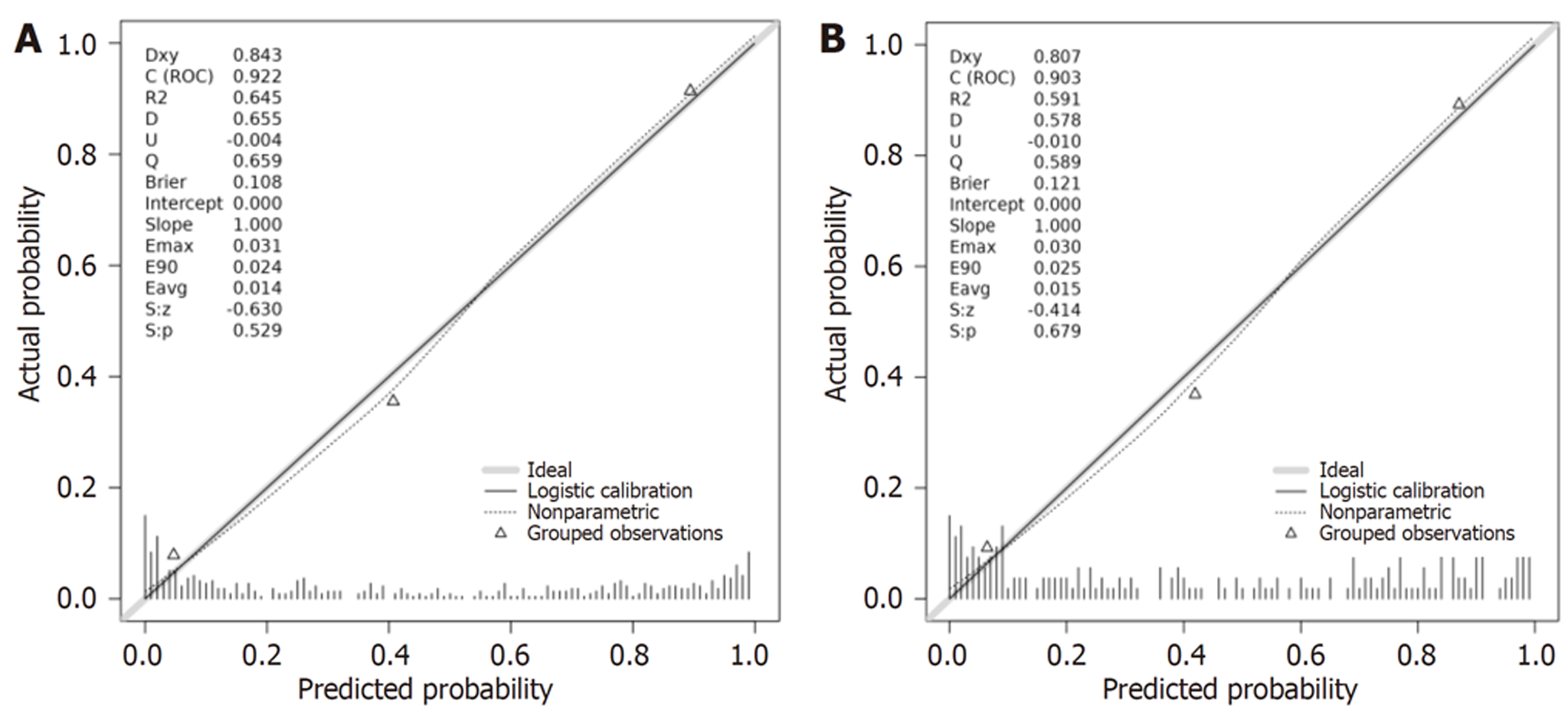
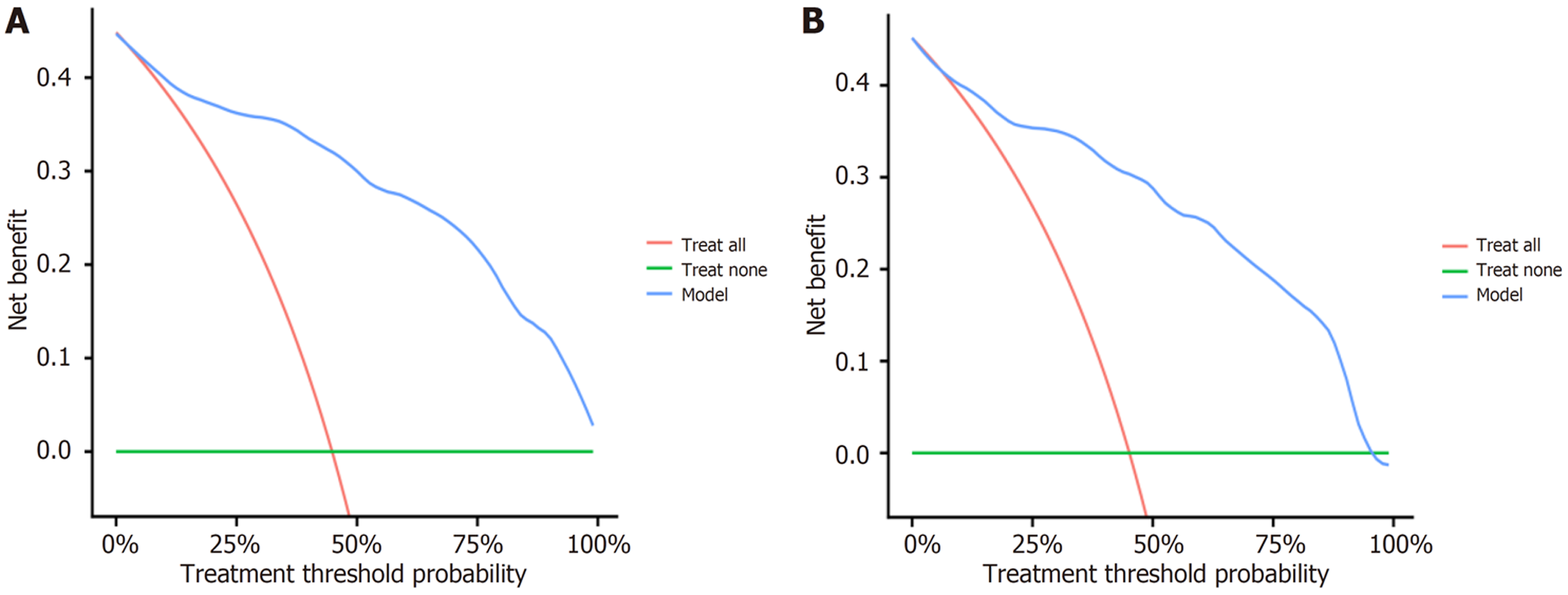
468例T2DM患者, 胃肠动力障碍发生率为44.84%; 胃动力过缓(OR = 4.553, P<0.05)、视网膜病变(OR = 4.676, P<0.05)、周围神经病变(OR = 3.652, P<0.05)、空腹血糖(fasting plasma glucose, FPG)(OR = 5.775, P<0.05)、餐后2h血糖(2h postprandial glucose, 2hPG)(OR = 3.627, P<0.05)、糖化血红蛋白(hemoglobin A1c, HbAlC)(OR = 5.792, P<0.05)、胃肠道症状评定量表(gastrointestinal symptom rating scale, GSRS)评分(OR = 3.939, P<0.05)、汉密尔抑郁量表(Hamilton Depression Scale, HAMD)评分(OR = 3.545, P<0.05)、汉密尔顿焦虑量表(Hamilton Anxiety Scale, HAMA)评分(OR = 4.108, P<0.05)、糖尿病病程(OR = 6.384, P<0.05)、体质量指数(body mass index, BMI)(OR = 3.809, P<0.05)是T2DM患者胃肠动力障碍的独立危险因素; ROC曲线显示列线图模型预测T2DM患者胃肠动力障碍的敏感度、特异度分别为82.36%、96.47%; 校准曲线及DCA提示实际及列线图预测模型预测概率值基本呈线性正相关, 实际曲线与理想曲线基本重合, 且列线图在预测T2DM患者胃肠动力障碍方面具有较好的临床适用性.
T2DM患者存在胃肠运动障碍风险, 且胃动力过缓、视网膜病变、周围神经病变、FPG、2hPG、HbAlc、GSRS评分、HAMD评分、HAMA评分、糖尿病病程、BMI等是其影响因素, 临床工作中加强预测模型构建, 可筛选识别高危人群, 为临床防控干预提供指导.
核心提要: 对于胃肠动力障碍, 临床研究主要集中于疾病治疗, 对未病先防关注较少. 本研究以2型糖尿病(type 2 diabetes mellitus, T2DM)为研究对象, 通过模型构建进一步探究T2DM患者胃肠动力障碍的风险因素, 以期丰富该版块研究数据, 为临床采取针对性、有侧重点的防控措施提供指导.
引文著录: 李定中, 丁佳, 范剑波. 2型糖尿病并发胃肠动力障碍现况及风险预测模型建立和效果评价. 世界华人消化杂志 2024; 32(8): 591-599
Revised: June 29, 2024
Accepted: July 30, 2024
Published online: August 28, 2024
Gastrointestinal motility disorder is a common complication of diabetes, which often leads to gastroparesis and decreased intestinal motility as the disease progresses, affecting gastrointestinal digestion and absorption and aggravating metabolic disorders. Currently, there is a lack of research on the risk factors for gastrointestinal motility disorder in diabetic patients, making it difficult to provide guidance for its clinical diagnosis and early prevention and control.
To observe the incidence of gastrointestinal motility disorder in patients with type 2 diabetes mellitus (T2DM), and construct a risk prediction model for gastrointestinal motility disorder to provide guidance for its clinical prevention and control.
A total of 468 patients with T2DM admitted to our hospital from October 2022 to April 2023 were selected to analyze the incidence of gastrointestinal motility disorder. Logistic regression analysis was used to identify the influencing factors of gastrointestinal motility disorder in T2DM patients. A nomogram prediction model for gastrointestinal motility disorder was established, and the clinical utility of the model was evaluated using receiver operating characteristic (ROC) curve analysis, calibration curve analysis, and decision curve analysis (DCA).
In 468 patients with T2DM, the incidence of gastrointestinal motility disorders was 44.84%. Decreased gastric motility (odds ratio [OR] = 4.553, P < 0.05), retinopathy (OR = 4.676, P < 0.05), peripheral neuropathy (OR = 3.652, P < 0.05), fasting plasma glucose (FPG) (OR = 5.775, P < 0.05), 2-hour postprandial glucose (2hPG) (OR = 3.627, P < 0.05), hemoglobin A1c (HbAlC) (OR = 5.792, P < 0.05), gastrointestinal symptom rating scale (GSRS) score (OR = 3.939, P < 0.05), Hamilton Depression Scale (HAMD) score (OR = 3.545, P < 0.05), Hamilton Anxiety Scale (HAMA) score (OR = 4.108, P < 0.05), diabetes duration (OR = 6.384, P < 0.05), and body mass index (BMI) (OR = 3.809, P < 0.05) were identified to be independent risk factors for gastrointestinal motility disorders in patients with T2DM. ROC curve analysis showed that the sensitivity and specificity of the nomogram model for predicting gastrointestinal motility disorder in patients with T2DM were 82.36% and 96.47%, respectively. Calibration curve analysis and DCA suggested that the predicted probability values of the nomogram model and the actual values were basically linearly correlated, and the actual curve was basically coincident with the ideal curve. The nomogram had good clinical applicability in predicting gastrointestinal motility disorders in patients with T2DM.
Patients with T2DM are at risk of gastrointestinal motility disorder, and factors such as decreased gastric motility, retinopathy, peripheral neuropathy, FPG, 2hPG, HbAlc, GSRS score, HAMD score, HAMA score, diabetes duration, and BMI are risk factors for gastrointestinal motility disorder in patients with T2DM. The predictive model constructed in this study can help screen and identify high-risk populations, providing guidance for the clinical prevention and intervention of gastrointestinal motility disorder in patients with T2DM.
- Citation: Li DZ, Ding J, Fan JB. Establishment of a risk prediction model for gastrointestinal motility disorder in patients with type 2 diabetes mellitus. Shijie Huaren Xiaohua Zazhi 2024; 32(8): 591-599
- URL: https://www.wjgnet.com/1009-3079/full/v32/i8/591.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i8.591
胃肠动力障碍是糖尿病常见并发症之一, 长期胃肠功能紊乱会增加患者心理和生理负担, 影响胃肠道消化吸收, 致使药物效价降低, 加重急慢性代谢紊乱[1]. 调查显示, 随胃肠动力障碍病情进展, 会发生糖尿病胃轻瘫、结肠及小肠动力降低, 增加治疗难度, 加速病情恶化[2]. 近年来, 关于胃肠运动异常临床主要集中于治疗方面的研究[3,4], 较少涉及胃肠动力障碍风险因素的筛选及高危人群的识别, 无法对临床诊断和有效防控提供指导意见. 鉴于这一背景, 本研究以2型糖尿病(type 2 diabetes mellitus, T2DM)患者为研究对象, 通过Logistic回归分析及列线图预测模型构建, 进一步探究T2DM患者胃肠动力障碍发生的风险因素, 以期丰富该版块的临床研究数据, 为临床采取具有针对性、有侧重点的防控措施提供指导.
选取2022-10/2023-04我院T2DM患者468例, (1)纳入标准: 符合2013年版2型糖尿病防治指南[5], 且T2DM病史至少半年; 年龄>18岁; 意识清晰, 无认知功能障碍, 能积极配合调查及各项检查; 知情同意本研究; (2)排除标准: 妊娠糖尿病、1型糖尿病者; 胃轻瘫患者; 伴有其他引起胃肠道功能异常疾病者, 如肠道器质性疾病或肠梗阻等; 合并精神系统或神经系统疾病者; 近期使用影响胃排空的降糖药物者; 严重心肝肾疾患者; 存在消化性溃疡等器质性病变者. 本研究经医院伦理委员会审批.
1.2.1 胃肠动力障碍诊断: 根据《胃肠动力检查手册》[6], 胃电图检查胃半排空时间>95 min, 或者餐后120 min胃排空率<50%, 则判定为胃肠动力障碍.
1.2.2 资料收集: 征得院方及患者同意后, 通过问卷及医院电子病历系统收集患者资料: (1)一般资料调查问卷: 包括年龄、性别、体质量指数(body mass index, BMI)、学历、婚姻状态、吸烟史、饮酒史等; (2)胃肠道症状评定量表(gastrointestinal symptom rating scale, GSRS)[7]: 共16个条目, 每项1-7分, 总分16-112分, 评分越高, 胃肠道症状越严重; (3)汉密尔抑郁量表(Hamilton Depression Scale, HAMD)[8]、汉密尔顿焦虑量表(Hamilton Anxiety Scale, HAMA)[9]: HAMD量表总分0-54分, 评分与抑郁程度成正比, 根据评分可分为无抑郁(<7分)、轻度(7-17分)、中度(18-24分)、重度(>24分); HAMA量表总分0-56分, 评分与焦虑程度成正比, 根据评分可分为无焦虑(<7分)、轻度(7-14分)、中度(15-29分)、重度(>29分). 同时, 通过医院电子病历系统收集患者病情相关资料, 包括糖尿病病程、合并症、有视网膜病变、有无周围神经病变、空腹血糖(fasting plasma glucose, FPG)、餐后2h血糖(2h postprandial glucose, 2hPG)、糖化血红蛋白(hemoglobin A1c, HbAlC)、胃动力等.
1.2.3 调查质量控制: (1)为了避免调查偏倚, 由接受统一培训的内分泌科人员负责问卷调查, 调查期间, 对调查问卷内的若干问题开展回访复查及随机抽查复核工作, 以对比2次调查结果的一致性; (2)采用Epi Data 3.02双人双录, 进行一致性检验; (3)将上述收集的数据录入数据库, 并对原始资料的准确性和完整性进行核实, 纠正错误记录并补填缺漏项.
统计学处理 应用SPSS 26.0软件, 计数资料以例数描述, χ2检验, 计量资料采取Bartlett方差齐性检验与Kolmogorov-Smirnov正态性检验, 正态数据以均数±标准差(mean±SD)表示, 非正态数据以中位数(四分位间距)表示. 若计量资料符合正态性, 则组间比较t检验; 若计量资料不符合正态性, 组间比较应用Wilcoxon秩和检验. Logistic回归方程筛选影响因素, 运用R语言绘制列线图预测模型, 采用受试者工作特征(receiver operating characteristic, ROC)曲线、校准曲线及决策曲线(decision curve analysis, DCA)对预测模型的临床效用及预测价值进行评价. P<0.05即差异有统计学意义.
468例T2DM患者, 共收回填写清晰、完整的有效问卷455份, 即本研究最终纳入样本量为455. 455例T2DM患者中男242例, 女213例, 分别占53.19%、46.81%; 年龄21-79岁, 平均(58.68±8.32)岁; 初中及以下140例, 高中/中专188例, 大专及以上127例, 分别占30.77%、41.32%、27.91%; 胃肠动力正常251例, 胃肠动力障碍204例, 分别占55.16%、44.84%, 见表1.
| 资料 | 例数 | 构成比(%) |
| 性别 | ||
| 男 | 242 | 53.19 |
| 女 | 213 | 46.81 |
| 年龄(岁) | ||
| <45 | 98 | 21.54 |
| 45-60 | 215 | 47.25 |
| >60 | 142 | 31.21 |
| 学历 | ||
| 初中及以下 | 140 | 30.77 |
| 高中/中专 | 188 | 41.32 |
| 大专及以上 | 127 | 27.91 |
| 婚姻状态 | ||
| 未婚 | 99 | 21.76 |
| 已婚/离异/丧偶 | 356 | 78.24 |
| 吸烟史 | ||
| 有 | 142 | 31.21 |
| 无 | 313 | 68.79 |
| 饮酒史 | ||
| 有 | 120 | 26.37 |
| 无 | 335 | 73.63 |
| 胃肠动力 | ||
| 正常 | 251 | 55.16 |
| 障碍 | 204 | 44.84 |
胃肠动力正常和障碍T2DM患者的胃动力过缓、视网膜病变、周围神经病变、FPG、2hPG、HbAlc、GSRS评分、HAMD评分、HAMA评分、糖尿病病程、BMI相比, 有显著差异(P<0.05), 见表2.
| 资料 | 正常(n = 251) | 障碍(n = 204) | t/u/χ2 | P |
| 性别 | 0.223 | 0.637 | ||
| 男 | 136(54.18) | 106(51.96) | ||
| 女 | 115(45.82) | 98(48.04) | ||
| 年龄(岁) | 0.910 | 0.634 | ||
| <45 | 50(19.92) | 48(23.53) | ||
| 45-60 | 122(48.61) | 93(45.59) | ||
| >60 | 79(31.47) | 63(30.88) | ||
| 学历 | 0.676 | 0.499 | ||
| 初中及以下 | 81(32.27) | 59(28.92) | ||
| 高中/中专 | 102(40.64) | 86(42.16) | ||
| 大专及以上 | 68(27.09) | 59(28.92) | ||
| 婚姻状态 | 1.005 | 0.312 | ||
| 未婚 | 59(23.51) | 40(19.61) | ||
| 已婚/离异/丧偶 | 192(76.49) | 164(80.39) | ||
| 吸烟史 | 0.294 | 0.588 | ||
| 有 | 81(32.27) | 61(29.90) | ||
| 无 | 170(67.73) | 143(70.10) | ||
| 饮酒史 | 0.468 | 0.494 | ||
| 有 | 63(25.10) | 57(27.94) | ||
| 无 | 188(74.90) | 147(72.06) | ||
| 胃动力过缓 | 33.984 | <0.001 | ||
| 是 | 18(7.17) | 56(27.45) | ||
| 否 | 233(92.83) | 148(72.55) | ||
| 合并症 | ||||
| 高血压 | 36(14.34) | 36(17.65) | 0.923 | 0.337 |
| 高脂血症 | 59(23.51) | 41(20.10) | 0.762 | 0.383 |
| 冠心病 | 12(4.78) | 14(6.86) | 0.905 | 0.341 |
| 视网膜病变 | 9.404 | 0.002 | ||
| 有 | 85(33.86) | 98(48.04) | ||
| 无 | 166(66.14) | 106(51.96) | ||
| 周围神经病变 | 11.946 | <0.001 | ||
| 有 | 47(18.73) | 67(32.84) | ||
| 无 | 204(81.27) | 137(67.16) | ||
| FPG(mmol/L) | 6.85±1.12 | 10.11±2.32 | 19.628 | <0.001 |
| 2hPG(mmol/L) | 9.36±1.08 | 12.33±1.75 | 22.190 | <0.001 |
| HbAlc(%) | 8.49±1.65 | 9.86±1.16 | 10.016 | <0.001 |
| GSRS评分(分) | 23.65±4.38 | 41.20±7.52 | 31.060 | <0.001 |
| HAMD评分(分) | 16.96±3.57 | 26.33±5.68 | 21.442 | <0.001 |
| HAMA评分(分) | 11.87±2.49 | 19.68±4.46 | 23.589 | <0.001 |
| 糖尿病病程(年) | 4.59±1.10 | 8.54±2.37 | 23.480 | <0.001 |
| BMI(kg/m2) | 24.36±3.12 | 26.12±2.85 | 6.219 | <0.001 |
经上述分析P<0.05的因素有: 胃动力过缓、视网膜病变、周围神经病变、FPG、2hPG、HbAlc、GSRS评分、HAMD评分、HAMA评分、糖尿病病程、BMI, 进行多重共线性诊断, 依据方差膨胀因子, 并结合专业知识选择VIF<3的变量纳入多因素分析, 上述因素VIF均<3不存在共线性问题.
将T2DM患者胃肠动力正常(赋值0)与胃肠动力障碍(赋值1)作为研究对象, 采用Logistic回归方程分析, 差异有意义的结果如下: 胃动力过缓(OR = 4.553, P<0.05)、视网膜病变(OR = 4.676, P<0.05)、周围神经病变(OR = 3.652, P<0.05)、FPG(OR = 5.775, P<0.05)、2hPG(OR = 3.627, P<0.05)、HbAlc(OR = 5.792, P<0.05)、GSRS评分(OR = 3.939, P<0.05)、HAMD评分(OR = 3.545, P<0.05)、HAMA评分(OR = 4.108, P<0.05)、糖尿病病程(OR = 6.384, P<0.05)、BMI(OR = 3.809, P<0.05)是T2DM患者胃肠动力障碍的独立危险因素, 见表3.
| 因素 | 赋值说明 | S.E. | β | OR | 95%CI | Wald χ2 | P | |
| 下限 | 上限 | |||||||
| 常量 | 2.998 | -11.326 | 23.012 | <0.001 | ||||
| 胃动力过缓 | 否 = 0, 是 = 1 | 0.421 | 1.516 | 4.553 | 1.355 | 15.302 | 17.536 | <0.001 |
| 视网膜病变 | 无 = 0, 有 = 1 | 0.253 | 1.543 | 4.676 | 1.642 | 13.318 | 24.759 | <0.001 |
| 周围神经病变 | 无 = 0, 有 = 1 | 0.312 | 1.295 | 3.652 | 1.568 | 8.507 | 9.467 | <0.001 |
| FPG | 输入实际值 | 0.466 | 1.754 | 5.775 | 2.318 | 14.389 | 48.041 | <0.001 |
| 2hPG | 输入实际值 | 0.297 | 1.288 | 3.627 | 1.046 | 12.574 | 17.050 | <0.001 |
| HbAlc | 输入实际值 | 0.326 | 1.756 | 5.792 | 2.015 | 16.647 | 14.207 | <0.001 |
| GSRS评分 | 输入实际值 | 0.344 | 1.371 | 3.939 | 2.132 | 7.279 | 21.310 | <0.001 |
| HAMD评分 | 输入实际值 | 0.279 | 1.266 | 3.545 | 1.106 | 11.365 | 15.073 | <0.001 |
| HAMA评分 | 输入实际值 | 0.320 | 1.413 | 4.108 | 1.619 | 10.425 | 16.872 | <0.001 |
| 糖尿病病程 | 输入实际值 | 0.510 | 1.854 | 6.384 | 2.122 | 19.207 | 44.149 | <0.001 |
| BMI | 输入实际值 | 0.367 | 1.337 | 3.809 | 1.065 | 13.625 | 17.468 | <0.001 |
(1)将Logistic回归方程中筛选出的T2DM患者胃肠动力障碍的影响因素(胃动力过缓、视网膜病变、周围神经病变、FPG、2hPG、HbAlc、GSRS评分、HAMD评分、HAMA评分、糖尿病病程、BMI)纳入列线图预测模型, 通过R3.6.3软件构建并输出胃肠动力障碍的个体化列线图预测模型, 见图1; (2)绘制预测模型预测T2DM患者胃肠动力障碍的ROC曲线, 结果得知, 此模型预测T2DM患者胃肠动力障碍的曲线下面积 = 0.922(95%CI: 0.831-0.984), 预测敏感度、特异度依次为82.36%、96.47%, 见图2; (3)校准曲线: 模型构建组和外部验证组的预测结果和实际结果保持高度一致, 实际及预测概率值基本呈线性正相关, 实际曲线与理想曲线基本重合, 提示列线图预测模型的校准效果较好, 见图3; (4)DCA曲线: 采用DCA曲线对列线图预测模型的临床效用进行验证, 结果发现, 列线图在预测T2DM患者胃肠动力障碍方面具有较好的临床适用性, 见图4.
胃与十二指肠内的压力差是胃排空的直接动力, 研究报道, 胃排空延迟这种胃肠动力障碍是糖尿病常见症状, 主要表现为反流、恶心呕吐、腹痛、腹泻及便秘等[10]. 本研究调查显示, 468例T2DM患者中, 胃肠动力障碍发生率为44.84%, 与鲍彩丽等[11]学者报道的45%的老年T2DM患者出现胃排空延迟的结果相近. 胃肠动力障碍带来的胃肠道不适不仅会对T2DM患者营养状况造成不良影响, 还会造成血糖水平控制不佳. 研究发现, 胃排空是影响血糖控制水平的重要因素, 延迟可能造成血糖升高, 增加血糖控制不良风险[12]. 因此, 筛选识别胃肠动力障碍的高危人群, 及时采取针对性防控措施可能会成为促进血糖控制的重要途径之一.
本研究发现, 胃动力过缓、周围神经病变、视网膜病变、FPG、2hPG、HbAlc、GSRS评分、糖尿病病程、BMI、HAMD评分、HAMA评分等多种因素是T2DM患者发生胃肠动力障碍的影响因素. (1)胃动力过缓: 胃动力过缓是胃肌肉收缩蠕动力不足的一种表现, 指胃电正常起搏点起搏, 并以顺向向远端传导, 胃动过缓范围处于0.5 cpm-2.4 cpm, 不仅会影响食物消化, 还会造成胃排空延迟, 增加胃肠动力障碍风险[13]; (2)周围神经病变: 以往, 学者文茜等[14]发现, 随着周围神经病变病情加重, T2DM患者胃电图异常更加明显, 胃肠动力障碍不断加重. 本研究发现, 周围神经病变是T2DM患者胃肠动力障碍的独立危险因素, 考虑原因在于, 随周围神经病变渐进性恶化, 神经组织细胞出现失活或凋零, 神经组织结构及轴突异常变化使胃肠自主神经细胞遭受损害, 致使胃肠运动功能障碍, 出现恶心呕吐、便秘、腹痛等症状; (3)视网膜病变: 表1显示, 48.04%的胃肠动力障碍患者存在视网膜病变, 且有研究证实, 糖尿病视网膜病变与胃排空延迟具有一定相关性[15], 而本研究进一步证实其是胃肠动力障碍的危险因素, 这就提示临床工作中, 对于存在视网膜病变的T2DM患者, 需加强管理, 及时对其胃肠动力进行检查, 做到早发现、早治疗, 以降低其对血糖的影响, 延缓疾病进展. 此外, 长期处于高血糖状态, 机体会对胃肠道功能产生反射性抑制, 造成胃排空迟缓, 出现胃胀、食欲减退等胃部不适, 严重时还会引发胃出血、胃溃疡及胃轻瘫等严重并发症[16,17]; (4)FPG、2hPG、HbAlc: 本研究发现, FPG、2hPG、HbAlc是T2DM患者胃肠动力障碍的危险因素, 与上述分析相符, 提示强化糖尿病管控的"5驾马车", 使患者保持良好的血糖水平, 对降低胃肠动力障碍发生率至关重要; (5)GSRS: GSRS量表是评估胃肠道症状的简单而有效工具, 研究发现, GSRS量表可对T2DM患者消化道症状进行准确评价, 且其与肠系膜动脉血流动力学变化相关[18]. 而本研究显示, 其是T2DM患者胃肠动力障碍的影响因素, 可将其作为预测胃肠动力障碍的重要因子, 以协助临床诊断; (6)糖尿病病程: 随着病情进展, 糖尿病患者易出现胃肠激素紊乱、神经病变、胃轻瘫等对胃肠功能造成损害, 引起胃与食管运动功能障碍. 本研究显示, 糖尿病病程是T2DM患者发生胃肠动力障碍的影响因素, 这与以往研究结果一致[19]; (7)BMI: 肥胖是引起糖尿病的重要因素, 且相比正常体重者, 肥胖者糖尿病发病率高出4倍, 且70%-80%的>40岁糖尿病人群有肥胖史[20]. 同时研究证实, 肥胖会引起胃肠道器官慢性微炎症, 是胃食管反流的危险因素[21]. 本研究发现, 肥胖是T2DM患者胃肠动力障碍的影响因素, 分析原因, 肥胖会造成腹内压增加, 致使食管压力梯度改变, 食管下段括约肌出现一过性松弛, 引起胃排空延缓, 增加胃肠动力障碍风险; (8)HAMD评分、HAMA评分: 焦虑、抑郁是慢性疾病患者常见精神症状, 尤其是T2DM患者, 受长期高血糖、胰岛素注射及未达降糖目标、并发症担忧等因素影响, 焦虑、抑郁症状发生率高, 已成为与心理因素密切相关的一种身心疾病[22]. 由此, 本研究进一步发现, 焦虑、抑郁是T2DM患者胃肠动力障碍的独立危险因素, 可见胃肠动力障碍与心理异常倾向有着明显的相关性, 原因可能在于焦虑、抑郁等不良情绪加重了植物神经功能紊乱, 对胃肠道及消化系统产生不良影响, 增加胃肠动力障碍发生的可能性[23]. 在此基础上, 本研究进一步构建预测模型, 结果显示列线图模型对T2DM患者胃肠动力障碍具有良好的预测效应、校准效果及临床适用性, 临床工作中可将其形成一项简单易行的胃肠动力障碍高危人群识别工具, 根据影响因素分析结果对T2DM患者展开具有针对性的、有侧重点的防控措施, 以降低胃肠动力障碍发生率, 减轻其对糖尿病病情的危害.
综上, T2DM患者存在胃肠运动障碍风险, 且胃动力过缓、视网膜病变、周围神经病变、FPG、2hPG、HbAlc、GSRS评分、HAMD评分、HAMA评分、糖尿病病程、BMI等是其影响因素, 临床工作中加强预测模型构建, 可筛选识别高危人群, 为临床防控干预提供指导. 但本研究存在样本量少的弊端, 致使纳入因素受限、研究结果可能存在一定偏倚, 今后可以此为目标, 增加样本数量、扩大因素纳入范围, 为临床提供更为全面、科学的试验数据.
2型糖尿病(type 2 diabetes mellitus, T2DM)会导致胃肠动力障碍, 影响患者的营养吸收, 严重的可降低免疫力, 使病情加重, 对患者身体健康造成不可逆的伤害, 增加患者心理负担, 治愈难度加大. 及早发现T2DM造成的胃肠动力障碍, 对该病的治疗起到关键的作用.
T2DM是导致胃肠动力障碍的主要因素, 但是也有环境、年龄等其他因素也会对胃肠动力障碍造成影响, 对相关因素的综合分析有助于更全面了解发病原因, 对不同的患者采取更有针对性的预防和治疗措施.
了解T2DM患者胃肠动力障碍的发生情况, 构建风险预测模型, 分析导致胃肠动力障碍的风险因素, 为T2DM患者的临床并发症防控提供借鉴.
主要通过回归分析, 列线图预测, ROC曲线等统计学方法对T2DM患者胃肠动力障碍的发病风险进行分析, 对预测模型的临床效用及预测价值进行评价.
胃动力过缓、视网膜病变、周围神经病变、FPG、2hPG、HbAlc、GSRS评分、HAMD评分、HAMA评分、糖尿病病程、BMI是T2DM患者胃肠动力障碍的独立危险因素, 且列线图在预测T2DM患者胃肠动力障碍方面具有较好的临床适用性.
胃动力过缓、视网膜病变、周围神经病变、FPG、2hPG、HbAlc、GSRS评分、HAMD评分、HAMA评分、糖尿病病程、BMI是T2DM患者胃肠动力障碍发生的风险因素, 有助于个性化的临床防控干预.
本研究发现了与T2DM患者胃肠动力障碍发生的相关高危因素, 为今后该疾病的发生提供一定的临床借鉴意义. 但是仍存在样本量少, 纳入因素有欠缺等问题,后期的研究将加大样本的数量、扩大因素纳入范围, 使研究结果更为全面、更科学.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Cani PD, Delzenne NM, Amar J, Burcelin R. Role of gut microflora in the development of obesity and insulin resistance following high-fat diet feeding. Pathol Biol (Paris). 2008;56:305-309. [PubMed] [DOI] |
| 2. | Liu Z, Dai X, Zhang H, Shi R, Hui Y, Jin X, Zhang W, Wang L, Wang Q, Wang D, Wang J, Tan X, Ren B, Liu X, Zhao T, Wang J, Pan J, Yuan T, Chu C, Lan L, Yin F, Cadenas E, Shi L, Zhao S, Liu X. Gut microbiota mediates intermittent-fasting alleviation of diabetes-induced cognitive impairment. Nat Commun. 2020;11:855. [PubMed] [DOI] |
| 3. | Krasaelap A, Kovacic K, Goday PS. Nutrition Management in Pediatric Gastrointestinal Motility Disorders. Nutr Clin Pract. 2020;35:265-272. [PubMed] [DOI] |
| 4. | Gill SK, Rossi M, Bajka B, Whelan K. Dietary fibre in gastrointestinal health and disease. Nat Rev Gastroenterol Hepatol. 2021;18:101-116. [PubMed] [DOI] |
| 7. | Lopresti AL, Smith SJ, Rea A, Michel S. Efficacy of a curcumin extract (Curcugen™) on gastrointestinal symptoms and intestinal microbiota in adults with self-reported digestive complaints: a randomised, double-blind, placebo-controlled study. BMC Complement Med Ther. 2021;21:40. [PubMed] [DOI] |
| 8. | Deligiannidis KM, Meltzer-Brody S, Gunduz-Bruce H, Doherty J, Jonas J, Li S, Sankoh AJ, Silber C, Campbell AD, Werneburg B, Kanes SJ, Lasser R. Effect of Zuranolone vs Placebo in Postpartum Depression: A Randomized Clinical Trial. JAMA Psychiatry. 2021;78:951-959. [PubMed] [DOI] |
| 9. | Zhu M, Zhang Y, Pan J, Fu C, Wang Y. Effect of simplified Tai Chi exercise on relieving symptoms of patients with mild to moderate Parkinson's disease. J Sports Med Phys Fitness. 2020;60:282-288. [PubMed] [DOI] |
| 12. | Maselli DB, Camilleri M. Effects of GLP-1 and Its Analogs on Gastric Physiology in Diabetes Mellitus and Obesity. Adv Exp Med Biol. 2021;1307:171-192. [PubMed] [DOI] |
| 15. | 隆 雨卿. 2型糖尿病患者胃排空功能异常及其相关因素的研究. 山东: 山东大学; 2017. |
| 16. | Sampath C, Srinivasan S, Freeman ML, Gangula PR. Inhibition of GSK-3β restores delayed gastric emptying in obesity-induced diabetic female mice. Am J Physiol Gastrointest Liver Physiol. 2020;319:G481-G493. [PubMed] [DOI] |
| 17. | Sprouse J, Sampath C, Gangula PR. Role of sex hormones and their receptors on gastric Nrf2 and neuronal nitric oxide synthase function in an experimental hyperglycemia model. BMC Gastroenterol. 2020;20:313. [PubMed] [DOI] |
| 18. | Nakajima H, Takewaki F, Hashimoto Y, Kajiyama S, Majima S, Okada H, Senmaru T, Ushigome E, Nakanishi N, Hamaguchi M, Yamazaki M, Tanaka Y, Oikawa Y, Nakajima S, Ohno H, Fukui M. The Effects of Metformin on the Gut Microbiota of Patients with Type 2 Diabetes: A Two-Center, Quasi-Experimental Study. Life (Basel). 2020;10. [PubMed] [DOI] |
| 19. | Goyal RK. Gastric Emptying Abnormalities in Diabetes Mellitus. N Engl J Med. 2021;384:1742-1751. [PubMed] [DOI] |
| 20. | Piché ME, Tchernof A, Després JP. Obesity Phenotypes, Diabetes, and Cardiovascular Diseases. Circ Res. 2020;126:1477-1500. [PubMed] [DOI] |
| 21. | Zaky A, Glastras SJ, Wong MYW, Pollock CA, Saad S. The Role of the Gut Microbiome in Diabetes and Obesity-Related Kidney Disease. Int J Mol Sci. 2021;22. [PubMed] [DOI] |