修回日期: 2024-07-11
接受日期: 2024-07-19
在线出版日期: 2024-07-28
十二指肠型滤泡性淋巴瘤(duodenal-type follicular lymphoma, DFL)是临床上罕见的良性肿瘤性疾病, 无典型的临床表现, 内镜和病理可协助诊断, 对该疾病认识不足容易漏诊、误诊, 治疗和预后也缺乏统一认识.
患者4名的年龄区间为47岁至74岁, 无症状或以不典型消化系统症状来诊, 行胃镜检查发现在十二指肠降部或球降部交界处簇状隆起. 根据内镜下表现、病理学形态和免疫组化等明确诊断. 4例均选择随诊观察, 截止至目前的随访时间为7 mo至72 mo病情稳定.
DFL主要发生在十二指肠降部或球降部交界处, 内镜下主要表现为息肉样隆起. 组织学形态符合典型DFL表现. 免疫组织提示: 肿瘤细胞均表达Bcl-2、Bcl-6、CD10、CD20、CD79α、滤泡树突网CD21、CD23阳性, 瘤细胞Cyclin D1、CD3、CD5、Mum1均呈阴性, Ki-67增值指数较低(5%至30%). 腹部增强CT一般无明显表现, 少数可发现胃肠壁增厚或肠系膜脂膜炎, 排除腹部其他部位病变, 排除继发于感染的反应性淋巴滤泡增生, 结合病理诊断为DFL. 4名患者均选择随访观察方案, 截止至目前的随访时间为7 mo至72 mo, 均未出现明显不适, 内镜下及病理未见病变进展. 文献复习大多数随诊观察患者预后良好, 少部分的随诊观察患者会出现复发或进展, 部分可见自愈. 因此, DFL是临床上罕见的良性肿瘤性疾病, 无典型的临床表现, 但具有典型的内镜和病理学特征, 尽管极少数病例出现复发及加重, 但过度治疗可能不能改善预后并且加重经济负担和影响患者的生活质量, 常规选择随诊观察是合理的.
核心提要: 十二指肠型滤泡性淋巴瘤临床罕见, 有典型的内镜和病理学特征时容易明确诊断, 认识不足时容易漏诊、误诊, 治疗和预后评估缺乏统一认识. 本文对4名患者临床资料及文献复习进行分析总结, 旨在为临床提供参考.
引文著录: 黄荣威, 贾琳, 孙延成, 刘一品. 十二指肠型滤泡性淋巴瘤文献复习及4例随诊报道. 世界华人消化杂志 2024; 32(7): 538-544
Revised: July 11, 2024
Accepted: July 19, 2024
Published online: July 28, 2024
Duodenal-type follicular lymphoma (DFL) is a rare benign neoplastic disease without typical clinical manifestations, and endoscopy and pathology can assist in the diagnosis of DFL, which is easy to be missed and misdiagnosed due to the lack of knowledge of the disease and the lack of a unified understanding of treatment and prognosis.
Four patients, ranging in age from 47 to 74 years, presented with no clinical symptoms or with atypical gastrointestinal symptoms. Gastroscopy revealed polypoid elevations in the descending protion of the duodenum or the junction between the duodenal bulb and the descending duodenum. The diagnosis of DFL was established based on gastrointestinal endoscopy, pathological examination, and immunohistochemical examination. All four patients were selected for follow-up observation and their conditions remained stabilised between 7-72 mo of follow-up.
DFL occurs mainly in the descending protion of the duodenum or the junction between the duodenal bulb and the descending duodenum, with polypoid elevations being the major endoscopic manifestation. Pathology suggests a relatively typical histological pattern. Immunohistochemistry suggests that the tumour cells are positive for Bcl-2, Bcl-6, CD10, CD20, and CD79α, follicular dendritic reticulum cells are positive for CD21 and CD23, and tumor cells are negative for cyclin Dl, CD3, CD5, and Mum1, with the Ki-67 index ranging from 5% to 30%. Contrast-enhanced CT of the abdomen generally revealed unremarkable results, and a few patients were found to have thickening of the gastrointestinal wall or mesenteric panniculitis. After excluding lesions in other parts of the abdomen and reactive lymphoid follicular hyperplasia secondary to infections, a diagnosis of DFL can be diagnosed in combination with the pathological findings. The majority of the patients from the literature had a good prognosis, with a small number of patients experiencing recurrence or progression, and some showing spontaneous recovery. Therefore, DFL is a rare benign neoplastic disease without typical clinical manifestations but with typical endoscopic and pathological features. Although recurrence and exacerbation occur in a small number of cases, over-treatment may not improve the prognosis and may increase the economic burden and affect the patient's quality of life, so it is reasonable to routinely choose follow-up observation.
- Citation: Huang RW, Jia L, Sun YC, Liu YP. Duodenal-type follicular lymphoma: Report of four cases and review of the literature. Shijie Huaren Xiaohua Zazhi 2024; 32(7): 538-544
- URL: https://www.wjgnet.com/1009-3079/full/v32/i7/538.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i7.538
胃肠道的滤泡性淋巴瘤(follicular lymphoma, FL)发病率仅占胃肠道受累的原发性非霍奇金淋巴瘤(nonhodgkin's lymphomas, NHL)的1%-4%, DFL的发病率更低, 约占胃肠道FL的10%, 是临床罕见的良性肿瘤性疾病, 但其全球发病率在逐渐增加, 目前国内外报道的病例较少, 主要以不典型的消化系统症状来诊, 由于缺乏典型的临床表现, 内镜和病理诊断是关键[1-6]. 在治疗及随访上还缺乏统一的共识, 既往文献多数建议DFL随诊即可, 由于少部分的患者出现了恶性进展, 选择随诊观察的合理性需要进一步考证. 本文报道于我院诊治的以十二指肠降部隆起为表现的DFL 4例, 并结合文献复习讨论随诊观察的合理性.
将患者编号为患者1、2、3、4(同表1), 主诉分别为反复反酸、烧心1年; 健康查体; 间断腹痛、大便异常2年; 剑突下及胸骨后不适1月.
| 编号 | 性别 | 年龄 | 症状 | 体格检查 | 既往病史 | CT检查 | C13 | Ki-67 | 随访时间 |
| 1 | 男 | 47岁 | 反酸、烧心 | 阴性 | 反酸、烧心, 甲状腺结节 | 未见明显异常 | 阴性 | 10% | 72 mo |
| 2 | 男 | 59岁 | 无明显症状 | 阴性 | 甲状腺结节 | 肠系膜脂膜炎 | 阴性 | 5% | 9 mo |
| 3 | 女 | 63岁 | 剑突下疼痛、中下腹痛、大便异常 | 剑突下、下腹压痛 | 无 | 胃窦部胃壁略增厚 | 阴性 | 10% | 12 mo |
| 4 | 女 | 74岁 | 剑突下及胸骨后不适 | 右下腹及中上腹轻压痛 | 慢性腹痛、子宫肌瘤 | 肠系膜脂膜炎 | 阴性 | 30% | 7 mo |
患者1: 反复反酸、烧心1年, 无其他不适, 抑酸治疗有效; 患者2: 健康查体, 无不适; 患者3: 间断腹痛、大便异常2年, 以剑突下隐痛为主, 进食可稍加重, 偶有中下腹疼痛伴大便稀软和次数增多, 便后疼痛可缓解, 发作时3-4次/日, 无其他不适, 抑酸护胃治疗有效; 患者4: 反复剑突下及胸骨后不适1月, 呈烧灼样, 持续时间不定, 休息后可逐渐缓解, 于日间症状较明显, 伴进食哽噎感, 伴间断的反酸、烧心, 伴腹胀且进食后明显, 无其他不适, 抑酸护胃治疗有效.
患者1: 反酸、烧心史, 甲状腺结节病史3年, 彩超提示TI-RADS 4a类结节, 未行特殊处理. 患者2: 甲状腺结节1年, 彩超提示TI-RADS 3类结节, 未特殊处理. 患者3: 既往体健. 患者4: 既往有慢性腹痛病史, 抑酸治疗好转. 4名患者均否认肝炎、结核等传染病史, 否认外伤、手术、药物食物过敏史, 否认输血史, 预防接种随当地.
患者4名均出生并久居烟台市牟平区, 无长期外地旅居史, 否认疫区接触史, 职业按编号分别为工人、工人、自由职业者和农民, 否认烟酒嗜好, 无性病史和冶游史. 否认家族遗传病及类似病史.
患者4名按编号分别为无阳性体征、无阳性体征、剑突下和下腹轻压痛、右下腹及中上腹轻压痛. 4例均发育正常、营养良好.
全血细胞计数和完整的代谢检查(包括肝功能、肾功能、血脂检查、乳酸脱氢酶)均正常, 常见肿瘤标志物, 如AFP、CEA、CA199、CA125等均正常, 免疫球蛋白A、G、M检查正常, 乙型肝炎、丙型肝炎和HIV检测呈阴性, 排除继发于感染的反应性淋巴滤泡增生和其他肿瘤相关的淋巴滤泡改变.
全腹部及盆腔增强CT: 肠系膜脂膜炎(mesenteric panniculitis, MP)(2例, 编号为2和4), 胃窦部胃壁略增厚(1例, 编号为3), 余无明显异常.
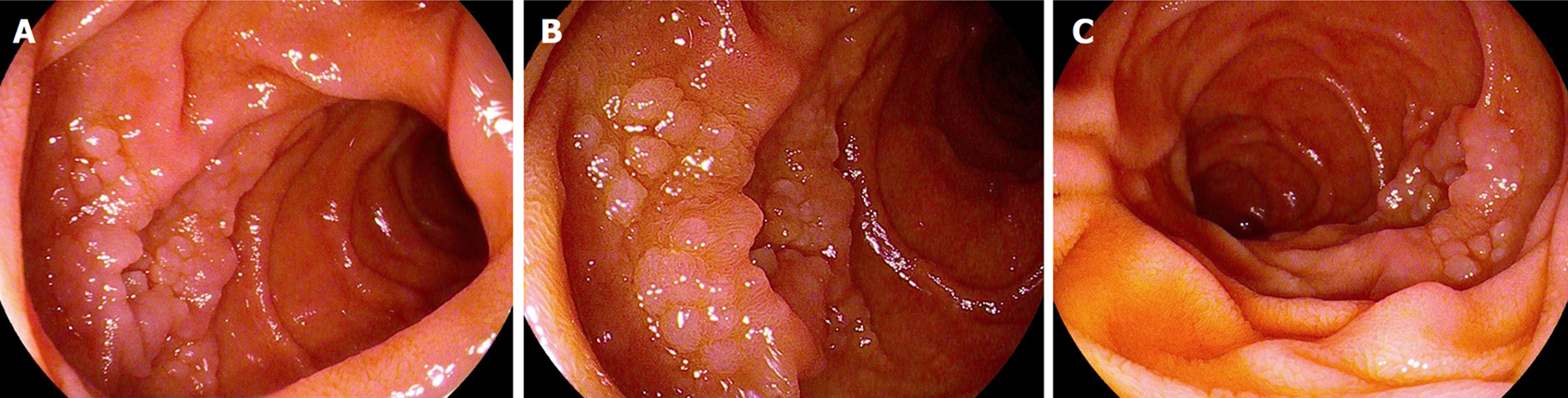
胃镜主要结果: 十二指肠降部或球降部交界处簇状息肉样隆起, 远端见黏膜粗糙, 质地软(见图1).
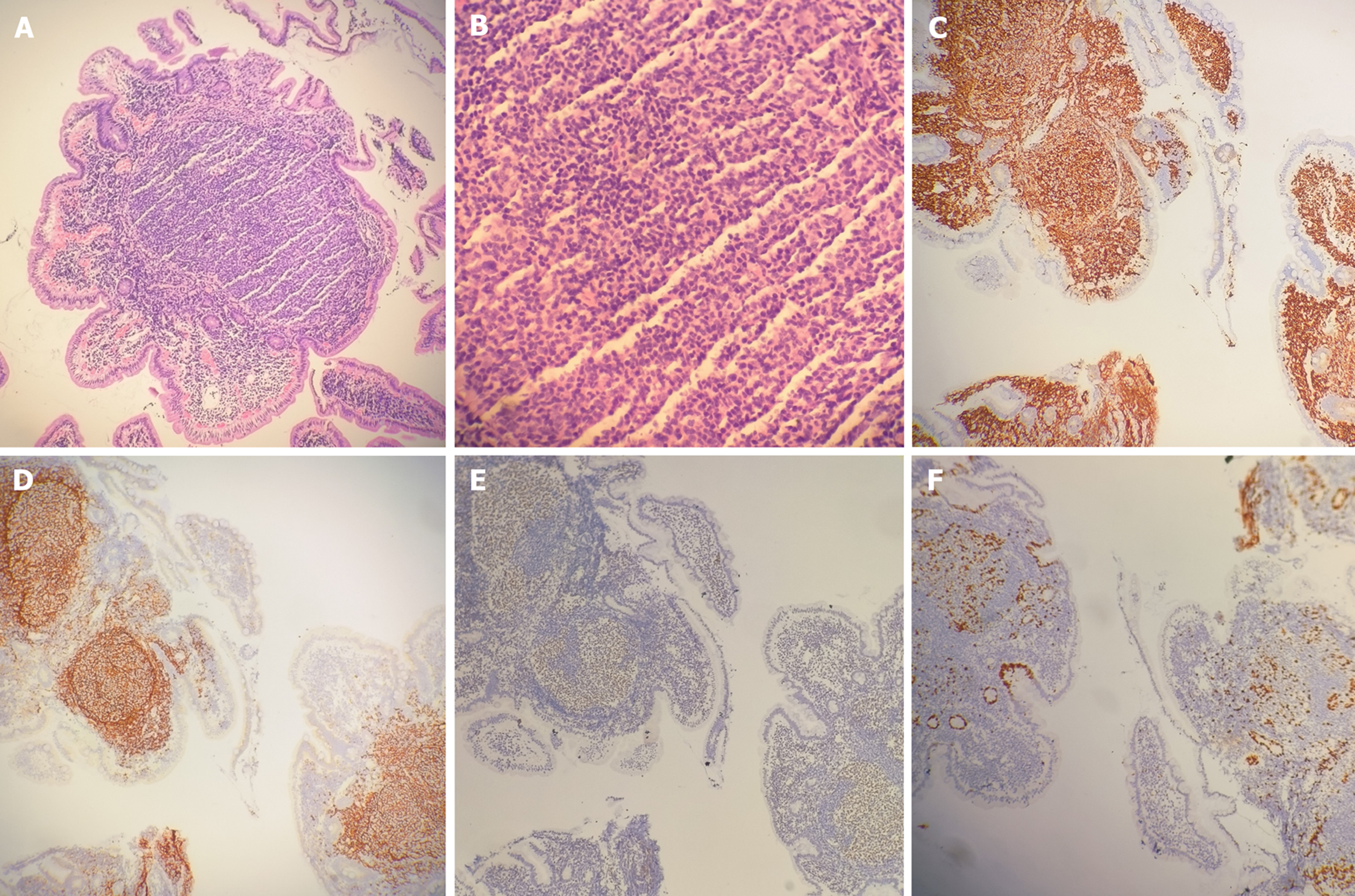
病理结果: 均位于黏膜层, 符合"十二指肠型滤泡性淋巴瘤, 低级别"表现(图2A和B). 免疫组化(部分结果, 见图2C-F)提示: 4例瘤细胞Bcl-2、Bcl-6、CD10、CD20、CD79a、滤泡树突网CD21、CD23均呈阳性; 瘤细胞Cyclin D1、CD3、CD5、Mum1均呈阴性; Ki-67增值指数5%至30%.
十二指肠型滤泡性淋巴瘤(低级别).
对症治疗, 随诊观察.
4例患者行定期电话或门诊随访(每3 mo), 考虑患者经济状况一般, 半年至1年复查胃镜评估病情变化及完善有意义的相关检验, 根据病情延长或缩短复诊时间, 若发现病情进展及时进行危险评估及药物干预治疗, 警惕进展为弥漫大B细胞淋巴瘤; 嘱如有不适, 及时就诊; 对于合并肠系膜脂膜炎的2名患者, 因病变较小, 建议年度复查CT评估. 目前随访7 mo至72 mo(按编号分别为72 mo、9 mo、12 mo、7 mo)均未见明显不适, 内镜下及病理未见明显病变进展.
5.1.1 基本特点: DFL是胃肠道原发性非霍奇金淋巴瘤中极其罕见的FL变种, 由于其独特的临床特征, 2016年在世界卫生组织分类中被分类为FL的新子类型, 特别强调DFL的独特性质, 尽管具有局部显性低级别FL的特征, 但与其他胃肠道FL不同, 并且具有许多与原发性滤泡性淋巴瘤(in situ follicular neoplasia, ISFN)重叠的特征, 以及一些类似于粘膜相关淋巴组织结外边缘区淋巴瘤的特征[1-4], DFL表现为惰性病程, 病程进展缓慢, 常见于中老年人, 欧美国家常见而亚洲国家发病率较低[1-4]; DFL主要是结合临床特点、内镜特点、病理特点、免疫组化和细胞遗传等进行诊断及鉴别诊断.
5.1.2 临床特点: 男女比例约1:1, 中位年龄分别是53, 58, 59, 65岁, 常以非特异性消化系统症状就诊, 最常见为腹痛, 但常常与DFL病情无关[7-10]. Lin[11]研究中国1090例结外受累的FL患者中发现, 男性、乳酸脱氢酶升高、体能状态差、大于1个结外部位以及胰腺受累等因素与预后相关. 本文报道4例的中位年龄是53岁, 性别比例相似, 症状同文献报道, 但未见乳酸脱氢酶升高及其他脏器受累.
5.1.3 影像学检查: 大多数患者(85.3%)无法通过CT扫描发现胃肠道病变, 少数患者可发现病变部位的胃壁和肠壁增厚, 对内镜检查部位有一定的指导作用, 且需警惕胃癌可能; 另外, 18F-FDG-PET(18F-fluoro-deoxyglucose positron emission tomography)与DFL的摄取亲和力低, 特别是对于直径小于1 cm-1.2 cm的病变容易出现假摄取, 因此不是诊断DFL的准确方法, 但可作为DFL检查的补充方式, 有助于检测内镜检查未发现的胃肠道部位和胃肠道外受累部位, 根据受累结果调整DFL的临床分期和治疗方案[4]. 本研究CT扫描还发现有MP(50%)存在, 文献复习发现, MP可能与DFL有关. CT发现MP的患者中有8%-46%合并肿瘤, 其中最多见为淋巴瘤且多数为NHL[12-14]. Grégory等[14]发现, 其实MP是一种相对罕见的影像学表现, 多数为良性病变, 仅8%病例伴随肿瘤或后续检查发现新发肿瘤, 不应所有病例均进行过度检查, 建议存在典型的恶性特征时才需要进一步检查以排除潜在的恶性肿瘤, 比如存在>10 mm软组织MP结节或相关的腹盆腔淋巴结肿大时.
5.1.4 内镜检查: 文献复习[7-10], 内镜下可表现为单发或多发息肉、颗粒状增生、黏膜粗糙或白色黏膜下隆起, 偶可见片状白斑或不规则增值性病灶, 超声内镜下病变多局限于黏膜层或黏膜下层, 一般无出血及坏死. 其中, 十二指肠降部的多个小息肉样病变(通常为1 mm至5 mm)是最常见的表现. DFL累及肠道各部, 最常累及十二指肠(89%), 降段最多(占81%), 乳头部次之, 球部最少, 其次是空肠(40%), 回肠(占22%), 盲肠少见(占2%), 仅3%发生于结直肠, 十二指肠降段受累患者多表现为多发性结节(约96%), 如有结肠累及预后较差, 病变可单发和多发. 本文4例均出现在十二指肠降部或球降交界处呈簇状隆起.
5.1.5 病理特点分析[1-3,7-9]: DFL病理多呈低级别(1至2级)FL表现; 可见肠黏膜组织固有腺体减少, 黏膜层或黏膜下层淋巴组织增生, 其生发中心可见中心细胞和散在分布中心母细胞, 一般没有"星空"现象和套区; 大多数样本中滤泡结构外存在具有圆形深色细胞核的小淋巴样细胞片, 并至少占据一些十二指肠绒毛. 在DFL患者中均不存在FL中观察到的边缘区分化(如浆样分化和单核细胞样B细胞分化), 部分病例可转化或进展为弥漫性大B细胞淋巴瘤病理表现. 本文4例均符合DFL病理特点.
5.1.6 免疫表型: 文献复习[7-10], 基本存在CD20、CD10、Bcl-6、Bcl-2, Ki-67低增值指数(2%至30%), 大多数表达CD79α、Pax-5、CD21、CD23, 均不表达CD3、CD5、Cyclin D1及SOX-11. CD21和CD23染色常显示于滤泡树突网在肿瘤性滤泡周边密集、浓染, 而在中央淡染、稀疏, 少数病例的滤泡树突细胞(follicular dendritic cell, FDC)网染色未显示该特点. 免疫组化可分辨肿瘤细胞的来源而与相似疾病相鉴别, 其中相对最具鉴别价值的是Bcl-2、Bcl-6、CD21、CD10和Ki-67低增值指数. 如生发中心出现密集Bcl-2阳性, 则应考虑FL, 但常仅用于良、恶性滤泡的鉴别而不用于其他成熟B细胞淋巴瘤鉴别; DFL中CD21有特征性外观可作为相对特异的标志物; Bcl-6和CD10可与边缘区淋巴瘤相鉴别等[15], 常见的鉴别诊断见5.2. 本文4例符合该免疫表型特点, 可见基本表达B细胞系标志物和特征性FL的典型免疫表型. 其中一名患者Ki-67达到30%, 文献复习, Ki-67发挥着维持细胞增殖作用, 提示细胞具有增殖活性, 侵袭性淋巴瘤通常大于50%, 惰性淋巴瘤通常小于30%, 除了用于鉴别诊断外还可评估预后[15]. 因此, 对于该名Ki-67指数更高的患者建议缩短复诊时间.
5.1.7 细胞遗传学: 文献复习, DFL与传统FL具有许多共同的遗传特征[8,9,16,17], 基因突变方面: 可能高相关性突变有t(14;18)、CREBBP. 低相关性: TNFRSF14、EZH2 、HVCN1、EEF1A1、TBL1XR1. DFL与其他FL比较时可通过更少的组蛋白甲基转移酶KMT2D(别名MLL2)突变和免疫微环境情况鉴别, 免疫微环境最明显的区别是高度不同的趋化因子/细胞因子环境和慢性炎症的特征, 表达最高的基因为CCL20[18]. 因考虑患者经济承受能力和检查必要性, 最终患者未行细胞遗传学检测.
常见鉴别诊断[1-3,7-9]包括(1)反应性淋巴滤泡增生: 患者常伴有发热、乏力等全身症状以及血沉、球蛋白、白蛋白等血结果的异常, 常由刺激B细胞增生的免疫反应引起, 多见于类风湿性关节炎和获得性免疫缺陷综合征, 病理提示淋巴细胞呈多克隆性增生, 滤泡形态大小不一, 界限明显, 可出现淋巴上皮病变, 但通常病变表面重, 底部轻度, 可见"星空"现象和生发中心明显扩大且周围有套区细胞围绕, 存在FDC网状结构, 生发中心Bcl-2阴性, Ki-67高表达. 而DFL一般无全身症状及基础疾病, 病理提示淋巴细胞为单克隆性增生, 滤泡样结构无"星空"现象及极化分区, CD21、CD23显示FDC网呈在肿瘤性滤泡周边密集、浓染, 生发中心Bcl-2为阳性, Ki-67低表达; (2)系统性FL累及十二指肠: 形态学及免疫表型与DFL类似, 但除了累及十二指肠的病变外, 还常有全身淋巴结肿大和其他结外区病变(如骨髓和腔外); 且没有滤泡中央区域斑驳、缺失, 树突细胞网表现弥漫、完整; (3)黏膜相关淋巴组织结外边缘区淋巴瘤(MALT淋巴瘤): 发病率较高, 常见于胃肠道且以胃部更常见, 临床症状主要有消化不良、反酸、腹痛和体重减轻等, 90%查见幽门螺杆菌阳性; 胃镜下可表现为胃黏膜病变, 如红斑、糜烂和溃疡等. 病理上主要由小B细胞组成的结外淋巴瘤, 其免疫蛋白Kappa、Lambda可存在限制性表达, 部分肿瘤细胞异常表达CD43, 而CD10、Bcl-6阴性, 最常见的染色体易位是t(11;18). 而DFL主要发生在十二指肠降部, 临床症状均不典型, 但幽门螺杆菌阳性率低于MALT淋巴瘤, 内镜下主要以多个小息肉样病变为主, 肿瘤细胞是生发中心细胞起源, 病理提示CD10及Bcl-6均阳性; (4)套细胞淋巴瘤(mantle cell lymphoma, MCL): 占全部NHL的6%, MCL有时可累及胃肠道, 内镜下呈多发性息肉状, 临床发展迅速, 病理镜下肿瘤细胞呈小圆形, 中心细胞样, 形成结节, 在腺体之间浸润. 有特征性t(11;14)易位, 可见Bcl-1、Cyclin D1、SOX-11、CD5、CD20阳性, Ki-67高表达. 而DFL呈惰性病程, Ki-67低表达, 特异性表达BCL-2, 不表达Cyclin D1、CD5及SOX-11; (5)慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL): 同样呈惰性, 但通常与淋巴结肿大或脾大相关, 胃肠道表现可能与全身系统性病变有关, CLL可出现外周血白细胞及B淋巴细胞增加, 镜下小淋巴细胞增生形成淡染的结节, 可形成"增殖中心"具有一定诊断意义, 肿瘤细胞CD20、Pax-5、CD5、CD23和LEF1通常阳性, 与DFL不同的是CD10和Bcl-6呈阴性, DFL血象变化不明显.
DFL治疗取决于疾病的进展和弥散程度和存在的症状, 部分患者可自愈, 无症状的早期患者可不需要治疗, 估计总生存率为92%-100%, 中位随访时间为20 mo-107 mo[19], 严重者可进行生物治疗或免疫治疗、化疗和放疗. 因为部分DFL出现疾病复发和进展的情况, 也有文献提到可通过一些特征来评判预后, 如T细胞介导的免疫反应越好, DFL预后越好[20]; 滤泡病变的周向位置(肠腔周长的一半以上)和滤泡病变的融合(密集的颗粒状隆起, 边界不明确)是临床分期进展、肠道病变扩展或转化为弥漫性大B细胞淋巴瘤的重要预测因素[21]. 对开放性文献进行复习(见表2), 随访观察的患者大部分病情稳定, 少部分病变可见病灶完全消失、复发或进展, 对其再进行继续治疗效果良好. 尽管使用化疗治疗的8例患者中也有3例复发[9], 但使用的化疗、靶向治疗和外科手术治疗等均未出现进展. 因此, 综合疗效、经济效益和患者生活质量考虑, 初诊及复查稳定的患者治疗上可选择随诊观察, 定期复查胃镜. 若出现可能预后不良的征象, 可选择利妥昔单抗或放化疗策略, 暂无根除HP研究证实对DFL治疗有意义, 但如果转化至弥漫性大 B 细胞淋巴瘤可能常规治疗较困难, 需要干细胞移植[25,26].
| 文献来源 | 分组 | n = 131 | 病变 | 随访时间(mo) | ||||
| 消失 | 稳定 | 复发 | 进展 | 中位 | 范围 | |||
| 本文 | 随访观察 | 4 | 0 | 4 | 0 | 0 | 10.5 | 07-72 |
| [7] | 随访观察 | 15 | 4 | 11 | 0 | 0 | 24 | 06-58 |
| 化疗+利妥昔单抗 | 4 | 4 | 0 | 0 | 0 | 37 | 30-43 | |
| 利妥昔单抗 | 3 | 3 | 0 | 0 | 0 | 36 | 26-60 | |
| [8] | 随访观察 | 14 | 0 | 14 | 0 | 0 | 17 | 04-45 |
| 化疗+利妥昔单抗 | 1 | 1 | 0 | 0 | 0 | 17 | 04-45 | |
| 病变肠断切除术 | 1 | 1 | 0 | 0 | 0 | 17 | 04-45 | |
| [9] | 随访观察 | 24 | 7 | 17 | 0 | 2 | 55 | 06-137 |
| 化疗(联合或不联合放疗) | 8 | 8 | 0 | 3 | 0 | 44 | 15-95 | |
| 利妥昔单抗 | 5 | 4 | 1 | 0 | 0 | 36 | 29-118 | |
| 放疗 | 19 | 19 | 0 | 0 | 0 | 37 | 10-108 | |
| [22] | 随访观察 | 3 | 1 | 2 | 0 | 0 | - | 07-61 |
| [23] | 随访观察 | 15 | 0 | 11 | 0 | 4 | 63 | 26-136 |
| 化疗+利妥昔单抗(加延长治疗) | 14 | 14 | 0 | 1 | 1 | 107.5 | 50-149 | |
| [24] | 随诊观察 | 1 | 0 | 1 | 0 | 0 | - | 09 |
正确的疾病严重程度和预后评估可能是目前需要解决的问题之一, 因为DFL的预后良好, 往往首选临床观察, 可能忽视疾病的严重性, 但是有部分病例出现全身性广泛复发或转化为弥漫性大B细胞淋巴瘤预后极差[26], 尽管再接受了各种化疗, 但也可在5年内死亡.
DFL临床上罕见, 但总体预后好, 建议首选随访观察, 根据疾病的进展、扩散程度和预后因素评估, 可选择药物及放化疗干预, 必要时可行干细胞移植, 无论是哪种治疗方案, 长时间的全身随访检查是必须的.
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 2. | Swerdlow SH, Campo E, Pileri SA, Harris NL, Stein H, Siebert R, Advani R, Ghielmini M, Salles GA, Zelenetz AD, Jaffe ES. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood. 2016;127:2375-2390. [PubMed] [DOI] |
| 3. | Iwamuro M, Tanaka T, Ennishi D, Matsueda K, Yoshioka M, Miyahara K, Sakaguchi C, Nishimura M, Nagahara T, Mannami T, Takenaka R, Oka S, Inoue M, Takimoto H, Inaba T, Kobayashi S, Toyokawa T, Tsugeno H, Suzuki S, Sawada S, Tanaka S, Tsuzuki T, Okada H. Long-term outcomes of patients with primary intestinal follicular lymphoma managed with watch-and-wait strategy. Sci Rep. 2023;13:5858. [PubMed] [DOI] |
| 4. | Iwamuro M, Okada H, Takata K, Shinagawa K, Fujiki S, Shiode J, Imagawa A, Araki M, Morito T, Nishimura M, Mizuno M, Inaba T, Suzuki S, Kawai Y, Yoshino T, Kawahara Y, Takaki A, Yamamoto K. Diagnostic role of 18F-fluorodeoxyglucose positron emission tomography for follicular lymphoma with gastrointestinal involvement. World J Gastroenterol. 2012;18:6427-36; discussion p.6434. [PubMed] [DOI] |
| 5. | Fernández Suárez B, Seoane Blanco L, Gómez Rivas M, García Gómez A, González Otero L, Roibás Veiga A, Fernández Molina J. Primary follicular lymphoma of the duodenum as an incidental finding on upper gastrointestinal endoscopy. Rev Esp Enferm Dig. 2024. [PubMed] [DOI] |
| 6. | Maeshima AM, Taniguchi H, Suzuki T, Yuda S, Toyoda K, Yamauchi N, Makita S, Fukuhara S, Munakata W, Maruyama D, Kobayashi Y, Saito Y, Tobinai K. Comparison of clinicopathologic characteristics of gastric follicular lymphomas and duodenal follicular lymphomas. Hum Pathol. 2017;65:201-208. [PubMed] [DOI] |
| 7. | 陈 青, 张 燕林, 何 妙侠, 郭 广秀, 廖 青, 周 小鸽. 十二指肠型滤泡性淋巴瘤22例回顾性分析. 临床与实验病理学杂志. 2019;35:1112-1114. [DOI] |
| 8. | 刘 英婷, 易 红梅, 王 雪, 杨 春雪, 欧阳 斌燊, 许 海敏, 王 朝夫. 十二指肠型滤泡性淋巴瘤17例临床病理特征及预后分析. 诊断学理论与实践. 2023;22:362-368. [DOI] |
| 9. | Schmatz AI, Streubel B, Kretschmer-Chott E, Püspök A, Jäger U, Mannhalter C, Tiemann M, Ott G, Fischbach W, Herzog P, Seitz G, Stolte M, Raderer M, Chott A. Primary follicular lymphoma of the duodenum is a distinct mucosal/submucosal variant of follicular lymphoma: a retrospective study of 63 cases. J Clin Oncol. 2011;29:1445-1451. [PubMed] [DOI] |
| 10. | Takata K, Okada H, Ohmiya N, Nakamura S, Kitadai Y, Tari A, Akamatsu T, Kawai H, Tanaka S, Araki H, Yoshida T, Okumura H, Nishisaki H, Sagawa T, Watanabe N, Arima N, Takatsu N, Nakamura M, Yanai S, Kaya H, Morito T, Sato Y, Moriwaki H, Sakamoto C, Niwa Y, Goto H, Chiba T, Matsumoto T, Ennishi D, Kinoshita T, Yoshino T. Primary gastrointestinal follicular lymphoma involving the duodenal second portion is a distinct entity: a multicenter, retrospective analysis in Japan. Cancer Sci. 2011;102:1532-1536. [PubMed] [DOI] |
| 11. | Lin Z, Zha J, Yi S, Li Z, Ping L, He X, Fan L, Yu H, Zheng Z, Xu W, Chen F, Xie Y, Chen B, Zhang H, Wang L, Ding K, Li W, Yang H, Zhao W, Qiu L, Li Z, Song Y, Xu B. Clinical characteristics and outcomes of follicular lymphoma patients with extranodal involvement: analysis of a series of 1090 cases in China. Clin Transl Oncol. 2023;25:1821-1829. [PubMed] [DOI] |
| 13. | Ehrenpreis ED, Roginsky G, Gore RM. Clinical significance of mesenteric panniculitis-like abnormalities on abdominal computerized tomography in patients with malignant neoplasms. World J Gastroenterol. 2016;22:10601-10608. [PubMed] [DOI] |
| 14. | Grégory J, Dana J, Yang I, Chong J, Drevon L, Ronot M, Vilgrain V, Reinhold C, Gallix B. CT features associated with underlying malignancy in patients with diagnosed mesenteric panniculitis. Diagn Interv Imaging. 2022;103:394-400. [PubMed] [DOI] |
| 15. | 时 云飞, 薛 卫成. 淋巴瘤免疫组织化学标志物的合理应用. 临床与实验病理学杂志. 2024;40:18-23. [DOI] |
| 16. | Jaffe ES, Quintanilla-Martinez L. t(14;18)-positive B cells: is it seed or soil? Blood. 2018;132:1631-1632. [PubMed] [DOI] |
| 17. | Iwamuro M, Tanaka T, Okada H. Review of lymphoma in the duodenum: An update of diagnosis and management. World J Gastroenterol. 2023;29:1852-1862. [PubMed] [DOI] |
| 18. | Hellmuth JC, Louissaint A, Szczepanowski M, Haebe S, Pastore A, Alig S, Staiger AM, Hartmann S, Kridel R, Ducar MD, Koch P, Dreyling M, Hansmann ML, Ott G, Rosenwald A, Gascoyne RD, Weinstock DM, Hiddemann W, Klapper W, Weigert O. Duodenal-type and nodal follicular lymphomas differ by their immune microenvironment rather than their mutation profiles. Blood. 2018;132:1695-1702. [PubMed] [DOI] |
| 19. | Duffles Amarante G, Collins G, Rocha V. What do we know about duodenal-type follicular lymphoma? From pathological definition to treatment options. Br J Haematol. 2020;188:831-837. [PubMed] [DOI] |
| 20. | Inoue H, Rai S, Tanaka H, Espinoza JL, Watatani Y, Kumode T, Serizawa K, Nakayama S, Taniguchi Y, Morita Y, Tatsumi Y, Ashida T, Matsumura I. Tumour-immune microenvironment in duodenal-type follicular lymphoma. Br J Haematol. 2020;191:243-252. [PubMed] [DOI] |
| 21. | Sumioka A, Oka S, Hirata I, Iio S, Tsuboi A, Takigawa H, Yuge R, Urabe Y, Boda K, Kohno T, Okanobu H, Kitadai Y, Arihiro K, Tanaka S. Predictive factors for the progression of primary localized stage small-bowel follicular lymphoma. J Gastroenterol. 2022;57:667-675. [PubMed] [DOI] |
| 23. | Tari A, Kitadai Y, Mouri R, Takigawa H, Asaoku H, Mihara K, Takata K, Fujihara M, Yoshino T, Koga T, Fujimori S, Tanaka S, Chayama K. Watch-and-wait policy versus rituximab-combined chemotherapy in Japanese patients with intestinal follicular lymphoma. J Gastroenterol Hepatol. 2018;33:1461-1468. [PubMed] [DOI] |
| 25. | Saburi M, Kondo Y, Ogata M, Soga Y, Abe M, Takano K, Kohno K, Nagai T, Nakayama T. Development of diffuse large B-cell lymphoma from duodenal type follicular lymphoma: a retrospective study of 23 cases. Int J Hematol. 2020;112:658-665. [PubMed] [DOI] |
| 26. | Saito M, Mori A, Tsukamoto S, Ishio T, Yokoyama E, Izumiyama K, Morioka M, Kondo T, Sugino H. Duodenal-type follicular lymphoma more than 10 years after treatment intervention: A retrospective single-center analysis. World J Gastrointest Oncol. 2022;14:1552-1561. [PubMed] [DOI] |