修回日期: 2024-06-02
接受日期: 2024-06-21
在线出版日期: 2024-07-28
胃癌是威胁人类生命健康的主要恶性肿瘤之一, 人类疱疹病毒(Epstein-Barr virus, EBV)是一种致癌病毒, 主要感染上皮细胞、B细胞, 与多种肿瘤的发生发展密切相关. 本研究尝试探究胃癌患者EBV感染情况及对预后的影响.
研究胃癌患者EBV感染情况及对预后的影响.
选取2020-01/2022-12本院300例胃癌患者作为研究组, 另选同期同年龄段150例胃部良性肿瘤(胃息肉)患者作为对照组. 比较研究组和对照组临床资料、EBV感染阳性率, 分析EBV感染与胃癌临床特征的相关性, 分析胃癌预后不良的影响因素, 根据影响因素构建预测预后不良的列线图模型, 分析列线图模型的预测价值.
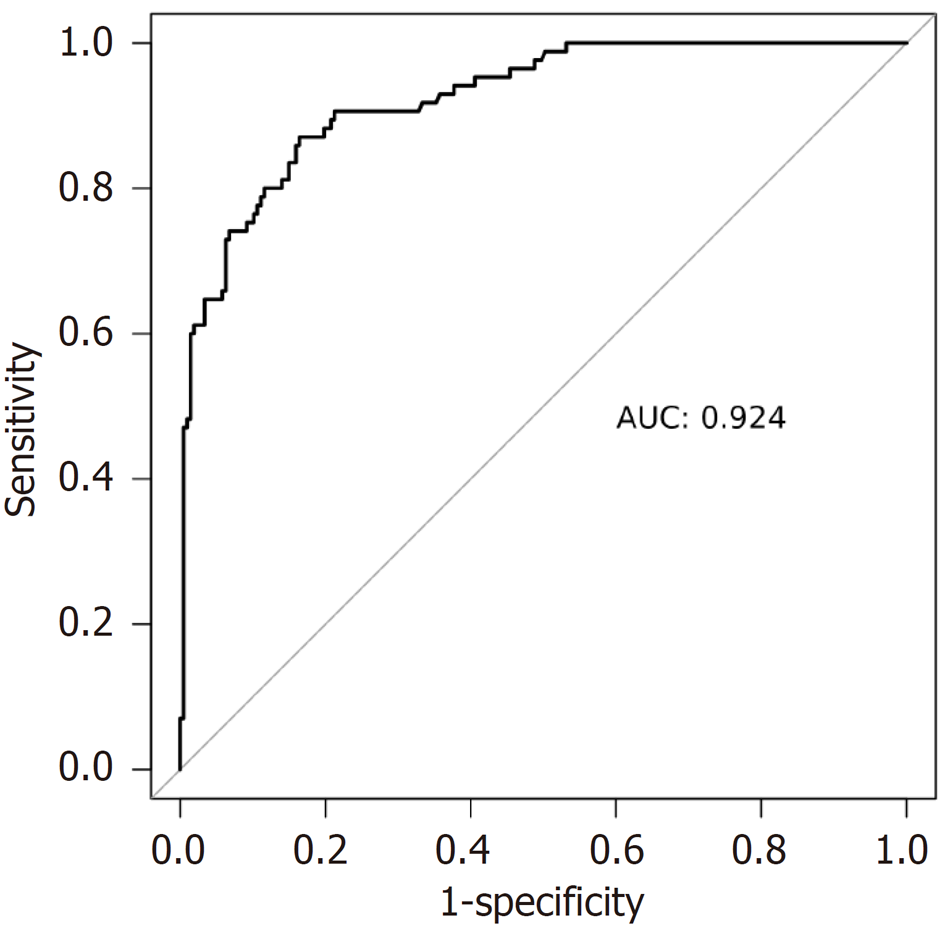
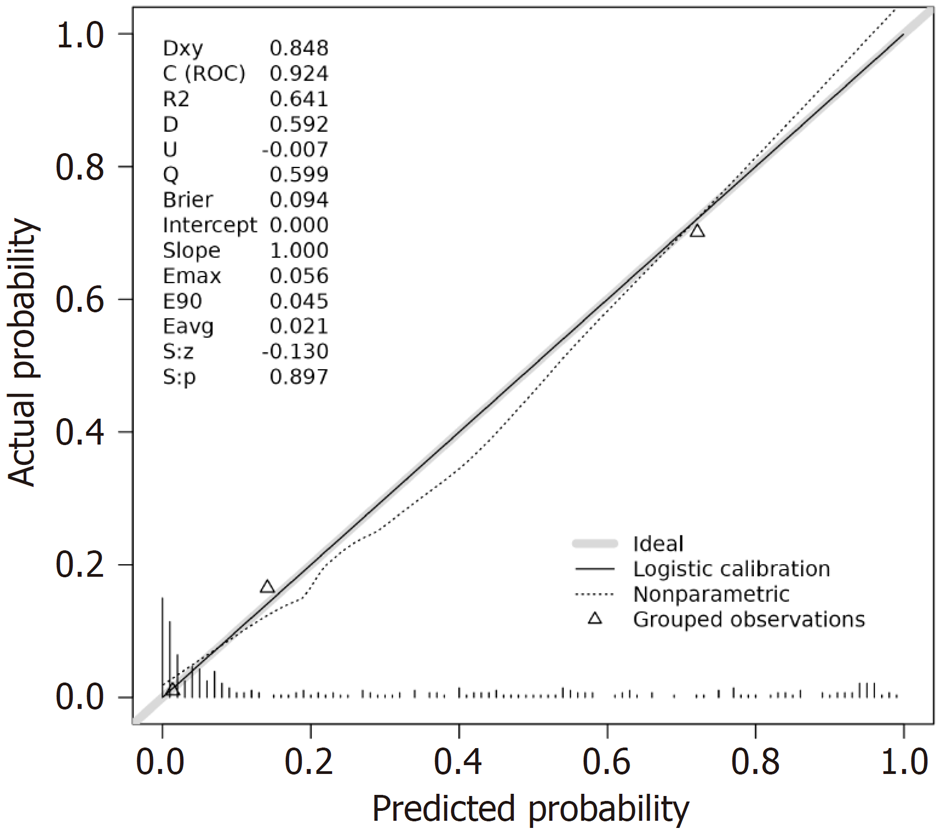
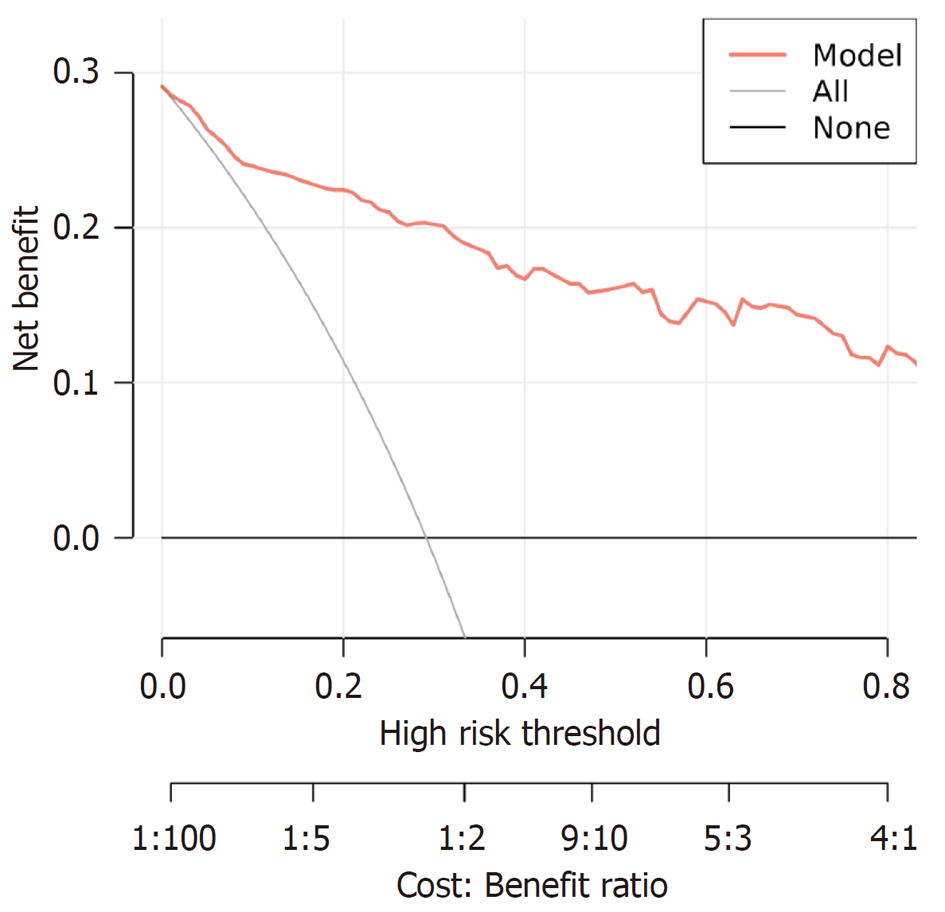
研究组EBV感染阳性率(10.67%)高于对照组(1.33%)(P<0.05); Lauren分型混合型胃癌患者EBV感染阳性率(21.05%)高于肠型(7.19%)、弥漫型(7.50%)、未分型(0.00%)患者, 程序性死亡分子1(programmed death-1, PD-1)阳性胃癌患者EBV感染阳性率(19.61%)高于PD-1阴性患者(6.06%), 程序性死亡配体1(programmed death receptor 1, PD-L1)阳性胃癌患者EBV感染阳性率(21.13%)高于PD-L1阴性患者(7.42%)(P<0.05); 研究组预后不良患者年龄、TNM分期Ⅲ-Ⅳ期占比、浸润深度T3+T4占比、淋巴结转移占比、分化程度低分化占比、PD-1阳性率、PD-L1阳性率、EBV感染阳性率高于预后良好患者(P<0.05); 年龄、TNM分期Ⅲ-Ⅳ期、浸润深度T3+T4、淋巴结转移、分化程度低分化、PD-1阳性、PD-L1阳性、EBV感染阳性均为胃癌预后不良的独立危险因素(P<0.05); 根据影响因素构建预测预后不良的列线图模型, 该模型预测胃癌患者预后不良的曲线下面积为0.924(95%CI: 0.892-0.956), 具有较高预测效能, 且预测预后不良的校准度、临床效用良好.
胃癌患者具有较高EBV感染阳性率, EBV感染与Lauren分型、PD-1/PD-L1信号通路有关, 且是胃癌预后不良的影响因素.
核心提要: 胃癌患者具有较高人类疱疹病毒(Epstein-Barr virus, EBV)感染阳性率, EBV感染与Lauren分型、程序性死亡分子1/程序性死亡配体1信号通路有关, 且是胃癌预后不良的影响因素.
引文著录: 向霞, 李小英. 胃癌患者EBV感染情况及对预后的影响. 世界华人消化杂志 2024; 32(7): 509-516
Revised: June 2, 2024
Accepted: June 21, 2024
Published online: July 28, 2024
Gastric cancer is one of the major malignant tumors that threaten human life and health. Epstein-Barr virus (EBV) is a carcinogenic virus that mainly infects epithelial cells and B cells, and is closely related to the occurrence and development of various tumors. This study attempted to explore the EBV infection status in patients with gastric cancer and its impact on prognosis.
To investigate the EBV infection status in patients with gastric cancer and its impact on the prognosis.
A total of 300 patients with gastric cancer treated at our hospital from January 2020 to December 2022 were selected as a study group, and another 150 patients with benign gastric tumors (gastric polyps) of the same age group were selected in the same period as a control group. The clinical data and positive rate of EBV infection were compared between the two groups, and the correlation between EBV infection and clinical characteristics of gastric cancer was analyzed. The clinical data and positive rate of EBV infection were compared in study group patients with different prognoses, and the influencing factors of poor prognosis of gastric cancer were analyzed. A nomogram model was constructed based on the influencing factors identified to predict the prognosis of gastric cancer.
The positive rate of EBV infection in the study group (10.67%) was higher than that of the control group (1.33%; P < 0.05). The positive rate of EBV infection (21.05%) in patients with mixed type gastric cancer (Lauren's classification) was higher than those of patients with intestinal type (7.19%), diffuse type (7.50%) and unclassified type (0.00%). The positive rate of EBV infection in programmed death-1 (PD-1) positive gastric cancer patients (19.61%) was higher than that of PD-1 negative ones (6.06%; P < 0.05), and the positive rate of EBV infection in programmed death receptor 1 (PD-L1) positive gastric cancer patients (21.13%) was also higher than that of PD-L1 negative ones (7.42%; P < 0.05). In the study group, the proportions of patients with TNM stage Ⅲ/Ⅳ, T3 + T4 stage, lymph node metastasis, and poorly differentiated tumors, and the positive rates of PD-1, PD-L1, and EBV infection were significantly higher in patients with a poor prognosis than in those with a good prognosis (P < 0.05). Age, TNM stage Ⅲ/Ⅳ, depth of invasion (T3 + T4), lymph node metastasis, low differentiation, PD-1 positivity, PD-L1 positivity, and EBV infection were identified to be independent risk factors for poor prognosis of gastric cancer (P < 0.05). A nomogram model for predicting poor prognosis was constructed based on these independent risk factors. The area under the curve of the model for predicting poor prognosis in gastric cancer patients was 0.924 (95% confidence interval: 0.892-0.956), suggesting high prediction efficiency. The correlation size (Dxy value) between the predicted value and the actual value of the model was 0.848, indicating a good calibration degree. Moreover, the model had significant positive net benefit, and had good clinical utility in predicting the risk of poor prognosis in patients with gastric cancer.
Patients with gastric cancer have a high positive rate of EBV infection, which is related to Lauren's classification and the PD-1/PD-L1 signaling pathway. EBV infection is an independent risk factor for poor prognosis of gastric cancer.
- Citation: Xiang X, Li XY. Infection with Epstein-Barr virus in gastric cancer patients and its impact on prognosis. Shijie Huaren Xiaohua Zazhi 2024; 32(7): 509-516
- URL: https://www.wjgnet.com/1009-3079/full/v32/i7/509.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i7.509
胃癌是全球主要癌症负担, 全球每年有超过100万人新诊断为胃癌[1,2]. 胃癌的发生受多方面因素影响, 如饮食不当、遗传因素、接触化学致癌物、幽门螺杆菌感染、人类疱疹病毒(Epstein-Barr virus, EBV)感染等[3]. 其中EBV是一种致癌病毒, 主要感染上皮细胞、B细胞, 也能感染免疫细胞, 与多种肿瘤的发生发展密切相关, 每年导致约20万例癌症相关死亡[4,5]. 有证据表明, EBV感染与胃部等消化道肿瘤的发生存在一定的关系[6,7]. 研究显示, EBV感染人体后将其DNA整合到宿主体内, 然后在潜伏蛋白的作用下通过微小核糖核酸(ribonucleic acid, RNA)影响脱氧核糖核酸(deoxyribonucleic acid, DNA)甲基化, 从而促进胃癌的发生[8]. 但EBV感染参与胃癌的发病机制及对预后的影响尚未明确, 本研究重点对此进行探究, 以期为EBV感染相关胃癌防治提供依据.
根据临床样本量估算方法, 参考估计样本含量公式计算, δ约为7, 总体标准差(σ)为6, α取双侧0.05, 检测功效为0.95, 代入公式, N = [(Zα/2+Zβ)σ/2δ]2(Q1-1+Q2-1), 得出最小样本量为270例. 选取2020-01/2022-12本院300例胃癌患者作为研究组, 胃癌诊断参照《胃癌诊疗规范(2018年版)》[9]. 另选同期同年龄段150例胃部良性肿瘤(胃息肉)患者作为对照组. 纳入标准: (1)胃癌及胃部良性肿瘤均经手术病理组织诊断确诊; (2)于我院行手术治疗; (3)手术前尚未接受相关治疗; (4)临床资料完整; (5)已签署同意书. 排除标准: (1)其他原发恶性肿瘤; (2)心肺肝肾等脏器严重功能不全; (3)精神疾病; (4)免疫系统障碍相关疾病; (5)复发性胃癌; (6)凝血功能障碍; (7)幽门螺杆菌感染.
1.2.1 EBV感染检测: 所有研究对象均取肿瘤组织, 采用EBV编码的小RNA原位杂交检测检测肿瘤组织EBV感染情况. 取肿瘤组织常规处理后切片(3 μm)、烤片(2 h), 以DL-DYE全自动染色仪(珠海迪尔生物)检测. 以已知阳性组织为阳性外对照, 显微镜下观察切片肿瘤细胞细胞核, EBV感染阳性表现为弥漫性或散在的点状蓝色信号.
1.2.2 胃癌治疗及预后评估: 研究组患者均参照《胃癌诊疗指南(2022年版)》[9]制定治疗方案, 治疗后随访1年, 随访方法为电话、微信、门诊, 每个月随访1次. 统计随访期间复发、转移及死亡情况, 将复发、转移及死亡判定为预后不良, 未复发、转移或死亡判定为预后良好.
(1)研究组和对照组临床资料、EBV感染阳性率; (2)分析EBV感染与胃癌临床特征的相关性; (3)研究组不同预后患者临床资料、EBV感染阳性率; (4)分析胃癌预后不良的影响因素; (5)根据影响因素构建预测预后不良的列线图模型.
统计学处理 采用SPSS 27.0软件统计、检验. 计数资料以率(%)表示, 用χ2检验. 计量资料以K-S法检验符合正态分布, 以mean±SD表示, 用t检验. 影响因素分析采用Logistic多因素回归. 预测价值分析采用受试者工作特征(receiver operating characteristic, ROC)曲线、校准曲线及决策曲线(decision curve analysis, DCA), 曲线下面积(area under the curve, AUC)>0.9表示预测效能较高. P<0.05为差异有统计学意义.
研究组EBV感染阳性率高于对照组(P<0.05), 见表1.
| 组别 | n | 性别 | 年龄(岁) | 体重指数(kg/m2) | 吸烟史 | 饮酒史 | 胃癌家族史 | 高血压 | 糖尿病 | 高脂血症 | EBV感染阳性 | |
| 男 | 女 | |||||||||||
| 研究组 | 300 | 183(61.00) | 117(39.00) | 60.53±8.59 | 22.81±1.63 | 101(33.67) | 129(43.0) | 42(14.00) | 54(18.00) | 46(15.33) | 31(10.33) | 32(10.67)b |
| 对照组 | 150 | 82(54.67) | 68(45.33) | 59.24±8.13 | 23.05±1.77 | 43(28.67) | 55(36.67) | 13(8.67) | 19(12.67) | 17(11.33) | 12(8.00) | 2(1.33) |
| χ2/t | 1.657 | 1.529 | 1.430 | 1.149 | 1.660 | 2.651 | 2.093 | 1.329 | 0.630 | 12.472 | ||
| P | 0.198 | 0.127 | 0.153 | 0.284 | 0.198 | 0.104 | 0.148 | 0.249 | 0.427 | <0.001 | ||
胃癌患者不同Lauren分型、程序性死亡分子1(programmed death-1, PD-1)、程序性死亡配体1(programmed death receptor 1, PD-L1)之间的EBV感染阳性率比较差异有统计学意义(P<0.05), 见表2.
| 临床特征 | n | EBV感染阳性 | χ2 | P | |
| 性别 | 男 | 183 | 20(10.93) | 2.233 | 0.135 |
| 女 | 117 | 12(10.26) | |||
| 年龄(岁) | <60 | 142 | 15(10.56) | 0.003 | 0.956 |
| ≥60 | 158 | 17(10.76) | |||
| 体重指数(kg/m2) | <24 | 203 | 22(10.84) | 0.019 | 0.890 |
| ≥24 | 97 | 10(10.31) | |||
| 胃癌家族史 | 有 | 42 | 5(11.90) | 0.000 | 0.991 |
| 无 | 258 | 27(10.47) | |||
| 病理分型 | 腺癌 | 231 | 24(10.39) | 0.217 | 0.897 |
| 印戒细胞癌 | 48 | 6(12.50) | |||
| 其他 | 21 | 2(9.52) | |||
| TNM分期 | Ⅰ-Ⅱ期 | 182 | 19(10.44) | 0.025 | 0.874 |
| Ⅲ-Ⅳ期 | 118 | 13(11.02) | |||
| 肿瘤最大径(cm) | <3.5 | 116 | 12(10.34) | 0.021 | 0.886 |
| ≥3.5 | 184 | 20(10.87) | |||
| 浸润深度 | T1+T2 | 175 | 18(10.29) | 0.064 | 0.800 |
| T3+T4 | 125 | 14(11.20) | |||
| 肿瘤部位 | 贲门 | 95 | 10(10.53) | 0.004 | 0.998 |
| 胃体 | 131 | 14(10.69) | |||
| 胃窦 | 74 | 8(10.81) | |||
| 淋巴结转移 | 有 | 116 | 8(6.90) | 2.821 | 0.093 |
| 无 | 184 | 24(13.04) | |||
| 分化程度 | 低分化 | 155 | 17(10.97) | 0.055 | 0.973 |
| 中分化 | 94 | 10(10.64) | |||
| 高分化 | 51 | 5(9.80) | |||
| Lauren分型 | 肠型 | 139 | 10(7.19) | 11.801 | 0.008 |
| 混合型 | 76 | 16(21.05) | |||
| 弥漫型 | 80 | 6(7.50) | |||
| 未分型 | 5 | 0(0.00) | |||
| PD-1 | 阳性 | 102 | 20(19.61)b | 12.966 | <0.001 |
| 阴性 | 198 | 12(6.06) | |||
| PD-L1 | 阳性 | 71 | 15(21.13)b | 10.680 | 0.001 |
| 阴性 | 229 | 17(7.42) | |||
随访期间, 研究组脱落8例(均为EBV感染阴性患者), 完成随访的292例患者中预后不良85例, 预后良好207例. 预后不良患者年龄、TNM分期Ⅲ-Ⅳ期占比、浸润深度T3+T4占比、淋巴结转移占比、分化程度低分化占比、PD-1阳性率、PD-L1阳性率、EBV感染阳性率高于预后良好患者(P<0.05), 见表3.
| 项目 | 预后不良(n = 85) | 预后良好(n = 207) | t/χ2/u | P |
| 性别 | 0.230 | 0.632 | ||
| 男 | 50(58.82) | 128(61.84) | ||
| 女 | 35(41.18) | 79(38.16) | ||
| 年龄(岁) | 65.17±8.62b | 58.51±7.87 | 6.387 | <0.001 |
| 体重指数(kg/m2) | 22.68±1.70 | 23.03±1.62 | 1.653 | 0.099 |
| 吸烟史 | 29(34.12) | 67(32.37) | 0.084 | 0.772 |
| 饮酒史 | 37(43.53) | 86(41.55) | 0.097 | 0.755 |
| 胃癌家族史 | 15(17.65) | 25(12.08) | 1.581 | 0.209 |
| 高血压 | 18(21.18) | 33(15.94) | 1.145 | 0.285 |
| 糖尿病 | 16(18.82) | 25(12.08) | 2.664 | 0.103 |
| 高脂血症 | 11(12.94) | 17(8.21) | 1.554 | 0.213 |
| 病理分型 | 2.240 | 0.326 | ||
| 腺癌 | 65(76.47) | 164(79.23) | ||
| 印戒细胞癌 | 12(14.12) | 33(15.94) | ||
| 其他 | 8(9.41) | 10(4.83) | ||
| TNM分期 | 73.669 | <0.001 | ||
| Ⅰ-Ⅱ期 | 20(23.53)b | 160(77.29) | ||
| Ⅲ-Ⅳ期 | 65(76.47)b | 47(22.71) | ||
| 肿瘤最大径(cm) | 0.310 | 0.578 | ||
| <3.5 | 35(41.18) | 78(37.68) | ||
| ≥3.5 | 50(58.82) | 129(62.32) | ||
| 浸润深度 | 29.523 | <0.001 | ||
| T1+T2 | 29(34.12)b | 142(68.60) | ||
| T3+T4 | 56(65.88)b | 65(31.40) | ||
| 肿瘤部位 | 0.240 | 0.887 | ||
| 贲门 | 25(29.41) | 66(31.88) | ||
| 胃体 | 38(44.71) | 92(44.44) | ||
| 胃窦 | 22(25.88) | 49(23.67) | ||
| 淋巴结转移 | 12.598 | <0.001 | ||
| 有 | 46(54.12)b | 66(31.88) | ||
| 无 | 39(45.88)b | 141(68.12) | ||
| 分化程度 | 4.721 | <0.001 | ||
| 低分化 | 63(74.12)b | 87(42.03) | ||
| 中分化 | 18(21.18)b | 74(35.75) | ||
| 高分化 | 4(4.71)b | 46(22.22) | ||
| Lauren分型 | 4.137 | 0.247 | ||
| 肠型 | 35(41.18) | 100(48.31) | ||
| 混合型 | 28(32.94) | 46(22.22) | ||
| 弥漫型 | 20(23.53) | 58(28.02) | ||
| 未分型 | 2(2.35) | 3(1.45) | ||
| PD-1阳性 | 45(52.94)b | 53(25.60) | 20.196 | <0.001 |
| PD-L1阳性 | 38(44.71)b | 27(13.04) | 34.908 | <0.001 |
| EBV感染阳性 | 20(23.53)b | 12(5.80) | 19.417 | <0.001 |
以胃癌患者是否发生预后不良为因变量(赋值: 否 = 0, 是 = 1), 将表3中差异有统计学意义指标作为自变量(赋值: 年龄: 连续变量, 原值代入; TNM分期Ⅲ-Ⅳ期: 否 = 0, 是 = 1; 浸润深度T3+T4: 否 = 0, 是 = 1; 淋巴结转移: 无 = 0, 有 = 1; 分化程度低分化: 否 = 0, 是 = 1; PD-1阳性: 否 = 0, 是 = 1; PD-L1阳性: 否 = 0, 是 = 1; EBV感染阳性: 否 = 0, 是 = 1), 通过Logistic多因素回归分析显示, 年龄、TNM分期Ⅲ-Ⅳ期、浸润深度T3+T4、淋巴结转移、分化程度低分化、PD-1阳性、PD-L1阳性、EBV感染阳性均为胃癌预后不良的独立危险因素(P<0.05), 见表4.
| 变量 | β | SE | Wald | OR | OR的95%置信区间 | P | |
| 下限 | 上限 | ||||||
| 年龄 | 0.116 | 0.042 | 7.603 | 1.123 | 1.035 | 1.218 | 0.002 |
| TNM分期Ⅲ-Ⅳ期 | 0.874 | 0.271 | 10.400 | 2.396 | 1.426 | 4.027 | <0.001 |
| 浸润深度T3+T4 | 0.710 | 0.236 | 9.047 | 2.034 | 1.183 | 3.496 | <0.001 |
| 淋巴结转移 | 0.919 | 0.292 | 9.896 | 2.506 | 1.510 | 4.158 | <0.001 |
| 分化程度低分化 | 1.051 | 0.315 | 11.126 | 2.860 | 1.631 | 5.014 | <0.001 |
| PD-1阳性 | 0.751 | 0.276 | 7.399 | 2.119 | 1.229 | 3.652 | 0.006 |
| PD-L1阳性 | 0.966 | 0.318 | 9.224 | 2.627 | 1.461 | 4.723 | <0.001 |
| EBV感染阳性 | 0.941 | 0.309 | 9.283 | 2.564 | 1.530 | 4.296 | <0.001 |
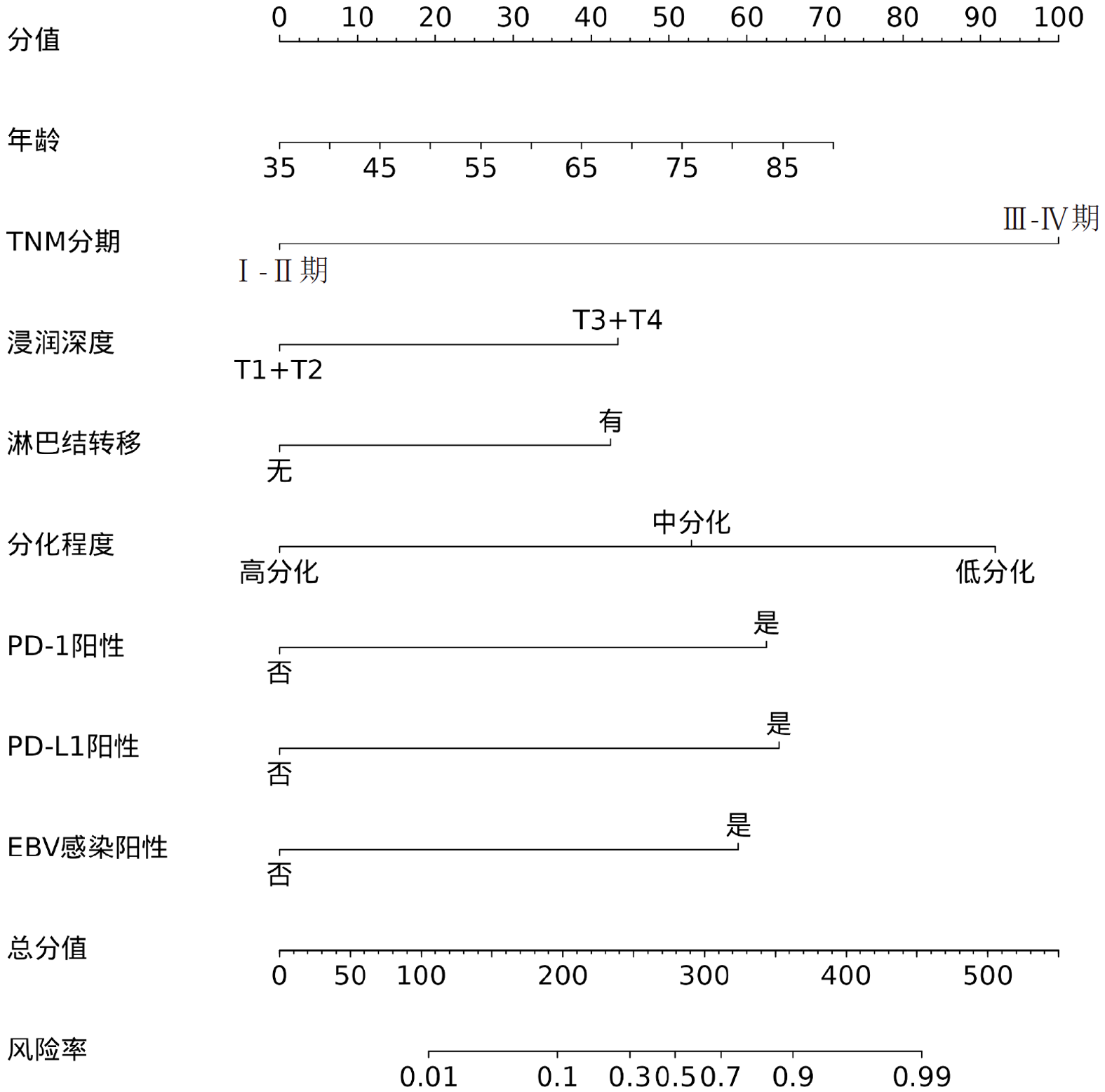
胃癌患者预后不良为目标事件, 以Logistic多因素回归分析筛选出的8个影响因素: 年龄、TNM分期、浸润深度、淋巴结转移情况、分化程度、PD-1表达情况、PD-L1表达情况、EBV感染情况为预测指标, 构建胃癌患者预测预后不良的列线图模型构建, 见图1.
EBV感染阳性胃癌约占全球胃癌的10%, EBV感染能通过诱导宿主、病毒基因组高甲基化, 促进胃癌的发生[10,11]. 本研究结果显示, 胃癌患者病灶组织中EBV感染阳性率为10.67%, 与上述报道数据相近, 且胃癌患者EBV感染阳性率明显高于胃部良性肿瘤患者. 说明EBV感染与胃癌的发生有关. 分析其原因在于, EBV感染人体后能于记忆性B细胞中终身潜伏, 诱导细胞癌变, 其分子作用机制可能在于EBV感染可诱导基因启动子甲基化, 高甲基化导致关键的肿瘤抑制基因、凋亡基因、细胞周期基因、DNA修复基因和细胞分化因子沉默, 从而促进高度增殖和低分化的细胞群形成, 最终增加胃癌发生风险[12,13].
本研究结果显示, 不同Lauren分型胃癌患者间的EBV感染阳性率比较存在明显差异, 其中Lauren分型混合型胃癌患者EBV感染阳性率高于肠型、弥漫型、未分型患者. 这与吴景等研究结果基本一致[14]. 由此可见, EBV感染与胃癌Lauren分型密切相关, 这可能与EBV易感染管状腺体组织有关, 混合型胃癌病例多数为管状腺癌, 易发生EBV感染. 近年来, 以PD-1/PD-L1信号通路为靶点的免疫检查点抑制剂成为癌症领域的研究热点. 本研究还发现, PD-1阳性胃癌患者EBV感染阳性率高于PD-1阴性患者, PD-L1阳性胃癌患者EBV感染阳性率高于PD-L1阴性患者. 由此可见, EBV感染能激活胃癌患者的PD-1/PD-L1信号通路, 参与胃癌的发生发展. 原因考虑为EBV感染可以通过复杂的机制上调PD-L1, 介导肿瘤免疫逃逸, 促进肿瘤增殖, 导致肿瘤发生和进展[15]. 国内相关研究显示, EBV感染阳性胃癌组织中PD-1、PD-L1阳性率明显增高[16]. 国外也有报道指出EBV感染阳性的肿瘤组织PD-1/PD-L1信号通路活性增强[17]. 与本研究结果一致. 此外, 多数研究显示[18-20], EBV感染阳性胃癌的淋巴结转移率较低. 本研究116例淋巴结转移患者中仅有8例EBV感染阳性, 与以上文献报道相符.
本研究结果显示年龄、TNM分期Ⅲ-Ⅳ期、浸润深度T3+T4、淋巴结转移、分化程度低分化均为胃癌预后不良的独立危险因素, 与既往研究结果基本一致[21-23]. 本研究还发现, PD-1阳性、PD-L1阳性、EBV感染阳性也是胃癌预后不良的独立危险因素. 这是因为EBV感染能促进PD-1/PD-L1信号通路表达, 导致PD-1、PD-L1的表达增加, 而PD-1、PD-L1表达上调能增强对免疫细胞的抑制作用, 导致肿瘤细胞增殖、免疫逃逸, 从而影响患者预后, 增加预后不良风险[24,25]. Soeratram等[26]研究显示, EBV感染状态是胃癌患者预后的独立相关因子. 支持本研究结果. 本研究创新性根据以上影响因素构建预测预后不良的列线图模型, 结果发现该模型预测胃癌患者预后不良的AUC高达0.924, 具有较高预测效能, 且预测预后不良的校准度良好, 有助于发现预后不良高危患者, 从而指导相关干预治疗措施的制定.
综上可知, 胃癌患者EBV感染阳性率较高, EBV感染能促进胃癌的发生发展, 且是胃癌预后不良的独立危险因素, 基于EBV感染等相关因素构建列线图模型, 可为临床预测胃癌患者预后转归方向提供可靠依据. 但本研究随访时间较短, EBV感染与胃癌患者远期预后的相关性尚未明确, 后期工作中需进一步研究.
胃癌是威胁人类生命健康的主要恶性肿瘤之一, 人类疱疹病毒(epstein-barr virus, EBV)是一种致癌病毒, 主要感染上皮细胞、B细胞, 与多种肿瘤的发生发展密切相关. 本研究尝试探究胃癌患者EBV感染情况及对预后的影响.
EBV感染人体后将其DNA整合到宿主体内, 然后在潜伏蛋白的作用下通过微小核糖核酸影响脱氧核糖核酸甲基化, 从而促进胃癌的发生.
研究胃癌患者EBV感染情况及对预后的影响.
根据影响因素构建预测预后不良的列线图模型, 分析列线图模型的预测价值.
该模型预测胃癌患者预后不良的曲线下面积为0.924(95%CI: 0.892-0.956), 具有较高预测效能, 且预测预后不良的校准度、临床效用良好.
胃癌患者具有较高EBV感染阳性率, EBV感染与Lauren分型、程序性死亡分子1/程序性死亡配体1信号通路有关, 且是胃癌预后不良的影响因素.
可为临床预测胃癌患者预后转归方向提供可靠依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Ajani JA, D'Amico TA, Bentrem DJ, Chao J, Cooke D, Corvera C, Das P, Enzinger PC, Enzler T, Fanta P, Farjah F, Gerdes H, Gibson MK, Hochwald S, Hofstetter WL, Ilson DH, Keswani RN, Kim S, Kleinberg LR, Klempner SJ, Lacy J, Ly QP, Matkowskyj KA, McNamara M, Mulcahy MF, Outlaw D, Park H, Perry KA, Pimiento J, Poultsides GA, Reznik S, Roses RE, Strong VE, Su S, Wang HL, Wiesner G, Willett CG, Yakoub D, Yoon H, McMillian N, Pluchino LA. Gastric Cancer, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2022;20:167-192. [PubMed] [DOI] |
| 2. | Thrift AP, El-Serag HB. Burden of Gastric Cancer. Clin Gastroenterol Hepatol. 2020;18:534-542. [PubMed] [DOI] |
| 3. | Sexton RE, Al Hallak MN, Diab M, Azmi AS. Gastric cancer: a comprehensive review of current and future treatment strategies. Cancer Metastasis Rev. 2020;39:1179-1203. [PubMed] [DOI] |
| 4. | Chakravorty S, Afzali B, Kazemian M. EBV-associated diseases: Current therapeutics and emerging technologies. Front Immunol. 2022;13:1059133. [PubMed] [DOI] |
| 5. | Damania B, Kenney SC, Raab-Traub N. Epstein-Barr virus: Biology and clinical disease. Cell. 2022;185:3652-3670. [PubMed] [DOI] |
| 6. | 李 华顺, 陈 红桃. 进展期胃癌的多层螺旋CT表现及其与EB病毒感染的关系. 中国CT和MRI杂志. 2021;19:160-163. [DOI] |
| 7. | Saito M, Kono K. Landscape of EBV-positive gastric cancer. Gastric Cancer. 2021;24:983-989. [PubMed] [DOI] |
| 8. | Sun K, Jia K, Lv H, Wang SQ, Wu Y, Lei H, Chen X. EBV-Positive Gastric Cancer: Current Knowledge and Future Perspectives. Front Oncol. 2020;10:583463. [PubMed] [DOI] |
| 9. | 国家卫生健康委员会. 胃癌诊疗规范(2018年版). 中华消化病与影像杂志(电子版). 2019;9:118-144. [DOI] |
| 10. | Benakli Y, Khenchouche A, Rabea S, Mansour AA, Salem-Bekhit MM, Taha EI, Salem MM, Singh S, Ould Ouali K, Benguerba Y, Houali K. Characterizing EBV-associated Gastric Carcinoma (EBVaGC): A deep dive into LMP1 expression patterns. Cell Mol Biol (Noisy-le-grand). 2023;69:217-224. [PubMed] [DOI] |
| 11. | Stanland LJ, Luftig MA. The Role of EBV-Induced Hypermethy-lation in Gastric Cancer Tumorigenesis. Viruses. 2020;12. [PubMed] [DOI] |
| 12. | Yang J, Liu Z, Zeng B, Hu G, Gan R. Epstein-Barr virus-associated gastric cancer: A distinct subtype. Cancer Lett. 2020;495:191-199. [PubMed] [DOI] |
| 13. | Iizasa H, Kartika AV, Fekadu S, Okada S, Onomura D, Wadi AFAA, Khatun MM, Moe TM, Nishikawa J, Yoshiyama H. Development of Epstein-Barr virus-associated gastric cancer: Infection, inflammation, and oncogenesis. World J Gastroenterol. 2022;28:6249-6257. [PubMed] [DOI] |
| 15. | Li X, Zhang W. Expression of PD-L1 in EBV-associated malignancies. Int Immunopharmacol. 2021;95:107553. [PubMed] [DOI] |
| 17. | Takahara T, Satou A, Ishikawa E, Kohno K, Kato S, Suzuki Y, Takahashi E, Ohashi A, Asano N, Tsuzuki T, Nakamura S. Clinicopathological analysis of neoplastic PD-L1-positive EBV(+) diffuse large B cell lymphoma, not otherwise specified, in a Japanese cohort. Virchows Arch. 2021;478:541-552. [PubMed] [DOI] |
| 18. | 彭 潇, 申 璐璐, 杨 宣琴, 吴 月琴, 耿 小鑫, 李 佳芠, 步 鹏, 昝 丽坤. EB病毒相关性胃癌的特征及免疫治疗的研究进展. 国际消化病杂志. 2023;43:69-72, 91. [DOI] |
| 19. | Osumi H, Kawachi H, Yoshio T, Fujisaki J. Clinical impact of Epstein-Barr virus status on the incidence of lymph node metastasis in early gastric cancer. Dig Endosc. 2020;32:316-322. [PubMed] [DOI] |
| 20. | Tsuji Y, Ushiku T, Shinozaki T, Yamashita H, Seto Y, Fukayama M, Fujishiro M, Oda I, Katai H, Taniguchi H, Hasatani K, Kaizaki Y, Oga A, Nishikawa J, Akasaka R, Endo M, Sugai T, Matsumoto T, Koike K. Risk for lymph node metastasis in Epstein-Barr virus-associated gastric carcinoma with submucosal invasion. Dig Endosc. 2021;33:592-597. [PubMed] [DOI] |
| 24. | 黄 小敏, 赵 旭辉, 达 德转, 马 桃梅, 李 红玲. EB病毒感染和程序性死亡受体配体1表达在晚期胃癌免疫靶向治疗中的研究进展. 临床荟萃. 2023;38:1048-1052. [DOI] |
| 25. | 王 涛, 张 伟, 杜 书祥, 晋 新峰, 张 雪涛, 吴 刚, 孙 培春. 胃癌中EB病毒与PD-L1表达的关系及临床病理意义. 中国肿瘤外科杂志. 2022;14:451-455. [DOI] |
| 26. | Soeratram TTD, Biesma HD, Egthuijsen JMP, Meershoek-Klein Kranenbarg E, Hartgrink HH, van de Velde CJH, Mookhoek A, van Dijk E, Kim Y, Ylstra B, van Laarhoven HWM, van Grieken NCT. Prognostic Value of T-Cell Density in the Tumor Center and Outer Margins in Gastric Cancer. Mod Pathol. 2023;36:100218. [PubMed] [DOI] |