修回日期: 2024-04-30
接受日期: 2024-05-28
在线出版日期: 2024-06-28
老年患者身体机能、抵抗能力较差, 术后极易发生感染, 且随着药细菌不断增多, 耐药菌感染发生率较高, 经验性用药已不能适应耐药菌的变化. 基于此, 本研究全面系统分析老年胃癌根治术后并发耐药菌感染情况.
分析老年胃癌根治术后并发耐药菌感染的影响因素及耐药菌分布特点, 为胃癌根治术后有效防治感染提供参考依据.
选取2019-04/2022-09我院收治的359例老年胃癌根治术患者, 其中46例术后发生感染, 包含耐药菌感染21例(耐药菌组)、非耐药菌感染25例(非耐药菌组)及未感染患者313例(对照组), 对老年胃癌根治术后并发耐药菌感染进行单因素与多因素Logistic回归分析, 采用R语言绘制预测并发耐药菌感染的列线图, 采用受试者工作特征曲线(receiver operating characteristic, ROC)评价列线图模型的预测效能, 采用决策分析曲线评价列线图的临床效用.
感染部位以肺部(42.86%)为主, 病原菌类型以革兰阴性菌为主, 常见病原菌类型有鲍曼不动杆菌(28.57%)、铜绿假单胞菌(23.81%)等; 耐药菌组年龄、糖尿病、术后机械通气、术后留置尿管>3 d、重症加强护理病房(intensive care unit, ICU)住院时间高于非耐药组、对照组, 白蛋白、辅助性T淋巴细胞CD4+/记忆性T细胞CD8+低于非耐药组、对照组(P<0.05); Logistic回归分析显示, 年龄、糖尿病、术后机械通气、术后留置尿管>3 d、ICU住院时间是发生耐药菌感染的相关独立危险因素, 白蛋白、CD4+/CD8+是发生耐药菌感染的相关保护因素(P<0.05); ROC分析发现, 所构建的列线图预测模型ROC曲线下面积为0.980(95%CI: 0.857-0.994), 校正曲线与理想曲线拟合良好.
老年胃癌根治术后并发耐药菌感染部位以肺部为主, 病原菌类型以革兰阴性菌为主, 年龄、糖尿病、术后机械通气、术后留置尿管、白蛋白、ICU住院时间、CD4+/CD8+是耐药菌感染的影响因素, 临床可据此制定针对性防护措施, 以进一步改善预后.
核心提要: 年龄、糖尿病、术后机械通气、术后留置尿管、白蛋白、重症加强护理病房住院时间、辅助性T淋巴细胞CD4+/记忆性T细胞CD8+是老年胃癌根治术后并发耐药菌感染的影响因素.
引文著录: 金晓姣, 徐磊, 王玉莹. 老年胃癌根治术后并发耐药菌感染的影响因素及耐药菌分布特点研究. 世界华人消化杂志 2024; 32(6): 430-437
Revised: April 30, 2024
Accepted: May 28, 2024
Published online: June 28, 2024
Elderly patients have poor physical function and resistance, and are prone to infection after surgery. With the increasing number of drug-resistant bacteria, the incidence of drug-resistant bacterial infection is high, and empirical medication cannot adapt to the changes in drug-resistant bacteria. This study comprehensively and systematically analyzed the incidence of drug-resistant bacterial infection after radical resection of gastric cancer in elderly patients.
To analyze the influencing factors of drug-resistant bacteria infections and distribution characteristics of pathogens in elderly people after radical gastric cancer surgery.
A total of 359 elderly patients admitted to our hospital for radical gastric cancer surgery from April 2019 to September 2022 were selected, among which 46 had postoperative infections, including 21 cases of drug-resistant bacterial infections (drug-resistant bacterial group) and 25 cases of non-drug-resistant bacterial infections (non-drug-resistant bacterial group), and 313 had no infection (control group). Univariate and multivariate Logistic regression analyses were performed to identify the factors influencing drug-resistant bacterial infections, and based on the influencing factors identified, R was used to draw a nomogram for predicting concurrent drug-resistant bacterial infections. Receiver operating characteristic (ROC) curve analysis was performed to evaluate the predictive efficacy of the nomogram model, and decision curve analysis was used to evaluate the clinical utility of the nomogram.
Infection occurred mainly in the lung (42.86%), and pathogens were mainly Gram-negative bacteria, with Acinetobacter baumannii (28.57%) and Pseudomonas aeruginosa (23.81%) being the predominant bacteria. Age, diabetes, postoperative mechanical ventilation, postoperative indwelling catheter > 3 d, and length of stay in intensive care unit (ICU) in the drug-resistant bacteria group were significantly higher than those of the non-drug-resistant group and the control group, while albumin and CD4+/CD8+ ratio were significantly lower than those of the non-drug-resistant group and the control group (P < 0.05). Logistic regression analysis showed that age, diabetes, postoperative mechanical ventilation, postoperative indwelling urinary catheter > 3 d, and ICU length of stay were independent risk factors associated with the development of drug-resistant bacterial infections, and albumin and CD4+/CD8+ ratio were protective factors (P < 0.05). ROC curve analysis demonstrated that the area under the ROC curve of the nomogram model was 0.980 (95% confidence interval: 0.857-0.994), and the calibration curve fitted well with the ideal curve.
Drug-resistant bacterial infections occur mainly in the lung of elderly patients after radical surgery for gastric cancer, and pathogens are mainly Gram-negative bacteria. Age, diabetes, postoperative mechanical ventilation, postoperative indwelling urinary catheter, albumin, length of ICU stay, and CD4+/CD8+ ratio are the influencing factors of drug-resistant bacterial infections, and clinicians should formulate targeted protective measures based on these factors to further improve the prognosis of such patients.
- Citation: Jin XJ, Xu L, Wang YY. Drug-resistant bacterial infection after radical resection of gastric cancer in elderly patients: Influencing factors and distribution characteristics of pathogens. Shijie Huaren Xiaohua Zazhi 2024; 32(6): 430-437
- URL: https://www.wjgnet.com/1009-3079/full/v32/i6/430.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i6.430
胃癌是临床常见恶性肿瘤, 发病率、病死率较高[1,2]. 胃癌根治术是其主要治疗手段, 但由于老年患者身体机能、抵抗能力较差, 术后极易发生感染, 影响疾病预后[3,4]. 且近年来, 随着大量广谱抗菌药物的广泛应用, 耐药细菌不断增多, 耐药菌感染发生率较高, 经验性用药已不能适应耐药菌的变化[5,6]. 因此, 临床应及时开展术后耐药菌感染的相关研究, 以掌握耐药菌分布特点及耐药菌感染的影响因素, 为临床防治老年胃癌根治术后并发耐药菌感染提供参考. 但目前临床关于老年胃癌根治术后感染的研究多集中于肺部感染、术后切口感染等单一感染部位的研究, 未进行整体分析探讨. 基于此, 本研究选取我院收治的359例老年胃癌根治术患者, 通过全面系统分析老年胃癌根治术后并发耐药菌感染情况, 为临床防治胃癌根治术后感染提供参考依据.
本研究经我院伦理委员会审核批准, 选取2019-04/2022-09我院收治的359例老年胃癌根治术患者, 其中46例术后发生感染, 包含耐药菌感染21例(耐药菌组)、非耐药菌感染25例(非耐药菌组)及未感染患者313例(对照组). 纳入标准: 均符合胃癌相关诊断标准[7]; 均经病理检查、CT检查等确诊为胃癌; 均符合胃癌根治术指征, 并自愿接受胃癌根治术; 年龄>60岁; 认知功能正常, 可配合调查研究; 美国麻醉医师协会(American Society of Anesthesiologists, ASA)分级为Ⅰ-Ⅱ级; 临床资料完整; 患者及家属均签署知情同意书; 排除标准: 合并其它恶性肿瘤; 精神病史; 凝血功能障碍; 肝、肾、心功能不全; 免疫系统疾病.
(1)收集内容: 以院内自制一般资料调查问卷收集患者年龄、性别、体质量指数、T分期、N分期、手术方式、ASA分级、合并疾病、术后是否机械通气、术后留置尿管时间、是否预防性使用抗菌药物、白细胞计数、血小板、血红蛋白、C反应蛋白、白蛋白、手术时间、重症加强护理病房(intensive care unit, ICU)住院时间、总住院时间、术中出血量、成熟T淋巴细胞CD3+、辅助性T淋巴细胞CD4+、CD4+/记忆性T淋巴细胞CD8+、免疫球蛋白A(immunoglobulin A, IgA)、免疫球蛋白M(immunoglobulin M, IgM)、免疫球蛋白G(immunoglobulin G, IgG)等一般资料及术后并发耐药菌感染者的感染部位、病原菌类型; (2)检测方法: ①于术后抽取患者清晨空腹静脉血3 mL, 常规分离取血清, 以全自动生化分析仪(上海始恒仪器设备有限公司, 仪器型号: PUZS-300X)测定白蛋白, 以免疫比浊法测定IgA、IgM、IgG、C反应蛋白. IgA、IgM、IgG检测试剂盒由上海酶联生物科技有限公司提供, C反应蛋白检测试剂盒由上海研启生物科技有限公司提供. ②于术后抽取患者清晨空腹静脉血3 mL, 以凝血分析仪(济南爱来宝仪器设备有限公司, 仪器型号: TSA8000)测定血小板, 以血细胞分析仪(山东欧莱博医疗器械有限公司, 仪器型号: HF-3800)测定血红蛋白、白细胞计数, 以流式细胞仪(上海士森视觉科技有限公司, 仪器型号: BD AccuriC6 Plus)测定CD3+、CD4+、CD4+/CD8+.
耐药菌是指具有耐药性的病原菌. 耐药菌感染患者均符合中华人民共和国卫生部2001年制定的《医院感染诊断标准(试行)》[8], 收集发生医院感染的患者病原菌标本做培养+药敏试验, 药敏结果按美国临床实验室标准化协会(CLSI)标准[9]进行判定. 检测的抗菌药物包括: 阿米卡星、头孢西丁、环丙沙星、头孢他啶、头孢唑林、复方磺胺甲恶唑、磷霉素、美罗培南、头孢哌酮、左氧氟沙星.
统计学处理 采用SPSS 22.0对数据进行分析, 计量资料以(mean±SD)表示, t检验, 多组比较采用单因素方差分析, 计数资料以n(%)表示, χ2检验, 若理论频数<1, Fisher's精确检验, 理论频数≥1且≤5, 用校正检验, 等级资料采用ridit检验, 采用多因素Logistic回归分析耐药菌感染的影响因素, 采用受试者工作特征曲线(receiver operating characteristic, ROC)评价列线图模型的预测效能, 采用决策分析曲线(decision curve analysis, DCA)评价列线图的临床效用, P<0.05表示差异有统计学意义.
359例老年胃癌根治术患者, 术后46例(12.81%)发生感染, 包含耐药菌感染21例(5.85%)、非耐药菌感染25例(6.96%)及未感染患者313例(87.19%); 耐药菌与非耐药均感染部位以肺部(42.86%、60.00%)为主, 病原菌类型均以革兰阴性菌为主, 常见耐药病原菌类型有鲍曼不动杆菌(28.57%)、铜绿假单胞菌(23.81%)等. 见表1.
耐药菌组年龄、糖尿病、术后机械通气、术后留置尿管>3 d、ICU住院时间高于非耐药组、对照组, 白蛋白、CD4+/CD8+低于非耐药组、对照组(P<0.05); 非耐药组年龄、糖尿病、术后机械通气、术后留置尿管>3 d、ICU住院时间高于对照组, 白蛋白、CD4+/CD8+低于对照组(P<0.05). 见表2.
| 资料 | 耐药菌组(n = 21) | 非耐药菌组(n = 25) | 对照组(n = 313) | F/χ2/u | P |
| 年龄(岁) | 68.42±7.37 | 65.00±8.29a | 61.35±7.61ab | 10.461 | <0.001 |
| 性别(男/女) | 13/8 | 11/14 | 162/151 | 1.468 | 0.480 |
| 体质量指数(kg/m2) | 23.20±0.79 | 23.30±0.82 | 23.41±0.86 | 0.745 | 0.475 |
| T分期 | 0.659 | 0.883 | |||
| T1 | 3(14.29) | 5(20.00) | 48(15.34) | ||
| T2 | 13(61.90) | 16(64.00) | 193(61.67) | ||
| T3 | 5(23.81) | 4(16.00) | 72(23.00) | ||
| N分期 | 0.659 | 0.883 | |||
| N0 | 6(28.57) | 8(32.00) | 91(29.07) | ||
| N1 | 12(57.14) | 15(60.00) | 181(57.83) | ||
| N2 | 3(14.29) | 2(8.00) | 41(13.10) | ||
| 手术方式 | 4.327 | 0.115 | |||
| 腹腔镜 | 13(61.90) | 21(84.00) | 199(63.58) | ||
| 开腹 | 8(38.10) | 4(16.00) | 114(36.42) | ||
| ASA分级 | 4.327 | 0.115 | |||
| Ⅰ | 11(52.38) | 18(72.00) | 170(54.31) | ||
| Ⅱ | 10(47.62) | 7(28.00) | 143(45.69) | ||
| 合并疾病 | |||||
| 糖尿病 | 18(85.71) | 13(52.00)a | 91(29.07)ab | 32.030 | <0.001 |
| 心脏病 | 4(19.05) | 5(20.00) | 56(17.89) | 0.083 | 0.960 |
| 高血压 | 5(23.81) | 7(28.00) | 79(25.24) | 0.121 | 0.941 |
| 术后机械通气 | 15.567 | <0.001 | |||
| 否 | 9(42.86) | 21(84.00) | 248(79.23) | ||
| 是 | 12(57.14) | 4(16.00)a | 65(20.77)ab | ||
| 术后留置尿管 | 16.957 | <0.001 | |||
| ≤3 d | 5(23.81) | 19(76.00) | 207(66.13) | ||
| >3 d | 16(76.19) | 6(24.00)a | 106(33.87)ab | ||
| 预防性使用抗菌药物 | 0.038 | 0.981 | |||
| 否 | 13(61.90) | 15(60.00) | 187(59.74) | ||
| 是 | 8(38.10) | 10(40.00) | 126(40.26) | ||
| 感染部位 | 2.126 | 0.547 | |||
| 腹腔 | 4(19.05) | 2(8.00) | / | ||
| 肺部 | 9(42.86) | 15(60.00) | / | ||
| 切口 | 5(23.81) | 6(24.00) | / | ||
| 尿路 | 3(14.29) | 2(8.00) | / | ||
| 白细胞计数 | 5.23±0.86 | 5.34±0.91 | 5.28±0.89 | 0.090 | 0.914 |
| 血小板(×109/L) | 169.74±41.59 | 172.33±38.85 | 170.25±44.90 | 0.028 | 0.973 |
| 血红蛋白(g/L) | 104.25±13.08 | 105.98±14.73 | 107.00±15.26 | 0.362 | 0.696 |
| C反应蛋白(mg/L) | 4.28±1.30 | 4.40±1.25 | 4.35±1.27 | 0.051 | 0.950 |
| 白蛋白(g/L) | 35.16±3.24 | 38.76±3.05a | 42.78±3.33ab | 65.582 | <0.001 |
| 手术时间(min) | 192.34±30.66 | 189.78±35.16 | 186.94±33.82 | 0.316 | 0.729 |
| ICU住院时间(d) | 5.26±1.53 | 3.91±1.22a | 2.84±0.90ab | 71.594 | <0.001 |
| 总住院时间(d) | 23.64±5.00 | 23.38±5.46 | 22.90±5.25 | 0.275 | 0.760 |
| 术中出血量(mL) | 215.28±36.77 | 208.99±33.82 | 212.76±35.68 | 0.191 | 0.826 |
| CD3+(%) | 40.86±3.93 | 41.03±3.78 | 40.97±3.85 | 0.012 | 0.989 |
| CD4+(%) | 35.86±3.79 | 36.13±4.09 | 36.06±3.91 | 0.031 | 0.970 |
| CD4+/CD8+ | 0.70±0.13 | 0.85±0.14a | 1.06±0.16ab | 68.139 | <0.001 |
| IgA(g/L) | 1.96±0.54 | 2.03±0.52 | 2.12±0.64 | 0.829 | 0.437 |
| IgM(g/L) | 1.28±0.36 | 1.34±0.40 | 1.38±0.39 | 0.737 | 0.479 |
| IgG(g/L) | 10.20±2.48 | 10.45±2.27 | 10.63±2.18 | 0.431 | 0.651 |
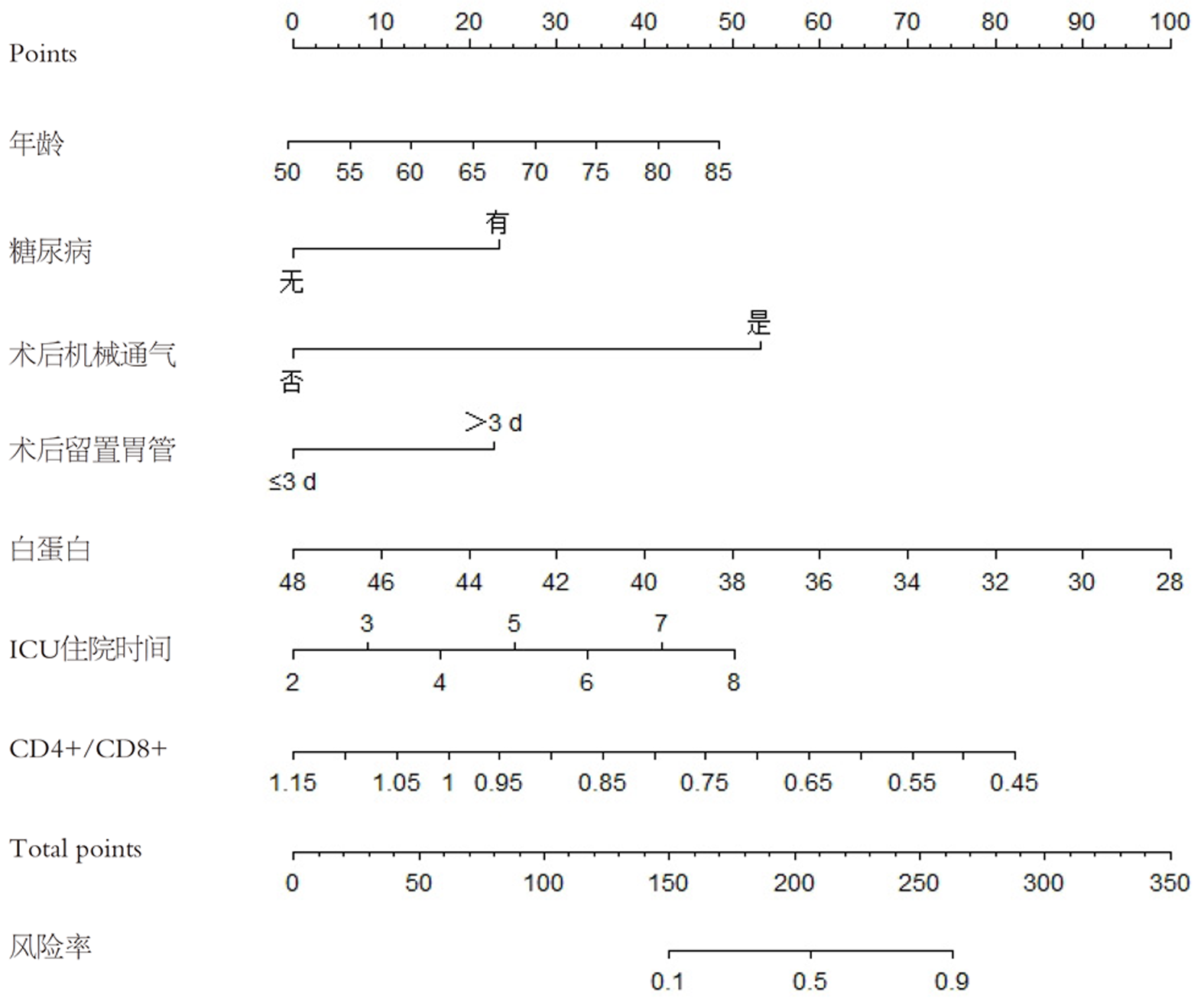
以耐药菌感染情况为因变量, 纳入年龄(按实际值赋值)、糖尿病(无 = 0, 有 = 1)、术后机械通气(否 = 0, 是 = 1)、术后留置尿管(≤3 d = 1, >3 d = 2)、白蛋白(按实际值赋值)、ICU住院时间(按实际值赋值)、CD4+/CD8+(按实际值赋值)作为自变量进行Logistic回归分析显示, 年龄、糖尿病、术后机械通气、术后留置尿管>3 d、ICU住院时间是发生耐药菌感染的相关独立危险因素, 白蛋白、CD4+/CD8+是发生耐药菌感染的相关保护因素(P<0.05). 见表3.
| 影响因素 | β | SE | Wald χ2 | OR | 95%CI | P |
| 年龄 | 2.058 | 0.715 | 8.289 | 7.834 | 1.026-59.816 | 0.014 |
| 糖尿病 | 2.725 | 0.736 | 13.712 | 15.263 | 3.108-74.952 | <0.001 |
| 术后机械通气 | 2.700 | 0.802 | 11.333 | 14.878 | 2.573-86.034 | <0.001 |
| 术后留置尿管>3 d | 2.802 | 0.825 | 11.531 | 16.470 | 2.850-95.174 | <0.001 |
| 白蛋白 | -0.551 | 0.154 | 12.799 | 0.576 | 0.349-0.952 | <0.001 |
| ICU住院时间 | 2.576 | 0.788 | 10.689 | 13.148 | 1.667-103.695 | <0.001 |
| CD4+/CD8+ | -0.909 | 0.266 | 11.676 | 0.403 | 0.194-0.837 | <0.001 |
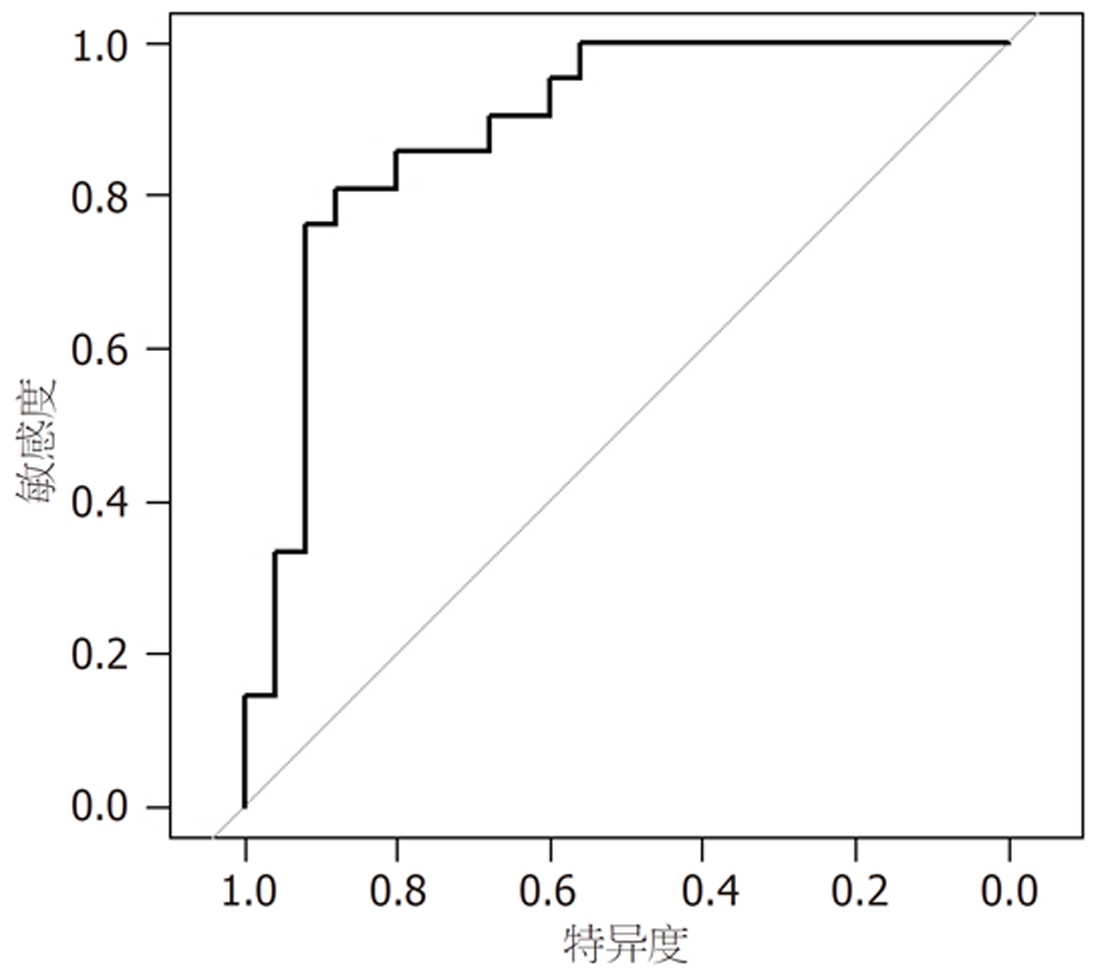
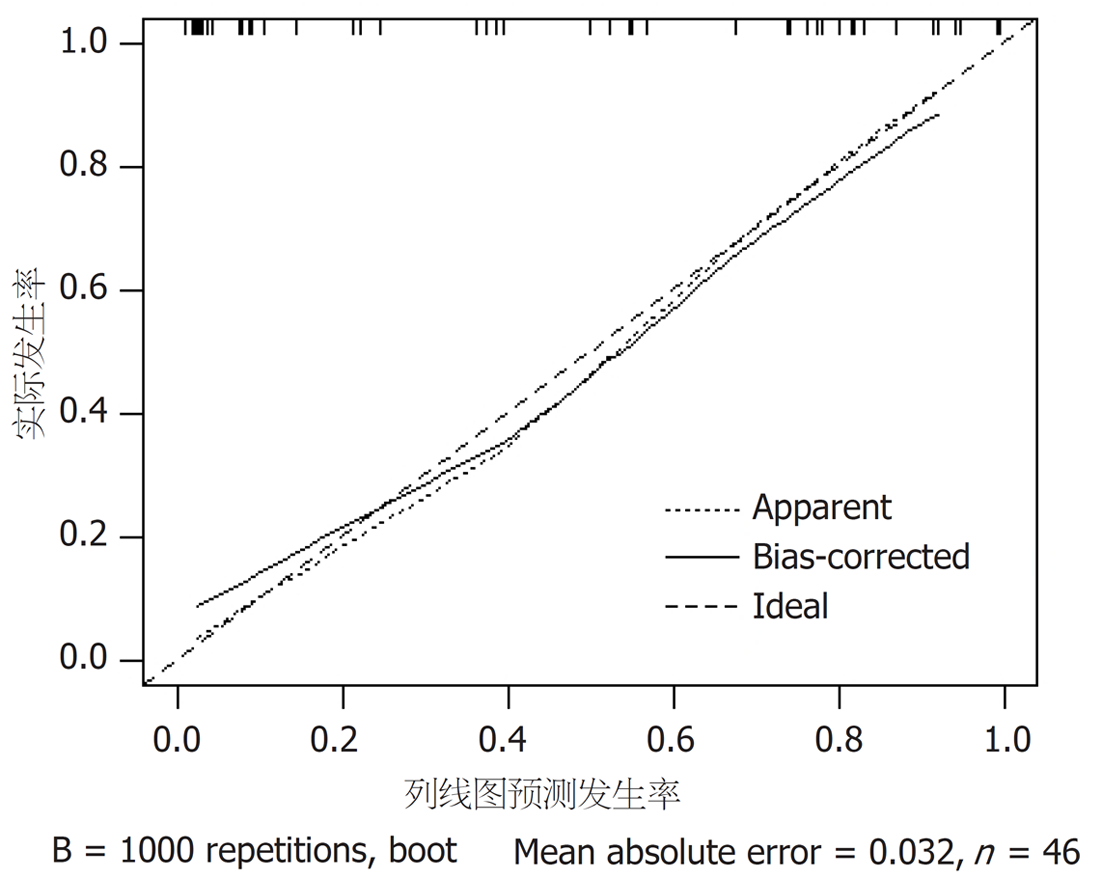
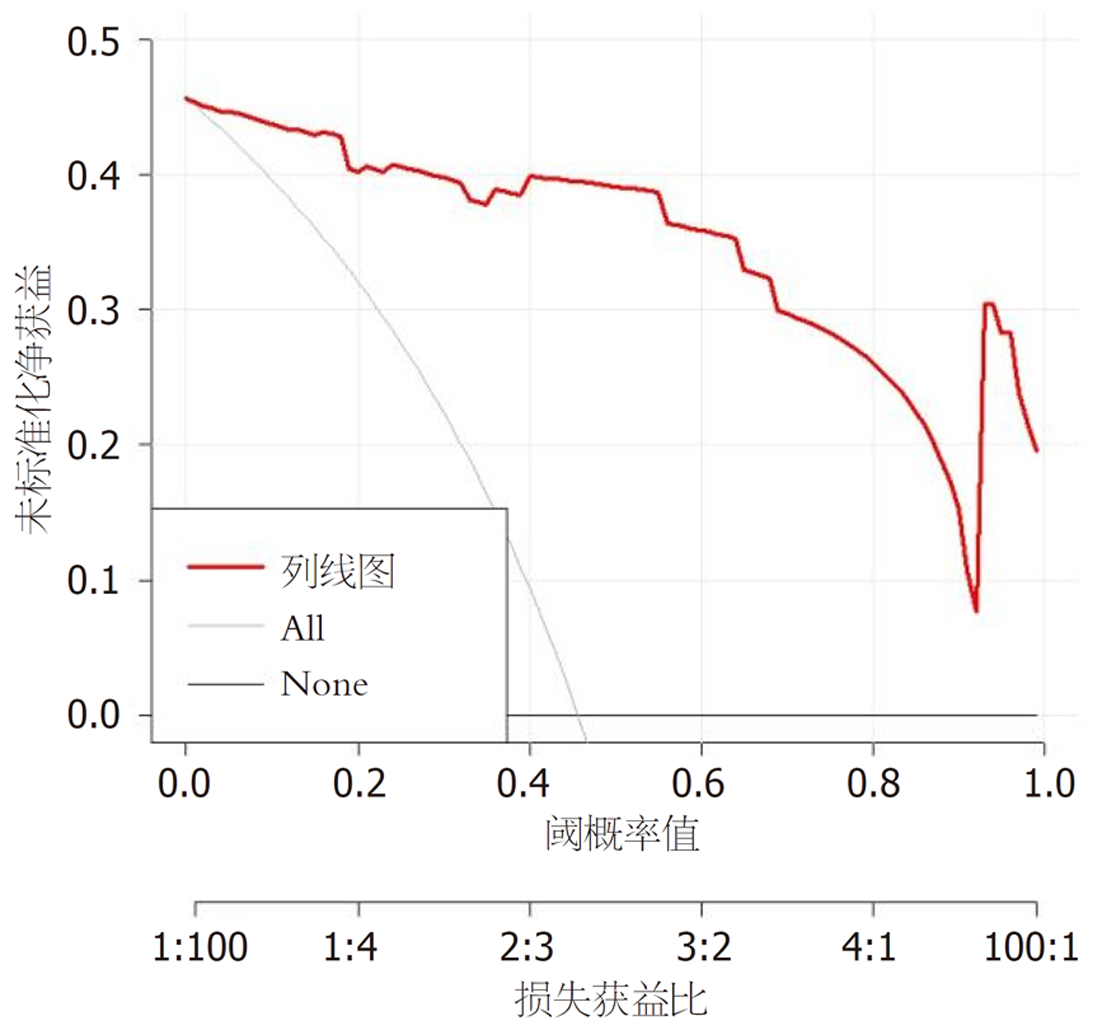
基于Logistic回归分析筛选出的各相关因素, 绘制预测耐药菌感染的列线图模型, 见图1; 列线图的模型验证: (1)区分度: 该模型的预测风险能力指数(concordance index, C-index)为0.980, 具有良好的区分度; ROC分析发现, 所构建的列线图预测模型ROC曲线下面积(area under the ROC curve, AUC)为0.980(95%CI: 0.857-0.994), 校正曲线与理想曲线拟合良好. 见图2; (2)校准度: 列线图模型预测耐药菌感染与实际观测结果有较好的一致性. 见图3; (3)临床应用: 绘制DCA决策曲线评价模型的临床效用, 结果显示, 列线图模型具有明显的正向净收益. 见图4.
本研究结果显示, 359例老年胃癌根治术患者中46例(12.81%)术后发生感染, 包含耐药菌感染21例, 可见老年胃癌根治术后感染风险较高, 且耐药菌感染较为严重, 推测原因为: 胃癌患者受手术创伤、放化疗等因素影响抵抗力下降, 因此, 术后感染发生率较高[10-12]. 故临床应及时探讨老年胃癌根治术后并发耐药菌感染的影响因素, 以制定相应临床策略, 有效改善预后. 此外, 本研究首次对胃癌根治术后感染部位进行调查分析, 结果显示, 在耐药菌感染患者中, 感染部位以肺部(42.86%)为主, 分析其原因, 可能在于: 胃癌患者术后需长期卧床, 容易导致呼吸功能下降, 排痰功能紊乱, 从而造成肺部痰液淤积, 引发肺部感染[13-16]. 其次感染部位依次为切口、腹腔、尿路, 因此, 对于胃癌术后患者临床应加强呼吸道管理, 指导患者正确排痰, 鼓励患者下床活动, 还应加强尿路、切口等护理, 从而有效预防术后感染. 此外, 既往研究指出, 引发ICU感染的致病菌中超过一半是革兰阴性球菌[17]. 本研究结果也显示耐药菌感染的病原菌类型以革兰阴性菌为主, 其中常见病原菌类型有鲍曼不动杆菌(28.57%)、铜绿假单胞菌(23.81%), 可能在于鲍曼不动杆菌在医院广泛分布, 极易获得, 且其存活时间长, 侵入人体后可阻断抗菌药物发挥效用, 造成耐药菌感染; 铜绿假单胞菌也是院内感染的重要病原菌, 可对多种常规抗菌药物产生耐药性[18]. 因此, 临床应及时对感染患者感染分泌物进行细菌培养, 明确细菌分布, 选择对应抗菌药物, 制定有效的预防和控制措施, 促进患者病情改善.
本研究结果显示, 年龄、糖尿病、术后机械通气、术后留置尿管>3 d、ICU住院时间是发生耐药菌感染的相关独立危险因素, 白蛋白、CD4+/CD8+是发生耐药菌感染的相关保护因素(P<0.05), 分析如下: (1)本研究结果显示, 年龄越大, 耐药菌感染风险越高, 与罗秋平等[19]研究结果一致, 分析为: 年龄高的患者基础疾病较多, 新陈代谢较慢, 免疫能力较低, 因此, 术后感染风险较高; (2)本研究结果显示, 合并糖尿病的患者耐药菌感染发生率是没有合并糖尿病患者的15倍之高, 可能在于: 王肖婷等[20]学者在其研究中指出, 糖尿病患者由于糖代谢异常, 蛋白质合成能力较低, 免疫功能紊乱, 极易引发耐药菌感染. 此外, 高血糖环境是病原菌良好的培养基, 易促进病原菌生长繁殖, 从而进一步增加了术后感染风险. 故患者住院后应及时采取相应措施控制患者血糖水平, 以有效预防术后耐药菌感染; (3)研究显示, 机械通气时间、留置导管时间是引发多药耐药菌感染的影响因素, 与本研究结果一致[21]. 推测为: 呼吸道正常的防御机制可使气管隆凹以下维持无菌状态, 术后机械通气等侵入性操作易破坏气管黏膜完整性, 当呼吸道受到损伤后, 全身免疫功能下降, 病原微生物便易侵入呼吸道, 引发一系列病原菌感染[22]. 因此, 患者住院期间应尽量减少不必要的操作, 缩短各类导管留置时间, 降低耐药菌感染发生风险; (4)ICU住院时间越长, 患者被周围环境污染及被人为携带的病原菌侵袭的风险越高, 因此, 更易发生术后耐药菌感染; (5)白蛋白主要反映患者营养状态, 白蛋白较低说明患者营养状态较差, CD4+/CD8+可表达机体免疫功能状态, 当其比值<1时, 提示机体免疫系统出现异常, 长期营养不良、免疫系统异常均会降低机体抵抗力, 增加术后耐药菌感染风险[23]. 故术后应定期评估患者营养状态, 及时给予早期营养干预, 纠正患者营养状态, 增强机体免疫力. 此外, 本研究结果还显示, 所构建的列线图预测模型AUC为0.980(95%CI: 0.857-0.994), 表明列线图模型具有较好的预测效能及临床效用.
综上所述, 老年胃癌根治术后并发耐药菌感染部位以肺部为主, 病原菌类型以革兰阴性菌为主, 年龄、糖尿病、术后机械通气、术后留置尿管>3 d、ICU住院时间是发生耐药菌感染的相关独立危险因素, 白蛋白、CD4+/CD8+是发生耐药菌感染的相关保护因素, 临床可加强早期感染分泌物的培养, 并对易感人群做好防控工作, 以有效降低术后耐药菌感染发生风险.
胃癌根治术后的部分患者由于相关原因, 会发生细菌感染, 尤其是近年来部分地区抗菌药物使用的不规范不科学, 导致患者术后耐药细菌发生率较高, 对患者术后康复的疗效影响较大.
影响耐药菌感染的因素较多, 了解胃癌根治术后耐药菌感染的因素有助于患者在术后的预防, 同时了解耐药菌的分布特点, 有助于感染后的治疗, 为临床预防和治疗提供方案借鉴.
全方位、多部位对临床关于老年胃癌根治术后感染的分布情况进行分析, 同时探讨耐药菌发病的影响因素, 为临床防治胃癌根治术后感染提供参考依据.
本研究通过对患者的一般资料和相关临床检测指标进行观察与统计学分析, 寻找与耐药菌感染相关的因素, 了解致病菌的分布和种类.
以肺部感染部位为主, 耐药病原菌有鲍曼不动杆菌和铜绿假单胞菌. 年龄、糖尿病、术后机械通气、术后留置尿管>3 d、ICU住院时间是发生耐药菌感染的相关独立危险因素, 白蛋白、CD4+/CD8+是发生耐药菌感染的相关保护因素.
结合老年胃癌根治术患者术后发生耐药菌感染的高危因素, 加强肺部的检查, 并对易感人群做好防控工作,对降低患者的耐药菌发病率, 提高患者康复质量具有重要的临床意义.
本研究为老年胃癌根治术患者术后防治耐药菌感染提供了有借鉴意义的信息, 但是耐药菌感染人数相对较少, 更多的患者例数可能对因素的统计分析会更有意义, 后续会继续搜集更多耐药菌患者, 提供更有统计学意义的分析结果.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Machlowska J, Baj J, Sitarz M, Maciejewski R, Sitarz R. Gastric Cancer: Epidemiology, Risk Factors, Classification, Genomic Characteristics and Treatment Strategies. Int J Mol Sci. 2020;21. [PubMed] [DOI] |
| 2. | Sexton RE, Al Hallak MN, Diab M, Azmi AS. Gastric cancer: a comprehensive review of current and future treatment strategies. Cancer Metastasis Rev. 2020;39:1179-1203. [PubMed] [DOI] |
| 4. | Zhou Y, Tian Z, Zeng J, Zhou W, Wu K, Shen W. Effect of neoadjuvant treatment combined with radical gastrectomy on postoperative complications and prognosis of gastric cancer patients. Scand J Gastroenterol. 2021;56:1343-1348. [PubMed] [DOI] |
| 5. | Jernigan JA, Hatfield KM, Wolford H, Nelson RE, Olubajo B, Reddy SC, McCarthy N, Paul P, McDonald LC, Kallen A, Fiore A, Craig M, Baggs J. Multidrug-Resistant Bacterial Infections in U.S. Hospitalized Patients, 2012-2017. N Engl J Med. 2020;382:1309-1319. [PubMed] [DOI] |
| 6. | Nordmann P, Poirel L. Epidemiology and Diagnostics of Carbapenem Resistance in Gram-negative Bacteria. Clin Infect Dis. 2019;69:S521-S528. [PubMed] [DOI] |
| 7. | Wang FH, Shen L, Li J, Zhou ZW, Liang H, Zhang XT, Tang L, Xin Y, Jin J, Zhang YJ, Yuan XL, Liu TS, Li GX, Wu Q, Xu HM, Ji JF, Li YF, Wang X, Yu S, Liu H, Guan WL, Xu RH. The Chinese Society of Clinical Oncology (CSCO): clinical guidelines for the diagnosis and treatment of gastric cancer. Cancer Commun (Lond). 2019;39:10. [PubMed] [DOI] |
| 10. | Bai D, Xiang W, Chen XZ, Hu JK. [Risk factors of postoperative pulmonary infection of gastric cancer and perioperative intervention measures]. Zhonghua Wei Chang Wai Ke Za Zhi. 2021;24:185-190. [PubMed] [DOI] |
| 11. | Meng Y, Zhao P, Yong R. Modified Frailty Index Independently Predicts Postoperative Pulmonary Infection in Elderly Patients Undergoing Radical Gastrectomy for Gastric Cancer. Cancer Manag Res. 2021;13:9117-9126. [PubMed] [DOI] |
| 12. | Nakamura N, Kaida D, Tomita Y, Miyata T, Miyashita T, Fujita H, Kinami S, Ueda N, Takamura H. Risk Factors for Overall Complications and Remote Infection After Gastrectomy in Elderly Gastric Cancer Patients. In Vivo. 2021;35:2917-2921. [PubMed] [DOI] |
| 16. | Liu J, Meng Z, Lv R, Zhang Y, Wang G, Xie J. Effect of intraoperative lung-protective mechanical ventilation on pulmonary oxygenation function and postoperative pulmonary complications after laparoscopic radical gastrectomy. Braz J Med Biol Res. 2019;52:e8523. [PubMed] [DOI] |
| 17. | 孟 冬梅, 田 立芝, 贺 靖东, 齐 玉娟, 李 培军, 刘 建实. 成人心脏外科术后ICU内医院感染的病原学及相关危险因素. 中华胸心血管外科杂志. 2019;35:334-338. [DOI] |
| 18. | Bao Q, Zhou H, Chen X, Yang Q, Zhou J. [Characteristics and Influencing Factors of Pathogenic Bacteria in Lung Cancer Chemotherapy Combined with Nosocomial Pulmonary Infection]. Zhongguo Fei Ai Za Zhi. 2019;22:772-778. [PubMed] [DOI] |
| 22. | Li ZJ, Zhang DF, Zhang WH. Analysis of Nosocomial Infection and Risk Factors in Patients with ECMO Treatment. Infect Drug Resist. 2021;14:2403-2410. [PubMed] [DOI] |
| 23. | Li K, Xu Y, Hu Y, Liu Y, Chen X, Zhou Y. Effect of Enteral Immunonutrition on Immune, Inflammatory Markers and Nutritional Status in Gastric Cancer Patients Undergoing Gastrectomy: A Randomized Double-Blinded Controlled Trial. J Invest Surg. 2020;33:950-959. [PubMed] [DOI] |