修回日期: 2024-03-08
接受日期: 2024-05-28
在线出版日期: 2024-06-28
肿瘤坏死因子超家族成员(TNF superfamily member, TNFSF)和肿瘤坏死因子受体超家族蛋白由多种分子组成, 对免疫系统的发育和功能起着关键作用. TNFSF15基因编码的肿瘤坏死因子样配体1(tumor necrosis factor-like ligand 1 aberrance, TL1A)是一种Ⅱ型跨膜蛋白, 有可溶性或膜结合两种存在形式, 通过结合其功能性受体-死亡受体3[(death receptor 3, DR3)或TNFFRSFf25]为下游信号通路提供刺激信号, 调节效应细胞的增殖、激活、凋亡以及细胞因子、趋化因子的产生. TL1A/DR3细胞因子系统已成为黏膜免疫的重要模块, 参与维持肠道稳态, 促进慢性炎症反应的发生和发展, 因此, 在炎症性肠病的发生发展过程中也发挥重要作用.
核心提要: 肿瘤坏死因子样配体1(tumor necrosis factor-like ligand 1 aberrance, TL1A)通过结合其功能性受体-死亡受体3参与维持肠道稳态, 促进慢性炎症反应的发生和发展, 促进黏膜的炎性反应及肠壁纤维化的发生. 本文将从TL1A作为炎症性肠病的治疗靶点进行评述.
引文著录: 战蓉蓉, 王冬, 张晓岚. TL1A作为炎症性肠病治疗靶点的研究进展. 世界华人消化杂志 2024; 32(6): 397-404
Revised: March 8, 2024
Accepted: May 28, 2024
Published online: June 28, 2024
TNF and TNF receptor superfamily proteins (TNFSF and TNFRSF) are composed of a variety of molecules that play a key role in the development and function of the immune system. TNF-like cytokine 1A (TL1A), encoded by the TNFSF15 gene, is a type Ⅱ transmembrane protein that exists in both soluble and membrane-bound forms. By binding to its functional receptor-death receptor 3 (DR3 or TNFFRSFf25), TL1A provides stimulation signals to downstream signaling pathways, and then regulates the proliferation, activation, apoptosis, and production of cytokines and chemokines in effector cells. The TL1A/DR3 cytokine system has become an important module of mucosal mucosal immunity, which is involved in maintaining intestinal homeostasis and promoting the occurrence and development of chronic inflammatory response, so it also plays an important role in the occurrence and development of inflammatory bowel disease.
- Citation: Zhan RR, Wang D, Zhang XL. Progress in research of TNF-like cytokine 1A as a therapeutic target for inflammatory bowel disease. Shijie Huaren Xiaohua Zazhi 2024; 32(6): 397-404
- URL: https://www.wjgnet.com/1009-3079/full/v32/i6/397.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i6.397
炎症性肠病(inflammatory bowel disease, IBD)包括克罗恩病(Crohn's disease, CD)和溃疡性结肠炎(ulcerative colitis, UC), 是一种病因和发病机制至今尚不十分清楚的非特异性肠道疾病, 具有慢性及反复发作的特点. 近年来IBD的患病率在西方世界约为0.5%, 在世界范围内总体呈上升趋势[1]. 我国IBD发病率和患病率尤其是近些年呈明显上升趋势[2]. 据不完全统计, 2005-2014年我国IBD的总病例数约为35万, 预计到2025年我国IBD患者将达到150万例[1]. 在过去的时间里, 针对参与IBD发病机制的细胞因子和受体的生物制剂的开发使IBD的治疗达到了更好的治疗效果, 改变了IBD的疾病进程. 然而, 目前已经上市的TNF-α抑制剂、抗白细胞介素-12/23和抗整合素等药物在大约33.3%的患者中原发性失应答, 40%的患者随着用药时间的推移会出现继发性失应答[3,4], 因此对于IBD的治疗仍面临诸多困难, 进一步探讨IBD的发病机制和寻找新的治疗靶点等相关研究至关重要.
TL1A是TNFSF15的蛋白产物, 可通过结合其DR3, 产生协同刺激信号, 激活T淋巴细胞, 对机体的免疫调节产生影响[5]. 证据表明, TL1A在骨髓细胞或者淋巴细胞的表达, 可使肠道T淋巴细胞表达的趋化因子受体CCR9、CCR10增加, 使Foxp3+调节性T细胞(Treg)的数目增加, 从而可提高Th1的活性, 且持续高表达可促进黏膜的炎性反应及肠壁纤维化的发生[6]. TNFSF15基因编码的TL1A作为粘膜免疫的调节剂, 并参与IBD发病机制的免疫途径, 尤其是2023年多个关于IBD的临床试验均来源于此靶点. 本文将在国内外研究数据的基础上, 结合笔者的临床经验, 从TL1A作为炎症性肠病的治疗靶点进行评述.
1997年Tan等[7]通过筛选人脐静脉血管内皮细胞cDNA文库, 从表达序列标签(expressed sequenced tag, EST)库中寻找TNF和Fas配体的同源分子时, 发现了一种肿瘤坏死因子家族新成员-血管内皮细胞生长抑制因子, 亦称为TNFSF15. TNFSF15基因编码的蛋白有3种亚型, 其中最早发现的是TNF样配体1(TNF like ligand 1, TL1), Migone等[8]发现的与TL1高度同源性的EST克隆cDNA编码251个氨基酸残基, 其蛋白质C-末端的151个氨基酸残基与TL1 C-末端的氨基酸残基完全相同, 为了与TL1相区别而将这个预测蛋白命名为TL1A. 氨基酸序列分析表明, TL1A是Ⅱ型跨膜蛋白, 全长含有251个氨基酸, 分子量为22 kD, 分为胞内区、跨膜区与胞外区, 胞外C末端的149个氨基酸残基组成可溶性分子, 具有抑制内皮细胞增殖的作用. TL1A除了以膜结合形式存在以外, 同时也存在可溶性形式[8]. 但近来研究表明, TL1A在炎症组织巨噬细胞、单核细胞、树突状细胞(dendritic cells, DC)和黏膜固有层T淋巴细胞中也有表达. TL1A作为TNF的配体, 可通过与DR3结合, 为T淋巴细胞的激活提供协同刺激信号, 促进Th1和Th17细胞的极化及效应功能, 进而在机体免疫调节中发挥重要作用.
全基因组关联研究(genome-wide association studies, GWAS)表明, IBD的发病中可能存在多重基因的作用和种族差异性. 在GWAS以及多项研究均显示TNFSF15是亚洲和欧洲IBD患者共有的易感基因, 并且在韩国最近的一项研究也证实了包括TNFSF15在内的多个UC风险基因位点[9]. 同时, 在南亚的印度IBD患者中的研究同样显示TNFSF15单核苷酸多态性(single nucleotide polymorphisms, SNPs)与IBD有强相关性[10]. 同时在IBD发病中也存在着种族差异性, 例如非犹太人中TNFSF15单体型A和B分别是IBD的风险和保护因素, 而犹太人中TNFSF15单体型B则是CD发病的一个重要风险因素.
TNFSF15的单核苷酸多态性与IBD的严重程度密切相关. 欧洲的一项大型基因研究显示, TNFSF15 rs4263839位点的IBD患者不仅进行肠切除的手术几率增加, 并且从发病到手术的时间间隔较短[11]. 来自韩国的一项研究显示, TNFSF15 rs6478108位点的IBD患者更容易发生肠管狭窄和非肛周的瘘管并发症, 而TNFSF15 rs4574921位点的IBD患者则发生肛周瘘管的几率增加[12]. TNFSF15 rs4263839位点的CD患者如果抗酿酒酵母菌抗体(anti-saccharomyces cerevisiae antibody, ASCA)-IgA阳性, 则更容易发生狭窄或穿孔, 导致病情加重[13].
2023年我国刘占举、李明松等共同发表的研究揭示了东亚和欧洲血统的炎症性肠病的遗传结构[14]. 研究结果之一TNFSF15在东亚人(EAS)中增加CD风险的幅度远大于欧洲人(EUR), 这一尚不解释的差异可能是由临床异质性或基因-环境/基因-基因相互作用驱动的. 2023年Cordero等[15]首次尝试使用MANTRA识别AA中的位点, 该方法考虑了不同祖先之间的异质性, 同时允许密切相关的人群之间的相似性, 并对EUR和EAS的IBD患者进行荟萃及免疫芯片研究检测到20个新位点, 其中含有免疫相关基因或具有IBD或免疫介导疾病相关性的其他证据的基因: PLEKHG5; TNFSFR25(编码死亡受体3, TNFSF15基因产物TL1A的受体)、XKR6、ELMO1、BC021024等.
以上研究均表明, TL1A作为IBD的易感基因可能与IBD的发病时间、部位、严重程度及并发症等诸多方面有关. 因此, 明确IBD患者的种族和基因型就有可能决定其是否能够应用阻断TL1A的方法进行治疗.
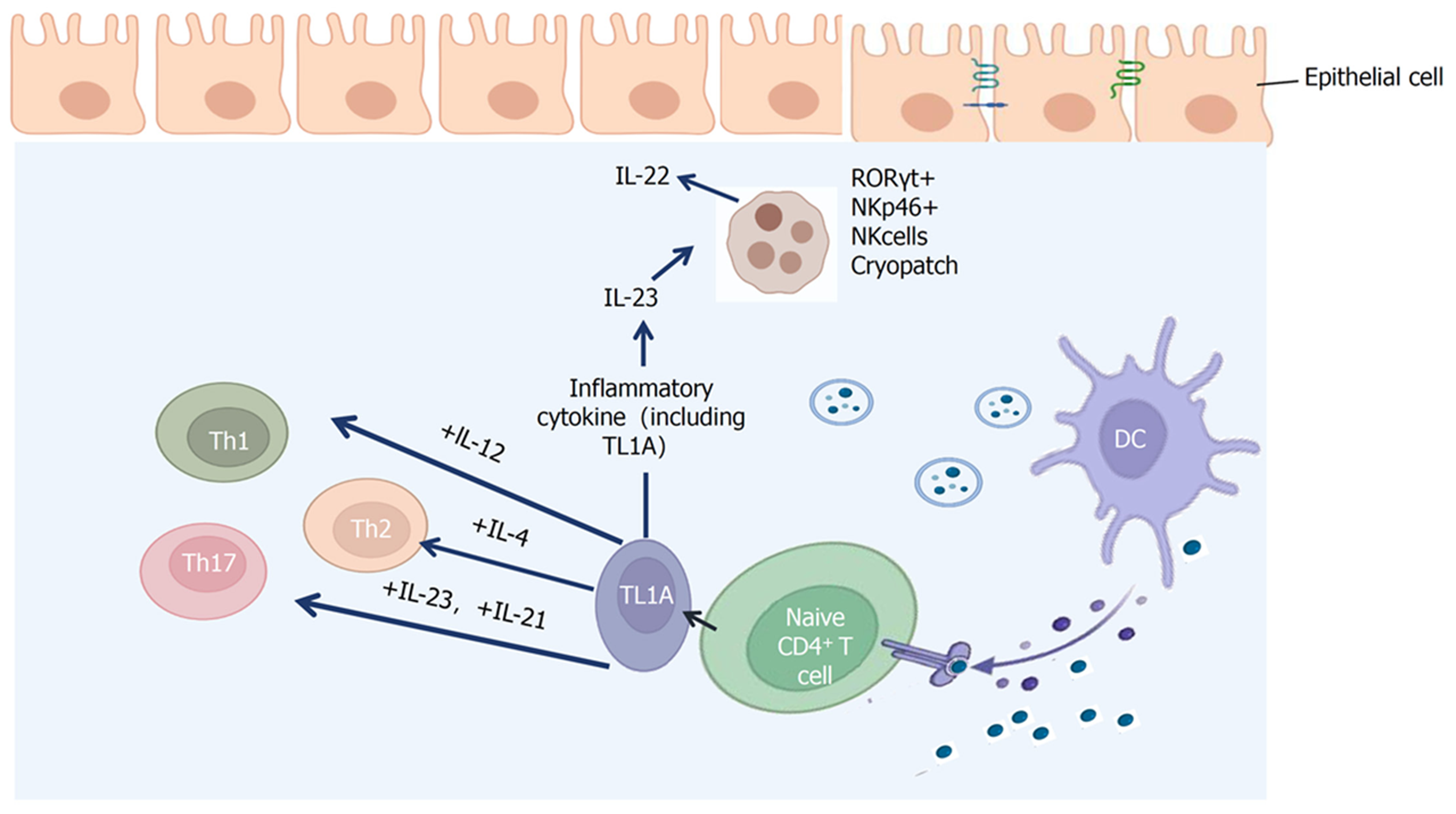
近年来, TL1A与其受体在自身免疫性疾病发生中的作用日益受到国内外学者的广泛关注[16]. 有研究表明, TL1A基因敲除实验动物的实验性自身免疫性脑脊髓炎临床症状的严重程度减轻, 而且TL1A-/-树突状细胞刺激Th17细胞的分化与增殖的能力下降[17]; 也有研究表明TL1A及其受体DR3在特异性皮炎中的表达上调[18]. 而TL1A及其受体在IBD发病中的作用, 更是成为了众多学者研究的焦点(见图1).
TL1A具有促进肠道炎症的作用. Dr. Targan及其课题组成员最初体外研究表明, TL1A可通过与其受体结合协同刺激白介素12-/白介素-18(interleukin-12/interleukin-18, IL-12/IL-18), 促进T细胞和自然杀伤细胞(natural killer cell, NK细胞)的干扰素-γ(interferon-γ, IFN-γ)分泌[19], 同时在自体抗原呈递细胞(antigen presenting cell, APC)与T细胞共培养实验中也发现, 单核细胞和/或树突细胞(dendritic cells, DC)产生的TL1A可诱导CD4+T细胞中IFN-γ的产生[20], 并且发现免疫复合物介导的FcγR信号激活可上调巨噬细胞和DC中TL1A mRNA和蛋白表达[21], 而TLR8(Toll样受体8)或TLR7/8配体(R848)可剂量依赖性地抑制单核细胞活化导致的TL1A表达[22]. 通过对IL-12/IL-18预处理的CD4+T细胞与HEK-293细胞共培养, 也发现膜结合型TL1A可通过与其受体结合诱导IFN-g表达[23]. 随着研究的深入, Takedatsu等[24]进一步采用DSS慢性结肠炎模型和结肠炎基因Gαi2敲除的T细胞转移模型鼠进行研究, 发现TL1A不仅可单独或协同IL-12和IL-23作用于Th1细胞分泌IFN-g, 同时还可作用于Th17细胞使其分泌IL-17增加. 中国医科大学Meng[25]的研究发现TL1A/DR3在T-T和DC-T细胞相互作用中促进了Th1和Th17细胞的分化, T细胞和DC-T细胞相互作用的方式促进Th1和Th17细胞分化. Di Sabatino等[26]的研究表明TNF-a单抗--英夫利西单抗(Infliximab)可减少胶原分泌,增加TIMP-1的表达, 阻断TNF-α不但能够促进伤口修复, 而且能阻断肠纤维化发生. Infliximab的出现使人们相信特异性的TNF家族成员TL1A可能成为新的生物学治疗靶点. 为此, Biener-Ramanujan及Targan等[23]继续应用抗鼠TL1A单克隆抗体(19E06A)治疗慢性结肠炎模型小鼠, 结果发现其可通过下调Th1和Th17细胞的活化阻止炎症进一步发展; 体外研究亦证实, 抗人TL1A单克隆抗体可通过抑制TL1A/DR3通路降低人CD4+T细胞表面IFN-g的表达[23]. 以上研究揭示TL1A及其受体可通过影响肠黏膜T细胞的活化、增殖, 诱导Th细胞极化, 致肠黏膜免疫系统耐受机制紊乱, 由此引发肠道炎症反应, 从而参与IBD的发生.
TL1A具有促进肠纤维化的作用. 我们课题组同Dr. Targan和Dr. Shih的研究小组一起, 进一步采用淋巴细胞过表达TL1A和髓样细胞过表达TL1A的两种转基因小鼠作为研究对象, 以具有相同遗传背景的野生型小鼠作为对照, 探讨TL1A过表达诱发自发性结肠炎的可能性. 结果发现TL1A过表达引起轻微的、不均匀分布的小肠炎症, 尤以回肠明显; 同时也发现TL1A转基因小鼠的肠道有纤维化发生[25]. 我们课题组的李辉、战蓉蓉应用淋巴细胞过表达TL1A的转基因小鼠建立了TNBS、DSS诱导的实验性结肠炎模型, 发现TLlA过表达可促进TNBS、DSS诱导的实验性结肠炎小鼠肠成纤维细胞活化、Ⅰ型与Ⅲ型胶原合成增强以及TIMP.1表达上调以及TGF-131/Smad3信号转导通路介导的肠成纤维细胞活化, 可能是肠道炎症并发肠纤维化的机制之一. 抗TLlA抗体可减轻TLlA介导的结肠炎相关肠纤维化, 预防性干预效果优于治疗性干预. 并且抗TLlA抗体可能通过抑制肠成纤维细胞活化、抑制TGF-β/Smad信号通路减轻T细胞转移结肠炎小鼠肠纤维化的发生[27-29]. 贾文秀等研究证实TL1A与IBD患者肠纤维化发生呈正相关, 并且可能通过TGF-β/Smad3通路参与肠纤维化中上皮间质转化发生[28]. 另外, TL1A可能通过上皮间质转化促进慢性实验性结肠炎小鼠肠纤维化形成, 并且TL1A可在体外促进HT-29细胞系发生上皮间质转化以及TL1A可能通过直接与DR3结合或间接分泌IL-13以干预TGF-β/Smad3通路进而影响EMT相关转录因子Snail1以及ZEB1表达[30].
肠道免疫功能异常是IBD发病的关键因素, 其中固有免疫作为启动因素, 在机体识别外来病原并抵御其入侵时发挥重要作用. 其参与IBD发病的细胞主要为组织定植的单核吞噬细胞, 包括巨噬细胞(macrophages, MPs)和树突状细胞(dendritic cells, DCs), 而肠黏膜组织中的DCs是肠道最重要的抗原递呈细胞. 研究发现, 黏膜MPs和DCs激活后可迅速上调TL1A基因表达[13]. IBD患者肠组织标本及肠黏膜固有层单核细胞中TL1A mRNA和蛋白表达均上调, 尤以CD患者肠黏膜固有层MPs中表达更为显著[31]. 黏膜在共生菌如大肠杆菌的刺激下, 肠黏膜固有层CD14+MPs可以产生更多膜结合型TL1A; 在UC患者中, IgG免疫复合物可以刺激肠黏膜固有层MPs的TL1A表达升高[32].
TL1A在肠道和外周血单核细胞来源的DCs中均有表达. 本课题组韩菲发现髓系细胞高表达TL1A的转基因小鼠可发生自发性小肠炎, 肠系膜淋巴结和脾脏DCs的CD80和CD86表达升高, 提示TL1A可能有促进肠道DCs活化的作用[33]. 此外, Taraban等[34]进一步构建DCs高表达TL1A的转基因小鼠, 探讨其对适应性免疫的影响时发现TL1A高表达的DCs可促进脾脏和小肠黏膜固有层T细胞活化. 临床研究显示, 儿童UC患者的外周血单核细胞中的DCs表达DR3显著升高[35]; 体外研究同样证实, 大肠杆菌可活化DCs进而分泌TL1A[21]. 同时, TL1A亦可通过与DCs表面的DR3受体结合, 促进DCs活化[22].
固有淋巴细胞(innate lymphoid cells, ILC)是一类新近定义的细胞家族, 分泌一系列类似于Th细胞分泌的细胞因子, 被认为是Th细胞的"镜像细胞". 依据产生的细胞因子分为ILC1、ILC2和ILC3三群. TL1A(TNFSF15)通过与DR3结合, 促进T细胞抵抗病原体入侵, 并直接刺激ILC2和ILC3, 在高表达TL1A转基因小鼠中可以通过刺激ILC2导致T细胞的激活与增加, 促进肠道增生和炎症[36]. 此外, 细胞实验中发现ILC2细胞表面有DR3的表达, 并且应用TL1A刺激人类ILC2细胞株后IL-5和IL-13的生成增加, 并且分泌IL-25和IL-33增多; 在TL1A诱导激活ILC2分泌IL-13的同时, DR3也能够促进ILC2数量进一步增加[25,37].
临床研究发现[38], CD患者较正常对照组产生IFN-γ的ILC1数量明显增加, 并且生成IL-22的NKp44+ ILC3数量减少, 这表明ILC1和ILC3在肠道炎症中可能发挥着相反的作用.
TL1A能够协同诱导T细胞激活, 增加辅助性T细胞(T helper cells, Th)1、Th2、Th17、Th9及调节性T细胞(regulatory T cells, Treg)等效应细胞功能, 调控免疫及炎症组织T细胞的聚集, 进而在适应性免疫中发挥重要作用, 参与IBD的发生发展.
在慢性结肠炎小鼠模型中, TL1A通过上调肠道相关淋巴组织(gut-associated lymphatic tissue, GALT)CD4+细胞中的Th1细胞亚基功能进而IFN-γ生成增加; 而TL1A缺陷小鼠中IFN-γ+CD4+T细胞数量明显下降, 这表明TL1A可以促进Th1细胞的分化, 进而在肠道黏膜炎症的发展中发挥重要的调节作用[24]. 大量的研究表明CCR9、CD161和IL-18Ra是TL1A特异性结合的T细胞亚基, 这些T细胞亚基在TL1A和IL-12及IL-18协同刺激下可诱导Th1细胞DR3表达增加, 进而分泌更多的IFN-γ[39,40]. 此外, 外源性TL1A可以使CD患者肠黏膜固有层单核细胞和外周血单核细胞分泌更多IFN-γ.
在不同的结肠炎实验模型中Th17细胞通过致病性或非致病性特征发挥不同作用. 致病性Th17细胞可以生成IL-17A, 并表达IL-18R1和CXC趋化因子受体3等特异性的表面标志. 研究发现UC和CD患者的结肠炎症黏膜中IL-17A和TL1A的mRNA水平与对照组相比均明显增加, DR3的mRNA没有明显变化, 但是在外周血中却没有发现上述的变化, 说明TL1A导致IBD发病可能是通过肠道局部诱导了IL-17A的产生[35]. 在慢性结肠炎中应用TL1A中和抗体则能够通过下调Th1细胞和Th17细胞数量来缓解慢性结肠炎模型的肠道炎症[24].
TL1A在Th2细胞功能及其介导的疾病中发挥重要的作用, 它通过激活NKT细胞协同刺激IL-13的生成, 在Th2细胞分化的CD4细胞中发挥着Th2细胞效应功能. IL-13在慢性炎症中可以损伤上皮细胞屏障的完整性以及诱导上皮细胞的凋亡, 故认为是IBD发病的重要环节[41]. Meylan等[42]对T细胞或DCs过表达TL1A的转基因小鼠进行研究发现, TL1A过表达可诱发IL-13介导的自发性结肠炎, 并增强Th2细胞介导的免疫反应. 同时有研究表明, TL1A转基因小鼠末端回肠黏膜层出现了潘氏细胞和杯状细胞的紊乱和肥大, 而阻断IL-13后明显改善了小肠的炎症, 进一步研究证实这主要通过Th2细胞效应进而导致IL-13表达升高; 并且在小鼠的炎症肠道中, NKT细胞、记忆CD4+T细胞或嗜酸性粒细胞可能是通过TL1A-DR3信号通路诱导产生Th2细胞因子的主要来源[34,42]. 以上研究说明TL1A/DR3在黏膜免疫反应中可以导致Th2/IL-13反应的增加, 并且目前已经发现了IL-13的中和抗体, 提示TL1A及IL-13等相关细胞因子的生物治疗可能成为IBD治疗的新方法.
Th9细胞是一类新近定义的Th细胞家族成员, 近期涌现的大量研究揭示了Th9细胞在过敏性疾病和自身免疫性疾病中的重要致病作用[28]. 本课题组王冬等发现Th9细胞主要通过分泌IL-9发挥促炎作用. 在葡聚糖硫酸钠(dextran Sulfate Sodium Salt, DSS)诱导的实验性结肠炎小鼠中应用IL-9抗体后肠道黏膜的炎症明显减轻, 表明IL-9抗体可能具有治疗作用[43]. 而在过敏性肺炎小鼠模型中, 与野生型小鼠相比, DR3-/-小鼠肺组织IL-9 mRNA表达明显下降, T细胞活化减少, 同时肺组织炎症减轻; 进一步的体外细胞实验证实应用TL1A能够促进Naïve CD4+T细胞向Th9细胞分化, 并呈剂量依赖性, 并且该实验证实TL1A与DR3结合后通过其转录因子PU.1及Traf6通路促进Th9细胞分化及IL-9生成增加[43]. 临床研究发现, 活动性UC患者肠上皮细胞IL-9R和黏膜固有层T细胞的IL-9表达均明显升高[44-46]. 因此, TL1A可能参与IBD发生过程中Th9细胞的分化与IL-9细胞因子的分泌. TL1A可能通过影响Th9细胞的分化、募集与分泌功能参与IBD的发病, 如果能够通过进一步的深入研究明确在IBD中TL1A与Th9细胞之间的联系, 那么就可能为IBD的治疗提供新的治疗靶点.
Th22细胞是近年发现的一类辅助性T细胞, 其功能主要通过IL-22实现. IL-22是IL-10亚群的成员, 在包括IBD在内的多种人类炎性疾病中发挥重要调节作用. Sugimoto等[47]在DSS诱导的实验性结肠炎模型中发现转染IL-22基因后肠道炎症迅速得到缓解, 表明IL-22在UC发病中可能发挥重要的防御作用. 在CD患者中发现TL1A可以诱导记忆性CD4+T细胞和Th17细胞大量表达IL-22, 并发现了IL-9的表达, 而应用IL-9抗体后无IL-22分泌, 说明TL1A通过IL-9诱导了记忆性CD4+ T细胞和Th17细胞中IL-22的表达[48]. 这表明TL1A和Th22以及IL-9在IBD的发病中可能起着重要的作用, 但具体的关系和机制尚需进一步研究明确.
Treg细胞在维持肠道的免疫耐受和通过调节固有免疫和适应性免疫抑制肠道炎症反应中发挥着重要的作用. 在实验性结肠炎模型中过表达或持续表达TL1A不仅可以导致效应性T细胞的增加, 而且可以导致Treg细胞的激活和增加; 在外源性或内源性TL1A存在的情况下Treg细胞可以抑制T细胞的增殖[19,30]. Sidhu-Varma及Targan等[6]最近的研究显示低水平的TL1A表达有利于维持Treg细胞的功能, 进而减轻实验性结肠炎小鼠模型的炎症, 提示在治疗中完全阻断TL1A/DR3可能并不是有益的. 这揭示了TL1A在调控T细胞介导的免疫反应及IBD发病中的新的作用, 同时也需注意在应用针对TL1A的生物治疗时也可能导致Treg细胞功能的受损, 进而出现疗效的下降.
目前全球共有14款TL1A靶点药物在研, 适应症主要集中在UC、CD, 进展最快的产品是Prometheus公司的的PRA023, 目前已经进入到临床III期; 此外, TEV-574、PF-06480605进入临床Ⅱb期试验; 其余产品均处于临床I期临床试验和临床早期阶段[49].
2022-12, 抗TL1A单克隆抗体PRA023在治疗CD与UC的两项2期临床试验中的临床数据表明: 在治疗中重度活动性CD患者的开放标签Ⅱa期临床试验中, PRA023组中26.0%获得内镜缓解, 与预先确定的安慰剂组缓解率(12%)相比差异显著. 从发表的数据上来看, 无论是CD还是UC PRA023均表现出了优异的治疗效果. 在治疗中重度UC的随机双盲2期临床试验中, PRA023达到主要终点. 即用药12 wk治疗后, PRA023组中26.5%的患者达到临床缓解的主要终点, 对照组这一数值为1.5%. PRA023组中36.8%的患者达到内镜改善的次要终点, 安慰剂组的数值为6.0%[49].
2023-10-23, 作为首个完全人源化的TL1A IgG1单抗PF-06480605(RVT-3101), 展现出良好的维持期治疗效果让人瞩目. 不论是临床缓解率还是内镜评分指标, PF-06480605都展现出了与诱导期相似的优异成果[51]. TUSCANY-2是一项大型、全球性、随机、双盲、安慰剂对照的剂量范围IIb期研究, 旨在调查PF-06480605在中度至重度UC成年参与者中的疗效、安全性和药代动力学[52]. TUSCANY-2是一项为期56 wk的研究, 在第14周测量了诱导期的关键疗效分析, 将PF-06480605的不同剂量与安慰剂进行比较. 在56 wk观察所有患者接受RVT-3101维持缓解治疗的关键结果, 在诱导期接受RVT-3101的患者被预先分配在缓解期接受相同或更低的剂量. 2023-01, Roivant报告了诱导缓解期的阳性数据, USCANY-2维持缓解的结果如下: 对于所有在诱导期和维持期接受预期第3阶段剂量的患者, 56 wk临床缓解率为36%(而第14周为29%), 56 wk内镜缓解50%(相比第14周为36%), 56 wk 21%的内镜缓解(相比之下, 第14周为11%). 对于预先指定的生物标志物检测呈阳性并在诱导缓解和维持缓解接受预期第3阶段剂量的患者, 56 wk临床缓解率为43%(而第14周为33%), 56 wk内镜缓解64%(相比之下, 第14周为47%), 56 wk内镜缓解率为36%(第14周为13%). 研究者发现对PF-06480605治疗前后的粪便样品进行分析发现与炎症性肠病相关的病原菌也显著减少. 基于初期这么好的试验结果, 相信抗TL1A治疗炎症性肠病临床试验可能会继续增多[52,53].
TL1A是IBD的易感基因; TL1A作为新发现的肿瘤坏死因子超家族成员, 通过与其受体结合, 在淋巴细胞活化、炎症反应调节及IBD发生发展中起重要作用; TL1A通过固有免疫、适应性免疫在IBD中发挥重要作用, TL1A的表达上调可促进肠黏膜炎症和纤维化的发生, 目前进行的相关临床试验及研究数据已经取得了可观的效果. 因此, TL1A与IBD及其相关肠纤维化具有相关性, 干预TL1A可能成为治疗IBD及逆转肠纤维化的新靶点.
学科分类: 胃肠病学和肝病学
手稿来源地: 河北省
同行评议报告学术质量分类
A级 (优秀): A, A
B级 (非常好): B
C级 (良好): 0
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Kaplan GG. The global burden of IBD: from 2015 to 2025. Nat Rev Gastroenterol Hepatol. 2015;12:720-727. [PubMed] [DOI] |
| 2. | Zhang Y, Liu J, Han X, Jiang H, Zhang L, Hu J, Shi L, Li J. Long-term trends in the burden of inflammatory bowel disease in China over three decades: A joinpoint regression and age-period-cohort analysis based on GBD 2019. Front Public Health. 2022;10:994619. [PubMed] [DOI] |
| 3. | Macaluso FS, Papi C, Orlando A, Festa S, Pugliese D, Bonovas S, Pansieri C, Piovani D, Fiorino G, Fantini MC, Caprioli F, Daperno M, Armuzzi A; Italian Group for the Study of Inflammatory Bowel Disease (IG-IBD); Working panel; Review panel. Use of biologics for the management of Crohn's disease: IG-IBD clinical guidelines based on the GRADE methodology. Dig Liver Dis. 2023;55:442-453. [PubMed] [DOI] |
| 4. | Furfaro F, Alfarone L, Gilardi D, Correale C, Allocca M, Fiorino G, Argollo M, Zilli A, Zacharopoulou E, Loy L, Roda G, Danese S. TL1A: A New Potential Target in the Treatment of Inflammatory Bowel Disease. Curr Drug Targets. 2021;22:760-769. [PubMed] [DOI] |
| 5. | Higashiyama M, Hokari R. New and Emerging Treatments for Inflammatory Bowel Disease. Digestion. 2023;104:74-81. [PubMed] [DOI] |
| 6. | Sidhu-Varma M, Shih DQ, Targan SR. Differential Levels of Tl1a Affect the Expansion and Function of Regulatory T Cells in Modulating Murine Colitis. Inflamm Bowel Dis. 2016;22:548-559. [PubMed] [DOI] |
| 7. | Tan KB, Harrop J, Reddy M, Young P, Terrett J, Emery J, Moore G, Truneh A. Characterization of a novel TNF-like ligand and recently described TNF ligand and TNF receptor superfamily genes and their constitutive and inducible expression in hematopoietic and non-hematopoietic cells. Gene. 1997;204:35-46. [PubMed] [DOI] |
| 8. | Migone TS, Zhang J, Luo X, Zhuang L, Chen C, Hu B, Hong JS, Perry JW, Chen SF, Zhou JX, Cho YH, Ullrich S, Kanakaraj P, Carrell J, Boyd E, Olsen HS, Hu G, Pukac L, Liu D, Ni J, Kim S, Gentz R, Feng P, Moore PA, Ruben SM, Wei P. TL1A is a TNF-like ligand for DR3 and TR6/DcR3 and functions as a T cell costimulator. Immunity. 2002;16:479-492. [PubMed] [DOI] |
| 9. | Ye BD, Choi H, Hong M, Yun WJ, Low HQ, Haritunians T, Kim KJ, Park SH, Lee I, Bang SY, Kim TH, Shin HD, Kang D, Youn HS, Li Y, Liu J, McGovern DP, Yang SK, Song K. Identification of Ten Additional Susceptibility Loci for Ulcerative Colitis Through Immunochip Analysis in Koreans. Inflamm Bowel Dis. 2016;22:13-19. [PubMed] [DOI] |
| 10. | Baskaran K, Pugazhendhi S, Ramakrishna BS. Protective association of tumor necrosis factor superfamily 15 (TNFSF15) polymorphic haplotype with Ulcerative Colitis and Crohn's disease in an Indian population. PLoS One. 2014;9:e114665. [PubMed] [DOI] |
| 11. | Cleynen I, González JR, Figueroa C, Franke A, McGovern D, Bortlík M, Crusius BJ, Vecchi M, Artieda M, Szczypiorska M, Bethge J, Arteta D, Ayala E, Danese S, van Hogezand RA, Panés J, Peña SA, Lukas M, Jewell DP, Schreiber S, Vermeire S, Sans M. Genetic factors conferring an increased susceptibility to develop Crohn's disease also influence disease phenotype: results from the IBDchip European Project. Gut. 2013;62:1556-1565. [PubMed] [DOI] |
| 12. | Yang DH, Yang SK, Song K, Hong M, Park SH, Lee HS, Kim JB, Lee HJ, Park SK, Jung KW, Kim KJ, Ye BD, Byeon JS, Myung SJ, Kim JH, Shin US, Yu CS, Lee I. TNFSF15 is an independent predictor for the development of Crohn's disease-related complications in Koreans. J Crohns Colitis. 2014;8:1315-1326. [PubMed] [DOI] |
| 13. | Tung CC, Wong JM, Lee WC, Liu HH, Chang CH, Chang MC, Chang YT, Shieh MJ, Wang CY, Wei SC. Combining TNFSF15 and ASCA IgA can be used as a predictor for the stenosis/perforating phenotype of Crohn's disease. J Gastroenterol Hepatol. 2014;29:723-729. [PubMed] [DOI] |
| 14. | Liu Z, Liu R, Gao H, Jung S, Gao X, Sun R, Liu X, Kim Y, Lee HS, Kawai Y, Nagasaki M, Umeno J, Tokunaga K, Kinouchi Y, Masamune A, Shi W, Shen C, Guo Z, Yuan K; FinnGen; International Inflammatory Bowel Disease Genetics Consortium; Chinese Inflammatory Bowel Disease Genetics Consortium, Zhu S, Li D, Liu J, Ge T, Cho J, Daly MJ, McGovern DPB, Ye BD, Song K, Kakuta Y, Li M, Huang H. Genetic architecture of the inflammatory bowel diseases across East Asian and European ancestries. Nat Genet. 2023;55:796-806. [PubMed] [DOI] |
| 15. | Cordero RY, Cordero JB, Stiemke AB, Datta LW, Buyske S, Kugathasan S, McGovern DPB, Brant SR, Simpson CL. Trans-ancestry, Bayesian meta-analysis discovers 20 novel risk loci for inflammatory bowel disease in an African American, East Asian and European cohort. Hum Mol Genet. 2023;32:873-882. [PubMed] [DOI] |
| 16. | Xu WD, Li R, Huang AF. Role of TL1A in Inflammatory Autoimmune Diseases: A Comprehensive Review. Front Immunol. 2022;13:891328. [PubMed] [DOI] |
| 17. | Pappu BP, Borodovsky A, Zheng TS, Yang X, Wu P, Dong X, Weng S, Browning B, Scott ML, Ma L, Su L, Tian Q, Schneider P, Flavell RA, Dong C, Burkly LC. TL1A-DR3 interaction regulates Th17 cell function and Th17-mediated autoimmune disease. J Exp Med. 2008;205:1049-1062. [PubMed] [DOI] |
| 18. | Hisamoto T, Suga H, Yoshizaki-Ogawa A, Sato S, Yoshizaki A. Increased Serum Levels of Tumor Necrosis Factor-like Ligand 1A in Atopic Dermatitis. Int J Mol Sci. 2023;24. [PubMed] [DOI] |
| 19. | Papadakis KA, Prehn JL, Landers C, Han Q, Luo X, Cha SC, Wei P, Targan SR. TL1A synergizes with IL-12 and IL-18 to enhance IFN-gamma production in human T cells and NK cells. J Immunol. 2004;172:7002-7007. [PubMed] [DOI] |
| 20. | Shih DQ, Kwan LY, Chavez V, Cohavy O, Gonsky R, Chang EY, Chang C, Elson CO, Targan SR. Microbial induction of inflammatory bowel disease associated gene TL1A (TNFSF15) in antigen presenting cells. Eur J Immunol. 2009;39:3239-3250. [PubMed] [DOI] |
| 21. | Prehn JL, Thomas LS, Landers CJ, Yu QT, Michelsen KS, Targan SR. The T cell costimulator TL1A is induced by FcgammaR signaling in human monocytes and dendritic cells. J Immunol. 2007;178:4033-4038. [PubMed] [DOI] |
| 22. | Saruta M, Michelsen KS, Thomas LS, Yu QT, Landers CJ, Targan SR. TLR8-mediated activation of human monocytes inhibits TL1A expression. Eur J Immunol. 2009;39:2195-2202. [PubMed] [DOI] |
| 23. | Biener-Ramanujan E, Gonsky R, Ko B, Targan SR. Functional signaling of membrane-bound TL1A induces IFN-gamma expression. FEBS Lett. 2010;584:2376-2380. [PubMed] [DOI] |
| 24. | Takedatsu H, Michelsen KS, Wei B, Landers CJ, Thomas LS, Dhall D, Braun J, Targan SR. TL1A (TNFSF15) regulates the development of chronic colitis by modulating both T-helper 1 and T-helper 17 activation. Gastroenterology. 2008;135:552-567. [PubMed] [DOI] |
| 25. | Meng F, Jiang X, Wang X, Zheng Q, Wang XN, Mei C, Yan S, He Y, Xue J, Zhang X, Fu W, You Y, Zhai J, Wang Y, Sun X. Tumor necrosis factor-like cytokine 1A plays a role in inflammatory bowel disease pathogenesis. Proc Natl Acad Sci USA. 2023;120:e2120771120. [PubMed] [DOI] |
| 26. | Di Sabatino A, Pender SL, Jackson CL, Prothero JD, Gordon JN, Picariello L, Rovedatti L, Docena G, Monteleone G, Rampton DS, Tonelli F, Corazza GR, MacDonald TT. Functional modulation of Crohn's disease myofibroblasts by anti-tumor necrosis factor antibodies. Gastroenterology. 2007;133:137-149. [PubMed] [DOI] |
| 27. | Li H, Song J, Niu G, Zhang H, Guo J, Shih DQ, Targan SR, Zhang X. TL1A blocking ameliorates intestinal fibrosis in the T cell transfer model of chronic colitis in mice. Pathol Res Pract. 2018;214:217-227. [PubMed] [DOI] |
| 28. | 战 蓉蓉, 王冬, 贾文秀, 宋佳, 吴梦瑶, 李辉, 尹凤荣, 王娜, 彭晨星, 张红, 宋梅, 陈爽, David Quan Shih, 张 晓岚. 肿瘤坏死因子样配体1A在慢性实验性结肠炎相关肠纤维化中的作用与机制. 中华消化杂志. 2019;39:452-457. [DOI] |
| 29. | 尹 凤荣, 战 蓉蓉, 王 冬, 宋 佳, 李 辉, 张 红, 张 晓岚. TL1A通过调控IL-17和IFN-γ促进慢性实验性结肠炎相关肠纤维化的发生. 中国病理生理杂志. 2020;36:1096-1103. [DOI] |
| 30. | Wenxiu J, Mingyue Y, Fei H, Yuxin L, Mengyao W, Chenyang L, Jia S, Hong Z, Shih DQ, Targan SR, Xiaolan Z. Effect and Mechanism of TL1A Expression on Epithelial-Mesenchymal Transition during Chronic Colitis-Related Intestinal Fibrosis. Mediators Inflamm. 2021;2021:5927064. [PubMed] [DOI] |
| 31. | Ślebioda TJ, Bojarska-Junak A, Stanisławowski M, Cyman M, Wierzbicki PM, Roliński J, Celiński K, Kmieć Z. TL1A as a Potential Local Inducer of IL17A Expression in Colon Mucosa of Inflammatory Bowel Disease Patients. Scand J Immunol. 2015;82:352-360. [PubMed] [DOI] |
| 32. | Uo M, Hisamatsu T, Miyoshi J, Kaito D, Yoneno K, Kitazume MT, Mori M, Sugita A, Koganei K, Matsuoka K, Kanai T, Hibi T. Mucosal CXCR4+ IgG plasma cells contribute to the pathogenesis of human ulcerative colitis through FcγR-mediated CD14 macrophage activation. Gut. 2013;62:1734-1744. [PubMed] [DOI] |
| 33. | Han F, Song J, Jia W, Yang M, Wang D, Zhang H, Shih DQ, Targan SR, Zhang X. TL1A primed dendritic cells activation exacerbated chronic murine colitis. Life Sci. 2020;262:118220. [PubMed] [DOI] |
| 34. | Taraban VY, Slebioda TJ, Willoughby JE, Buchan SL, James S, Sheth B, Smyth NR, Thomas GJ, Wang EC, Al-Shamkhani A. Sustained TL1A expression modulates effector and regulatory T-cell responses and drives intestinal goblet cell hyperplasia. Mucosal Immunol. 2011;4:186-196. [PubMed] [DOI] |
| 35. | Slebioda TJ, Bojarska-Junak A, Cyman M, Landowski P, Kaminska B, Celinski K, Kmiec Z. Expression of death receptor 3 on peripheral blood mononuclear cells differes in adult IBD patients and children with newly diagnosed IBD. Cytometry B Clin Cytom. 2017;92:165-169. [PubMed] [DOI] |
| 36. | Ferdinand JR, Richard AC, Meylan F, Al-Shamkhani A, Siegel RM. Cleavage of TL1A Differentially Regulates Its Effects on Innate and Adaptive Immune Cells. J Immunol. 2018;200:1360-1369. [PubMed] [DOI] |
| 37. | Yu X, Pappu R, Ramirez-Carrozzi V, Ota N, Caplazi P, Zhang J, Yan D, Xu M, Lee WP, Grogan JL. TNF superfamily member TL1A elicits type 2 innate lymphoid cells at mucosal barriers. Mucosal Immunol. 2014;7:730-740. [PubMed] [DOI] |
| 38. | Bernink JH, Peters CP, Munneke M, te Velde AA, Meijer SL, Weijer K, Hreggvidsdottir HS, Heinsbroek SE, Legrand N, Buskens CJ, Bemelman WA, Mjösberg JM, Spits H. Human type 1 innate lymphoid cells accumulate in inflamed mucosal tissues. Nat Immunol. 2013;14:221-229. [PubMed] [DOI] |
| 39. | Jin S, Chin J, Seeber S, Niewoehner J, Weiser B, Beaucamp N, Woods J, Murphy C, Fanning A, Shanahan F, Nally K, Kajekar R, Salas A, Planell N, Lozano J, Panes J, Parmar H, DeMartino J, Narula S, Thomas-Karyat DA. TL1A/TNFSF15 directly induces proinflammatory cytokines, including TNFα, from CD3+CD161+ T cells to exacerbate gut inflammation. Mucosal Immunol. 2013;6:886-899. [PubMed] [DOI] |
| 40. | Holmkvist P, Roepstorff K, Uronen-Hansson H, Sandén C, Gudjonsson S, Patschan O, Grip O, Marsal J, Schmidtchen A, Hornum L, Erjefält JS, Håkansson K, Agace WW. A major population of mucosal memory CD4+ T cells, coexpressing IL-18Rα and DR3, display innate lymphocyte functionality. Mucosal Immunol. 2015;8:545-558. [PubMed] [DOI] |
| 41. | Mannon P, Reinisch W. Interleukin 13 and its role in gut defence and inflammation. Gut. 2012;61:1765-1773. [PubMed] [DOI] |
| 42. | Meylan F, Song YJ, Fuss I, Villarreal S, Kahle E, Malm IJ, Acharya K, Ramos HL, Lo L, Mentink-Kane MM, Wynn TA, Migone TS, Strober W, Siegel RM. The TNF-family cytokine TL1A drives IL-13-dependent small intestinal inflammation. Mucosal Immunol. 2011;4:172-185. [PubMed] [DOI] |
| 43. | Wang D, Li H, Duan YY, Han F, Luo YX, Wu MY, Yang MY, Zhan RR, Song J, Zhang H, Zhang XL. TL1A modulates the severity of colitis by promoting Th9 differentiation and IL-9 secretion. Life Sci. 2019;231:116536. [PubMed] [DOI] |
| 44. | Gerlach K, Hwang Y, Nikolaev A, Atreya R, Dornhoff H, Steiner S, Lehr HA, Wirtz S, Vieth M, Waisman A, Rosenbauer F, McKenzie AN, Weigmann B, Neurath MF. TH9 cells that express the transcription factor PU.1 drive T cell-mediated colitis via IL-9 receptor signaling in intestinal epithelial cells. Nat Immunol. 2014;15:676-686. [PubMed] [DOI] |
| 45. | Richard AC, Tan C, Hawley ET, Gomez-Rodriguez J, Goswami R, Yang XP, Cruz AC, Penumetcha P, Hayes ET, Pelletier M, Gabay O, Walsh M, Ferdinand JR, Keane-Myers A, Choi Y, O'Shea JJ, Al-Shamkhani A, Kaplan MH, Gery I, Siegel RM, Meylan F. The TNF-family ligand TL1A and its receptor DR3 promote T cell-mediated allergic immunopathology by enhancing differentiation and pathogenicity of IL-9-producing T cells. J Immunol. 2015;194:3567-3582. [PubMed] [DOI] |
| 46. | Nalleweg N, Chiriac MT, Podstawa E, Lehmann C, Rau TT, Atreya R, Krauss E, Hundorfean G, Fichtner-Feigl S, Hartmann A, Becker C, Mudter J. IL-9 and its receptor are predominantly involved in the pathogenesis of UC. Gut. 2015;64:743-755. [PubMed] [DOI] |
| 47. | Sugimoto K, Ogawa A, Mizoguchi E, Shimomura Y, Andoh A, Bhan AK, Blumberg RS, Xavier RJ, Mizoguchi A. IL-22 ameliorates intestinal inflammation in a mouse model of ulcerative colitis. J Clin Invest. 2008;118:534-544. [PubMed] [DOI] |
| 48. | Thomas LS, Targan SR, Tsuda M, Yu QT, Salumbides BC, Haritunians T, Mengesha E, McGovern DP, Michelsen KS. The TNF family member TL1A induces IL-22 secretion in committed human T(h)17 cells via IL-9 induction. J Leukoc Biol. 2017;101:727-737. [PubMed] [DOI] |
| 49. | Ditrich F, Blümel S, Biedermann L, Fournier N, Rossel JB, Ellinghaus D, Franke A, Stange EF, Rogler G, Scharl M; Swiss IBD Cohort Study Group. Genetic risk factors predict disease progression in Crohn's disease patients of the Swiss inflammatory bowel disease cohort. Therap Adv Gastroenterol. 2020;13:1756284820959252. [PubMed] [DOI] |
| 50. | Danese S, Klopocka M, Scherl EJ, Romatowski J, Allegretti JR, Peeva E, Vincent MS, Schoenbeck U, Ye Z, Hassan-Zahraee M, Rath N, Li G, Neelakantan S, Banfield C, Lepsy C, Chandra DE, Hung KE. Anti-TL1A Antibody PF-06480605 Safety and Efficacy for Ulcerative Colitis: A Phase 2a Single-Arm Study. Clin Gastroenterol Hepatol. 2021;19:2324-2332.e6. [PubMed] [DOI] |
| 51. | Banfield C, Rudin D, Bhattacharya I, Goteti K, Li G, Hassan-Zahraee M, Brown LS, Hung KE, Pawlak S, Lepsy C. First-in-human, randomized dose-escalation study of the safety, tolerability, pharmacokinetics, pharmacodynamics and immunogenicity of PF-06480605 in healthy subjects. Br J Clin Pharmacol. 2020;86:812-824. [PubMed] [DOI] |
| 52. | Hassan-Zahraee M, Ye Z, Xi L, Baniecki ML, Li X, Hyde CL, Zhang J, Raha N, Karlsson F, Quan J, Ziemek D, Neelakantan S, Lepsy C, Allegretti JR, Romatowski J, Scherl EJ, Klopocka M, Danese S, Chandra DE, Schoenbeck U, Vincent MS, Longman R, Hung KE. Antitumor Necrosis Factor-like Ligand 1A Therapy Targets Tissue Inflammation and Fibrosis Pathways and Reduces Gut Pathobionts in Ulcerative Colitis. Inflamm Bowel Dis. 2022;28:434-446. [PubMed] [DOI] |