修回日期: 2024-04-27
接受日期: 2024-05-22
在线出版日期: 2024-05-28
原花青素(proanthocyanidins, PAs)可改善乙醇诱导的胃溃疡, 而目前尚不清楚其能否在幽门螺杆菌(Helicobacter pylori, H. pylori)感染所致的胃黏膜损伤发挥修复作用.
探讨PAs对H. pylori所致小鼠胃黏膜损伤的保护作用及作用机制.
选取SPF级雄性C57BL/6小鼠43只, 随机分为对照组、模型组、及低、中、高剂量PAs干预组(PAs-L、PAs-M、PAs-H). 通过灌胃法定植H. pylori构建小鼠胃炎模型, 并灌胃给予PAs干预4 wk. 快速尿素酶试验及Warthin-Starry染色法评估H. pylori感染情况, HE染色观察小鼠胃黏膜组织的病理学表现, 试剂盒测定小鼠胃黏膜组织氧化应激水平及血清中炎症因子[肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素(interleukin, IL)-1β, IL-8]的水平, TUNEL染色检测黏膜上皮细胞凋亡, Western blot检测胃黏膜组织中B细胞淋巴瘤-2(B cell lymphoma-2, Bcl-2)、Bcl-2相关X蛋白(Bcl-2 assaciated X protein, Bax)及裂解的半胱氨酸蛋白酶3(cleaved cysteine protease 3, cleaved-caspase 3)的表达.
H. pylori定植感染可致小鼠胃黏膜出现损伤, 表现为黏膜明显的出血点、糜烂及溃疡面, 同时腺体数量减少, 排列紊乱, 有明显的炎性浸润; PAs干预可显著改善H. pylori所致的胃黏膜损伤. 与模型组相比, PAs干预组小鼠血清中的TNF-α、IL-1β和IL-8水平以及胃黏膜组织中的氧化应激水平、胃黏膜细胞凋亡、Bax和cleaved-caspase3的表达均显著降低, 而Bcl-2的表达明显增加, 并且这种变化呈现出剂量依赖性.
PAs可改善H. pylori感染所致的胃黏膜损伤, 机制可能与其降低H. pylori感染所致的胃黏膜氧化应激和炎症反应并调控凋亡相关蛋白的表达抑制胃黏膜细胞凋亡有关.
核心提要: 原花青素可通过抗炎、抗氧化和抑制胃黏膜细胞凋亡来修复幽门螺杆菌感染所致的胃黏膜损伤.
引文著录: 林丹阳, 陈肖敏, 蒋雪. 原花青素对幽门螺杆菌所致小鼠胃黏膜损伤的作用及机制. 世界华人消化杂志 2024; 32(5): 368-375
Revised: April 27, 2024
Accepted: May 22, 2024
Published online: May 28, 2024
Proanthidins (PAs) have been shown to ameliorate ethanol-induced gastric ulcers; however, their potential for repairing gastric mucosal injury caused by Helicobacter pylori (H. pylori) infection remains uncertain.
To investigate the protective effect and mechanism of PAs on H. pylori-induced gastric mucosal injury in mice.
Forty-three specific pathogen-free male C57BL/6 mice were randomly divided into control group, model group, and low, medium, and high dose PAs intervention groups (PAS-L, PAS-M, and PAS-H, respectively). A mouse model of gastritis was constructed by orally administering H. pylori, and then the mice received gavage of PAs for 4 wk. The rapid urease test and Warthin-Starry staining were used to assess H. pylori infection, and the pathological changes in mouse gastric mucosa tissue were observed after hematoxylin-eosin staining. The oxidative stress level in mouse gastric mucosal tissue and the levels of inflammatory factors [tumor necrosis factor-α (TNF-α), interleukin (IL)-1β, and IL-8] in serum were measured with commercial kits. TUNEL staining was employed to evaluate the apoptosis of mucosal epithelial cells, and Western blot was used to detect the expression of B cell lymphoma-2 (Bcl-2), Bcl-2 assaciated X protein (Bax), and cleaved cysteine protease 3 (cleaved-caspase3) in gastric mucosal tissue.
H. pylori infection caused damage to the gastric mucosa of mice, characterized by obvious bleeding points, erosion and ulceration, decrease in glandular quantity, disordered glandular arrangement, and obvious inflammatory infil-tration. Compared to the model group, the PAs intervention groups exhibited a significant dose-dependent decrease in serum levels of TNF-α, IL-1β, and IL-8. Additionally, there was a notable reduction in oxidative stress levels in the gastric mucosa, apoptosis of gastric mucosa cells, as well as expression of Bax and cleaved-caspase3. Conversely, the expression of Bcl-2 showed a significant increase after treatment with PAs.
PAs can improve gastric mucosal injury caused by H. pylori infection, and its mechanism may be related to reducing oxidative stress and inflammatory response of the gastric mucosa caused by H. pylori infection and regulating the expression of apoptosis-related proteins to inhibit gastric mucosal cell apoptosis.
- Citation: Lin DY, Chen XM, Jiang X. Effect and mechanism of Proanthocyanidins on Helicobacter pylori-induced gastric mucosal injury in mice. Shijie Huaren Xiaohua Zazhi 2024; 32(5): 368-375
- URL: https://www.wjgnet.com/1009-3079/full/v32/i5/368.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i5.368
幽门螺杆菌(Helicobacter pylori, H. pylori)为一种微需氧的革兰氏阴性菌, 主要定植于胃黏膜上皮, 其在人群中感染率高达50%[1]. 大量研究提示, H. pylori感染是慢性胃炎、消化性溃疡等胃部常见疾病的主要风险因素, 并且还能增加胃癌的发病风险[2,3]. 目前对H. pylori感染的一线治疗方案依然以抗生素药物为主, 但这些药物并不能修复受损伤的胃黏膜, 且对感染所致的炎症反应并无显著的治疗作用. 原花青素(proanthocyanidins, PAs)是一种可从多种植物中提取而来的类黄酮类化合物, 属于天然的抗氧化剂, 可清除体内自由基, 进而对抗自由基诱导的过氧化损伤[4,5]. Lokman等[6]的研究表明, 在乙醇诱导的消化性溃疡模型中, PAs可通过抑制过度的氧化损伤、炎症反应等发挥抗溃疡的作用. 此外, PAs已被发现具有清除H. pylori的功能[7,8]. 但其是否可改善H. pylori感染所致的胃黏膜损伤以及其中涉及的具体机制尚未有明确的研究. 基于以上研究背景, 本研究通过构建H. pylori感染小鼠模型, 观察PAs对胃黏膜损伤的作用, 并初步探索其可能的作用机制, 以期为H. pylori感染的治疗提供新方向.
PAs(北京索莱宝科技有限公司); H. pylori SS1标准菌株(宝赛质粒菌株资源公司); HE染色试剂盒(南京森贝伽生物科技有限公司); H. pylori尿素酶检测试剂盒(上海恩康生物科技有限公司); Warthin-Starry银染色液(上海尚宝生物科技有限公司); 丙二醛(malondialdehyde, MDA)检测试剂盒、超氧化物歧化酶(superoxide dismutase, SOD)活力检测试剂盒、还原型谷胱甘肽(glutathione, GSH)检测试剂盒、总抗氧化能力(total antioxidant capacity, T-AOC)检测试剂盒(南京建成生物研究所); 小鼠肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)ELISA检测试剂盒(上海酶联生物科技有限公司); 小鼠白介素(interleukin, IL)-1β和IL-8 ELISA检测试剂盒(上海烜雅生物科技有限公司); TUNEL染色试剂盒(武汉塞维尔生物科技有限公司); B细胞淋巴瘤-2(B cell lymphoma-2, Bcl-2)和Bcl-2相关X蛋白(Bcl-2 assaciated X protein, Bax)单克隆抗体(武汉博士德生化科技有限公司); 半胱氨酸蛋白酶3(cysteine protease 3, caspase 3)和裂解的caspase3(cleaved-caspase3)单克隆抗体(美国Abcam); GAPDH单克隆抗体(武汉三鹰生物技术有限公司).
1.2.1 H. pylori菌株的培养: 冷冻储存的H. pylori SS1标准菌株经解冻后, 采用接种环将菌液均匀涂布于含1%微生物添加剂和5%羊血的H. pylori固体培养基中, 置于微需氧培养箱中培养, 培养箱条件设置为37 ℃、5%O2、10%CO2及85%N2. 无菌接种环刮取平板上的菌落并混悬于脑心浸液肉汤培养液中, 通过比浊法调整菌液浓度为1×108 CFU/mL.
1.2.2 H. pylori感染小鼠模型的制备及给药: 43只SPF级8周龄雄性C57BL/6小鼠购于上海斯莱克实验动物有限责任公司, 经1 wk的适应性喂养后, 随机取其中35只小鼠用于构建H. pylori感染模型[9]: 小鼠禁水禁食12 h后, 隔日一次灌胃给予300 μL H. pylori SS1混悬液(1×108 CFU/mL), 共计7次灌胃. 另取8只小鼠作为对照组同步等量给予生理盐水灌胃. 在H. pylori感染4 wk后, 随机处死3只小鼠, 用快速尿素酶试验、Warthin-Starry银染色及HE染色评估H. pylori感染模型构建情况. 将造模成功的32只H. pylori感染小鼠分为模型组和低、中、高剂量PAs组(PAs-L、PAs-M、PAs-H), 每组8只, 分别给予灭菌蒸馏水和PAs(50 mg/kg、100 mg/kg、200 mg/kg)灌胃, 每天1次, 给药干预4 wk后, 麻醉后牺牲小鼠, 用快速尿素酶试验判定各组小鼠胃黏膜的H. pylori的感染状态, 然后取材进行后续的实验分析. 所有动物实验均经台州恩泽医疗中心(集团)实验动物伦理委员会批准, 批准编号: tzy-2022005.
1.2.3 ELISA检测血清中炎症因子水平: 用采血针收集小鼠腹主动脉血液, 1000×g离心5 min收集上层血清. 按ELISA试剂盒操作说明加入相应试剂, 待反应结束后检测各孔在450 nm波长处的吸光度值, 用标准曲线计算血清中炎症因子TNF-α、IL-1β、IL-8的水平.
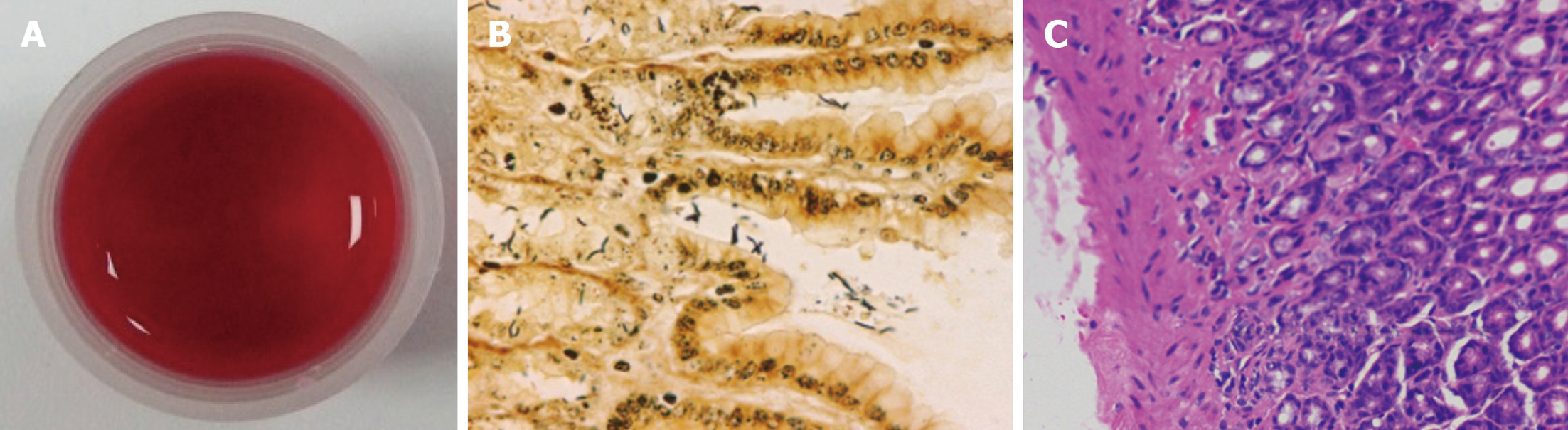
1.2.4 收集胃组织及HE染色: 安乐死小鼠, 取出胃并沿着胃大弯切开, 肉眼初步观察胃黏膜的变化. 收集胃组织, 一部分经4%多聚甲醛固定后, 用石蜡包埋并制备石蜡组织切片; 另一部分经液氮速冻后存储于-80 ℃冰箱中, 用于相应试剂盒检测及组织蛋白的提取. HE染色: 5 μm厚的胃黏膜组织切片经脱蜡至水后, 进行HE染色, 显微镜下观察胃黏膜组织的病理形态并采用随机视野拍照.
1.2.5 快速尿素酶试验: 取小块胃黏膜组织剪碎后放入尿素酶测试液中, 若测试液由橘黄色快速变为红色, 则表示H. pylori感染结果为阳性; 然后在630 nm波长处检测吸光度值, 其吸光度值与H. pylori感染量成正比. PAs对H. pylori的治疗效果以H. pylori根除率(此处用H. pylori阴性比例计算)和快速尿素酶试验半定量分析(OD630值)来综合评价.
1.2.6 Warthin-Starry银染色鉴定H. pylori定植情况: 取胃组织石蜡切片, 脱蜡至水后, 在56 ℃条件下, 将其依次浸入硝酸银染液和Warthin-Starry银染液, 各染色0.5 h, 显微镜下观察胃黏膜组织中H. pylori定植感染情况(菌体被染成黑色为H. pylori阳性)并采用随机视野拍照.
1.2.7 氧化应激水平试剂盒检测: 取胃组织, 匀浆后收集匀浆液, 采用相应试剂盒检测总抗氧化(T-AOC)、MDA和GSH水平以及SOD活性.
1.2.8 TUNEL染色: 取胃黏膜组织石蜡切片, 脱蜡至水后, 用100 μL蛋白酶K工作液孵育15 min, 洗涤后, 滴加TUNEL反应液和DAPI染色液避光孵育, 荧光显微镜下观察TUNEL阳性细胞情况并拍照, 用于评估小鼠胃黏膜细胞的凋亡情况.
1.2.9 Western blot 检测: 取胃组织, 用RIPA裂解液提取蛋白, 采用BCA法对所提取的总蛋白进行定量. 依定量结果, 每组样本取60 μg蛋白质行SDS-PAGE蛋白凝胶电泳, 分离出目的蛋白后将其通过电转法转移至PVDF膜上, 加5%的脱脂乳粉室温封闭60 min, 依次孵育一抗和二抗, TBST洗涤后于暗室中滴加ECL化学发光液显影, 曝光胶片并通过Image J软件对结果进行灰度半定量分析.
统计学处理 所得数据录入GraphPad 8.3软件中进行统计学分析. 计数资料用χ2检验, 计量实验结果以均数±标准差(mean±SD)表示, 多组间的比较采用方差分析, 各组均数间的两两比较用Bonferroni校正的t检验, P<0.05表示有显著差异.
用快速尿素酶试验及Warthin-Starry银染色评估小鼠胃黏膜组织中H. pylori定植感染情况, 结果显示(图1A和图1B): 小鼠经过造模后, 快速尿素酶试验呈阳性, 且胃组织上皮细胞间以及黏液层均可观察到被染成黑色的H. pylori菌体; 此外, HE染色(图1C)可见明显的黏膜损伤. 说明造模成功, 可进行后续实验.
通过快速尿素酶试验定性和半定量方法综合判断各组小鼠胃黏膜的H. pylori的感染状态, 结果见表1所示, 模型组显示H. pylori感染; 与模型组比较, 低、中、高PAs剂量组小鼠胃黏膜的H. pylori的感染状态均明显降低(P<0.05), H. pylori根除率明显增加(P<0.05).
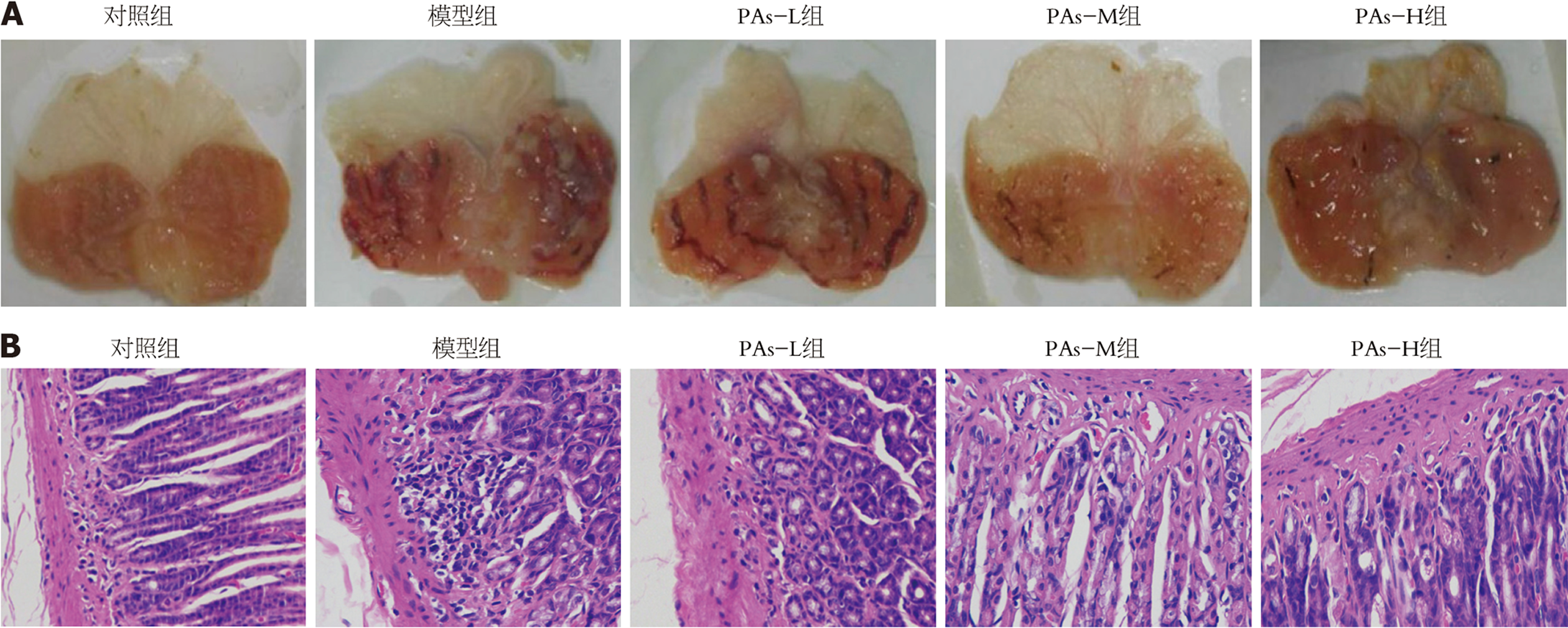
肉眼观察初步判断各组小鼠胃黏膜状态(图2A): 对照组小鼠胃黏膜表面光滑, 无出血点, 无萎缩现象; 模型组小鼠胃黏膜上可见明显的糜烂及溃疡面; 与模型组相比, PAs干预后, 中剂量及高剂量组小鼠胃黏膜表面溃疡及出血情况明显得到改善, 黏膜色泽红润, 无明显萎缩现象. HE染色结果显示(图2B): 对照组小鼠胃黏膜上皮结构完整, 细胞及相关腺体排列整齐有序, 无炎性浸润; 模型组线束胃部腺体排列紊乱, 上皮细胞出现明显的脱落缺失, 黏膜层可见明显炎性浸润; 与模型组相比, 给予中、高剂量PAs干预后, 黏膜损伤情况明显得到改善, 上皮结构趋于清晰, 腺体数量增多, 排列有序, 炎性浸润明显减轻.
各组小鼠胃黏膜组织氧化应激水平的检测结果如表2所示: 相较于对照组, 模型组小鼠胃黏膜组织中T-AOC和GSH水平及SOD活性显著降低(P<0.05), MDA的含量升高(P<0.05); 与H. pylori组比较, PAs可剂量依赖性提高小鼠胃黏膜组织抗氧化能力(T-AOC和GSH水平及SOD活性升高), 降低组织中MDA含量.
| 组别 | T-AOC(mmol/mg 蛋白) | MDA(nmol/mg蛋白) | GSH(μmol/mg蛋白) | SOD(U/mg蛋白) |
| 对照组 | 3.36±0.42 | 1.24±0.12 | 33.67±2.96 | 66.62±6.58 |
| 模型组 | 1.08±0.16a | 3.01±0.29a | 12.18±2.65a | 22.68±4.05a |
| PAs-L组 | 1.44±0.25b | 2.35±0.18b | 16.49±2.33b | 31.84±4.68b |
| PAs-M组 | 2.83±0.18b | 1.96±0.21b | 22.38±3.05b | 46.72±3.45b |
| PAs-H组 | 3.13±0.33b | 1.36±0.10b | 29.18±3.75b | 62.39±5.32b |
| F | 31.654 | 24.658 | 45.162 | 37.184 |
| P | <0.001 | <0.001 | <0.001 | <0.001 |
各组小鼠血清中炎症因子的水平检测结果如表3所示: 相较于对照组, 模型组小鼠血清中TNF-α、IL-1β和IL-8水平均显著升高(P<0.05); 与H. pylori组比较, PAs干预可剂量依赖性降低TNF-α、IL-1β和IL-8水平.
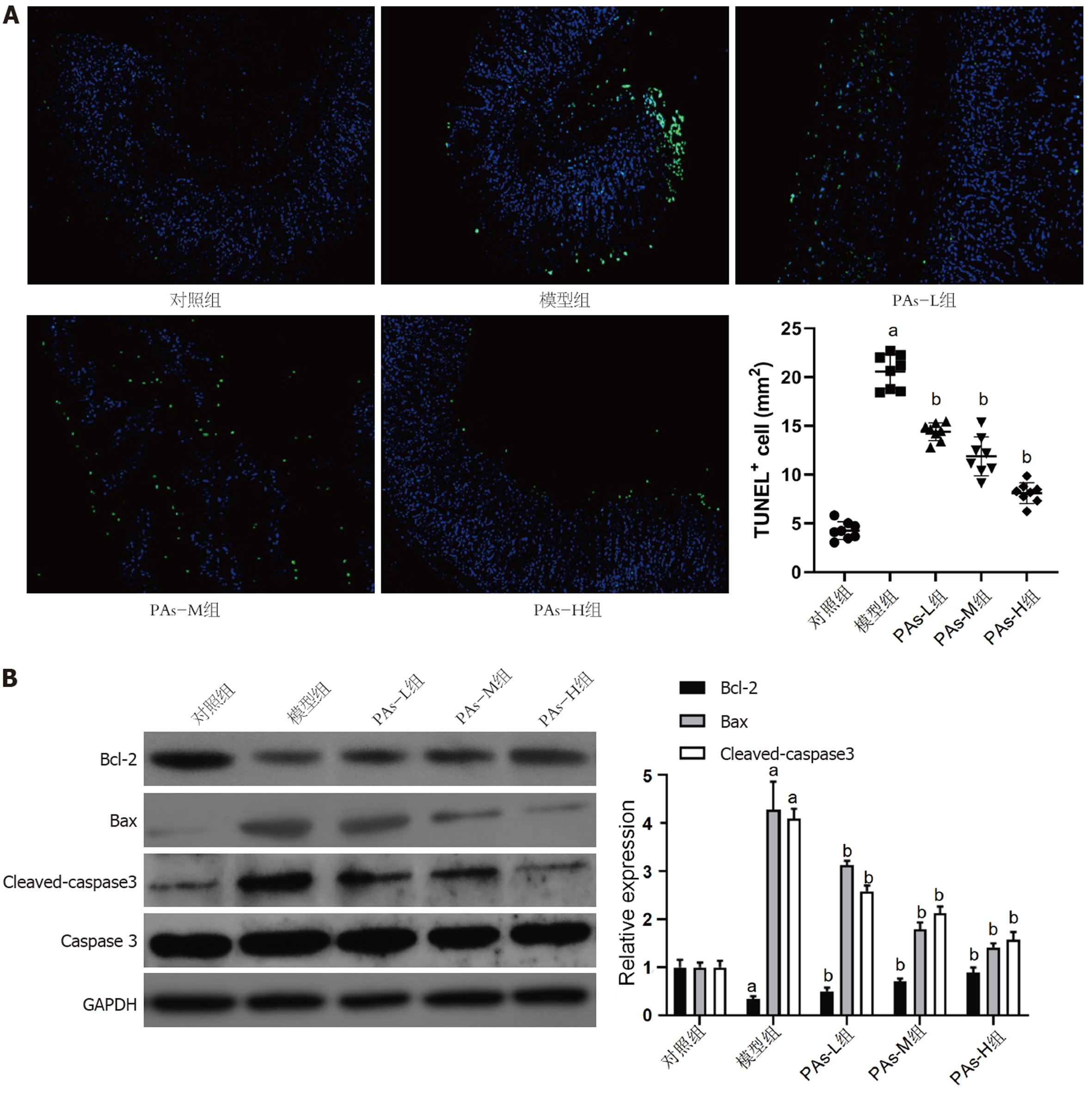
TUNEL染色检测PAs对H. pylori感染所致胃黏膜细胞凋亡的影响, 结果显示(图3A), 模型组小鼠胃黏膜组织中可检测到大量TUNEL阳性染色细胞; 与模型组比较, PAs可剂量依赖性降低TUNEL阳性染色细胞计数(P<0.05).
Western blot检测结果(图3B)显示, 与对照组相比, 模型组胃组织中Bcl-2表达显著降低(P<0.05), 而Bax和cleaved-caspase3的表达显著增加(P<0.05); 与模型组比较, PAs可剂量依赖性增加Bcl-2表达并降低Bax和cleaved-caspase3表达.
PAs是天然的抗氧化剂, 可用于预防或治疗与氧化应激有关的疾病, 包括癌症以及代谢、神经退行性疾病、心血管疾病和炎症性疾病[6]. 此外, 已发现PAs在H. pylori感染模型小鼠中具有清除H. pylori的作用[7,8], 但其是否能同时修复胃黏膜仍不明确. 因此, 本研究旨在探讨PAs对H. pylori感染所致胃黏膜损伤的作用及其机制. 肉眼观察及HE染色的结果显示PAs对H. pylori感染所致胃黏膜损伤具有修复作用.
H. pylori感染定植于胃黏膜所引起的各种胃肠相关疾病疾病与细菌本身毒力因子、宿主的炎症反应以及氧化应激状态等因素密切相关[10]. 氧化应激在H. pylori感染致胃黏膜损伤中发挥重要作用[10,11]. 既往研究显示, H. pylori感染后, 胃黏膜内生成大量活性氧(reactive oxygen species, ROS), 过量的ROS 能进一步通过氧化应激诱导胃上皮细胞凋亡, 加重黏膜损伤[10,11]. SOD和GSH能清除ROS, 其是减轻氧自由基损伤的主要抗氧化物质[12], T-AOC则是体内总抗氧化能力的体现[13]. 此外, MDA的含量通常可反映机体内脂质过氧化的程度, 间接地反映出细胞损伤的程度[12]. 提高胃黏膜组织中抗氧化酶活性能降低的氧化应激水平并减轻胃黏膜损伤[10,11]. 本研究结果显示PAs治疗可显著提高H. pylori感染小鼠胃黏膜组组中T-AOC、SOD和GSH的水平, 并降低MDA的含量, 结果提示, PAs可显著提高小鼠的抗氧化能力, 减轻H. pylori感染所致的胃黏膜氧化应激水平.
炎症反应不仅是胃炎病症的症状, 也是其驱动因素[10,14]. 在H. pylori感染所致的炎症反应中, 中性粒细胞和单核细胞的募集以及各种促炎因子的释放, 以及炎症级联放大效应能加重胃炎的进展[14]. Lokman等[6]研究已经表明PAs可通过抑制炎性因子(如IL-1β、IL-6和TNF-α等)释放来降低酸性乙醇构建的胃溃疡小鼠的胃炎严重程度. 本研究检测了在胃炎中能发挥主要促炎作用的细胞因子IL-1β、IL-8和TNF-α, 结果与之一致[7], 相较于模型组, PAs组小鼠血清中IL-1β、IL-8和TNF-α均降低, 结果提示, PAs可抑制H. pylori感染所致的炎症反应.
胃黏膜上皮细胞是保护胃黏膜下层组织的第一道防线, H. pylori感染定植可通过释放细胞毒素A和空泡毒素A等毒力因子以及脂多糖等刺激因子促进上皮细胞凋亡, 进而破坏黏膜的完整性[15,16]. 反之, 通过药物干预措施调节凋亡相关蛋白的表达进而抑制胃黏膜上皮细胞凋亡, 则能维持黏膜屏障的完整性[15,16]. 本研究检测了PAs在该过程中的作用, 结果显示, PAs干预可上调胃组织内抗凋亡蛋白Bcl-2的表达, 抑制促凋亡蛋白Bax和凋亡执行蛋白cleaved-caspase3的表达, 阻止H. pylori感染所致的胃黏膜上皮细胞凋亡. 以上结果提示PAs可通过调节凋亡相关蛋白的表达, 抑制H. pylori所致胃黏膜上皮细胞的凋亡; 然而该过程中涉及的具体凋亡机制及参与的信号通路还需进一步深入的研究.
综上所述, PAs可改善H. pylori感染所致的胃黏膜损伤, 作用机制可能与其降低H. pylori感染所致的胃黏膜氧化应激与炎症反应并调控凋亡相关蛋白的表达抑.
目前幽门螺杆菌(Helicobacter pylori, H. pylori)感染的一线治疗方案对受损的胃黏膜不具备修复作用, 且由于抗生素耐药率增高的原因造成疗效明显下降. 因此, 探索具有H. pylori清除功能且同时具有修复胃黏膜作用的治疗药剂尤为重要.
原花青素(proanthocyanidins, PAs)被发现具有清除H. pylori的功能, 且具有抗氧化、抗炎和抗溃疡的作用, 但其对H. pylori感染所致的胃黏膜损伤的作用及机制并不清楚.
探索PAs在H. pylori感染模型中是否具有修复胃黏膜损伤的作用并分析潜在的机制.
构建H. pylori感染模型的小鼠模型,并分别给予低、中、高剂量的PAs干预4 wk.观察胃黏膜的组织形态学表现; 检测H. pylori根除情况、血清中炎性因子水平、胃黏膜中氧化应激状态、上皮细胞凋亡水平及凋亡相关蛋白表达情况.
PAs剂量依赖性根除H. pylori, 降低血清中促炎因子水平和胃黏膜中氧化应激水平, 抑制胃黏膜上皮细胞凋亡并上调B细胞淋巴瘤-2蛋白表达, 抑制Bcl-2相关X蛋白和裂解的半胱氨酸蛋白酶3蛋白的表达.
PAs可能通过抗炎、抗氧化和抑制胃黏膜细胞凋亡来改善H. pylori感染所致的胃黏膜损伤.
PAs可能是有潜力的治疗H. pylori感染相关胃炎和胃溃疡的药物.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Waskito LA, Yamaoka Y. The Story of Helicobacter pylori: Depicting Human Migrations from the Phylogeography. Adv Exp Med Biol. 2019;1149:1-16. [PubMed] [DOI] |
| 2. | Chen YC, Malfertheiner P, Yu HT, Kuo CL, Chang YY, Meng FT, Wu YX, Hsiao JL, Chen MJ, Lin KP, Wu CY, Lin JT, O'Morain C, Megraud F, Lee WC, El-Omar EM, Wu MS, Liou JM. Global Prevalence of Helicobacter pylori Infection and Incidence of Gastric Cancer Between 1980 and 2022. Gastroenterology. 2024;166:605-619. [PubMed] [DOI] |
| 3. | Nabavi-Rad A, Azizi M, Jamshidizadeh S, Sadeghi A, Aghdaei HA, Yadegar A, Zali MR. The Effects of Vitamins and Micronutrients on Helicobacter pylori Pathogenicity, Survival, and Eradication: A Crosstalk between Micronutrients and Immune System. J Immunol Res. 2022;2022:4713684. [PubMed] [DOI] |
| 4. | Sahoo DK, Heilmann RM, Paital B, Patel A, Yadav VK, Wong D, Jergens AE. Oxidative stress, hormones, and effects of natural antioxidants on intestinal inflammation in inflammatory bowel disease. Front Endocrinol (Lausanne). 2023;14:1217165. [PubMed] [DOI] |
| 5. | Fenech MF, Bull CF, Van Klinken BJ. Protective Effects of Micronutrient Supplements, Phytochemicals and Phytochemical-Rich Beverages and Foods Against DNA Damage in Humans: A Systematic Review of Randomized Controlled Trials and Prospective Studies. Adv Nutr. 2023;14:1337-1358. [PubMed] [DOI] |
| 6. | Lokman MS, Zaafar D, Althagafi HA, Abdel Daim MM, Theyab A, Hasan Mufti A, Algahtani M, Habotta OA, Alghamdi AAA, Alsharif KF, Albrakati A, Oyouni AAA, Bauomy AA, Baty RS, Zhery AS, Hassan KE, Abdel Moneim AE, Kassab RB. Antiulcer activity of proanthocyanidins is mediated via suppression of oxidative, inflammatory, and apoptotic machineries. J Food Biochem. 2022;46:e14070. [PubMed] [DOI] |
| 7. | 上海华珠生物科技有限公司. 原花青素类化合物用于制备防治幽门螺杆菌相关性胃炎的药物和保健食品: CN200710037280.3. 2008-08-13. |
| 8. | 上海华珠生物科技有限公司. 防治幽门螺杆菌感染的组合物: CN200710037246.6. 2008-08-13. |
| 9. | Zhang W, Zhou Y, Fan Y, Cao R, Xu Y, Weng Z, Ye J, He C, Zhu Y, Wang X. Metal-Organic-Framework-Based Hydrogen-Release Platform for Multieffective Helicobacter Pylori Targeting Therapy and Intestinal Flora Protective Capabilities. Adv Mater. 2022;34:e2105738. [PubMed] [DOI] |
| 10. | Ansari S, Yamaoka Y. Helicobacter pylori Virulence Factors Exploiting Gastric Colonization and its Pathogenicity. Toxins (Basel). 2019;11. [PubMed] [DOI] |
| 11. | Han L, Shu X, Wang J. Helicobacter pylori-Mediated Oxidative Stress and Gastric Diseases: A Review. Front Microbiol. 2022;13:811258. [PubMed] [DOI] |
| 12. | Faggiano A, Gherbesi E, Avagimyan A, Ruscica M, Donisi L, Fedele MA, Cipolla CM, Vicenzi M, Carugo S, Cardinale D. Melatonin mitigates oxidative damage induced by anthracycline: a systematic-review and meta-analysis of murine models. Front Cardiovasc Med. 2023;10:1289384. [PubMed] [DOI] |
| 13. | Sun Y, Dong H, Zhan A, Wang W, Duan Y, Xie M, Liu Q, Li H, Zhang J. Protection of teprenone against hypoxia and reoxygenation stress in stomach and intestine of Lateolabrax maculatus. Fish Physiol Biochem. 2020;46:575-584. [PubMed] [DOI] |
| 14. | Lim NR, Chung WC. Helicobacter pylori-associated Chronic Atrophic Gastritis and Progression of Gastric Carcinogenesis. Korean J Gastroenterol. 2023;82:171-179. [PubMed] [DOI] |
| 15. | Wang C, Li W, Shao L, Zhou A, Zhao M, Li P, Zhang Z, Wu J. Both extracellular vesicles from helicobacter pylori-infected cells and helicobacter pylori outer membrane vesicles are involved in gastric/extragastric diseases. Eur J Med Res. 2023;28:484. [PubMed] [DOI] |
| 16. | Chen L, Wei S, He Y, Wang X, He T, Zhang A, Jing M, Li H, Wang R, Zhao Y. Treatment of Chronic Gastritis with Traditional Chinese Medicine: Pharmacological Activities and Mechanisms. Pharmaceuticals (Basel). 2023;16. [PubMed] [DOI] |