修回日期: 2024-03-07
接受日期: 2024-03-22
在线出版日期: 2024-04-28
胃癌根治术是治疗胃癌患者的主要手术, 但是存在术后感染的风险, 感染一旦发生, 发展迅速, 严重影响患者术后的身体恢复, 甚至危及生命. 对感染的早发现是治疗的关键.
分析胃癌根治术围术期血清白细胞介素(interleukin, IL)-6、肝素结合蛋白(heparin-binding protein, HBP)、T淋巴亚群水平变化及预测院内感染的价值, 为临床胃癌诊疗提供有利参考.
选取2020-01/2023-10于我院行胃癌根治术治疗, 术后发生院内感染的57例胃癌患者作为感染组, 另选同期未发生院内感染的63例患者作为未感染组. 比较两组血清IL-6、HBP、T淋巴亚群, 包括分化簇3+(cluster of differentation 3+, CD3+)、分化簇4+(cluster of differentation 4+, CD4+)、CD4+/CD8+水平, 并分析手术前后各指标变化值与院内感染病情程度的相关性、预测胃癌根治术后发生院内感染的价值.
感染组术后外周血白细胞(white blood cell, WBC)、血清降钙素原(procalcitonin, PCT)、IL-6、HBP水平高于未感染组, CD3+、CD4+、CD4+/CD8+水平低于未感染组, 且感染组△WBC、△PCT、△IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+均大于未感染组(均为P<0.05); 重度感染患者△IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+均大于轻度感染患者(P<0.05); 感染组△IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+均与院内感染病情程度呈正相关(P<0.05); △WBC、△PCT、△IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+预测胃癌患者胃癌根治术后发生院内感染的受试者工作特征曲线和曲线下面积分别为0.792、0.769、0.810、0.762、0.748、0.772、0.820, △IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+预测院内感染的AUC与△WBC、△PCT比较, 差异无统计学意义; 与各指标单独预测比较, 联合预测的AUC明显增大, NRI、IDI均>0(P<0.05).
胃癌根治术围术期血清IL-6、HBP、T淋巴亚群水平变化与患者院内感染的发生及感染程度密切相关, IL-6、HBP、CD3+、CD4+、CD4+/CD8+动态变化联合预测院内感染具有较高价值.
核心提要: 围术期血清白介素6、肝素结合蛋白、T淋巴亚群水平反映胃癌根治术患者早期感染情况的灵敏度较高, 利于术后感染患者的治疗康复.
引文著录: 毛莉莉, 孙艳, 姜文兰. 胃癌根治术围术期血清IL-6、HBP、T淋巴亚群水平变化及预测院内感染的价值分析. 世界华人消化杂志 2024; 32(4): 285-292
Revised: March 7, 2024
Accepted: March 22, 2024
Published online: April 28, 2024
Radical gastrectomy is the main operation for the treatment of gastric cancer patients, but there is a risk of postoperative infection. Once the infection occurs, it develops rapidly, seriously affecting the postoperative recovery of patients and even endangering their lives. Thus, early detection of such infection is key to the treatment of gastric cancer.
To analyze the changes of serum interleukin-6 (IL-6), heparin-binding protein (HBP) and T-lymphoid subsets during the perioperative period of radical gastrectomy and to assess their value in predicting nosocomial infections.
Fifty-seven gastric cancer patients who underwent radical gastric cancer treatment at our hospital from January 2021 to October 2023 and developed nosocomial infections after surgery were selected as an infection group, and 63 patients who did not develop nosocomial infections in the same period were selected as an uninfected group. The levels of serum IL-6, HBP, and T-lymphocyte subgroups (CD3+, CD4+, and CD4+/CD8+ ratio) before and after the operation were compared between the two groups. The correlation between the changes of the above indexes and the severity of nosocomial infection was analyzed, and their value in predicting the occurrence of nosocomial infections after radical surgery for gastric cancer was assessed.
Postoperative peripheral blood white blood cell count (WBC) and serum PCT, IL-6, and HBP levels were higher in the infected group than in the uninfected group, CD3+ and CD4+ T-lymphocytes and CD4+/CD8+ ratio were lower than those in the uninfected group, and △WBC, △PCT, △IL-6, △HBP, △CD3+, △CD4+, and △CD4+/CD8+ ratio in the infected group were greater than those in the uninfected group (P < 0.05 for all). In the infection group, their were 32 cases of mild infection and 25 cases of severe infection. In patients with severe infection, △IL-6, △HBP, △CD3+, △CD4+, and △CD4+/CD8+ ratio were higher than those of patients with mild infection (P < 0.05). In the infection group, △IL-6, △HBP, △CD3+, △CD4+, and △CD4+/CD8+ ratio were positively correlated with the severity of nosocomial infection (P < 0.05). The area under the curve (AUC) values of WBC, △PCT, △IL-6, △HBP, △CD3+, △CD4+, and △CD4+/CD8+ ratio in predicting nosocomial infections in patients with gastric cancer after radical gastrectomy were 0.792, 0.769, 0.810, 0.762, 0.748, 0.772, and 0.820, respectively, and the AUC values of △IL-6, △HBP, △CD3+, △CD4+, and △CD4+/CD8+ ratio in predicting hospital-acquired infections were not statistically different from those of △WBC and △PCT (P > 0.05). Compared with individual prediction with each indicator, the AUC of the joint prediction significantly increased, with both net reclassification improvement and integrated discrimination improvement being greater than 0 (P < 0.05).
The changes of serum IL-6, HBP, and T-lymphocyte subsets during the perioperative period of radical gastrectomy are closely related to the occurrence and severity of nosocomial infection. The dynamic changes of IL-6, HBP, CD3+ and CD4+ T-lymphocyte subsets, and CD4+/CD8+ ratio are of high value in predicting nosocomial infections.
- Citation: Mao LL, Sun Y, Jiang WL. Value of changes in perioperative serum interleukin-6, heparin-binding protein, and T-lymphocyte subpopulations in predicting nosocomial infections in radical gastric cancer surgery. Shijie Huaren Xiaohua Zazhi 2024; 32(4): 285-292
- URL: https://www.wjgnet.com/1009-3079/full/v32/i4/285.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i4.285
胃癌根治术是早期胃癌患者常用的根治性治疗方式, 可有效提升胃癌患者术后生存率; 但该术式创伤较大、涉及消化道重建、操作复杂, 术中肠道或胃内容物易污染腹腔, 加之患者抵抗力下降, 胃癌根治术后易并发腹腔感染、切口感染、肺部感染等院内感染从而增加患者不良预后风险[1-3]. 通常术后感染早期无典型临床症状, 而一旦感染加重则迅速进展, 严重影响患者术后恢复及生存, 因此早期监测院内感染尤为重要. 近年有研究发现感染患者中血清白细胞介素(interleukin, IL)-6、肝素结合蛋白(heparin-binding protein, HBP)对存在异常表达, 在术后感染早期具有一定诊断价值[4,5]. 而不同血清指标对机体感染的反映存在敏感度、特异度差异, 单一指标预测效能欠佳. T淋巴亚群可反映机体免疫功能, 有报道显示胃癌患者免疫状态与术后感染有关[6]. 本研究分析了胃癌根治术后血清中IL-6、HBP及T淋巴亚群的动态变化, 并探讨了其对院内感染的预测价值, 旨在为临床监测预防围术期院内感染、提高手术效果、促进术后恢复提供有力依据. 现报告如下.
本研究征得我院伦理委员会和患者家属签字同意. 选取2020-01/2023-10于我院行胃癌根治术治疗, 术后发生院内感染的57例胃癌患者作为感染组, 另选同期未发生院内感染的63例患者未感染组, 120胃癌患者中男72例, 女48例, 年龄40-76岁, 平均(57.53±8.37)岁, 体重指数18-27 kg/m2, 平均(22.62±1.85) kg/m2; 病灶部位: 胃窦40例(33.33%), 胃底37例(30.83%), 胃体43例(35.83%); 肿瘤分期: Ⅰ期36例(30%), Ⅱ期64例(53.33%), Ⅲ期20例(16.67); 病理类型: 胃非黏液癌, 其中低分化腺癌52例(43.33%), 中高分化腺癌68例(56.67%); 手术方式: 开腹手术32例(26.67%), 腹腔镜手术88例(73.33%); 抗生素预防感染95例(79.17%).
纳入标准: (1)符合《中华医学会胃癌临床诊疗指南(2021版)》[7]胃非黏液癌相关诊断标准; (2)肿瘤分期Ⅰ-Ⅱ期; (3)接受胃癌根治术; (4)术前无放化疗等相关治疗史; (5)无自身免疫疾病; (6)卡氏评分>60分.
排除标准: (1)预计生存期不足6 mo; (2)伴有胃癌根治术禁忌症; (3)存在严重营养不良; (4)伴有其他恶性肿瘤; (5)存在肝、心等重要脏器病变; (6)术前机体已存在感染; (7)精神异常; (8)存在腹水或远处转移.
1.2.1 实验室指标检测: 术前1 d、术后第3 d分别采集受检者4 mL空腹静脉血, 以酶联免疫吸附法测定血清IL-6、HBP水平, 采用流式细胞仪(美国贝克曼库尔特, FC-500型)检测T淋巴亚群(血清CD3+、CD4+、CD4+/CD8+)水平.
1.2.2 院内感染诊断主要包括: 肺部感染、切口感染、腹腔感染, 诊断标准参考中华医学会制定的《医院感染诊断标准(试行)》[8]、《医院获得性肺炎诊断和治疗指南(草案)》[9].
1.2.3 感染程度判定[10]: 采用感染可能性评分(infection probability score, IPS)评估, 包含心率(12分)、呼吸频率(1分)、体温(2分)、C反应蛋白(6分)、白细胞计数(3分)、序贯性器官功能衰竭(2分); 一般感染: IPS评分<13分, 重症感染: IPS评分≥13分.
(1)统计胃癌根治术围术期院内感染发生情况; (2)比较感染组、未感染组临床资料(性别、体重指数、肿瘤分期、病理类型、病灶部位、手术方式、抗生素预防感染情况)、血清IL-6、HBP、T淋巴亚群水平; (3)比较感染组不同病情程度血清IL-6、HBP、T淋巴亚群变化值; (4)分析血清IL-6、HBP、T淋巴亚群变化值与院内感染病情程度的相关性; (5)分析血清IL-6、HBP、T淋巴亚群变化值预测院内感染的价值; (6)比较血清IL-6、HBP、T淋巴亚群变化值单独与联合预测院内感染的价值.
统计学处理 采用SPSS 23.0对数据进行分析, 计量资料以(mean±SD)表示, 差异行t检验, 计数资料以n(%)表示, 差异行χ2检验, 以Spearman相关性分析血清IL-6、HBP、T淋巴亚群变化值与院内感染病情程度的相关性, 采用受试者工作特征(receiver operating characteristic, ROC)曲线分析血清IL-6、HBP、T淋巴亚群变化值预测院内感染的价值, 检验水准α = 0.05.
两组临床资料、术前体温、外周血白细胞(white blood cell, WBC)、血清降钙素原(procalcitonin, PCT)、IL-6、HBP、CD3+、CD4+、CD4+/CD8+水平比较差异无统计学意义; 感染组术后外周血WBC、血清PCT、IL-6、HBP水平高于未感染组, CD3+、CD4+、CD4+/CD8+水平低于未感染组, 且感染组△WBC、△PCT、△IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+均大于未感染组(均为P<0.05). 见表1.
| 组别 | 感染组(n = 57) | 未感染组(n = 63) | χ2/t | P |
| 性别(男/女) | 32/25 | 40/23 | 0.674 | 0.412 |
| 年龄(岁) | 58.31±8.24 | 56.82±7.91 | 1.010 | 0.315 |
| 体重指数(kg/m2) | 22.86±1.74 | 22.41±1.56 | 1.494 | 0.138 |
| 肿瘤分期 | 0.345 | 0.842 | ||
| Ⅰ期 | 16(28.07) | 20(31.75) | ||
| Ⅱ期 | 32(56.14) | 32(50.79) | ||
| Ⅲ期 | 9(15.79) | 11(17.46) | ||
| 病理类型 | 0.720 | 0.396 | ||
| 高分化腺癌 | 30(52.63) | 38(60.32) | ||
| 低分化腺癌 | 27(47.37) | 25(39.68) | ||
| 病灶部位 | 1.050 | 0.789 | ||
| 胃窦 | 20(35.09) | 20(31.75) | ||
| 胃底贲门 | 15(26.32) | 22(34.92) | ||
| 胃体 | 22(38.60) | 21(33.33) | ||
| 手术方式 | 2.468 | 0.116 | ||
| 开腹手术 | 19(33.33) | 13(20.63) | ||
| 腹腔镜手术 | 38(66.67) | 50(79.37) | ||
| 抗生素预防感染 | 42(73.68) | 53(84.13) | 1.979 | 0.160 |
| 体温 | ||||
| 术前 | 36.91±0.18 | 36.87±0.17 | 1.252 | 0.213 |
| 术后 | 36.98±0.19 | 36.94±0.15 | 1.256 | 0.201 |
| △体温 | 0.07±0.02 | 0.07±0.01 | 0.000 | 1.000 |
| WBC(×109/L) | ||||
| 术前 | 6.91±1.42 | 6.75±1.36 | 0.630 | 0.530 |
| 术后 | 12.54±3.18 | 10.26±2.73 | 4.225 | <0.001 |
| △WBC | 5.63±1.76 | 3.51±1.08 | 8.036 | <0.001 |
| PCT(ng/mL) | ||||
| 术前 | 0.68±0.17 | 0.65±0.15 | 1.027 | 0.307 |
| 术后 | 1.61±0.43 | 0.94±0.27 | 10.323 | <0.001 |
| △PCT | 0.93±0.26 | 0.29±0.09 | 18.366 | <0.001 |
| IL-6(ng/mL) | ||||
| 术前 | 43.51±14.22 | 40.83±12.51 | 1.098 | 0.274 |
| 术后 | 206.39±59.74 | 95.71±30.80 | 12.932 | <0.001 |
| △IL-6 | 162.88±52.81 | 54.88±17.69 | 15.316 | <0.001 |
| HBP(ng/L) | ||||
| 术前 | 28.13±8.97 | 25.96±8.52 | 1.359 | 0.177 |
| 术后 | 107.83±34.28 | 59.43±19.31 | 9.645 | <0.001 |
| △HBP | 79.70±25.84 | 33.47±10.91 | 12.983 | <0.001 |
| CD3+(%) | ||||
| 术前 | 64.93±5.88 | 66.21±6.49 | 1.128 | 0.262 |
| 术后 | 55.31±4.19 | 59.71±4.63 | 5.438 | <0.001 |
| △CD3+ | 9.62±3.14 | 4.50±1.48 | 11.600 | <0.001 |
| CD4+(%) | ||||
| 术前 | 39.41±5.28 | 40.36±5.41 | 0.972 | 0.333 |
| 术后 | 32.29±4.35 | 36.83±4.67 | 5.493 | <0.001 |
| △CD4+ | 7.12±2.29 | 3.53±1.14 | 11.027 | <0.001 |
| CD4+/CD8+ | ||||
| 术前 | 1.38±0.26 | 1.41±0.28 | 0.606 | 0.546 |
| 术后 | 0.92±0.19 | 1.15±0.21 | 6.267 | <0.001 |
| △CD4+/CD8+ | 0.46±0.15 | 0.26±0.08 | 9.233 | <0.001 |
感染组病情程度为: 轻度感染32例, 重度感染25例. 重度感染患者△IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+均大于轻度感染患者(P<0.05). 见表2.
| 组别 | n | △IL-6 | △HBP | △CD3+ | △CD4+ | △CD4+/CD8+ |
| 重度感染 | 25 | 181.43±42.16 | 91.26±21.89 | 10.79±2.46 | 8.46±2.11 | 0.56±0.13 |
| 轻度感染 | 32 | 148.39±37.28 | 70.67±19.54 | 8.71±2.29 | 6.07±1.95 | 0.38±0.11 |
| t | 3.135 | 3.745 | 3.294 | 4.430 | 5.660 | |
| P | 0.003 | <0.001 | 0.002 | <0.001 | <0.001 |
△CD4+、△CD4+/CD8+均与院内感染病情程度(赋值: 轻度感染 = 1, 重度感染 = 2)呈正相关(P<0.05). 见表3.
| 指标 | △IL-6 | △HBP | △CD3+ | △CD4+ | △CD4+/CD8+ | |
| 院内感染病情程度 | r | 0.326 | 0.405 | 0.371 | 0.426 | 0.480 |
| P | 0.007 | 0.001 | 0.003 | <0.001 | <0.001 | |
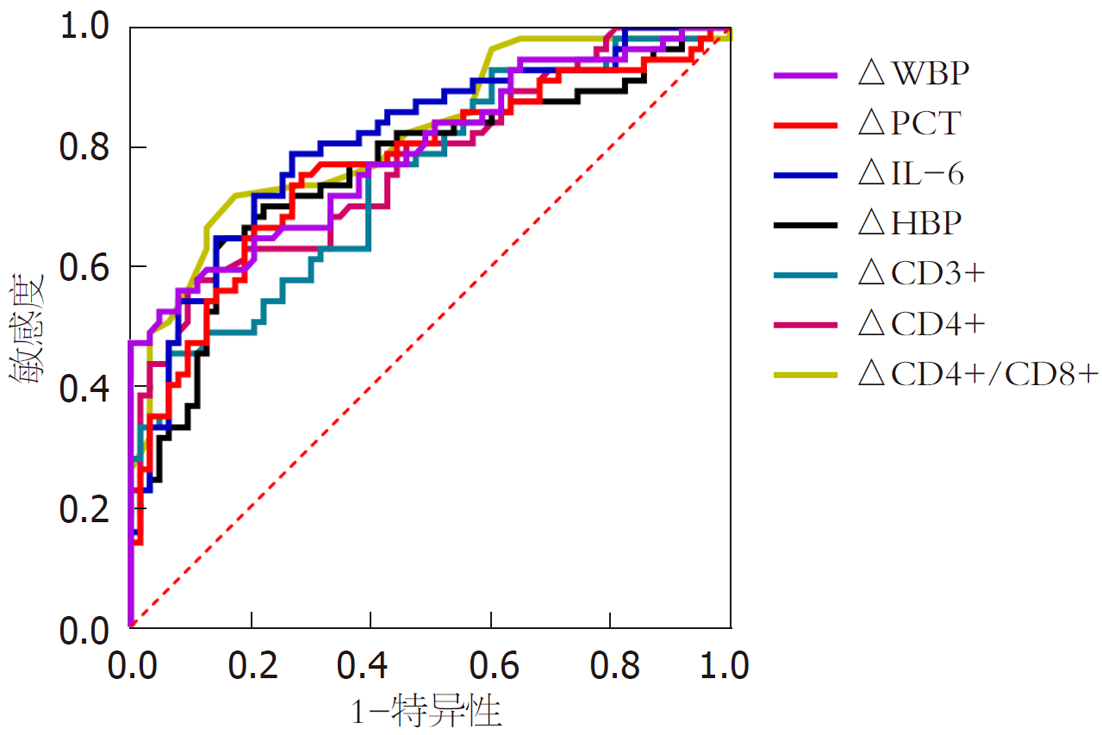
以感染组为阳性样本, 未感染组为阴性样本, 绘制△WBC、△PCT、△IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+预测胃癌患者胃癌根治术后发生院内感染的ROC曲线, 结果显示各指标预测院内感染的AUC分别为0.792、0.769、0.810、0.762、0.748、0.772、0.820, △IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+预测院内感染的AUC与△WBC、△PCT比较, 差异无统计学意义. 见表4、图1.
| 指标 | AUC | 95%CI | 截断值 | 敏感度 | 特异度 | P |
| △WBC | 0.792 | 0.709-0.861 | 5.47 | 56.14 | 92.06 | <0.001 |
| △PCT | 0.769 | 0.684-0.841 | 64.87 | 75.44 | 71.43 | <0.001 |
| △IL-6 | 0.810 | 0.728-0.876 | 120.01 | 78.95 | 73.02 | <0.001 |
| △HBP | 0.762 | 0.676-0.835 | 60.98 | 64.91 | 84.13 | <0.001 |
| △CD3+ | 0.748 | 0.660-0.823 | 7.12 | 45.61 | 93.65 | <0.001 |
| △CD4+ | 0.772 | 0.687-0.844 | 5.90 | 57.89 | 88.89 | <0.001 |
| △CD4+/CD8+ | 0.820 | 0.740-0.843 | 0.40 | 71.93 | 82.54 | <0.001 |
绘制△IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+联合预测胃癌患者胃癌根治术后发生院内感染的ROC曲线, 结果显示, 联合预测的AUC为0.901(95%CI: 0.833-0.948), 预测敏感度、特异度分别为91.23%、80.95%. 与各指标单独预测比较, 联合预测的AUC明显增大, NRI、IDI均>0(P<0.05). 见表5.
| 成对对比 | AUC差异(95%CI, P) | NRI(95%CI, P) | IDI(95%CI, P) |
| 联合-△IL-6 | 0.091(0.008-0.190, 0.416) | 0.041(0.021-0.079, 0.021) | 0.054(0.031-0.095, 0.018) |
| 联合-△HBP | 0.139(0.037-0.242, 0.008) | 0.055(0.035-0.086, 0.017) | 0.069(0.043-0.112, 0.012) |
| 联合-△CD3+ | 0.153(0.051-0.256, 0.003) | 0.036(0.019-0.068, 0.030) | 0.046(0.026-0.082, 0.019) |
| 联合-△CD4+ | 0.129(0.025-0.233, 0.015) | 0.043(0.023-0.081, 0.019) | 0.060(0.036-0.099, 0.014) |
| 联合-△CD4+/CD8+ | 0.081(0.014-0.176, 0.037) | 0.030(0.015-0.060, 0.037) | 0.046(0.028-0.076, 0.020) |
胃癌根治术过程中创伤较大、创面暴露时间较长, 为细菌定植提供了有利条件, 且胃癌患者多存在营养不良、免疫力低下, 增加了感染风险, 不利于患者预后[11,12]. 肺部感染是影响胃癌根治术预后的重要因素[13]. 有研究证实, 有效降低胃癌患者术后感染对术后恢复、预后改善及生存期延长有积极意义[14].
IL-6是分泌于免疫细胞的炎症敏感指标, 具有促进单核细胞聚集、T细胞增殖的作用, 在其在血清中的水平越高说明机体创伤或感染越严重[15,16]. 陈海等[17]显示外科术后腹腔感染患者IL-6、超敏C反应蛋白等存在异常升高. Jerome等[18]报道显示IL-6是诊断行腹部手术患者术后感染的高性能的生物标志物. 本研究显示感染组术后血清IL-6水平高于未感染组, 且△IL-6大于未感染组, 说明感染后IL-6异常高表达, 对临床决策有一定指导意义. HBP是主要存在于中性粒细胞的蛋白分子, 可诱导血管水肿形成、促进炎症反应、破坏机体血管屏障, 损害器官功能[19]. 本研究感染组术后血清HBP水平高于未感染组, 且△HBP大于未感染组. 许家亮等[20]报道表明, 胃癌根治术后发生感染并发症患者血清HBP水平高于未发生感染并发症患者. 李晓慧等[21]研究显示ICU重症感染生存患者血清HBP水平低于病死患者, 以上均与本研究结果相似. CD3+、CD4+是调节免疫反应、辅助B细胞合成抗体的T细胞代表CD8+可抑制细胞毒性T淋巴细胞, 平衡免疫系统[22,23]. 感染一旦发生, 会一定程度抑制机体免疫功能, 促使CD3+、CD4+降低, CD8+升高[24]. 感染组CD3+、CD4+、CD4+/CD8+水平低于未感染组, 且△CD3+、△CD4+、△CD4+/CD8+均大于未感染组, 这提示了T淋巴亚群可能参与感染的细胞免疫过程, 与胃癌根治术后院内感染发生有关. 于宗平等学者[25]研究指出, 胃癌患者手术前后T淋巴亚群水平变化与术后感染性并发症明显相关, CD4+/CD8+<1是胃癌术后感染的危险因素. 另外, 本研究中重度感染患者△IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+均大于轻度感染患者, 且进行相关性分析发现, 上述指标均与院内感染病情程度呈正相关. 表明胃癌根治术后发生院内感染, 机体受到炎症反应刺激, 血清IL-6、HBP水平呈现高表达, 故监测血清IL-6、HBP水平变化有助于诊断患者是否发生相关感染并发症, 为早期治疗提供帮助, 改善预后. 本研究进一步绘制ROC曲线分析发现: 绘制△WBC、△PCT、△IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+预测胃癌患者胃癌根治术后发生院内感染的ROC曲线AUC均大于0.7, △IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+预测院内感染的AUC与基本参数△WBC、△PCT比较无明显差异. △IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+联合预测胃癌患者胃癌根治术后发生院内感染的AUC为0.901, 与各指标单独预测比较, 联合预测的AUC明显增大, NRI、IDI均>0. 说明在临床可联合检测上述指标, 观察期动态变化情况, 有效预测胃癌根治术后院内感染发生风险.
综上所述, 血清IL-6、HBP、CD3+、CD4+、CD4+/CD8+变化与胃癌根治术患者院内感染密切相关, 且与感染程度相关, 联合IL-6、HBP、T淋巴亚群水平动态变化对院内感染的预测价值较高. 但本研究未探究不同部位的感染是否对各项指标产生不同的影响, 这是本研究的不足之处, 未来工作中会进一步深入探讨.
胃癌根治术对患者造成的创口较大, 伤口的恢复对术后护理的要求较高, 愈合的时间也较长, 同时, 患者的免疫力普遍较低, 细菌容易附着繁殖引发感染, 对患者健康造成较大影响.
经过胃癌根治术治疗的患者, 发生感染的概率较高, 感染初期容易治愈, 但是处理不当, 发展较快, 对生命产生威胁. 因此, 通过检测早发现、早治疗对感染患者具有重要意义.
发生感染后, 血清中白细胞介素(interleukin, IL)-6、肝素结合蛋白(heparin-binding protein, HBP)及T淋巴亚群会发生动态变化, 本研究观察以上因子的变化, 探讨其与院内感染的相关性, 为促进术后恢复提供有效的检测标志物.
本研究严格按照医学研究随机分组的方法, 通过检测血液中几种与感染相关的标志物在胃癌根治术围术期的变化, 观察并分析各指标与院内感染病情程度的相关性.
与未感染组相比, 感染组术后外周血白细胞(white blood cell, WBC)、血清降钙素原(procalcitonin, PCT)、IL-6、HBP、△WBC、△PCT、△IL-6、△HBP、△CD3+、△CD4+、△CD4+/CD8+水平更高, CD3+、CD4+、CD4+/CD8+水平更低. △CD4+、△CD4+/CD8+均与院内感染病情程度呈正相关. 联合预测感染的灵敏度更高.
胃癌根治术患者围术期内血清IL-6、HBP、T淋巴亚水平变化与院内感染的发生率和感染程度均相关, 联合检测能够提高感染检测的敏感度, 具有较高的临床价值.
本研究为临床诊断胃癌根治术患者术后感染的早发现提供了几种分子标志物, 具有一定的临床意义. 但是感染部位的不同是否会对相关指标产生类似的影响, 本研究并未涉及, 需要在接下来的研究中深入探讨.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Jiang Y, Yang F, Ma J, Zhang N, Zhang C, Li G, Li Z. Surgical and oncological outcomes of distal gastrectomy compared to total gastrectomy for middle-third gastric cancer: A systematic review and meta-analysis. Oncol Lett. 2022;24:291. [PubMed] [DOI] |
| 2. | Zizzo M, Zanelli M, Sanguedolce F, Palicelli A, Ascani S, Morini A, Tumiati D, Mereu F, Zuliani AL, Nardecchia M, Gatto F, Zanni M, Giunta A. Gastrectomy with or without Complete Omentectomy for Advanced Gastric Cancer: A Meta-Analysis. Medicina (Kaunas). 2022;58. [PubMed] [DOI] |
| 3. | Meng X, Wang L, Zhu B, Sun T, Guo S, Wang Y, Zhang J, Yang D, Zheng G, Zhang T, Zheng Z, Zhao Y. Totally Laparoscopic Gastrectomy Versus Laparoscopic-Assisted Gastrectomy for Gastric Cancer: A Systematic Review and Meta-Analysis. J Laparoendosc Adv Surg Tech A. 2021;31:676-691. [PubMed] [DOI] |
| 4. | Skonieczna-Żydecka K, Kaczmarczyk M, Łoniewski I, Lara LF, Koulaouzidis A, Misera A, Maciejewska D, Marlicz W. A Systematic Review, Meta-Analysis, and Meta-Regression Evaluating the Efficacy and Mechanisms of Action of Probiotics and Synbiotics in the Prevention of Surgical Site Infections and Surgery-Related Complications. J Clin Med. 2018;7. [PubMed] [DOI] |
| 5. | Wu YL, Yo CH, Hsu WT, Qian F, Wu BS, Dou QL, Lee CC. Accuracy of Heparin-Binding Protein in Diagnosing Sepsis: A Systematic Review and Meta-Analysis. Crit Care Med. 2021;49:e80-e90. [PubMed] [DOI] |
| 6. | 李 东霞, 黄 淑俊, 邓 颖辉, 陈 泓磊, 温 月娥. sTREM-1,PCT,CD4+/CD8+与老年食管癌术后肺部感染相关性及预测价值. 中华医院感染学杂志. 2020;30:4. [DOI] |
| 10. | 赵 茜, 郭 慧, 吕 畅, 马 志超, 马 佳倩, 李 建国. 感染可能性评分及血清胆碱酯酶和淀粉样蛋白A与危重症感染患者生存情况的关系. 中国医药. 2020;15:1891-1895. [DOI] |
| 11. | 马 勇, 杨 建栋, 罗 涌, 谢 正勇, 罗 逸潜. 血清PCT、CRP以及T淋巴细胞亚群的动态变化及与胃癌患者术后感染性并发症的关系. 现代生物医学进展. 2019;19:3857-3861. [DOI] |
| 12. | Yang J, Wang Z, Dong K, Zhang R, Xiao K, Shang L, Li L. Safety and efficacy of indocyanine green fluorescence imaging-guided radical gastrectomy: a systematic review and meta-analysis. Expert Rev Gastroenterol Hepatol. 2021;15:1319-1328. [PubMed] [DOI] |
| 13. | Murnane LC, Forsyth AK, Koukounaras J, Pilgrim CHC, Shaw K, Brown WA, Mourtzakis M, Tierney AC, Burton PR. Low muscularity increases the risk for post-operative pneumonia and delays recovery from complications after oesophago-gastric cancer resection. ANZ J Surg. 2021;91:2683-2689. [PubMed] [DOI] |
| 14. | Cowling J, Gorman B, Riaz A, Bundred JR, Kamarajah SK, Evans RPT, Singh P, Griffiths EA. Peri-operative Outcomes and Survival Following Palliative Gastrectomy for Gastric Cancer: a Systematic Review and Meta-analysis. J Gastrointest Cancer. 2021;52:41-56. [PubMed] [DOI] |
| 15. | Kastrati K, Aletaha D, Burmester GR, Chwala E, Dejaco C, Dougados M, McInnes IB, Ravelli A, Sattar N, Stamm TA, Takeuchi T, Trauner M, van der Heijde D, Voshaar MJH, Winthrop K, Smolen JS, Kerschbaumer A. A systematic literature review informing the consensus statement on efficacy and safety of pharmacological treatment with interleukin-6 pathway inhibition with biological DMARDs in immune-mediated inflammatory diseases. RMD Open. 2022;8. [PubMed] [DOI] |
| 16. | Paval DR, Patton R, McDonald J, Skipworth RJE, Gallagher IJ, Laird BJ; Caledonian Cachexia Collaborative. A systematic review examining the relationship between cytokines and cachexia in incurable cancer. J Cachexia Sarcopenia Muscle. 2022;13:824-838. [PubMed] [DOI] |
| 17. | 陈 海, 李 华敏, 江 振剑, 陈 晓君, 符 映. 以替加环素为基础的联合用药对重症加强护理病房多重耐药鲍曼不动杆菌外科术后腹腔感染患者降钙素原、超敏C反应蛋白及白细胞介素6的影响. 中国医师进修杂志. 2022;45:934-937. [DOI] |
| 18. | Jerome E, McPhail MJ, Menon K. Diagnostic accuracy of procalcitonin and interleukin-6 for postoperative infection in major gastrointestinal surgery: a systematic review and meta-analysis. Ann R Coll Surg Engl. 2022;104:561-570. [PubMed] [DOI] |
| 21. | 李 晓慧, 岳 胜, 杜 小静, 秦 秉玉, 梁 凯. ICU重症感染患者血清C-反应蛋白、内毒素、肝素结合蛋白水平及其预测价值. 中华医院感染学杂志. 2020;30:2647-2651. [DOI] |
| 22. | Xin F, Mzee SAS, Botwe G, He H, Zhiyu S, Gong C, Said ST, Jixing C. Short-term evaluation of immune levels and nutritional values of EN versus PN in gastric cancer: a systematic review and a meta-analysis. World J Surg Oncol. 2019;17:114. [PubMed] [DOI] |
| 23. | Liu K, Yang T, Peng XF, Lv SM, Ye XL, Zhao TS, Li JC, Shao ZJ, Lu QB, Li JY, Liu W. A systematic meta-analysis of immune signatures in patients with COVID-19. Rev Med Virol. 2021;31:e2195. [PubMed] [DOI] |
| 24. | Zainaldain H, Rizvi FS, Rafiemanesh H, Alizadeh M, Jamee M, Mohammadi S, Kiaee F, Mohammadi H, Babaie F, Yazdani R, Abolhassani H, Aghamohammadi A, Azizi G. Infectious Complications Reporting in Common Variable Immunodeficiency: A Systematic Review and Meta-analysis. Oman Med J. 2020;35:e157. [PubMed] [DOI] |