修回日期: 2024-11-26
接受日期: 2024-12-17
在线出版日期: 2024-12-28
鞘氨醇-1-磷酸转运体2(spinster homolog 2, SPNS2)参与了多种肿瘤的生物学作用, 然而其在结直肠癌(colorectal cancer, CRC)中的表达情况及功能尚不明晰.
探讨SPNS2在CRC中的表达及其对SW620细胞增殖、侵袭和迁移的作用和潜在生物学机制.
在癌症基因组图谱(Cancer Genome Atlas, TGCA)数据库中检索CRC的表达谱数据, 利用R软件分析SPNS2在CRC及正常组织中的表达差异; 同时利用人类蛋白质图谱(Human Protein Atlas, HPA)数据库对其验证; 并通过Kaplan-Meier Plotter网站分析其与患者预后的关系. 通过转染si-SPNS2下调SW620细胞中SPNS2的表达后, 采用WST-8法、克隆形成实验、划痕分析及Transwell小室侵袭实验检测增殖、迁移与侵袭; 同时, 通过Western blot分析细胞增殖、上皮间质转化(epithelial-mesenchymal transition, EMT)及磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase, PI3K)/蛋白激酶B(protein kinase B, PKB, AKT)信号通路相关蛋白的表达水平.
TCGA表达谱数据分析结果显示SPNS2在CRC组织中显著高表达, 此发现得到了HPA数据库的验证. Kaplan-Meier Plotter分析显示, 高表达SPNS2的患者预后较差. 相较于对照组, 转染si-SPNS2可显著抑制SW620细胞中SPNS2的表达, 且SW620细胞增殖能力显著下降, 克隆形成率、细胞迁移率以及细胞侵袭率均明显降低; western blot基因表达检测显示, 敲减SPNS2可上调SW620细胞中E-钙黏蛋白的表达, 下调增殖细胞核抗原、Ki-67抗原、N-钙黏蛋白、Snail、基质金属蛋白酶9、p-PI3K/PI3K、p-AKT/AKT的表达水平.
SPNS2在CRC中呈上调表达. 敲减SPNS2能够抑制SW620细胞的增殖、侵袭及迁移,其机制可能与对增殖、EMT 以及PI3K/AKT信号通路相关蛋白表达的调节有关.
核心提要: 鞘氨醇-1-磷酸转运体2在结直肠癌组织中的表达呈上调态势, 对其表达进行靶向抑制或许能够抑制结直肠癌细胞的增殖、侵袭与迁移.
引文著录: 冯星星, 王佳洁, 董爱琴. SPNS2在结直肠癌中的表达及其对结直肠癌细胞增殖与迁移的作用. 世界华人消化杂志 2024; 32(12): 919-926
Revised: November 26, 2024
Accepted: December 17, 2024
Published online: December 28, 2024
Sphingosine-1-phosphate transporter 2 (SPNS2) is involved in various tumor biological processes, but its expression status and function in colorectal cancer (CRC) have not been clarified yet.
To investigate SPNS2 expression in CRC tissues and explore its role and mechanisms in proliferation, invasion, and migration of SW620 cells.
The expression profile data of CRC were retrieved from the Cancer Genome Atlas (TCGA) database. The expression difference of SPNS2 in CRC and normal tissues was analyzed using R, and verified using the Human Protein Atlas (HPA) database. The relationship between SPNS2 expression and the prognosis of patients was analyzed through the Kaplan-Meier Plotter website. After downregulating the expression of SPNS2 in SW620 cells by transfecting si-SPNS2, the proliferation, migration and invasion capabilities of the cells were assessed through the WST-8 assay, colony formation assay, scratch assay, and Transwell cell invasion assay. Concurrently, the expression levels of proteins related to cell proliferation, epithelial-mesenchymal transition (EMT), and the phosphatidylinositol 3-kinase (PI3K)/protein kinase B (PKB, AKT) signaling pathway were analyzed via Western blot.
The TCGA expression profile data analysis showed that SPNS2 was significantly upregulated in CRC tissues, which was confirmed using the HPA database. Kaplan-Meier Plotter analysis showed that patients with high expression of SPNS2 had a poor prognosis. Compared to the control group, transfection with si-SPNS2 significantly inhibited SPNS2 expression in SW620 cells, leading to a notable reduction in their proliferation capability, colony formation rate, cell migration rate, and cell invasion rate. Additionally, Western blot analysis indicated that SPNS2 knockdown resulted in increased E-cadherin expression in SW620 cells, while simultaneously decreasing the expression levels of proliferating cell nuclear antigen, Ki-67 antigen, N-cadherin, Snail, matrix metallopeptidase 9, p-PI3K/PI3K, and p-AKT/AKT.
SPNS2 is upregulated in CRC. Knockdown of SPNS2 can inhibit the proliferation, invasion, and migration of SW620 cells, and the mechanism may be related to the regulation of proliferation, EMT, and expression of PI3K/AKT signaling pathway-related proteins.
- Citation: Feng XX, Wang JJ, Dong AQ. Expression of SPNS2 in colorectal cancer and its role in colorectal cell proliferation and migration. Shijie Huaren Xiaohua Zazhi 2024; 32(12): 919-926
- URL: https://www.wjgnet.com/1009-3079/full/v32/i12/919.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i12.919
结直肠癌(colorectal cancer, CRC)为全球范围内发病率与死亡率皆居高位的恶性肿瘤之一[1], 其发病机制复杂, 涉及多条分子通路的异常[2]. 随着诊疗理念和技术的发展以及肿瘤相关分子生物学的深入研究, 靶向治疗和生物免疫治疗为提高CRC患者生存质量和生存率提供了新的方向[3,4]. 因此, 深入研究CRC的分子机制, 寻找新的生物标志物和治疗靶点依然具有重要的临床意义. 鞘氨醇-1-磷酸转运体2(spinster homolog 2, SPNS2)属于主要协助转运蛋白超家族, 是一种与细胞膜脂质代谢相关的转运蛋白[5], 已被确认其涉及多种生物学活动, 包括细胞增殖和迁移[5,6]. 近年来, 其在肿瘤中的作用日渐受到关注[7]. Lu等[8]的研究显示, SPNS2在口腔鳞癌组织中表达显著低于正常组织样本; 而在三阴性乳腺癌中, SPNS2可发挥原癌基因样作用[9]. Jiang等[10]在CRC中的研究提示, 长链非编码RNA HOXA-AS3可通过与miR-4319/SPNS2形成竞争性內源RNA网络调控CRC细胞的恶性生物学行为. 然而SPNS2在CRC中的具体作用仍需大量的临床及基础实验进行系统的研究和验证. 基于此, 本研究通过生物信息学分析和相应的实验验证对CRC中SPNS2的表达进行系统的分析, 并初步探讨了其对CRC细胞系SW620恶性生物学行为的影响和潜在的分子机制.
人CRC细胞系SW620购自中科院上海细胞库; 小分子干扰RNA(si-SPNS2)及其阴性对照siRNA(si-NC)由上海吉玛公司合成; LipoFectMax细胞转染试剂、Trizol试剂、WST-8细胞活性分析试剂盒、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)和β-肌动蛋白(β-actin)抗体购自武汉安迪福诺生物科技有限公司; SYBR Green qPCR预混液购自武汉科斯坦生物科技有限公司; E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase, PI3K)、磷酸化PI3K(Phospho-PI3K, p-PI3K)抗体购自美国CST公司; 增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、Ki-67抗原(Ki-67 antigen, Ki-67)、基质金属蛋白酶9(matrix metalloprotein 9, MMP-9)、蛋白激酶B(protein kinase B, AKT)、磷酸化AKT(Phospho-AKT, p-AKT)抗体以及SPNS2抗体购自美国Abcam公司; Snail 抗体购自美国Santa Cruz公司.
1.2.1 基于TCGA数据库分析CRC中SPNS2的表达和HPA数据库验证: 通过UCSC Xena网站(https://xena.ucsc.edu/)下载癌症基因组图谱(Cancer Genome Atlas, TCGA)数据库中COAD&READ的RNA-Seq数据及临床数据. 将数据载入R软件(version 4.3.3), 提取SPNS2 mRNA原始表达矩阵, 并分析SPNS2在正常样品及肿瘤样品中的差异表达情况, ggplot2软件包对数据进行可视化. 利用人类蛋白质图谱数据库(Human Protein Atls, HPA; https://www.proteinatlas.org/)对CRC组织和正常组织中SPNS2蛋白的表达情况进行验证.
1.2.2 Kaplan-Meier Plotter网站生存分析: 采用Kaplan-Meier Plotter网站(https://kmplot.com/analysis/)评估SPNS2的表达与患者总生存期(overall survival, OS)和无复发生存期(recurrence-free survival, RFS)之间的关系.
1.2.3 SW620细胞常规培养及细胞转染: 人结直肠癌细胞系SW620常规培养. 选取生长状态良好的细胞进行转染, 操作如下: 实验分组设置为空白对照组(Ctrl)、阴性转染对照组(转染si-NC)及SPNS2敲减组(转染si-SPNS2); 依据以上实验分组配置转染试剂, 转染后培养48 h.
1.2.4 WST-8检测: 各组细胞经相应转染处理后, 接种至96孔板中(密度: 1000个/孔), 细胞常规培养于CO2细胞培养箱中, 并分别于0 h、24 h、48 h及72 h时用WST-8染料孵育4 h, 通过酶标仪(OD570)评估各组的相对细胞活性.
1.2.5 克隆形成实验: 各组细胞接种至6孔板中(密度: 500个/孔), 细胞常规培养, 14 d后取出培养板, 固定细胞并以0.1%结晶紫染液染色, 对细胞克隆计数.
1.2.6 划痕实验: 各组细胞接种至6孔板中, 待细胞密度达到90%左右, 用200 μL无菌枪头在各孔中垂直划线, 磷酸盐缓冲液洗去脱落细胞, 倒置相差显微镜下观察并拍照(记为0 h), 继续置于培养箱中常规培养. 24 h后, 取出培养板, 同一视野下观察拍照(记为24 h). 结果录入电脑经Image J软件分析细胞迁移情况.
1.2.7 Transwell细胞侵袭实验: 各组细胞制成无血清细胞悬液, 继而添加入预先涂覆基质胶的 Transwell 小室中; 下室则加入常规细胞培养基, 将装置放于细胞培养箱中继续培养24 h, 侵袭进入底部的细胞经甲醛固定和结晶紫染色后, 于显微镜下观察并计数穿膜细胞的数量.
1.2.8 RT-qPCR 检测: 采用Trizol一步法抽提各组细胞内总RNA, 逆转录后经荧光定量PCR分析SPNS2 mRNA的相对表达量. PCR反应条件: 95 ℃ 30 s, 然后40个循环[95 ℃ 5 s, 55 ℃ 30 s, 72 ℃ 30 s]. 引物序列: SPNS2正向引物序列为5'-TTACTGGCTCCAGCGTGA-3', 反向引物序列为5'-TGATCATGCCCAGGACAG-3'; 内参GAPDH正向引物序列为5'-ACCTGACCTGCCGTCTAGAA-3', 反向引物序列为5'- TCCACCACCCTGTTGCTGTA-3'. 以2-△△CT法计算SPNS2 mRNA表达水平.
1.2.9 Western blot检测: 超声裂解提取细胞的总蛋白, 定量后, 取等量(70 μg/泳道)蛋白进行电泳分离与转印. 加5%的脱脂乳粉室温封闭蛋白90 min, 依据说明书要求, 依次孵育一抗SPNS2(1:1500)、PCNA(1:500)、Ki-67(1:500)、E-cadherin(1:3000)、Snail(1:2000)、N-cadherin(1:4000)、MMP-9(1:3000)、PI3K(1:5000)、AKT(1:4000)、p-PI3K(1:1000)、p-AKT(1:1000)、β-actin(1:10000)、GAPDH(1:10000)和HRP标记二抗, ECL发光试剂显像, Image J软件对目的蛋白的表达进行灰度半定量分析.
统计学处理 所得数据录入Graphpad 8.3软件或R4.3.3软件中进行统计学分析及可视化. 结果以均数±标准差(mean±SD)表示, 采用方差分析数据差异性, P<0.05表示有显著差异.
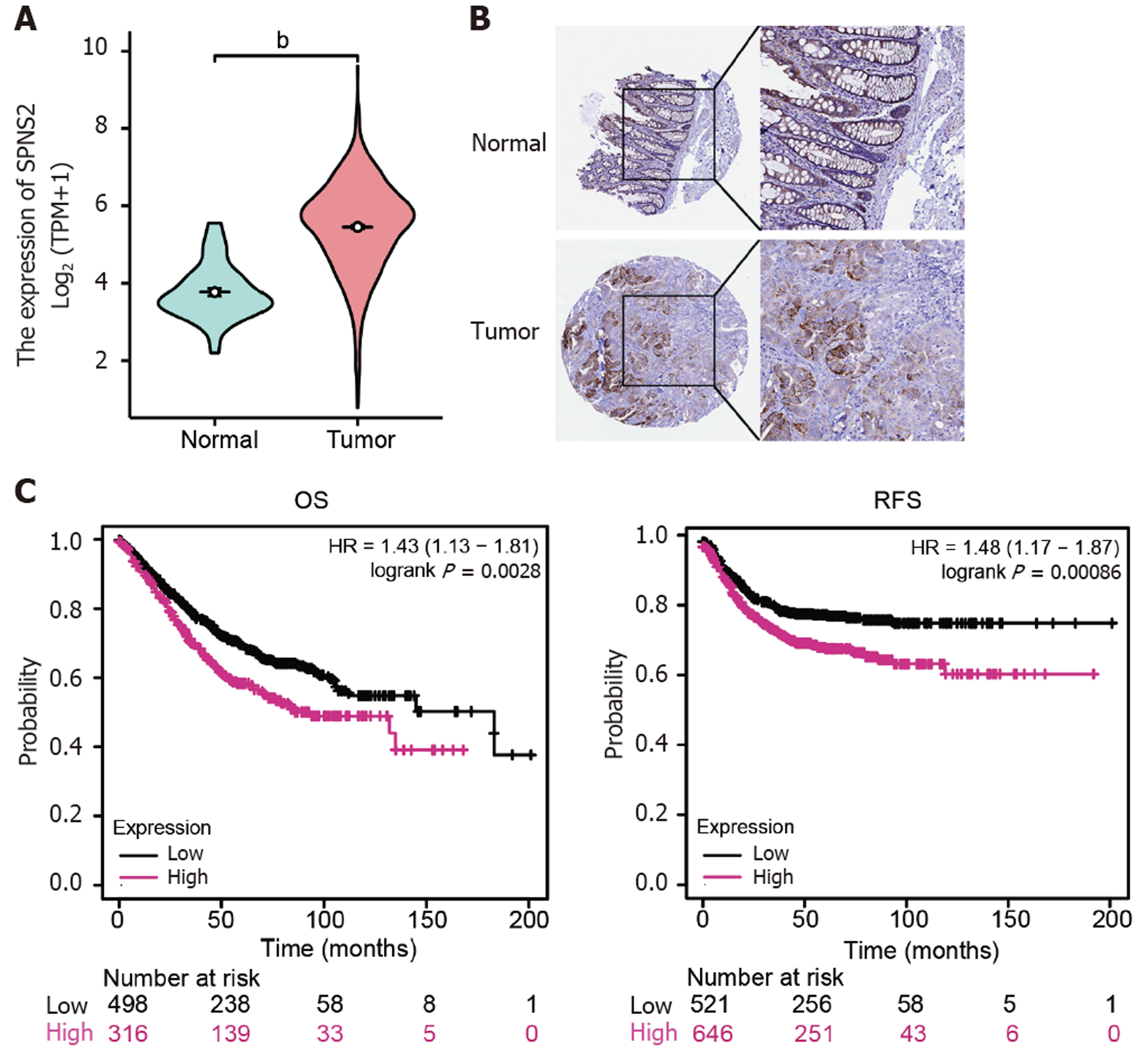
利用R软件分析TCGA数据库提取的CRC基因表达矩阵, 结果显示(图1A): 相较于癌旁组织, SPNS2在CRC组织中的表达明显升高; HPA数据库验证(图1B)显示, SPNS2在CRC肿瘤组织胞浆/胞膜呈强阳性染色, 在正常结肠组织中染色强度较弱. 通过Kaplan-Meier Plotter生存分析结果如图1C所示, SPNS2高表达的患者具有较差的OS和RFS.
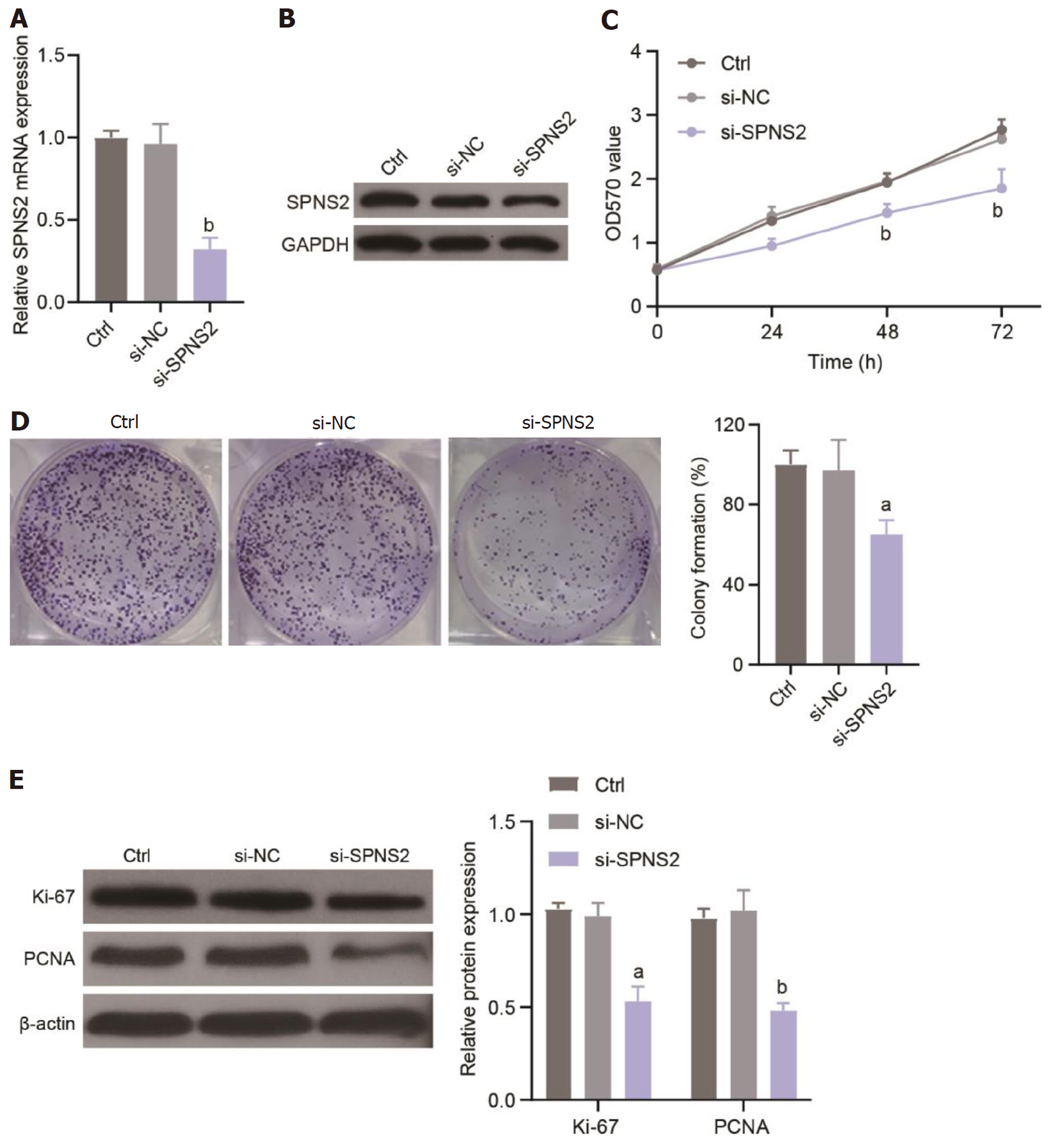
转染靶向干扰SPNS2的siRNA, 转染效率检测如图2A和B所示: 相较于对照组, si-SPNS2组SW620中SPNS2的表达显著减低, 可用于后续功能学实验分析. WST-8法分析敲减SPNS2后SW620细胞活性的变化, 结果如图2C所示: si-SPNS2组SW620细胞活性在48 h和72 h显著低于si-NC组(P<0.01). 克隆形成实验(图2D)同样显示: 转染si-SPNS2可显著抑制SW620细胞的克隆形成能力. 进一步采用Western blot检测各组细胞内增殖相关蛋白PCDA和Ki-67的表达情况, 结果显示(图2E): 相较于si-NC组, si-SPNS2组PCDA和Ki-67的蛋白表达水平均显著降低. 结果表明敲减SPNS2可抑制SW620细胞增殖.
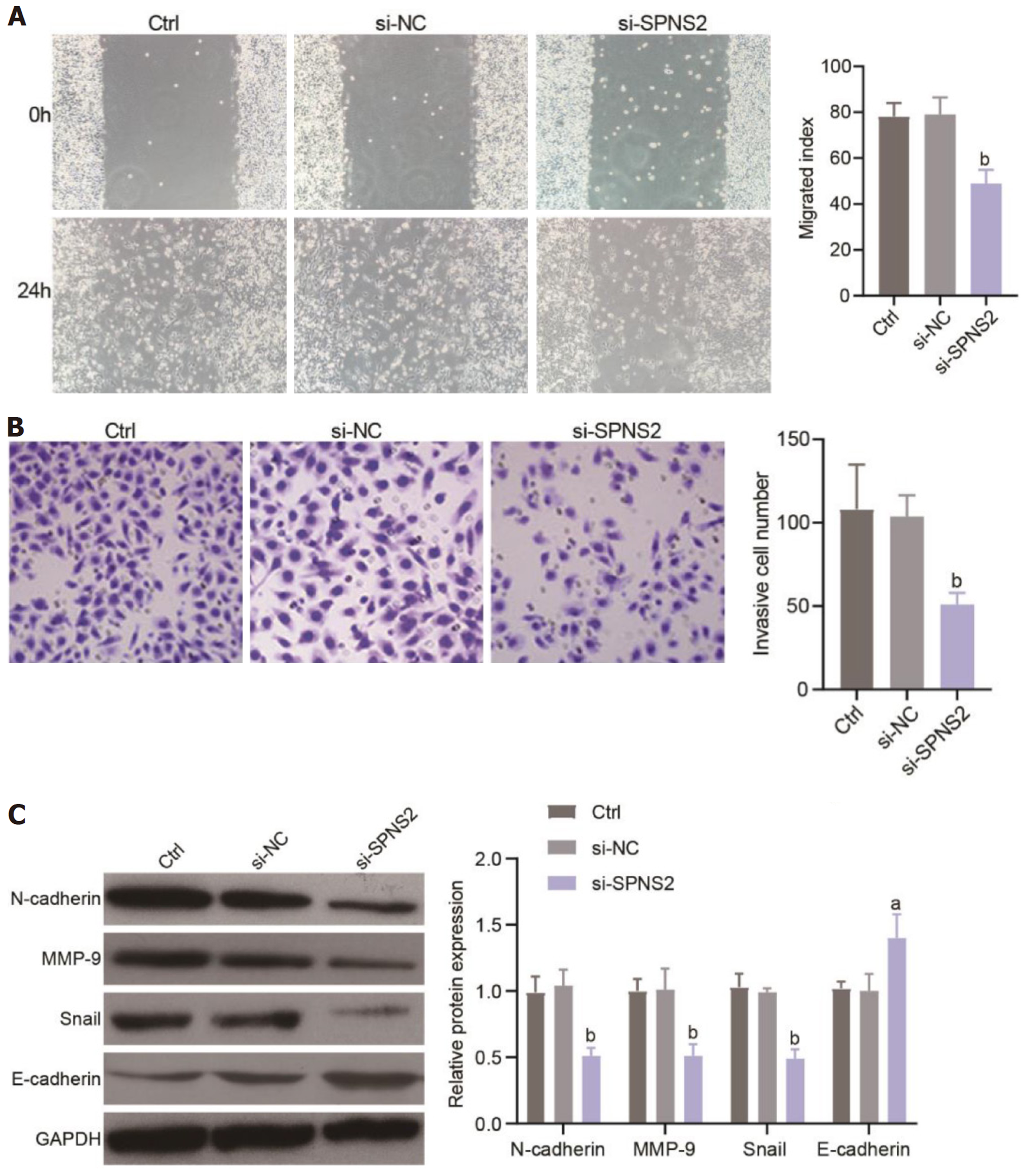
划痕实验结果显示(图3A): si-NC组和si-SPNS2组细胞的迁移指数分别为(78.96±7.46)%和(48.84±6.02)%, 差异有统计学意义(P = 0.005). Transwell细胞侵袭实验结果显示(图3B): si-NC组和 si-SPNS2组穿膜细胞分别为103.7±12.84和50.92±6.99, 差异有统计学意义(P = 0.003).
Western blot 检测上皮间质转化(epithelial-mesenchymal transition, EMT)相关蛋白的表达, 结果显示(图3C): 相较于si-NC组, si-SPNS2组细胞内N-cadherin(P = 0.002)、MMP-9(P = 0.009)以及Snail(P = 0.0003)的蛋白表达水平均显著降低, E-cadherin(P = 0.036)的蛋白表达水平明显升高. 结果表明敲减SPNS2可抑制EMT进程, 进而影响SW620细胞侵袭和迁移.
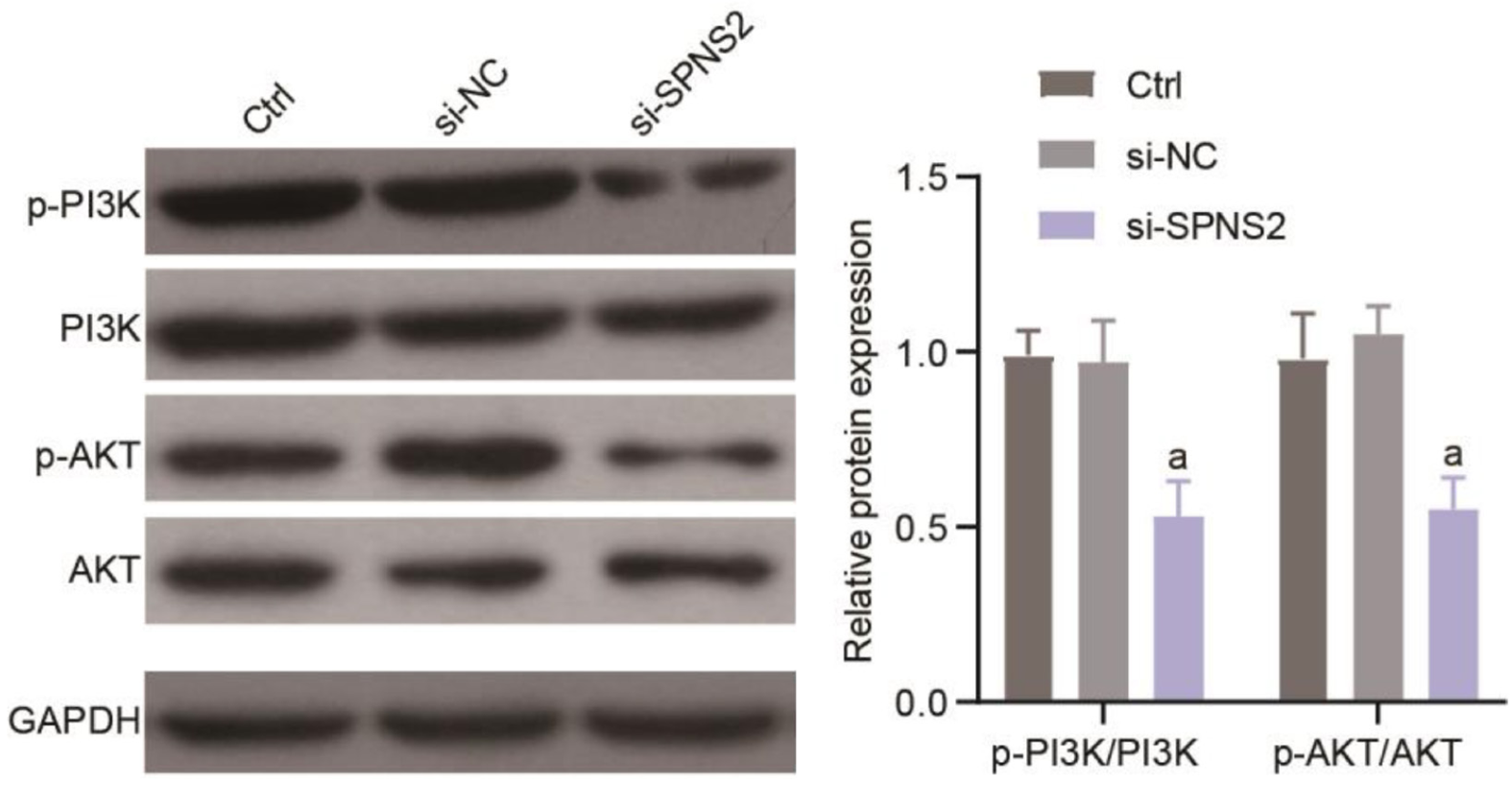
为探讨敲减SPNS2抑制结直肠癌细胞SW620增殖与迁移的潜在作用机制, 本研究通过对SPNS2相关文献进行分析, 选取对细胞生长发育至关重要的PI3K/AKT信号通路做进一步探索, Western blot结果如图4显示: 相较于si-NC组, si-SPNS2组p-PI3K/PI3K、p-AKT/AKT的水平均显著降低(P<0.05).
前期的文献调研表明, SPNS2虽然可参与调控癌症的进展, 但在不同类型的肿瘤中, 发挥的作用也不尽相同[7-10]. 本研究聚焦于CRC, 旨在分析SPNS2在癌组织中的表达特征及其对癌细胞增殖、侵袭及迁移等的影响. 本研究通过对TCGA数据库中CRC表达谱数据进行生物信息学分析, 并在HPA数据库中进行免疫组化验证, 结果表明SPNS2在CRC组织中高表达; 进一步利用Kaplan-Meier Plotter网站进行生存分析, 发现SPNS2高表达患者的预后较差, 提示SPNS2可能参与影响CRC进展.
肿瘤进展与肿瘤细胞的多种恶性生物学行为之间存在密切联系[11]. 本研究进一步通过对CRC细胞系SW620进行相关的功能学研究, 初步探讨SPNS2对癌细胞增殖、侵袭及迁移等恶性生物学行为的影响, 结果显示, 敲减细胞内SPNS2的表达可抑制SW620细胞的增殖、侵袭和迁移. 基于以上表型的相关变化, 本研究推测SPNS2对细胞的影响可能与其EMT进程有关. EMT是细胞由上皮表型向间充质表型变化的一个过程, 这也是肿瘤细胞获得侵袭特征的一个关键环节, 对肿瘤的浸润、转移和生长至关重要[12]. EMT的发展需要多种转录因子的参与, 其中包括维持上皮细胞表型的E-cadherin. 在EMT进展过程中, E-cadherin表达减少, 而N-cadherin表达增加, 呈现所谓的"钙黏素转换", 进而导致肿瘤细胞粘附能力下降, 促进其侵袭和迁移[13]. 此外, EMT进程还受Snail和MMP蛋白的调控[14]. 本研究对这些关键蛋白进行了检测, 结果显示, 敲减SPNS2可下调SW620细胞中N-cadherin、MMP-9以及Snail的蛋白表达水平, 同时上调E-cadherin的蛋白表达水平. 结果表明敲减SPNS2可抑制EMT进程, 这可能是其影响SW620细胞恶性生物学行为潜在机制之一.
肿瘤细胞EMT进程的激活与细胞内各种复杂的型号通路有着密不可分的联系. 研究表明, 肿瘤微环境可通过某些特殊的信号分子, 激活上皮细胞中的信号通路, 包括Wnt、Notch、PI3K等常见的信号通路, 进而诱导EMT[15,16]. 本研究通过对相关文献进行分析[17], 选取PI3K/AKT信号通路做进一步探索, 结果表明敲减SPNS2可抑制PI3K/AKT信号活性. 这可能是调控EMT及恶性表型的潜在机制, 然而信号通路往往是通过复杂的调控网络共同发挥作用, 该过程中是否还有其他信号的参与, 以及彼此之间的相互作用还需进一步深入的研究.
综上所述, SPNS2在CRC中高表达, 敲减SPNS2能够抑制SW620细胞的增殖、侵袭及迁移,其机制可能与对增殖、EMT以及PI3K/AKT信号通路相关蛋白表达的调节有关. 这些发现为CRC的生物标志物筛选和靶向治疗提供了新的思路, 未来可进一步探索SPNS2在CRC中的临床应用潜力.
鞘氨醇-1-磷酸转运体2(spinster homolog 2, SPNS2)在多种肿瘤的进展与预后中发挥重要作用, 而其对结直肠癌(colorectal cancer, CRC)中的影响尚不清楚.
探讨SPNS2在CRC中的作用及机制.
明确SPNS2对CRC进展与预后的影响; 并以SW620细胞为研究对象, 阐明敲减SPNS2对细胞增殖、迁移的影响及机制.
基于生物信息学方法剖析SPNS2在CRC中的表达及其对CRC患者预后的影响; 以SW620细胞为研究对象, 探究敲减SPNS2对其增殖、侵袭与迁移的效应以及相关蛋白表达所受的影响.
SPNS2在CRC组织中上调表达且预示患者预后不良; 敲减SPNS2能抑制SW620细胞的增殖、迁移与侵袭, 并调节细胞增殖、上皮间质转化及磷脂酰肌醇3激酶/蛋白激酶B信号通路相关蛋白的表达.
SPNS2在CRC组织中上调表达, 并发挥促癌作用.
SPNS2或许具备作为CRC预后及靶向治疗的生物标志物的潜力.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Baidoun F, Elshiwy K, Elkeraie Y, Merjaneh Z, Khoudari G, Sarmini MT, Gad M, Al-Husseini M, Saad A. Colorectal Cancer Epidemiology: Recent Trends and Impact on Outcomes. Curr Drug Targets. 2021;22:998-1009. [PubMed] [DOI] |
| 2. | Li J, Ma X, Chakravarti D, Shalapour S, DePinho RA. Genetic and biological hallmarks of colorectal cancer. Genes Dev. 2021;35:787-820. [PubMed] [DOI] |
| 3. | Shin AE, Giancotti FG, Rustgi AK. Metastatic colorectal cancer: mechanisms and emerging therapeutics. Trends Pharmacol Sci. 2023;44:222-236. [PubMed] [DOI] |
| 4. | Underwood PW, Ruff SM, Pawlik TM. Update on Targeted Therapy and Immunotherapy for Metastatic Colorectal Cancer. Cells. 2024;13. [PubMed] [DOI] |
| 5. | Chen H, Ahmed S, Zhao H, Elghobashi-Meinhardt N, Dai Y, Kim JH, McDonald JG, Li X, Lee CH. Structural and functional insights into Spns2-mediated transport of sphingosine-1-phosphate. Cell. 2023;186:2644-2655.e16. [PubMed] [DOI] |
| 6. | Zhu X, Ren K, Zeng YZ, Zheng Z, Yi GH. Biological function of SPNS2: From zebrafish to human. Mol Immunol. 2018;103:55-62. [PubMed] [DOI] |
| 7. | Fang L, Hou J, Cao Y, Shan JJ, Zhao J. Spinster homolog 2 in cancers, its functions and mechanisms. Cell Signal. 2021;77:109821. [PubMed] [DOI] |
| 8. | Lu JW, Tseng YS, Lo YS, Lin YM, Yeh CM, Lin SH. Prognostic Significance of Cytoplasmic SPNS2 Expression in Patients with Oral Squamous Cell Carcinoma. Medicina (Kaunas). 2021;57. [PubMed] [DOI] |
| 9. | Weng W, Huang H. LINC01503 promotes the cell proliferation, migration and invasion of triple-negative breast cancer as a ceRNA to elevate SPNS2 expression by sponging miR-335-5p. Heliyon. 2024;10:e36531. [PubMed] [DOI] |
| 10. | Jiang Y, Yu XY, Sun HX, Gu XY, Geng JS. Long non-coding RNA HOXA-AS3 facilitates the malignancy in colorectal cancer by miR-4319/SPNS2 axis. J Physiol Biochem. 2021;77:653-666. [PubMed] [DOI] |
| 11. | Hanahan D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022;12:31-46. [PubMed] [DOI] |
| 12. | Gundamaraju R, Lu W, Paul MK, Jha NK, Gupta PK, Ojha S, Chattopadhyay I, Rao PV, Ghavami S. Autophagy and EMT in cancer and metastasis: Who controls whom? Biochim Biophys Acta Mol Basis Dis. 2022;1868:166431. [PubMed] [DOI] |
| 13. | Kaszak I, Witkowska-Piłaszewicz O, Niewiadomska Z, Dworecka-Kaszak B, Ngosa Toka F, Jurka P. Role of Cadherins in Cancer-A Review. Int J Mol Sci. 2020;21. [PubMed] [DOI] |
| 14. | Thiery JP. EMT: An Update. Methods Mol Biol. 2021;2179:35-39. [PubMed] [DOI] |
| 15. | Xue W, Yang L, Chen C, Ashrafizadeh M, Tian Y, Sun R. Wnt/β-catenin-driven EMT regulation in human cancers. Cell Mol Life Sci. 2024;81:79. [PubMed] [DOI] |
| 16. | Ang HL, Mohan CD, Shanmugam MK, Leong HC, Makvandi P, Rangappa KS, Bishayee A, Kumar AP, Sethi G. Mechanism of epithelial-mesenchymal transition in cancer and its regulation by natural compounds. Med Res Rev. 2023;43:1141-1200. [PubMed] [DOI] |
| 17. | Liang W, Liu M, Su Y, Wen Y, Wang L, Shan J, Zhao J, Xie K, Wang J. Spinster homolog 2 reduces malignancies of glioblastoma via PTEN/PI3K/AKT pathway. IUBMB Life. 2024;76:140-160. [PubMed] [DOI] |