修回日期: 2024-11-26
接受日期: 2024-12-17
在线出版日期: 2024-12-28
在肝硬化疾病中, 不仅血小板计数会发生变化, 血小板功能也会随之发生变化. 那么, 在不同时期肝硬化患者中, 血小板计数和血小板功能的变化一样吗?两者之间的变化有何关系?这都值得我们进一步探究.
探讨代偿期与失代偿期肝硬化患者血小板计数与功能的差异.
研究纳入2023-01/2023-12于西安交通大学第二附属医院感染科住院治疗的肝硬化患者150例, 收集其临床资料, 并采用血栓弹力图检测外周血的血小板聚集功能. 比较代偿期肝硬化与失代偿期肝硬化患者血小板计数及功能的差异, 进一步评估血小板计数和功能变化与肝功能的相关性.
失代偿期肝硬化患者的血小板计数[(137.30±63.40)×109/L vs (79.69±43.80)×109/L, P<0.001]以及凝血最大振幅(maximum amplitude, MA)值[(51.67±6.61) mm vs (45.68±9.40) mm, P<0.001]低于代偿期肝硬化患者. 同时, 我们分析发现, 与没有脾功能亢进患者相比, 有脾功能亢进患者的最大振幅(maximum amplitude, MA)值较低[(53.59±5.70)×109/L vs (45.92±9.02)×109/L, P<0.01], 平均血小板体积(mean platelet volume, MPV)较高[(10.89±0.90) fL vs (11.91±1.15) fL, P<0.01]. 而血小板计数、MA值与Child评分、Meld评分以及Meld-Na评分呈负相关. 进一步分析血小板计数与血小板功能发现, 血小板计数与MA值(r = 0.6014, P<0.001)呈正相关, 与MPV(r = -0.4335, P = 0.011)呈负相关, 而当血小板计数<50×109/L时, 血小板计数与MA值及MPV均无显著相关性.
随着血小板计数与血小板聚集功能的下降、血小板活化能力的提升, 肝硬化患者病情呈进行性加重. 然而当我们对血小板计数进行分层分析时, 发现当血小板计数降至<50×109/L时, 血小板聚集功能以及血小板的活化能力与其并不呈现一致性, 可能有某种代偿机制参与其中.
核心提要: 失代偿期肝硬化患者的血小板计数及血小板聚集功能较代偿期肝硬化是显著下降的, 且与肝硬化疾病的严重程度密切相关, 当血小板计数降至<50×109/L时, 血小板聚集功能并未随血小板计数的下降呈进行性下降.
引文著录: 李婷, 张萌, 吴姣姣, 刘子菡, 李亚萍, 党双锁. 代偿期肝硬化和失代偿期肝硬化患者血小板计数与功能的差异对比分析. 世界华人消化杂志 2024; 32(12): 904-911
Revised: November 26, 2024
Accepted: December 17, 2024
Published online: December 28, 2024
In cirrhosis, both platelet count and function change. It remains unclear if there are differences in platelet count and function changes among patients with cirrhosis at different stages, and the relationship between the two changes is worthy of further investigation.
To investigate the difference in platelet count and function in patients with compensated and decompensated cirrhosis.
One hundred and fifty patients with cirrhosis admitted to the Department of Infectious Diseases, the Second Affiliated Hospital of Xi'an Jiaotong University from January 2023 to December 2023 were included in this study. Their clinical data were collected and thromboelastography was used to detect platelet aggregation in peripheral blood. The difference in platelet count and function between patients with compensated cirrhosis and decompensated cirrhosis was compared, and the correlation between platelet count and function and liver function was assessed.
The platelet count [(137.30 ± 63.40) × 109/L vs (79.69 ± 43.80) × 109/L, P < 0.001)] and maximum amplitude (MA) [(51.67 ± 6.61) mm vs (45.68 ± 9.40) mm, P < 0.001)] values of patients with decompensated cirrhosis were significantly lower than those of patients with compensated cirrhosis. Compared with patients without hypersplenism, patients with hypersplenism had lower MA values [(53.59 ± 5.70) × 109/L vs (45.92 ± 9.02) × 109/L, P < 0.01] and higher mean platelet volume (MPV) [(10.89 ± 0.90) fL vs (11.91 ± 1.15) fL, P < 0.01]. The platelet count and MA values were negatively correlated with Child-Pugh score, MELD score, and MELD-NA score. Further analysis of platelet count and function showed that platelet count was positively correlated with MA value (r = 0.6014, P < 0.001) and negatively correlated with MPV (r = -0.4335, P = 0.011); however, when platelet count was < 50 × 109/L, platelet count was not significantly correlated with MA value and MPV value.
The platelet count and aggregation function of patients with decompensated cirrhosis are significantly lower than those of patients with compensated cirrhosis, and are closely related to the severity of cirrhosis. When the platelet count is less than 50 × 109/L, the platelet aggregation function is not consistent with the degree of decrease of platelet count.
- Citation: Li T, Zhang M, Wu JJ, Liu ZH, Li YP, Dang SS. Comparative analysis of platelet count and function in patients with compensated and decompensated liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2024; 32(12): 904-911
- URL: https://www.wjgnet.com/1009-3079/full/v32/i12/904.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i12.904
血小板减少症在慢性肝病中的发生率约为6%, 而在肝硬化中的发生率可高达78%[1]. 随着肝脏疾病的进展, 血小板计数可能呈进行性下降. 血小板在肝硬化疾病的发生和发展过程中发挥着重要作用, 而肝硬化患者不仅存在血小板计数的变化, 其血小板功能也会随之发生改变. 因此, 在临床实践中, 我们应重视血小板功能在肝硬化患者中的变化. 血栓弹力图采用全血直接进行血小板聚集功能的检测, 相比其他血小板聚集功能检测方法, 血栓弹力图更为快捷和精确, 能够体现血小板与凝血系统间的相互联系与作用, 是整体评价凝血功能的一个敏感指标[2]. 本研究旨在通过血栓弹力图检测外周血凝血功能的变化, 结合临床资料分析比较代偿期与失代偿期肝硬化患者的血小板功能差异.
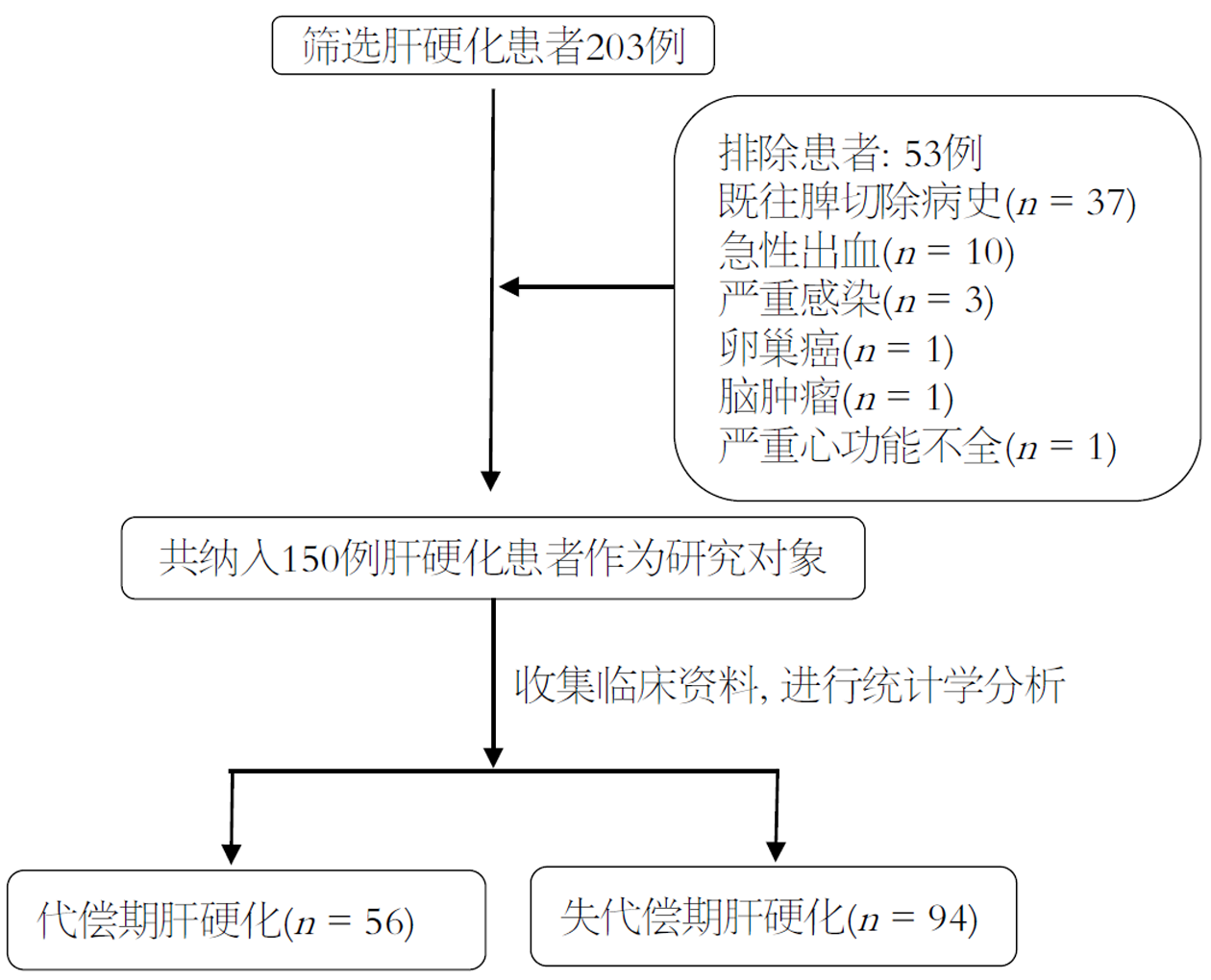
选择2023-01/2023-12于西安交通大学第二附属医院住院的肝硬化患者203例, 按照入组和排除标准严格筛选, 最终纳入150例肝硬化患者. 本研究已通过西安交通大学第二附属医院伦理委员会审批, 伦理批号2023408.
纳入标准: 符合《肝硬化诊治指南(2019版)》中肝硬化诊断标准. 排除标准: 存在下列任意一项者予以排除. (1)合并严重的冠心病、心功能、肾功能衰竭的患者; (2)脾脏已切除的患者; (3)合并有血液系统疾病所致血小板计数及功能异常者; (4)合并有严重感染者; (5)急性上消化道出血患者; (6)合并有神经、精神疾患而无法合作或不愿合作者; (7)妊娠、哺乳期妇女或近期有生育计划者; (8)合并有任何肿瘤; (9)入选后无法同意者; (10)临床资料不全.
1.2.1 代偿期肝硬化的诊断依据(下列四条之一): (1)组织学符合肝硬化诊断; (2)内镜显示食管胃静脉曲张或消化道异位静脉曲张, 除外非肝硬化性门静脉高压; (3)B超、LSM或CT等影像学检查提示肝硬化或门静脉高压特征: 如脾大、门静脉≥1.3 cm, LSM测定符合不同病因的肝硬化诊断界值; (4)无组织学、内镜或影像学检查者, 以下检查指标异常提示存在肝硬化(需符合4条中2条): ①血小板计数(platelet count, PLT)<100×109/L, 且无其他原因可以解释. ②血清白蛋白<35 g/L, 排除营养不良或肾脏疾病等其他原因. ③标准化比值(normalized ratio, INR)>1.3或凝血酶原时间(prothrombin time, PT)延长(停用溶栓或抗凝药7d以上). ④谷草转氨酶(aspartate aminotransferase, AST)/PLT比率指数(aspartate aminotransferase-to-platelet ratio index, APRI): 成人APRI评分>2.
需注意降酶药物等因素对APRI的影响. 失代偿期肝硬化的诊断依据在肝硬化基础上, 出现门静脉高压并发症和(或)肝功能减退. (1)具备肝硬化的诊断依据; (2)出现门静脉高压相关并发症: 如腹水、食管胃静脉曲张破裂出血、脓毒症、肝性脑病、肝肾综合征等.
1.2.2 检测与检查: 收集资料包括性别、年龄、现病史、并发症(有无腹水、肝性脑病、消化道出血等)以及实验室检查, 包括血常规(白细胞计数、血小板计数等)、凝血功能(PT、凝血酶原活动度、INR)、各项生化指标[总胆红素、ALT、AST、γ-转肽酶、碱性磷酸酶、白蛋白、肌酐、血钠(Na+)等]、血栓弹力图[R时间、K时间、最大振幅(maximum amplitude, MA)等]等. 评价指标: Child-Pugh分级评级方法: 将5个指标(肝性脑病、腹水、血清胆红素、白蛋白、凝血酶原时间)进行分层, 每个指标的评分进行相加. 总分5-6分为A级, 7-9分为B级, 10-15分为C级. 终末期肝病模型(end-stage liver disease model, MELD)评分的计算公式为: MELD = 3.78×ln[总胆红素(mg/dL)]+11.2×ln[INR]+9.57×ln[肌酐(mg/dL)]+6.43×病因(胆汁性或酒精性0, 其他1). MELD-Na评分 = MELD+1.59×(135-Na), 公式中血清Na+水平>135 mmol/L者按135 mmol/L计算, 血清Na+水平<120 mmol/L者按120 mmol/L计算, 120 mmol/L≤血清Na+水平≤135 mmol/L者按照具体数值计算.
统计学处理 应用SPSS 22.0和GraphPad Prism 8.0.1软件进行统计学分析. 根据Kolmogorov-Smirnov检验分析数据分布, 对符合正态分布的连续性变量表示为平均值±标准差, 非正态分布数据表示为中位数, 分类变量表示为率. 连续性变量采用单因素或独立样本t检验, 非正态分布数据采用Mann-Whitney U检验, 分类资料采用χ2检验或Fisher精确检验, P<0.05为差异有统计学意义.
本研究共纳入150例肝硬化患者(筛选流程图如图1), 其中男性92(61.3%)例, 女性58(38.7%)例; 平均年龄为55.90岁±11.32岁, 病因学方面, 其中乙型肝炎肝硬化68(45.3%)例, 丙型肝炎肝硬化32(21.3%)例, 自身免疫性肝炎肝硬化21(14.0%)例, 酒精性肝硬化13(8.7%)例, 不明原因肝硬化16(10.7%)例. 其中, 既往曾有上消化道出血的患者有15(10.0%)例, 合并有肝性脑病的患者有13(8.7%)例, 合并有腹水的患者有13(8.7%)例, 合并有门静脉血栓的患者有2(2.0%)例.
对肝硬化患者进行分析, 将其分为代偿期肝硬化组和失代偿期肝硬化组, 对比两组血小板相关参数, 结果如表1. 同时, 对于代偿期肝硬化, 我们从病因学方面分析血小板参数相关差异, 发现乙肝肝硬化患者和非乙肝肝硬化在血小板计数、平均血小板体积(mean paltalet volume, MPV)、大血小板比例、血小板比容、血小板体积分布宽度和MA值均无显著差异. 对于失代偿期肝硬化, 我们发现乙肝肝硬化患者的MA值低于非乙肝肝硬化的MA值[(41.81±8.27) mm vs (48.30±9.28) mm, (P = 0.001)], 而两组在血小板计数、MPV、大血小板比例、血小板比容和血小板体积分布宽度之间无显著差异.
| 项目 | 代偿期肝硬化(n = 56) | 失代偿期肝硬化(n = 94) | P值 |
| 年龄(岁) | 55.82±12.07 | 55.95±10.91 | 0.948 |
| 白细胞计数(×109/L) | 4.52±1.62 | 3.61±1.83 | 0.002 |
| 血小板计数(×109/L) | 137.30±63.40 | 79.69±43.80 | <0.001 |
| 平均血小板体积(fL) | 11.38±1.23 | 11.77±1.11 | 0.060 |
| 大血小板比例(%) | 35.05±10.60 | 41.54±28.57 | 0.111 |
| 血小板比容(%) | 0.150±0.067 | 0.100±0.049 | <0.001 |
| 血小板体积分布宽度(%) | 14.24±3.75 | 15.40±4.66 | 0.129 |
| MA值(mm) | 51.67±6.61 | 45.68±9.40 | <0.001 |
| R时间(min) | 5.22±1.94 | 5.12±1.31 | 0.687 |
| K时间(min) | 2.75±1.24 | 3.82±3.53 | 0.031 |
| Angle角 | 58.02±9.63 | 55.56±11.29 | 0.176 |
| LY30 | 0.79±1.20 | 0.59±0.86 | 0.239 |
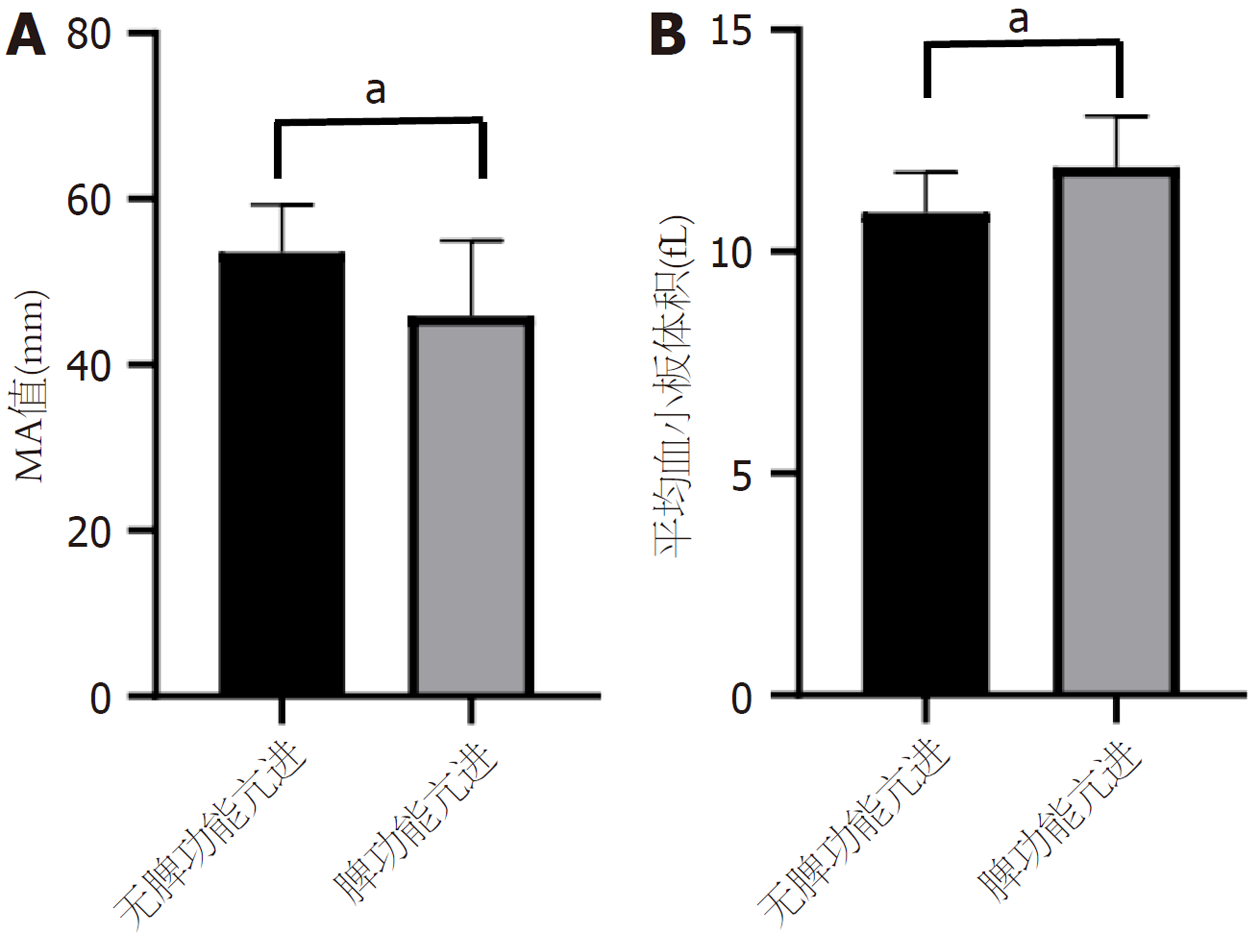
因肝硬化患者的失代偿与脾亢程度并不一致, 我们分析对比了脾功能亢进与血小板肝功能的关系, 发现与没有脾功能亢进患者相比, 有脾功能亢进患者的MA值较低[(53.59±5.70)×109/L vs (45.92±9.02)×109/L, P<0.01], MPV较高[(10.89±0.90) fL vs (11.91±1.15) fL, P<0.01](如图2).
我们进一步分析肝硬化患者血小板相关参数之间的关系, 结果显示, 血小板计数与MA值呈显著正相关(r = 0.6014, P<0.001)、与血小板比容也呈显著正相关(r = 9692, P<0.001); 而与MPV(r = -0.4335, P = 0.011)及血小板体积分布宽度(r = -0.2210, P = 0.010)呈显著负相关.
根据血小板计数对患者进行分层, 分为血小板计数>100×109/L组、血小板计数75-100×109/L组, 血小板计数50-75×109/L组及血小板计数<50×109/L组, 分析不同分层下, 血小板相关参数之间的差异(如表2)及相关性. 在血小板计数<50×109/L组中, 血小板计数与MA值呈正相关, 与MPV、大血小板比例呈负相关, 与血小板体积分布宽度及血小板比容之间呈正相关, 但均无显著统计学相关性. 在血小板计数≥50×109/L组中, 血小板计数与MA值(r = 0.4880, P<0.001)、血小板比容(r = 9660, P<0.001)呈正相关, 与MPV(r = -0.4629, P<0.001)、血小板体积分布宽度(r = -0.2402, P = 0.009)呈显著负相关.
| 项目 | >100×109/L组(n = 53) | 75-100×109/L组(n = 41) | 50-75×109/L组(n = 34) | <50×109/L组(n = 22) | P值 |
| 平均血小板体积(fL) | 10.95±0.92 | 12.08±0.98a | 12.04±1.17a | 11.96±1.42a | <0.001 |
| 大血小板比例(%) | 32.20±8.30 | 40.54±8.58 | 48.81±8.93a | 37.68±8.38 | 0.015 |
| 血小板比容(%) | 0.180±0.056 | 0.100±0.018a | 0.070±0.016ab | 0.050±0.014ab | <0.001 |
| 血小板体积分布宽度(%) | 13.47±3.61 | 15.84±3.02a | 15.73±4.47a | 16.21±7.38a | 0.019 |
| MA值(mm) | 54.01±6.01 | 49.43±7.54a | 43.57±6.81ab | 37.11±6.61abc | <0.001 |
同时, 我们分析了血小板相关参数与肝功能的关系(如表3), 结果发现, 随着血小板计数下降, 肝功能均呈现逐渐加重, 血小板计数与Child评分(r = -0.348, P<0.001)、Meld评分(r = -0.279, P = 0.001)及Meld-Na评分(r = -0.262, P = 0.001)呈负相关. 同时, 随着MA值下降, 肝功能也均呈现逐渐加重, MA值与Child评分(r = -0.383, P<0.001)、Meld评分(r = -0.361, P<0.001)及Meld-Na评分(r = -0.299, P<0.001)呈负相关.
| 血小板计数 | 平均血小板体积 | 大血小板比例 | 血小板比容 | 血小板体积分布宽度 | MA值 | ||
| Child评分 | r | -0.348 | 0.077 | 0.075 | -0.399 | 0.152 | -0.383 |
| P | <0.001 | 0.381 | 0.393 | <0.001 | 0.081 | <0.001 | |
| Meld评分 | r | -0.270 | 0.058 | 0.017 | -0.309 | 0.249 | -0.316 |
| P | 0.001 | 0.506 | 0.846 | <0.001 | 0.004 | <0.001 | |
| Meld-Na评分 | r | -0.262 | 0.066 | 0.020 | -0.285 | 0.215 | -0.299 |
| P | 0.001 | 0.453 | 0.824 | <0.001 | 0.013 | <0.001 |
在本研究中, 我们发现失代偿期肝硬化患者的血小板计数低于代偿期肝硬化[(79.69±43.80)×109/L vs (137.30±63.40)×109/L, P<0.05)], 与既往研究报道[3]相一致. 既往研究表明[4-6], 血小板不仅在免疫炎症、宿主防御、血管生成、组织修复和再生等过程中发挥重要作用, 同时血小板对于抑制肝纤维化具有重要作用[7]. 既往研究表明[8-10], 谷草转氨酶/血小板指数可作为预测肝纤维化和肝硬化的重要指标, 同时血小板减少程度与食管胃底静脉曲张呈负相关[11,12]. 我们将血小板计数与肝功能做了相关性分析发现, 血小板计数与Child评分、MELD评分以及MELD-Na评分呈负相关, 提示随着血小板计数的下降, 肝功能呈进行性恶化, 血小板计数与肝硬化病情严重程度密切相关. 那么血小板计数越低, 是否出血风险就越高?我们的研究发现, 在肝硬化患者中除血小板计数发生变化外, 血小板的质量也随着血小板的数量在发生变化, 且可能存在一定的代偿能力. 且目前更多的证据证明[12], 食管胃底静脉曲张出血风险高低与门静脉压力相关, 而不是直接与血小板计数相关.
在肝硬化患者中除血小板数量发生变化外, 其血小板功能随着疾病的进展也在发生变化[13]. 那么血小板功能的变化在肝硬化疾病中具有哪些重要意义?我们通过血栓弹力图检测发现失代偿期肝硬化患者的凝血最大振幅(MA值)低于代偿期肝硬化[(45.68±9.40) mm vs (51.67±6.61) mm, P<0.05], 没有脾功能亢进患者的MA值高于脾功能亢进患者的[(53.59±5.70)×109/L vs (45.92±9.02)×109/L, P<0.01]. 同时, 我们将MA值与肝功能做了相关性分析发现, MA值与Child评分、MELD评分以及MELD-Na评分呈负相关. 而血栓弹力图的MA值反应了血小板的聚集功能, 代表了纤维蛋白与血小板通过GPⅡb/Ⅲa受体结合后形成的血凝块的最大强度, 我们的研究提示随着血小板聚集功能的下降, 肝功能呈进行性恶化, 同时从侧面也反映了血小板聚集功能与肝硬化病情严重程度密切相关, 血小板聚集功能的下降可能预示着肝硬化疾病的预后不佳, 当然我们也需要更多的数据来证实. 那么血小板计数和血小板聚集功能的下降是否呈现一致性?
因此, 我们对血小板计数进行了分层, 进一步分析了肝硬化患者血小板计数与血小板聚集功能的关系, 我们发现血小板聚集功能随着血小板计数的下降呈进行性下降, 但是我们惊奇的发现, 当血小板计数<50×109/L时, 血小板聚集功能与血小板计数的下降并不呈现一致性. de Oliveira Souza等[14]对肝硬化血小板减少的患者进行血小板功能评估, 发现尽管患者血小板数量有着不同程度的减少, 但其血小板聚集及粘附功能均未显著降低, 其可能是由于肝硬化机体内高水平的血管性血友病因子(von Willebrand factor, vWF)可弥补血小板减少带来的功能缺失, 通过代偿机制维持血小板的粘附和聚集能力[15]. 另一个可能的解释是肝硬化状态下血小板聚集受信号分子激活的阀值存在下调, 进而提高了血小板聚集的敏感性, 导致其更"易于"激活. 我们的研究支持这一观点, 即当血小板计数≥50×109/L时, 血小板计数与血小板聚集功能呈正相关, 而当血小板计数<50×109/L时, 血小板聚集功能与血小板计数的下降并不呈现一致性. 由此推测, 肝硬化患者在血小板计数极低时, 可能通过vWF水平增加以及信号分子激活阈值的下调来维持血小板的聚集功能, 这一推测有待更多实验验证, 也可能解释了肝硬化患者在血小板计数极低时, 并未显著增加出血风险.
在肝硬化患者中, 不仅血小板的聚集功能在发生变化, 同时血小板的活化功能也在发生的变化. MPV是血细胞分析中的一项重要指标, 可反映血小板大小及活化状态, MPV增加可诱导血小板膜糖蛋白Ⅱb/Ⅲa和P-选择素的表达及释放, 从而增强血小板的活性. 我们研究发现失代偿期患者的MPV绝对值高于代偿期肝硬化患者[(11.38±1.23) fL vs (11.77±1.11) fL, P>0.05), 既往研究发现, MPV与疾病严重程度呈正相关, 我们的研究发现与没有脾功能亢进患者相比, 有脾功能亢进患者MPV较高[(10.89±0.90) fL vs (11.91±1.15) fL, P<0.01], 也证实了MPV与疾病严重程度密切相关, 是因为血小板总体激活状态根据细菌易位、感染、肝功能不全、肾功能不全等多种因素持续快速演变[16-18], 可能进一步影响MPV的结果. 同时, 当我们对血小板计数进行分层时, 发现当血小板计数≥50×109/L时, 血小板计数与血小板活化功能呈负相关, 而当血小板计数<50×109/L时, 血小板计数与血小板活化功能无显著负相关性. 而在Giannini等[19]的研究中, 发现在代偿期肝硬化和失代偿肝硬化患者的代表性队列中, MPV值与血小板减少或严重血小板减少的存在无关, 且不受血小板计数影响. 我们的研究表明当血小板计数<50×109/L时, 此时的血小板活化状态可能更易发生改变, 与肝硬化病情的复杂程度及严重程度变化密切.
综上所述, 随着血小板计数与血小板聚集功能的下降、血小板活化能力的提升, 肝硬化患者病情呈进行性加重. 然而当我们对血小板计数进行分层分析时, 发现当血小板计数降至<50×109/L时, 血小板聚集功能以及血小板的活化能力与其并不呈现一致性, 可能有某种代偿机制参与其中. 当前关于肝硬化中血小板功能的研究存在争议, 因为血小板功能的解释受到血小板减少症的挑战. 我们需要更多的临床试验数据加以证明.
肝硬化患者常合并有血小板计数减少, 且血小板计数的减少给我们临床工作带来了很大的挑战, 尤其在进行各种有创检查或手术时. 因此我们旨在比较代偿期肝硬化和失代偿期肝硬化患者血小板计数的改变, 以及随之带来的血小板功能的改变, 评估是否存在某种代偿机制而降低血小板计数减少所带来的风险.
血栓弹力图在临床中广泛应用, 其最大振幅(maximum amplitude, MA)值反映了血小板的聚集功能, 以期在肝硬化患者中可以基于血小板计数和血小板功能评估出血风险, 为临床治疗提供指导作用.
探究代偿期肝硬化和失代偿期肝硬化血小板计数和血小板功能的变化, 同时分析血小板计数和血小板功能与肝功能的关系, 并分层分析血小板计数和血小板功能的关系.
收集代偿期肝硬化患者56例, 失代偿期肝硬化患者94例, 收集其临床资料, 并采用血栓弹力图检测外周血的血小板聚集功能. 比较代偿期肝硬化与失代偿期肝硬化患者血小板计数及功能的差异, 进一步评估血小板计数和功能变化与肝功能的相关性.
结果发现, 失代偿期肝硬化患者的血小板计数以及凝血MA值低于代偿期肝硬化患者. 与没有脾功能亢进患者相比, 有脾功能亢进患者的MA值较低, 而平均血小板体积(mean paltalet volume, MPV)较高. 而当血小板计数及MA值越低, Child评分、Meld评分以及Meld-Na评分越高. 我们对血小板计数进行分层分析发现, 血小板计数>50×109/L时, 血小板计数与MA值呈正相关, 与MPV呈负相关, 而当血小板计数<50×109/L时, 血小板计数与MA值及MPV均无显著相关性.
随着血小板计数与血小板聚集功能的下降、血小板活化能力的提升, 肝功能呈进行性恶化. 当我们对血小板计数进行分层分析时, 发现血小板计数>50×109/L时, 血小板计数与MA值呈正相关, 与MPV呈负相关, 而当血小板计数降至<50×109/L时, 血小板聚集功能以及血小板的活化能力与其并不呈现一致性.
我们的研究发现当血小板计数降至<50×109/L时, 血小板聚集功能以及血小板的活化能力与其并不呈现一致性, 未来我们将收集更多的临床数据来对其进行验证, 并拟证实其存在的某种代偿机制对于疾病预后的影响.
学科分类: 胃肠病学和肝病学
手稿来源地: 陕西省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 2. | 于 茜, 王 凡, 刘 宏斌. 血小板功能评价方法. 中华老年多器官疾病杂志. 2016;15:868-872. [DOI] |
| 3. | Yoshida M, Tateishi R, Hiroi S, Fujiwara M, Kitanishi Y, Iwasaki K, Takeshima T, Igarashi A. Changes in Platelet Counts and Thrombocytopenia Risk in Patients with Chronic Liver Disease with Different Etiologies Using Real-World Japanese Data. Adv Ther. 2022;39:992-1003. [PubMed] [DOI] |
| 4. | Scherlinger M, Richez C, Tsokos GC, Boilard E, Blanco P. The role of platelets in immune-mediated inflammatory diseases. Nat Rev Immunol. 2023;23:495-510. [PubMed] [DOI] |
| 5. | Pircher J, Engelmann B, Massberg S, Schulz C. Platelet-Neutrophil Crosstalk in Atherothrombosis. Thromb Haemost. 2019;119:1274-1282. [PubMed] [DOI] |
| 6. | Seki E, Schwabe RF. Hepatic inflammation and fibrosis: functional links and key pathways. Hepatology. 2015;61:1066-1079. [PubMed] [DOI] |
| 7. | Gotlieb N, Schwartz N, Zelber-Sagi S, Chodick G, Shalev V, Shibolet O. Longitudinal decrease in platelet counts as a surrogate marker of liver fibrosis. World J Gastroenterol. 2020;26:5849-5862. [PubMed] [DOI] |
| 8. | Dong B, Chen Y, Lyu G, Yang X. Aspartate Aminotransferase to Platelet Ratio Index and Fibrosis-4 Index for Detecting Liver Fibrosis in Patients With Autoimmune Hepatitis: A Meta-Analysis. Front Immunol. 2022;13:892454. [PubMed] [DOI] |
| 9. | Liu K, Huang Z, Yang S, Lin L, Zheng S, Zhang X, Xue Y, Xie W. The Age, Gamma-Glutamyl Transpeptidase and Platelet Index: A Novel Noninvasive Model for Predicting Hepatocellular Carcinoma in Patients with Hepatitis B Virus-Related Liver Cirrhosis. J Hepatocell Carcinoma. 2022;9:1057-1063. [PubMed] [DOI] |
| 10. | Suarez-Quintero CY, Patarroyo Henao O, Muñoz-Velandia O. Concordance between hepatic biopsy and the APRI index (Ast to Platelet Ratio Index) for the diagnosis of cirrhosis in patients with autoimmune liver disease. Gastroenterol Hepatol. 2021;44:465-471. [PubMed] [DOI] |
| 11. | Liu H, Zhang Q, Gao F, Yu H, Jiang Y, Wang X. Platelet Count/Spleen Thickness Ratio and the Risk of Variceal Bleeding in Cirrhosis With Esophagogastric Varices. Front Med (Lausanne). 2022;9:870351. [PubMed] [DOI] |
| 12. | Rogalski P, Rogalska-Plonska M, Wroblewski E, Kostecka-Roslen I, Dabrowska M, Swidnicka-Siergiejko A, Wasielica-Berger J, Cydzik M, Hirnle T, Dobrzycki S, Flisiak R, Dabrowski A. Blood platelet function abnormalities in cirrhotic patients with esophageal varices in relation to the variceal bleeding history. Scand J Gastroenterol. 2019;54:311-318. [PubMed] [DOI] |
| 13. | Zanetto A, Campello E, Bulato C, Gavasso S, Farinati F, Russo FP, Tormene D, Burra P, Senzolo M, Simioni P. Increased platelet aggregation in patients with decompensated cirrhosis indicates higher risk of further decompensation and death. J Hepatol. 2022;77:660-669. [PubMed] [DOI] |
| 14. | de Oliveira Souza E, D'Amico ÉA, Flores da Rocha TR, Marcondes Ferreira C, Medeiros Batista J, Carneiro D'Albuquerque LA, Carrilho FJ, Queiroz Farias A. Preservation of platelet function in patients with cirrhosis and thrombocytopenia undergoing esophageal variceal ligation. Hepatobiliary Pancreat Dis Int. 2020;19:555-560. [PubMed] [DOI] |
| 15. | Pan J, Wang L, Gao F, An Y, Yin Y, Guo X, Nery FG, Yoshida EM, Qi X. Epidemiology of portal vein thrombosis in liver cirrhosis: A systematic review and meta-analysis. Eur J Intern Med. 2022;104:21-32. [PubMed] [DOI] |
| 16. | Raparelli V, Basili S, Carnevale R, Napoleone L, Del Ben M, Nocella C, Bartimoccia S, Lucidi C, Talerico G, Riggio O, Violi F. Low-grade endotoxemia and platelet activation in cirrhosis. Hepatology. 2017;65:571-581. [PubMed] [DOI] |
| 17. | Zanetto A, Campello E, Bulato C, Gavasso S, Saggiorato G, Shalaby S, Burra P, Angeli P, Senzolo M, Simioni P. Global hemostatic profiling in patients with decompensated cirrhosis and bacterial infections. JHEP Rep. 2022;4:100493. [PubMed] [DOI] |
| 18. | Zanetto A, Rinder HM, Campello E, Saggiorato G, Deng Y, Ciarleglio M, Wilson FP, Senzolo M, Gavasso S, Bulato C, Simioni P, Garcia-Tsao G. Acute Kidney Injury in Decompensated Cirrhosis Is Associated With Both Hypo-coagulable and Hyper-coagulable Features. Hepatology. 2020;72:1327-1340. [PubMed] [DOI] |
| 19. | Giannini EG, Moscatelli A, Brunacci M, Zentilin P, Savarino V. Prognostic role of mean platelet volume in patients with cirrhosis. Dig Liver Dis. 2016;48:409-413. [PubMed] [DOI] |