修回日期: 2024-11-04
接受日期: 2024-11-21
在线出版日期: 2024-11-28
晚期肝癌患者已错失最佳手术治疗时机, 而原发性肝癌(primary hepatocellular carcinoma, PHC)术前转换治疗可提升手术切除率. 替雷利珠单抗抗癌活性较强, 在晚期PHC患者治疗中取得一定进展, 但其在转换治疗中仍处于探索阶段. 因此, 本研究旨在分析其治疗晚期PHC患者的效果、安全性.
分析替雷利珠单抗联合多纳非尼治疗晚期PHC患者的临床获益情况.
采用治疗前后自身对照研究法, 前瞻性选取2021-01/2022-01我院收治的89例经肝动脉栓塞化疗介入术后晚期PHC患者(其中1例未遵医用药剔除, 2例失访), 均予以替雷利珠单抗联合多纳非尼治疗. 观察患者的生存率、转化率、手术情况. 18 mo后进行客观疗效、安全性评价.
治疗后疗效: 改良后实体瘤疗效评价标准标准下, 疾病控制率(disease control rate, DCR)为95.35%(82/86), 客观缓解率为75.58%(65/86); 实体瘤疗效评价标准1.1版标准下, DCR为95.35%(82/86); 生存率: 86例晚期PHC患者, 中位无事件生存率为9.5 mo, 全部患者6 mo、12 mo、18 mo、末次随访生存率分别为94.19%、83.72%、76.74%、62.79%; 转化率: 60例患者成功转化, 转化成功率为69.77%(60/86); 转化治疗后、手术后甲胎蛋白、异常凝血酶原均较治疗前下降(P<0.05); 安全性: 任意治疗相关不良反应(treatment-related adverse events, TRAEs)发生率为63.95%(55/86), 3级TRAEs发生率为11.63%(10/86).
替雷利珠单抗联合多纳非尼治疗晚期PHC患者疗效确切, 能明显改善治疗后转化率, 且安全性良好.
核心提要: 晚期原发性肝癌(primary hepatocellular carcinoma, PHC)患者已错失最佳手术治疗时机. 应用替雷利珠单抗联合多纳非尼治疗可有效提升转换率及疗效, 延长患者生存时间, 且毒副反应小, 可为晚期PHC治疗选择提供方案, 为转化治疗提供循证依据.
引文著录: 邵佩玲, 喻彤, 陈应芬. 替雷利珠单抗联合多纳非尼治疗晚期PHC患者的临床获益分析. 世界华人消化杂志 2024; 32(11): 835-842
Revised: November 4, 2024
Accepted: November 21, 2024
Published online: November 28, 2024
Patients with advanced liver cancer have missed the best opportunity for surgical treatment, while preoperative conversion therapy for primary hepatocellular carcinoma (PHC) can improve the rate of surgical resection. Tislelizumab has strong anticancer activity and has resulted in some progress in the treatment of advanced PHC patients, but it is still in the exploratory stage in conversion therapy. Therefore, this study aimed to analyze the efficacy and safety of tislelizumab in the treatment of advanced PHC patients.
To analyze the clinical benefits of tislelizumab combined with dorafenib in the treatment of patients with advanced PHC.
A self-controlled before-after study was used to prospectively select 89 patients with advanced PHC after transcatheter arterial chemoembolization intervention in our hospital from January 2021 to January 2022 (1 case was excluded for not complying with medical drug rejection and 2 cases were lost to follow-up), and all of them were treated with tiralizumab combined with donafenib. The survival rate, conversion rate, and operation status of the patients were observed. The objective efficacy and safety were evaluated 18 months later.
According to the modified Response Evaluation Criteria in Solid Tumors, the disease control rate (DCR) was 95.35% (82/86), and the objective response rate was 75.58% (65/86). According to the Response Evaluation Criteria in Solid Tumors 1.1, the DCR was 95.35% (82/86). Among the 86 patients with advanced PHC, the median event-free survival was 9.5 months, and the survival rates at 6 months, 12 months, 18 months, and the last follow-up were 94.19%, 83.72%, 76.74%, and 62.79%, respectively. Sixty patients were successfully converted, with a conversion success rate of 69.77% (60/86). After conversion therapy and surgery, both alpha-fetoprotein and prothrombin levels decreased compared with those before treatment (P < 0.05). The incidence of any treatment-related adverse events (TRAEs) was 63.95% (55/86), and the incidence of grade 3 TRAEs was 11.63% (10/86).
Tirellizumab combined with donafenib is effective in the treatment of advanced PHC patients, and can significantly improve the conversion rate after treatment, with good safety.
- Citation: Shao PL, Yu T, Chen YF. Clinical benefits of tislelizumab combined with donafenib in treatment of patients with advanced primary hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2024; 32(11): 835-842
- URL: https://www.wjgnet.com/1009-3079/full/v32/i11/835.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i11.835
原发性肝癌(primary hepatocellular carcinoma, PHC)早期症状隐匿, 确诊时多数患者已为中晚期, 无法接受手术切除治疗[1-3]. 近年, 临床研究发现转化治疗可通过局部(放疗、血管介入治疗)或系统(免疫治疗、靶向治疗)干预治疗将初始不可切除PHC转化为可切除, 为中晚期PHC患者提供手术治疗机会[4-6]. 多项研究表明, 多纳非尼联合经肝动脉化疗栓塞术(transarterial chemoembolisation, TACE)、程序性死亡受体1(programmed death 1, PD-1)单抗药物治疗初始不可切除的肝癌疗效优异, 但临床在PD-1单抗药物选择上仍处于探索状态[7,8]. 替雷利珠单抗(新型PD-1抑制剂)可通过阻断PD-1与其受体结合, 使抗肿瘤免疫反应增强, 防止癌细胞逃逸, 达到抗肿瘤的效果, 由于其抗癌活性较强, 已被广泛应用于治疗晚期PHC患者[9,10]. 但临床尚缺乏对替雷利珠单抗联合多纳非尼治疗晚期PHC患者的研究报道. 在此背景下, 本研究前瞻性选取我院收治TACE介入术后晚期PHC患者作为研究对象, 旨在探讨替雷利珠单抗联合多纳非尼治疗晚期PHC患者的效果. 现报道如下.
本研究经我院伦理委员会审核同意(审批文号: (2023)伦审第(114)号). 本研究前瞻性选取我院2021-01/2022-01收治的89例TACE介入术后晚期PHC患者[其中剔除1例(未遵医用药), 失访2例], 最终纳入研究86例.
纳入标准: 符合文献[1]PHC诊断标准: 症状主要表现为肝区疼痛、腹胀、黄疸、上腹部包块等; 经病理学、影像学、细胞学检查确诊; 中国肝癌分期(China Liver Cancer Staging, CNLC): Ⅲa或Ⅲb期; 肝功能储备功能Child-Pugh分级: A级或B级, 但B级PHC患者肝功能储备功能分级(Child-Pugh)评分≤7分; 预期生存期>6 mo; 年龄≥18岁; 美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)体力状况评分0-1分; 经改良后实体瘤疗效评价标准(Modified Response Evaluation Criteria in Solid Tumors, mRECIST)确认, 至少有1个可经磁共振成像检查或电子计算机断层扫描检查测量的病灶[11].
排除标准: 伴严重心、肾、肺功能障碍; 伴认知功能障碍、精神系统疾病; 伴其他恶性肿瘤; 对本研究涉及药物过敏、不耐受者; 用药依从性差, 无法配合完成治疗、研究者; 有肝移植或肝切除外科手术指征; 特殊人群(备孕期或生育期、哺乳期、妊娠期女性); 有处于急性发作期或未经控制的严重疾病. 患者/家属自愿签署知情同意书.
(1)①d1、d22行TACE治疗, 21 d/次, 连续治疗2次. 操作如下: 用2%利多卡因(成都倍特药业, 国药准字: H32023420, 规格: 5 mL: 50 mg)局麻后, 于右侧股动脉穿刺置管, 在数字减影血管造影下行腹腔、肝动脉造影, 确认病灶位置、数量、血供后, 选择肿瘤供血动脉缓慢注入氟尿嘧啶(辽宁新高制药, 国药准字: H21024236, 规格: 10 mL: 0.25 g)0.75 g-1.25 g、顺铂(云南植物药业, 国药准字: H53021740, 规格: 2 mL: 10 mg)80 mg-120 mg、奥沙利铂(哈药集团生物, 国药准字: H20133094, 规格: 50 mg/剂)200 mg、表柔比星(瀚晖制药, 国药准字: H20030260, 规格: 50 mg/剂)80 mg-120 mg. 栓塞剂采用吸收性明胶海绵(1000-1400, 艾力康). 化疗药物、栓塞剂用量根据患者血供情况、肿瘤大小情况而定, 术后予以护胃、保肝等常规药物治疗; ②TACE后3 d, 空腹口服甲苯磺酸多纳非尼片(苏州泽璟生物, 国药准字: H20210020, 规格: 0.1 g/片)0.2 g/次, 2次/d, 术前1 wk停用; d1、d22静脉滴注替雷利珠单抗(广州百济神州生物, 国药准字: S20190045, 规格: 100 mg/瓶)200 mg/次, 21 d/周期, 治疗周期≥2个周期. 并通过肿瘤影像学检查, 判断手术可行性, 检查时间为末次给药(替雷利珠单抗)后21 d(±3 d). 若联合治疗后患者仍不能行手术治疗, 可追加治疗周期(≤2个周期).
(2)按需追加TACE, 次数<2次, 方案同上(1). ①d1, 口服甲苯磺酸多纳非尼片2次/d, 0.2 g/次, 术前1周停用; ②d1、d22, 静脉滴注替雷利珠单抗200 mg/次, 21 d/周期, 连续给药2个周期, 待联合治疗后患者可行手术治疗后, 再行拟定手术治疗方案, 需注意手术时间不能超过末次给药(替雷利珠单抗)28 d(±3 d). 治疗过程中发生非血液学毒性(≥2级)、血液学毒性(≥3级)时, 予以剂量暂停或下调.
注意事项: ①替雷利珠单抗剂量连续暂停<4个周期, 剂量暂停>2个周期时, 需根据临床情况调整后续治疗方案; ②多纳非尼连续剂量暂停<28 d, 时间剂量暂停时间超过以上规定时, 需根据临床情况调整后续治疗方案.
本研究的主要研究终点为主要病理缓解率(major pathologic response, MPR), 次要研究终点为病理部分缓解(pathologic partial remission, pPR)率、客观缓解率(objective response rate, ORR)、疾病控制率(disease control rate, DCR)、转化成功率、R0切除率、无事件生存率(event-free survival, EFS)、治疗前后肿瘤标记物[异常凝血酶原(abnormal protein induced by vitamink absence or antagonist-Ⅱ, PIVKA-Ⅱ)、甲胎蛋白(alphafetoprotein, AFP)]变化、安全性.
(1)MPR率: 手术切除标本中存活癌细胞≤10%的患者比率.
(2)pPR率: 手术切除标本中, 10%<存活癌细胞<90%的患者比率.
(3)ORR、DCR参照文献[11,12]中相关标准进行评估, 评价指标均为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病进展(progressive disease, PD)、疾病稳定(stable disease, SD), ORR = (CR+PR)例数/总例数×100%; DCR = (1-PD)例数/总例数×100%. ①实体瘤疗效评价标准1.1版(Response Evaluation Criteria in Solid Tumors1.1, RECIST1.1)评估标准[12]: 病灶(靶病灶、非靶病灶)消失为CR; 靶病灶综合长度缩小>30%, 且无新发病灶为PR; 靶病灶总和长度增加>20%, 或有新发病灶为PD; 靶病灶总和长度有缩小但未达到PR或有增长但未达到PD为SD; ②mRECIST评估标准[11]: 靶病灶中任何瘤内动脉增强消失为CR; 靶病灶动脉期增强直径总和较靶病灶直径基线总和减少≥30%为PR; 任何与PR、CR不符的为SD; 靶病灶曾庆部分直径总和增加≥20%或出现新病灶为PD. 注: RECIST1.1、mRECIST由2名经验丰富(工作年限>10年)的医师进行评估, 若存在差异由2名医师协同审查、协商达成一致.
(4)转化成功率: 转化治疗成功, 且完成手术切除的患者比率.
(5)R0切除率: 手术切除后, 医生根据R0切除定义(显微镜下无原肿瘤残余)判断为根治术的患者比率.
(6)EFS: EFS为首次用药治疗时间至首次发生以下任何事件(局部/远处复发、任何原因导致死亡、疾病进展无法进行手术)的末次随访时间. 所有转化治疗患者均予以持续随访, 统计EFS, 随访时间为6 mo、12 mo、18 mo及末次随访, 随访方式为门诊复查/电话.
(7)肿瘤标记物检测: 用血清采集管(红色血清管)采集患者3 mL空腹静脉血, 静置30 min后予以离心处理10 min(3000 r/min, 半径8 cm), 取上层血清, -80 ℃保存待检; AFP、PIVKA-Ⅱ采用全自动免疫分析仪、原装配套试剂盒检测.
(8)安全性: 记录患者用药后治疗相关不良反应(treatment-related adverse events, TRAEs), 包括发热、白细胞减少、血小板减少、血红蛋白降低、皮疹、反应性毛细血管增生症、高血压、中性粒细胞减少, 药物安全性评价依据文献[13]进行评估.
统计学处理 以SPSS 22.0分析, 计数资料以n(%)表示, 计量资料采用中位数M(P25, P25)表示, P<0.05为差异有统计学意义.
统计患者临床基线资料, 包括年龄、性别、Child-Pugh分级(A级、B级)、肿瘤最大直径(<10 cm、≥10 cm)、病灶数量(1-3个、≥4个)、门静脉癌栓(是、否)、ECOG评分(0分、1分)、CNLC分期(Ⅲa、Ⅲb)、流行病学(丙肝感染、乙肝感染、乙肝丙肝感染、无病毒感染)、病理类型(低分化腺癌、中分化腺癌、黏液腺癌), 见表1.
| 参数 | n(%) |
| 年龄(岁) | 43.58(22.05, 64.23) |
| 性别 | |
| 男 | 70(81.40) |
| 女 | 16(18.60) |
| Child-Pugh分级 | |
| A级 | 78(90.70) |
| B级 | 8(9.30) |
| 肿瘤最大直径(cm) | |
| <10 | 47(54.65) |
| ≥10 | 39(45.35) |
| 病灶数量(个) | |
| 1-3 | 30(34.88) |
| ≥4 | 56(65.12) |
| 门静脉癌栓 | |
| 是 | 46(53.49) |
| 否 | 40(46.51) |
| ECOG评分 | |
| 0 | 17(19.77) |
| 1 | 69(80.23) |
| CNLC分期(期) | |
| Ⅲa | 63(73.26) |
| Ⅲb | 23(26.74) |
| 流行病学 | |
| 丙肝感染 | 7(8.14) |
| 乙肝感染 | 58(67.44) |
| 乙肝丙肝感染 | 2(2.33) |
| 无病毒感染 | 19(22.09) |
| 病理类型 | |
| 低分化腺癌 | 45(52.33) |
| 中分化腺癌 | 22(25.58) |
| 黏液腺癌 | 19(22.09) |
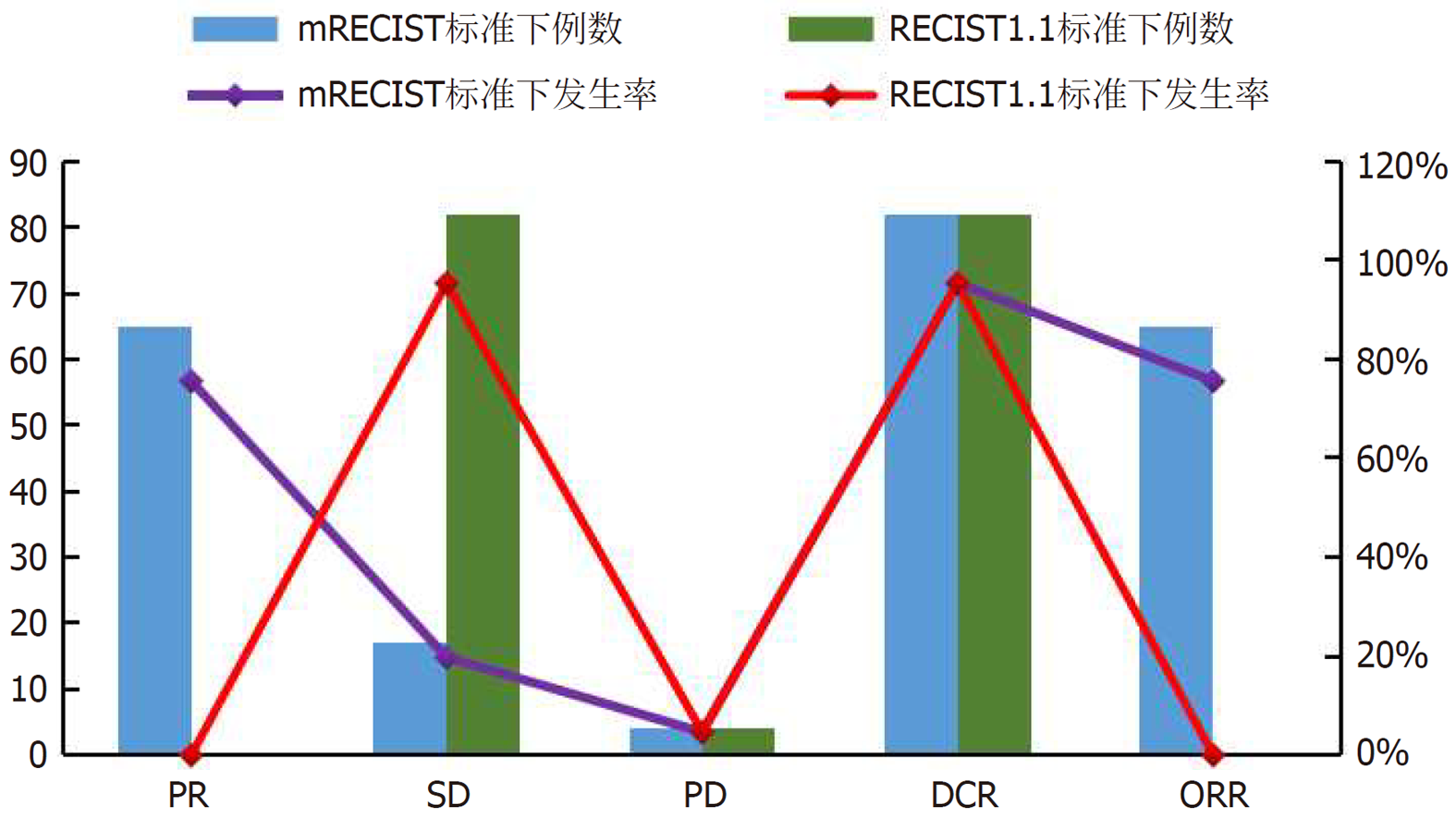
随访31个月, 2例失访, 最终纳入的86例晚期PHC患者, mRECIST标准下, PR患者65例, SD患者17例, PD患者4例, DCR为95.35%(82/86), ORR为75.58%(65/86); RECIST1.1标准下, SD患者82例, PD患者4例, DCR为95.35%(82/86), 见图1.
86例晚期PHC患者, 中位EFS为9.5 mo. 全部患者6 mo、12 mo、18 mo、末次随访的生存率分别为94.19%、83.72%、76.74%、62.79%, 见表2.
| 时间 | 总例数 | 生存例数 | 生存率(%) |
| 6 mo | 86 | 81 | 94.19 |
| 12 mo | 86 | 72 | 83.72 |
| 18 mo | 86 | 66 | 76.74 |
| 末次随访 | 86 | 54 | 62.79 |
60例患者成功转化, 并实施了手术(腹腔镜肝切除术26例, 开放手术7例, 机器人辅助手术27例), 转化成功率为69.77%(60/86); 8例患者完成转化治疗后仍在等待手术, 实施手术切除的患者均达到R0切除, R0切除率为100%, 术后病理显示, 30例(50%)达到MPR, 25例(41.67%)达到pPR.
与治疗前比较, 转化治疗后AFP、PIVKA-Ⅱ显著降低(P<0.05), 手术后AFP、PIVKA-Ⅱ进一步降低(P<0.05), 见表3.
| 指标 | 时间 | M(P25, P75) | Mann-Whitney U | P值 | 时间 | M(P25, P75) | Mann-Whitney U | P值 |
| AFP(ng/mL) | 治疗前 | 620.54(12.58, 22915.33) | 7.986 | <0.001 | 治疗前 | 620.54(12.58, 22915.33) | 10.521 | <0.001 |
| 转化治疗后 | 286.51(1103, 10280.65)a | 手术后 | 11.14(3.68, 124.84)a | |||||
| PIVKA-Ⅱ(mA/mL) | 治疗前 | 11576.81(1585.66, 30415.26) | 8.863 | <0.001 | 治疗前 | 11576.81(1585.66, 30415.26) | 12.854 | <0.001 |
| 转化治疗后 | 2487.30(275.12, 9075.69)a | 手术后 | 503.75(126.28, 2457.33)a |
86例患者, 任意TRAEs发生率为63.95%, 3级TRAEs发生率为11.63%, 因TRAEs暂停用药1例. TRAE以发热、白细胞减少、血小板减少最为常见, 见表4.
| 不良反应 | n | 发生率(%) |
| 任意TRAEs | 55 | 63.95 |
| 3级TRAEs | 10 | 11.63 |
| 因TRAEs暂停用药 | 1 | 1.16 |
| 因TRAEs停药/减量 | 0 | 0.00 |
| TRAE种类 | 全部级别[n(%)] | 3级[n(%)] |
| 发热 | 21(24.42) | 1(1.16) |
| 白细胞减少 | 12(13.95) | 4(4.65) |
| 血小板减少 | 12(13.95) | 0(0.00) |
| 血红蛋白降低 | 9(10.47) | 0(0.00) |
| 皮疹 | 7(8.14) | 2(2.33) |
| 反应性毛细血管增生症 | 9(10.47) | 6(6.98) |
| 高血压 | 2(2.33) | 0(0.00) |
| 中性粒细胞减少 | 1(1.16) | 0(0.00) |
PHC发病早期缺乏典型性症状, 多数患者确诊时已属中晚期, 手术治疗切除率较低或不可行手术切除治疗[14]. 近年随着靶向治疗、免疫治疗不断涌现, 临床研究发现, TACE联合靶向、免疫类药物实施转化治疗, 可将初始不可切除肿瘤转化为可切除, 提升手术切除率, 利于延长患者生存周期[15,16]. 尽管转换治疗在PHC治疗中已取得较大进展, 但临床相关研究样本量均较小, 导致研究结果的稳定性、可靠性受到影响, 尚缺乏大样本量研究进一步验证[6,17]. 鉴于此, 本研究选取我院收治的TACE介入术后晚期PHC患者, 旨在分析替雷利珠单抗、多纳非尼联合治疗的有效性、安全性. 现报道如下.
既往研究表明, 提高肿瘤患者长期生存时间是所有临床治疗的终极目标[18-20]. 本研究发现, 雷利珠单抗、多纳非尼联合治疗TACE介入术后晚期PHC患者达到了较高的ORR(75.58%)、DCR(95.35%). 本研究60例患者成功转化, 转化成功率为69.77%. 由此可见, 靶向治疗、免疫治疗之间具有协同效应, 可提高转化成功率、临床疗效, 这一观点在曹亚娟等[6]研究中也有所体现. 考虑可能与多模式联合可协同不同作用机制发挥抗肿瘤效应有关. (1)TACE是2022年《原发性肝癌诊疗指南》[21]中推荐治疗不可切除PHC患者的有效治疗方法, 但仍有部分患者(CNLC Ⅲa期)不适合单独采用局部治疗, 临床推荐联合系统治疗[19,20]; (2)替雷利珠单抗可通过靶向阻断PD-1与其程序性死亡受体-配体-1结合, 激活患者免疫系统抑制癌细胞生长、扩散, 且研究表明在接受TACE治疗的晚期PHC患者联合替雷利珠单抗治疗具有较好的长期疗效, 利于延长患者生存时间[22]; (3)多纳非尼作为治疗PHC常用的靶向药物, 可通过减弱多靶点的酪氨酸激酶活性, 阻碍血管生成, 拮抗患者机体内的免疫抑制[23]. 且研究表明与其联合能提高TACE、PD-1抗体的治疗效果[6]. 因此, 多模式联合治疗能达到提高临床疗效的效果. 另外, 本研究转化成功患者中除8例患者尚在等待手术外, 其余接受手术切除治疗者, R0切除率达100%. 且术后病理显示, MPR达50%、pPR达41.67%, 进一步验证了TACE+替雷利珠单抗+多纳非尼治疗晚期PHC患者有较好的临床疗效.
既往研究显示, 肿瘤标志物AFP、PIVKA-Ⅱ可用于辅助肿瘤诊断及疗效评估[24-26]. 本研究治疗前后肿瘤标志物对比分析, 结果显示转化治疗后、手术后AFP、PIVKA-Ⅱ均明显降低, 提示经转化治疗后患者获益明显. 此外, 在关注临床疗效的同时也要重视联合用药所产生的毒副反应, 若毒副反应强烈可直接影响患者预后. 本研究结果显示, 患者经联合治疗后任意TRAEs发生率为63.95%, 其中3级TRAEs发生率为11.63%, 在安全性方面显现出的毒副反应较轻, 且无因TRAEs停药/减量情况发生. 由此可见, 对于TACE介入术后晚期PHC患者, 雷利珠单抗、多纳非尼联合治疗是一种可行的转化治疗方案, 安全性有保障. 但本研究为单臂设计, 导致该治疗方案在晚期PHC患者治疗中的获益、风险缺少随机对照组进行比较、验证.
综上所述, 雷利珠单抗、多纳非尼联合治疗TACE介入术后晚期PHC患者显示出较好的转化率及疗效, 利于延长部分患者生存时间, 且无严重毒副反应, 为该类患者选择治疗方案提供了参考, 同时也为应用转化治疗进一步提供了循证依据.
晚期原发性肝癌(primary hepatocellular carcinoma, PHC)患者已错失最佳手术治疗时机, 而PHC术前转换治疗[替雷利珠单抗联合程序性死亡受体1(programmed death 1, PD-1)抑制剂]可提升手术切除率, 为患者提供手术治疗机会. 替雷利珠单抗为新型PD-1抑制剂, 可阻断PD-1与其受体结合, 增强肿瘤免疫反应, 阻止癌细胞扩散, 但其在转换治疗中治疗效果、安全性尚不明确.
希望通过分析替雷利珠单抗联合多纳非尼治疗晚期PHC患者的治疗效果, 为该类患者治疗提供参考新线索, 同时也为应用转化治疗进一步提供循证依据.
保证晚期PHC患者于治疗过程中的有效用药, 为该类患者提供手术治疗机会, 提升转换率及疗效.
选取我院2021-01/2022-01收治的89例动脉化疗栓塞术(transarterial chemoembolisation, TACE)介入术后晚期PHC患者[其中剔除1例(未遵医用药), 失访2例], 最终纳入研究86例. 均予以替雷利珠单抗联合多纳非尼治疗. 观察患者的生存率、转化率、手术情况. 18 mo后进行客观疗效、安全性评价.
改良后实体瘤疗效评价标准的标准下, 疾病控制率(disease control rate, DCR)为95.35%, 客观缓解率为75.58%;实体瘤疗效评价标准1.1版标准下, DCR为95.35%(82/86); 生存率: 86例晚期PHC患者, 中位无事件生存率为9.5 mo, 全部患者6 mo、12 mo、18 mo、末次随访生存率分别为94.19%、83.72%、76.74%、62.79%; 转化率: 60例患者成功转化, 转化成功率为69.77%); 转化治疗后、手术后甲胎蛋白、异常凝血酶原均较治疗前下降(P<0.05); 安全性: 任意TRAEs发生率为63.95%, 3级TRAEs发生率为11.63%.
雷利珠单抗、多纳非尼联合治疗TACE介入术后晚期PHC患者可有效提升转化率及疗效, 利于延长部分患者生存时间, 且毒副反应相对较小, 为应用转化治疗进一步提供了循证依据.
转换治疗是目前治疗晚期PHC患者的研究热点, 本研究分析得出雷利珠单抗、多纳非尼转换治疗在晚期PHC治疗中可提升转换率、疗效, 后续可在此基础上开展随机对照研究, 加以验证, 以为后续晚期PHC患者转换治疗提供循证依据.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Feng F, Zhao Y. Hepatocellular Carcinoma: Prevention, Diagnosis, and Treatment. Med Princ Pract. 2024;33:414-423. [PubMed] [DOI] |
| 2. | Yang W, Li X, He J, Xuan Q, Si H, Yao W. Efficacy and safety of immune checkpoint inhibitors combined with anti-VEGF therapy in the treatment of unresectable or advanced liver cancer: a systematic review. Immunopharmacol Immunotoxicol. 2023;45:770-779. [PubMed] [DOI] |
| 3. | Zhou H, Song T. Conversion therapy and maintenance therapy for primary hepatocellular carcinoma. Biosci Trends. 2021;15:155-160. [PubMed] [DOI] |
| 4. | Liu X, Lu Y, Qin S. Atezolizumab and bevacizumab for hepatocellular carcinoma: mechanism, pharmacokinetics and future treatment strategies. Future Oncol. 2021;17:2243-2256. [PubMed] [DOI] |
| 5. | Llovet JM, De Baere T, Kulik L, Haber PK, Greten TF, Meyer T, Lencioni R. Locoregional therapies in the era of molecular and immune treatments for hepatocellular carcinoma. Nat Rev Gastroenterol Hepatol. 2021;18:293-313. [PubMed] [DOI] |
| 6. | 古 善智, 黄 满平, 谭 玉林, 胡 鸿涛, 朱 旭, 郑 桐森, 郑 振东, 袁 牧. 多纳非尼片联合抗PD-1单抗和经导管动脉化疗栓塞术治疗不可手术切除的肝细胞癌的临床研究. 临床肿瘤学杂志. 2023;28:609-614. [DOI] |
| 7. | 曹 亚娟, 张 雪斌, 史 炯, 唐 敏, 程 春晓, 余 德才. 甲苯磺酸多纳非尼联合经肝动脉栓塞化疗(TACE)及卡瑞利珠单抗转化治疗初始不可切除的肝细胞癌: 一项前瞻性、单臂、单中心Ⅱ期临床试验. 临床肿瘤学杂志. 2023;28:481-487. [DOI] |
| 11. | Lencioni R, Llovet JM. Modified RECIST (mRECIST) assessment for hepatocellular carcinoma. Semin Liver Dis. 2010;30:52-60. [PubMed] [DOI] |
| 12. | Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M, Rubinstein L, Shankar L, Dodd L, Kaplan R, Lacombe D, Verweij J. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer. 2009;45:228-247. [PubMed] [DOI] |
| 13. | Freites-Martinez A, Santana N, Arias-Santiago S, Viera A. Using the Common Terminology Criteria for Adverse Events (CTCAE - Version 5.0) to Evaluate the Severity of Adverse Events of Anticancer Therapies. Actas Dermosifiliogr (Engl Ed). 2021;112:90-92. [PubMed] [DOI] |
| 14. | Rimassa L, Finn RS, Sangro B. Combination immunotherapy for hepatocellular carcinoma. J Hepatol. 2023;79:506-515. [PubMed] [DOI] |
| 15. | Llovet JM, Pinyol R, Yarchoan M, Singal AG, Marron TU, Schwartz M, Pikarsky E, Kudo M, Finn RS. Adjuvant and neoadjuvant immunotherapies in hepatocellular carcinoma. Nat Rev Clin Oncol. 2024;21:294-311. [PubMed] [DOI] |
| 16. | Sheng Y, Wang Q, Liu H, Wang Q, Chen W, Xing W. Prognostic nomogram model for selecting between transarterial chemoembolization plus lenvatinib, with and without PD-1 inhibitor in unresectable hepatocellular carcinoma. Br J Radiol. 2024;97:668-679. [PubMed] [DOI] |
| 17. | Wang S, Wang Y, Zhu C, Liu K, Chao J, Zhang N, Piao M, Yang X, Zhang L, Long J, Xun Z, Zhang T, Sang X, Yang X, Zhao H. Conversion surgery intervention versus continued systemic therapy in patients with a response after PD-1/PD-L1 inhibitor-based combination therapy for initially unresectable biliary tract cancer: a retrospective cohort study. Int J Surg. 2024;110:4608-4616. [PubMed] [DOI] |
| 18. | Lin LW, Yan LY, Ke K, Yang WZ, Lin JQ, Huang N. Efficacy and safety of transarterial chemoembolization combined with lenvatinib, programmed death-1 inhibitor, and iodine-125 seed brachytherapy for hepatocellular carcinoma with portal vein tumor thrombosis. Brachytherapy. 2023;22:858-871. [PubMed] [DOI] |
| 19. | Wu J, Wu J, Li S, Luo M, Zeng Z, Li Y, Fu Y, Li H, Liu D, Ou X, Lin Z, Wei S, Yan M. Effect of transcatheter arterial chemoembolization combined with lenvatinib plus anti-PD-1 antibodies in patients with unresectable hepatocellular carcinoma: A treatment with Chinese characteristics. Biosci Trends. 2024;18:42-48. [PubMed] [DOI] |
| 20. | Lu H, Liang B, Xia X, Zheng C. Efficacy and safety analysis of TACE + Donafenib + Toripalimab versus TACE + Sorafenib in the treatment of unresectable hepatocellular carcinoma: a retrospective study. BMC Cancer. 2023;23:1033. [PubMed] [DOI] |
| 23. | Guan H, Wang C, Zhao Z, Han S. Cost-Effectiveness of Donafenib as First-Line Treatment of Unresectable Hepatocellular Carcinoma in China. Adv Ther. 2022;39:3334-3346. [PubMed] [DOI] |
| 24. | Wang K, Dong L, Lu Q, Yang Z, Fan X, Gao F, Ge W, Wang Z, Zhou Z, Lu D, Wei X, Wei Q, Zhuang L, Qin L, Ye Q, Yang J, Dong J, Zheng S, Xu X. Incorporation of protein induced by vitamin K absence or antagonist-II into transplant criteria expands beneficiaries of liver transplantation for hepatocellular carcinoma: a multicenter retrospective cohort study in China. Int J Surg. 2023;109:4135-4144. [PubMed] [DOI] |
| 26. | Qiu ZC, Wu YW, Qi WL, Li C. PIVKA-II combined with tumor burden score to predict long-term outcomes of AFP-negative hepatocellular carcinoma patients after liver resection. Cancer Med. 2024;13:e6835. [PubMed] [DOI] |