修回日期: 2023-11-24
接受日期: 2023-12-20
在线出版日期: 2024-01-28
胰胆管合流异常(pancreaticobiliary maljunction, PBM)患者的共同通道(common channel, CC)过长导致Oddi括约肌的作用不直接影响到胰胆连接处, 继而胰液和胆汁相互反流, 造成胆道或胰腺的各种病理改变. 探索内镜下微创缩短胰胆管CC通道在PBM中的应用及其机制变得尤为重要, 为患者提供又一个治疗的技术选择.
探讨经内镜下十二指肠乳头括约肌共同通道切开术(endoscopic common channel sphinctertomy, CCEST)微创干预治疗PBM患者的临床效果及安全性.
观察分析CCEST内镜下微创干预治疗的35例PBM患者, 其中BP型19例、PB型16例, 复杂型0例. 35例患者均行经内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography, ERCP)下CCEST并分析内镜下微创干预治疗对PBM患者的影响作用及并发症等情况.
35例PBM患者中, 男性12例, 女性23例, 平均年龄为(46±26.38)岁(3岁-89岁). 所有患者均给予内镜下CCEST, 以缩短共同通道. 35例PBM患者中合并胆、胰管结石患者18例(51.43%), 14例患者首次ERCP取石成功, 成功率为78%(14/18). ERCP微创干预治疗术后1 wk, 35例患者中血清生化、C-反应蛋白(C-reactive protein, CRP)指标及胆汁淀粉酶较术前均明显下降(P<0.05). 5例患者出现轻度ERCP术后胰腺炎, 经对症治疗后均未出现术后出血、消化道穿孔和重症胰腺炎等严重并发症. 经过对35例患者(22.05±10.67) mo的随访, 其中1例术后确诊胆管癌而行外科手术; 有4例患者因结石复发再次行ERCP治疗, 也取得满意疗效. 治疗总有效率为88.6%(31/35).
PBM起病较隐匿, ERCP可协助明确PBM诊断. CCEST通过缩短胆胰管汇合部共同通道, 早期改善PBM患者胆胰管引流, 是内镜微创治疗PBM患者的有效安全方法.
核心提要: 本文探讨经内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography, ERCP)下缩短共同通道(common channel, CC)在胰胆管合流异常(pancreaticobiliary maljunction, PBM)中的应用及其机制研究. 通过缩短CC通道, 减少胰胆反流, 矫正"合流异常"转化为"分流入肠", 改善CC通道的引流作用, 并同时取出胆胰管结石等, 最大限度减少局部解剖结构损伤, 从而达到内镜下微创干预治疗的目的. 评估分析PBM内镜下微创治疗的优劣势及安全性, 为内镜下微创治疗PBM奠定理论基础, 提出新策略和新思路.
引文著录: 徐梦想, 范震, 赵敏楠. 内镜下CCEST微创干预治疗胰胆管合流异常患者35例分析. 世界华人消化杂志 2024; 32(1): 41-49
Revised: November 24, 2023
Accepted: December 20, 2023
Published online: January 28, 2024
Patients with pancreaticobiliary maljunction (PBM) have a common channel (CC) that is too long, causing the Oddi sphincter not to directly affect the pancreaticobiliary junction. As a result, reflux between pancreatic juice and bile occurs, causing various pathological changes in the bile duct or pancreas. Exploring the application and mechanism of minimally invasive endoscopic shortening of the pancreatic bile duct CC channel in PBM has become particularly important, providing patients with another treatment option.
To investigate the clinical efficacy and safety of minimally invasive endoscopic common channel sphinctertomy (CCEST) in the treatment of patients with PBM.
The clinical data of 35 PBM patients treated by minimally invasive CCEST were analyzed, and there were BP type (n = 19) and PB type (n = 16) PBM. All 35 patients underwent CCEST with the help of endoscopic retrograde cholangiopancreatography, and the therapeutic effects and complications of minimally invasive CCEST in PBM patients were analyzed.
A total of 35 patients were diagnosed with PBM, of whom 12 were male and 23 were female. The patients ranged in age from 3 to 89 years, with a mean age of (46 ± 26.38) years. CCEST was performed in all patients to reduce the length of the CC. Among the 35 patients with PBM, 18 (51.43%) had combined biliary and pancreatic duct stones and underwent intraoperative lithotripsy. First-time ERCP stone extraction was successful in 14 patients, with a success rate of 78% (14/18). One week after minimally invasive intervention therapy, the serum biochemistry and C-reactive protein (CRP) and bile amylase in the 35 patients showed a significant decrease compared to the preoperative levels (P < 0.05). Post-ERCP pancreatitis was observed in five patients, but no serious complications such as postoperative bleeding, gastrointestinal perforation, and severe pancreatitis occurred after symptomatic treatment. After a mean follow-up period of (22.05 ± 10.67) mo in the 35 patients, one patient was diagnosed with carcinoma of the bile duct and treated by surgery, and four were treated by ERCP again because of stone recurrence and achieved satisfactory efficacy. The total effective rate of the treatment was 88.6% (31/35).
PBM patients often present with an insidious onset. ERCP is a valuable procedure for the diagnosis of PBM. CCEST effectively improves biliopancreatic drainage in early-stage PBM patients by reducing the length of the common biliopancreatic confluence channel. CCEST is a safe and effective minimally invasive intervention for the treatment of PBM patients.
- Citation: Xu MX, Fan Z, Zhao MN. Treatment of pancreaticobiliary maljunction by minimally invasive endoscopic common channel sphinctertomy: Analysis of 35 cases. Shijie Huaren Xiaohua Zazhi 2024; 32(1): 41-49
- URL: https://www.wjgnet.com/1009-3079/full/v32/i1/41.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v32.i1.41
胰胆管合流异常(pancreaticobiliary maljunction, PBM)是一种先天性的胆胰管解剖结构异常, 胆总管与主胰管在十二指肠壁外异常汇合, 其胆胰管的共同通道过长, 导致Oddi括约肌无法正常作用到两者的交汇处, 造成了胰液与胆汁的相互逆流, 引起胆管炎、胰腺炎、胆胰管结石, 甚至胆道恶性肿瘤等并发症[1]. 研究发现, 由于内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography, ERCP)介入治疗技术及操作配件发展相对缓慢, 以往PBM患者大多采用外科手术治疗甚至开腹手术治疗. 近年来随着内镜诊疗技术的迅速发展, ERCP内镜微创技术在诊断及协助解除胆胰管梗阻, 甚至在治疗PBM患者方面取得了良好效果. 本文对35例诊断为PBM患者进行数据资料统计分析, 探讨ERCP内镜下微创干预治疗对PBM患者的影响作用、临床治疗效果及其术后并发症等情况, 以期对PBM患者的内镜下ERCP微创干预诊疗提供新的思路和方法.
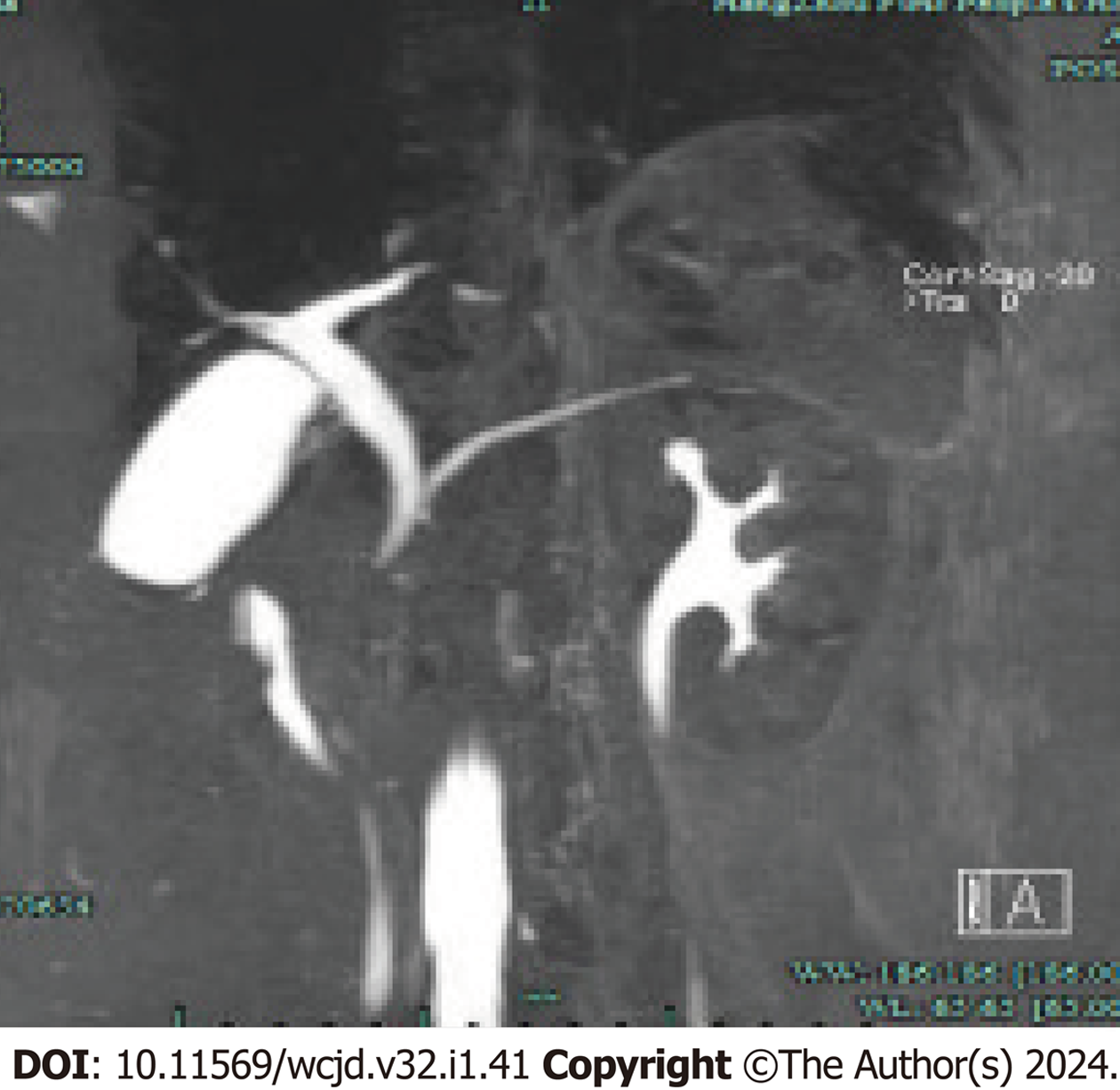
本资料观察分析2020-03/2023-04经ERCP内镜下微创干预治疗的35例PBM患者, 男性12例, 女性23例, 男女比例约为1:1.9, 年龄为(46岁±26.38岁)(3岁-89岁). 其中儿童患者10例(≤12岁), 成人患者25例. 35例患者均经MRI及ERCP逆行胰胆管造影明确诊断为PBM, 其中19例为胆管汇入胰管型(B-P型), 16例为胰管汇入胆管型(P-B型), 无复杂型患者病例. PBM诊断标准和分型[2,3]: 上腹部磁共振(magnetic resonance imagine, MRI)、ERCP逆行胰胆管造影等影像学提示胰胆管共同通道过长, 长度≥15 mm; 或共同通道不足15 mm时, 其壶腹部收缩段完全居于胆胰管合流处的远端即可以诊断为PBM. Komi分型: 根据胆管及胰管汇合的情况分为, 胆管汇入胰管型(B-P型)、胰管汇入胆管型(P-B型)和复杂型, 即胆胰管以复杂的方式汇合, 以至于连接处不能归类为前面两种类型中的任何一种.
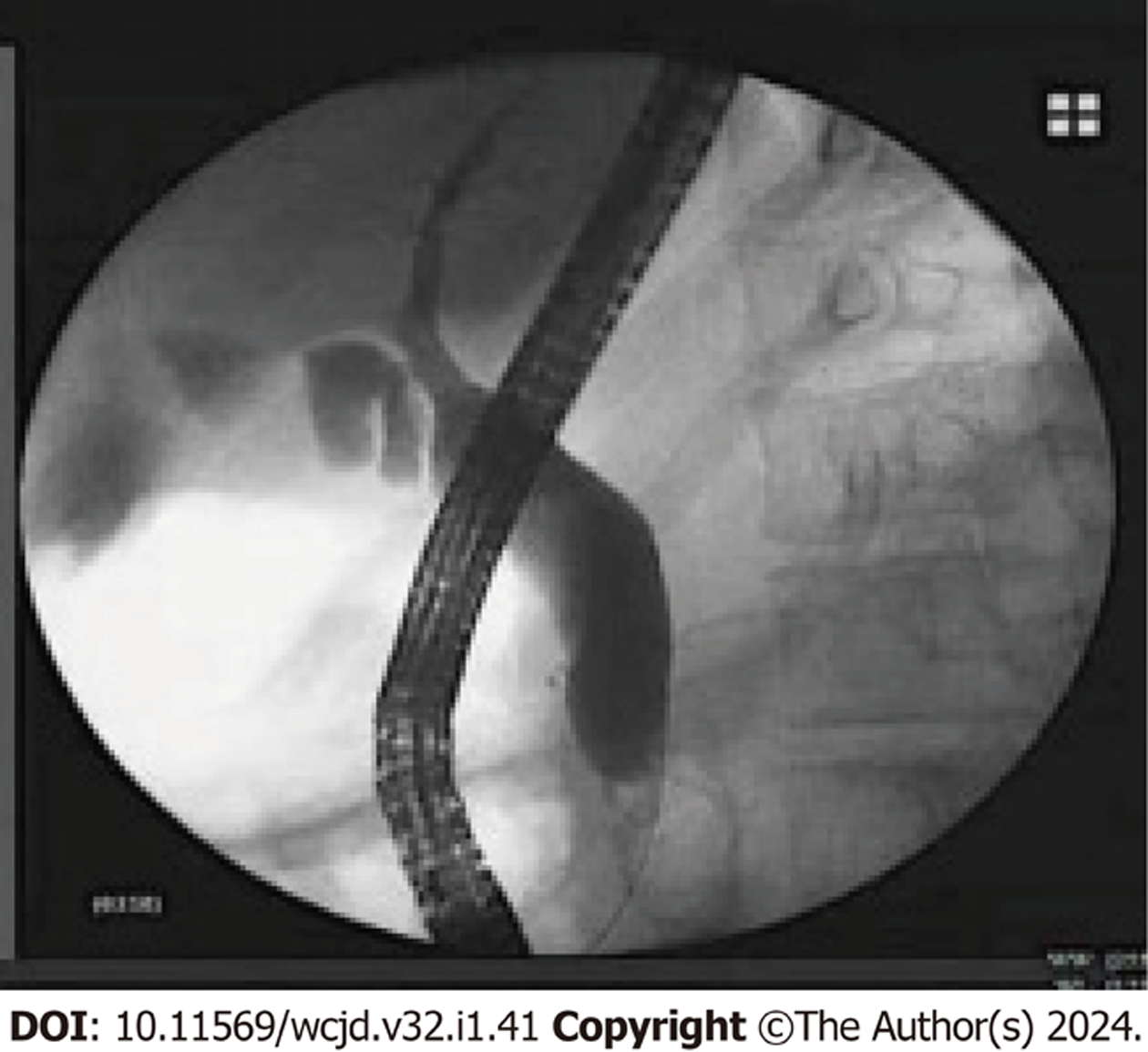
PBM患者35例, 男性12例, 女性23例, 其中儿童患者10例, 成人患者25例. 35例PBM患者中, 临床表现为腹痛30例(30/35, 85.7%), 发热9例(9/35, 25.7%), 呕吐8例(8/35, 22.9%), 黄疸4例(4/35, 11.4%), 仅有腹部不适症状的患者3例(3/35, 8.6%). 10例(10/35, 28.6%)患者表现为长期慢性腹痛、腹部不适等非特异性临床症状. 入院首发断为急性胰腺炎10例(10/35, 28.6%), 急性胆管炎伴胆管扩张6例(6/35, 17.1%), 胆囊炎1例(1/35, 2.9%), 慢性胰腺炎1例(1/35, 2.9%). 术中诊断合并胆总管结石14例(14/35, 40.0%), 胰腺结石4例(4/35, 11.4%), 胆管扩张23例(23/35, 65.7%), 先天性胆总管囊肿1例(2.9%), 胰腺完全分裂症2例(5.7%), 十二指肠乳头旁憩室1例(2.9%), 胆管癌1例(2.9%). 见表1及图1和图2.
| 分型 | PB型 | BP型 |
| 男 | 5(14.3) | 7(20.0) |
| 女 | 11(31.4) | 12(34.3) |
| 年龄(岁, mean±SD) | 49.75±25.95 | 33.63±35.06 |
| 临床表现 | ||
| 腹痛 | 13(37.1) | 17(48.6) |
| 发热 | 2(5.7) | 7(20.0) |
| 呕吐 | 4(11.4) | 4(11.4) |
| 黄疸 | 2(5.7) | 2(5.7) |
| 仅有腹部不适 | 2(5.7) | 1(2.9) |
| 合并症情况 | ||
| 胆总管扩张 | 11(31.4) | 12(34.3) |
| 胆总管结石 | 8(22.9) | 6(17.1) |
| 胰管结石 | 1(2.9) | 3(8.6) |
| 胆总管囊肿 | 0(0.0) | 1(2.9) |
| 急性胰腺炎 | 6(17.1) | 4(11.4) |
| 胰腺完全分裂 | 0(0.0) | 2(5.7) |
| 十二指肠憩室乳头 | 1(2.9) | 0(0.0) |
| 胆管癌 | 0(0.0) | 1(2.9) |
内镜下微创干预治疗方法: 所有患者完成术前准备, 麻醉方式采用静脉麻醉. 将ERCP内镜插至十二指肠降部, 观察十二指肠乳头形态, 明确有无憩室及肿瘤等. 经乳头插管成功, 先抽取10 mL胆汁, 检测胆汁淀粉酶, 然后注射造影剂, X线下动态观察胆、胰管远端形态、胆胰管汇合关系, 记录分析汇合位置、形式、分型、胆胰管是否扩张、有无合并结石、共同通道长度及其他合并症等. 所有患者均行内镜下十二指肠乳头括约肌共同通道切开术(endoscopic common channel sphinctertomy, CCEST). 结合患者ERCP术中情况, 给予内镜下乳头气囊扩张(endoscopic papillary balloon dilation, EPBD)、胆、胰管取石, 内镜下胰管支架引流术(endoscopic retrograde pancreatic drainage, ERPD)、内镜下鼻胆管引流术(endoscopic nasobiliary drainage, ENBD)、内镜下胆道支架引流术(endoscopic retrograde biliary drainage, ERBD)等. 术后7 d再次经鼻胆管抽取原始胆汁测定胆汁淀粉酶活性.
效果评估: 对比分析经ERCP内镜微创干预治疗前后1 wk, 35例患者临床变化情况, 如腹痛、腹胀、黄疸等临床症状; 实验室检查包括血液生化如肝功能、血清淀粉酶、CRP、胆汁淀粉酶等指标变化情况. 疼痛评分采用数字评分量表(numerical rating scale, NRS)进行评估: 无疼痛为0分, 轻度疼痛为1-3分, 中度疼痛为4-6分, 重度疼痛为7-10分. 对比统计分析经ERCP内镜微创干预治疗前后1 wk后, 患者疼痛评分变化情况.
统计学处理 SPSS 25.0统计软件进行数据分析, 计量资料用均数±标准差(mean±SD)表示, 各组间比较统计方法符合正态分布的采用t检验, 不符合正态分布的采用非参数检验(Mann-Whitney U检验), 计数资料采用采用例数和百分数表示. P<0.05为差异有统计学意义.
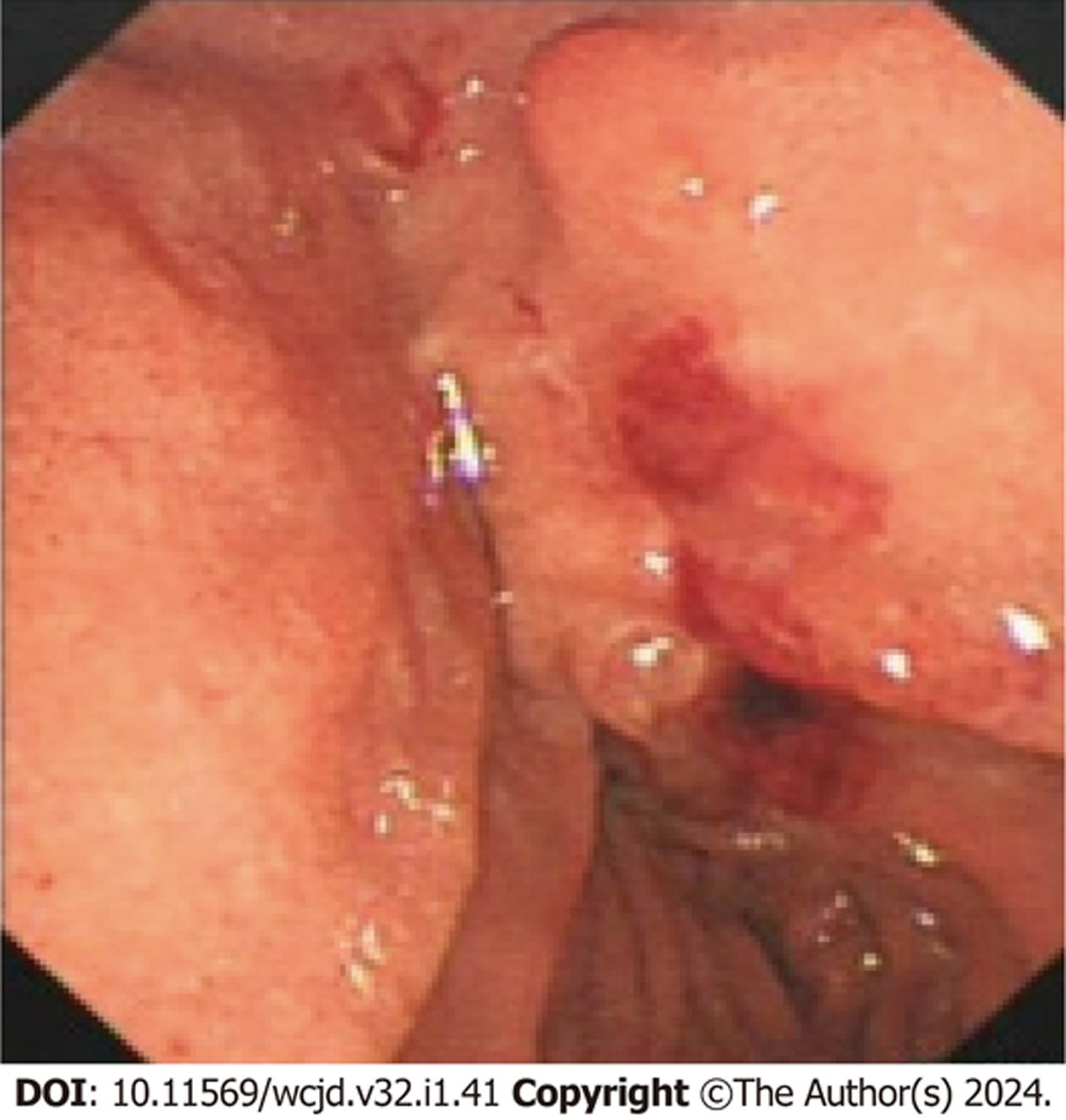
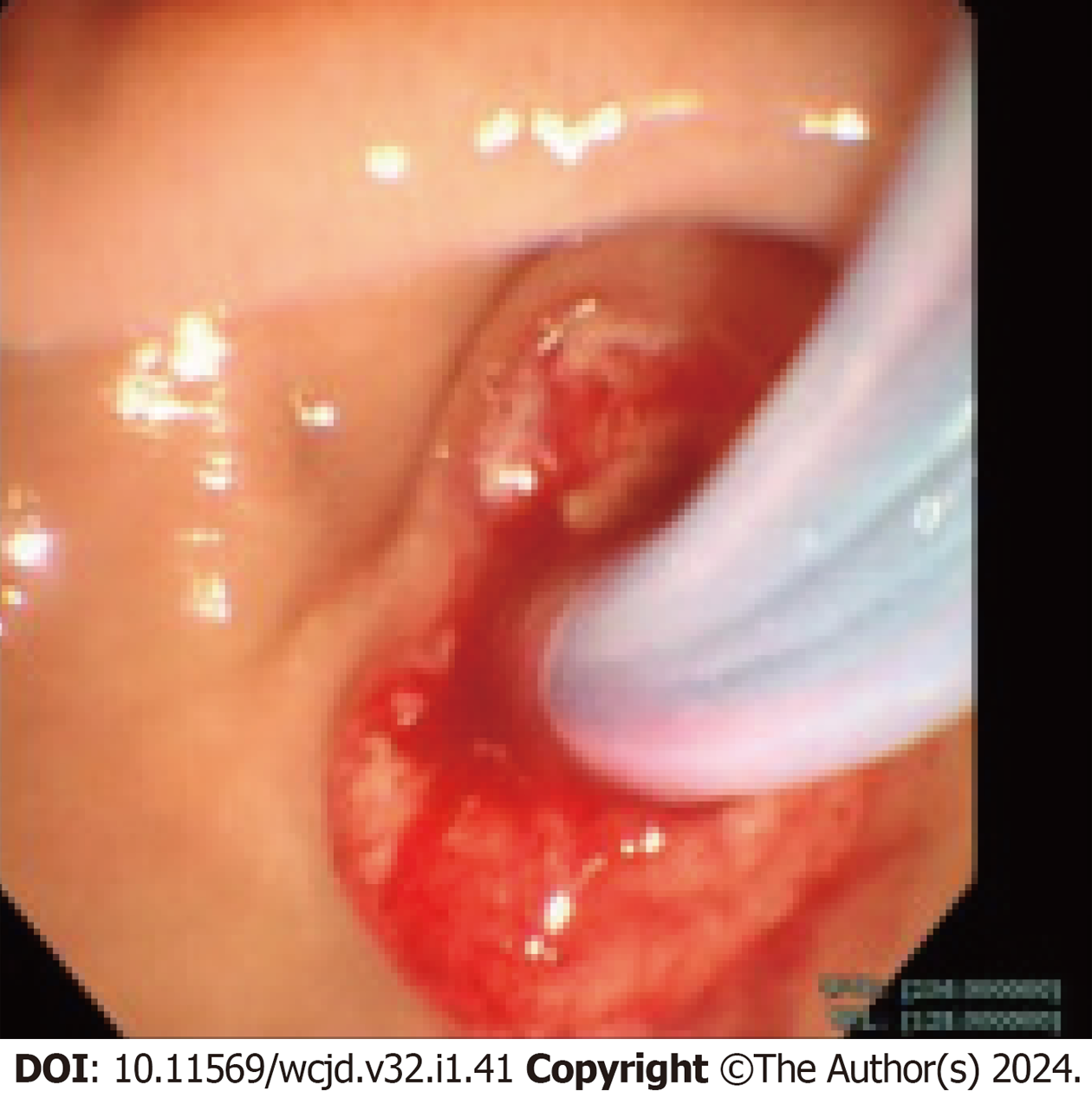
35例患者共行ERCP内镜下微创干预治疗41次, 其中1例患者第一次ERCP插管失败, 于3 d后再次行ERCP内镜下治疗成功, 首次ERCP插管成功率为97.1%(34/35). 35例患者均给予CCEST(35/35, 100%), 以缩短共同通道, 改善胆胰管过长及汇合部异常, 解除流出道梗阻及胆胰管通畅引流. 14例(14/35, 40.0%)患者术中行胆总管取石, 4例(4/35, 11.4%)患者ERCP术中行胰管取石. 其中有4例(4/14, 28.6%)胆总管结石患者, 因结石过大而无法一次性取净结石, 置入ENBD后择期行体外静波碎石2-3次后再次取石. 18例(18/35, 51.4%)合并胆、胰管结石患者均取石成功. 7例(7/25, 28.0%)患者行EPBD, 塑形共同通道; 14例(14/35, 40.0%)患者行ERPD通畅引流; 16例(16/35, 45.7%)患者行ENBD; 9例(9/35, 25.7%)患者行ERBD, 胆管通畅引流. 见图3和图4及表2.
| 分型 | CCEST | EPBD | 取石 | ERBD | ENBD | ERPD |
| PB型 | 16(45.7) | 3(42.8) | 7(38.9) | 5(55.6) | 8(50.0) | 7(50.0) |
| BP型 | 19(54.3) | 4(57.1) | 11(61.1) | 4(44.4) | 8(50.0) | 7(50.0) |
35例患者于ERCP术后1 wk, 血清ALT、AST、TBil、DBil、CRP等生化指标与术前比较明显改善, 差异具有显著统计学意义(P<0.05). 尽管血清GGT指标与术前1 wk比较有所下降, 但差异无显著性统计学意义. 血清淀粉酶较术前升高, 差异无显著性统计学意义. 胆汁淀粉酶自术前(3247±1032) U/L, 于术后1 wk降至(2876±926) U/L, 差异具有显著统计学意义(P<0.05). 30例患者疼痛评分于术后1 wk自(6.9±1.02)分下降至(0.3±0.53)分, 且发热及皮肤黄染等症状明显好转或消失. 35例患者中, 有5例(5/35, 14.3%)ERCP术后出现轻度ERCP术后胰腺炎(post-ERCP pancreatitis, PEP), 经过抑酸、抑酶、抗感染补液治疗后好转. 35例患者均无术后出血、消化道穿孔、甚至死亡等严重并发症. 见表3.
| 指标 | 治疗前 | 治疗后 | Z值 | P值 |
| ALT(U/L) | 43.0(16.0, 143.0) | 32.0(14.0, 61.0) | -3.03 | <0.05 |
| AST(U/L) | 35.0(24.0, 75.0) | 29.0(20.0, 34.0) | -3.11 | <0.05 |
| GGT(U/L) | 99.0(24.0, 305.0) | 75.0(22.0, 230.0) | -3.71 | >0.05 |
| Tbil(μmol/L) | 14.2(10.8, 19.1) | 11.0(9.4, 13.4) | -3.2 | <0.05 |
| Dbil(μmol/L) | 5.9(3.6, 7.9) | 4.9(3.5, 6.6) | -2.73 | <0.05 |
| CRP(mg/L) | 4.1(2.4, 19.9) | 3.0(0.5, 8.7) | -3.04 | <0.05 |
| SAMY(U/L) | 247.2(102, 362.0) | 393.1(236.4, 703.8) | -3.64 | >0.05 |
经过对35例PBM患者(22.05±10.67) mo的随访, 其中1例患者确诊为合并胆管癌而行外科手术治疗; 有4例因胆总管结石复发再次行ERCP微创治疗, 也取得满意疗效. 治疗总有效率为88.6%(31/35).
PBM的发生与诊断标准: PBM于1916年首次报道, 1969年Babbitt正式命名为"胰胆合流异常"[4]; PBM是指解剖上主胰管和胆管在十二指肠壁外汇合. 通常情况下Oddi括约肌从胆管末端包围胰胆汇合处, 胆总管内压力较十二指肠压高约10 mmHg-15 mmHg, 而Oddi括约肌基础压力高于胰管及胆管内压力, 因此可有效的防止十二指肠内容物反流, 维持胆、胰管内部生理环境的稳定, 同时又可调节胆汁和胰液的分泌、储存与排泄. 然而, PBM因其解剖结构异常, 致使共同通道过长, 导致Oddi括约肌无法有效作用于汇合处, 引起胰液与胆汁相互反流而造成胆胰疾病及相关并发症的发生[5].
目前关于PBM的发病机制还不完全清楚, 有学者认为主要与遗传因素有关. 尽管人类为更好的适应环境而不断地进化、改进自身的解剖结构及其功能, 从而形成一个近似完美的生物体, 但自然进化具有较大的偶然性, 进化过程难免出现不完美的现象或瑕疵. 研究发现, PBM形成主要与胚胎时期的异常发育有关. 胚胎在妊娠的第4-8周时即可形成胰、胆系统. 胆道系统与胰腺均起源于胚胎前肠, 肝憩室本身转化为胆总管、胆囊管、胆囊及左右腹胰腺, 随后在妊娠第5周左右融合成单叶腹侧胰腺[6]. 妊娠第8周时, 随着前肠扭转和十二指肠的形成, 腹侧胰芽和胆管连接背侧胰芽, 后腹胰管与背胰管汇合形成主胰管, 并与胆总管汇合, 开口于十二指肠主乳头, 形成胆胰管汇合部[7,8]. PBM被认为是由于腹侧胰腺形成时, 腹侧胰腺发育不良而发生的.
目前PBM的诊断标准存在争议, 影像学提示胰胆管共同通道过长, 长度为≥15 mm, 或共同通道不足15 mm时壶腹部收缩段完全居于胆胰管合流处的远端也可以诊断为PBM[2]. Komi[3]将PBM根据胆管及胰管汇合的情况分为三种临床类型: 胆管汇入胰管型(BP型)、胰管汇入胆管型(PB型)和复杂型即胆胰管以复杂的方式汇合, 以至于连接处不能归类为前面两种类型中的任何一种. 有学者指出, PBM还可以依据胆总管直径以10 mm为标准进行分型, 以指导临床制定诊疗方案, 将其分为胆管扩张型(先天性胆道扩张)和无胆管扩张型[9]. 据相关报道[10], PBM在西方人群的发病率明显偏低, 不及亚洲人群的1%. 本病女性发病率高于男性, 大约为3:1或2:1, 本文女性占据大多数, 占总人数的65.7%. 35例患者中, 伴胆管扩张的较无扩张的患者发病率高, 合并胆总管扩张的有23例(65.71%)患者, 是无扩张型患者(12例, 34.29%)的1.9倍, 所以我们更应该重视该病, 加强这方面的研究.
PBM的病理生理与胆胰疾病: 正常情况下, Oddi括约肌具有自主的收缩及舒张节律, 一般3-10次/min, 通过其紧张性及收缩性, 共同调节胆道和胰管压力, 控制着胰液及胆汁的排泄, 有利于食物的消化吸收. PBM因其异常的解剖结构, 使得其可能存在胰胆反流、胆胰反流及胆、胰相互反流三种模式. 胆汁与胰液的相互反流是一系列胆、胰疾病发生的始动原因. 由于胰管压力常高于胆总管, 胰液向胆管内逆流现象更为常见, 胰液与胆汁混合形成胆汁酸, 可使大量无活性的胰酶被激活(尤其是磷脂酶A2), 激活的胰酶可引起胆囊及胆管黏膜上皮组织、细胞损伤, 而且胆管上皮细胞因长期不断炎症刺激, 久而久之出现炎性增生性病变、化生、基因突变乃至癌变等. 共同通道流出不畅, 以及其异常的解剖结构使得胆道流体力学发生改变、涡流或胰胆反流, 导致胆汁淤积, 进而形成胆囊及胆管结石[7]. 当因共同通道梗阻, 形成结石或蛋白质栓塞时, 胆汁亦可反流至胰管, 激活的胰酶可损伤胰管黏膜上皮及胰腺组织, 引起组织炎性水肿、坏死, 诱发急慢性胰腺炎, 甚至胰腺肿瘤的发生[11], 儿童PBM患者多以急性胰腺炎为首发表现. 一项研究[12]分析了PBM的患者, 发现术前急性胰腺炎在儿科患者中(28-32%)比成人患者(9%)更常见. 本研究中5例患儿均出现腹痛及血淀粉酶的升高, 呈现急性胰腺炎的明显症状, ERCP术后患者疼痛缓解, 血尿、胆汁淀粉酶复查下降, 影像学未见急性胰腺炎表现, 所以当急性胰腺炎反复发作出现时, 应考虑到如PBM、Oddi括约肌功能障碍(sphincter oddi dysfunction, SOD)、十二指肠乳头旁憩室等胰、胆管解剖结构异常原因所致. 临床上常见的胰腺炎病因大多为胆道结石、高脂血症、酒精性、SOD、感染因素、暴饮暴食等, 但常常有一部分胰腺炎患者一时无法找到其发病原因, 笔者认为, 任何事物的发生都有一定的因果关系, 疾病也是如此, 此时应考虑是否存在胆胰管汇合异常、十二指肠乳头旁憩室等. 研究发现[13], 壶腹部解剖结构异常也是导致不明原因胰腺炎的重要原因之一. 因此, 当出现无法明确病因的胰腺炎、胆管扩张或肿瘤等一系列胆胰疾病时, 临床医师应进一步检查, 考虑是否存在PBM或其他可引发胰胆反流的发病因素如SOD等.
PBM诊断与ERCP内镜微创干预治疗: PBM患者早期常无临床症状, 部分患者仅表现为长期的上腹部饱胀感或隐痛等, 多数患者未予以重视, 往往出现明显不适前往医院就诊时多已合并相关胆胰疾病, 此时临床上多表现为腹痛、发热、呕吐、黄疸等. 本研究中35例患者入院表现为腹痛30例次(85.7%)、发热9例次(25.7%)、呕吐8例次(22.8%)、黄疸4例次(11.4%)、无不适症状的3例次(8.6%); 大部分患者实验室指标中均有一项或多项血液生化如肝酶及胆红素异常升高. PBM患者起病隐匿, 且临床症状不典型, 有时被其他胆胰疾病所掩盖或被临床医生忽视, 因此, 及时明确PBM诊断, 尽早进行有效的内镜微创干预治疗就显得尤为重要.
对于PBM患者诊断, MRCP作为常规首选检查手段, 可以清晰地显示胰胆汇合部的情况, 具有无创、无辐射、经济方便等优点. 但据文献报道, 成人诊断灵敏度为82%-100%, 儿童仅为40%-80%, 特别是对于因年龄小共同通道较短如婴幼儿的PBM显像, 普通MRCP检查效果欠佳, 且检查过程中患儿不易配合, 造成图像不清, 并有运动伪影等质量缺点[14]. 随着内镜技术的不断发展, 现代医学微创或超级微创的观念深入人心, 而ERCP的广泛临床应用, 更使胆胰疾病内镜诊断与超级微创干预治疗融为一体. 对于PBM患者, ERCP不仅可以清晰显示胆胰汇合部的解剖结构, 明确诊断或排除其他相关病变, 还可以在ERCP内镜下微创采集胆汁和组织取样, 而胆汁中的高淀粉酶对PBM具有辅助诊断作用[15]. 根据日本的一项调查结果显示[16], PBM合并胆道扩张患者的胆管癌和胆囊癌的发病率分别为32.1%和62.3%, 而不伴胆道扩张的为7.3%和88.1%, 调查发现, PBM患者的胆道肿瘤要比正常患者发病早约15-20年左右. 因此对于PBM合并胆道扩张患者, 预防性手术切除肝外胆管并进行肝空肠吻合术是一种有效的治疗方式[17]. 但是, 对于肝外胆管未扩张的PBM患者, 是否需要及何时需要预防性外科手术切除胆囊或肝外胆管切除治疗, 目前尚未完全达成共识. 还有学者认为[18], 预防性的胆囊切除术虽然可以降低胆囊癌的发病率, 但是根据后续不断随访调查发现, 外科手术虽然可以降低癌变的发病生率, 但其手术创伤又可造成更进一步的相关部位解剖结构的改变, 手术切除部位之外残存的部位仍然会有出现癌症的风险, 以及术后出现相关并发症等. 对于这部分不合并胆道扩张的患者进行外科手术一切了之更不现实, 而这部分拒绝行外科手术治疗的年轻患者, 则可能会反复发生胰腺炎、胆管炎、胆管结石, 甚至胆道系统癌变等严重后果, 因此, 经ERCP内镜下微创干预治疗就可能成为优先选择. 研究发现, 即使是外科给予预防性胆囊切除术后, PBM患者的胆、胰管的异常解剖病理改变也还是存在的, 甚至因为胆囊或肝外胆管的预防性切除, 导致胆道流体动力学的进一步不可预期的改变. 对于PBM患者, 解除流出道梗阻, 促进胆胰液分流成为解决问题的关键所在. Kobayashi等[19]报道了在46例有胆道扩张的患者外科行肝外胆管切除后, 随访结果中有3例发生了胆管癌(6.5%). 本文中有3名患者尽管入院前因腹痛、胆囊炎/胆囊结石、PBM等原因, 已经采取了胆囊切除术或预防性切除术, 但是仍以首发急性胰腺炎/胆管炎再次入院, 其中1例53岁女性伴胆管扩张的患者, 随诊半年后确诊为肝门部胆管癌后而行外科手术治疗. 因此, 对于PBM患者, 无论是外科的预防性胆囊或肝外胆管切除手术, 还是ERCP内镜下微创干预治疗后, 都应密切随访和检查, 及时发现胆道系统癌变等严重病变.
PBM引发的胆、胰相关疾病的原因主要是胰、胆反流问题. 有研究表明[20], EST可缩短共同通道的长度, 对异常汇合的胰胆管进行分流, 改善反流情况, 促使胰液及胆汁分流通畅, 甚至可以使胆胰管"合流入肠"矫正为"分流入肠". 加之, ERCP亦可对PBM患者共同通道狭窄的患者, 进行十二指肠柱状气囊扩张术及胆、胰管取石等操作, 明显改善了胆、胰汇合异常所导致的胆汁流体力学变化及并发症发生[21,22]. 因此, ERCP在PBM微创干预治疗中具有重要作用. Zeng等[23]回顾分析了经ERCP包括EST等干预治疗PBM患者的临床效果, 结果显示, ERCP是缓解PBM患者胆道或胰腺梗阻症状的安全有效的治疗选择, 具有创伤小、并发症少、可重复性强的特点. Zhang等[24]学者通过53例胆囊结石或淤泥的患者研究发现, 经EST术治疗后, 发现患者无论在进食或静息状态下, 其术后胆囊的射排分数均较术前明显增加, 超声检查胆囊内结石或污泥消失, 可见ERCP可以缓解其临床症状, 减少胆囊胆汁淤积, 改善胆囊排空能力, 降低胆囊炎及胆囊结石的发病率. 本研究所有患者行CCEST微创干预治疗后, 与EST术前比较, 术后1 wk腹痛疼痛评分从术前(6.9±1.02)分下降至(0.3±0.53)分(P<0.05); 血清ALT、AST、TBil、DBil、CRP指标显著下降(P<0.05); 尽管ERCP术后1 wk血清GGT值从99.0 U/L下降至75.0 U/L, 无显著统计学差异, 但考虑可能与本组患者经ERCP微创干预后复查间隔时间较短、该指标下降缓慢且样本量偏少有关. ERCP术后1 wk, 患者血清淀粉酶较术前有所升高, 差异无显著性统计学意义, 考虑与患者术后发生PEP有关. 结果显示, 35例患者胆汁淀粉酶从术前(3247±1032) U/L术后1 wk降至(2876±926) U/L, 差异有显著性统计学意义(P<0.05). 该研究35例PBM患者经过(22.05±10.67) mo的随访, 其中1例患者确诊为合并胆管癌行外科手术, 术后有4人因胆总管结石复发而再次行ERCP治疗, 相关临床症状消失, 也取得满意疗效, 总有效率为88.6%(31/35). 研究发现[25], CCEST术不仅可以缩短PBM患者胆、胰管共同通道, 而且对于部分合并胆、胰管结石患者给予内镜下结石取出术, 解决了胆胰管及共同通道梗阻问题, 通畅引流, 使临床症状得到明显缓解或消失.
但对于PBM患者选择内镜下微创治疗或外科手术一直存在一定争议, 尽管内镜微创介入一定程度上改善了胆胰管汇合部合流异常的解剖结构, 通畅引流, 但是仍然面临着PBM患者的胆管癌高发风险的预期问题[26]. 因此, 对于PBM患者行ERCP内镜微创治疗时更需要把握CCEST的适应症的"度", 做到对于不同的PBM患者应具体情况具体分析, 充分评估, 这也是PBM患者行内镜微创介入治疗的难点所在, 值得进一步研究. 本组患者经内镜下CCEST微创介入治疗均未出现明显出血、消化道穿孔、急性重症胰腺炎等ERCP相关严重并发症, 为医生提供了更多的临床治疗选择.
PBM起病隐匿, 且发病率较低, 引发的胆、胰相关疾病和胆道癌变高风险值得临床医生重视, 尤其是对于年轻PBM患者, 尽早明确诊断及治疗是关键. 相较于常规预防性外科手术治疗的创伤性, 且术后仍有胆胰汇合解剖结构异常的存在和相关胆胰疾病的发生, 经ERCP内镜下超级微创干预治疗就显得弥足可取, 因此, 无论是儿童还是成人PBM患者, ERCP内镜下微创干预治疗, 尤其是CCEST缩短共同通道有望成为一种优先选择.
胰胆管合流异常(pancreaticobiliary maljunction, PBM)指解剖上主胰管和胆管在十二指肠壁外汇合, 于1969年Babbitt正式命名. PBM导致Oddi括约肌的作用不直接影响胰胆连接处, 无法对汇合口发挥管控作用, 导致胰液和胆汁在两管腔之间交互反流, 继而造成胆道或胰腺的各种病理改变. 目前单纯的进行外科手术一切了之不现实, 研究探索内镜逆行胰胆管造影(endoscopic retrograde cholangiopancreatography, ERCP)微创缩短胰胆管共同通道在PBM中的应用及其机制就变得越来越迫切需要, 这也为PBM患者提供又一个治疗的技术选择.
本研究的重点是ERCP微创干预治疗PBM, 探讨通过缩短共同通道(common channel, CC)对PBM患者是否具有减少胰胆反流, 矫正"合流异常"转化为"分流入肠"的作用; 同时通过柱状气囊扩张等, 尽量保护括约肌功能, 同时又改善共同通道的引流作用, 防止胰胆反流, 减少反流性胆管炎及复发性胰腺炎等疾病发生, 并同时取出胆胰结石等, 从而达到内镜下微创干预, 最大限度减少局部解剖结构损伤的治疗目的和动机, 为临床内镜治疗PBM提供理论依据.
探讨经内镜下十二指肠乳头括约肌共同通道切开术(endoscopic common channel sphinctertomy, CCEST)微创干预治疗PBM患者的临床效果及安全性.
对比观察分析经ERCP内镜下CCEST微创干预治疗35例PBM患者前后1 wk的临床症状变化情况、实验室检查结果、疼痛评分变化、结石取出率等. 统计学采用t检验和非参数检验(Mann-Whitney U检验).
35例PBM患者均给予内镜下CCEST, 以缩短共同通道,其中合并胆、胰管结石患者18例(51.43%), 14例患者首次ERCP取石成功, 成功率为78%; ERCP微创干预治疗术后1 wk, 患者腹痛疼痛评分从术前(6.9±1.02)分下降至(0.3±0.53)分, 差异有显著性统计学意义(P<0.05); 血清ALT、AST、TBil、DBil、CRP及胆汁淀粉酶指标明显下降, 差异有显著性统计学意义(P<0.05); 5例患者出现轻度PEP, 经对症治疗后均未出现术后出血、消化道穿孔和重症胰腺炎等严重并发症.
CCEST通过缩短胆胰管汇合部共同通道, 早期改善PBM患者胆胰管引流, 使患者临床症状得到改善或消失, 是内镜微创治疗PBM患者的有效安全方法.
CCEST术不仅可以缩短PBM患者胆、胰管共同通道, 而且对于部分合并胆、胰管结石患者给予内镜下结石取出术, 解决了胆胰管及共同通道梗阻问题, 通畅引流, 使临床症状得到明显缓解或消失, 为临床医生提供了更多的治疗选择. 但考虑本研究纳入患者数较少可能会限制统计分析的可靠性, 其近、远期的临床效果及安全性仍需要进一步循证医学研究和探索.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 2. | Kamisawa T, Ando H, Hamada Y, Fujii H, Koshinaga T, Urushihara N, Itoi T, Shimada H; Japanese Study Group on Pancreaticobiliary Maljunction. Diagnostic criteria for pancreaticobiliary maljunction 2013. J Hepatobiliary Pancreat Sci. 2014;21:159-161. [PubMed] [DOI] |
| 3. | Komi N, Takehara H, Kunitomo K, Miyoshi Y, Yagi T. Does the type of anomalous arrangement of pancreaticobiliary ducts influence the surgery and prognosis of choledochal cyst? J Pediatr Surg. 1992;27:728-731. [PubMed] [DOI] |
| 4. | Babbitt DP. [Congenital choledochal cysts: new etiological concept based on anomalous relationships of the common bile duct and pancreatic bulb]. Ann Radiol (Paris). 1969;12:231-240. [PubMed] |
| 5. | Kamisawa T, Honda G. Pancreaticobiliary Maljunction: Markedly High Risk for Biliary Cancer. Digestion. 2019;99:123-125. [PubMed] [DOI] |
| 6. | Kamisawa T, Kaneko K, Itoi T, Ando H. Pancreaticobiliary maljunction and congenital biliary dilatation. Lancet Gastroenterol Hepatol. 2017;2:610-618. [PubMed] [DOI] |
| 7. | Sanada Y, Sakuma Y, Sata N. Embryological etiology of pancreaticobiliary system predicted from pancreaticobiliary maljunction with incomplete pancreatic divisum: a case report. BMC Surg. 2018;18:50. [PubMed] [DOI] |
| 9. | Kamisawa T, Ando H, Suyama M, Shimada M, Morine Y, Shimada H; Working Committee of Clinical Practice Guidelines for Pancreaticobiliary Maljunction; Japanese Study Group on Pancreaticobiliary Maljunction. Japanese clinical practice guidelines for pancreaticobiliary maljunction. J Gastroenterol. 2012;47:731-759. [PubMed] [DOI] |
| 10. | Ragot E, Mabrut JY, Ouaïssi M, Sauvanet A, Dokmak S, Nuzzo G, Halkic N, Dubois R, Létoublon C, Cherqui D, Azoulay D, Irtan S, Boudjema K, Pruvot FR, Gigot JF, Kianmanesh R; Working Group of the French Surgical Association. Pancreaticobiliary Maljunctions in European Patients with Bile Duct Cysts: Results of the Multicenter Study of the French Surgical Association (AFC). World J Surg. 2017;41:538-545. [PubMed] [DOI] |
| 11. | Yamada K, Ishikawa T, Ohno E, Iida T, Suzuki H, Uetsuki K, Yashika J, Yoshikawa M, Takami H, Inokawa Y, Uchida H, Kawashima H, Fujishiro M. Double common bile duct associated with pancreaticobiliary maljunction. Nagoya J Med Sci. 2021;83:655-661. [PubMed] [DOI] |
| 12. | Morine Y, Mori H, Utsunomiya T, Imura S, Ikemoto T, Ishibashi H, Shimada M. Epidemiology and Clinical features of Pancreaticobiliary Maljunction. Tando. 2011;25:133-140. [DOI] |
| 13. | Beyer G, Hoffmeister A, Lorenz P, Lynen P, Lerch M M, Mayerle J. Clinical Practice Guideline-Acute and Chronic Pancreatitis. Deutsches Arzteblatt international. 2022;119:495-501. [PubMed] [DOI] |
| 15. | Morine Y, Shimada M, Takamatsu H, Araida T, Endo I, Kubota M, Toki A, Noda T, Matsumura T, Miyakawa S, Ishibashi H, Kamisawa T, Shimada H. Clinical features of pancreaticobiliary maljunction: update analysis of 2nd Japan-nationwide survey. J Hepatobiliary Pancreat Sci. 2013;20:472-480. [PubMed] [DOI] |
| 16. | Kamisawa T, Kuruma S, Chiba K, Tabata T, Koizumi S, Kikuyama M. Biliary carcinogenesis in pancreaticobiliary maljunction. J Gastroenterol. 2017;52:158-163. [PubMed] [DOI] |
| 17. | Ishibashi H, Shimada M, Kamisawa T, Fujii H, Hamada Y, Kubota M, Urushihara N, Endo I, Nio M, Taguchi T, Ando H; Japanese Study Group on Congenital Biliary Dilatation (JSCBD). Japanese clinical practice guidelines for congenital biliary dilatation. J Hepatobiliary Pancreat Sci. 2017;24:1-16. [PubMed] [DOI] |
| 18. | Fukuzawa H, Kajihara K, Tajikawa T, Aoki K, Ajiki T, Maeda K. Mechanism of pancreatic juice reflux in pancreaticobiliary maljunction: A fluid dynamics model experiment. J Hepatobiliary Pancreat Sci. 2020;27:265-272. [PubMed] [DOI] |
| 19. | Kobayashi S, Asano T, Yamasaki M, Kenmochi T, Nakagohri T, Ochiai T. Risk of bile duct carcinogenesis after excision of extrahepatic bile ducts in pancreaticobiliary maljunction. Surgery. 1999;126:939-944. [PubMed] [DOI] |
| 20. | Parlak E, Köksal AŞ, Eminler AT, Çiçek B, Dişibeyaz S, Bostancı EB, Akoğlu M, Şahin B. Pancreaticobiliary maljunction in Turkish patients: a multicenter case series. Surg Endosc. 2022;36:2042-2051. [PubMed] [DOI] |
| 22. | Halász A, Pécsi D, Farkas N, Izbéki F, Gajdán L, Fejes R, Hamvas J, Takács T, Szepes Z, Czakó L, Vincze Á, Gódi S, Szentesi A, Párniczky A, Illés D, Kui B, Varjú P, Márta K, Varga M, Novák J, Szepes A, Bod B, Ihász M, Hegyi P, Hritz I, Erőss B; Hungarian Pancreatic Study Group. Outcomes and timing of endoscopic retrograde cholangiopancreatography for acute biliary pancreatitis. Dig Liver Dis. 2019;51:1281-1286. [PubMed] [DOI] |
| 23. | Zeng JQ, Deng ZH, Yang KH, Zhang TA, Wang WY, Ji JM, Hu YB, Xu CD, Gong B. Endoscopic retrograde cholangiopancreatography in children with symptomatic pancreaticobiliary maljunction: A retrospective multicenter study. World J Gastroenterol. 2019;25:6107-6115. [PubMed] [DOI] |
| 24. | Zhang C, Yang YL, Ma YF, Zhang HW, Shi LJ, Li JY, Lin MJ, Qi CC. Endoscopic Sphincterotomy for Gallbladder Muddy Stones or Sludge in Patients With Papillary Disease: A Retrospective Study. Surg Laparosc Endosc Percutan Tech. 2018;28:30-35. [PubMed] [DOI] |
| 25. | Jin Z, Bie LK, Tang YP, Ge L, Shen SS, Xu B, Li T, Gong B. Endoscopic therapy for patients with pancreaticobiliary maljunction: a follow-up study. Oncotarget. 2017;8:44860-44869. [PubMed] [DOI] |