修回日期: 2023-04-03
接受日期: 2023-04-25
在线出版日期: 2023-05-08
慢性乙型肝炎(chronic hepatitis B, CHB)伴结核病患者确诊后需及时进行抗病毒、抗结核治疗, 但由于疗程较长, 应用药物较多, 治疗过程中易发生肝损伤, 影响治疗结局. 本文对治疗中肝损伤进行研究探讨, 为临床防治肝损伤提供参考.
探讨不同病情CHB伴肺结核患者抗病毒+抗结核治疗中肝损伤情况及临床意义, 以期为临床预防肝损伤提供理论依据.
选取2017-12/2022-12我院收治的200例CHB伴肺结核患者, 均给予抗病毒联合抗结核治疗, 统计患者抗结核治疗完成情况与肝损伤发生情况. 比较乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)阳性与阴性、不同肝组织炎症坏死分级和纤维化程度患者治疗前后肝生化变化及肝损伤发生情况, 应用Spearman分析肝组织炎症坏死分级和纤维化程度与肝生化异常项目数关系.
(1)200例CHB伴肺结核患者抗病毒+抗结核治疗中共发生肝损伤97例, 总发生率为48.50%(97/200), 69例经过更改抗结核药物和护肝处理完成标准疗程治疗, 28例经更改抗结核药物和护肝处理后肝生化仍无好转, 暂停抗结核治疗, 导致肺结核治疗失败; (2)肝生化谷草转氨酶(aspartate aminotransferase, AST)、谷丙转氨酶(alanine aminotransferase, ALT)、胆碱酯酶、凝血酶原活动度、电泳γ球蛋白、白蛋白/球蛋白(A/G)、白蛋白、总胆红素(total bilirubin, TBIL)异常程度分布以轻中度为主; (3)治疗后HBsAg阳性患者ALT、AST、电泳γ球蛋白、TBIL高于阴性患者, 胆碱酯酶、凝血酶原活动度、A/G、白蛋白低于阴性患者(P<0.05); 治疗后随着肝组织炎症坏死分级和纤维化分级程度递增, ALT、AST、电泳γ球蛋白、TBIL逐渐升高, 胆碱酯酶、凝血酶原活动度、A/G、白蛋白逐渐降低(P<0.05); (4)HBsAg阳性患者肺结核治疗失败率、肝损伤总发生率高于阴性患者(P<0.05); 肝组织炎症坏死分级和纤维化分级程度越高, 肺结核治疗失败率、肝损伤总发生率越高(P<0.05); (5)肝组织炎症坏死分级、纤维化程度与肝生化异常项目数呈正相关(r = 0.458、0.604, P<0.001).
HBsAg阳性、肝组织炎症坏死分级及肝组织纤维化程度高的CHB伴肺结核患者肝生化异常程度严重、肝损伤总发生率高、肺结核治疗失败率高, 因此, 在CHB伴肺结核患者抗结核治疗过程中, 应对上述人群加强肝功能检测, 以便及时调整治疗方案, 进一步改善预后.
核心提要: 本研究探讨不同病情慢性乙型肝炎伴肺结核患者抗病毒+抗结核治疗中肝损伤情况, 发现乙型肝炎表面抗原阳性、肝组织炎症坏死分级及肝组织纤维化程度高的患者肝损伤总发生率高, 可为临床预防肝损伤提供理论依据.
引文著录: 田家发, 桂启芳. 不同病情CHB伴肺结核患者抗病毒联合抗结核治疗中肝损伤情况观察及临床意义. 世界华人消化杂志 2023; 31(9): 377-384
Revised: April 3, 2023
Accepted: April 25, 2023
Published online: May 8, 2023
Patients with chronic hepatitis B (CHB) and tuberculosis need timely antiviral and anti-tuberculosis treatment after diagnosis, but due to the long duration of treatment and the simultaneous use of multiple drugs, liver injury may occur during treatment and affect the outcome.
To investigate the clinical significance of liver injury in antiviral + anti-tuberculosis treatment in patients with different conditions of CHB with pulmonary tuberculosis.
Two hundred patients with CHB and pulmonary tubercu-losis admitted to our hospital from December 2017 to December 2022 were selected, and all were given antiviral + anti-tuberculosis treatment. The completion of anti-tuberculosis treatment and the occurrence of liver injury were recorded. Hepatic biochemical changes and the occurrence of liver injury were compared between hepatitis B surface antigen (HBsAg)-positive and -negative patients, and between those with different liver tissue inflammation/necrosis degrees and fibrosis grades. Spearman correlation analysis was performed to analyze the relationship between liver tissue inflammation/necrosis degree and fibrosis grade and the number of abnormal liver biochemical indexes.
A total of 97 cases of liver injury occurred in 200 patients with CHB and pulmonary tuberculosis on antiviral + anti-tuberculosis therapy, with an overall incidence of 48.50% (97/200). Sixty-nine cases completed the standard course of treatment after changing anti-tuberculosis drugs and using liver protecting treatment, while 28 cases had no improvement in liver biochemistry even after changing anti-tuberculosis drugs and using liver protecting treatment and discontinued anti-tuberculosis treatment, resulting in failure of anti-tuberculosis treatment. The abnormalities of alanine aminotransferase (ALT), aspartate aminotransferase (AST), cholinesterase, prothrombin activity, electrophoretic gamma globulin, albumin/globulin (A/G) ratio, albumin, and total bilirubin were mainly mild to moderate. After treatment, ALT, AST, electrophoretic gamma globulin, and total bilirubin were higher in HBsAg-positive patients than in HBsAg-negative patients, and cholinesterase, prothrombin activity, A/G ratio, and albumin were lower in HBsAg-positive patients than in HBsAg-negative patients (P < 0.05). ALT, AST, electrophoretic gamma globulin, cholinesterase, and total bilirubin gradually increased as liver tissue inflammation/necrosis degree and fibrosis grade increased (P < 0.05). The failure rate of anti-tuberculosis treatment and the total incidence of liver injury were higher in HBsAg-positive patients than in negative patients (P < 0.05). The higher the degree of inflammation/necrosis and fibrosis in liver tissue, the higher the failure rate of anti-tuberculosis treatment and the overall incidence of liver injury (P < 0.05). There was a positive correlation between liver tissue inflammation/necrosis degree the fibrosis grade and the number of abnormal liver biochemical indexes (r = 0.458 and 0.604, respectively, P < 0.001 for both).
Patients with CHB with pulmonary tuberculosis who are HBsAg positive and have high grade of liver tissue inflammation/necrosis and fibrosis have severe liver biochemical abnormalities, high overall incidence of liver injury, and high failure rate of anti-tuberculosis treatment. Therefore, liver function tests should be strengthened in the process of anti-tuberculosis treatment among these patients so as to adjust the treatment plan in a timely manner and further improve the prognosis.
- Citation: Tian JF, Gui QF. Clinical significance of liver injury in antiviral plus anti-tuberculosis treatment in patients with different conditions of chronic hepatitis B with pulmonary tuberculosis. Shijie Huaren Xiaohua Zazhi 2023; 31(9): 377-384
- URL: https://www.wjgnet.com/1009-3079/full/v31/i9/377.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i9.377
慢性乙型肝炎(chronic hepatitis B, CHB)和结核病是病毒性传染性疾病及细菌性传染性疾病的两大主要疾患, 严重危害人类健康公共卫生问题[1-3], 患者确诊后应及时进行抗病毒联合抗结核治疗[4,5], 以控制病情进展, 降低疾病传播风险. 既往研究指出[6-10], 由于抗病毒+抗结核疗程较长、联合应用药物较多, 患者在治疗过程中易发生肝损伤, 影响治疗结局. 因此, 临床应及时对患者抗病毒+抗结核治疗中肝损伤情况开展调查研究, 以对肝损伤的预防提供指导信息. 但目前, 临床对CHB和结核病患者肝损伤的研究多集中于药物预防等方面[11,12], 而对治疗中肝损伤情况的研究较少. 基于此, 本研究选取我院200例CHB伴肺结核患者, 通过观察不同病情CHB伴肺结核患者抗病毒+抗结核治疗中肝损伤情况, 为临床治疗CHB伴肺结核时有效预防肝损伤提供理论依据. 报告如下.
本研究经我院伦理委员会审核批准, 伦理编号为: JH87795. 选取2017-12/2022-12我院收治的200例CHB伴肺结核患者, 男125例, 女75例, 年龄26岁-67岁, 平均(38.62±4.14)岁. 纳入标准: 符合CHB、肺结核相关诊断标准[13,14]; 均经乙肝五项检查、肝功能检查、乙肝DNA检测等确诊为慢性乙型肝炎; 均经影像学检查、病原学检查等确诊为肺结核; 均为初次治疗, 入院前未使用过抗病毒+抗结核相关药物; 年龄>18岁; 认知功能正常; 排除标准: 合并肺气肿、肝硬化、肺癌等疾病; 入院3 mo内使用过免疫抑制剂; 合并酒精性肝病、药物性肝病、遗传代谢性肝病等其他影响肝功能指标的疾病; 精神病史; 依从性差.
患者均清淡规律饮食, 戒烟戒酒, 防止过度疲劳, 同时给予抗病毒+抗结核治疗: 恩替卡韦片(中美上海施贵宝制药有限公司, 批准文号: H20052237)0.5 mg, 口服, 1次/d; 注射用硫酸链霉素(华北制药股份有限公司, 批准文号: H13020651)750 mg, 肌肉注射, 1次/d; 利福平胶囊(邯郸市柏林药业有限公司, 批准文号: H13020373)450 mg, 口服, 1次/d; 异烟肼片(安徽国森药业有限公司, 批准文号: H34022342)300 mg, 口服, 1次/d; 吡嗪酰胺片(恒诚制药集团淮南有限公司, 批准文号: H34022731)1250 mg, 口服, 1次/d. 连续治疗2 mo后, 将治疗方案调整为恩替卡韦片0.5 mg, 口服, 1次/d; 异烟肼片300 mg, 口服, 1次/d; 利福平胶囊450 mg, 口服, 1次/d; 连续治疗4 mo. 治疗期间每半个月测定1次肝功能, 对于40 U/L<谷草转氨酶(aspartate aminotransferase, AST)<130 U/L, 总胆红素(total bilirubin, TBIL)轻度增高者, 可继续采用上述方案治疗, 同时给予保肝药物, 并每周检测1次肝功能; 对于AST≥130 U/L, TBIL急剧增高者, 立即停止抗结核治疗, 将治疗方案调整为利福喷丁(河北爱尔海泰制药有限公司, 批准文号: H20133047)、力克肺疾[华润三九(北京)药业有限公司, 批准文号: H11022366]、乙胺丁醇(哈药集团制药六厂, 批准文号: H23020090)等对肝功能损伤较小的药物, 并加强护肝治疗.
(1)参照《药物性肝损伤诊治指南》[15]中相关诊断标准: 治疗前肝生化指标正常, 治疗后肝生化指标≥1项异常即为肝损伤. 肝生化指标指AST、谷丙转氨酶(alanine aminotransferase, ALT)、胆碱酯酶、凝血酶原活动度、电泳γ球蛋白、白蛋白/球蛋白(A/G)、白蛋白、TBIL; (2)肝损伤程度判定标准: 轻度: 临床症状轻微, B超检查肝脾无异常变化, 肝功能指标轻度异常, 表现为胆碱酯酶>5400 U/L, A/G≥1.4, ALT/AST≤正常3倍, 电泳γ球蛋白≤21%, TBIL≤正常2倍, 凝血酶原活动度>70%, 白蛋白≥35 g/L; 中度: 临床症状较为明显, B超可见肝内回声增粗, 肝脏或肝脾轻度肿大, 肝内管道走行多清晰, 门静脉、脾静脉内径无增宽, 肝功能指标中度异常, 表现为4500 U/L<胆碱酯酶≤5400 U/L, 1.0<A/G<1.4, ALT/AST>正常3倍, 21%<电泳γ球蛋白<26%, 正常2倍<TBIL≤正常5倍, 60%≤凝血酶原活动度≤70%, 白蛋白≥35 g/L; 重度: 明显或持续性肝炎症状, B超可见肝内回声明显增粗、分布不均, 脾脏明显肿大, 肝内管道走行不清晰或轻度狭窄, 门静脉、脾静脉内径增宽; 肝功能指标重度异常, 表现为胆碱酯酶≤4500 U/L, A/G<1.0, ALT/AST>正常3倍, 电泳γ球蛋白≥26%, TBIL>正常5倍, 40%<凝血酶原活动度<60%, 白蛋白≤32 g/L.
(1)于患者入院后次日清晨抽取晨起空腹静脉血5 mL, 3000 r/min离心12 min(离心半径10 cm), 分离取血清, 置于-20 ℃低温保存, 以电化学发光免疫法测定乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg), HBsAg≤0.5 ng/mL为阴性, >0.5 ng/mL为阳性; 以全自动生化分析仪(美国贝克曼公司, 仪器型号: AU680)测定ALT、AST、胆碱酯酶、电泳γ球蛋白、A/G、白蛋白、TBIL, 以全自动血凝仪(美德太平洋科技有限责任公司, 仪器型号: TSA6000)测定凝血酶原活动度; (2)在患者签署知情同意书后开展肝活检, 通过B超进行定位, 获取10 mm-20 mm肝组织, 包括4个以上可供评价的汇管区. 由高年资病理医师进行肝组织炎症坏死分级、肝组织纤维化程度判断, 严格参照《慢性乙型肝炎防治指南》[16]中相关标准进行判断.
统计学处理 采用SPSS 23.0软件包进行数据分析, 计数资料以n(%)表示, χ2检验, 若理论频数<1, Fisher`s精确检验, 理论频数≥1且≤5, 用校正检验, 计量资料满足正态性和方差齐性用(mean±SD)表示, 两组间比较采用独立样本t检验, 多组间比较采用单因素方差分析, 应用Spearman分析肝组织炎症坏死分级和纤维化程度与肝生化异常项目数关系, P<0.05表示差异有统计学意义.
200例患者中, 103例(51.50%)无肝损伤完成抗结核标准疗程治疗, 69例(34.50%)有肝损伤患者经过更改抗结核药物和护肝处理完成标准疗程治疗, 28例(14.00%)经更改抗结核药物和护肝处理, 肝生化仍无好转, 暂停抗结核治疗, 导致肺结核治疗失败.
HBsAg阳性患者肺结核治疗失败率高于阴性患者(P<0.05); 肝组织炎症坏死分级G3分级患者肺结核治疗失败率高于G2、G1分级患者, G2分级肺结核治疗失败率高于G1分级(P<0.05); 肝组织纤维化程度S3分级患者肺结核治疗失败率高于S0-S2分级患者, S2分级患者肺结核治疗失败率高于S0-S1分级患者, S1分级患者肺结核治疗失败率高于S0分级患者(P<0.05). 见表1.
| 病情分类 | 例数 | 无肝损伤完成抗结核标准疗程 | 有肝损伤完成抗结核标准疗程 | 肺结核治疗失败 |
| HBsAg | ||||
| 阳性 | 86 | 26(30.23) | 41(47.67) | 19(22.09) |
| 阴性 | 114 | 77(67.54) | 28(24.56) | 9(7.89) |
| χ2 | 27.322 | 11.589 | 8.208 | |
| P | <0.001 | 0.001 | 0.004 | |
| 肝组织炎症坏死分级 | ||||
| G1 | 64 | 52(81.25) | 12(18.75) | 0(0.00) |
| G2 | 71 | 38(53.52) | 23(32.39) | 10(14.08) |
| G3 | 65 | 13(20.00) | 34(52.31) | 18(27.69) |
| χ2 | 48.616 | 16.286 | 20.540 | |
| P | <0.001 | 0.001 | 0.004 | |
| 肝组织纤维化程度 | ||||
| S0 | 46 | 41(89.13) | 5(10.87) | 0(0.00) |
| S1 | 48 | 33(68.75) | 14(29.17) | 1(2.08) |
| S2 | 56 | 26(46.43) | 21(37.50) | 9(16.07) |
| S3 | 50 | 3(6.00) | 29(58.00) | 18(36.00) |
| χ2 | 73.816 | 24.413 | 33.449 | |
| P | <0.001 | <0.001 | <0.001 | |
200例CHB伴肺结核患者抗病毒+抗结核治疗中共发生肝损伤97例, 总发生率为48.50%(97/200); 其中肝生化异常项目数: 1项46例(47.42%), 2项31例(31.96%), ≥3项20例(20.62%); 肝生化ALT、AST、胆碱酯酶、凝血酶原活动度、电泳γ球蛋白、A/G、白蛋白、TBIL异常程度分布以轻中度为主, 详情见表2.
| 肝生化 | 轻度异常 | 中度异常 | 重度异常 | 总异常率 |
| ALT | 16(8.00) | 17(8.50) | 3(1.50) | 36(18.00) |
| AST | 20(10.00) | 25(12.50) | 4(2.00) | 45(22.50) |
| 胆碱酯酶 | 5(2.50) | 3(1.50) | 2(1.00) | 10(5.00) |
| 凝血酶原活动度 | 21(10.50) | 5(2.50) | 1(0.50) | 27(13.50) |
| 电泳γ球蛋白 | 13(6.50) | 6(3.00) | 2(1.00) | 21(10.50) |
| A/G | 15(7.50) | 2(1.00) | 1(0.50) | 18(9.00) |
| 白蛋白 | 9(4.50) | 4(2.00) | 1(0.50) | 14(7.00) |
| 总胆红素 | 22(11.00) | 13(6.50) | 4(2.00) | 39(34.50) |
HBsAg阳性与阴性患者、不同肝组织炎症坏死分级和纤维化程度患者治疗前ALT、AST、胆碱酯酶、凝血酶原活动度、电泳γ球蛋白、A/G、白蛋白、TBIL比较, 差异无统计学意义; 见表3.
| 病情分类 | 例数 | ALT(U/L) | AST(U/L) | 胆碱酯酶(U/L) | 凝血酶原活动度(%) | 电泳γ球蛋白(%) | A/G | 白蛋白(g/L) | 总胆红素 |
| HBsAg | |||||||||
| 阳性 | 86 | 30.15±4.06 | 32.80±3.77 | 5824.06±317.33 | 83.66±7.52 | 15.42±3.03 | 1.82±0.24 | 42.25±6.08 | 13.05±3.42 |
| 阴性 | 114 | 29.87±4.29 | 31.95±4.16 | 5872.82±325.97 | 84.78±8.94 | 15.75±3.48 | 1.86±0.27 | 43.19±5.64 | 12.79±3.55 |
| t | 0.468 | 1.489 | 1.059 | 0.938 | 0.701 | 1.087 | 1.128 | 0.521 | |
| P | 0.641 | 0.138 | 0.291 | 0.349 | 0.484 | 0.278 | 0.261 | 0.603 | |
| 肝组织炎症坏死分级 | |||||||||
| G1 | 64 | 29.79±3.79 | 31.00±3.88 | 5887.60±309.64 | 85.01±9.57 | 15.73±3.50 | 1.83±0.25 | 43.05±5.75 | 12.94±3.61 |
| G2 | 71 | 29.35±4.05 | 32.27±4.36 | 5824.35±348.11 | 84.18±8.68 | 15.90±3.26 | 1.82±0.26 | 42.97±6.22 | 12.86±3.49 |
| G3 | 65 | 30.89±4.63 | 32.67±4.19 | 5846.69±326.74 | 83.73±9.03 | 15.18±3.47 | 1.87±0.24 | 42.34±5.94 | 12.90±3.52 |
| F | 2.424 | 2.847 | 0.633 | 0.330 | 0.815 | 0.743 | 0.277 | 0.009 | |
| P | 0.091 | 0.060 | 0.532 | 0.720 | 0.444 | 0.477 | 0.759 | 0.991 | |
| 肝组织纤维化程度 | |||||||||
| S0 | 46 | 29.16±3.76 | 31.76±3.59 | 5834.22±316.20 | 83.66±8.77 | 15.77±3.60 | 1.86±0.23 | 42.88±6.03 | 12.88±3.40 |
| S1 | 48 | 29.85±4.51 | 32.45±3.76 | 5909.75±309.79 | 84.95±9.25 | 15.26±3.39 | 1.82±0.20 | 43.01±5.66 | 13.01±3.29 |
| S2 | 56 | 30.48±3.89 | 32.68±3.44 | 5874.48±338.76 | 83.57±9.84 | 16.03±3.45 | 1.83±0.25 | 42.95±5.92 | 12.97±3.34 |
| S3 | 50 | 30.34±4.14 | 32.31±3.02 | 5787.14±325.60 | 85.08±8.12 | 15.33±3.22 | 1.85±0.27 | 42.32±5.89 | 12.73±3.81 |
| F | 1.045 | 0.628 | 1.316 | 0.405 | 0.596 | 0.279 | 0.147 | 0.064 | |
| P | 0.374 | 0.598 | 0.270 | 0.750 | 0.618 | 0.840 | 0.932 | 0.979 | |
治疗后HBsAg阳性患者ALT、AST、电泳γ球蛋白、TBIL高于阴性患者, 胆碱酯酶、凝血酶原活动度、A/G、白蛋白低于阴性患者(P<0.05); 治疗后随着肝组织炎症坏死分级和纤维化分级程度递增, ALT、AST、电泳γ球蛋白、TBIL逐渐升高, 胆碱酯酶、凝血酶原活动度、A/G、白蛋白逐渐降低, 两两分级间比较差异均有统计学意义(P<0.05). 见表4.
| 病情分类 | 例数 | ALT(U/L) | AST(U/L) | 胆碱酯酶(U/L) | 凝血酶原活动度(%) | 电泳γ球蛋白(%) | A/G | 白蛋白(g/L) | 总胆红素 |
| HBsAg | |||||||||
| 阳性 | 86 | 70.52±16.29 | 83.26±20.77 | 5400.96±266.01 | 73.22±9.00 | 23.35±3.79 | 1.29±0.22 | 36.27±4.59 | 48.94±11.03 |
| 阴性 | 114 | 46.88±14.56 | 51.24±18.35 | 5696.24±215.36 | 78.84±7.15 | 19.16±4.05 | 1.57±0.26 | 39.68±3.00 | 32.76±10.25 |
| t | 10.799 | 11.541 | 8.671 | 4.921 | 7.445 | 8.047 | 6.340 | 10.695 | |
| P | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | |
| 肝组织炎症坏死分级 | |||||||||
| G1 | 64 | 40.89±15.00 | 51.71±14.68 | 5796.25±208.44 | 78.92±7.05 | 18.04±3.11 | 1.60±0.19 | 40.22±3.56 | 20.55±5.00 |
| G2 | 71 | 55.74±12.02 | 68.49±17.90 | 5532.61±223.38 | 76.84±6.44 | 21.06±3.45 | 1.52±0.21 | 38.05±3.64 | 31.04±4.82 |
| G3 | 65 | 74.39±16.95 | 74.30±16.11 | 5385.83±216.70 | 73.50±6.63 | 23.73±3.67 | 1.23±0.18 | 36.41±3.28 | 68.08±4.63 |
| F | 83.966 | 33.305 | 59.513 | 10.763 | 44.671 | 65.361 | 19.214 | 1747.785 | |
| P | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | |
| 肝组织纤维化程度 | |||||||||
| S0 | 46 | 42.62±10.06 | 47.55±10.64 | 5730.15±197.58 | 80.95±7.11 | 18.11±2.99 | 1.70±0.19 | 40.02±4.39 | 25.26±3.85 |
| S1 | 48 | 49.98±13.67 | 58.36±13.82 | 5694.33±220.35 | 77.78±5.94 | 20.06±3.54 | 1.59±0.17 | 38.98±4.52 | 33.85±4.19 |
| S2 | 56 | 57.56±11.46 | 68.59±16.67 | 5560.72±205.18 | 75.51±6.38 | 21.78±3.26 | 1.36±0.20 | 37.84±3.79 | 41.71±5.66 |
| S3 | 50 | 76.54±15.92 | 83.45±15.22 | 5310.78±184.50 | 71.97±6.56 | 23.53±3.64 | 1.19±0.21 | 36.22±4.05 | 56.43±4.94 |
| F | 61.383 | 54.354 | 43.052 | 16.326 | 22.915 | 68.052 | 7.349 | 373.733 | |
| P | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | |
HBsAg阳性患者肝损伤总发生率高于阴性患者(P<0.05); 随着肝组织炎症坏死分级和纤维化程度递增, 肝损伤总发生率逐渐升高, 两两分级间比较差异均有统计学意义(P<0.05). 见表5.
| 病情分类 | 例数 | 1项异常 | 2项异常 | ≥3项异常 | 总发生率 |
| HBsAg | |||||
| 阳性 | 86 | 24(27.91) | 20(23.26) | 16(18.60) | 60(69.77) |
| 阴性 | 114 | 22(19.30) | 11(9.65) | 4(3.51) | 37(32.46) |
| χ2 | 27.322 | ||||
| P | <0.001 | ||||
| 肝组织炎症坏死分级 | |||||
| G1 | 64 | 8(12.50) | 4(6.25) | 0(0.00) | 12(18.75) |
| G2 | 71 | 17(23.94) | 11(15.49) | 5(7.04) | 33(46.48) |
| G3 | 65 | 21(32.31) | 16(24.62) | 15(23.08) | 52(80.00) |
| χ2 | 48.656 | ||||
| P | <0.001 | ||||
| 肝组织纤维化程度 | |||||
| S0 | 46 | 2(4.35) | 3(6.52) | 0(0.00) | 5(10.87) |
| S1 | 48 | 9(18.75) | 5(10.42) | 1(2.08) | 15(31.25) |
| S2 | 56 | 14(25.00) | 7(12.50) | 9(16.07) | 30(53.57) |
| S3 | 50 | 21(42.00) | 16(32.00) | 10(20.00) | 47(94.00) |
| χ2 | 78.122 | ||||
| P | <0.001 | ||||
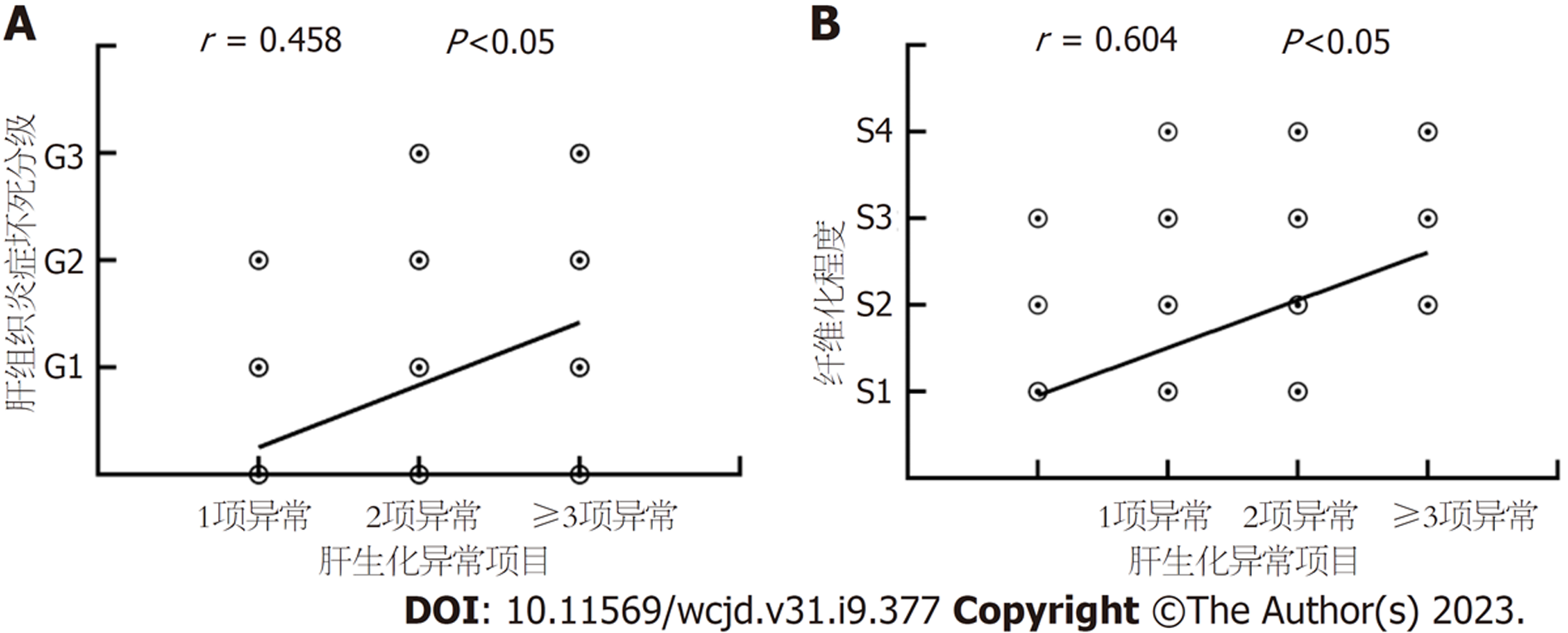
肝组织炎症坏死分级、纤维化程度与肝生化异常项目数呈正相关(r = 0.458、0.604, 均P<0.001), 见图1.
本研究对200例CHB伴肺结核患者抗结核治疗完成情况、肝生化异常情况、肝损伤发生情况进行分析, 结果显示, 200例CHB伴肺结核患者抗病毒+抗结核治疗中共发生肝损伤97例, 总发生率为48.50%(97/200), 肝生化异常程度分布以轻中度为主, 其中69例有肝损伤患者经过更改抗结核药物和护肝处理完成标准疗程治疗, 28例经更改抗结核药物和护肝处理, 肝生化仍无好转, 暂停抗结核治疗, 导致肺结核治疗失败. 可见CHB伴肺结核患者抗病毒+抗结核治疗中肝损伤发生率较高, 可能与患者需长期服用多种抗结核、抗病毒药物, 药物代谢困难, 患者肝脏负担大有关[17,18]. 其中肝脏生化指标异常程度以轻中度为主, 多可通过更改抗结核药物和护肝处理减轻肝损伤程度, 完成标准疗程治疗. 因此, 临床应积极探讨CHB伴肺结核患者抗病毒+抗结核治疗中肝损伤情况, 为有效防治肝损伤提供理论依据.
本研究结果还显示, HBsAg阳性患者肺结核治疗失败率、肝生化异常程度、肝损伤总发生率高于阴性患者, 随着肝组织炎症坏死分级和纤维化程度递增, 肺结核治疗失败率、肝生化异常程度、肝损伤总发生率逐渐升高, 且进一步研究表明肝组织炎症坏死分级、纤维化程度与肝生化异常项目数呈正相关, 表明HBsAg阳性患者、肝组织炎症坏死分级及肝组织纤维化程度高的患者肝生化异常程度严重, 肝损伤总发生率高, 肺结核治疗失败率高. 分析其原因, 可能在于: (1)吴启文等[19]学者在其研究中指出, HBsAg阳性肺结核患者肝损伤发生率61.00%高于HBsAg阳性肺结核患者9.10%, 与本研究结果相似. 其中HBsAg阳性表示患者存在乙肝病毒感染[20-22]. 肺结核合并乙肝病毒感染患者抗结核治疗中肝损伤发生率明显高于无乙肝病毒感染者, 一方面在于结核菌、乙肝病毒可引发机体免疫功能紊乱, 加速肝细胞病理损伤进程; 另一方面乙肝病毒感染会在一定程度上降低机体网状内皮细胞功能, 减弱肝脏清除炎症因子及体内毒素的能力, 从而导致肝生化异常程度严重, 肝损伤总发生率较高; (2)肝组织炎症坏死分级越高, 肝脏生物转化功能越弱, 从而导致药物在肝脏内代谢变慢, 药物浓度较高, 易引发中毒性肝损伤; (3)肝纤维化指在各种因素作用下, 肝内蛋白多糖、胶原及糖蛋白等细胞外基质成分过度沉积[23,24]. 过度的肝纤维沉积会破坏肝小叶结构, 影响肝组织血流供应, 降低药物清除能力, 加剧药物肝毒性, 从而进一步引发肝损伤, 增加肺结核治疗失败风险.
综上所述, HBsAg阳性、肝组织炎症坏死分级及肝组织纤维化程度高的CHB伴肺结核患者肝生化异常程度严重, 肝损伤总发生率高, 肺结核治疗失败率高, 因此, 在CHB伴肺结核患者抗结核治疗过程中, 应注意对上述患病人群加强实验室指标检测, 以便及时调整用药方案, 降低肝损伤发生风险.
慢性乙型肝炎(chronic hepatitis B, CHB)伴结核病患者对患者身心健康造成较大影响, 既要维持乙肝病毒在体内的复发, 还要进行抗结核病的治疗, 临床治疗该类患者的效果并不十分理想.
CHB伴结核病患者用药物进行抗病毒的疗效慢, 疗程较长, 由于药物的毒副作用, 易发生肝损伤. 因此快速有效地治疗方法具有重要的临床意义.
CHB伴结核病患者在抗病毒+抗结核的长期治疗中, 服用较多的药物是否对肝有损伤, 以及损伤的程度等具有临床参考意义, 以期为临床预防肝损伤提供理论依据.
本研究通过检测不同分级的CHB伴结核病患者在治疗过程中肝功能的相关指标, 来评价对肝的副作用影响.
相比较阴性患者, 乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)阳性患者肺结核治疗失败率更高, 肝损伤总发生率更高, 治疗后HBsAg阳性患者ALT、AST、电泳γ球蛋白、总胆红素更高, 胆碱酯酶、凝血酶原活动度、A/G、白蛋白更低, 肝组织炎症坏死分级与治疗效果有关系. 肝组织炎症坏死分级、纤维化程度与肝生化异常项目数呈正相关.
HBsAg阳性、肝组织炎症坏死分级及肝组织纤维化程度高的CHB伴肺结核患者易发生肝损伤, 因此, 在治疗中需要加强该类患者肝功能的监测和保护.
CHB伴肺结核患者由于肝组织炎症坏死分级及肝组织纤维化程度的不同对肝功能的影响不同. 但是抗病毒药物治疗并非本研究中一种, 其他治疗药物对肝功能的损害是否也会达到同样程度还需进一步鉴定.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Neumann-Haefelin C, Thimme R. [Chronic hepatitis B virus infection: current and future treatment strategies]. Bundesgesundheitsblatt Gesundheitsforschung. Gesundheitsschutz. 2022;65:238-245. [PubMed] [DOI] |
| 2. | Tan M, Bhadoria AS, Cui F, Tan A, Van Holten J, Easterbrook P, Ford N, Han Q, Lu Y, Bulterys M, Hutin Y. Estimating the proportion of people with chronic hepatitis B virus infection eligible for hepatitis B antiviral treatment worldwide: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2021;6:106-119. [PubMed] [DOI] |
| 3. | Furquim d'Almeida A, Ho E, Van Hees S, Vanwolleghem T. Clinical management of chronic hepatitis B: A concise overview. United European Gastroenterol J. 2022;10:115-123. [PubMed] [DOI] |
| 4. | Natarajan A, Beena PM, Devnikar AV, Mali S. A systemic review on tuberculosis. Indian J Tuberc. 2020;67:295-311. [PubMed] [DOI] |
| 5. | Lange C, Kalsdorf B, Maurer FP, Heyckendorf J. [Tuberculosis]. Internist (Berl). 2019;60:1155-1175. [PubMed] [DOI] |
| 6. | Mangwani N, Singh PK, Kumar V. Medicinal plants: Adjunct treatment to tuberculosis chemotherapy to prevent hepatic damage. J Ayurveda Integr Med. 2020;11:522-528. [PubMed] [DOI] |
| 8. | Li B, Ren Q, Li Y, Tian S, Chong Y, Sun S, Feng F. Screening differential circular RNA expression profiles reveals the regulatory role of circMARS in anti-tuberculosis drug-induced liver injury. J Cell Mol Med. 2022;26:1050-1059. [PubMed] [DOI] |
| 9. | Huang D, Peng J, Lei L, Chen Y, Zhu Z, Cai Q, Deng Y, Chen J. Time of Liver Function Abnormal Identification on Prediction of the Risk of Anti-tuberculosis-induced Liver Injury. J Clin Transl Hepatol. 2023;11:425-432. [PubMed] [DOI] |
| 10. | Su Q, Liu Q, Liu J, Fu L, Liu T, Liang J, Peng H, Pan X. Study on the associations between liver damage and antituberculosis drug rifampicin and relative metabolic enzyme gene polymorphisms. Bioengineered. 2021;12:11700-11708. [PubMed] [DOI] |
| 13. | 中华医学会; 中华医学会杂志社; 中华医学会全科医学分会; 中华医学会《中华全科医师杂志》编辑委员会; 慢性乙型肝炎基层诊疗指南编写专家组. 慢性乙型肝炎基层诊疗指南(2020年). 中华全科医师杂志. 2021;20:137-149. [DOI] |
| 17. | Li JF, Li YS, Zhang YY, Sun SF, Han TS, Li YH, Feng FM. Regulation of P300 and HDAC1 on endoplasmic reticulum stress in isoniazid-induced HL-7702 hepatocyte injury. J Cell Physiol. 2019;234:15299-15307. [PubMed] [DOI] |
| 18. | Giadans CG, Ríos DA, Ameigeiras B, Pietrantonio AM, Lucatelli NL, Haddad L, Mullen E, Heinrich F, De Matteo E, Flichman D, Valva P, Preciado MV. Chronic hepatitis B: The interplay between intrahepatic lymphocyte population and viral antigens in relation to liver damage. J Viral Hepat. 2019;26:727-737. [PubMed] [DOI] |
| 20. | Pfefferkorn M, Schott T, Böhm S, Deichsel D, Felkel C, Gerlich WH, Glebe D, Wat C, Pavlovic V, Heyne R, Berg T, van Bömmel F. Composition of HBsAg is predictive of HBsAg loss during treatment in patients with HBeAg-positive chronic hepatitis B. J Hepatol. 2021;74:283-292. [PubMed] [DOI] |
| 21. | Grudda T, Hwang HS, Taddese M, Quinn J, Sulkowski MS, Sterling RK, Balagopal A, Thio CL. Integrated hepatitis B virus DNA maintains surface antigen production during antiviral treatment. J Clin Invest. 2022;132. [PubMed] [DOI] |
| 22. | Kwak MS, Chung GE, Yang JI, Yim JY. Long-term outcomes of HBsAg/anti-HBs double-positive versus HBsAg single-positive patients with chronic hepatitis B. Sci Rep. 2019;9:19417. [PubMed] [DOI] |
| 23. | Parola M, Pinzani M. Liver fibrosis: Pathophysiology, pathogenetic targets and clinical issues. Mol Aspects Med. 2019;65:37-55. [PubMed] [DOI] |