修回日期: 2023-03-29
接受日期: 2023-04-24
在线出版日期: 2023-04-28
慢性乙型肝炎病毒感染(chronic hepatitis B infection, CHB)诱导肝细胞的染色体超倍化(包括非整倍化和多倍化)及染色体不稳定性, 是导致原发性肝细胞癌(primary hepatocytic carcinoma, HCC)发生的主要原因之一. 尽管肝细胞对于正常条件下染色体复制的多倍体化具有调节作用, 但对于CHB引起的超倍化难以调节从而致癌. 研究表明, 乙型肝炎病毒(hepatitis B virus, HBV)使得多条信号途径如PLK1/PRC1失调, 诱导肝细胞染色体超倍化并发生恶性转化. 本论文综述了HBV感染诱导肝细胞染色体超倍化导致肝癌发生的机制以及靶向染色体超倍化药物研究的最新进展.
核心提要: 本文综述了乙型肝炎病毒通过上调Polo样激酶1/蛋白调节因子1和细胞周期蛋白E1以及介导细胞融合, 导致了肝细胞染色体成倍增加或非成倍增加, 引起染色体不稳定性及细胞周期紊乱, 从而促进肝细胞的致癌转化.
引文著录: 施旭佳, 尧晨光, 李涵泺, 魏艳红, 胡康洪. HBV慢性感染诱导的染色体超倍化及靶向治疗策略. 世界华人消化杂志 2023; 31(8): 299-306
Revised: March 29, 2023
Accepted: April 24, 2023
Published online: April 28, 2023
Chronic hepatitis B virus (HBV) infection induces chromosomal hyperploidy (including aneuploidy and polyploidy) and chromosomal instability in hepatocytes, which is one of the main causes of primary hepatocellular carcinoma (HCC). Although hepatocytes can regulate polyploidization of chromosomes under normal conditions, it is difficult to regulate hyperploidization caused by HBV infection and thus carcinogenesis. Studies have shown that HBV can cause dysregulation of many signal pathways such as PLK1/PRC1, and induce chromosome hyperploidy and malignant transformation of hepatocytes. Herein we review the mechanism of HBV infection-induced chromosomal hyperploidy of hepatocytes to cuase hepatocarcinogenesis and the advances in research of drugs targeting chromosomal hyperploidy.
- Citation: Shi XJ, Yao CG, Li HL, Wei YH, Hu KH. Chromosome hyperploidy induced by chronic hepatitis B virus infection and its targeted therapeutic strategy. Shijie Huaren Xiaohua Zazhi 2023; 31(8): 299-306
- URL: https://www.wjgnet.com/1009-3079/full/v31/i8/299.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i8.299
乙型肝炎病毒(hepatitis B virus, HBV)是嗜肝病毒科的DNA病毒成员之一, 其特异性感染肝脏, 从而诱发慢性肝炎(chronic hepatitis B, CHB)、肝硬化及肝细胞癌(hepatocellular carcinoma, HCC), 全球约50%的HCC患者感染HBV[1].
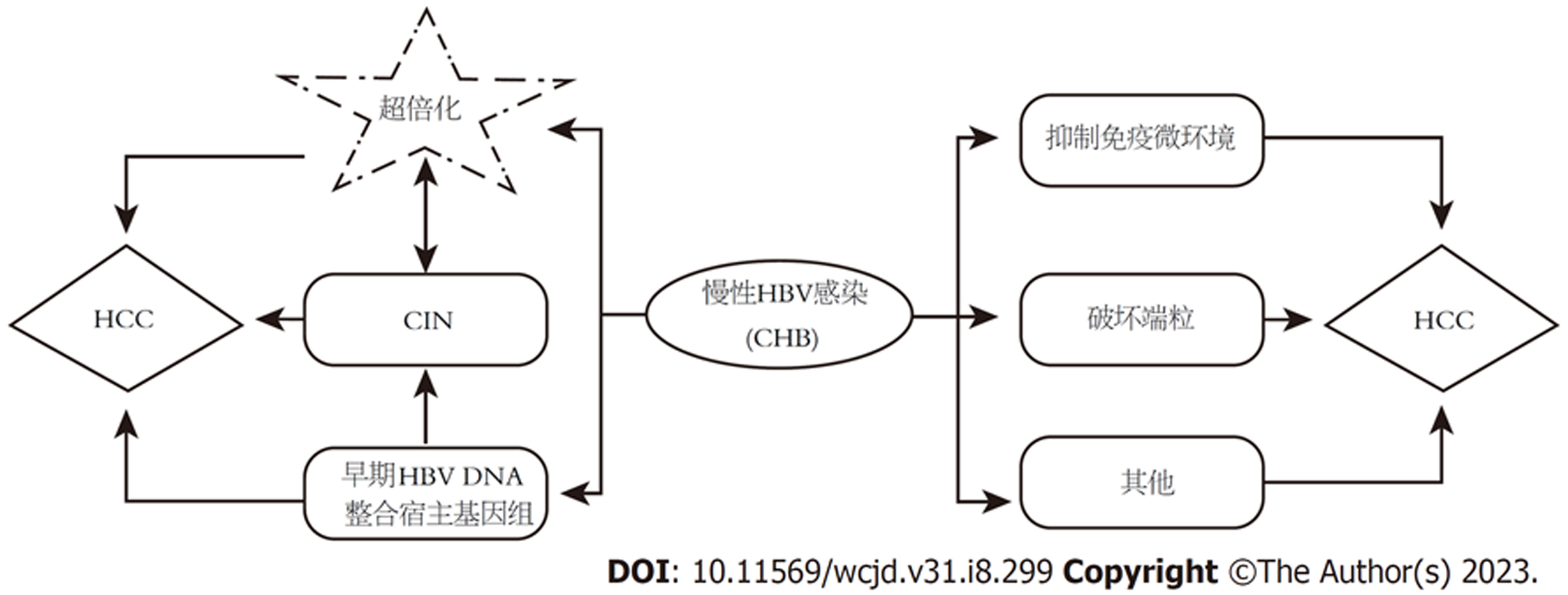
既往研究表明, HBV可通过基因整合或突变引起宿主细胞有丝分裂异常, 染色体数目成倍或非成倍增加, 这种现象被称为染色体超倍化. 染色体数目成倍增加的现象称为多倍化, 而非成倍增加的现象称为非整倍化. HBV诱导的超倍化、染色体不稳定性(chromosomal instability, CIN)、抑制免疫微环境及端粒破坏等途径是HCC形成的重要因素(图1)[2-4]. 高度CIN会使细胞死亡, 然而, 在多种肿瘤细胞中, CIN导致的突变累积、拷贝数变异等活动使细胞适应不利环境, 驱动癌症发生[5,6]和转移[7], 并导致肿瘤患者预后不良与化疗抵抗[8,9]. 此外, 近乎一半的CIN可由细胞分裂过程中染色体出现的超倍化(即多倍化和/或非整倍化)通过染色体错误分离或畸变等途径诱导产生[10].
一个完整的细胞周期分为G0、G1、S、G2、M期, 其中G1、S和G2期又称为有丝分裂间期, 主要为有丝分裂M期储备充足的核酸和蛋白质来复制基因组. 当胞质分裂阻滞或M期被截断时, 细胞会停滞在间期或M期从而产生多倍体细胞[11,12]. 有丝分裂过程中还会发生纺锤体装配检查点缺陷、内聚缺陷、Merotelic附着, 中心体扩增等错误产生超倍化、DNA损伤与CIN等事件, 均有助于肿瘤的发生和发展[13].
在正常肝细胞中, 多倍体细胞如四倍体或八倍体约占25%, 这样的多倍体化与终末分化和衰老相关[14]. 多倍体细胞的有丝分裂有两种形式, 一种是多极分裂产生多个非整倍体细胞, 另一种是双极分裂产生两个多倍体细胞, 产生的多倍体细胞还会进一步分裂产生多倍体细胞或非整倍体细胞. 正常肝细胞的多倍体化是一种复杂的、有序的生理过程, 受到多种因素的调控, 包括细胞周期调控因子、细胞信号通路、肿瘤抑制基因等. 在这种调控下, 细胞可以进行有序的多倍化, 而不会导致HCC[13-18]. 部分肝切除术、黄曲霉素、代谢过载或辐射等也能诱导肝细胞多倍体比例的上升[14]. 在HBV与HCV感染相关肝炎、肝纤维化、肝硬化及肝癌中也发现肝细胞的倍性改变 , 表现为多倍体化或非整倍体化, 受病毒对细胞的影响, 这些多倍体化或非整倍体化难以经细胞调控而修复从而发生致癌级联反应[19,20].
因此, 以上证据表明, HBV与超倍化及CIN具有高度相关性, 超倍化可能作为HBV诱导HCC的一条额外途径.
Polo样激酶1(polo-like kinase 1, PLK1)是有丝分裂和非有丝分裂过程中的重要调节因子之一, 在多种癌症中高表达, 其可调节包括中心体成熟、姐妹染色单体分离、纺锤体组装、有丝分裂退出、DNA复制、DNA损伤反应、G2 DNA损伤检查点恢复、染色体动力学和微管动力学等多个环节[21,22], 因此其功能障碍可能促进癌症发生发展并与预后不良相关[22-24].
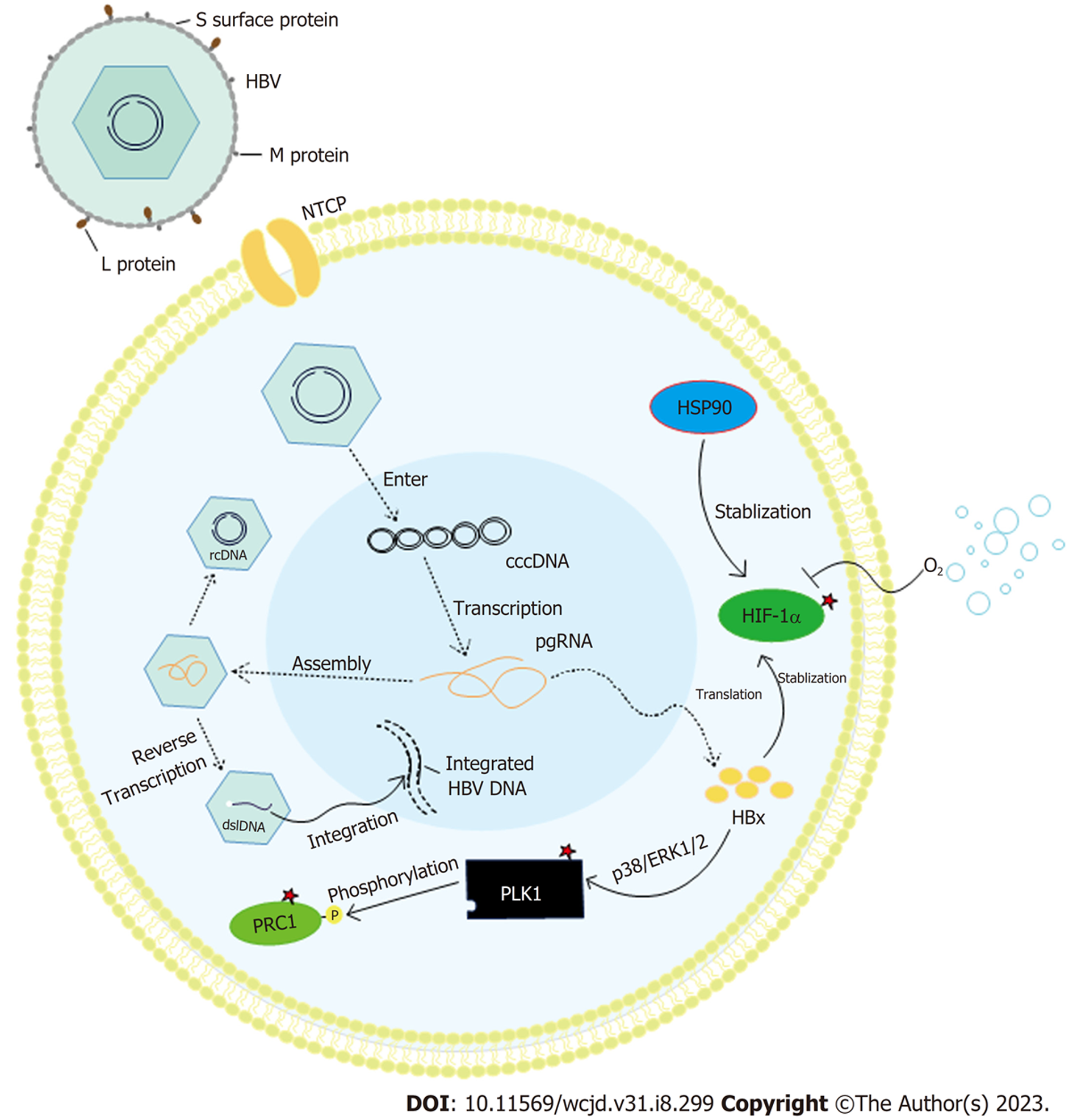
HBV表达的HBx蛋白有多种生物学功能, 包括参与解除对细胞周期检查点的调控、激活/抑制细胞凋亡、提高糖异生水平、激活主要代谢信号通路、表观遗传调控等[25,26]. 在HBx转基因小鼠中, HBx能通过p38和ERK1/2途径上调PLK1(图2), 诱导细胞周期检查点破坏, 导致肝细胞多倍化、双核性减少、DNA损伤累及和炎症, 从而促进致癌转化(同时HCC祖细胞标记物Ly6D表达上升)[27]. 另外, 值得注意的是, 有研究显示[28], 在表达HBx的4pX-1细胞系中, HBx介导的多倍化可能与致癌转化无直接关系, 在此过程中, PLK1诱导的DNA损伤累及才是致癌转化的关键. 免疫共沉淀分析其可能是通过下调ZNF198和SUZ12, 从而增强HBV复制、DNA损伤及调节p53活性, 促进转化[29]. 另一项研究也提出[30], 70%的HBV慢性感染患者体内LHBS阳性肝细胞的细胞核大小及超倍化水平均显著高于LHBS阴性肝细胞, 可能是由LHBS反式激活PLK1, 从而破坏G2/M检查点, 诱导胞质分裂失败, 但LHBS具体如何上调PLK1的机制尚不明晰. 二倍体细胞胞质分裂失败应产生四倍体/多倍体, 但该研究显示大多数LHBS阳性肝细胞染色体数为51条-70条(非整倍体), 可能的解释为LHBS阳性细胞的多倍体化伴随着异常的多极分裂, 这最终导致超倍体产生[30].
PLK1可以调节有丝分裂后期胞质分裂蛋白调节因子(protein regulator of cytokinesis 1, PRC1)的激活(图2)[12], PRC1是与CIN相关性排名第二的基因[31], 通过稳定纺锤体中间区结构来稳定促进胞质分裂, 其过表达与敲低均可引起细胞分裂异常[12], 进一步促进非整倍体、肿瘤发生和不良临床患者结果[32-37]. 由此可见, PLK1是HBV相关超倍化诱导致癌转化过程中的关键蛋白, 但HBV到底是通过怎样的相互作用来控制PLK1还尚不清楚.
作为一种DNA病毒, HBV可以通过其双链线性DNA(dsl DNA)将基因整合到宿主染色体(图2), 在约80%-90%的HBV感染的HCC患者肝癌细胞中发现HBV DNA与宿主细胞染色体整合现象[38,39]. HBV DNA整合到宿主基因组的位置存在随机性, 但在HCC中, HBV DNA与宿主细胞基因整合位点主要富集在CpG岛(与DNA甲基化有关)、端粒及一些DNA易突变或重排的基因组区域[40].
细胞周期蛋白E1(cyclin E1)细胞周期的G1和S期发挥作用, 促进细胞周期顺利完成S期, 编码cyclin E1的CCNE1基因座被观察到在许多类型的癌细胞中扩增, 而HBV基因能整合在CCNE1基因附近, 并通过病毒本身的增强子使CCNE1过表达(约32倍), 从而诱导肝细胞超倍化, 选择性诱导肝脏细胞CIN和DNA双链断裂(DBS)诱导肝细胞癌变[41,42]. 此外, CCNE1还可通过过度激活PLK1等因子来破坏细胞分裂的动力学[41].
在一些病毒诱导作用下, 宿主细胞会发生融合现象, 从而产生多倍体细胞. HCV和HPV含有细胞融合诱导蛋白(HCV的E1、E2蛋白, HPV的E5蛋白)导致合胞体形成并诱导细胞多倍体化[43,44]. 值得一提的是, 细胞融合过程如HPV介导的细胞融合包括细胞质膜与核膜的融合, 质膜融合后通常会形成双核多倍体细胞, 这些细胞大多会死亡, 只有少部分细胞发生核膜融合变为单核多倍体细胞, 这些细胞具有不稳定的基因组和基因表达, 最终容易发展成为癌细胞[44].
有研究表明, HBV的L(preS1)和S蛋白是HBV能够发生膜融合从而进入细胞的关键因素[45]. ERp57蛋白能促进HBV表面S蛋白交叉链二硫键构象变化, 导致preS1中融合肽的暴露, 激活HBV的膜融合能力[45]. 更重要的是, L、S蛋白在胞内和胞外均可介导细胞融合, 且这种融合不依赖于与HBV感染受体牛磺胆酸钠共转运肽(NTCP)相互作用和胞吞作用[45]. 有研究表示[10], 在HCC肝组织和慢性乙肝肝炎中有更高的ERp57的表达, 且与不良预后有关.
目前, 肝癌化疗药物主要有索拉非尼、阿替利珠单抗、贝伐珠单抗等, 但由于耐药、肿瘤异质性等问题的存在, 这些化疗药物的治疗效果对部分患者仍不理想. 对于CHB诱导的超倍化相关HCC, 抑制HBV大表面蛋白(HBV large surface protein, LHBs)、HBx和宿主PLK1、PRC1的表达以及使低氧诱导因子-1α(hypoxia inducible factor-1, HIF-1α)失稳可能是治疗HCC的有效策略(表1).
PLK1和PRC1为胞质分裂关键调节因子, 降低PLK1和PRC1的表达或抑制其活性可以抑制肿瘤的生长[46]. PLK1在多种癌细胞中特异性高表达, 目前, 已开发出一些直接靶向PLK1的小分子抑制剂如TAK-960、BI-2536、GSK461364[47,48]、Volasertib[49]和Rigosertib[50]. 这些小分子抑制剂已经被证明可以单独或联合其他药物抑制多种肿瘤[49-51]. 此外, 由于PLK1致中心体扩增的特点[6], 癌细胞通过中心体聚集而诱导细胞发生非整倍化, 因此一系列破坏细胞中心体异常聚集的药物也值得我们关注[13], 如HSET/KifC1抑制剂CW069、AZ82和SR31527[52-54].
PRC1参与纺锤体中间区的形成及平衡着丝粒张力, 这决定了其在细胞分裂、染色体不稳定性及肿瘤异质性中存在的重要作用[12]. 遗憾的是, 目前仅有一些PRC1上游靶点的抑制剂, 如CBXs, BMI-1和RING1B的抑制剂[55], 尚没有直接靶向PRC1的药物. PRC1在多种癌症中异常表达并与预后相关, 因此其还可作为预后相关生物标志物[56].
非整倍体细胞对毒性应激和代谢应激类化合物更敏感, 因此这类化合物可应用于HBV相关非整倍体导致的HCC[13,57], 如HSP90抑制剂17-AAG、格尔德霉素衍生物和XL888[58]或HSF1抑制剂, 从而加剧非整倍体蛋白折叠障碍[59]. 抑制HSP90的药物同时还能诱导HIF-1α降解[60], 抑制HIF-1α蛋白水平可以降低高倍体细胞[61]与肿瘤细胞非整倍体耐药性[62,63]. 非整倍体细胞还表现出神经鞘脂代谢失调, 导致促凋亡脂质神经酰胺水平升高, 使得增加神经酰胺水平的药物如神经酰胺类似物DL-PDMP对非整倍体细胞的毒性大于二倍体细胞, 促进非整倍体细胞凋亡[13,64].
清除HBV cccDNA是治疗HBV感染相关HCC的终极目标. 鉴于cccDNA的致密超螺旋微染色体结构, 其很难从患者体内被清除, 现阶段的治疗策略主要为利用核苷(酸)类似物抑制HBV DNA复制或利用干扰素免疫抑制HBV DNA复制, 但这两种策略清除cccDNA的周期中位数约34年, 存在cccDNA整合至宿主基因组、病毒耐药或患者依从性差等问题. 目前, 一些直接或间接靶向cccDNA的方法正在开发, 如基于CRISPR的基因编辑直接降解cccDNA, 碱基编辑直接靶向cccDNA引发其甲基化、突变及降解[65], 人工转录因子靶向HBV增强子Ⅰ抑制其转录和复制[66].
HBV基因组与宿主细胞染色体整合后, HBV转录可逃避免疫监视从而长期潜伏在宿主体内, 为治疗HBV相关HCC带来了极大的挑战. HBV整合机制极具争议, 六种可能的模型被提出, 包括松弛环状DNA介导的单链缺口模型、直接重复序列介导的整合模型、"滚入"模型、部分序列同源模型、基于细胞酶介导的非同源末端连接和微同源性介导的末端连接[67]. 更加深入和清晰地解析cccDNA整合机制有助于开发未来针对HBV相关HCC的新疗法.
流式细胞术和单细胞测序均证实正常肝组织中存在一定比例的多倍体肝细胞[68], HBV感染进一步导致肝细胞的多倍化或非整倍化, 从而诱导广泛的染色体不稳定性和肿瘤的发生及转移. 此外, 一些研究表明在化学诱导的肝细胞向HCC转化过程中, 细胞倍性减少, 可能是由于二倍体细胞而非多倍体细胞对隐性突变或有毒物质的保护更少[7], 而在HBV感染的肝细胞, 倍性更倾向非整倍体变化. 非整倍体化在土拨鼠肝炎病毒所致的土拨鼠肝癌细胞中也有发现[32]. 产生这种差异的可能解释是, HBV感染诱导肝细胞细胞周期或胞质分裂调节相关蛋白的失调[67], 从而导致肝细胞染色体超倍化和肝癌的发生.
HBV可通过多种途径使PLK1及PRC1失调从而诱导超倍化. 目前, 它们的一些抑制剂已经进入开发阶段. 此外, p53也在多种病毒介导的肿瘤转化中发挥重要的作用[69,70]. p53的存在与激活可以防止细胞周期异常, 进而控制细胞倍性和染色体不稳定性[71]. 尽管HBV感染初期导致的非整倍体可能并不影响p53功能, 但在HBV相关多倍体肝癌细胞中p53失活, 这提示了p53与HBV相关超倍化有着密切的联系[41,72]. 近来, 两种p53功能恢复剂的出现使细胞检查功能的恢复成为可能, 包括三氧化二砷和更为低毒的酒石酸锑钾[73,74].
HBV与超倍化及CIN之间的关联可能还不止如此, 生物信息学分析发现与CIN相关性最强的TPX1基因[31]在HBV相关HCC中表达上调, 其上调可导致多核性及多倍化[75], 参与HCC发生发展, 可以用作独立预后基因之一[76,77].
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | de Martel C, Maucort-Boulch D, Plummer M, Franceschi S. World-wide relative contribution of hepatitis B and C viruses in hepatocellular carcinoma. Hepatology. 2015;62:1190-1200. [PubMed] [DOI] |
| 2. | Jiang Y, Han Q, Zhao H, Zhang J. The Mechanisms of HBV-Induced Hepatocellular Carcinoma. J Hepatocell Carcinoma. 2021;8:435-450. [PubMed] [DOI] |
| 3. | Zhao LH, Liu X, Yan HX, Li WY, Zeng X, Yang Y, Zhao J, Liu SP, Zhuang XH, Lin C, Qin CJ, Zhao Y, Pan ZY, Huang G, Liu H, Zhang J, Wang RY, Yang Y, Wen W, Lv GS, Zhang HL, Wu H, Huang S, Wang MD, Tang L, Cao HZ, Wang L, Lee TL, Jiang H, Tan YX, Yuan SX, Hou GJ, Tao QF, Xu QG, Zhang XQ, Wu MC, Xu X, Wang J, Yang HM, Zhou WP, Wang HY. Genomic and oncogenic preference of HBV integration in hepatocellular carcinoma. Nat Commun. 2016;7:12992. [PubMed] [DOI] |
| 4. | El Idrissi M, Hervieu V, Merle P, Mortreux F, Wattel E. Cause-specific telomere factors deregulation in hepatocellular carcinoma. J Exp Clin Cancer Res. 2013;32:64. [PubMed] [DOI] |
| 5. | Pino MS, Chung DC. The chromosomal instability pathway in colon cancer. Gastroenterology. 2010;138:2059-2072. [PubMed] [DOI] |
| 6. | Gheghiani L, Wang L, Zhang Y, Moore XTR, Zhang J, Smith SC, Tian Y, Wang L, Turner K, Jackson-Cook CK, Mukhopadhyay ND, Fu Z. PLK1 Induces Chromosomal Instability and Overrides Cell-Cycle Checkpoints to Drive Tumorigenesis. Cancer Res. 2021;81:1293-1307. [PubMed] [DOI] |
| 7. | Bakhoum SF, Ngo B, Laughney AM, Cavallo JA, Murphy CJ, Ly P, Shah P, Sriram RK, Watkins TBK, Taunk NK, Duran M, Pauli C, Shaw C, Chadalavada K, Rajasekhar VK, Genovese G, Venkatesan S, Birkbak NJ, McGranahan N, Lundquist M, LaPlant Q, Healey JH, Elemento O, Chung CH, Lee NY, Imielenski M, Nanjangud G, Pe'er D, Cleveland DW, Powell SN, Lammerding J, Swanton C, Cantley LC. Chromosomal instability drives metastasis through a cytosolic DNA response. Nature. 2018;553:467-472. [PubMed] [DOI] |
| 8. | Bakhoum SF, Cantley LC. The Multifaceted Role of Chromosomal Instability in Cancer and Its Microenvironment. Cell. 2018;174:1347-1360. [PubMed] [DOI] |
| 9. | Sansregret L, Vanhaesebroeck B, Swanton C. Determinants and clinical implications of chromosomal instability in cancer. Nat Rev Clin Oncol. 2018;15:139-150. [PubMed] [DOI] |
| 10. | Liu M, Du L, He Z, Yan L, Shi Y, Shang J, Tang H. Increased ERp57 Expression in HBV-Related Hepatocellular Carcinoma: Possible Correlation and Prognosis. Biomed Res Int. 2017;2017:1252647. [PubMed] [DOI] |
| 11. | Gjelsvik KJ, Besen-McNally R, Losick VP. Solving the Polyploid Mystery in Health and Disease. Trends Genet. 2019;35:6-14. [PubMed] [DOI] |
| 12. | Li J, Dallmayer M, Kirchner T, Musa J, Grünewald TGP. PRC1: Linking Cytokinesis, Chromosomal Instability, and Cancer Evolution. Trends Cancer. 2018;4:59-73. [PubMed] [DOI] |
| 13. | Levine MS, Holland AJ. The impact of mitotic errors on cell proliferation and tumorigenesis. Genes Dev. 2018;32:620-638. [PubMed] [DOI] |
| 14. | Celton-Morizur S, Desdouets C. Polyploidization of liver cells. Adv Exp Med Biol. 2010;676:123-135. [PubMed] [DOI] |
| 15. | Zhao JZ, Ye Q, Wang L, Lee SC. Centrosome amplification in cancer and cancer-associated human diseases. Biochim Biophys Acta Rev Cancer. 2021;1876:188566. [PubMed] [DOI] |
| 16. | Brinkley BR. Managing the centrosome numbers game: from chaos to stability in cancer cell division. Trends Cell Biol. 2001;11:18-21. [PubMed] [DOI] |
| 17. | Kwon M, Godinho SA, Chandhok NS, Ganem NJ, Azioune A, Thery M, Pellman D. Mechanisms to suppress multipolar divisions in cancer cells with extra centrosomes. Genes Dev. 2008;22:2189-2203. [PubMed] [DOI] |
| 18. | Donne R, Sangouard F, Celton-Morizur S, Desdouets C. Hepatocyte Polyploidy: Driver or Gatekeeper of Chronic Liver Diseases. Cancers (Basel). 2021;13. [PubMed] [DOI] |
| 19. | Koike Y, Kamijyo K, Suzuki Y, Kiyosawa K, Nagata A, Furuta S, Nagata T. DNA content of hepatocytes in various stages of liver cirrhosis. Liver. 1985;5:156-161. [PubMed] [DOI] |
| 20. | Toyoda H, Bregerie O, Vallet A, Nalpas B, Pivert G, Brechot C, Desdouets C. Changes to hepatocyte ploidy and binuclearity profiles during human chronic viral hepatitis. Gut. 2005;54:297-302. [PubMed] [DOI] |
| 21. | Zitouni S, Nabais C, Jana SC, Guerrero A, Bettencourt-Dias M. Polo-like kinases: structural variations lead to multiple functions. Nat Rev Mol Cell Biol. 2014;15:433-452. [PubMed] [DOI] |
| 22. | Liu Z, Sun Q, Wang X. PLK1, A Potential Target for Cancer Therapy. Transl Oncol. 2017;10:22-32. [PubMed] [DOI] |
| 23. | Ramani P, Nash R, Sowa-Avugrah E, Rogers C. High levels of polo-like kinase 1 and phosphorylated translationally controlled tumor protein indicate poor prognosis in neuroblastomas. J Neurooncol. 2015;125:103-111. [PubMed] [DOI] |
| 24. | Iliaki S, Beyaert R, Afonina IS. Polo-like kinase 1 (PLK1) signaling in cancer and beyond. Biochem Pharmacol. 2021;193:114747. [PubMed] [DOI] |
| 25. | Slagle BL, Bouchard MJ. Role of HBx in hepatitis B virus persistence and its therapeutic implications. Curr Opin Virol. 2018;30:32-38. [PubMed] [DOI] |
| 26. | Sartorius K, An P, Winkler C, Chuturgoon A, Li X, Makarova J, Kramvis A. The Epigenetic Modulation of Cancer and Immune Pathways in Hepatitis B Virus-Associated Hepatocellular Carcinoma: The Influence of HBx and miRNA Dysregulation. Front Immunol. 2021;12:661204. [PubMed] [DOI] |
| 27. | Ahodantin J, Bou-Nader M, Cordier C, Mégret J, Soussan P, Desdouets C, Kremsdorf D. Hepatitis B virus X protein promotes DNA damage propagation through disruption of liver polyploidization and enhances hepatocellular carcinoma initiation. Oncogene. 2019;38:2645-2657. [PubMed] [DOI] |
| 28. | Studach LL, Rakotomalala L, Wang WH, Hullinger RL, Cairo S, Buendia MA, Andrisani OM. Polo-like kinase 1 inhibition suppresses hepatitis B virus X protein-induced transformation in an in vitro model of liver cancer progression. Hepatology. 2009;50:414-423. [PubMed] [DOI] |
| 29. | Wang WH, Studach LL, Andrisani OM. Proteins ZNF198 and SUZ12 are down-regulated in hepatitis B virus (HBV) X protein-mediated hepatocyte transformation and in HBV replication. Hepatology. 2011;53:1137-1147. [PubMed] [DOI] |
| 30. | Li TN, Wu YJ, Tsai HW, Sun CP, Wu YH, Wu HL, Pei YN, Lu KY, Yen TT, Chang CW, Chan HL, Tao MH, Liou JY, Chang MD, Su IJ, Wang LH. Intrahepatic hepatitis B virus large surface antigen induces hepatocyte hyperploidy via failure of cytokinesis. J Pathol. 2018;245:502-513. [PubMed] [DOI] |
| 31. | Carter SL, Eklund AC, Kohane IS, Harris LN, Szallasi Z. A signature of chromosomal instability inferred from gene expression profiles predicts clinical outcome in multiple human cancers. Nat Genet. 2006;38:1043-1048. [PubMed] [DOI] |
| 32. | Dewhurst SM, McGranahan N, Burrell RA, Rowan AJ, Grönroos E, Endesfelder D, Joshi T, Mouradov D, Gibbs P, Ward RL, Hawkins NJ, Szallasi Z, Sieber OM, Swanton C. Tolerance of whole-genome doubling propagates chromosomal instability and accelerates cancer genome evolution. Cancer Discov. 2014;4:175-185. [PubMed] [DOI] |
| 33. | Ganem NJ, Cornils H, Chiu SY, O'Rourke KP, Arnaud J, Yimlamai D, Théry M, Camargo FD, Pellman D. Cytokinesis failure triggers hippo tumor suppressor pathway activation. Cell. 2014;158:833-848. [PubMed] [DOI] |
| 34. | Vassilev A, Lee CY, Vassilev B, Zhu W, Ormanoglu P, Martin SE, DePamphilis ML. Identification of genes that are essential to restrict genome duplication to once per cell division. Oncotarget. 2016;7:34956-34976. [PubMed] [DOI] |
| 35. | Zheng S, Cherniack AD, Dewal N, Moffitt RA, Danilova L, Murray BA, Lerario AM, Else T, Knijnenburg TA, Ciriello G, Kim S, Assie G, Morozova O, Akbani R, Shih J, Hoadley KA, Choueiri TK, Waldmann J, Mete O, Robertson AG, Wu HT, Raphael BJ, Shao L, Meyerson M, Demeure MJ, Beuschlein F, Gill AJ, Sidhu SB, Almeida MQ, Fragoso MCBV, Cope LM, Kebebew E, Habra MA, Whitsett TG, Bussey KJ, Rainey WE, Asa SL, Bertherat J, Fassnacht M, Wheeler DA; Cancer Genome Atlas Research Network, Hammer GD, Giordano TJ, Verhaak RGW. Comprehensive Pan-Genomic Characterization of Adrenocortical Carcinoma. Cancer Cell. 2016;29:723-736. [PubMed] [DOI] |
| 36. | Zack TI, Schumacher SE, Carter SL, Cherniack AD, Saksena G, Tabak B, Lawrence MS, Zhsng CZ, Wala J, Mermel CH, Sougnez C, Gabriel SB, Hernandez B, Shen H, Laird PW, Getz G, Meyerson M, Beroukhim R. Pan-cancer patterns of somatic copy number alteration. Nat Genet. 2013;45:1134-1140. [PubMed] [DOI] |
| 37. | Kuznetsova AY, Seget K, Moeller GK, de Pagter MS, de Roos JA, Dürrbaum M, Kuffer C, Müller S, Zaman GJ, Kloosterman WP, Storchová Z. Chromosomal instability, tolerance of mitotic errors and multidrug resistance are promoted by tetraploidization in human cells. Cell Cycle. 2015;14:2810-2820. [PubMed] [DOI] |
| 38. | Bréchot C, Gozuacik D, Murakami Y, Paterlini-Bréchot P. Molecular bases for the development of hepatitis B virus (HBV)-related hepatocellular carcinoma (HCC). Semin Cancer Biol. 2000;10:211-231. [PubMed] [DOI] |
| 39. | Minami M, Daimon Y, Mori K, Takashima H, Nakajima T, Itoh Y, Okanoue T. Hepatitis B virus-related insertional mutagenesis in chronic hepatitis B patients as an early drastic genetic change leading to hepatocarcinogenesis. Oncogene. 2005;24:4340-4348. [PubMed] [DOI] |
| 40. | Hino O, Ohtake K, Rogler CE. Features of two hepatitis B virus (HBV) DNA integrations suggest mechanisms of HBV integration. J Virol. 1989;63:2638-2643. [PubMed] [DOI] |
| 41. | Aziz K, Limzerwala JF, Sturmlechner I, Hurley E, Zhang C, Jeganathan KB, Nelson G, Bronk S, Fierro Velasco RO, van Deursen EJ, O'Brien DR, Kocher JA, Youssef SA, van Ree JH, de Bruin A, van den Bos H, Spierings DCJ, Foijer F, van de Sluis B, Roberts LR, Gores GJ, Li H, van Deursen JM. Ccne1 Overexpression Causes Chromosome Instability in Liver Cells and Liver Tumor Development in Mice. Gastroenterology. 2019;157:210-226.e12. [PubMed] [DOI] |
| 42. | Chu C, Geng Y, Zhou Y, Sicinski P. Cyclin E in normal physiology and disease states. Trends Cell Biol. 2021;31:732-746. [PubMed] [DOI] |
| 43. | Herbein G, Nehme Z. Polyploid Giant Cancer Cells, a Hallmark of Oncoviruses and a New Therapeutic Challenge. Front Oncol. 2020;10:567116. [PubMed] [DOI] |
| 44. | Gao P, Zheng J. Oncogenic virus-mediated cell fusion: new insights into initiation and progression of oncogenic viruses--related cancers. Cancer Lett. 2011;303:1-8. [PubMed] [DOI] |
| 45. | Pérez-Vargas J, Teppa E, Amirache F, Boson B, Pereira de Oliveira R, Combet C, Böckmann A, Fusil F, Freitas N, Carbone A, Cosset FL. A fusion peptide in preS1 and the human protein disulfide isomerase ERp57 are involved in hepatitis B virus membrane fusion process. Elife. 2021;10. [PubMed] [DOI] |
| 46. | Ugras S, Brill E, Jacobsen A, Hafner M, Socci ND, Decarolis PL, Khanin R, O'Connor R, Mihailovic A, Taylor BS, Sheridan R, Gimble JM, Viale A, Crago A, Antonescu CR, Sander C, Tuschl T, Singer S. Small RNA sequencing and functional characterization reveals MicroRNA-143 tumor suppressor activity in liposarcoma. Cancer Res. 2011;71:5659-5669. [PubMed] [DOI] |
| 47. | Schöffski P. Polo-like kinase (PLK) inhibitors in preclinical and early clinical development in oncology. Oncologist. 2009;14:559-570. [PubMed] [DOI] |
| 48. | Nie Z, Feher V, Natala S, McBride C, Kiryanov A, Jones B, Lam B, Liu Y, Kaldor S, Stafford J, Hikami K, Uchiyama N, Kawamoto T, Hikichi Y, Matsumoto S, Amano N, Zhang L, Hosfield D, Skene R, Zou H, Cao X, Ichikawa T. Discovery of TAK-960: an orally available small molecule inhibitor of polo-like kinase 1 (PLK1). Bioorg Med Chem Lett. 2013;23:3662-3666. [PubMed] [DOI] |
| 49. | Cortes J, Podoltsev N, Kantarjian H, Borthakur G, Zeidan AM, Stahl M, Taube T, Fagan N, Rajeswari S, Uy GL. Phase 1 dose escalation trial of volasertib in combination with decitabine in patients with acute myeloid leukemia. Int J Hematol. 2021;113:92-99. [PubMed] [DOI] |
| 50. | Bowles DW, Diamond JR, Lam ET, Weekes CD, Astling DP, Anderson RT, Leong S, Gore L, Varella-Garcia M, Vogler BW, Keysar SB, Freas E, Aisner DL, Ren C, Tan AC, Wilhelm F, Maniar M, Eckhardt SG, Messersmith WA, Jimeno A. Phase I study of oral rigosertib (ON 01910.Na), a dual inhibitor of the PI3K and Plk1 pathways, in adult patients with advanced solid malignancies. Clin Cancer Res. 2014;20:1656-1665. [PubMed] [DOI] |
| 51. | Weiss GJ, Jameson G, Von Hoff DD, Valsasina B, Davite C, Di Giulio C, Fiorentini F, Alzani R, Carpinelli P, Di Sanzo A, Galvani A, Isacchi A, Ramanathan RK. Phase I dose escalation study of NMS-1286937, an orally available Polo-Like Kinase 1 inhibitor, in patients with advanced or metastatic solid tumors. Invest New Drugs. 2018;36:85-95. [PubMed] [DOI] |
| 52. | Sekino Y, Oue N, Koike Y, Shigematsu Y, Sakamoto N, Sentani K, Teishima J, Shiota M, Matsubara A, Yasui W. KIFC1 Inhibitor CW069 Induces Apoptosis and Reverses Resistance to Docetaxel in Prostate Cancer. J Clin Med. 2019;8. [PubMed] [DOI] |
| 53. | Parvin A, Hao SL, Tan FQ, Yang WX. Inhibition of kinesin motor protein KIFC1 by AZ82 induces multipolar mitosis and apoptosis in prostate cancer cell. Gene. 2020;760:144989. [PubMed] [DOI] |
| 54. | Zhang W, Zhai L, Wang Y, Boohaker RJ, Lu W, Gupta VV, Padmalayam I, Bostwick RJ, White EL, Ross LJ, Maddry J, Ananthan S, Augelli-Szafran CE, Suto MJ, Xu B, Li R, Li Y. Discovery of a novel inhibitor of kinesin-like protein KIFC1. Biochem J. 2016;473:1027-1035. [PubMed] [DOI] |
| 55. | Itoh Y, Takada Y, Yamashita Y, Suzuki T. Recent progress on small molecules targeting epigenetic complexes. Curr Opin Chem Biol. 2022;67:102130. [PubMed] [DOI] |
| 56. | Chen J, Rajasekaran M, Xia H, Zhang X, Kong SN, Sekar K, Seshachalam VP, Deivasigamani A, Goh BK, Ooi LL, Hong W, Hui KM. The microtubule-associated protein PRC1 promotes early recurrence of hepatocellular carcinoma in association with the Wnt/β-catenin signalling pathway. Gut. 2016;65:1522-1534. [PubMed] [DOI] |
| 57. | Zhou L, Jilderda LJ, Foijer F. Exploiting aneuploidy-imposed stresses and coping mechanisms to battle cancer. Open Biol. 2020;10:200148. [PubMed] [DOI] |
| 58. | Lu X, Wang L, Ruden DM. Hsp90 inhibitors and the reduction of anti-cancer drug resistance by non-genetic and genetic mechanisms. Pharmaceuticals (Basel). 2012;5:890-898. [PubMed] [DOI] |
| 59. | Chen Y, Chen J, Loo A, Jaeger S, Bagdasarian L, Yu J, Chung F, Korn J, Ruddy D, Guo R, McLaughlin ME, Feng F, Zhu P, Stegmeier F, Pagliarini R, Porter D, Zhou W. Targeting HSF1 sensitizes cancer cells to HSP90 inhibition. Oncotarget. 2013;4:816-829. [PubMed] [DOI] |
| 60. | Rashid M, Zadeh LR, Baradaran B, Molavi O, Ghesmati Z, Sabzichi M, Ramezani F. Up-down regulation of HIF-1α in cancer progression. Gene. 2021;798:145796. [PubMed] [DOI] |
| 61. | Qi J, You T, Pan T, Wang Q, Zhu L, Han Y. Downregulation of hypoxia-inducible factor-1α contributes to impaired megakaryopoiesis in immune thrombocytopenia. Thromb Haemost. 2017;117:1875-1886. [PubMed] [DOI] |
| 62. | Simões-Sousa S, Littler S, Thompson SL, Minshall P, Whalley H, Bakker B, Belkot K, Moralli D, Bronder D, Tighe A, Spierings DCJ, Bah N, Graham J, Nelson L, Green CM, Foijer F, Townsend PA, Taylor SS. The p38α Stress Kinase Suppresses Aneuploidy Tolerance by Inhibiting Hif-1α. Cell Rep. 2018;25:749-760.e6. [PubMed] [DOI] |
| 63. | Li S, Yang Y, Ding X, Yang M, She S, Peng H, Xu X, Ran X, Li S, Hu P, Hu H, Zhang D, Ren H. LHBs can elevate the expression of MDR1 through HIF-1α in patients with CHB infection: a comparative proteomic study. Oncotarget. 2017;8:4549-4562. [PubMed] [DOI] |
| 64. | Tang YC, Yuwen H, Wang K, Bruno PM, Bullock K, Deik A, Santaguida S, Trakala M, Pfau SJ, Zhong N, Huang T, Wang L, Clish CB, Hemann MT, Amon A. Aneuploid Cell Survival Relies upon Sphingolipid Homeostasis. Cancer Res. 2017;77:5272-5286. [PubMed] [DOI] |
| 65. | Maepa MB, Bloom K, Ely A, Arbuthnot P. Hepatitis B virus: promising drug targets and therapeutic implications. Expert Opin Ther Targets. 2021;25:451-466. [PubMed] [DOI] |
| 66. | Luo W, Wang J, Xu D, Bai H, Zhang Y, Zhang Y, Li X. Engineered zinc-finger transcription factors inhibit the replication and transcription of HBV in vitro and in vivo. Int J Mol Med. 2018;41:2169-2176. [PubMed] [DOI] |
| 67. | Bousali M, Papatheodoridis G, Paraskevis D, Karamitros T. Hepatitis B Virus DNA Integration, Chronic Infections and Hepatocellular Carcinoma. Microorganisms. 2021;9. [PubMed] [DOI] |
| 68. | Knouse KA, Wu J, Whittaker CA, Amon A. Single cell sequencing reveals low levels of aneuploidy across mammalian tissues. Proc Natl Acad Sci USA. 2014;111:13409-13414. [PubMed] [DOI] |
| 69. | Levrero M, Zucman-Rossi J. Mechanisms of HBV-induced hepatocellular carcinoma. J Hepatol. 2016;64:S84-S101. [PubMed] [DOI] |
| 70. | Marur S, D'Souza G, Westra WH, Forastiere AA. HPV-associated head and neck cancer: a virus-related cancer epidemic. Lancet Oncol. 2010;11:781-789. [PubMed] [DOI] |
| 72. | Sladky VC, Knapp K, Szabo TG, Braun VZ, Bongiovanni L, van den Bos H, Spierings DC, Westendorp B, Curinha A, Stojakovic T, Scharnagl H, Timelthaler G, Tsuchia K, Pinter M, Semmler G, Foijer F, de Bruin A, Reiberger T, Rohr-Udilova N, Villunger A. PIDDosome-induced p53-dependent ploidy restriction facilitates hepatocarcinogenesis. EMBO Rep. 2020;21:e50893. [PubMed] [DOI] |
| 73. | Tang Y, Song H, Wang Z, Xiao S, Xiang X, Zhan H, Wu L, Wu J, Xing Y, Tan Y, Liang Y, Yan N, Li Y, Li J, Wu J, Zheng D, Jia Y, Chen Z, Li Y, Zhang Q, Zhang J, Zeng H, Tao W, Liu F, Wu Y, Lu M. Repurposing antiparasitic antimonials to noncovalently rescue temperature-sensitive p53 mutations. Cell Rep. 2022;39:110622. [PubMed] [DOI] |
| 74. | Chen S, Wu JL, Liang Y, Tang YG, Song HX, Wu LL, Xing YF, Yan N, Li YT, Wang ZY, Xiao SJ, Lu X, Chen SJ, Lu M. Arsenic Trioxide Rescues Structural p53 Mutations through a Cryptic Allosteric Site. Cancer Cell. 2021;39:225-239.e8. [PubMed] [DOI] |
| 75. | Hsu CW, Chen YC, Su HH, Huang GJ, Shu CW, Wu TT, Pan HW. Targeting TPX2 Suppresses the Tumorigenesis of Hepatocellular Carcinoma Cells Resulting in Arrested Mitotic Phase Progression and Increased Genomic Instability. J Cancer. 2017;8:1378-1394. [PubMed] [DOI] |
| 76. | Zeng XC, Zhang L, Liao WJ, Ao L, Lin ZM, Kang W, Chen WN, Lin X. Screening and Identification of Potential Biomarkers in Hepatitis B Virus-Related Hepatocellular Carcinoma by Bioinformatics Analysis. Front Genet. 2020;11:555537. [PubMed] [DOI] |
| 77. | Zhang J, Liu X, Zhou W, Lu S, Wu C, Wu Z, Liu R, Li X, Wu J, Liu Y, Guo S, Jia S, Zhang X, Wang M. Identification of Key Genes Associated With the Process of Hepatitis B Inflammation and Cancer Transformation by Integrated Bioinformatics Analysis. Front Genet. 2021;12:654517. [PubMed] [DOI] |