修回日期: 2023-01-22
接受日期: 2023-03-20
在线出版日期: 2023-04-08
中药复方具有多成分综合调节的特点, 在肝纤维化防治中显示出独特的优势. 一贯煎始载于魏之琇所著《续名医类案》, 是滋阴疏肝的著名方剂, 能够改善肝纤维化症状, 研究其抗肝纤维化机制有助于药物开发和推广.
通过网络药理学探究一贯煎治疗肝纤维化的机制并实验验证.
利用文献和TCMSP数据库收集一贯煎成分及靶点, GeneCard、OMIM数据库收集肝纤维化疾病靶点. 通过STRING数据库构建一贯煎-肝纤维化蛋白互作网络(protein-protein interaction, PPI)子网络, 应用重启随机游走算法获得关键基因, 通过DAVID数据库进行基因本体(gene ontology, GO)富集分析及京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes, KEGG)富集分析. 动物实验验证, 18只SD大鼠随机分为正常组、模型组、一贯煎组. 模型组、一贯煎组大鼠采用腹腔注射50%四氯化碳(carbon tetrachloride, CCl4)橄榄油溶液造模6周, 正常组注射等量橄榄油. 造模结束后一贯煎组每天灌胃一贯煎溶液(6.67 g/kg)共4 wk, 其他组灌胃等量蒸馏水, 取血和肝脏. 全自动生化仪检测血清丙氨酸转氨酶(alanine aminotransferase, ALT)和天冬氨酸转氨酶(aspartate aminotransferase, AST). HE、Masoon染色观察肝脏病理学变化. Western blot法和qRT-PCR法检测肝脏关键蛋白表达水平和mRNA转录水平.
筛选得到一贯煎成分52个, 潜在作用靶点186个, 肝纤维化疾病靶点1080个, 得到一贯煎治疗肝纤维化的关键基因, 其中亲和度前10的基因为STAT6、SRC、MAPK3、STX1A、EP300、STAT3、PLG、CTNNB1、CDKN1B、CANX, 亲和度前50的基因KEGG富集得到PI3K-Akt信号通路、FoxO信号通路等134条. 动物实验结果发现, 一贯煎能够改善CCL4肝纤维化大鼠肝功能和减轻纤维化, 降低α-肌动蛋白表达, 促进信号转导和转录激活因子6(signal transducer and activator of transcription 6, STAT6)磷酸化, 提高过氧化物酶体增殖物激活受体-γ(peroxisome proliferator activated receptor-γ, PPAR-γ)、白细胞分化抗原163(cluster of differentiation 163,CD163)蛋白表达和精氨酸酶1、白细胞分化抗原206、CD163mRNA转录水平, 降低白细胞介素6的mRNA转录水平.
一贯煎治疗肝纤维化作用涉及多个成分、多条信号通路, 其中包括STAT6/PPAR-γ通路.
核心提要: 本研究基于网络药理学方法, 通过构建一贯煎-肝纤维化蛋白互作子网络, 应用重启随机游走算法探索一贯煎治疗肝纤维化的作用机制, 实验验证表明一贯煎抗肝纤维化作用与调控STAT6/PPAR-γ通路促进巨噬细胞向M2型极化有关.
引文著录: 崔欣怡, 姜晓丹, 李汶航, 张睿, 油红捷, 唐佐青, 马赟, 杨铮, 车念聪, 刘文兰. 基于网络药理学研究一贯煎治疗肝纤维化的有效成分及作用机制. 世界华人消化杂志 2023; 31(7): 256-267
Revised: January 22, 2023
Accepted: March 20, 2023
Published online: April 8, 2023
Traditional Chinese medicine compounds are characterized by the comprehensive adjustment of multiple components and show unique advantages in the prevention and treatment of liver fibrosis. Yiguanjian (YGJ) is a famous prescription for nourishing Yin to soothe the liver, which can improve the symptoms of liver fibrosis, and understanding its anti-liver fibrosis mechanism can promote its development and use.
To explore the mechanism of YGJ in the treatment of liver fibrosis through network pharmacology and to experi-mentally validate the initial results obtained.
Components of YGJ and potentially targeted proteins were downloaded from the Traditional Chinese Medicine Systems Pharmacology (TCMSP) database. The targets of liver fibrosis were accessed from GeneCard and OMIM databases. STRING database was utilized to construct a protein-protein interaction (PPI) network based on the components of YGJ and the targets of liver fibrosis. The PPI network was subjected to random walk with restart (RWR) to obtain key genes, and Gene Ontology (GO) and Kyoto Encyclopedia of Genes and Genomes (KEGG) enrichment analyses were performed based on the DAVID database. For animal experimental validation, eighteen SD rats were randomly assigned to a normal group, a model group, and a YGJ group. The rats in the model group and YGJ group were intraperitoneally injected with 50% CCl4 olive oil solution for 6 wk to induce liver fibrosis, and rats in the normal group were intraperitoneally injected with the same amount of olive oil solution. Then, the rats of the YGJ group were given YGJ decoction (6.67 g/kg) daily for 4 weeks. Meanwhile, rats in the other groups were given distilled water. Blood and liver samples were collected, and the levels of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) in the serum of rats were detected with an automated analyzer. Pathological changes in liver tissue were observed by hematoxylin-eosin (HE) and Masson staining. Western blot and qRT-PCR were used to detect the expression of key proteins and genes in the liver.
A total of 52 components and 186 potential targets of YGJ were obtained, and 1080 targets of liver fibrosis were screened. The top 10 genes with the high-affinity scores to the drug targets were STAT6, SRC, MAPK3, STX1A, EP300, STAT3, PLG, CTNNB1, CDKN1B, and CANX. The top 50 genes were mainly enriched in response to PI3K- Akt signaling pathway and FoxO signaling pathway, etc. In CCl4-induced liver fibrosis rats, YGJ decoction could significantly improve liver lesions and reduce fibrosis. YGJ decoction could reduce α-SMA expression, promote the expression of phosphorylated STAT6, increase the protein expression of PPAR-γ and CD163 and the mRNA expression of Arg-1, CD206, and CD163, and inhibit the gene expression of IL-6.
The therapeutic effect of YGJ decoction for liver fibrosis involves multiple components and multiple pathways, including the STAT6/PPAR-γ pathway.
- Citation: Cui XY, Jiang XD, Li WH, Zhang R, You HJ, Tang ZQ, Ma Y, Yang Z, Che NC, Liu WL. Investigation of effective components and action mechanism of Yiguanjian in treatment of liver fibrosis based on network pharmacology. Shijie Huaren Xiaohua Zazhi 2023; 31(7): 256-267
- URL: https://www.wjgnet.com/1009-3079/full/v31/i7/256.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i7.256
肝纤维化是由细胞外基质的过度沉积导致肝脏结构和功能异常的病理变化[1], 是慢性肝病发展到肝硬化的必经阶段. 全球每年约有100多万人死于肝硬化及其并发症, 而在早期肝纤维化干预治疗可以有效减缓肝硬化的发生发展[2]. 肝纤维化进程中有多种细胞及细胞因子参与, 因此单一用药的效果可能有限, 而中医药具有毒副作用小, 多成分、多靶点的特点, 在抗肝纤维化领域可以发挥整体用药的优势[3]. 一贯煎始载于魏之琇所著《续名医类案》, 由生地黄、北沙参、当归、枸杞子、麦冬、川楝子组成, 是滋阴疏肝的著名方剂, 临床上可用于治疗慢性肝炎、酒精性脂肪肝、肝纤维化等疾病, 具有很好的疗效[4]. 由于一贯煎药理机制研究尚未明确, 阻碍了其进一步开发应用, 借助网络药理学有利于阐明其有效成分及作用机制. 因此本研究应用网络药理学方法基于邻近网络筛选一贯煎治疗肝纤维化的关键靶基因, 并通过药理实验进行验证, 旨在为后期进一步研究一贯煎治疗肝纤维化的作用机制提供基础.
1.1.1 药物: 一贯煎组成: 由北沙参9 g、麦冬9 g、当归9 g、生地黄20 g、枸杞子12 g、川楝子4.5 g组成, 购于北京同仁堂药店. 按饮片(g):水(mL) = 1:6的比例加入蒸馏水并浸泡饮片1 h, 大火加热至沸腾, 小火煎煮20 min, 过滤, 收集滤液, 滤渣中再加入饮片(g):水(mL) = 1:4比例的蒸馏水继续煎煮30 min, 合并两次滤液, 最终将两次煎煮的汤液浓煎至1 g/mL.
1.1.2 动物: 6周龄SPF级Sprague-Dawlay雄性大鼠, 体重(200±20) g, 购自北京维通利华实验动物技术有限公司, 合格证号SCXK(京)2016-0006, 动物实验伦理审查批准号: AEEI-2015-123. 饲养在首都医科大学实验动物科学部SPF级动物室, 自由饮食, 室温保持在(24±2) ℃, 湿度保持在30%左右.
1.1.3 试剂与仪器: 试剂: 橄榄油(迈萨维诺特级初榨橄榄油, 希腊, 货号: 67519); 四氯化碳(carbon tetrachloride, CCl4)(纯度≥99.0%, 上海易恩化学技术有限公司, 货号: 206848); 天冬氨酸转氨酶(aspartate aminotransferase, AST)检测试剂盒(北京莱帮生物技术有限公司, 货号: Lb10702); 丙氨酸转氨酶(alanine aminotransferase, ALT)检测试剂盒(北京莱帮生物技术有限公司, 货号: Lb10701); HE染色试剂盒(上海歌凡生物科技有限公司, 货号: 20200602); Masson三色染色试剂盒(上海歌凡生物科技有限公司, 货号: 20200704); RIPA蛋白裂解液(兰博利德, 中国, 货号: 1090121810); BCA蛋白浓度测定试剂盒(江苏碧云天公司, 货号: 010719190828); 总RNA提取试剂(苏州新赛美生物科技有限公司, 货号: M5100); SYBR Green Qpcr Master Mix(武汉赛维尔生物, 货号: MPC2011005); 兔源信号转导和转录激活因子6(signal transducer and activator of transcription 6, STAT6)(D3H4)抗体(CST, 美国, 货号: #5397); 兔源过氧化物酶体增殖物激活受体-γ(peroxisome proliferator activated receptor-γ, PPAR-γ)抗体(proteintech, 中国, 货号: 16643-1-AP); 兔源Anti-STAT6(phospho Y641)抗体[EPR22599-78](abcam, 美国, 货号: ab263947); 兔源白细胞分化抗原163(cluster of differentiation 163, CD163)抗体[EPR19518](abcam, 美国, 货号: ab182422); 鼠源α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)抗体(Sigma, 美国, 货号: A2547); 鼠源甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体 (Proteintech, 中国, 货号60004-1-Ig-100UL); PBS缓冲液(北京翱擎生物科技有限公司, 货号: 15002109016); 通用型抗体稀释液(苏州新赛美生物科技有限公司, 货号: WB500D).
仪器: 酶标仪(美国, 型号: Multiskan FC); 电泳槽/电泳仪(美国, 型号: bio-RAD mini-PROTEAN); 实时荧光定量PCR仪(美国, 型号: Bio-rad CFX96); 化学发光成像系统(美国, 型号: bio-RAD ChemiDoc XRS).
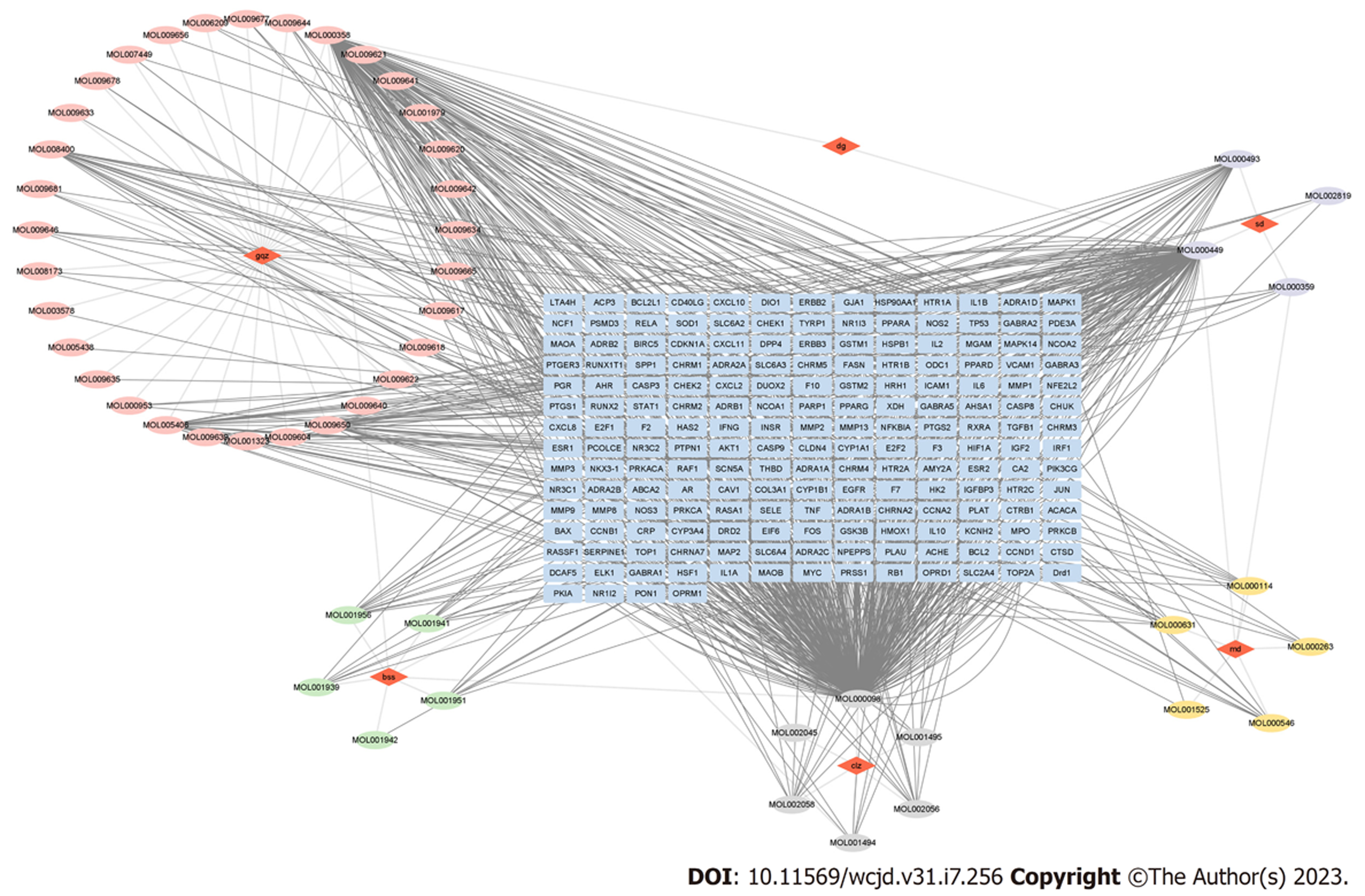
1.2.1 一贯煎治疗肝纤维化关键基因筛选: (1)一贯煎作用靶点筛选 通过检索文献[5-7]和中药系统药理学数据库与分析平台[8](TCMSP, https://tcmsp-e.com/tcmsp.php)收集药物成分信息, 以口服生物利用度≥30%; 药物相似性≥0.18为筛选条件, 获取北沙参、麦冬、当归、生地黄、枸杞子、川楝子6味中药成分靶点信息. 利用Uniprot数据库[9](http://www.uniprot.org/)对筛选出的靶点基因进行标准化处理, 运用Cytoscape 3.9.0软件, 构建一贯煎成分-靶点网络; (2)肝纤维化疾病靶点筛选 通过人类基因综合数据库GeneCard[10](https://www.genecards.org/)及人类孟德尔遗传OMIM[11](http://www.omim.org/), 以"liver fibrosis"为检索关键词, 筛选肝纤维化疾病靶点; (3)蛋白互作网络构建 通过蛋白相互作用数据库STRING数据库[12](https://string-db.org/), 筛选"智人"数据可信度评分>900的蛋白互作关系, 构建人类蛋白互作网络(protein-protein interaction, PPI). 合并一贯煎作用靶点和肝纤维化疾病靶点作为节点, 基于人类PPI网络构建一贯煎-肝纤维化子网络; (4)基于随机游走重启算法筛选一贯煎治疗肝纤维化的关键基因 利用R语言RandomWalkRestartMH包, 在子网络中基于重启随机游走(random walk with restart, RWR)算法, 以一贯煎作用靶点为种子基因, 设置重启概率(r)为0.75, 获得与一贯煎作用靶点亲和度较高的基因为一贯煎治疗肝纤维化的关键基因; (5)基因本体(gene ontology, GO)富集分析和京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes, KEGG)富集分析 通过DAVID数据库[13](https://david.ncifcrf.gov/), 物种选择人类(Homo sapiens), 对一贯煎治疗肝纤维化的关键基因中亲和度前50个关键基因进行GO分析及KEGG分析, 筛选FDR值<0.05的生物过程或者相关通路. 利用R语言ggplot2包进行可视化.
1.2.2 肝纤维化大鼠模型建立及分组给药: 将18只SD大鼠随机分为正常组、模型组和一贯煎组, 每组6只. 模型组和一贯煎组大鼠每周腹腔注射三次50% CCl4油溶液(四氯化碳:橄榄油 = 1:1), 1 wk-2 wk注射剂量为2 mL/kg; 3 wk-4 wk注射剂量为1 mL/kg; 5 wk-6 wk注射剂量为0.5 mL/kg, 正常组大鼠每周按相同剂量注射三次橄榄油. 造模结束后, 一贯煎组大鼠每天给予一次6.67 g/kg一贯煎溶液灌胃治疗(临床一贯煎成年人用量63.5 g, 大鼠与60 kg成人按体表面积折算等效剂量比值按照6.3倍计算), 共持续4 wk. 正常组和模型组以等量蒸馏水灌胃.
1.2.3 样本采集: 治疗结束, 麻醉后腹主动脉取血, 血液室温静置4 h以上, 1500×g低温离心15 min, 收集上层血清. 分离肝脏, 拍照, 取约1 cm3肝组织进行固定, 剩余肝脏组织冻存, 检测相关指标.
1.2.4 血清生化指标检测: 按照血清ALT和AST活性测定试剂盒, 应用全自动生化分析仪检测大鼠血清ALT、AST.
1.2.5 肝脏病理切片观察: 固定好的肝组织水洗后, 经过脱水-透明-浸蜡-包埋-切片等过程制作石蜡切片. 进行HE染色、Masson染色的分析.
1.2.6 Western blotting检测肝脏STAT6、p-STAT6、PPAR-γ、α-SMA、CD163蛋白表达: 取肝脏组织, 加入组织蛋白抽提液(100:1:1 = RIPA裂解液:PMSF贮存液:磷酸酶蛋白抑制剂), 匀浆, 涡旋, 冰浴20 min待裂解充分. 12000 r/min离心20 min, 收集上清液, 即为总蛋白溶液. 采用BCA法测蛋白浓度, 并将各样品浓度统一为6 μg/μL, 金属浴90 ℃ 5 min使蛋白变性. 冷却后, 将样品加入电泳孔中, 电压150 V进行电泳. 将蛋白湿法转至PVDF膜, 加入TBST于室温下脱色摇床上洗3次, 每次5 min, 使用5%脱脂奶粉(0.5% TBST配制), 于摇床上封闭2 h. 加入TBST于室温下脱色摇床上洗3次, 每次5 min, 加入一抗, 4 ℃摇床孵育过夜, 加入TBST于室温下脱色摇床上洗3次, 每次5 min. 加入二抗室温孵育1 h, 用TBST在室温下脱色摇床上洗3次, 每次5 min. ECL底物孵育, 化学发光成像系统获取蛋白条带, Image J软件处理系统分析目标带的灰度值, 以GAPDH为内参计算蛋白相对表达量.
1.2.7 qRT-PCR检测肝脏α-SMA、白细胞介素6(interleukin 6, IL-6)、精氨酸酶1(arginase I, Arg-1)、白细胞分化抗原206(cluster of differentiation 206, CD206)、CD163mRNA转录水平: 剪取肝脏组织30 mg-40 mg, Trizol法提取总RNA. 通过研磨、离心、抽提出总RNA, 溶于20 μL无RNA酶水中, 检测RNA浓度及纯度, 最后反转录浓度为5 μg/μL cDNA, 稀释10倍后待测.
qRT-PCR反应体系(以20 μL体系为例)为2×SYBR qPCR Master Mix(Low ROX): 10 μL; Forward Primer(10 μmol/L): 0.4 μL; Reverse Primer(10 μmol/L): 0.4 μL; cDNA: 1 μL; Nuclease-Free Water: 8.2 μL. 引物序列见表1. 反应程序为预变性95 ℃、30 s; 变性95 ℃、15 s; 退火、延伸, 60 ℃, 30 s, 循环(45次); 最后仪器自带熔解曲线程序. 2-ΔΔCt法计算目的基因相对表达量.
| 引物名称 | 引物序列(5'→3') |
| GAPDH-F | CTGGAGAAACCTGCCAAGTATG |
| GAPDH-R | GGTGGAAGAATGGGAGTTGCT |
| CD163-F | CTGGGATGTCCAACTGCCAT |
| CD163-R | AATGCTTCCCCCATTCCTGG |
| Arg-1-F | TGGACCCTGGGGAACACTAT |
| Arg-1-R | CTTCCTTCCCAGCAGGTAGC |
| CD206-F | TTTGGCTGGGACTGACCTA |
| CD206-R | GGTGTAGGCTCGGGTAGTAGTG |
| IL-6-F | CAACGCTGCTGGGAGTCTTGT |
| IL-6-R | GACAAGGCTTTTTGTTGTTTGCTTC |
| α-SMA-F | ACCCAGGCATTGCTGACAG |
| α-SMA-R | AGAAGCATTTGCGGTGGAC |
统计学处理 采用Graph Pad Prism 8软件进行数据统计分析, 采用单因素方差分析组间差异, 组间两两比较用最小显著性差异法, P<0.05为差异有统计学意义.
通过GeneCard数据库及OMIM数据库筛选得到1080个肝纤维化疾病靶点.
通过String数据库, 构建包含11812个节点和247200条边的人类PPI网络, 以一贯煎作用靶点和肝纤维化疾病靶点作为节点, 排除单独蛋白, 构建有826个节点, 10270条边的一贯煎-肝纤维化子网络.
基于子网络进行RWR算法筛选得到一贯煎治疗肝纤维化的关键基因, 亲和度前10的基因见表2.
| 序号 | 基因 | 评分 |
| 1 | STAT6 | 0.002386264 |
| 2 | SRC | 0.002183804 |
| 3 | MAPK3 | 0.002144015 |
| 4 | STX1A | 0.002072575 |
| 5 | EP300 | 0.001943904 |
| 6 | STAT3 | 0.001840098 |
| 7 | PLG | 0.001807229 |
| 8 | CTNNB1 | 0.001723117 |
| 9 | CDKN1B | 0.001684177 |
| 10 | CANX | 0.001529570 |
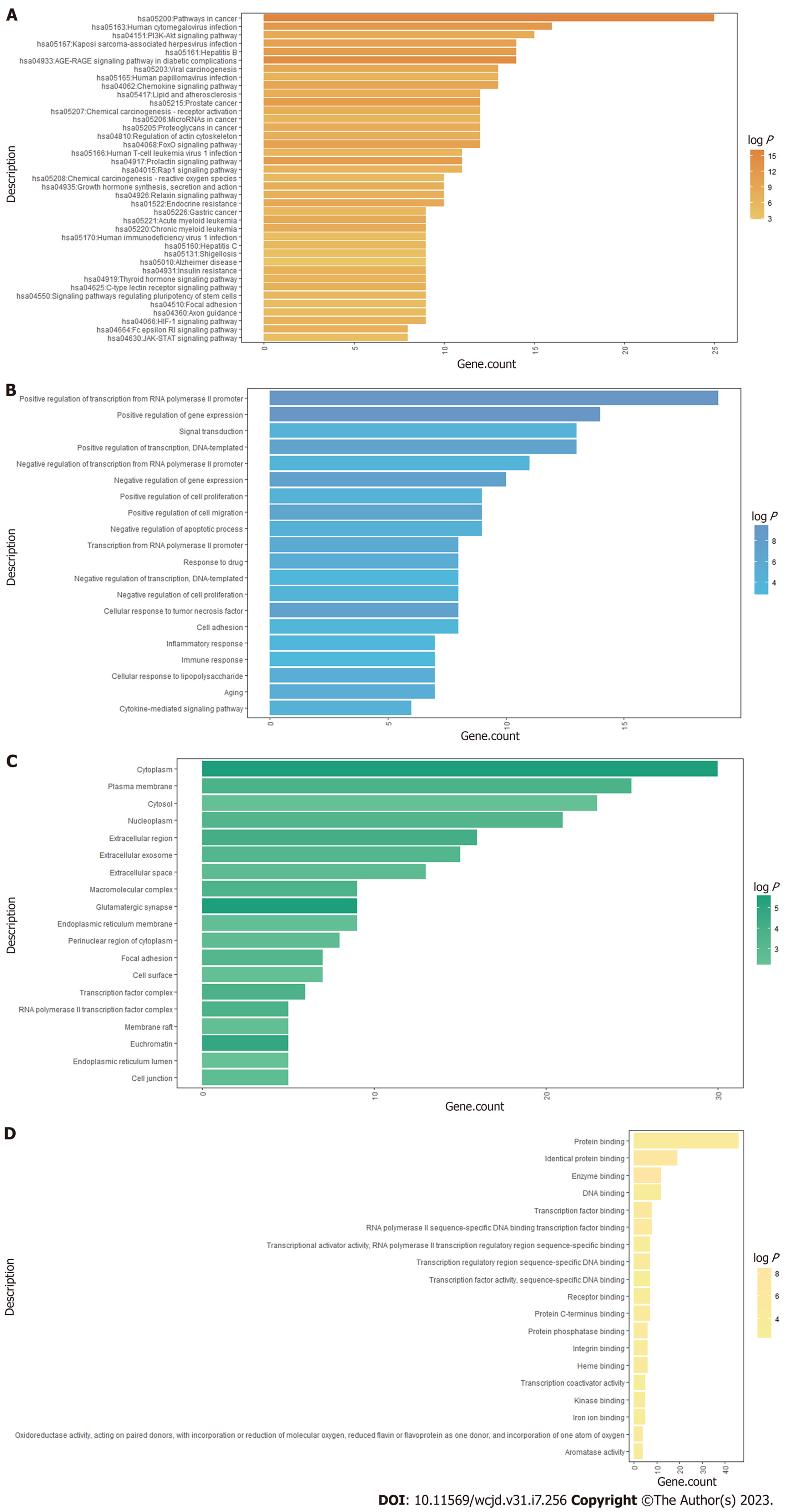
KEGG结果富集得到PI3K-Akt信号通路、FoxO信号通路、HIF-1信号通路、JAK-STAT信号通路等134条. GO富集结果显示主要涉及信号转导、凋亡过程的负调控、细胞增殖的正调控、炎症反应等89个生物进程; 细胞质、细胞外区域、细胞外泌体等23个细胞组分; 酶结合、受体结合、蛋白磷酸酶结合等33个分子功能. 以富集基因数排序, 展示前40条KEGG通路, 前20条GO分析, 见图2.
生化指标检测结果见表3显示, 与正常组大鼠比较, 模型组大鼠血清中的ALT、AST水平显著上升(P<0.01), 提示肝功能损伤. 与模型组大鼠比较, 给予一贯煎治疗后, 大鼠血清中ALT、AST水平明显下降(P<0.01), 提示一贯煎治疗具有改善大鼠肝功能的作用.
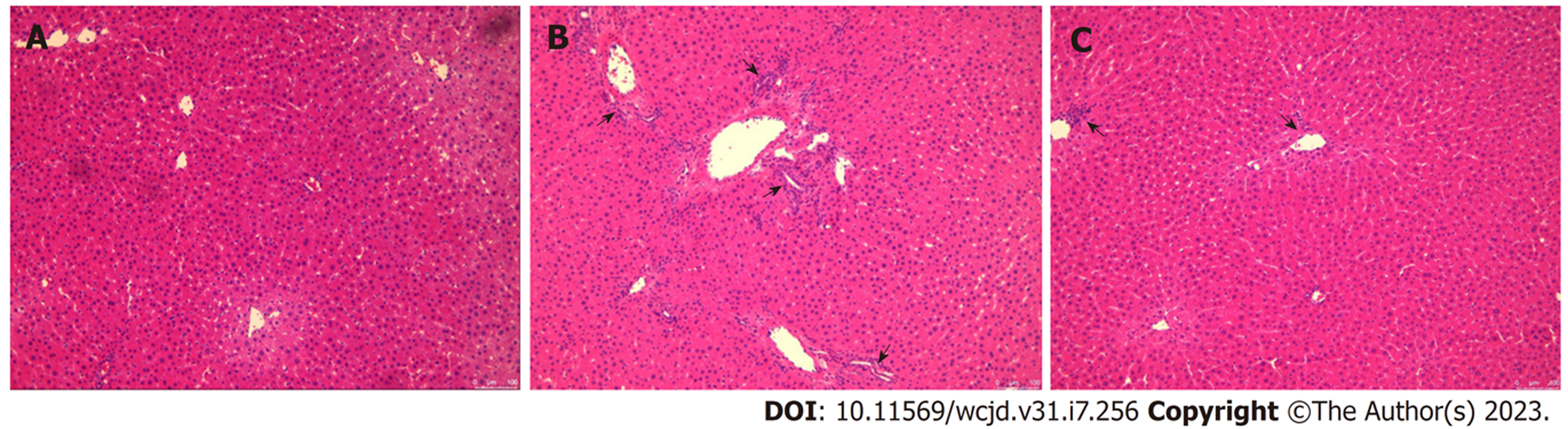
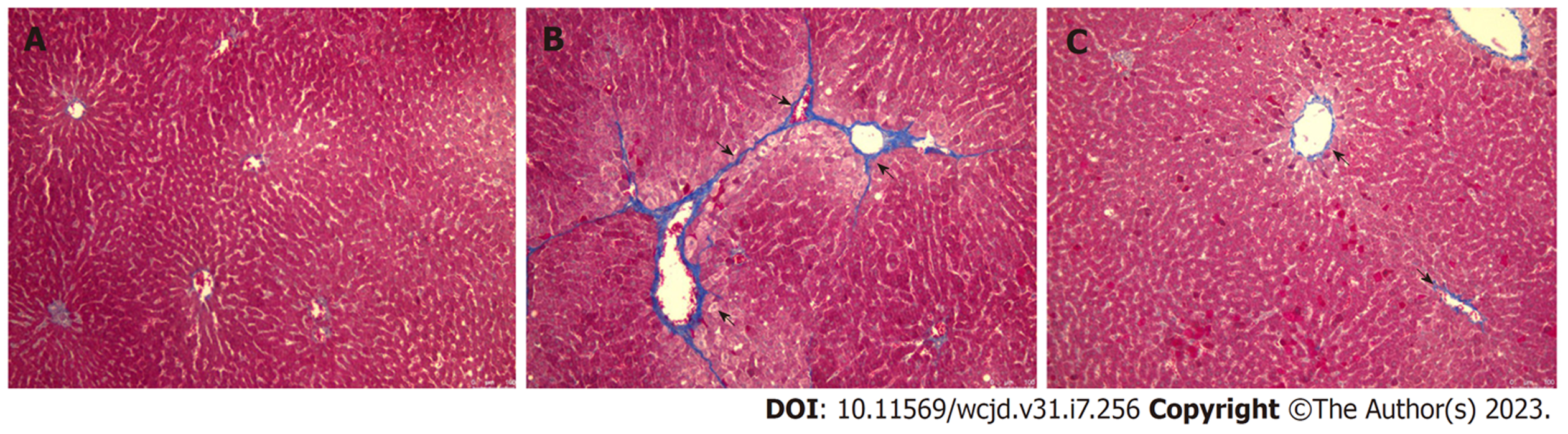
HE、Masson染色结果见图3、4: 图3A、图4A显示, 正常组大鼠肝脏结构清晰、肝细胞排列规则, 胞核清楚、胞浆均匀, 仅在汇管区附近出现极少量胶原; 图3B、图4B显示, 模型组大鼠肝脏结构明显破坏, 细胞排列杂乱, 出现大量炎症细胞浸润, 可见片状和桥接坏死, 有大量蓝色胶原纤维连接形成间隔, 肝纤维化形成, 提示模型组出现明显肝纤维化变化; 图3C、4C显示, 一贯煎组大鼠肝脏结构损伤明显减轻, 炎性浸润细胞明显减少, 纤维面积显著减少, 提示一贯煎减轻肝纤维化程度.
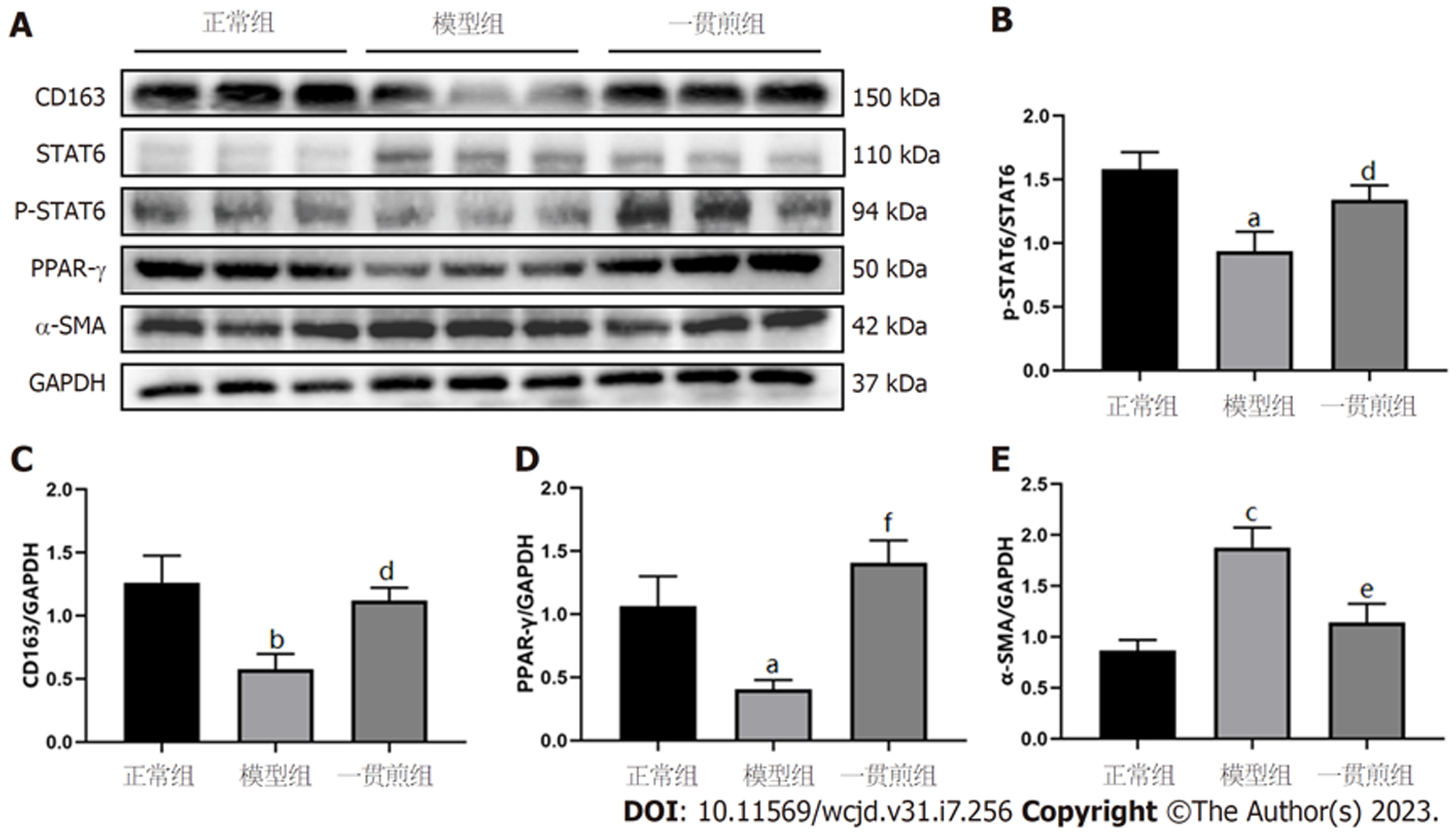
WB检测结果显示: 与正常组相比, 模型组的α-SMA蛋白表达水平显著升高(P<0.001), STAT6磷酸化水平显著降低(P<0.01), PPAR-γ、CD163蛋白表达显著下降(P<0.05); 与模型组相比, 一贯煎组α-SMA的蛋白表达水平显著降低(P<0.01), STAT6磷酸化水平明显上升(P<0.05), PPAR-γ、CD163蛋白表达显著升高(P<0.05或P<0.001), 见图5.
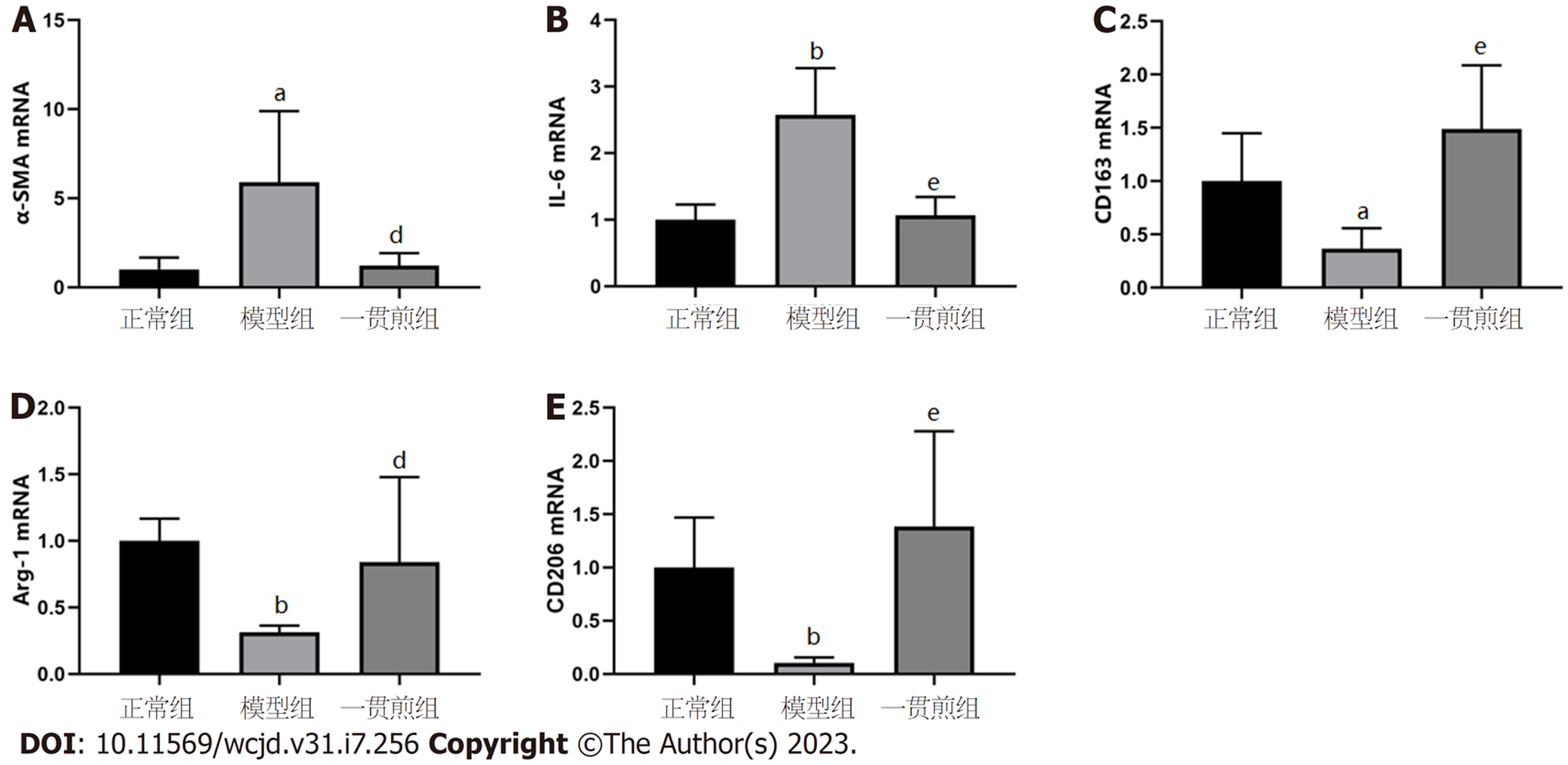
qRT-PCR结果显示: 与正常组相比, 模型组的α-SMA、IL-6 mRNA转录水平显著升高, M2型巨噬细胞标志物Arg-1、CD206、CD163 mRNA转录水平显著降低(P<0.05或P<0.01); 与模型组相比, 一贯煎组α-SMA、IL-6的mRNA转录水平显著降低(P<0.05或P<0.01), Arg-1、CD206、CD163 mRNA转录水平显著升高(P<0.05或P<0.01), 见图6.
网络药理可以帮助探究药物、靶点与疾病之间的相互作用, 尤其适用于成分复杂的中药复方[14]. 通过药物作用靶点和疾病靶点构建PPI子网络, 可以在更大范围寻找有效的潜在作用靶点, 进一步预测药物作用机制[15,16]. 本研究基于人类PPI网络以药物作用靶点和疾病靶点为节点构建一贯煎-肝纤维化PPI子网络, 利用RWR算法筛选一贯煎治疗肝纤维化的关键靶点.
根据RWR评分, 与一贯煎作用靶点亲和度较高的前10位基因有STAT6、SRC、MAPK3、STX1A、EP300、STAT3、PLG、CTNNB1、CDKN1B、CANX. 其中多数基因与肝纤维化的形成和逆转密切相关: 转录因子家族中的成员, 信号转导和转录激活因子3(signal transducer and activator of transcription 3, STAT3)以及STAT6在细胞生长、分化等基本细胞过程中发挥着至关重要的作用[17]. 其中, 抑制STAT3表达水平, 能够减少细胞外基质沉积, 减轻肝纤维化[18]. STAT6的磷酸化可以诱导肝脏巨噬细胞向抗炎(M2)型转换[19]. M2型巨噬细胞在肝纤维化消退过程中, 也发挥逆转纤维化的作用[20]. 如M2型巨噬细胞可以表达Arg-1对抑制和消除纤维化极为重要[21]; M2型巨噬细胞分泌的外泌体中microRNA-411-5p可以下调钙调素调节蛋白表达抑制肝星状细胞活化, 从而逆转肝纤维化[22]. 原癌基因酪氨酸蛋白激酶(proto-oncogene tyrosine-protein kinase, SRC)通过STAT3、蛋白激酶B等磷酸化, 从而调节各种生物活性, 包括细胞存活、增殖和迁移[23,24]. 研究表明SRC促进肝星状细胞活化, 刺激转化生长因子-β的产生, 抑制SRC的表达可以预防肝纤维化的形成[25]. 组蛋白乙酰基转移酶EP300[26]、细胞内支架蛋白β-catenin(由CTNNB1编码产生)[27]、细胞周期抑制蛋白p27(由CDKN1B编码产生)[28]以及ER应激关键因子钙连蛋白(由CANX编码产生)[29]的表达均可通过减少肝星状细胞活化或促进肝星状细胞凋亡, 来改善肝纤维化. 纤溶酶原(plasminogen, PLG)是血液中的一种纤溶因子, 会促进低密度脂蛋白的摄取导致巨噬细胞发泡, 实验表明, 抑制PLG可减少巨噬细胞发泡, 从而减轻非酒精性脂肪性肝炎导致的纤维化[30]. 以上结果显示通过PPI子网络筛选得到的关键基因可以作为抗肝纤维化的潜在治疗基因, 为一贯煎抗肝纤维化的机制研究提供理论依据.
对亲和度前50个关键基因进行通路富集分析, 结果表明一贯煎抗肝纤维化作用涉及多个通路, 如PI3K-Akt信号通路、FoxO信号通路、HIF-1信号通路、JAK-STAT信号通路等. 研究显示, PI3K/Akt信号通路在调控细胞增殖、凋亡方面发挥重要作用, 肝康片可以激活PI3K/Akt信号通路, 抑制下游相关凋亡基因, 减少肝细胞凋亡, 有效减轻大鼠肝纤维化, 保护肝脏[31]. FoxO信号通路可以诱导线粒体自噬, 从而减轻肝脏氧化应激反应, 缓解肝组织损伤[32]. HIF-1信号通路是应答缺氧应激的关键通路, HIF-1α是缺氧诱导因子1(hypoxia-inducible factor-1, HIF-1)的一个亚型, 肝损伤会引起肝缺氧和HIF-1α持续激活, 导致生长促进因子持续产生, 最终引起胶原蛋白的累积和肝纤维化的形成[33]. 通过抑制HIF-1α的表达, 可以减缓肝组织纤维化进程[34]. JAK-STAT信号通路主要由酪氨酸激酶相关受体、Janus激酶以及信号转导和转录激活因子组成, 可以被白细胞介素4、IL-6等细胞因子激活, 调控靶基因转录与表达, 在肝纤维化的形成过程发挥重要的调控作用[35]. 徐冲等[36]发现高车前素通过干预JAK1/STAT3信号通路可有效减轻CCl4诱导小鼠肝纤维化程度和炎症小鼠的肝损伤和炎症程度. 因此, 一贯煎抗肝纤维化的主要途径可能参与多条通路, 涉及缺氧, 细胞增殖、凋亡, 氧化应激等多个环节.
根据网络药理学结果, 选择RWR结果评分最高的STAT6基因进行动物实验验证, 以探究一贯煎抗纤维化的作用机制. PPAR-γ属于核受体超家族, 是一种配体激活的转录因子[37]. PPAR-γ是M2型巨噬细胞成熟的必要条件[38], 其与STAT6的相互作用能够促使巨噬细胞向M2型极化[39]. Western blot和qRT-PCR实验表明一贯煎可以促进STAT6蛋白磷酸化, 上调PPAR-γ表达, 同时, M2型巨噬细胞标志物CD163蛋白及CD206、Arg-1 mRNA转录水平增加, 提示一贯煎促进巨噬细胞向M2型极化. 此外, 说明一贯煎通过调控STAT6磷酸化诱导巨噬细胞极化可以作为抗肝纤维化的靶点, 在一定程度上验证了本次网络药理学结果的可靠性.
本研究借助网络药理学方法探究一贯煎治疗肝纤维化可能的作用靶标及途径, 预测一贯煎可以通过多种成分、多条通路治疗肝纤维化. 通过实验验证发现一贯煎可以通过调控STAT6/PPAR-γ通路促进巨噬细胞向M2型极化, 发挥逆转肝纤维化的作用, 为后续深入研究一贯煎治疗肝纤维化的作用机制提供科学依据.
肝纤维化是慢性肝病向肝硬化发展过程中的重要过程, 阻止、甚至逆转肝纤维化进程具有重要临床意义. 中医对肝纤维化虽无确定病名, 但肝纤维化的主要临床表现可将其归属于"胁痛"、"积聚"或"鼓胀"等范畴, 在中医药宝库中留有大量治疗此类疾病的珍贵方剂, 其中一贯煎配伍精当, 是治疗肝纤维化肝肾阴虚证的首选方剂.
探索一贯煎治疗肝纤维化作用机制对于其开发和推广具有重要意义.
通过网络药理学方法探索一贯煎治疗肝纤维化机制的潜在作用机制.
通过搜索文献和TCMSP数据库收集一贯煎成分及靶点, GeneCard、OMIM数据库收集肝纤维化疾病靶点. 基于STRING数据库构建一贯煎-肝纤维化蛋白互作子网络, 应用重启随机游走算法获得一贯煎治疗肝纤维化的关键基因, 通过基因本体富集分析与京都基因和基因组百科全书通路分析关键基因主要参与的生物学过程与信号通路. 进行实验验证. 给予四氯化碳油溶液建立肝纤维化大鼠模型. 并用一贯煎进行治疗. 收集大鼠血清和肝组织. 检测血清肝功能指标天冬氨酸转氨酶、丙氨酸转氨酶变化. HE、Masoon染色观察肝脏病理学变化. Western blot法和qRT-PCR法检测一贯煎对肝纤维化标志α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、炎症标志物白细胞介素6(interleukin-6, IL-6)、关键基因信号转导和转录激活因子6(signal transducer and activator of transcription 6, STAT6)、p-STAT6、过氧化物酶体增殖物激活受体-γ(peroxisome proliferatoractivated receptor-γ, PPAR-γ)、M2巨噬细胞标志白细胞分化抗原163(cluster of differentiation 163, CD163)、精氨酸酶1(arginase I, Arg-1)、白细胞分化抗原206(cluster of differentiation 206, CD206)蛋白表达及mRNA转录水平的影响.
收集得到一贯煎成分52个, 靶点186个, 肝纤维化疾病靶点1080个, 得到一贯煎治疗肝纤维化亲和度前10的关键基因有STAT6、SRC、MAPK3、STX1A、EP300、STAT3、PLG、CTNNB1、CDKN1B、CANX. GO富集分析和KEGG富集分析结果显示主要涉及信号转导、凋亡过程的负调控等生物进程; 细胞质、细胞外区域等细胞组分; 酶结合、受体结合等分子功能. 涉及PI3K-Akt信号通路、FoxO信号通路等. 实验验证结果发现, 一贯煎能够改善大鼠肝功能, 减轻纤维化, 降低α-SMA表达及IL-6的mRNA转录水平, 促进STAT6磷酸化, 提高PPAR-γ、CD163蛋白表达和Arg-1、CD206、CD163 mRNA转录水平.
网络药理学预测结果显示一贯煎可以通过多种成分、多条通路治疗肝纤维化, STAT6、SRC、MAPK3、STX1A、EP300、STAT3、PLG、CTNNB1、CDKN1B、CANX是一贯煎治疗肝纤维化的关键基因. 实验验证证明一贯煎可以减轻肝纤维化症状, 与调控STAT6/PPAR-γ通路促进巨噬细胞向M2型极化有关.
本研究借助网络药理学方法对一贯煎治疗肝纤维化作用机制进行预测, 并对预测结果进行了简单验证, 但仅对亲和度评分最高的基因进行了基本验证, 还需对其他基因及机制进行进一步研究, 有望为一贯煎治疗肝纤维化的作用机制及药物开发提供新思路.
学科分类: 胃肠病学和肝病学
手稿来源地: 北京市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Kisseleva T, Brenner D. Molecular and cellular mechanisms of liver fibrosis and its regression. Nat Rev Gastroenterol Hepatol. 2021;18:151-166. [PubMed] [DOI] |
| 2. | Ginès P, Castera L, Lammert F, Graupera I, Serra-Burriel M, Allen AM, Wong VW, Hartmann P, Thiele M, Caballeria L, de Knegt RJ, Grgurevic I, Augustin S, Tsochatzis EA, Schattenberg JM, Guha IN, Martini A, Morillas RM, Garcia-Retortillo M, de Koning HJ, Fabrellas N, Pich J, Ma AT, Diaz MA, Roulot D, Newsome PN, Manns M, Kamath PS, Krag A; LiverScreen Consortium Investigators. Population screening for liver fibrosis: Toward early diagnosis and intervention for chronic liver diseases. Hepatology. 2022;75:219-228. [PubMed] [DOI] |
| 8. | Ru J, Li P, Wang J, Zhou W, Li B, Huang C, Li P, Guo Z, Tao W, Yang Y, Xu X, Li Y, Wang Y, Yang L. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines. J Cheminform. 2014;6:13. [PubMed] [DOI] |
| 9. | Wang Y, Wang Q, Huang H, Huang W, Chen Y, McGarvey PB, Wu CH, Arighi CN; UniProt Consortium. A crowdsourcing open platform for literature curation in UniProt. PLoS Biol. 2021;19:e3001464. [PubMed] [DOI] |
| 10. | Stelzer G, Rosen N, Plaschkes I, Zimmerman S, Twik M, Fishilevich S, Stein TI, Nudel R, Lieder I, Mazor Y, Kaplan S, Dahary D, Warshawsky D, Guan-Golan Y, Kohn A, Rappaport N, Safran M, Lancet D. The GeneCards Suite: From Gene Data Mining to Disease Genome Sequence Analyses. Curr Protoc Bioinformatics. 2016;54:1.30.1-1.30.33. [PubMed] [DOI] |
| 11. | Whirl-Carrillo M, McDonagh EM, Hebert JM, Gong L, Sangkuhl K, Thorn CF, Altman RB, Klein TE. Pharmacogenomics knowledge for personalized medicine. Clin Pharmacol Ther. 2012;92:414-417. [PubMed] [DOI] |
| 12. | Szklarczyk D, Gable AL, Nastou KC, Lyon D, Kirsch R, Pyysalo S, Doncheva NT, Legeay M, Fang T, Bork P, Jensen LJ, von Mering C. The STRING database in 2021: customizable protein-protein networks, and functional characterization of user-uploaded gene/measurement sets. Nucleic Acids Res. 2021;49:D605-D612. [PubMed] [DOI] |
| 13. | Sherman BT, Hao M, Qiu J, Jiao X, Baseler MW, Lane HC, Imamichi T, Chang W. DAVID: a web server for functional enrichment analysis and functional annotation of gene lists (2021 update). Nucleic Acids Res. 2022;50:W216-W221. [PubMed] [DOI] |
| 14. | Zhang R, Zhu X, Bai H, Ning K. Network Pharmacology Databases for Traditional Chinese Medicine: Review and Assessment. Front Pharmacol. 2019;10:123. [PubMed] [DOI] |
| 15. | Wei X, Hou W, Liang J, Fang P, Dou B, Wang Z, Sai J, Xu T, Ma C, Zhang Q, Cheng F, Wang X, Wang Q. Network Pharmacology-Based Analysis on the Potential Biological Mechanisms of Sinisan Against Non-Alcoholic Fatty Liver Disease. Front Pharmacol. 2021;12:693701. [PubMed] [DOI] |
| 16. | Yu J, Fu Y, Zeng L, Zheng Y. Investigating the active components of Huatan Tongjing decoction for the treatment of polycystic ovary syndrome via network pharmacology. Chem Biol Drug Des. 2022;100:515-524. [PubMed] [DOI] |
| 17. | Kong X, Horiguchi N, Mori M, Gao B. Cytokines and STATs in Liver Fibrosis. Front Physiol. 2012;3:69. [PubMed] [DOI] |
| 18. | Tang M, Chen Y, Li B, Sugimoto H, Yang S, Yang C, LeBleu VS, McAndrews KM, Kalluri R. Therapeutic targeting of STAT3 with small interference RNAs and antisense oligonucleotides embedded exosomes in liver fibrosis. FASEB J. 2021;35:e21557. [PubMed] [DOI] |
| 19. | Li Y, Sheng Q, Zhang C, Han C, Bai H, Lai P, Fan Y, Ding Y, Dou X. STAT6 up-regulation amplifies M2 macrophage anti-inflammatory capacity through mesenchymal stem cells. Int Immunopharmacol. 2021;91:107266. [PubMed] [DOI] |
| 20. | Cheng D, Chai J, Wang H, Fu L, Peng S, Ni X. Hepatic macrophages: Key players in the development and progression of liver fibrosis. Liver Int. 2021;41:2279-2294. [PubMed] [DOI] |
| 21. | Pesce JT, Ramalingam TR, Mentink-Kane MM, Wilson MS, El Kasmi KC, Smith AM, Thompson RW, Cheever AW, Murray PJ, Wynn TA. Arginase-1-expressing macrophages suppress Th2 cytokine-driven inflammation and fibrosis. PLoS Pathog. 2009;5:e1000371. [PubMed] [DOI] |
| 22. | Wan Z, Yang X, Liu X, Sun Y, Yu P, Xu F, Deng H. M2 macrophage-derived exosomal microRNA-411-5p impedes the activation of hepatic stellate cells by targeting CAMSAP1 in NASH model. iScience. 2022;25:104597. [PubMed] [DOI] |
| 23. | Jiang XL, Deng B, Deng SH, Cai M, Ding WJ, Tan ZB, Chen RX, Xu YC, Xu HL, Zhang SW, Zhang SQ, Liu B, Zhang JZ. Dihydrotanshinone I inhibits the growth of hepatoma cells by direct inhibition of Src. Phytomedicine. 2022;95:153705. [PubMed] [DOI] |
| 24. | Zhang L, Zhou F, Drabsch Y, Gao R, Snaar-Jagalska BE, Mickanin C, Huang H, Sheppard KA, Porter JA, Lu CX, ten Dijke P. USP4 is regulated by AKT phosphorylation and directly deubiquitylates TGF-β type I receptor. Nat Cell Biol. 2012;14:717-726. [PubMed] [DOI] |
| 25. | Seo HY, Lee SH, Lee JH, Kang YN, Hwang JS, Park KG, Kim MK, Jang BK. Src Inhibition Attenuates Liver Fibrosis by Preventing Hepatic Stellate Cell Activation and Decreasing Connetive Tissue Growth Factor. Cells. 2020;9. [PubMed] [DOI] |
| 26. | Zhao J, Peng L, Cui R, Guo X, Yan M. Dimethyl α-ketoglutarate reduces CCl(4)-induced liver fibrosis through inhibition of autophagy in hepatic stellate cells. Biochem Biophys Res Commun. 2016;481:90-96. [PubMed] [DOI] |
| 27. | Rong X, Liu J, Yao X, Jiang T, Wang Y, Xie F. Human bone marrow mesenchymal stem cells-derived exosomes alleviate liver fibrosis through the Wnt/β-catenin pathway. Stem Cell Res Ther. 2019;10:98. [PubMed] [DOI] |
| 28. | Wang L, Bai G, Chen F. Human bone marrow mesenchymal stem cells suppress the proliferation of hepatic stellate cells by inhibiting the ubiquitination of p27. Biochem Cell Biol. 2017;95:628-633. [PubMed] [DOI] |
| 29. | He L, Hou X, Fan F, Wu H. Quercetin stimulates mitochondrial apoptosis dependent on activation of endoplasmic reticulum stress in hepatic stellate cells. Pharm Biol. 2016;54:3237-3243. [PubMed] [DOI] |
| 30. | Tomonari Y, Iwaki T, Arakawa T, Umemura K. Inhibition of plasminogen suppresses fibrosis and macrophage foaming in a nonalcoholic steatohepatitis mouse model. Fundam Clin Pharmacol. 2022;36:827-836. [PubMed] [DOI] |
| 33. | Zhan L, Huang C, Meng XM, Song Y, Wu XQ, Yang Y, Li J. Hypoxia-inducible factor-1alpha in hepatic fibrosis: A promising therapeutic target. Biochimie. 2015;108:1-7. [PubMed] [DOI] |
| 37. | Li J, Guo C, Wu J. The Agonists of Peroxisome Proliferator-Activated Receptor-γ for Liver Fibrosis. Drug Des Devel Ther. 2021;15:2619-2628. [PubMed] [DOI] |