修回日期: 2022-12-29
接受日期: 2023-01-17
在线出版日期: 2023-03-28
胃底腺型胃癌(gastric adenocarcinoma of the fundic gland type, GA-FG)是近年来新发现的一种胃癌类型, 不同于传统的肠癌和弥漫性胃癌, 是一种分化良好的肿瘤. 预计GA-FG在所有胃癌中的比例将越来越高, 但目前内镜医师及临床病理学家对该病认识不足容易导致误诊.
本文通过对该病的内镜、临床及病理特点进行系统回顾, 旨在增加该疾病的诊断率并减少漏诊及误诊.
在Pubmed及中国知网收集2007-01/2022-03期间公开发表的中英文文献中报道的胃底腺型胃癌患者临床、病理及内镜资料, 并进行回顾分析.
共收集67篇文献中320例胃底腺型胃癌患者共322处病变相关资料. 病变多位于胃上1/3(81.6%), 病变平均大小9.66 mm(1 mm-85 mm), 约76.88%病变大体形态为隆起型. 窄带成像观察病变表面可见微血管扩张及微腺体结构紊乱或增粗. 所有病变中主细胞分化型约占74.84%, 显著表达MUC6及胃蛋白酶原, 预后良好.
胃底腺型胃癌发病率低, 内镜下完整切除及外科手术可到达治愈性切除的目的, 预后较好, 但易误诊, 诊断时应结合其临床病理学特点, 从而减少误诊及漏诊率.
核心提要: 胃底腺型胃癌是一种罕见的胃腺癌亚型, 好发于老年患者. 其分化良好, 免疫组化特征可以用于明确诊断. 绝大多数病例通过内镜可将病灶完全切除, 并在随访期间没有复发或转移.其发病机制尚不明确, 仍需进一步研究.
引文著录: 郭宝珍, 刘真真, 申高飞, 朱飞, 连慧芬, 李欣, 郑君仪, 李进鹏, 邓水苗, 黄蕊. 胃底腺型胃癌临床病理特点的文献回顾分析. 世界华人消化杂志 2023; 31(6): 244-248
Revised: December 29, 2022
Accepted: January 17, 2023
Published online: March 28, 2023
Gastric adenocarcinoma of fundic gland type (GA-FG) is a newly discovered type of gastric cancer in recent years, and it is a form of well-differentiated malignancy unlike conventional intestinal and diffuse gastric cancers. It is expected that GA-FG will account for an increasing proportion of all gastric cancers, but the current lack of knowledge among endoscopists and clinicopathologists may lead to misdiagnosis.
To increase the diagnostic yield of GA-FG and reduce missed diagnosis and misdiagnosis, we conducted a systematic review of the endoscopic, clinical, and pathological features of GA-FG.
The clinical, pathological, and endoscopic data of patients with GA-FG reported in the Chinese and English literature published between January 2007 and March 2022 were collected from PubMed and CNKI and retrospectively analyzed.
Data related to a total of 322 lesions in 320 patients with GA-FG were collected from 67 articles. Most of the lesions were located in the upper third of the stomach (81.6%), with an average lesion size of 9.66 mm (1 mm-85 mm), and approximately 76.88% of the lesions had an elevated gross morphology. Microvascular dilatation and disorganized or thickened microglandular structures were observed on the surface of the lesions by narrow band imaging. The main cell differentiation type accounted for approximately 74.84% of all lesions, which significantly expressed MUC6 and pepsinogen.
The incidence of GA-FG is low. Endoscopic complete resection and surgical operation can achieve curative resection. The prognosis is good, but it tends to be misdiagnosed. The diagnosis should be combined with its clinicopathological characteristics to reduce the rate of misdiagnosis and missed diagnosis.
- Citation: Guo BZ, Liu ZZ, Shen GF, Zhu F, Lian HF, Li X, Zheng JY, Li JP, Deng SM, Huang R. Clinicopathological features of gastric adenocarcinoma of fundic gland type. Shijie Huaren Xiaohua Zazhi 2023; 31(6): 244-248
- URL: https://www.wjgnet.com/1009-3079/full/v31/i6/244.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i6.244
胃底腺型胃癌(gastric adenocarcinoma of the fundic gland type, GA-FG)是胃腺癌的一种特殊类型, 具有独特的临床病理和内镜特征[1,2]. 在2017年GA-FG作为一种特殊的癌症类型被添加到日本胃癌分类中, 世界卫生组织于2019年也将GA-FG列入消化系统肿瘤分类中[3,4]. 组织学上, GA-FG是一种分化良好的上皮性肿瘤, 表现为向胃底腺分化的非典型细胞, 具有轻度核异型性、低增殖活性以及不规则血管生长的特点[5,6]. 免疫组织化学(immunohistochemistry, IHC)中, GA-FG显示胃蛋白酶原-Ⅰ和/或H+K+-ATPase阳性, 分子特征还涉及核β-连环蛋白阳性, 这可能与WNT-β-连环蛋白信号通路的激活有关[2,7]. GA-FG的表层被非肿瘤性黏膜覆盖, 肿瘤腺体主要分布于胃底腺黏膜的中深层[8]. 根据肿瘤的特征性分化组成将GA-FG分为三个亚类, 即主细胞型(99%以上的报告病例)、壁细胞型和混合型.
在接受内镜检查的早期胃癌患者中GA-FG患者仅占1%, 并且目前报道的大多数病例分布在韩国和日本, 其他地区相对少见[4]. 由于公共卫生条件的改善和根除性治疗, 全球幽门螺杆菌感染已显着减少, 与之相关的肠型胃癌的发病率将逐渐降低, 预计GA-FG在胃癌中的比例将有所升高[9]. 尽管对GA-FG的认知正在逐渐提高, 但由于其罕见且缺乏形态特异性, 目前部分病例仍难以诊断并且可能误诊为其他疾病, GA-FG(尤其是混合型)可以模拟胃底腺息肉或幽门腺肿瘤的特征, 仅仅通过内镜检查很难将其与分化良好的其他病变区分开来[10]. 因此, 本研究旨在通过对GA-FG相关文献的归纳梳理和总结评价, 从内镜特征、组织学特征、IHC结果和患者病史等方面进一步加强对GA-FG的理解.
在检索万方、中国知网、维普、Pubmed数据库、web of science数据库中进行了中英文文献系统筛选. 英文文献使用了以下关键词进行检索: "gastric adenocarcinoma of the fundic gland type", "gastric adenocarcinoma chief cell predominant type", "gastric adenocarcinoma mixed parietal and chief cell type", "gastric adenocarcinoma parietal cell type", "parietal cell carcinoma". 中文文献使用以下关键词进行检索: 胃底腺型胃癌, 主细胞型胃腺癌, 壁细胞和主细胞混合型胃腺癌, 壁细胞型胃腺癌. 所有搜索使用医学主题词与自由词的组合. 检索时间限定为2022-04-01之前.
纳入和排除标准: 筛选和审查所有文献, 并根据以下条件确定符合条件的研究. 纳入标准包括: (1)包含GA-FG病例的研究; (2)以英文和中文发表的研究; (3)GA-FG患者的临床信息完整. 排除标准包括: (1)排除会议摘要、学术论文等非正式发表的文献; (2)排除综述、述评、新闻报道等非一手原始资料; (3)排除没有可用数据的研究; (4)非英语和中文的研究.
采用Endnote X9软件进行文献查重, 并且排除重复文献. 从纳入的研究中获得以下数据: 研究类型、第一作者、发表年份、国家、GA-FG病例数、患者年龄、患者性别、临床特征、内镜下表现、病理组织学特征、免疫组化及随访情况.
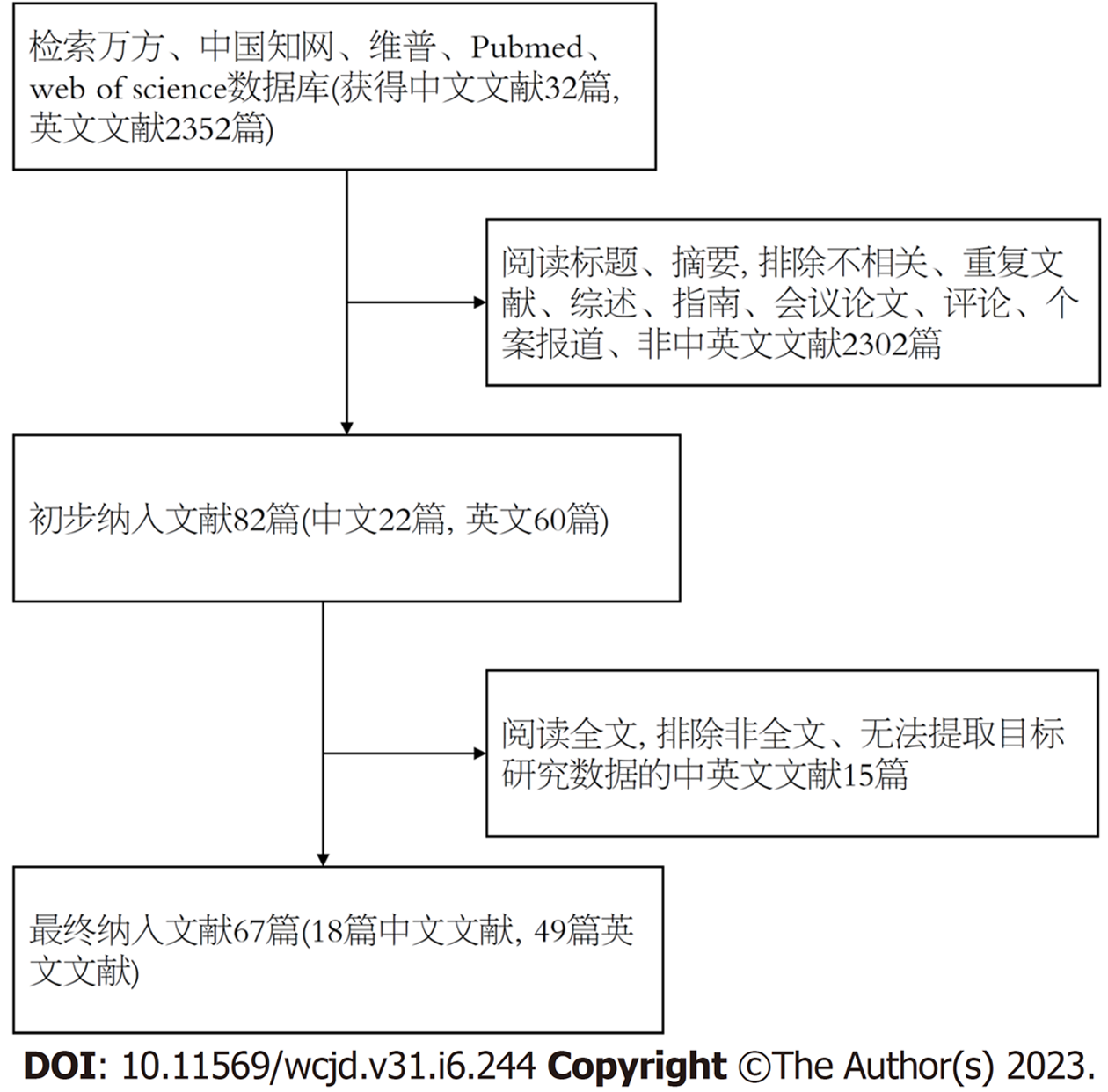
共收集67篇文献中320例胃底腺型胃癌患者共322处病变的相关资料,筛选流程如图1所示. 其中男性196(61.25%)例, 女性124(38.75%)例, 男女比率为1.58:1, 患者为老年人居多, 平均年龄64.9岁(38-87岁). 患者多表现为上腹部疼痛、腹胀、反酸等不典型症状, 部分患者无明显临床症状, 于体检时发现. 320例患者中, 幽门螺旋杆菌感染阳性者29例, 阴性112例, 161例无数据, 18例患者为幽门螺旋杆菌除菌后状态. 个别患者有质子泵抑制剂及H2受体拮抗剂服用史, 但大多数报告没有详细记录用药史, 尤其是质子泵抑制剂的使用.
内镜下观察, 绝大多数病变(263例)位于胃上1/3(81.68%), 少部分(50例)位于胃中1/3(15.53%), 仅7例位于胃下1/3(2.17%), 剩余2处病变未说明具体部位. 病变平均大小9.66 mm(1 mm-85 mm), 约76.88%(246/320)病变大体形态为隆起型, 部分呈黏膜下肿瘤样, 余为平坦型、隆起+凹陷型及凹陷型, 2处病变未明确描述大体形态. 白光内镜下观察, 在详细记录病变表面色泽的228处病变中共有133处(58.33%)病变表面为褪色调改变, 其余表面色泽发红或与周围粘膜一致, 极少数表面呈现黑色或棕色改变, 背景黏膜多无萎缩. 窄带成像观察病变多无明确边界, 表面可见微血管扩张及微腺体结构紊乱或增粗.
所有病变经活检、内镜下切除或外科手术切除后行病理及免疫组化分析, 结果显示217处(67.39%)病变浸润至粘膜下层, 71处(22.05%)病变局限于粘膜层, 各有1处病变浸润至黏膜肌层及固有肌层, 另外有2处病变浸润至浆膜层, 其余30处病变未记录浸润深度或浸润深度无法评估. 大多数病变(255/322)无淋巴血管浸润, 部分(20/322)有淋巴血管浸润, 其余未评估或未记录淋巴血管浸润情况. 淋巴结转移、胃外播散少见. 主细胞分化型约占74.84%(241/322), 其余为壁细胞分化型及混合型或不详. 主细胞分化型显著表达MUC6及胃蛋白酶原, 壁细胞显著表达H+/K+ATP酶, 少部分表达MUC5AC, MUC2及P53阴性, Ki67增殖指数范围在1%-40%.
2名浸润深度在浆膜层的患者均伴有淋巴结转移, 最后均行全胃切除术及淋巴结清扫术. 随访过程中, 各有1名患者死于肝癌及心血管疾病, 1名患者死于癌症, 但未确定组织学类型且未进行尸检, 另外有1名患者可能由于病变切除不完整而处于持续性疾病状态. 其余大多数患者经治疗后均存活且无癌症转移, 55名患者无随访数据.
GA-FG是最近发现的一种罕见的胃腺癌病理亚型, 其病因及发病机制尚不明确, 幽门螺杆菌感染引起的慢性萎缩性炎是常规胃癌的主要致病因素, 相比之下, 大多数GA-FG在内镜下或病理上没有明显的萎缩区域, 因此其发病机制被认为与幽门螺杆菌感染无潜在联系[11]. 本研究也表明只有少数GA-FG患者有幽门螺杆菌感染感染史. 值得注意的是, Iwamuro等[11]提出有幽门螺杆菌感染史的GA-FG患者倾向在非典型部位出现扁平型病变, 而不是在常规的胃上三分之一处, 但这需要进一步扩大样本量进行确认. GA-FG也具有一定的分子特征, 文献报道的基因改变包括: 与Wnt/β-连环蛋白信号通路、GNAS突变、KRAS突变和Sonic Hedgehog通路相关的基因改变[12]. WNT-β-连环蛋白信号通路的激活被认为与肿瘤发生密切相关, 另外, 有研究表明散发性胃底腺息肉也表现出β-连环蛋白的激活突变[13]. 有研究对比了胃腺癌和GA-FG的GNAS和KRAS突变数据, 结果提示GNAS突变频率显着更高, KRAS 突变频率无显着差异[9]. GNAS突变在常规胃腺瘤和腺癌中很少被报道, 可能是GA-FG独特的分子特征. 然而, GA-FG并未检测到TP53突变, 这表明GA-FGM是一种比普通型胃腺癌级别低的恶性肿瘤[9].
GA-FG具有特殊的病理特征: 浅表区保留了正常小凹上皮细胞, 固有层和黏膜下层则有不规则分支和扩张的胃底腺, 细胞核略大于正常, 明显深染. 通过H&E染色可以识别分化良好的GA-FG中的壁细胞和主细胞, 然而在分化程度较低的病例中鉴定GA-FG需要结合免疫组织化学[14]. 主细胞分化标志物(胃蛋白酶原-Ⅰ)和壁细胞分化标志物(RUNX3、H+/K+-ATPase和PDFRA-α)有助于GA-FG诊断, 肿瘤细胞也对MUC6表现出强阳性[15]. GA-FG浅表区的非肿瘤小凹细胞倾向于MUC5AC染色阳性, 而主细胞和壁细胞是阴性的. 在一项研究中, 突触素和CD56染色在GA-FG腺体中呈弥漫性阳性, 而嗜铬粒蛋白则完全阴性[16,17]. 由于嗜铬粒蛋白阳性是前肠源性内分泌细胞特征, 因此我们推断GA-FG没有向内分泌细胞分化的趋势.
GA-FG的鉴别诊断包括: 神经内分泌肿瘤、幽门腺腺瘤和泌酸腺腺瘤. 这些鉴别诊断的内镜检查结果具有黏膜下肿瘤样特征, 但是都和GA-FG有一定形态特征差异[18]. 本研究的临床病理学显示, GA-FG病变较小, 平均直径为9.66毫米, 多位于胃的上三分之一. 大体特征表现为隆起病变为主, 少数平坦或凹陷病变, 并且在一些深度浸润的病例中观察到中央凹陷. 但是大多数神经内分泌肿瘤是黏膜和黏膜下层的小、光滑、坚硬且界限清楚的息肉样隆起物, 随着生长可能会累及整个胃壁[18]. GA-FG无任何息肉样外观, 可用于区分GA-FG与胃神经内分泌肿瘤. 一项研究显示GA-FG和幽门腺腺瘤的IHC谱和分子表型具有相似性, 因此可能主要根据形态特征进行区分[4]. 幽门腺瘤由立方/柱状细胞组成, 具有泡沫状毛玻璃样细胞质, 幽门腺表现出息肉样增殖, 细胞高分化为小凹和幽门腺细胞表型, 然而缺乏主细胞和壁细胞[19,20]. 泌酸腺瘤是一种由柱状细胞组成的良性上皮肿瘤, 可分化为主细胞、壁细胞或两者兼有, 通常缺乏复杂的腺体结构和黏膜下浸润. 有学者认为泌酸腺息肉或腺瘤和GA-FG表现出形态连续性, 腺瘤是主细胞型腺癌的前兆[9].
有随访资料的病例中, 1例处于持续疾病状态, 可能与病灶切除不完全有关. 某些病例的根治性手术切除以及大多数病例的内镜粘膜下剥离术(endoscopic submucosal dissection, ESD)或内镜下黏膜切除术似乎是足够可以治愈的. 在《日本2018胃癌治疗指南》的肿瘤根治性切除扩大适应症中[21,22], 当黏膜下浸润深度等于或大于500 μm时, 需要对分化型胃癌进行额外手术切除. 由于GA-FG几乎没有血管侵犯, 无论SM侵犯深度如何都没有复发或转移, 因此建议此类GA-FG病例不需要额外手术切除. 此外, 还有一些关于GA-FG的病例报告进行了长期随访观察[23].
总之, GA-FG是一种分化良好的腺癌, 多见于老年人, 具有轻度细胞学异型性, 常伴有黏膜下浸润, 但淋巴和血管浸润并不常见. 病变直径较小, 大多位于胃的上三分之一, 主要由主细胞组成. GA-FG的主要免疫组织化学标志物是胃蛋白酶原-Ⅰ和MUC6. 绝大多数病例使用ESD或EMR可将病灶完全切除, 在随访期间没有复发或转移. 如果在内镜检查中怀疑有GA-FG, 病理学家应该进行免疫组织化学染色以明确诊断. GA-FG不同于常规胃腺癌, 其病因和发病机制值得更多关注.
胃底腺型胃癌(gastric adenocarcinoma of the fundic gland type, GA-FG)是胃腺癌的一种新的罕见变异型, 表现为向胃底腺分化的非典型细胞.
尽管对GA-FG的认知正在逐渐提高, 一些病例仍然难以做出正确诊断和治疗.
通过分析汇总GA-FG的内镜特征、组织学特征、IHC结果和患者病史加强对GA-FG的理解.
在国内外常见的数据库进行文献搜索, 依据文献纳入及排除标准, 对符合的文献进行系统综述.
总计汇总了中英文文献67篇. GA-FG病变位置多位于胃上, 形态多为隆起型, 分化以主细胞为主. 免疫组化显著表达MUC6及胃蛋白酶原并且预后良好.
GA-FG容易误诊, 建议结合临床病理学特点提高诊断准确性,治疗建议采取内镜下完整切除和外科手术.
GA-FG不同于常规胃腺癌和肠癌, 其病因和发病机制仍需要进一步研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 陕西省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Zhang H, Wang S, Zhang Y, Ye F, Wang C. Clinicopathological features of early stage gastric adenocarcinoma of fundic gland type: Case series. Medicine (Baltimore). 2022;101:e28469. [PubMed] [DOI] |
| 2. | Iwamuro M, Kusumoto C, Nakagawa M, Kobayashi S, Yoshioka M, Inaba T, Toyokawa T, Hori S, Tanaka S, Matsueda K, Tanaka T, Okada H. Endoscopic resection is a suitable initial treatment strategy for oxyntic gland adenoma or gastric adenocarcinoma of the fundic gland type. Sci Rep. 2021;11:7375. [PubMed] [DOI] |
| 3. | Miyazawa M, Matsuda M, Yano M, Hara Y, Arihara F, Horita Y, Matsuda K, Sakai A, Noda Y. Gastric adenocarcinoma of the fundic gland (chief cell-predominant type): A review of endoscopic and clinicopathological features. World J Gastroenterol. 2016;22:10523-10531. [PubMed] [DOI] |
| 4. | Ueyama H, Matsumoto K, Nagahara A, Hayashi T, Yao T, Watanabe S. Gastric adenocarcinoma of the fundic gland type (chief cell predominant type). Endoscopy. 2014;46:153-157. [PubMed] [DOI] |
| 5. | Sun WW, Zhang L, Gu MM, Zhang YQ, Qiu CM, Da Q. [Gastric adenocarcinoma of the fundic gland type: clinicopathological analysis of six cases]. Zhonghua Bing Li Xue Za Zhi. 2020;49:343-347. [PubMed] [DOI] |
| 6. | Liu L, Han L, Ma Q, Zhang J. Gastric adenocarcinoma of fundic gland (chief cell predominant type) coexisting with well differentiated intestinal adenocarcinoma: A case report. Medicine (Baltimore). 2021;100:e25861. [PubMed] [DOI] |
| 7. | Li C, Wu X, Yang S, Yang X, Yao J, Zheng H. Gastric adenocarcinoma of the fundic gland type: clinicopathological features of eight patients treated with endoscopic submucosal dissection. Diagn Pathol. 2020;15:131. [PubMed] [DOI] |
| 8. | Imamura K, Yao K, Nimura S, Tanabe H, Kanemitsu T, Miyaoka M, Ono Y, Ueki T, Iwashita A. Characteristic endoscopic findings of gastric adenocarcinoma of fundic-gland mucosa type. Gastric Cancer. 2021;24:1307-1319. [PubMed] [DOI] |
| 9. | Ueyama H, Yao T, Akazawa Y, Hayashi T, Kurahara K, Oshiro Y, Yamada M, Oda I, Fujioka S, Kusumoto C, Fukuda M, Uchita K, Kadota T, Oono Y, Okamoto K, Murakami K, Matsuo Y, Kato M, Maehata T, Yahagi N, Yasuhara Y, Yada T, Uraushihara K, Yamane T, Matsuo T, Ito M, Maruyama Y, Osako A, Ono S, Kato M, Yagi K, Hashimoto T, Tomita N, Tsuyama S, Saito T, Matsumoto K, Matsumoto K, Watanabe S, Uemura N, Chiba T, Nagahara A. Gastric epithelial neoplasm of fundic-gland mucosa lineage: proposal for a new classification in association with gastric adenocarcinoma of fundic-gland type. J Gastroenterol. 2021;56:814-828. [PubMed] [DOI] |
| 10. | Benedict MA, Lauwers GY, Jain D. Gastric Adenocarcinoma of the Fundic Gland Type: Update and Literature Review. Am J Clin Pathol. 2018;149:461-473. [PubMed] [DOI] |
| 11. | Iwamuro M, Kusumoto C, Nakagawa M, Matsueda K, Kobayashi S, Yoshioka M, Inaba T, Toyokawa T, Sakaguchi C, Tanaka S, Tanaka T, Okada H. Endoscopic features of oxyntic gland adenoma and gastric adenocarcinoma of the fundic gland type differ between patients with and without Helicobacter pylori infection: a retrospective observational study. BMC Gastroenterol. 2022;22:294. [PubMed] [DOI] |
| 12. | Singhi AD, Lazenby AJ, Montgomery EA. Gastric adenocarcinoma with chief cell differentiation: a proposal for reclassification as oxyntic gland polyp/adenoma. Am J Surg Pathol. 2012;36:1030-1035. [PubMed] [DOI] |
| 13. | Torbenson M, Lee JH, Cruz-Correa M, Ravich W, Rastgar K, Abraham SC, Wu TT. Sporadic fundic gland polyposis: a clinical, histological, and molecular analysis. Mod Pathol. 2002;15:718-723. [PubMed] [DOI] |
| 14. | Tohda G, Osawa T, Asada Y, Dochin M, Terahata S. Gastric adenocarcinoma of fundic gland type: Endoscopic and clinicopathological features. World J Gastrointest Endosc. 2016;8:244-251. [PubMed] [DOI] |
| 15. | Sato Y, Fujino T, Kasagawa A, Morita R, Ozawa SI, Matsuo Y, Maehata T, Yasuda H, Takagi M, Itoh F. Twelve-year natural history of a gastric adenocarcinoma of fundic gland type. Clin J Gastroenterol. 2016;9:345-351. [PubMed] [DOI] |
| 16. | Chan K, Brown IS, Kyle T, Lauwers GY, Kumarasinghe MP. Chief cell-predominant gastric polyps: a series of 12 cases with literature review. Histopathology. 2016;68:825-833. [PubMed] [DOI] |
| 17. | Park ES, Kim YE, Park CK, Yao T, Kushima R, Kim KM. Gastric adenocarcinoma of fundic gland type: report of three cases. Korean J Pathol. 2012;46:287-291. [PubMed] [DOI] |
| 18. | Fukatsu H, Miyoshi H, Ishiki K, Tamura M, Yao T. Gastric adenocarcinoma of fundic gland type (chief cell predominant type) treated with endoscopic aspiration mucosectomy. Dig Endosc. 2011;23:244-246. [PubMed] [DOI] |
| 19. | Joo M, Han SH. Gastric-Type Extremely Well-Differentiated Adenocarcinoma of the Stomach: A Challenge for Preoperative Diagnosis. J Pathol Transl Med. 2016;50:71-74. [PubMed] [DOI] |
| 20. | Khor TS, Alfaro EE, Ooi EM, Li Y, Srivastava A, Fujita H, Park Y, Kumarasinghe MP, Lauwers GY. Divergent expression of MUC5AC, MUC6, MUC2, CD10, and CDX-2 in dysplasia and intramucosal adenocarcinomas with intestinal and foveolar morphology: is this evidence of distinct gastric and intestinal pathways to carcinogenesis in Barrett Esophagus? Am J Surg Pathol. 2012;36:331-342. [PubMed] [DOI] |
| 21. | Terada T. Well differentiated adenocarcinoma of the stomach composed of chief cell-like cells and parietal cells (Gastric adenocarcinoma of fundic gland type). Int J Clin Exp Pathol. 2011;4:797-798. [PubMed] |
| 22. | Li Y, Lu Y, Yu C, Xiao J, Han S. Efficacy analysis of endoscopic submucosal dissection in gastric adenocarcinoma of fundic gland type: five cases of more than 36 months of follow-up. Transl Cancer Res. 2019;8:1734-1740. [PubMed] [DOI] |
| 23. | Kawasaki K, Kurahara K, Oshiro Y, Matsumoto T. Depressed Gastric Adenocarcinoma of the Fundic Gland Type. Intern Med. 2016;55:543-544. [PubMed] [DOI] |