修回日期: 2023-02-09
接受日期: 2023-02-28
在线出版日期: 2023-03-08
急性出血坏死型胰腺炎是临床常见的消化系统急症, 肺损伤是其常见并发症和致死原因. 黄芪注射液具有调节内分泌、增强免疫力、抑制病毒、抗炎、抗氧化应激等作用, 但目前尚未见关于黄芪注射液在重症急性胰腺炎肺损伤中的相关研究.
分析黄芪注射液通过调控雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)/核糖体70S小亚基S6蛋白激酶(ribosome 70S small subunit S6 protein kinase, p70S6K)信号通路对急性出血坏死型胰腺炎(acute hemorrhagic necrotic pancreatitis, AHNP)肺损伤炎症反应的影响.
48只成年SD大鼠简单随机化分为对照组、模型组、低、中、高黄芪注射液组、阳性对照组, 各8只, 记录各组胰腺与肺组织组织病理学变化, 比较各组Schmidt评分、血清淀粉酶(amylase, AMS)Hofouaer评分、动脉血二氧化碳分压(PaCO2)、动脉血氧分压(PaO2)、炎症因子[肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)、白介素-6(interleukin-6, IL-6)]、mTOR/p70S6K信号通路蛋白[mTOR、p70S6K、p-p70S6K、p-mTOR、真核启动因子4E结合蛋白1(p-4E binding protein 1, 4EBP1)]水平.
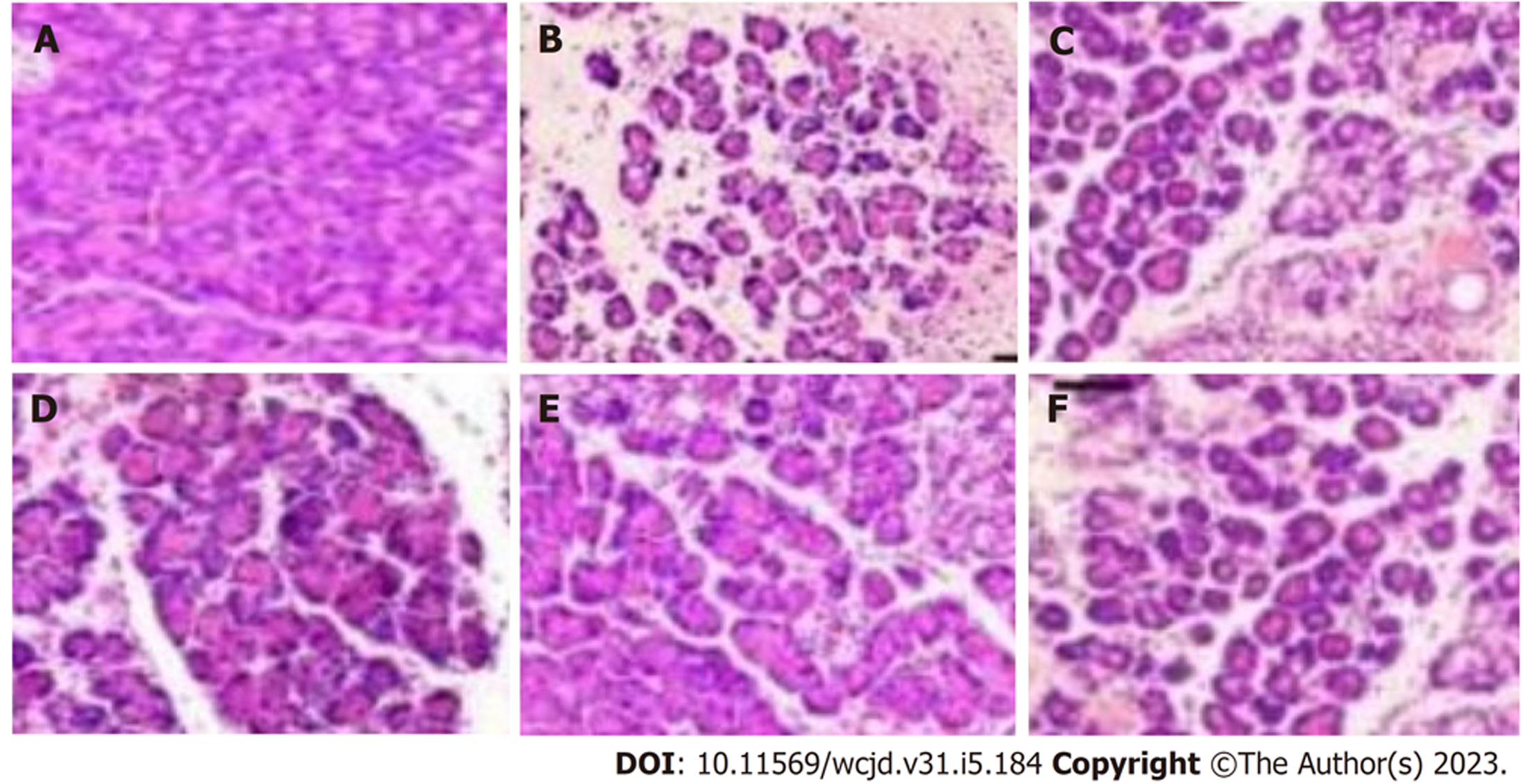
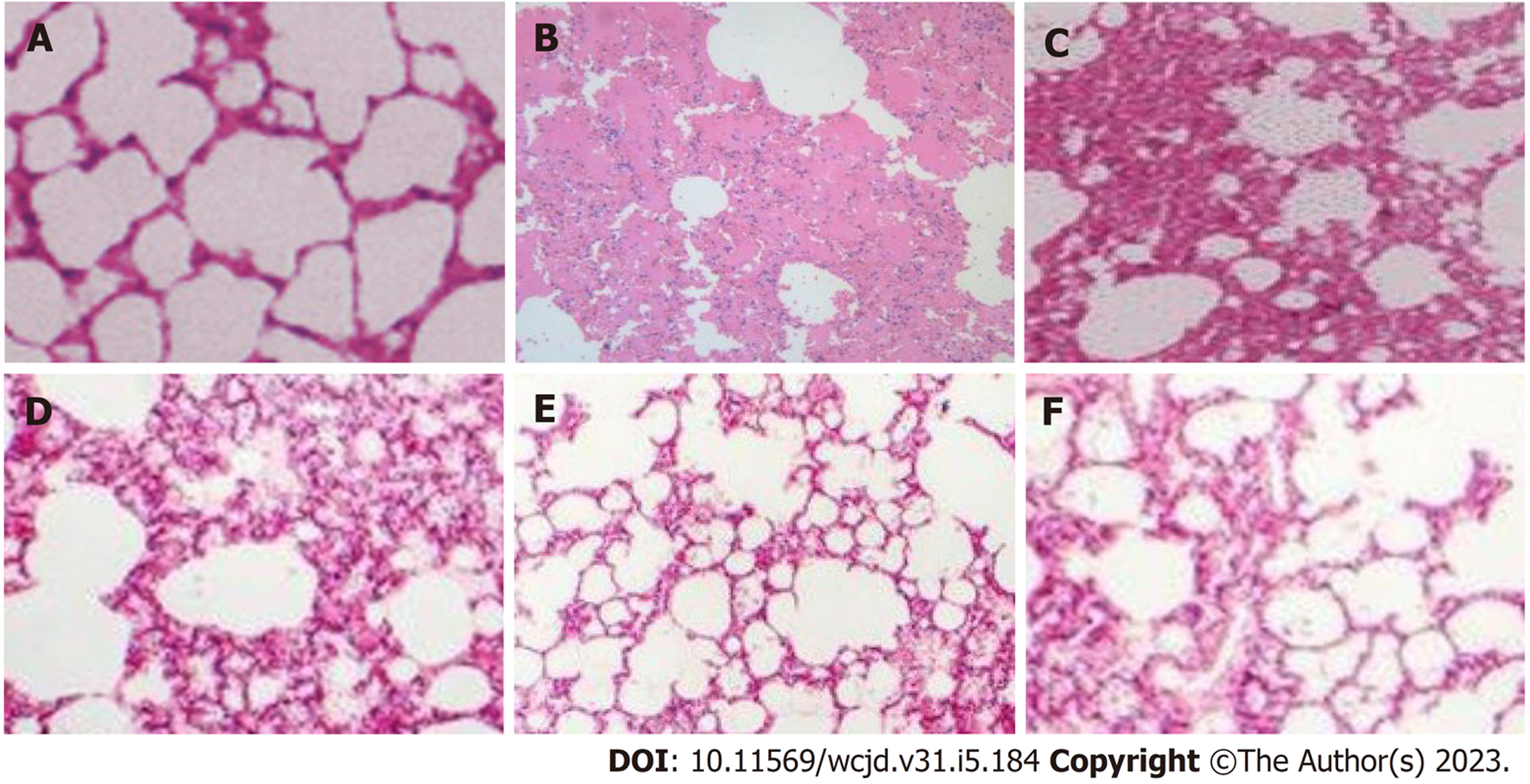
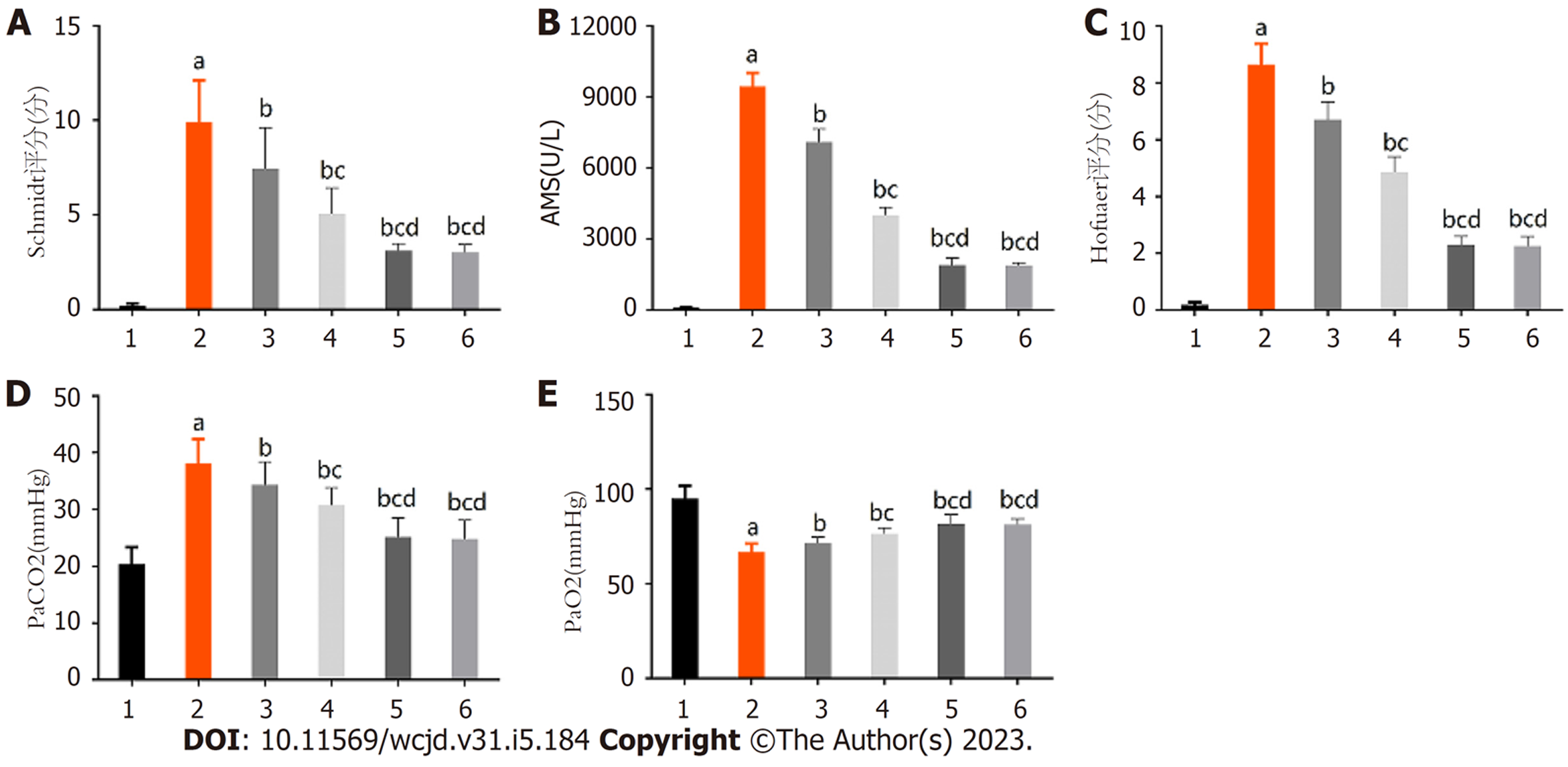
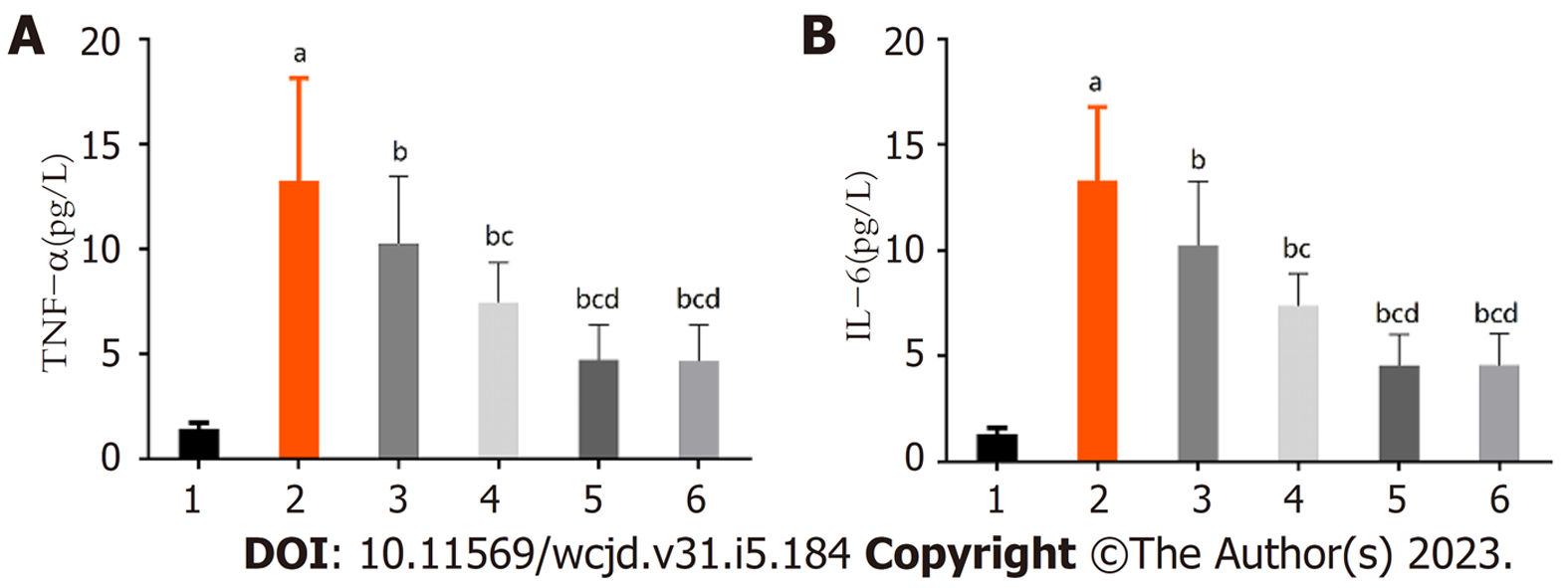
对照组胰腺、肺组织无异常变化; 模型组胰腺实质呈片状坏死、充血水肿, 胰腺腺泡细胞与间质细胞大量破坏, 小叶结构紊乱, 大量炎症细胞浸润与红细胞溢出, 肺泡结构排卵紊乱、间质水肿、炎性细胞浸润、肺泡间隔增宽、灶性或片状肺不张、出血; 低、中、高黄芪注射液组胰腺与模型组相比, 呈现出不同程度改善, 且随黄芪注射液剂量增加, 改善程度依次增加, 其中高黄芪注射液组与阳性对照组组织病理呈现出相似特征; 模型组Schmidt评分、AMS、Hofouaer评分PaCO2均高于对照组, PaO2均低于对照组(P<0.05); 低、中、高黄芪注射液组Schmidt评分、AMS、Hofouaer评分PaCO2依次降低, PaO2依次升高(P<0.05); 模型组TNF-α、IL-6高于对照组(P<0.05); 低、中、高黄芪注射液组TNF-α、IL-6依次降低(P<0.05); 模型组mTOR、p70S6K、p-p70S6K、p-mTOR、4EBP1高于对照组(P<0.05); 低、中、高黄芪注射液组mTOR、p70S6K、p-p70S6K、p-mTOR、4EBP1依次降低(P<0.05).
黄芪注射液可呈剂量依赖性改善AHNP血气指标、炎症反应、胰腺与肺组织病理状态, 其机制可能是通过调控mTOR/p70S6K信号通路实现的, 抑制mTOR/p70S6K信号通路可能为AHNP肺损伤的治疗提供了一个新思路.
核心提要: 本研究成功复制急性出血坏死型胰腺炎(acute hemorrhagic necrotic pancreatitis, AHNP)大鼠肺损伤模型, 探讨黄芪注射液减轻AHNP的肺损伤效果, 结果发现芪注射液能够减轻AHNP大鼠肺组织损伤, 抑制炎症, 抑制雷帕霉素靶蛋白/核糖体70S小亚基S6蛋白激酶信号通路激活.
引文著录: 洪春霞, 张照伟, 陈伟前. 黄芪注射液通过调控mTOR/p70S6K信号通路对急性出血坏死型胰腺炎肺损伤炎症反应的影响. 世界华人消化杂志 2023; 31(5): 184-192
Revised: February 9, 2023
Accepted: February 28, 2023
Published online: March 8, 2023
Acute hemorrhagic necrotic pancreatitis is a clinically common digestive system emergency. Lung injury is a common complication and cause of death. Astragalus injection can regulate endocrine balance, enhance immunity, inhibit virus, and exert anti-inflammatory and antioxidant effects. However, there has been no relevant study on Astragalus injection in lung injury caused by severe acute pancreatitis.
To analyze the effect of Astragalus injection on the inflammatory response in lung injury secondary to acute hemorrhagic necrotic pancreatitis (AHNP) with regard to regulating the target protein of rapamycin/ribosomal 70S small subunit S6 protein kinase (mTOR/p70S6K).
Forty-eight adult SD rats were randomly divided into a control group, a model group, low, medium, and high dosage Astragalus injection groups, and a positive control group, with 8 rats in each group. The histopathological changes of pancreas and lung tissues were recorded. Schmidt score, serum amylase (AMS), Hofouaer score, arterial blood carbon dioxide partial pressure (PaCO2), arterial oxygen partial pressure (PaO2), inflammatory factors [tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6)], and mTOR/p70S6K signaling pathway protein (mTOR, p70S6K, p-p70S6K, p-mTOR, and 4EBP1) levels were assessed.
There were no abnormal changes in the pancreas and lung tissues in the control group. The pancreatic parenchyma of mice in the model group showed flaky necrosis, congestion, and edema, massive destruction of pancreatic acinar cells and interstitial cells, disordered lobular structure, infiltration of inflammatory cells and red blood cell overflow, and disordered alveolar structure, interstitial edema, inflammatory cell infiltration, alveolar septum widening, focal or flaky atelectasis, and hemorrhage. Compared with the model group, the low, medium, and high dosage Astragalus injection groups showed different degrees of improvement in a dose dependent manner. The histopathology of the high dosage Astragalus injection group and the positive control group showed similar characteristics. The Schmidt score, AMS, Hofouaer score, and PaCO2 in the model group were higher than those in the control group, and PaO2 was lower than that of the control group (P < 0.05). Schmidt score, AMS, Hofouaer score, and PaCO2 decreased, and PaO2 increased in the low, medium, and high dosage Astragalus injection groups compared with the model group (P < 0.05). TNF-α and IL-6 in the model group were higher than those of the control group (P < 0.05); TNF-α and IL-6 decreased in the low, medium, and high dosage Astragalus injection groups compared with the model group (P < 0.05). mTOR, p70S6K, p-p70S6K, p-mTOR, and 4EBP1 were higher in the model group than in the control group (P < 0.05), while the low, medium, high dosage Astragalus injection groups had lower mTOR, p70S6K, p-p70S6K, p-mTOR, and 4EBP1 than the model group (P < 0.05).
Astragalus injection can improve blood gas indexes, inflammatory response, pancreas and lung pathological state in AHNP in a dose dependent manner. Such effects may be achieved by regulating the mTOR/p70S6K signaling pathway, and inhibiting the mTOR/p70S6K signaling pathway may provides a new idea for the treatment of lung injury in AHNP.
- Citation: Hong CX, Zhang ZW, Chen WQ. Astragalus injection improves inflammatory response in lung injury in acute hemorrhagic necrotizing pancreatitis by regulating the mTOR/p70S6K signal pathway. Shijie Huaren Xiaohua Zazhi 2023; 31(5): 184-192
- URL: https://www.wjgnet.com/1009-3079/full/v31/i5/184.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i5.184
急性出血坏死型胰腺炎(acute hemorrhagic necrotic pancreatitis, AHNP)是消化内科常见危急重症之一, 其主要以胰腺组织水肿, 脂肪、胰腺腺泡、血管大片坏死, 网膜、系膜组织被消化等病理表现为特征, 病情笃重, 且发展急剧, 并发症多, 死亡率较高, 严重威胁患者生命[1]. 研究指出, 肺损伤是AHNP常见且严重的并发症, 可导致患者发生急性呼吸窘迫综合征、多器官功能衰竭, 增加患者病死的风险, 多被用于评估AHNP病情的严重程度临床指标[2]. 目前, AHNP急性肺损伤的发病机制尚未完全阐明. 雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是一种丝氨酸/苏氨酸激酶, 具有促进物质代谢、参与细胞凋亡、自噬等作用, 在多种疾病中扮演着不可忽视的角色[3]. 核糖体70S小亚基S6蛋白激酶(ribosome 70S small subunit S6 protein kinase, p70S6K)是mTOR的下游底物, 系核糖体蛋白激酶, 与细胞生长、增殖有关[4]. 在以往研究中已证实mTOR/p70S6K信号通路与脑损伤后炎症反应、氧化应激性肺损伤纤维化有关, 但对AHNP肺损伤炎症反应的影响尚不明确[5]. 黄芪注射液由中药黄芪制成, 可益气养元, 扶正祛邪, 健脾利湿. 本研究选取48只SD大鼠, 从mTOR/p70S6K信号通路出发, 分析黄芪注射液对AHNP肺损伤炎症反应的影响, 报告如下.
1.1.1 实验动物: 48只成年SD大鼠, 体质量(220-250) g, 由成都达硕提供, 许可证号为SCXK(川)2013-24, 试验前进行一周适应性饲养, 分笼饲养, 给予规律光照(12 h: 12 h), 温度22 ℃, 自由饮食, 饲料由成都达硕提供.
1.1.2 主要仪器、试剂: 电热恒温水浴箱(广东汕头广播仪器厂); 低温高速离心机(美国Begman公司); 酶标仪(日本Bio-Rad); 石蜡切片机(德国LEICA公司); 贝克曼CX9全自动生化分析仪(美国Begman公司); 动脉血气分析仪(美国Begman公司); 光学纤维镜(日本OLMPUS公司); 3.5%牛黄胆酸钠(美国sigma公司); 戊巴比妥钠(上海信裕生物科技有限公司); 黄芪注射液(江苏九旭药业有限公司, 国药准字Z19993151, 10 mL/支); 淀粉酶(AMS)试剂盒(上海抚生); TMB底物显色试剂盒(百奥莱博); mTOR抗体(美国Abcam公司); p70S6K抗体(武汉友联特生物技术有限公司); p-p70S6K抗体(上海宝曼生物科技有限公司); p-mTOR抗体(北京博奥森生物技术有限公司); 4EBP1抗体(深圳市豪地华拓生物科技有限公司); β-action内参抗体(北京中杉金桥生物); 考马斯亮蓝总蛋白定量试剂盒(南京建成生物工程研究所); 辣根酶标记山羊抗兔二抗(北京中杉金桥生物).
1.2.1 AHNP造模[6]: 造模前禁食12 h, 不禁水. 戊巴比妥钠腹腔注射麻醉, 固定四肢, 腹壁沿正中线切开4 cm左右, 经十二指肠降部肠壁位置用聚四氟乙烯导管通过壶腹部乳头逆行穿刺, 至胰胆管后推进5 mm, 流出胆汁、胰液后, 结扎壶腹部乳头开口位置, 用小动脉夹夹闭胆总管上段. 胰胆管穿刺完成后, 3.5%牛黄胆酸按1 mL/kg在微量泵恒压下匀速注射, 见胰腺组织出现肉眼可见的肿胀、出血视为造模成功, 撤出动脉夹, 明确无胆汁外漏、胰胆管通畅, 逐层关腹.
1.2.2 动物分组: 48只成年SD大鼠简单随机化分为对照组、模型组、低、中、高黄芪注射液组、阳性对照组, 各8只. 对照组正常饲养, 不给予任何处理; 模型组按照AHNP造模方法造模; 依据文献[7]报道的黄芪注射液的成人用量, 参照"人和动物间按体表面积折算的等效剂量比值表"进行计算, 得到黄芪注射液的大鼠给药剂量, 其中, 低、中、高黄芪注射液组在AHNP造模后在造模前12 h、24 h、造模后即刻、造模后12 h及24 h分别给予(0.10、0.15、0.20) mL/(100 g·d)黄芪注射液经尾静脉注射; 阳性对照组在造模后给予腹腔置管引流, 经大鼠右侧下腹开一小孔, 留置十字形腹腔引流管于腹腔, 腹腔内长度控制在3 cm左右, 牢固固定后关腹. 为防止大鼠啃咬引流管, 应用适当粗细的弹簧管套住引流管, 接引流袋.
各组在完成处理后6 h, 以脱颈椎法处死大鼠, 腹部胸部剪毛, 打开腹腔、胸腔, 取胰腺组织、左肺组织, 剪成合适大小, 分装在EP管中, 编号后液氮冷冻, 保存于-80 ℃下. 取适量组织标本, 乙醇梯度脱水, 透明, 石蜡包埋、切片, HE染色, 400倍光镜下观察组织病理变化. 采用改良schmidt、Hofouaer评分标准[8]分别对胰腺、肺组织进行组织病理学评价, 其中胰腺组织包括坏死(坏死面积>30%、21%-30%、11%-20%、1%-10%、无坏死依次取4、3、2、1、0分)、水肿(细胞间隙增宽、小叶结构完全破坏; 小叶结构受破坏、腺泡间隙增宽; 小叶结构欠完整、腺泡轻度分离、叶间隙增宽明显; 轻度也间隙增宽、结构完整、无水肿依次取4、3、2、1、0分)、炎症(出现微脓肿或>30分、21-30个、11-20个、2-10个、0-1个依次取4、3、2、1、0分), 病理学评分取各项之和; 肺组织包括炎症浸润(大部分肺泡和间质有中性粒细胞集成团, 显著的单核细胞浸润; 间质及肺泡腔有较多的中性粒细胞及中等量的单核细胞浸润; 间质少量中性粒细胞, 单核细胞浸润; 无中性粒细胞、单核细胞浸润依次取3、2、1、0分)、水肿(间质和肺泡广泛性水肿、重度肺泡壁水肿、轻度肺泡壁水肿、无水肿依次取3、2、1、0分)、组织出血(肺泡腔出血范围>50%、出血范围25%-50%、间质及肺泡腔出血范围<25%、未见明显出血依次取3、2、1、0分), 病理学评分取各项之和.
各组在完成处理后6 h, 麻醉后, 迅速从左心室采血, 肝素抗凝, 采用血气分析仪测定动脉血二氧化碳分压(PaCO2)、动脉血氧分压(PaO2), 并采用酶联免疫吸附法检测血清淀粉酶(AMS)水平.
制作肺组织标本蛋白匀浆, 设标准8孔, 分别加入标准稀释液100 μL, 其余样品孔每孔加入待测样品100 μL, 37 ℃孵育90 min, 洗涤, 除零孔外, 每孔加50 μL一抗, 37 ℃孵育60 min, 加入TMB显色剂, 37 ℃避光显色15 min, 加入一滴终止液, 于酶标仪上450波长位置读取OD值, 记录肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)、白介素-6(interleukin-6, IL-6)水平.
制作肺组织标本蛋白匀浆, 按蛋白提取液30 μg, 等量上样于10% SDS-PAGE胶, 电泳, 砖模, 脱色摇床摇动封闭2 h, mTOR抗体、p70S6K抗体、p-p70S6K抗体、p-mTOR抗体、4EBP1抗体稀释浓度均为1:500, β-action内参抗体稀释浓度为1:1000, 加入抗体4 ℃孵育过夜, 加入辣根酶标记山羊抗兔二抗常温孵育2 h, 洗膜, 曝光, 洗片, 以Bio-Rad凝胶摄像分析系统扫描, 用Image J定量分析蛋白条带.
统计学处理 采用SPSS 22.0统计学软件处理数据, 计量资料以(mean±SD)表示, 多组间比较以单因素方差进行分析, 两两比较以LSD-t检验. P<0.05为差异有统计学意义.
对照组胰腺组织及肺组织未见异常. 模型组胰腺实质呈片状坏死、充血水肿, 胰腺腺泡细胞与间质细胞大量破坏, 小叶结构紊乱, 大量炎症细胞浸润与红细胞溢出, 肺组织也出现炎性损伤, 肺泡结构排卵紊乱、间质水肿、炎性细胞浸润、肺泡间隔增宽、灶性或片状肺不张、出血; 低、中、高黄芪注射液组胰腺及肺组织与模型组相比均呈现出不同程度改善, 且呈剂量依赖性. 见图1和图2.
各组Schmidt评分、AMS、Hofouaer评分、PaCO2、PaO2比较差异具有统计学意义(P<0.05); 模型组Schmidt评分、AMS、Hofouaer评分、PaCO2均高于对照组, PaO2均低于对照组(P<0.05); 低、中、高黄芪注射液组Schmidt评分、AMS、Hofouaer评分、PaCO2依次降低, PaO2依次升高(P<0.05); 高黄芪注射液组Schmidt评分、AMS、Hofouaer评分、PaCO2、PaO2与阳性对照组相比, 差异无统计学意义. 见图3.
各组TNF-α、IL-6比较差异具有统计学意义(P<0.05); 模型组TNF-α、IL-6高于对照组(P<0.05); 低、中、高黄芪注射液组TNF-α、IL-6依次降低(P<0.05); 高黄芪注射液组TNF-α、IL-6与阳性对照组比较差异无统计学意义. 见图4.
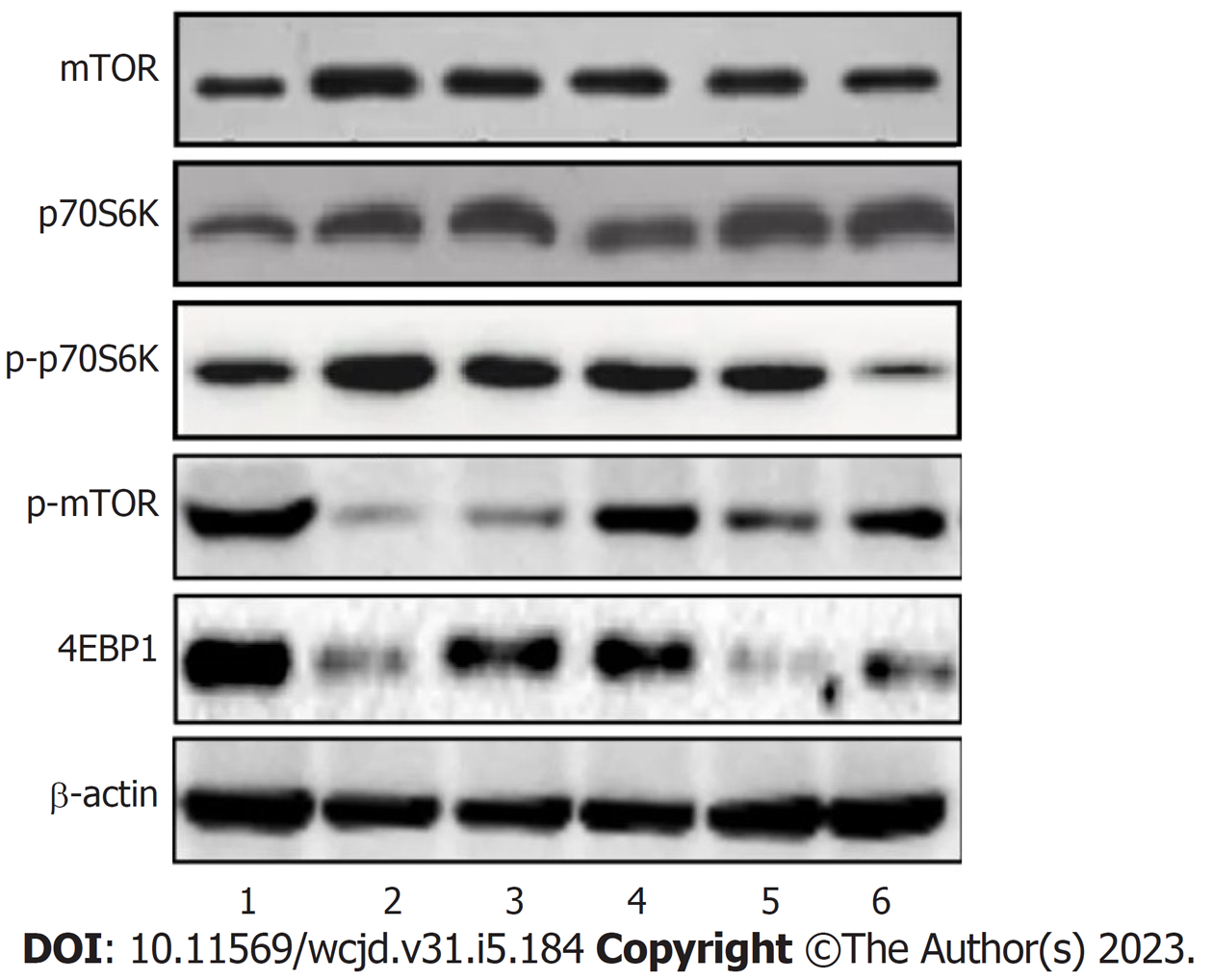
各组mTOR、p70S6K、p-p70S6K、p-mTOR、4EBP1比较差异具有统计学意义(P<0.05); 模型组mTOR、p70S6K、p-p70S6K、p-mTOR、4EBP1高于对照组(P<0.05); 低、中、高黄芪注射液组mTOR、p70S6K、p-p70S6K、p-mTOR、4EBP1依次降低(P<0.05); 高黄芪注射液组mTOR、p70S6K、p-p70S6K、p-mTOR、4EBP1与阳性对照组相比, 差异无统计学意义. 见图5, 表1.
| 组别 | 数量(只) | mTOR | p70S6K | p-p70S6K | p-mTOR | 4EBP1 |
| 对照组 | 8 | 0.30±0.08 | 0.31±0.06 | 0.11±0.02 | 0.20±0.04 | 0.19±0.02 |
| 模型组 | 8 | 0.89±0.15 | 0.85±0.14 | 0.54±0.10 | 0.73±0.18 | 0.71±0.13 |
| 低黄芪注射液组 | 8 | 0.76±0.13 | 0.69±0.13 | 0.45±0.12 | 0.58±0.15 | 0.59±0.14 |
| 中黄芪注射液组 | 8 | 0.63±0.12 | 0.57±0.12 | 0.36±0.11 | 0.46±0.12 | 0.47±0.12 |
| 高黄芪注射液组 | 8 | 0.49±0.14 | 0.45±0.11 | 0.22±0.05 | 0.34±0.06 | 0.35±0.11 |
| 阳性对照组 | 8 | 0.48±0.12 | 0.44±0.10 | 0.21±0.06 | 0.33±0.05 | 0.35±0.12 |
| F | 23.102 | 23.772 | 29.682 | 22.915 | 21.586 | |
| P | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
AHNP不仅可造成胰腺组织广泛性出血坏死, 亦可在早期出现严重反应综合征, 引起肝、心、肺等多器官功能不全[9]. 既往资料显示, 受解剖、低压循环生理特征、肺组织巨噬细胞广泛分布的影响, 约30% AHNP患者病情会进展至肺损伤, 而近65%死亡患者的死因与肺损伤有关[10]. 因此, 研究治疗AHNP肺损伤炎症反应具有重要临床意义.
中医学中AHNP属于"腹痛"、"脾心痛"等范畴. 《三因极一病证方论》曾记载"脾心痛者, 如针刺其心腹, 蕴蕴然气满". 中医认为, AHNP病机主要是由于各种因素导致脾气虚弱, 不能运化水湿, 湿热内生, 或外感湿热之邪, 湿热阻于中焦、气血运行失常所致. AHNP发病初期多以湿热、气滞为主, 湿热下侵, 火盛气逆, 热结血癖, 可导致血虚气馁, 气虚不摄, 随着病情进展可逐渐演变为气虚、阳虚、阴虚为主的病机, 故应顾护正气, 防邪扶正. 黄芪在中医学中为大补元气之药, 具有健脾利湿、扶正除邪、益气养元的功效. 现代医学认为, 黄芪注射液含有黄酮、皂甙类等成分, 可调节内分泌、增强免疫力、抑制病毒、抗炎、抗氧化应激等, 有临床研究显示, 黄芪注射液在急性水肿型胰腺炎的治疗中有显著辅助作用[11,12].
本研究采用黄芪注射液治疗AHNP肺损伤大鼠, 结果显示对照组胰腺、肺组织无异常变化, 而模型组胰腺实质呈片状坏死、充血水肿, 胰腺腺泡细胞与间质细胞大量破坏, 小叶结构紊乱, 大量炎症细胞浸润与红细胞溢出, 肺泡结构排卵紊乱、间质水肿、炎性细胞浸润、肺泡间隔增宽、灶性或片状肺不张、出血, 说明造模成功. 且低、中、高黄芪注射液组胰腺、肺组织病理表现与模型组相比, 呈现出剂量依赖性改善效果, Schmidt评分、AMS、Hofouaer评分、PaCO2依次降低, PaO2依次升高, 提示黄芪注射液可改善AHNP胰腺与肺组织病理状态、血气指标. 同时本研究设置阳性对照组, 其采用的腹腔引流术在以往动物学实验及临床研究中, 均证实可有效控制AHNP病情, 缓解肺损伤[14,15]. 而高黄芪注射液组与阳性对照组在胰腺及肺组织病理表现、Schmidt评分、AMS、Hofouaer评分PaCO2、PaO2上, 均呈现出相似的变化特征, 再次佐证了黄芪注射液对AHNP肺损伤病情的改善作用, 这可为临床保守性干预AHNP肺损伤提供参考.
研究发现, TNF-α在AHNP发病早期即可升高, 并在病程中发挥核心作用, 与AHNP严重程度密切相关[16,17], 可用于评估AHNP患者的预后[18]. 杨晴等[19]报道指出, 与病死患者相比, 存活患者血清TNF-α水平升高更为明显, 达峰时间更长. 动物学实验表明, TNF-α能通过介导c-Jun氨基末端激酶信号通路导致肺损伤[20]. 且TNF-α可促进IL-6等合成释放, 直接和间接参与炎症瀑布样级联反应. 可见TNF-α、IL-6不仅与AHNP病情有关, 还与肺炎症反应有关. 本研究发现, 模型组TNF-α、IL-6高于对照组, 但经低、中、高黄芪注射液干预后, TNF-α、IL-6依次降低(P<0.05), 说明黄芪注射液能改善AHNP肺损伤炎症反应.
由以上分析可知, 黄芪注射液能缓解AHNP肺损伤炎症反应, 但关于其机制尚未明确, 故本研究尝试对此进行探讨. mTOR属于磷酸肌醇激酶相关蛋白激酶家族, mTOR信号通路是细胞内多种重要信号传导通路的枢纽[21]. 黄洋峰等[22]通过建立AHNP大鼠模型发现, p-mTOR/p70S6K通路活性降低可抑制AHNP大鼠胰腺细胞增殖分化, 减少了炎症因子的释放, 可见mTOR信号通路可调控炎症反应. Wang等[23]研究指出, mTOR、4EBP1在哮喘小鼠肺组织中表达明显高于健康小鼠, 而经mTOR抑制剂干预后mTOR、4EBP1水平明显降低. 且以往报道证实[24], 阻断mTOR信号通路后, p70S6K、p-p70S6K、p-mTOR、4EBP1水平均表现为降低, 且肺受损细胞由正常或接近正常的肺泡所替代, 可见mTOR能特异性调控p70S6K、p-p70S6K、p-mTOR、4EBP1表达, 并对肺受损产生影响. 本研究发现, 模型组mTOR、p70S6K、p-p70S6K、p-mTOR、4EBP1高于对照组, 提示在AHNP肺损伤炎症反应过程中, mTOR/p70S6K信号通路相关蛋白表达升高, 该通路可能参与了AHNP肺损伤炎症的病理进程. 而给予干预后低、中、高黄芪注射液组mTOR、p70S6K、p-p70S6K、p-mTOR、4EBP1依次降低, 提示黄芪注射液能抑制mTOR/p70S6K信号通路表达. 且由以上分析可知, 低、中、高黄芪注射液组肺损伤炎症反应呈现不同程度的改善, 可推出黄芪注射液对肺损伤炎症反应的改善机制可能是通过调控mTOR/p70S6K信号通路实现的. 另一方面, 抑制mTOR/p70S6K信号通路可能为AHNP肺损伤的治疗提供了一个新思路. 值得注意的是, 高黄芪注射液组TNF-α、IL-6、mTOR/p70S6K信号通路等的改善均与对照组存在显著差异, 可见肺损伤炎症反应不能完全通过黄芪注射液完全逆转, 仍需依赖其他干预手段, 本研究不足之处即在于此, 未对黄芪注射液合适的配伍方案进行探讨, 仍有待于后续的动物学试验及临床研究持续分析.
综上所述, 黄芪注射液可呈剂量依赖性改善AHNP血气指标、炎症反应、胰腺与肺组织病理状态, 其机制可能是通过调控mTOR/p70S6K信号通路实现的, 抑制mTOR/p70S6K信号通路可能为AHNP肺损伤的治疗提供了一个新思路.
急性胰腺炎导致的肺损伤常导致病情加重, 危及患者生命. 减轻肺组织损伤, 可加速患者康复. 黄芪注射液对急性胰腺炎有治疗效果, 可减轻其急性出血坏死型胰腺炎(acute hemorrhagic necrotic pancreatitis, AHNP)大鼠肺组织损伤程度降低.
本研究试图探讨黄芪注射液对AHNP大鼠肺组织损伤的改善作用及对雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)/核糖体70S小亚基S6蛋白激酶(ribosome 70S small subunit S6 protein kinase, p70S6K)信号通路的影响, 旨在为重症胰腺炎肺损伤患者的更有效治疗提供有效的药物治疗.
本研究旨在通过建立AHNP大鼠肺组织损伤模型, 观察不同剂量黄芪注射液对肺损伤的改善作用, 并分析其对mTOR/p70S6K信号通路相关蛋白的影响.
本研究成功建立AHNP大鼠肺组织损伤模型, 并给予(0.10、0.15、0.20) mL/(100 g·d)黄芪注射液治疗, 观察大鼠胰腺及肺组织病理损伤情况, 血清AMS、Hofouaer评分、PaCO2、PaO2、肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)、白介素-6(interleukin-6, IL-6)、mTOR/p70S6K信号通路蛋白[mTOR、p70S6K、p-p70S6K、p-mTOR、真核启动因子4E结合蛋白1(p-4E binding protein 1, 4EBP1)]水平.
给予黄芪注射液治疗后, 大鼠血清中的Schmidt评分、AMS、Hofouaer评分、PaCO2依次降低, PaO2依次升高; TNF-α、IL-6依次降低; mTOR、p70S6K、p-p70S6K、p-mTOR、4EBP1依次降低.
黄芪注射液可呈剂量依赖性改善AHNP血气指标、炎症反应、胰腺与肺组织病理状态, 其机制可能是通过调控mTOR/p70S6K信号通路实现的.
只是动物实验的角度对机制进行了研究, 到临床上的研究和应用还有一段距离, 还需进一步研究黄芪注射液对肺组织损伤的具体作用机制, 并进一步往临床方向进行相关研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Harris TJ, Beck WC, Bhavaraju A, Davis B, Kimbrough MK, Jensen JC, Privratsky A, Taylor JR, Sexton KW. Severe acute gallstone pancreatitis with diffuse hemorrhagic gastritis. J Surg Case Rep. 2018;2018:rjy048. [PubMed] [DOI] |
| 3. | Pan S, Lin H, Luo H, Gao F, Meng L, Zhou C, Jiang C, Guo Y, Ji Z, Chi J, Guo H. Folic acid inhibits dedifferentiation of PDGF-BB-induced vascular smooth muscle cells by suppressing mTOR/P70S6K signaling. Am J Transl Res. 2017;9:1307-1316. [PubMed] |
| 4. | Li SH, Chen CH, Lu HI, Huang WT, Tien WY, Lan YC, Lee CC, Chen YH, Huang HY, Chang AY, Lin WC. Phosphorylated p70S6K expression is an independent prognosticator for patients with esophageal squamous cell carcinoma. Surgery. 2015;157:570-580. [PubMed] [DOI] |
| 5. | 李 龙辉, 王 少华, 邹 冬梅, 郑 雪媚, 邓 健. 雷帕霉素靶蛋白在未成熟鼠氧化应激性肺损伤纤维化中的作用. 中华新生儿科杂志(中英文). 2017;32:220-225. [DOI] |
| 8. | de Oliveira Andrade R, Kunitake T, Koike MK, Machado MC, Souza HP. Effects of diazoxide in experimental acute necrotizing pancreatitis. Clinics (Sao Paulo). 2017;72:125-129. [PubMed] [DOI] |
| 9. | Jia D, Yamamoto M, Otsuki M. Effect of endogenous cholecystokinin on the course of acute pancreatitis in rats. World J Gastroenterol. 2015;21:7742-7753. [PubMed] [DOI] |
| 10. | Redechová S, Féderová L, Hammerová L, Filkászová A, Horváthová D, Redecha M. [Thrombotic microangiopathy in pregnancy complicated by acute hemorrhagic-necrotic pancreatitis during early puerperium]. Ceska Gynekol. 2014;79:190-192. [PubMed] |
| 11. | Zhou Y, Liao S, Zhang Z, Wang B, Wan L. Astragalus injection attenuates bleomycin-induced pulmonary fibrosis via down-regulating Jagged1/Notch1 in lungs. J Pharm Pharmacol. 2016;68:389-396. [PubMed] [DOI] |
| 12. | Shang XL, Tao HY, Chen SY, Li YX, Hua YH. Clinical and MRI outcomes of HA injection following arthroscopic microfracture for osteochondral lesions of the talus. Knee Surg Sports Traumatol Arthrosc. 2016;24:1243-1249. [PubMed] [DOI] |
| 15. | 邓 超, 曹 均强, 梁 鸿寅, 陈 光宇, 刘 卫辉, 汤 礼军, 戴 睿武. 早期腹腔置管引流对大鼠重症急性胰腺炎相关肠黏膜损伤的作用. 解放军医学杂志. 2016;41:119-122. [DOI] |
| 16. | 公 丕平, 孙 杰, 牛 春茂, 刘 昊刚, 任 凤玲, 解 现慈. 急性胰腺炎患者TNF-α基因多态性与病情严重程度及临床预后的相关性分析. 重庆医学. 2017;46:3858-3860. |
| 18. | Wang XY, Tang QQ, Zhang JL. Effect of SB203580 on pathologic change of pancreatic tissue and expression of TNF-α and IL-1β in rats with severe acute pancreatitis. Eur Rev Med Pharmacol Sci. 2014;18:338-343. [DOI] |
| 21. | Cao GD, Xu XY, Zhang JW, Chen B, Xiong MM. Phosphorylated Mammalian Target of Rapamycin p-mTOR Is a Favorable Prognostic Factor than mTOR in Gastric Cancer. PLoS One. 2016;11:e0168085. [PubMed] [DOI] |
| 23. | 王 莉, 张 艳丽, 王 秀芳, 宋 哲, 王 伟. mTOR/4EBP1/HIF-1α/VEGF信号通路在哮喘小鼠肺组织中的表达及意义. 中国当代儿科杂志. 2017;19:7. [DOI] |
| 24. | Chen LM, Song TJ, Xiao JH, Huang ZH, Li Y, Lin TY. Tripchlorolide induces autophagy in lung cancer cells by inhibiting the PI3K/AKT/mTOR pathway and improves cisplatin sensitivity in A549/DDP cells. Oncotarget. 2017;8:63911-63922. [PubMed] [DOI] |