修回日期: 2022-11-04
接受日期: 2023-01-17
在线出版日期: 2023-02-28
营养不良是脑卒中(cerebralvascular accident, CVA)患者预后不良的独立危险因素, 但单纯肠内营养支持难以保证营养物质的及时消化吸收, 而含益生菌肠内营养支持是改善胃肠道功能, 提高营养物质吸收的有效手段, 可用于脑卒中后吞咽障碍患者.
探讨CVA后吞咽障碍患者含益生菌肠内营养支持疗效.
选取2017-09/2020-10我院脑卒中后吞咽障碍患者106例, 以随机数字表法分为观察组(n = 53)、对照组(n = 53). 对照组采取常规肠内营养支持, 观察组采取含益生菌肠内营养支持, 均治疗2 wk. 比较两组治疗前、治疗1 wk、2 wk后营养参数[血红蛋白(hemoglobin, Hb)、白蛋白(albumin, ALB)、总蛋白(total protein, TP)]、免疫功能指标[外周血总淋巴计数(total lymphocyte count, TLC)与血清免疫球蛋白M(immunoglobulin M, IgM)、免疫球蛋白G(immunoglobulin G, IgG)、免疫球蛋白A(immunoglobulin A, IgA)]、美国国立卫生院神经功能缺损量表(national institutes of health neurological deficit scale, NIHSS)、急性生理学及慢性健康状况评分系统Ⅱ(acute physiology and chronic health scoring system Ⅱ, APACHEⅡ)评分、肠道屏障功能指标[二胺氧化酶(diamine oxidase, DAO)、D-乳酸(D-lactic acid, D-LA)]水平, 并统计胃肠道并发症发生情况、住院时间、住院费用.
观察组治疗1 wk、2 wk后外周血TLC与血清IgM、IgG、IgA、Hb、ALB、TP水平均高于对照组(P<0.05); 观察组治疗1 wk、2 wk后NIHSS、APACHEⅡ评分及血清DAO、D-LA水平均低于对照组(P<0.05); 观察组住院时间短于对照组, 胃肠道并发症发生率及住院费用低于对照组(P<0.05).
含益生菌肠内营养支持应用于脑卒中后吞咽障碍患者中, 可有效减少胃肠道并发症发生, 改善患者营养状态及免疫功能, 促进肠道屏障功能恢复, 缩短康复进程, 且医疗费用较低, 值得临床推广与应用.
核心提要: 本文基于营养、免疫、肠道屏障功能等探究含益生菌肠内营养支持对脑卒中后吞咽障碍患者予的疗效, 结果发现含益生菌肠内营养支持应用于脑卒中后吞咽障碍患者中, 疗效显著, 且医疗费用较低.
引文著录: 沈敏瑾, 胡春晓, 卢翀. 脑卒中后吞咽障碍患者行含益生菌肠内营养支持的疗效观察. 世界华人消化杂志 2023; 31(4): 150-156
Revised: November 4, 2022
Accepted: January 17, 2023
Published online: February 28, 2023
Malnutrition is an independent risk factor for poor prognosis of cerebralvascular accident (CVA) patients, but it is difficult to ensure timely digestion and absorption of nutrients by simple enteral nutrition support, while enteral nutrition support with probiotics is an effective means to improve gastrointestinal function and nutrient absorption, which can be used for patients with dysphagia after stroke.
To evaluate the efficacy of enteral nutrition support containing probiotics in patients with swallowing disorders after CVA (stroke).
A total of 106 patients with dysphagia after stroke treated at our hospital from September 2017 to October 2020 were selected and divided into either an observation group (n = 53) or a control group (n = 53) by the random number table method. The control group received routine enteral nutrition support, and the observation group received enteral nutrition support with probiotics. Both groups were treated for 2 wk. Nutritional parameters [hemoglobin (Hb), albumin (ALB), and total protein (TP)], immune function indexes [total lymphocyte count (TLC) in peripheral blood and serum immunoglobulin (Ig)M, IgG, and IgA], National Institute of Health stroke scale (NIHSS) score, acute physiology and chronic health evaluation Ⅱ (APACHE Ⅱ) score, and intestinal barrier function indexes [diamine oxidase (DAO) and D-lactic acid (D-LA)] before treatment and at 1 wk and 2 wk after treatment were compared between the two groups. The occurrence of gastrointestinal complications, hospital stay, and hospital expenses were recorded.
The levels of peripheral blood TLC and serum IgM, IgG, IgA, Hb, ALB, and TP in the observation group were significantly higher than those in the control group after 1 and 2 wk of treatment (P < 0.05). NIHSS score, APACHEⅡ score, and serum DAO and D-LA levels in the observation group were significantly lower than those in the control group after 1 and 2 wk of treatment (P < 0.05). The length of hospital stay in the observation group was shorter than that in the control group, and the incidence of gastrointestinal complications and hospitalization expenses were lower than those in the control group (P < 0.05).
The application of enteral nutrition support with probiotics in patients with dysphagia after stroke can effectively reduce the occurrence of gastrointestinal complications and improve the nutritional status and immune function of patients, promote the recovery of intestinal barrier function, shorten the rehabilitation process, and has low medical costs.
- Citation: Shen MJ, Hu CX, Lu C. Efficacy of enteral nutrition support with probiotics in patients with swallowing disorders after cerebralvascular accident. Shijie Huaren Xiaohua Zazhi 2023; 31(4): 150-156
- URL: https://www.wjgnet.com/1009-3079/full/v31/i4/150.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i4.150
吞咽障碍为脑卒中后常见症状及后遗症, 发病率高达30%以上, 多因两侧皮质脊髓束损伤后, 延髓支配肌肉瘫痪无力所致, 主要表现为进食呛咳、咀嚼无力、吞咽困难等, 极易引起营养不良、内环境紊乱等并发症, 严重影响患者预后[1-3]. 研究指出, 营养不良是脑卒中患者预后不良的独立危险因素[4]. 肠内营养支持作为吞咽障碍的一种替代措施, 可明显改善患者进食状况, 帮助改善机体营养状态及免疫功能, 减少或避免并发症发生, 有助于改善预后[5,6]. 但单纯肠内营养支持无法平衡脑卒中后吞咽障碍患者能量汲取及消耗, 导致胃肠道负担加重, 难以保证营养物质的及时消化吸收[7,8]. 有学者认为, 含益生菌肠内营养支持是改善胃肠道功能, 提高营养物质吸收的有效手段, 可用于脑卒中后吞咽障碍患者[9]. 基于此, 本研究对脑卒中后吞咽障碍患者予以含益生菌肠内营养支持, 效果颇佳. 现报告如下.
选取2017-09/2020-10我院脑卒中后吞咽障碍患者106例作为研究对象, 纳入标准: (1)均经颅脑CT或MRI等影像学检查证实有脑出血或脑梗死, 且合并吞咽障碍; (2)洼田饮水试验≥3级; (3)生命体征稳定, 且患者或其家属自愿签署本研究知情同意书; 排除标准: (1)伴有影响吞咽功能的其他疾病者; (2)合并心、肝、肾等重要器官功能障碍者; (3)频繁呕吐、腹泻或胃肠道出血者; (4)过敏体质, 或对营养制剂过敏者; (5)颅脑或其他部位恶性肿瘤者. 以随机数字表法分为观察组(n = 53)、对照组(n = 53). 两组年龄、性别、体质量指数、卒中类型及吞咽功能分级等资料均衡可比(P>0.05). 见表1.
| 组别 | 观察组(n = 53) | 对照组(n = 53) | Z/t/χ2 | P |
| 性别(男/女) | 32/21 | 35/18 | 0.365 | 0.546 |
| 年龄(岁) | 47-78(61.98±7.76) | 45-81(63.05±9.02) | 0.655 | 0.514 |
| 体质量指数(kg/m2) | 18-26(22.14±2.06) | 18-28(23.07±2.71) | 1.989 | 0.049 |
| 卒中类型 | 0.716 | 0.397 | ||
| 脑出血 | 18(33.96) | 14(26.42) | ||
| 脑梗死 | 35(66.04) | 39(73.58) | ||
| 吞咽功能分级 | 0.098 | 0.922 | ||
| 3级 | 15(28.30) | 14(26.42) | ||
| 4级 | 30(56.60) | 33(62.26) | ||
| 5级 | 8(15.09) | 6(11.32) |
两组均予以降颅压、营养神经、抗感染、维持水电解质及酸碱平衡等基础治疗; 于此基础上, 对照组采取常规肠内营养支持, 经鼻饲管注入肠内营养乳剂(Fresenius KabiDeutschland GmbH, 国药准字J20090096), 喂养方式均按125 KJ/(kg·d), 初始剂量为目标量的1/4, 之后每日以1/4逐渐递增至全量, 肠内营养支持初期以适量静脉营养补充热量不足部分; 观察组采取含益生菌肠内营养支持, 益生菌(双歧杆菌乳杆菌三联活菌片, 内蒙古双奇药业股份有限公司, 国药准字S19980004), 3片/次, 1次/d, 将益生菌研磨成为药粉后, 将药粉加入肠内营养液中经胃管缓慢注入. 均治疗2 wk.
统计对比两组治疗前、治疗1 wk、2 wk后营养参数[血红蛋白(hemoglobin, Hb)、白蛋白(albumin, ALB)、总蛋白(total protein, TP)]、免疫功能指标[外周血总淋巴计数(total lymphocyte count, TLC)与血清免疫球蛋白M(immunoglobulin M, IgM)、免疫球蛋白G(immunoglobulin G, IgG)、免疫球蛋白A(immunoglobulin A, IgA)]、美国国立卫生院神经功能缺损量表(national institutes of health neurological deficit scale, NIHSS)、急性生理学及慢性健康状况评分系统Ⅱ(acute physiology and chronic health scoring system Ⅱ, APACHEⅡ)评分、肠道屏障功能指标[二胺氧化酶(diamine oxidase, DAO)、D-乳酸(D-lactic acid, D-LA)]水平, 并统计胃肠道并发症发生情况、住院时间、住院费用.
治疗前、治疗1 wk、2 wk后抽取5 mL肘静脉血, 采用全自动生化分析仪(日立7600-020型)检测血清Hb、ALB、TP水平, 结果由机器直接读出, 以评价营养状况; 以改良酶学分光光度法(Sigma公司)检测DAO、D-LA水平, 以评价肠道黏膜屏障实际功能; 以流式细胞仪(美国BD公司提供)测定外周血TLC, 采用MODULAR DPP型全自动生化分析仪及其配套免疫球蛋白试剂测定血清IgM、IgG、IgA水平, 以评价免疫功能.
治疗前、治疗1 wk、2 wk后以NIHSS评价神经功能缺损程度, 分值越高, 神经功能缺损越严重[10]; APACHEⅡ评价病情程度, 分值越高, 病情越严重[11].
统计学处理 SPSS 19.0分析, 计量资料用(mean±SD)表示平均数±标准差, t检验, 多组间比较采用重复测量方差, 计数资料用n(%)表示, χ2检验, 等级资料以秩和检验, P<0.05表示差异有统计学意义.
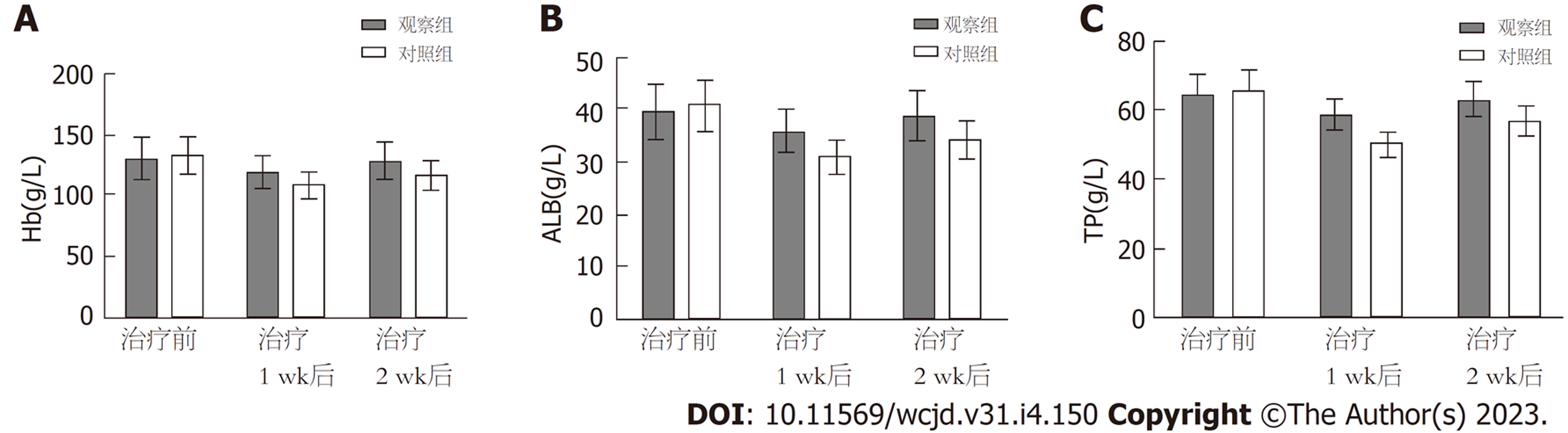
组间比较, 两组治疗前血清Hb、ALB、TP水平相比, 差异无统计学意义, 观察组治疗1 wk、2 wk后上述血清各指标水平均高于对照组(P<0.05); 组内比较, 观察组治疗1 wk、对照组治疗1 wk、2 wk后上述血清各指标水平均较本组治疗前降低(P<0.05), 观察组治疗2 wk后上述血清各指标水平与本组治疗前相比, 差异无统计学意义; 两组各指标组间、不同时间点、组间·不同时点间交互作用相比, 差异有统计学意义(P<0.05). 见图1.
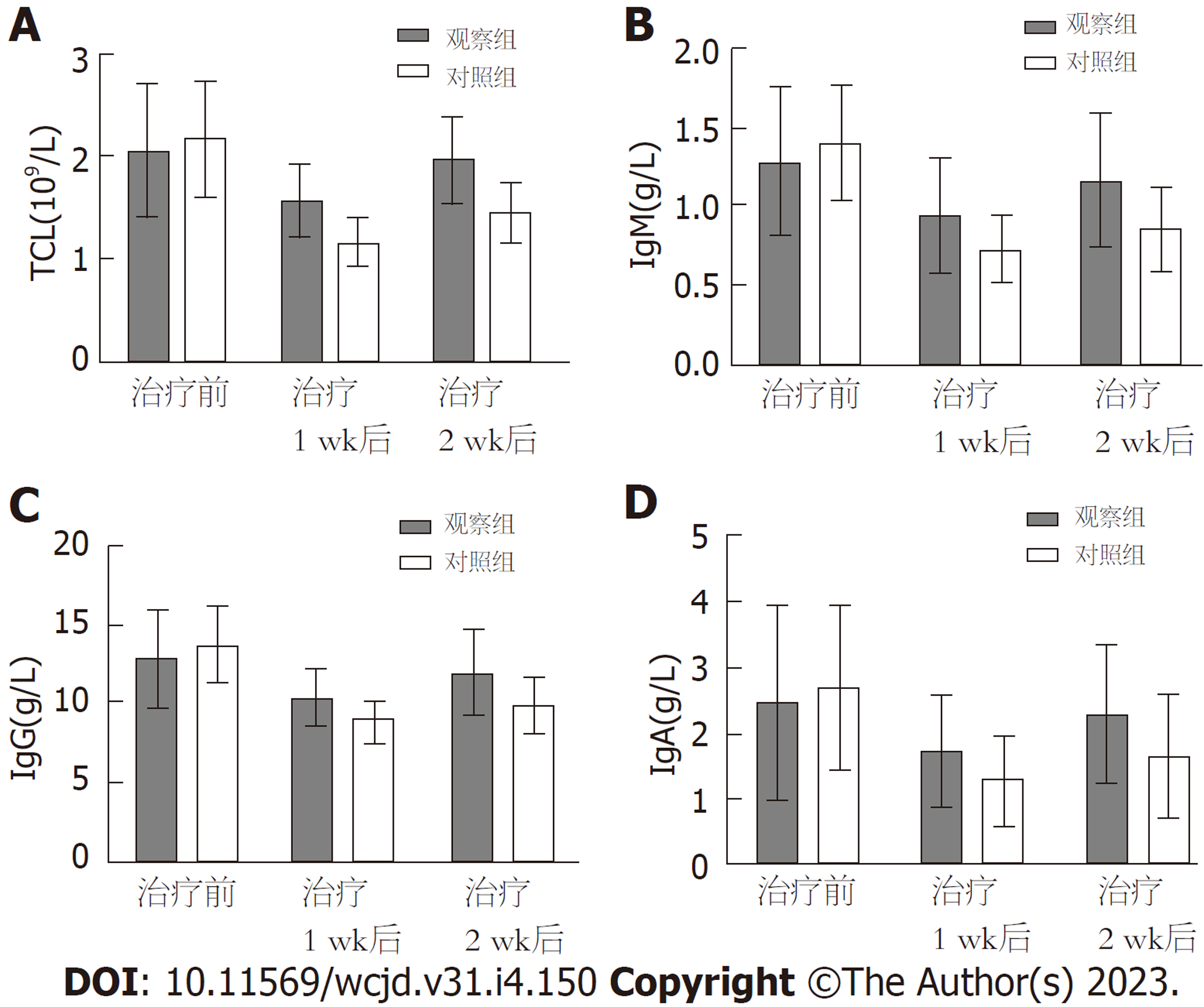
组间比较, 两组治疗前外周血TLC与血清IgM、IgG、IgA水平相比, 差异无统计学意义, 观察组治疗1 wk、2 wk后上述各指标水平均高于对照组(P<0.05); 组内比较, 观察组治疗1 wk、对照组治疗1 wk、2 wk后上述各指标水平均较本组治疗前降低(P<0.05), 观察组治疗2 wk后上述各指标水平与本组治疗前相比, 差异无统计学意义; 两组各指标组间、不同时间点、组间·不同时点间交互作用相比, 差异有统计学意义(P<0.05). 见图2.
组间比较, 两组治疗前NIHSS、APACHEⅡ评分相比, 差异无统计学意义, 观察组治疗1 wk、2 wk后上述评分均低于对照组(P<0.05); 组内比较, 两组治疗1 wk、2 wk后上述评分均较本组治疗前降低(P<0.05); 两组各指标组间、不同时间点、组间·不同时点间交互作用相比, 差异有统计学意义(P<0.05). 见表2.
| 组别 | 例数 | NIHSS评分 | APACHEⅡ评分 | ||||
| 治疗前 | 治疗1 wk后 | 治疗2 wk后 | 治疗前 | 治疗1 wk后 | 治疗2 wk后 | ||
| 观察组 | 53 | 19.24±3.47 | 12.07±2.36a | 10.48±2.09a | 15.92±3.47 | 11.43±2.26a | 9.49±1.83a |
| 对照组 | 53 | 18.36±3.95 | 14.24±3.18a | 12.36±2.52a | 14.86±4.25 | 13.07±2.95a | 11.74±2.28a |
| 组间 | F = 12.837; P = 0.000 | F = 12.963; P = 0.000 | |||||
| 不同时点间 | F = 10.912; P = 0.000 | F = 14.835; P = 0.000 | |||||
| 组间/不同时点间 | F = 10.891; P = 0.000 | F = 12.074; P = 0.000 | |||||
组间比较, 两组治疗前血清DAO、D-LA水平相比, 差异无统计学意义, 观察组治疗1 wk、2 wk后上述血清指标水平均低于对照组(P<0.05); 组内比较, 两组治疗1 wk、2 wk后上述血清指标水平均较本组治疗前降低(P<0.05); 两组各指标组间、不同时间点、组间·不同时点间交互作用相比, 差异有统计学意义(P<0.05). 见表3.
| 组别 | 例数 | DAO(U/mL) | D-LA(μmol/L) | ||||
| 治疗前 | 治疗1 wk后 | 治疗2 wk后 | 治疗前 | 治疗1 wk后 | 治疗2 wk后 | ||
| 观察组 | 53 | 5.02±0.64 | 3.59±0.48a | 2.97±0.39a | 0.32±0.14 | 0.16±0.05a | 0.13±0.04a |
| 对照组 | 53 | 4.89±0.72 | 4.28±0.60a | 3.72±0.54a | 0.29±0.12 | 0.23±0.08a | 0.19±0.06a |
| 组间 | F = 17.625; P = 0.000 | F = 15.601; P = 0.000 | |||||
| 不同时点间 | F = 15.143; P = 0.000 | F = 13.274; P = 0.000 | |||||
| 组间/不同时点间 | F = 18.027; P = 0.000 | F = 16.301; P = 0.000 | |||||
观察组胃肠道并发症发生率较对照组低(P<0.05). 见表4.
吞咽障碍作为脑卒中患者最常见并发症, 发生率占脑卒中患病总人数的37%-78%[12,13]. 脑卒中后吞咽障碍可引起营养不良、肺部感染、肠道菌群紊乱、脱水等并发症, 其中营养不良发生率高达48%左右, 严重影响患者预后[14,15]. 因此, 及时采取安全、有效的营养替代及支持治疗尤为关键.
脑卒中患者胃黏膜吸收功能下降, 上皮细胞因能量缺乏出现萎缩、凋亡, 增加上皮细胞通透性, 引起肠道菌群紊乱、移位, 影响机体对营养物质的消化、吸收程度[16-19]. 因此, 维持肠道微生态稳定, 保护胃肠黏膜屏障为提高脑卒中后吞咽障碍患者肠内营养支持疗效的关键. 微生物治疗学是一种基于"以菌治菌"的临床理念, 通过生物拮抗改善机体微生态失衡状态, 近年来逐渐广泛应用于临床. 李媛媛等学者[20]证实, 含益生菌肠内营养支持可改善危重脑出血术后患者营养状态及肠道菌群, 降低其并发症发生率, 充分证实了含益生菌肠内营养支持的有效性及安全性. 基于此, 本研究采用含益生菌肠内营养支持治疗脑卒中后吞咽障碍, 结果显示, 两组治疗1 wk后血清Hb、ALB、TP水平均低于治疗前, 治疗2 wk后逐渐回升, 且观察组治疗1 wk、2 wk后血清Hb、ALB、TP水平均高于对照组(P<0.05), 提示含益生菌肠内营养支持治疗脑卒中后吞咽障碍, 可减缓或抑制患者营养状态恶化. 分析原因, 可能是由于脑卒中后吞咽障碍患者机体代谢紊乱, 能量消耗增加, 蛋白质分解加速, 营养状态恶化, 随着治疗时间延长, 患者营养状况之间好转. 双歧杆菌乳杆菌三联活菌片作为一种临床常用复发微生态制剂, 是由肠道固有菌群组成, 其产生的特殊物质可更新肠道上皮细胞, 抵御病原体入侵, 促进肠蠕动及肠道神经肌肉活性, 促进胃肠道消化、吸收功能恢复, 使得营养物质利用率提升, 进而加快蛋白质合成过程[21], 与肠内营养支持联合应用, 可达到协同增效作用, 减缓或抑制患者营养状态恶化. 此外, 脑卒中患者处于负氮平衡状态, 蛋白质-热量供应不足, 机体必需的营养物质缺乏, 造成机体特异性及非特异性免疫功能低下, 补体合成减少, 中性粒细胞趋化能力及对细菌杀伤能力下降, TLC总数降低, 而机体体液免疫中B淋巴细胞产生的免疫球蛋白可对抗致病菌侵袭, 且具有免疫监视及维持内环境稳定等作用[22]. 因此, 本研究通过测定TLC及免疫球蛋白水平了解患者机体免疫功能, 发现观察组治疗1 wk、2 wk后外周血TLC与血清IgM、IgG、IgA水平均高于对照组(P<0.05), 提示含益生菌肠内营养支持治疗脑卒中后吞咽障碍, 可有效调节机体免疫功能.
本研究中观察组治疗1 wk、2 wk后血清DAO、D-LA水平均低于对照组(P<0.05), 提示含益生菌肠内营养支持治疗脑卒中后吞咽障碍, 可显著降低患者血清DAO、D-LA水平, 促进肠道黏膜屏障恢复, 降低肠黏膜通透性. 原因在于双歧杆菌乳杆菌三联活菌片口服后直接补充肠道有益菌, 并大量繁殖, 可拮抗致病菌产生, 纠正、稳定细菌菌落结构, 维持肠道菌群平衡, 重建胃肠道"菌膜"屏障, 促进肠上皮屏障成熟, 降低肠道通透性, 延缓其萎缩[23-25]. 含益生菌肠内营养支持可一定程度刺激咀嚼中枢, 促进患者自主进食功能恢复[26]. 观察组治疗1 wk、2 wk后NIHSS、APACHEⅡ评分均低于对照组, 且住院时间短于对照组, 住院费用低于对照组(P<0.05), 充分说明含益生菌肠内营养支持治疗脑卒中后吞咽障碍, 可有效缓解患者病情, 缩短康复进程, 减少医疗费用. 此外, 含益生菌肠内营养支持对患者副作用小, 治疗期间虽有胃肠道并发症, 但随治疗推进, 均可自行消失. 本研究中观察组胃肠道并发症发生率低于对照组, 提示含益生菌肠内营养支持在脑卒中后吞咽障碍康复治疗中安全性较高. 但本研究样本量较小, 且未进行长期随访研究, 还需临床多中心、多渠道取样, 作进一步证实.
综上所述, 含益生菌肠内营养支持治疗脑卒中后吞咽障碍, 可有效改善患者营养状态、免疫功能及肠道屏障功能, 加速病情恢复, 减少胃肠道并发症发生, 疗效显著, 且安全性高, 值得临床推广与应用.
吞咽障碍为脑卒中后常见症状及后遗症, 发病率高达30%以上, 多因两侧皮质脊髓束损伤后, 延髓支配肌肉瘫痪无力所致, 主要表现为进食呛咳、咀嚼无力、吞咽困难等, 极易引起营养不良、内环境紊乱等并发症, 严重影响患者预后, 而营养不良是脑卒中患者预后不良的独立危险因素. 含益生菌肠内营养支持是改善胃肠道功能, 提高营养物质吸收的有效手段, 可用于脑卒中后吞咽障碍患者.
关于含益生菌肠内营养支持在脑卒中后吞咽障碍中应用的研究报道相对较少, 本研究结果有助于改肠内营养支持治疗提供实验室依据.
阐明含益生菌肠内营养支持对脑卒中后吞咽障碍治疗的疗效及安全性, 为该肠内永阳支持推广提供理论基础.
以本院脑卒中后吞咽障碍患者106例, 以随机分为观察组(n = 53)、对照组(n = 53). 对照组采取常规肠内营养支持, 观察组采取含益生菌肠内营养支持, 均治疗2 wk. 比较两组治疗前、治疗后营养参数、免疫功能指标、病情程度、肠道屏障功能指标, 并统计胃肠道并发症发生情况、住院时间、住院费用. 明确含益生菌肠内营养支持对脑卒中后吞咽障碍治疗的疗效及安全性.
脑卒中后吞咽障碍患者含益生菌肠内营养支持治疗后营养状态、免疫功能及肠道屏障功能均得以改善, 且患者病情恢复明显较快, 胃肠道不良反应的发生率较低.
含益生菌肠内营养支持可通过有效改善营养状态、免疫功能及肠道屏障功能治疗脑卒中后吞咽障碍, 促进病情恢复, 疗效显著, 且安全性高.
但本研究样本量较小, 且未进行长期随访研究, 还需临床多中心、多渠道取样, 作进一步证实含益生菌肠内营养支持对脑卒中后吞咽障碍治疗的疗效及安全性.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Souza JT, Ribeiro PW, de Paiva SAR, Tanni SE, Minicucci MF, Zornoff LAM, Polegato BF, Bazan SGZ, Modolo GP, Bazan R, Azevedo PS. Dysphagia and tube feeding after stroke are associated with poorer functional and mortality outcomes. Clin Nutr. 2020;39:2786-2792. [PubMed] [DOI] |
| 2. | Simonelli M, Ruoppolo G, Iosa M, Morone G, Fusco A, Grasso MG, Gallo A, Paolucci S. A stimulus for eating. The use of neuromuscular transcutaneous electrical stimulation in patients affected by severe dysphagia after subacute stroke: A pilot randomized controlled trial. NeuroRehabilitation. 2019;44:103-110. [PubMed] [DOI] |
| 3. | Juan W, Zhen H, Yan-Ying F, Hui-Xian Y, Tao Z, Pei-Fen G, Jian-Tian H. A Comparative Study of Two Tube Feeding Methods in Patients with Dysphagia After Stroke: A Randomized Controlled Trial. J Stroke Cerebrovasc Dis. 2020;29:104602. [PubMed] [DOI] |
| 7. | 陈 金莹, 罗 云英, 朱 珍萍, 朱 碧宏, 傅 攀. 早期肠内营养联合益生菌对重症缺血性脑卒中患者肠道菌群及免疫功能的影响. 中国中西医结合急救杂志. 2019;26:329-333. [DOI] |
| 8. | 金 鑫, 史 颖, 袁 蓓, 王 惠凌, 刘 海燕, 陈 雅静, 邸 卫英, 王 楚涵. 添加益生菌的早期滋养量肠内营养对重症脑卒中患者呼吸机相关性肺炎的影响. 中国微生态学杂志. 2019;31:174-178. [DOI] |
| 10. | Chalos V, van der Ende NAM, Lingsma HF, Mulder MJHL, Venema E, Dijkland SA, Berkhemer OA, Yoo AJ, Broderick JP, Palesch YY, Yeatts SD, Roos YBWEM, van Oostenbrugge RJ, van Zwam WH, Majoie CBLM, van der Lugt A, Roozenbeek B, Dippel DWJ; MR CLEAN Investigators. National Institutes of Health Stroke Scale: An Alternative Primary Outcome Measure for Trials of Acute Treatment for Ischemic Stroke. Stroke. 2020;51:282-290. [PubMed] [DOI] |
| 11. | Simkins M, Iqbal A, Gronemeyer A, Konzen L, White J, Koenig M, Palmer C, Kerby P, Buckman S, Despotovic V, Hoehner C, Boyle W. Inter-Rater Reliability and Impact of Disagreements on Acute Physiology and Chronic Health Evaluation IV Mortality Predictions. Crit Care Explor. 2019;1:e0059. [PubMed] [DOI] |
| 12. | Marin S, Serra-Prat M, Ortega O, Clavé P. Cost of oropharyngeal dysphagia after stroke: protocol for a systematic review. BMJ Open. 2018;8:e022775. [PubMed] [DOI] |
| 13. | Park JS, Lee G, Jung YJ. Effects of game-based chin tuck against resistance exercise vs head-lift exercise in patients with dysphagia after stroke: An assessor-blind, randomized controlled trial. J Rehabil Med. 2019;51:749-754. [PubMed] [DOI] |
| 14. | 董 旭, 李 壮苗, 吴 燕华. 生物反馈治疗脑卒中后吞咽障碍疗效的Meta分析. 中华物理医学与康复杂志. 2019;41:227-233. [DOI] |
| 15. | Eltringham SA, Kilner K, Gee M, Sage K, Bray BD, Pownall S, Smith CJ. Impact of Dysphagia Assessment and Management on Risk of Stroke-Associated Pneumonia: A Systematic Review. Cerebrovasc Dis. 2018;46:99-107. [PubMed] [DOI] |
| 17. | 涂 芊茜, 拓 西平, 张 文俊, 陈 海涛, 赵 宁, 鞠 泽亚, 乌 日罕, 黄 枫. 肠内营养支持结合康复治疗对于高龄老年痴呆营养不良患者的疗效观察. 中华老年医学杂志. 2019;38:274-277. [DOI] |
| 19. | 许 自阳, 兰 钰洁, 唐 志明, 窦 祖林, 温 红梅, 安 德连. 黄原胶类与变性淀粉类增稠剂在脑卒中吞咽障碍患者及健康人群中喜好度和口感异味差异分析. 中华物理医学与康复杂志. 2020;42:1110-1112. [DOI] |