修回日期: 2023-10-27
接受日期: 2023-11-18
在线出版日期: 2023-11-28
复杂性腹腔感染(complicated intra-abdominal infections, cIAI)与腹部创伤相关, 病因复杂, 病情急重, 危险系数高, 是导致腹部创伤患者死亡的重要原因, 安全、有效的治疗策略是患者预后的影响因素.
基于血清炎症指标、T淋巴细胞亚群、康复情况、治疗费用探究厄他培南联合硝唑在cIAI治疗中的疗效.
选取2021-06/2023-01我院92例cIAI患者, 随机分为对照组和研究组, 各46例. 两组入院后均寻找腹部感染灶, 积极进行穿刺引流、双套管持续冲洗、抗感染、器官功能支持、营养支持等一系列治疗, 于此基础上, 对照组采用哌拉西林/他唑巴坦联合甲硝唑治疗, 研究组采用厄他培南联合甲硝唑治疗. 比较两组治疗效果、康复情况、治疗费用、治疗前后血清炎症指标[降钙素原(procalcitonin, PCT)、Toll样受体4(toll-like receptor 4, TLR-4)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、C反应蛋白(C-reactive protein, CRP)]、T淋巴细胞亚群(CD3+、CD4+、CD4+/CD8+)水平、急性生理学与慢性健康状况Ⅱ(acute physiology and chronic health evaluationⅡ, APACHEⅡ)评分、器官功能衰竭(sequential organ failure assessment, SOFA)评分、不良反应、细菌培养结果.
研究组治疗总有效率93.48%显著高于对照组78.26%(P<0.05); 治疗3 d、7 d后研究组血清PCT、TLR-4、TNF-α、CRP水平低于对照组, 血清CD3+、CD4+、CD4+/CD8+水平高于对照组(P<0.05); 研究组治疗3 d、7 d后APACHEⅡ评分、SOFA评分低于对照组(P<0.05); 研究组发热消退时间、ICU治疗时间、住院时间短于对照组, 药品费用、其他资源费用少于对照组(P<0.05); 研究组不良反应发生率4.35%低于对照组17.39%(P<0.05); 两组治疗前、治疗后致病菌分布情况比较差异无统计学意义.
厄他培南联合甲硝唑治疗cIAI效果显著, 可减轻炎症反应, 改善免疫功能, 控制患者病情进展, 降低器官功能衰竭风险, 同时能减轻患者经济负担, 提高治疗安全性.
核心提要: 复杂性腹腔感染(complicated intra-abdominal infections, cIAI)病情复杂, 且变化迅速, 是导致感染性休克、脓毒症的重要原因. 外科手术是临床治疗cIAI重要方案, 但术后仍需辅助抗感染以提升临床疗效. 临床多主张多种抗菌药物联合治疗. 厄他培南与哌拉西林/他唑巴坦均为β-内酰胺酶广谱类抗生素, 对cIAI术后感染可起到较好的抑制效果. 本研究选取我院92例cIAI患者, 旨在进一步分析厄他培南联合甲硝唑的临床价值, 以期为cIAI的临床治疗提供理论依据.
引文著录: 杜海旭, 洪春霞, 喻彤. 基于血清炎症指标、T淋巴细胞亚群、康复情况、治疗费用探究厄他培南联合甲硝唑在复杂性腹腔感染治疗中的疗效. 世界华人消化杂志 2023; 31(22): 940-948
Revised: October 27, 2023
Accepted: November 18, 2023
Published online: November 28, 2023
Complex intra-abdominal infections (cIAIs), often associated with abdominal trauma, have a complex etiology, are acute and severe, and have a high risk. They are an important cause of death in patients with abdominal trauma. Safe and effective treatment strategies are the factors affecting the prognosis of such patients.
To investigate the efficacy and safey of ertapenem combined with metronidazole in the treatment of cIAIs as well as the impact on serum inflammatory markers and T lymphocyte subsets, recovery status, and treatment costs.
A total of 92 patients with cIAIs treated at our hospital from June 2021 to January 2023 were randomly divided into a control group and a study group, with 46 cases in each group. After admission, both groups received puncture drainage, continuous double-cannula irrigation, anti-infection therapy, organ function support, nutritional support, and other treatments. On this basis, the control group was treated with piperacillin/tazobactam combined with metronidazole, while the study group was treated with ertapenem combined with metronidazole. The therapeutic effects, recovery conditions, treatment costs, serum inflammatory indicators [procalcitonin (PCT), Toll-like receptor 4 (TLR-4), tumor necrosis factor-α (TNF-α), and C-reactive protein (CRP)], T lymphocyte subsets (CD3+, CD4+, and CD4+/CD8+ ratio), acute physiology and chronic health evaluation Ⅱ (APACHE Ⅱ) score, sequential organ failure assessment (SOFA) score, adverse reactions, and bacterial culture results were compared between the two groups.
The total effective rate of the study group was 93.48%, significantly higher than that of the control group (78.26%; P < 0.05). After 3 d and 7 d of treatment, the levels of serum PCT, TLR-4, TNF-α, and CRP in the study group were significantly lower and the levels of serum CD3+ and CD4+ T lymphocytes and CD4+/CD8+ ratio were significantly higher than those of the control group (P < 0.05). The APACHEⅡ score and SOFA score of the study group were significantly lower than those of the control group after 3 d and 7 d of treatment (P < 0.05). The time to fever resolution, ICU stay duration, and hospital stay in the study group were significantly shorter than those of the control group, and the costs of drugs and other resources were less than those of the control group (P < 0.05). The incidence of adverse reactions in the study group was 4.35%, significantly lower than that of the control group (17.39%; P < 0.05). There was no significant difference in the distribution of pathogenic bacteria between the two groups before and after treatment (P > 0.05).
Ertapenem combined with metronidazole is effective in the treatment of cIAIs, which can reduce inflammation, improve immune function, control disease progression, reduce the risk of organ failure, reduce the economic burden of patients, and improve treatment safety.
- Citation: Du HX, Hong CX, Yu T. Ertapenem combined with metronidazole for treatment of complex abdominal infections: Efficacy and impact on serum inflammatory indicators and T lymphocyte subsets. Shijie Huaren Xiaohua Zazhi 2023; 31(22): 940-948
- URL: https://www.wjgnet.com/1009-3079/full/v31/i22/940.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i22.940
复杂性腹腔感染(complicated intra-abdominal infections, cIAI)是由胆囊炎合并穿孔、阑尾穿孔、肠道外伤性穿孔等病因在腹膜腔内诱发炎症及脓肿的病理特征, 其病情复杂, 且变化迅速, 是导致感染性休克、脓毒症的重要原因[1,2]. 有研究显示[3], cIAI病死率较高, 居ICU感染死亡因素第2位. 外科手术是临床治疗cIAI重要方案, 如穿刺引流、双套管持续冲洗术及腹腔镜等, 虽能有效清除感染病灶, 但术后仍需辅助抗感染以提升临床疗效[4]. cIAI致病菌多是革兰阴性菌、革兰阳性菌及厌氧菌, 既往采用的甲硝唑虽有较好的抑菌作用, 但对于感染病菌复杂的cIAI, 单独使用治疗力度不足, 会导致治疗失败[5]. 此类患者临床多主张多种抗菌药物联合治疗. 厄他培南与哌拉西林/他唑巴坦均为β-内酰胺酶广谱类抗生素, 对革兰阴性菌、革兰阳性菌及厌氧菌等多种菌属可起到较好的抑制效果[6]. 本研究选取我院92例cIAI患者, 旨在进一步分析厄他培南联合甲硝唑的临床价值, 以期为cIAI的临床治疗提供理论依据. 报告如下.
本研究采用有限元对照分析. 前瞻性选取2021-06/2023-01我院92例cIAI患者, 其中男42例, 女50例; 年龄(45-70)岁, 平均(57.5±6.25)岁. 采用电脑随机法将患者分为研究组(n = 46)和对照组(n = 46). 两组基线资料间无显著差异(P>0.05), 具有可比性. 见表1. 本研究经本院伦理委员会审核批准, 伦理批号: (2020)伦审(155)号.
| 组别 | n | 年龄(mean±SD, 岁) | 性别(%) | 体重指数(mean±SD, kg/m2) | 手术类型(%) | 病情程度(%) | 腹腔积液(%) | 感染病因(%) | |||||||
| 男 | 女 | 穿刺引流 | 双套管冲洗 | 腹腔镜手术 | 中轻度 | 重度 | 是 | 否 | 革兰阴性菌 | 革兰阳性菌 | 厌氧菌 | ||||
| 研究组 | 46 | 56.95±6.28 | 19(41.30) | 27(58.70) | 23.18±1.29 | 24(52.17) | 15(32.61) | 7(15.22) | 38(82.61) | 8(17.39) | 13(28.26) | 33(71.74) | 16(34.78) | 23(50.00) | 7(15.22) |
| 对照组 | 46 | 58.13±6.19 | 23(50.00) | 23(50.00) | 23.51±1.43 | 23(50.00) | 14(30.43) | 9(19.57) | 35(76.09) | 11(23.91) | 17(36.96) | 29(63.04) | 18(39.13) | 20(43.48) | 8(17.39) |
| χ2/t | 0.908 | 0.701 | 1.162 | 0.306 | 0.597 | 0.791 | 0.394 | ||||||||
| P | 0.367 | 0.403 | 0.248 | 0.858 | 0.440 | 0.374 | 0.821 | ||||||||
诊断标准: 符合2019版《中国腹腔感染诊治指南》[7]中社区获得性cIAI的相关诊断, 并经体格检查、生化指标检查、影像检查及腹腔穿刺确诊. 入选条件: 具备明显的cIAI手术指征, 如胆囊炎合并穿孔、阑尾穿孔、肠道外伤性穿孔、急性十二指肠穿孔等; 感染局限于腹腔, 未出现全身扩散; 腹腔引流液病原菌检测及药敏试验显示对哌拉西林/他唑巴坦、厄他培南敏感; 患者或家属签署知情同意书. 排除条件: 脏器功能衰竭患者; 合并恶性肿瘤、免疫缺陷性疾病患者; 合并精神、认知障碍患者.
治疗方法: (1)基础治疗: 包括穿刺引流、双套管冲洗、腹腔镜手术、器官功能支持、营养支持等; (2)对照组: 哌拉西林/他唑巴坦(品牌: 山东瑞阳制药, 规格: 0.625 g, 批准文号: 国药准字H20133350)静脉滴注, 4.5 g/次, 1次/8 h; 注射用甲硝唑(品牌: 吉林津升制药, 规格: 25 mg, 批准文号: 国药准字H20041392)静脉滴注, 0.5 g/次, 1次/8 h; (3)研究组: 注射用厄他培南(品牌: FAREVA Mirabel, 规格: 1 g, 注册证号: H20150481)静脉滴注, 1.5 g/次, 1次/8 h; 注射用甲硝唑用法用量均同对照组. 两组均治疗7 d.
(1)参照《抗菌药物临床试验技术指导原则》[8]评估治疗效果, 治愈: 临床症状及体征消失, 病原学与实验室指标检查正常; 显效: 临床症状及体征基本消失, 病原学与实验室指标基本恢复; 有效: 病情有所减轻, 但不明显; 无效: 症状未改善或病情恶化. 治愈、显效、有效例数计入总有效率; (2)血清炎症指标: 采集患者治疗前及治疗3 d后、7 d后外周静脉血5 mL, 离心15 min分离上层血清低温冰箱保存. 采用半定量免疫色谱法检测血清降钙素原(procalcitonin, PCT)水平, 酶联免疫法检测血清肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、C反应蛋白(C-reactive protein, CRP)、Toll样受体4(toll-like receptor 4, TLR-4)水平, 试剂盒均购自Alere Technologies AS; (3)血清T淋巴细胞亚群水平: 采集流式细胞仪(品牌: Sysmex Partec GmbH, 型号: CyFlow® Counter)检测、T淋巴细胞亚群CD3+、CD4+、CD8+水平, 并计算CD4+/CD8+; (4)采用急性生理学与慢性健康状况Ⅱ[9](acute physiology and chronic health evaluationⅡ, APACHEⅡ)评分评估治疗前及治疗3 d后、7 d后病情严重程度, 评分越高表示病情越严重; 以器官功能衰竭[10](sequential organ failure assessment, SOFA)评分评估患者治疗前及治疗3 d后、7 d后预后, 评分越高则预后效果越差; (5)康复情况及治疗费用: 记录患者发热消退时间、ICU治疗时间、住院时间、药品费用、其他资源费及治疗期间; (6)不良反应: 包括、恶心/呕吐、腹泻、头痛、皮疹、静脉炎; (7)细菌培养结果: 治疗前后进行药敏试验检测致病菌分布情况.
统计学处理 采用统计学软件SPSS 25.0进行数据分析, 计数资料采用χ2检验, 以(n, %)表示; 计量资料采用重复测量方差分析, 以F检验, 进一步两两比较采用LSD-t检验, 以(mean±SD)表示. P<0.05表示差异具有统计学意义.
研究组治疗总有效率93.48%显著高于对照组78.26%(P<0.05). 见表2.
| 组别 | n | 无效 | 有效 | 显效 | 治愈 | 总有效 |
| 研究组 | 46 | 3(6.52) | 10(21.74) | 13(28.26) | 20(43.48) | 43(93.48) |
| 对照组 | 46 | 10(21.74) | 11(23.91) | 10(21.74) | 15(32.61) | 36(78.26) |
| χ2 | 4.390 | |||||
| P | 0.036 |
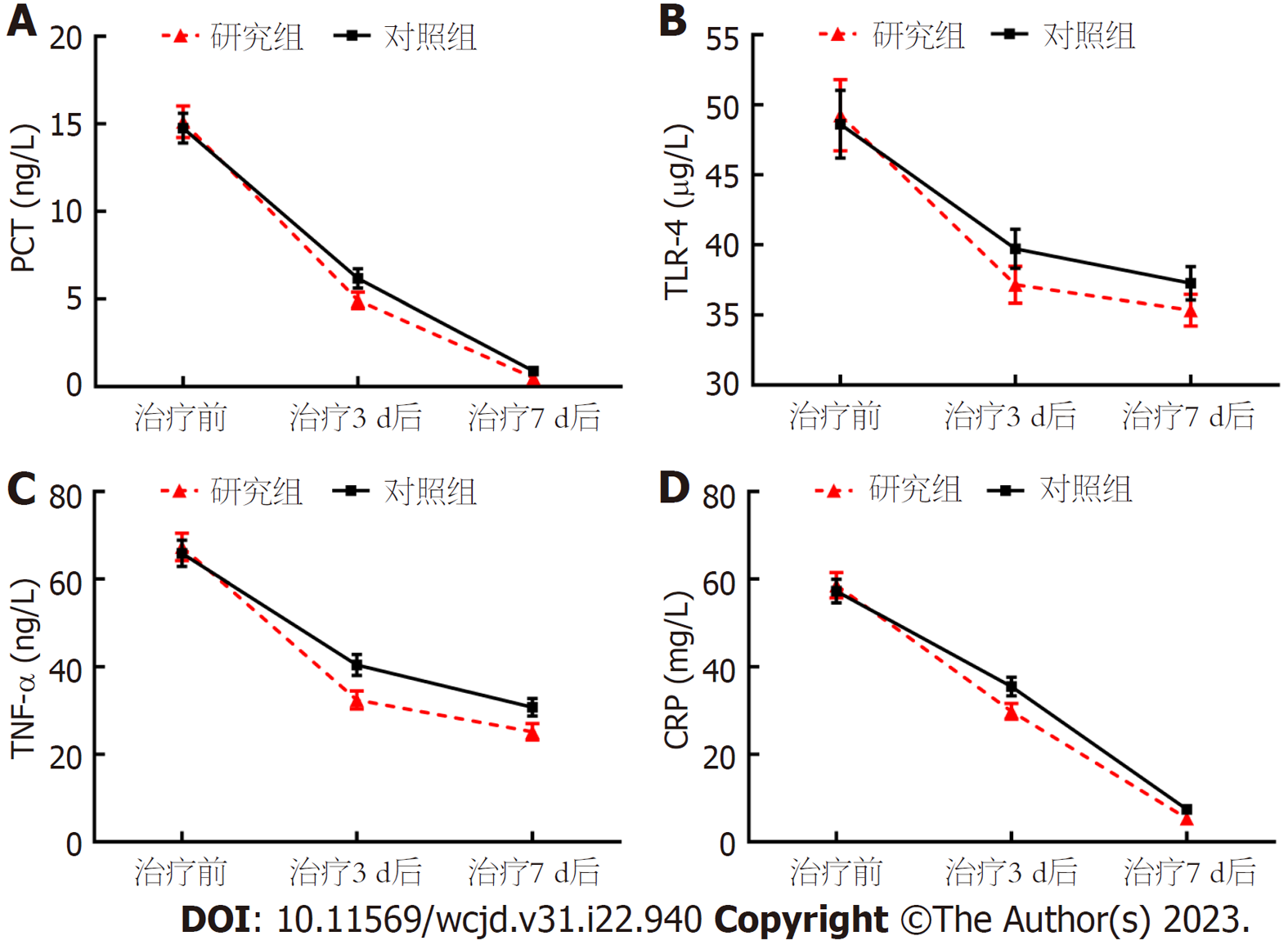
重复测量方差分析: 血清PCT、TLR-4、TNF-α、CRP水平组间-时间点交互作用比较, 差异有统计学意义(P<0.05); 组间比较, 研究组治疗3 d、7 d后血清PCT、TLR-4、TNF-α、CRP水平低于对照组(P<0.05); 组内比较, 两组治疗前、治疗3 d、7 d后血清PCT、TLR-4、TNF-α、CRP水平呈逐渐降低趋势(P<0.05). 见表3、图1.
| 指标 | 组别 | n | 治疗前 | 治疗3 d后 | 治疗7 d后 |
| PCT(ng/L) | 研究组 | 46 | 15.12±3.04 | 4.93±1.61 | 0.51±0.12 |
| 对照组 | 46 | 14.76±2.85 | 6.18±1.87 | 0.89±0.26 | |
| 组间 | F = 8.492, P<0.001 | ||||
| 时间 | F = 29.584, P<0.001 | ||||
| 组间-时间交互 | F = 13.511, P<0.001 | ||||
| TLR-4(μg/L) | 研究组 | 46 | 49.26±8.57 | 37.15±4.46 | 35.34±3.81 |
| 对照组 | 46 | 48.62±8.19 | 39.72±4.71 | 37.26±4.03 | |
| 组间 | F = 5.139, P = 0.007 | ||||
| 时间 | F = 25.839, P<0.001 | ||||
| 组间-时间交互 | F = 7.288, P<0.001 | ||||
| TNF-α(ng/L) | 研究组 | 46 | 67.39±10.58 | 32.41±7.08 | 25.14±6.32 |
| 对照组 | 46 | 65.87±10.23 | 40.46±8.25 | 30.75±6.80 | |
| 组间 | F = 8.317, P<0.001 | ||||
| 时间 | F = 40.211, P<0.001 | ||||
| 组间-时间交互 | F = 19.543, P<0.001 | ||||
| CRP(mg/L) | 研究组 | 46 | 58.64±9.72 | 29.86±6.15 | 5.39±1.62 |
| 对照组 | 46 | 57.33±9.15 | 35.49±7.22 | 7.41±1.85 | |
| 组间 | F = 7.954, P<0.001 | ||||
| 时间 | F = 48.936, P<0.001 | ||||
| 组间-时间交互 | F = 22.719, P<0.001 | ||||
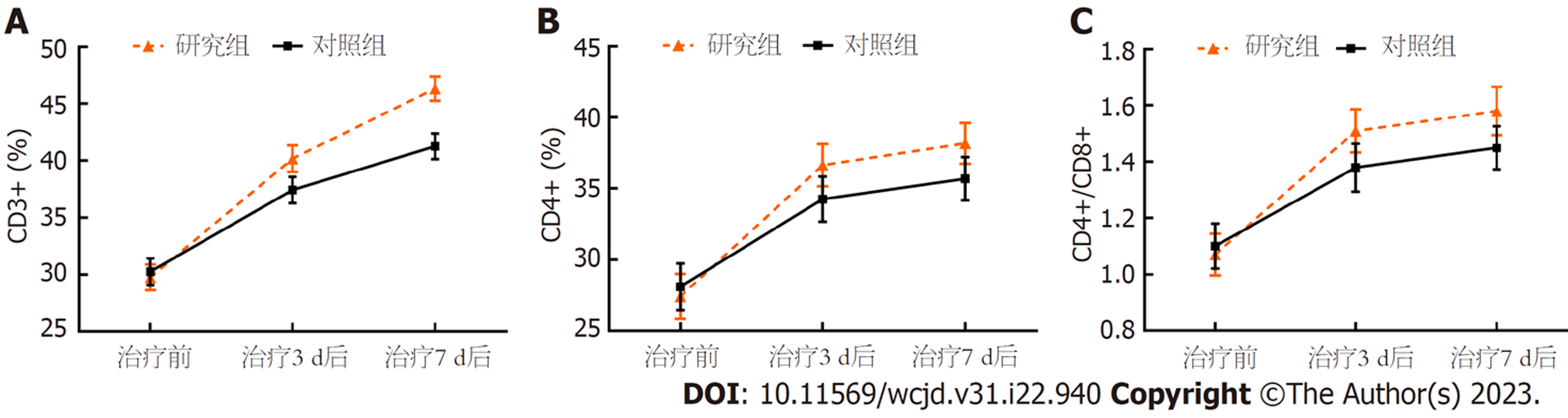
重复测量方差分析: 血清CD3+、CD4+、CD4+/CD8+水平组间-时间点交互作用比较, 差异有统计学意义(P<0.05); 组间比较, 研究组治疗3 d、7 d后血清CD3+、CD4+、CD4+/CD8+水平高于对照组(P<0.05); 组内比较, 两组治疗前、治疗3 d、7 d后血清CD3+、CD4+、CD4+/CD8+水平呈逐渐升高趋势(P<0.05). 见表4、图2.
| 指标 | 组别 | n | 治疗前 | 治疗3 d后 | 治疗7 d后 |
| CD3+(%) | 研究组 | 46 | 29.77±3.81 | 40.18±3.93 | 46.32±3.58 |
| 对照组 | 46 | 30.25±3.94 | 37.42±3.86 | 41.26±3.76 | |
| 组间 | F = 7.186, P<0.001 | ||||
| 时间 | F = 29.753, P<0.001 | ||||
| 组间-时间交互 | F = 12.755, P<0.001 | ||||
| CD4+(%) | 研究组 | 46 | 27.42±5.36 | 36.64±5.01 | 38.17±4.85 |
| 对照组 | 46 | 28.10±5.53 | 34.26±5.31 | 35.69±5.11 | |
| 组间 | F = 4.981, P = 0.037 | ||||
| 时间 | F = 27.543, P<0.001 | ||||
| 组间-时间交互 | F = 7.148, P<0.001 | ||||
| CD4+/CD8+ | 研究组 | 46 | 1.07±0.25 | 1.51±0.26 | 1.58±0.29 |
| 对照组 | 46 | 1.10±0.27 | 1.38±0.29 | 1.45±0.26 | |
| 组间 | F = 7.288, P<0.001 | ||||
| 时间 | F = 19.432, P<0.001 | ||||
| 组间-时间交互 | F = 9.385, P<0.001 |
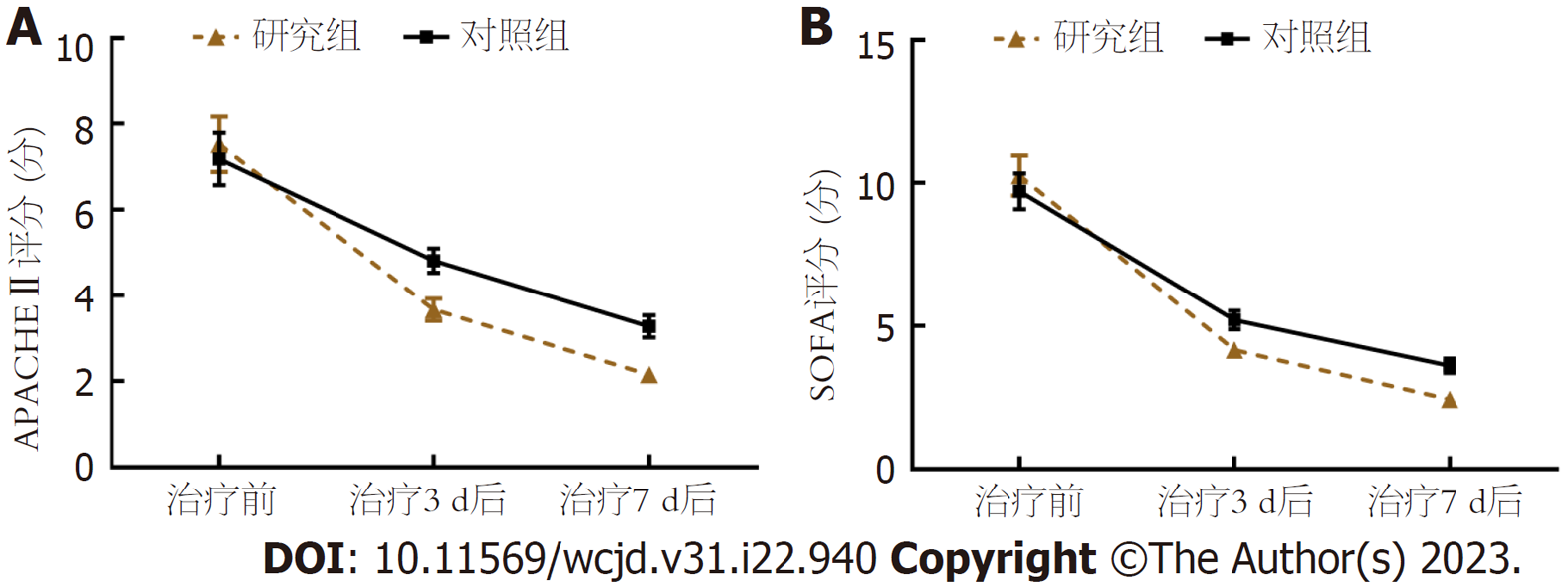
重复测量方差分析: APACHEⅡ评分、SOFA评分组间-时间点交互作用比较, 差异有统计学意义(P<0.05); 组间比较, 研究组治疗3 d、7 d后APACHEⅡ评分、SOFA评分低于对照组(P<0.05); 组内比较, 两组治疗前、治疗3 d、7 d后APACHEⅡ评分、SOFA评分呈逐渐降低趋势(P<0.05). 见表5、图3.
| 指标 | 组别 | n | 治疗前 | 治疗3 d后 | 治疗7 d后 |
| APACHEⅡ | 研究组 | 46 | 7.52±2.16 | 3.67±0.88 | 2.15±0.64 |
| 对照组 | 46 | 7.18±2.04 | 4.81±0.95 | 3.28±0.87 | |
| 组间 | F = 7.311, P<0.001 | ||||
| 时间 | F = 20.294, P<0.001 | ||||
| 组间-时间交互 | F = 10.858, P<0.001 | ||||
| SOFA | 研究组 | 46 | 10.26±2.35 | 4.16±0.97 | 2.43±0.70 |
| 对照组 | 46 | 9.71±2.11 | 5.20±1.12 | 3.61±0.85 | |
| 组间 | F = 8.253, P<0.001 | ||||
| 时间 | F = 22.779, P<0.001 | ||||
| 组间-时间交互 | F = 11.082, P<0.001 |
研究组发热消退时间、ICU治疗时间、住院时间短于对照组, 药品费用、其他资源费用少于对照组(P<0.05). 见表6.
| 组别 | n | 发热消退时间(d) | ICU治疗时间(d) | 住院时间(d) | 药品费用(元) | 其他资源费用(元) |
| 研究组 | 46 | 7.18±2.06 | 9.74±2.23 | 14.62±2.58 | 5813.74±489.67 | 546.82±87.64 |
| 对照组 | 46 | 9.42±2.51 | 11.36±2.75 | 16.37±2.79 | 7891.26±623.51 | 591.45±95.13 |
| t | 4.679 | 3.103 | 3.123 | 17.773 | 2.340 | |
| P | <0.001 | 0.003 | 0.002 | <0.001 | 0.022 |
研究组不良反应发生率4.35%低于对照组17.39%(P<0.05). 见表7.
研究组46例患者治疗前分离出59株致病菌, 治疗7 d后分离出9株致病菌; 对照组46例患者治疗前分离出57株致病菌, 治疗7 d后分离出20株致病菌. 两组治疗前、治疗后致病菌分布情况比较差异无统计学意义; 治疗后两组病菌分布均较治疗前改善(P<0.05). 见表8.
| 时间 | 组别 | 鲍曼不动杆菌 | 肺炎克雷伯菌 | 大肠埃希菌 | 铜绿假单胞菌 | 屎肠球菌 | 产气肠杆菌 | 金黄色葡萄球菌 | 其他 |
| 治疗前 | 研究组 | 14(30.43) | 11(23.91) | 9(19.57) | 6(13.04) | 5(10.87) | 4(8.70) | 4(8.70) | 6(13.04) |
| 对照组 | 13(28.26) | 10(21.74) | 7(15.22) | 8(17.59) | 4(8.70) | 5(10.87) | 3(6.52) | 7(15.22) | |
| χ2 | 1.028 | ||||||||
| P | 0.994 | ||||||||
| 治疗7 d后 | 研究组 | 3(6.52) | 2(4.35) | 2(4.35) | 1(2.17) | 0(0.00) | 0(0.00) | 0(0.00) | 0(0.00) |
| 对照组 | 6(13.04) | 5(10.87) | 3(6.52) | 3(6.52) | 2(4.35) | 1(2.17) | 0(0.00) | 0(0.00) | |
| χ2 | 3.482 | ||||||||
| P | 0.626 | ||||||||
腹腔感染是常见的感染性疾病, 多因坏死型炎症、消化道外伤、不洁外科手术所致, 依据感染范围分布可分为cIAI与非复杂性腹腔感染. cIAI病情较为严重, 临床治疗难度较大, 既往临床常采用手术联合抗生素治疗, 其中手术能快速清除积液, 改善腹腔环境, 联合抗生素以发挥抗菌作用, 提高临床疗效. 但抗菌药物使用过量或不当, 极易出现耐药性, 对患者预后造成不利影响[11]. 因此, 合理使用抗菌药物, 对治疗cIAI及降低病死率均起着至关重要的作用. 厄他培南属于碳青霉烯类抗菌药物, 抗菌谱广, 尤其对产超广谱β-内酰胺酶的革兰阴性菌具有较高的敏感性, 被多个权威指南推荐用于重度感染一线治疗药物[12,13]. 为了探究厄他培南治疗cIAI的临床价值, 本研究通过不同用药方案对治疗效果进行对比观察, 并积极探讨对血清PCT、TLR-4的影响.
本研究结果显示, 研究组治疗总有效率显著高于对照组(P<0.05), 发热消退时间、ICU治疗时间、住院时间短于对照组, 药品费用、其他资源费用少于对照组(P<0.05), 可见厄他培南联合甲硝唑治疗cIAI能获得更佳的治疗效果, 可有效缩短患者康复进程, 减轻经济负担. 现阶段关于厄他培南与哌拉西林/他唑巴坦在cIAI治疗中的研究较少, 仅张璐莹等[14]研究显示, 厄他培南治疗cIAI的有效率为60.8%, 高于哌拉西林/他唑巴坦的53.2%, 而本研究结果治疗有效率与既往研究存在差异, 考虑原因可能在于: 本研究采用联合用药方案以及用药剂量存在差异.
另外, 本研究还显示, 研究组不良反应发生率4.35%低于对照组17.39%(P<0.05), 说明厄他培南联合甲硝唑这一方案具有更高的安全性. 与对照组相比, 研究组之所以能够获得更佳的治疗效果与较少的不良反应, 原因在于厄他培南对β-内酰胺酶的稳定性较好, 合理使用耐药率低, 能够有效清除体内细菌, 降低内毒素和炎性因子水平[15]. 尽管如此, 在用药过程中, 临床医生仍需密切关注不良反应发生情况, 并需加强管理措施, 当不良反应发生后能够及时对症处理.
cIAI会引起全身炎症反应, 导致器官功能衰竭, 使病死率增高, 因此临床常采用广谱类抗生素进行抗感染治疗, 以尽快清除细菌感染, 改善患者治疗结局[16]. 内毒素是细菌致病启动因子, 一旦接触巨噬细胞会导致TNF-α等炎性因子大量释放, 诱发全身炎性反应[17]. PCT是反映机体炎性程度的指标蛋白, CRP是反应细菌感染程度的反应蛋白. TLR-4是一种跨膜蛋白, 与腹腔感染严重程度及预后密切相关[18]. 因此, TNF-α、PCT、CRP、TLR-4动态变化不仅与机体炎性反应程度相关, 且能反映患者预后. 本研究显示, 研究组治疗3 d、7 d后血清PCT、TLR-4、TNF-α、CRP水平低于对照组(P<0.05), 可见厄他培南联合甲硝唑在清除内毒素、降低炎性因子水平方面更具优势. 机体感染会造成患者免疫功能发生变化, 尤其是重症感染患者CD4+T淋巴细胞和抗原细胞凋亡可导致抗体水平降低, 从而引发免疫功能紊乱, 加重器官功能损伤[19,20]. 本研究显示, 研究组治疗3 d、7 d后血清CD3+、CD4+、CD4+/CD8+水平高于对照组(P<0.05), 提示厄他培南联合甲硝唑可有效改善机体免疫功能. 这是因为厄他培南抗菌谱覆盖革兰阴性菌、革兰阳性菌及厌氧菌, 具有抗菌谱广、耐β-内酰胺酶、杀菌能力强的特点, 能够快速消除体内细菌, 从而促进身体较快恢复, 使机体免疫功能得到较快改善, 更有助于控制和减轻感染这也是本研究中研究组器官功能衰竭风险更小、疾病进展控制更好的重要因素. 本研究还显示, 研究组治疗3 d、7 d后APACHEⅡ评分、SOFA评分低于对照组(P<0.05), 可见相较于哌拉西林/他唑巴坦, 采用厄他培南联合甲硝唑在抑制cIAI病情进展, 改善患者预后方面更具优势. 此外, 细菌培养结果显示, 治疗后两组致病菌分布情况均较治疗前明显改善, 且研究组有四种致病菌未检测出, 而对照组有两种致病菌未检测出, 提示厄他培南联合甲硝唑抗菌能力更强, 但两组间无显著差异, 可能以样本量有关.
综上所述, 厄他培南联合甲硝唑治疗cIAI疗效更显著, 可有效控制病情, 减轻炎性反应, 改善患者免疫功能, 有助于促进病情恢复, 降低器官功能衰竭风险, 同时能减轻患者经济负担, 提高治疗安全性. 但目前临床关于此类研究较少, 选取样本量有限, 治疗结果会出现偏倚, 随着治疗方案的推广, 后续有待选取大样本量做进一步分析.
复杂性腹腔感染(complicated intra-abdominal infections, cIAI)病情较为严重, 临床治疗难度较大, 既往临床常采用手术联合抗生素治疗, 其中手术能快速清除积液, 改善腹腔环境, 联合抗生素以发挥抗菌作用, 提高临床疗效. 但抗菌药物使用过量或不当, 极易出现耐药性, 对患者预后造成不利影响. 因此, 合理使用抗菌药物, 对治疗cIAI及降低病死率均起着至关重要的作用.
厄他培南与哌拉西林/他唑巴坦均为β-内酰胺酶广谱类抗生素, 对cIAI术后感染可起到较好的抑制效果.本研究选取我院92例cIAI患者, 旨在进一步分析厄他培南联合甲硝唑的临床价值, 以期为cIAI的临床治疗提供理论依据.
本研究为了探究厄他培南治疗cIAI的临床价值, 通过不同用药方案对治疗效果进行对比观察, 并积极探讨对血清降钙素原(procalcitonin, PCT)、Toll样受体4(toll-like receptor 4, TLR-4)的影响.
选取2021-06/2023-01我院92例cIAI患者, 随机分为对照组和研究组, 两组入院后均予以一系列对症支持治疗, 于此基础上, 对照组采用哌拉西林/他唑巴坦联合甲硝唑治疗, 研究组采用厄他培南联合甲硝唑治疗. 比较两组治疗效果、康复情况、治疗费用、治疗前后血清炎症指标、T淋巴细胞亚群、APACHEⅡ评分、SOFA评分、不良反应、细菌培养结果的差异.
厄他培南联合甲硝唑治疗cIAI效果显著, 可减轻炎症反应, 改善免疫功能, 控制患者病情进展, 降低器官功能衰竭风险, 同时能减轻患者经济负担, 提高治疗安全性. 应用厄他培南联合甲硝唑治疗cIAI从临床和实验证明是有效的, 而且通过治疗疗效、血清[PCT、TLR-4、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、C反应蛋白(C-reactive protein, CRP)]水平、治疗费用、T淋巴细胞亚群、APACHEⅡ评分、SOFA评分、不良反应探讨了作用机制, 设计合理, 数据详实.
厄他培南联合甲硝唑治疗cIAI效果显著, 可减轻炎症反应, 改善免疫功能, 控制患者病情进展, 降低器官功能衰竭风险, 同时能减轻患者经济负担, 提高治疗安全性.
厄他培南联合甲硝唑在复杂性腹腔感染治疗中疗效显著. 通过综合分析血清炎症指标、T淋巴细胞亚群、康复情况及治疗费用, 我们认为该治疗方案可有效缩短康复时间、降低治疗成本, 设计合理, 数据详实, 具有较高的临床应用价值. 对临床具有指导意义, 对复杂性腹腔感染治疗的研究具有借鉴意义.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Ahmed S, Wilcox MH, Kirby A. Measuring outcomes in complicated intra-abdominal infections. Curr Opin Gastroenterol. 2020;36:1-4. [PubMed] [DOI] |
| 2. | Sartelli M, Coccolini F, Kluger Y, Agastra E, Abu-Zidan FM, Abbas AES, Ansaloni L, Adesunkanmi AK, Atanasov B, Augustin G, Bala M, Baraket O, Baral S, Biffl WL, Boermeester MA, Ceresoli M, Cerutti E, Chiara O, Cicuttin E, Chiarugi M, Coimbra R, Colak E, Corsi D, Cortese F, Cui Y, Damaskos D, De' Angelis N, Delibegovic S, Demetrashvili Z, De Simone B, de Jonge SW, Dhingra S, Di Bella S, Di Marzo F, Di Saverio S, Dogjani A, Duane TM, Enani MA, Fugazzola P, Galante JM, Gachabayov M, Ghnnam W, Gkiokas G, Gomes CA, Griffiths EA, Hardcastle TC, Hecker A, Herzog T, Kabir SMU, Karamarkovic A, Khokha V, Kim PK, Kim JI, Kirkpatrick AW, Kong V, Koshy RM, Kryvoruchko IA, Inaba K, Isik A, Iskandar K, Ivatury R, Labricciosa FM, Lee YY, Leppäniemi A, Litvin A, Luppi D, Machain GM, Maier RV, Marinis A, Marmorale C, Marwah S, Mesina C, Moore EE, Moore FA, Negoi I, Olaoye I, Ordoñez CA, Ouadii M, Peitzman AB, Perrone G, Pikoulis M, Pintar T, Pipitone G, Podda M, Raşa K, Ribeiro J, Rodrigues G, Rubio-Perez I, Sall I, Sato N, Sawyer RG, Segovia Lohse H, Sganga G, Shelat VG, Stephens I, Sugrue M, Tarasconi A, Tochie JN, Tolonen M, Tomadze G, Ulrych J, Vereczkei A, Viaggi B, Gurioli C, Casella C, Pagani L, Baiocchi GL, Catena F. WSES/GAIS/SIS-E/WSIS/AAST global clinical pathways for patients with intra-abdominal infections. World J Emerg Surg. 2021;16:49. [PubMed] [DOI] |
| 3. | 中华医学会外科学分会; 中国研究型医院学会感染性疾病循证与转化专业委员会; 中华外科杂志编辑部. 外科常见腹腔感染多学科诊治专家共识. 中华外科杂志. 2021;59:161-178. [DOI] |
| 5. | 蓝 海苟, 李 艳娟, 王 南斗, 刘 军华. 哌拉西林-他唑巴坦钠与甲硝唑联用对严重腹腔感染患者的疗效及其对炎性因子水平改善的影响. 抗感染药学. 2019;16:1465-1467. [DOI] |
| 6. | Pedraza R, Kieffer N, Guzmán-Puche J, Artacho MJ, Pitart C, Hernández-García M, Vila J, Cantón R, Martinez-Martinez L. Hidden dissemination of carbapenem-susceptible OXA-48-producing Proteus mirabilis. J Antimicrob Chemother. 2022;77:3009-3015. [PubMed] [DOI] |
| 9. | Hansted AK, Møller MH, Møller AM, Vester-Andersen M. APACHE II score validation in emergency abdominal surgery. A post hoc analysis of the InCare trial. Acta Anaesthesiol Scand. 2020;64:180-187. [PubMed] [DOI] |
| 10. | Matsuda J, Kato S, Yano H, Nitta G, Kono T, Ikenouchi T, Murata K, Kanoh M, Inamura Y, Takamiya T, Negi K, Sato A, Yamato T, Inaba O, Morita H, Matsumura Y, Nitta J, Yonetsu T. The Sequential Organ Failure Assessment (SOFA) score predicts mortality and neurological outcome in patients with post-cardiac arrest syndrome. J Cardiol. 2020;76:295-302. [PubMed] [DOI] |
| 11. | Scott LJ. Eravacycline: A Review in Complicated Intra-Abdominal Infections. Drugs. 2019;79:315-324. [PubMed] [DOI] |
| 12. | Yoon YK, Moon C, Kim J, Heo ST, Lee MS, Lee S, Kwon KT, Kim SW; Korean Society for Antimicrobial Therapy; Korean Society of Infectious Diseases. Korean Guidelines for Use of Antibiotics for Intra-abdominal Infections in Adults. Infect Chemother. 2022;54:812-853. [PubMed] [DOI] |
| 13. | Alikhan A, Sayed C, Alavi A, Alhusayen R, Brassard A, Burkhart C, Crowell K, Eisen DB, Gottlieb AB, Hamzavi I, Hazen PG, Jaleel T, Kimball AB, Kirby J, Lowes MA, Micheletti R, Miller A, Naik HB, Orgill D, Poulin Y. North American clinical management guidelines for hidradenitis suppurativa: A publication from the United States and Canadian Hidradenitis Suppurativa Foundations: Part I: Diagnosis, evaluation, and the use of complementary and procedural management. J Am Acad Dermatol. 2019;81:76-90. [PubMed] [DOI] |
| 15. | Academia EC, Jenrette JE, Mueller SW, McLaughlin JM. Evaluation of First-Dose, Intravenous Push Penicillins and Carbapenems in the Emergency Department. J Pharm Pract. 2022;35:369-376. [PubMed] [DOI] |
| 16. | Surat G, Vogel U, Wiegering A, Germer CT, Lock JF. Defining the Scope of Antimicrobial Stewardship Interventions on the Prescription Quality of Antibiotics for Surgical Intra-Abdominal Infections. Antibiotics (Basel). 2021;10. [PubMed] [DOI] |
| 17. | Abu Rahma MZ, Mahran ZG, Shafik EA, Mohareb DA, Abd El-Rady NM, Mustafa MA, Khalil M, Abo-Amer YE, Abd-Elsalam S. The Role of Serum Procalcitonin Level as an Early Marker of Ascitic Fluid Infection in Post Hepatitic Cirrhotic Patients. Antiinflamm Antiallergy Agents Med Chem. 2021;20:61-67. [PubMed] [DOI] |
| 18. | 海 峰, 郭 建凤, 岳 柯萌, 吴 超叶, 盖 东和, 成 伟霞. TNFα-308和TOLL样受体4基因多态性与老年胃癌根治术后腹腔感染和临床转归的关联. 中华医院感染学杂志. 2022;32:1712-1716. [DOI] |
| 19. | 刘 双庆(编译), 姚 咏明(审校). 免疫细胞数量和中性粒细胞/淋巴细胞比值对腹腔感染所致脓毒症患者28天病死率的预测价值. 中华烧伤与创面修复杂志. 2022;38:300-300. [DOI] |