修回日期: 2023-08-22
接受日期: 2023-09-01
在线出版日期: 2023-09-08
结肠癌的发病率及死亡率逐年上升. 对于Ⅱ期结肠癌, 目前大部分指南仅建议具有高危因素的患者进行化疗. 但是治疗决策往往受到资源限制和成本的影响, 因此从药物经济学角度评价化疗的受益情况至关重要.
评估高危Ⅱ期结肠癌患者化疗的成本-效用.
应用TreeagePro2011软件建立两个马尔科夫(Markov)模型分别代表化疗期和随访期. 以质量调整生命年(quality-adjusted life years, QALYs)衡量健康结果, 以增量成本-效用比(incremental cost effectiveness ratio, ICER)为治疗策略经济学效益的评价指标并对结果进行敏感性分析.
通过建立的无病生存期(disease free survival, DFS)曲线进行生存分析, Ⅱ期结肠癌患者可以从化疗中受益(P<0.0001). 亚叶酸/5-氟尿嘧啶/奥沙利铂(folinic acid/5-fluorouracil/oxaliplatin, FOLFOX)方案相比观察组的增量成本为27917.36元, 增量效用为1.47 QALY, 增量成本效用比为18913.88元/QALY. 当WTP = 216600元时, Monte Carlo模拟分析表明FOLFOX方案相比于观察组具有成本-效用的概率是100%.
具有高危因素的Ⅱ期结肠癌患者采用FOLFOX方案化疗具有较好的成本-效用.
核心提要: 本文从药物经济学角度探究高危Ⅱ期结肠癌各种化疗方案包括亚叶酸/5-氟尿嘧啶、亚叶酸/5-氟尿嘧啶/奥沙利铂(folinic acid/5-fluorouracil/oxaliplatin, FOLFOX)、卡培他滨/奥沙利铂方案的成本-效用. 研究结果发现, FOLFOX方案在延长无病生存期方面具有优势, 最具成本-效用, 推荐医疗决策者使用.
引文著录: 张霞, 尹瑞华, 金霞云, 郑红娟, 徐锡枫, 王庆华, 傅健飞. 高危Ⅱ期结肠癌不同化疗决策的成本-效用分析. 世界华人消化杂志 2023; 31(17): 742-752
Revised: August 22, 2023
Accepted: September 1, 2023
Published online: September 8, 2023
The incidence and death rates of colon cancer have been increasing year by year. Currently, most guidelines only recommend chemotherapy for stage Ⅱ colon cancer patients with high risk factors. However, treatment decisions are often influenced by resource constraints and cost, so it is important to evaluate the benefits of chemotherapy by cost-effectiveness analysis.
To evaluate the cost-effectiveness of chemotherapy in patients with high-risk stage Ⅱ colon cancer.
Two Markov models were established using Treeage Pro 2011 software to represent the chemotherapy period and follow-up period. Health outcomes were measured as quality-adjusted life years (QALYs). The incremental cost-effectiveness ratio (ICER) was used as the evaluation index of the economic benefits of the treatment strategy, and the sensitivity analysis was performed on the results.
Based on the disease free survival (DFS) curve, patients with stage Ⅱ colon cancer could benefit from chemotherapy (P < 0.0001). Compared with observation alone, the incremental cost of the folinic acid/5-fluorouracil/oxaliplatin (FOLFOX) regimen was 27917.36 yuan, the incremental effectiveness was 1.47 QALYs, and the ICER was 18913.88 yuan/QALY. When willingness-to-pay = 216600 yuan, Monte Carlo simulation analysis indicated that the FOLFOX regimen had a cost-effective probability of 100% compared to the observation group.
FOLFOX regimen is a more affordable option in China for patients with high-risk stage Ⅱ colon cancer.
- Citation: Zhang X, Yi RH, Jin XY, Zheng HJ, Xu XF, Wang QH, Fu JF. Cost-effectiveness of different chemotherapy strategies for high-risk stage Ⅱ colon cancer. Shijie Huaren Xiaohua Zazhi 2023; 31(17): 742-752
- URL: https://www.wjgnet.com/1009-3079/full/v31/i17/742.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i17.742
结肠癌的发病率及死亡率在全球癌症中位居前列[1]. 目前, 外科手术仍然是结肠癌患者获得根治的基础, 但手术不能彻底清除组织或血液中存在的微小转移灶. 因此, 有效的术后化疗是结肠癌获得长期生存的必要条件[2]. 辅助化疗是切除后Ⅲ期结肠腺癌的治疗标准, Ⅱ期结肠癌患者的辅助治疗仍是肿瘤学领域的一个争议. 目前大部分指南仅建议Ⅱ期伴有高危因素(T4、低分化、脉管浸润、神经浸润、术前肠梗阻或穿孔、切缘阳性、送检淋巴结不足12枚等)的结肠癌患者进行术后辅助化疗[3]. 当前应用于Ⅱ期结肠癌的化疗方案主要有亚叶酸/5-氟尿嘧啶(folinic acid/5-fluorouracil, LV/5FU)、亚叶酸/5-氟尿嘧啶/奥沙利铂(folinic acid/5-fluorouracil/oxaliplatin, FOLFOX)、卡培他滨/奥沙利铂(capecitabine/oxaliplatin, CAPEOX)方案[4-6]. QUASUA研究证实辅助化疗组的总生存期(overall survival, OS)及无病生存期(disease free survival, DFS)均显著提高, 首次证实了LV/5FU方案化疗可改善Ⅱ期患者预后[7]. Sargent等[8]对20800名Ⅱ期或Ⅲ期癌症患者进行分析发现与单纯观察相比, 接受辅助化疗的患者的8年生存率从66.8%提高到72.2%. MOSAIC和IDEA研究分别证实了奥沙利铂为基础的化疗方案在高危Ⅱ期结肠癌术后辅助化疗的作用[6,9]. 其中LV/5FU的化疗方案需接受氟尿嘧啶46 h持续静脉输注, 且患者需接受每2 wk一次的住院治疗, 而卡培他滨为口服制剂, 用药更为便捷.
病理危险因素和微卫星不稳定状态决定了II期结肠癌辅助治疗的选择, 但高危患者的治疗和预后仍存在差异[10]. 一旦接受化疗, 均会对患者生活造成影响, 无论是经济的损失还是化疗的毒性反应所造成的生活质量下降. 尽管上述这些研究发现化疗对高危Ⅱ期结肠癌辅助化疗的生存可能有益, 但仍不清楚由于成本和毒性, 这种益处是否超过了这种治疗的额外负担也是我们应该考虑的. 因此, 从药物经济学角度对Ⅱ期结肠癌化疗作出评估至关重要. 本研究通过模拟Ⅱ期结肠癌DFS曲线, 得到化疗对于Ⅱ期结肠癌患者受益情况, 再从中国医疗卫生角度出发, 运用Markov模型对高危Ⅱ期结肠癌的化疗方案进行成本-效用分析, 为临床提供用药指导, 为医疗卫生部门提供合理化建议.
首先进行文献筛选, 初筛出含有的高危Ⅱ期结肠癌患者化疗组与观察组的DFS曲线的文献, 入选标准: 行根治性结肠癌切除手术的患者, 术后病理或组织学检查证实为高危Ⅱ期结肠癌. 排除标准: (1)缺少诊断年龄、性别、种族、婚姻状况、分期、分化分级等信息; (2)年龄小于20岁或大于80岁; (3)多原发肿瘤; (4)术后存活时间少于1 mo; (5)接受放疗; (6)接受术前新辅助化疗. 然后进一步筛选, Kaplan-Meier(K-M)曲线下方需有特定时间点对应的numbers at risk资料以及文献中需报道观察期内的总事件数, 最终纳入3项研究. 其中, 5FU/LV方案纳入287例患者, 数据来源于MOSAIC研究[9]; CAPEOX方案纳入999例患者, 数据来源于IDEA研究[6]; FOLFOX方案纳入635例患者, 数据来源于IDEA研究[6]; 观察组纳入509名患者, 数据来源于IMPACTB2研究[11]. 利用Getdata软件提取出不同时间点所对应的DFS率, 利用R软件重构两个组别的单个患者数据(individual patient data, IPD)数据. 将从不同文献所得到的IPD整合在一起, 模拟出Ⅱ期结肠癌化疗组与观察组的生存曲线.
1.2.1 模型假设: 假设Ⅱ期结肠癌患者在手术后6 mo内均没有复发, 无论化疗与否, 随之进入随访期. 随访期模型分为三种状态: 无病生存状态, 复发状态, 死亡状态. 所有患者进入随访期的初始状态均为无病状态, 1个周期后在三种状态中分布, 无病可转换为复发状态, 无病状态和复发状态均可能转换至死亡状态. 在随访期模型中, 由于数据有限, 我们忽略了化疗组患者与观察组患者5年后复发概率的差异, 假设4种方案复发之后所使用的药物相同, 4组患者复发后的生存概率一致.
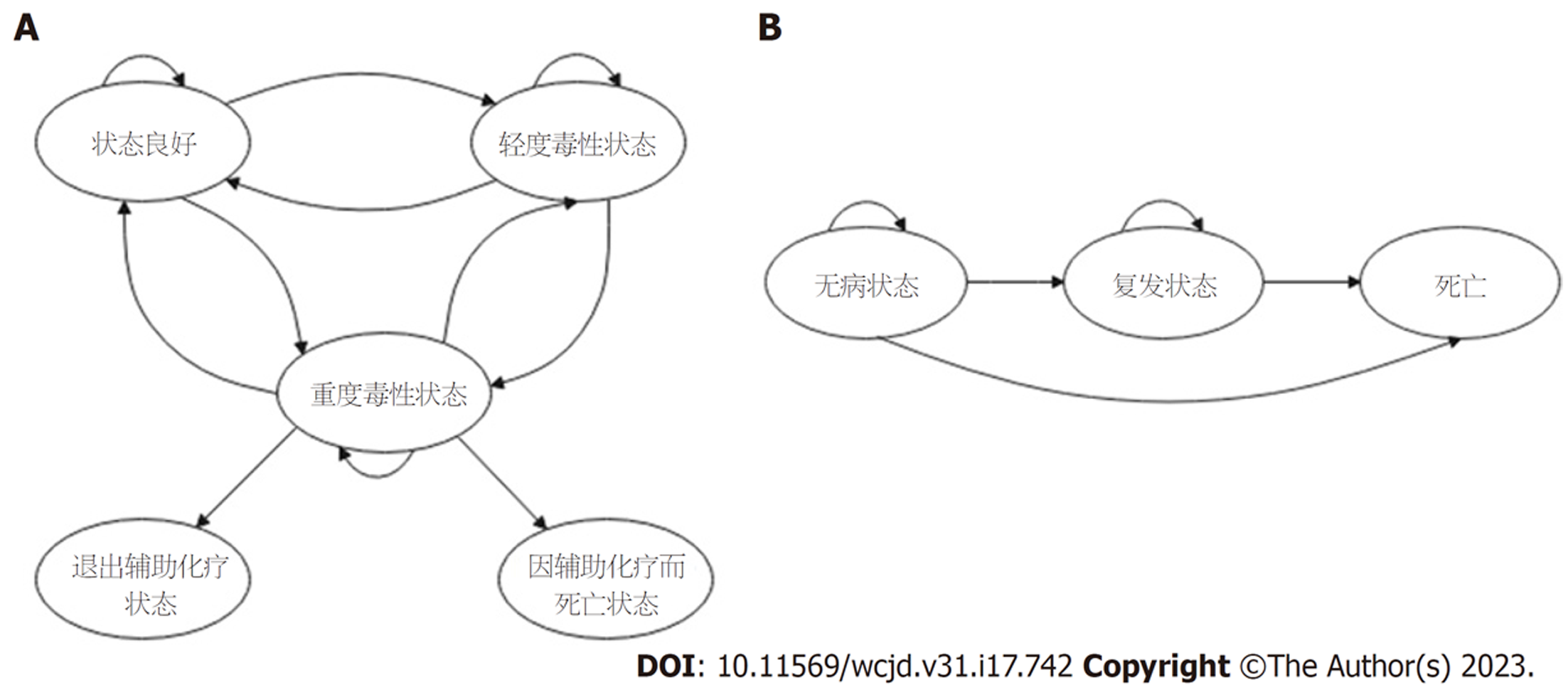
1.2.2 模型建立: 我们使用TreeAge Pro 2011软件针对具有高危因素的Ⅱ期结肠癌患者构建2个Markov模型, 分别代表化疗期与随访期. 假设模型中所有的病人均是具有高危因素的Ⅱ期结肠癌患者并已进行手术治疗, 中位年龄为60岁. 第1个Markov代表化疗期. 将Markov模型的周期长度设为1 mo, 化疗总时间设定为6 mo. 化疗方案包括LV/5FU、FOLFOX、CAPEOX方案. 化疗期包括5种状态: 良好、轻度毒性状态、重度毒性状态、退出辅助化疗状态和由于辅助化疗而死亡状态, 状态之间可以相互转化(图1A). 未接受辅助化疗的患者(观察组)手术后直接进入随访期. 接受辅助化疗的患者6 mo后进入随访期, 随访期为20年. 随访期Markov包括三个状态: 疾病稳定、疾病进展以及死亡(图1B). 模型主要效用指标为质量调整生命年(quality-adjusted life years, QALYs). 成本和效用贴现率均设为3%每年[12].
1.2.3 化疗方案: 假设患者依从性良好, 化疗期病人均完成6 mo化疗, 人体表面积以1.6 m2来计算用药剂量[13]. 药物剂量和疗程参考NCCN、ASCO、ESMO治疗指南, 规范选择剂量范围和疗程. LV/5FU方案每隔2 wk重复1次, 共12个周期, 包括在第1天静脉输注亚叶酸钙(400 mg/m2)、5-氟尿嘧啶(400 mg/m2), 然后在第1天时泵入5-Fu 2400 mg/m2, 持续泵入46 h. FOLFOX方案每隔2 wk重复1次, 共12个周期, 包括在第1天静脉输注奥沙利铂(85 mg/m2)、亚叶酸钙(400 mg/m2)、5-FU(400 mg/m2), 然后在第1天时泵入5-Fu 2400 mg/m2, 持续泵入46 h. CAPEOX方案每隔3 wk重复1次, 共8个周期, 包括第1天静脉滴注奥沙利铂(130 mg/m2) 2 h, 第1天至第14天口服卡培他滨(1000 mg/m2), 每天2次. 复发时各组均采用FOLFIRI方案化疗, 每隔2 wk重复1次, 共8个周期, 包括第1天静脉输注伊立替康(180 mg/m2)、亚叶酸钙(400 mg/m2)、5-FU(400 mg/m2), 然后在第1天泵入5-Fu 2400 mg/m2, 持续静脉输注46 h.
1.2.4 模型中各态之间的转移概率: 所有患者在辅助化疗开始时将所有病人均处于良好状态, 良好状态可以向其他任何状态转化(见图1). Pw, Pmi, Pma, Pq, Pd分别代表当前周期中状态良好、轻度毒性状态、重度毒性状态、退出辅助化疗状态和由于辅助化疗而死亡状态的概率. Pw-w、Pw-mi Pw-ma, Pmi-w、Pmi-mi Pmi-ma, Pma-w, Pma-mi, Pma-ma, Pma-q, 和Pma-d代表不同状态之间的转化概率[14,15]. 例如Pw-ma表示当前周期处于良好状态的患者在下一个周期变为重度毒性状态的概率, 具体数值详见表1. 随访期模型设置周期为1年, 随访期设置为20年, DFS状态到复发状态的转移概率原始数据来自于IDEA研究、MOSAIC研究、IMPACT B2研究所报道的DFS值. 用Getdata Version 2.20对原始数据进行提取, 用R 4.0.3根据提取的数据进行原始曲线的重现, 然后进行韦伯(Weibull)分布模拟, 与拟合出的原始曲线进行对比. 具体参数详见表2, 从无病至复发转移概率计算公式: P(t) = 1-exp[λ(t-1)γ-λtγ]16,17].
| 变量 | LV/5FU | FOLFOX | CAPEOX |
| Pw-w | 0.66 | 0.66 | 0.52 |
| Pw-mi | 0.31 | 0.31 | 0.46 |
| Pw-ma | 0.03 | 0.03 | 0.02 |
| Pmi-w | 0.36 | 0.36 | 0.32 |
| Pmi-mi | 0.32 | 0.32 | 0.4 |
| Pmi-ma | 0.32 | 0.32 | 0.28 |
| Pma-w | 0.1 | 0.1 | 0.1 |
| Pma-mi | 0.39 | 0.39 | 0.49 |
| Pma-ma | 0.3 | 0.3 | 0.2 |
| Pma-q | 0.2 | 0.2 | 0.2 |
| Pma-d | 0.01 | 0.01 | 0.01 |
| 状态 | Scale | Shape |
| LV/5FU组无病状态至复发状态 | 0.07 | 0.88 |
| FOLFOX组无病状态至复发状态 | 0.04 | 0.61 |
| CAPEOX组无病状态至复发状态 | 0.04 | 0.84 |
| 观察组无病状态至复发状态 | 0.09 | 0.75 |
| 复发状态至死亡状态 | 0.19 | 1.38 |
其中λ是比例参数(scale), γ是形状参数(shape), t代表循环的周期数. 从无病状态至死亡状态数据采用非肿瘤死亡的生命表. 从进展到死亡的概率同样通过上述方法进行weibull模拟, 原始数据取自FIRE-3试验的数据[18]. 从进展到死亡公式: 1-exp(-λ*t^γ).
1.2.5 成本组成: 化疗期的费用分为四部分: 直接化疗的成本, 治疗相关副作用的成本, 社会方面成本. 假设状态良好及轻度毒性状态不良反应治疗费用为0, 重度毒性状态及因不良反应退出化疗状态需要使用药物治疗不良反应. 治疗成本数据从金华市中心医院获取, 以体表面积1.6 m2来计算用药剂量, 治疗不良反应相关成本根据治疗不良反应药物价格计算. 随访期成本主要包括检验及影像学检查的费用, 根据浙江省医疗服务价格表大概估算出患者随访期所需花费. 假设复发后均采用FOLFIRI方案化疗, 同样以体表面积1.6 m2来计算用药剂量, 估算出复发所需费用(表3).
| 方案 | 直接化疗成本(1个疗程) | 不良反应费用(1 mo) | 社会费用(1 mo) | 随访费用(1年) | 复发费用(1年) |
| LV/5FU | 2300.256 | 30 | 1136 | 2500 | 47554.432 |
| FOLFOX | 2762.384 | 120 | 1136 | 2500 | 47554.432 |
| CAPEOX | 2397.078 | 30 | 267 | 2500 | 47554.432 |
| 观察组 | 0 | 0 | 0 | 2500 | 47554.432 |
1.2.6 效用值: 模型健康结果以QALYs来衡量, 方法是使用文献中提供的数值来估计各种状态的效用. 在化疗阶段, 对状态良好的患者的效用设为0.84, 与术后未进行辅助化疗的观察组相同[19]. 对于轻度毒性和重度毒性的效用, 参照文献分别设置为0.73, 0.59, 详见表4. 随访期无病状态效用值设置为0.84, 复发状态设置为0.47[20].
| 变量 | 取值 |
| 状态良好 | 0.84 |
| 轻度毒性 | 0.73 |
| 重度毒性 | 0.59 |
| 退出辅助化疗 | 0.47 |
| 因辅助化疗而死亡 | 0.00 |
| 无病 | 0.84 |
| 复发 | 0.47 |
| 死亡 | 0.00 |
1.2.7 敏感性分析: WHO规定, ICER<3倍人均GDP为具有成本-效用[21]. 本研究意愿支付值(willingness-to-pay, WTP)采用3倍中国人均GDP, 在我们的模型中WTP为216600元. 各个状态的效用值根据文献设定, 成本变化范围设定为±20%. 设定成本服从Gamma分布, 效用值服从Beta分布, 然后以Monte Carlo模拟的形式将模型运行1000次, 其结果里可接受曲线和增量成本-效用比散点图表示.
统计学处理 采用 Treeage Pro2011软件建立Markov模型, 进行成本效用分析; 采用R4.2.0软件进行weibull分布模拟及生存分析, 组间比较采用Log-rank检验, 以P<0.05为差异有统计学意义.
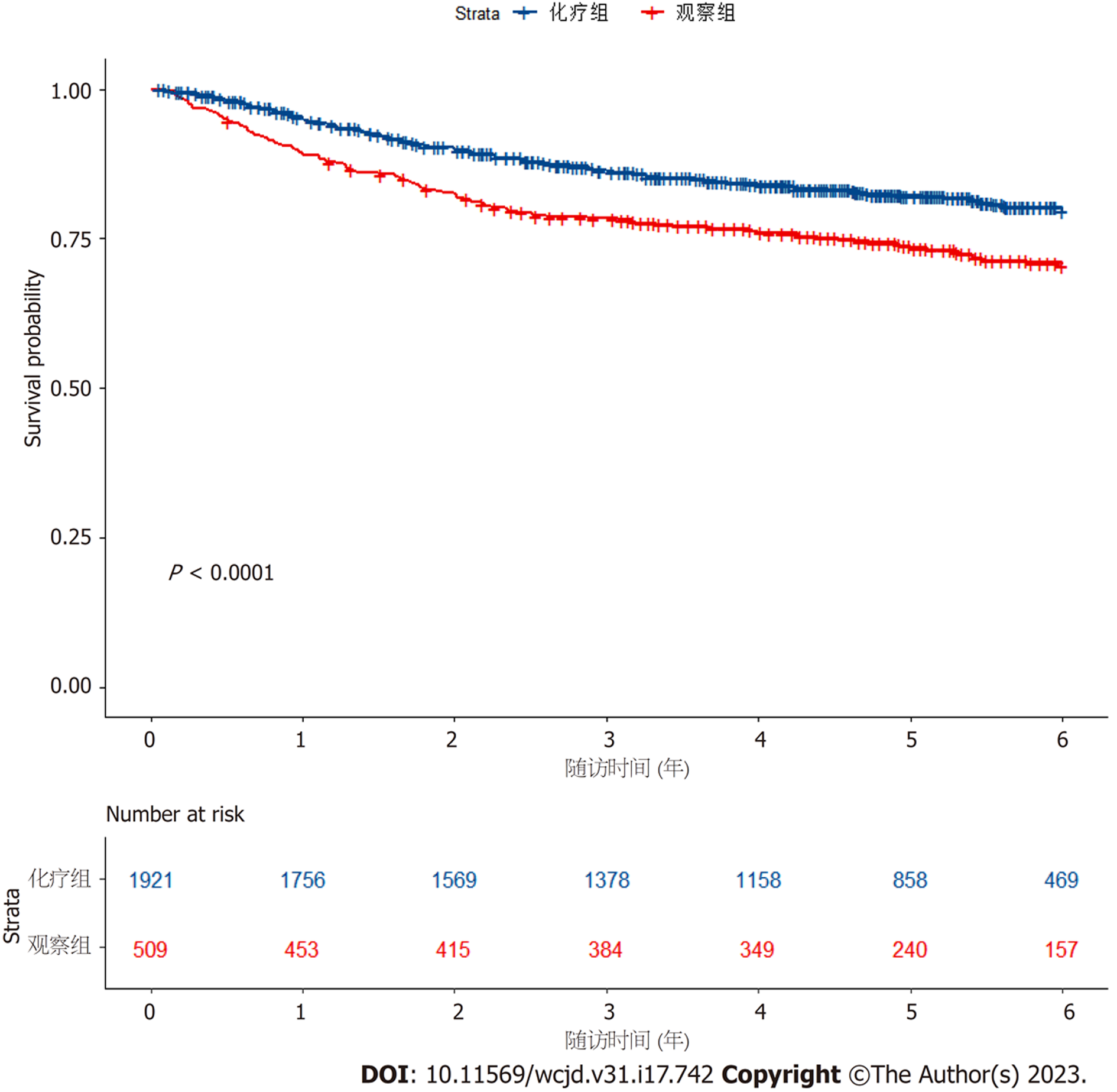
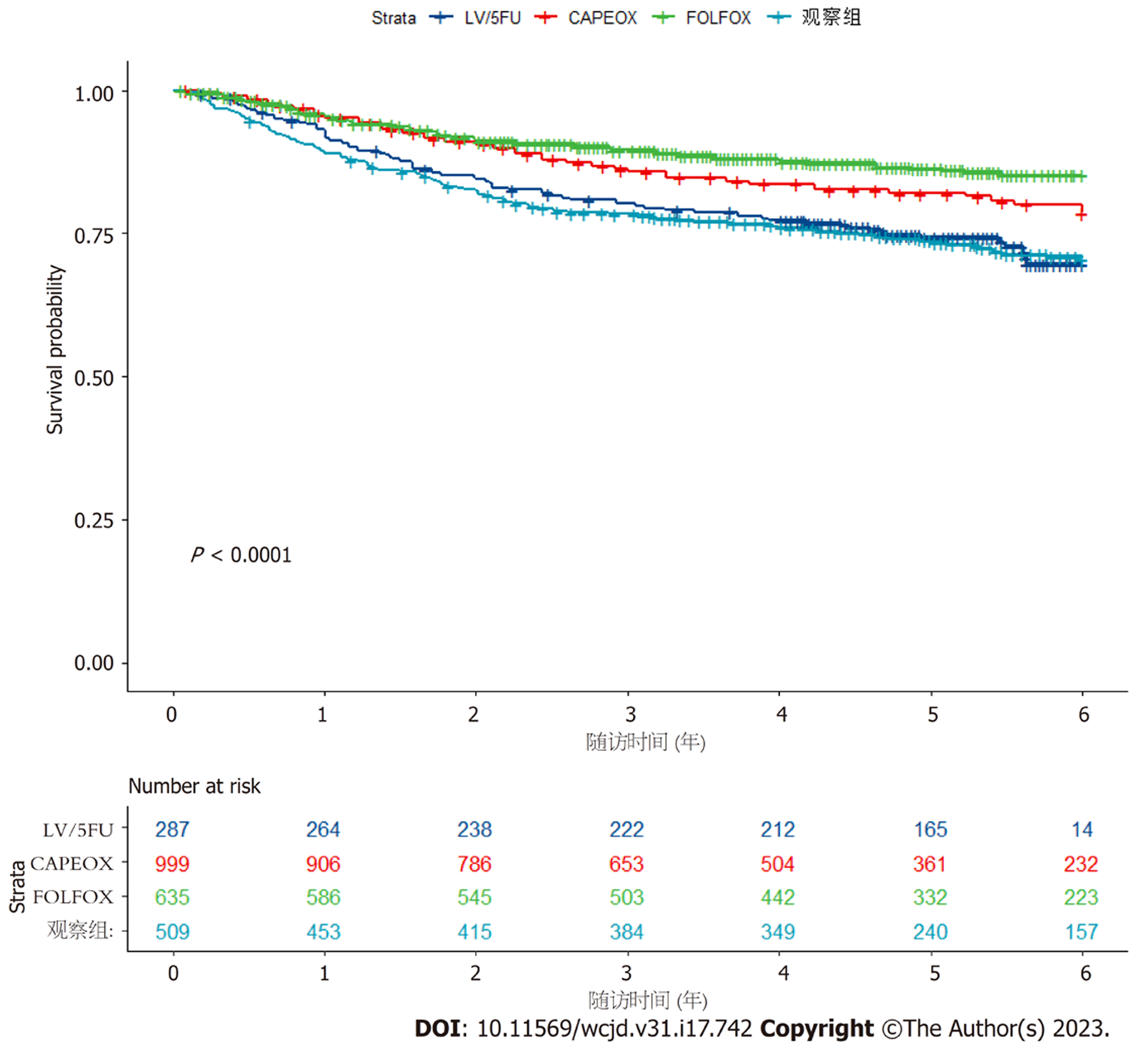
基于IDEA研究、MOSAIC研究及IMPACTB2研究, 利用R软件提取IPD构建DFS曲线. 其中, 化疗组入组3560名患者, 观察组入组509名患者(见图2). 结果显示, 术后辅助化疗可以提高高危Ⅱ期患者的DFS(P<0.0001). 如图3所示, 4种不同治疗方案所带来的受益不同, FOLFOX方案在提高患者无病生存期中具有优势(P<0.0001).
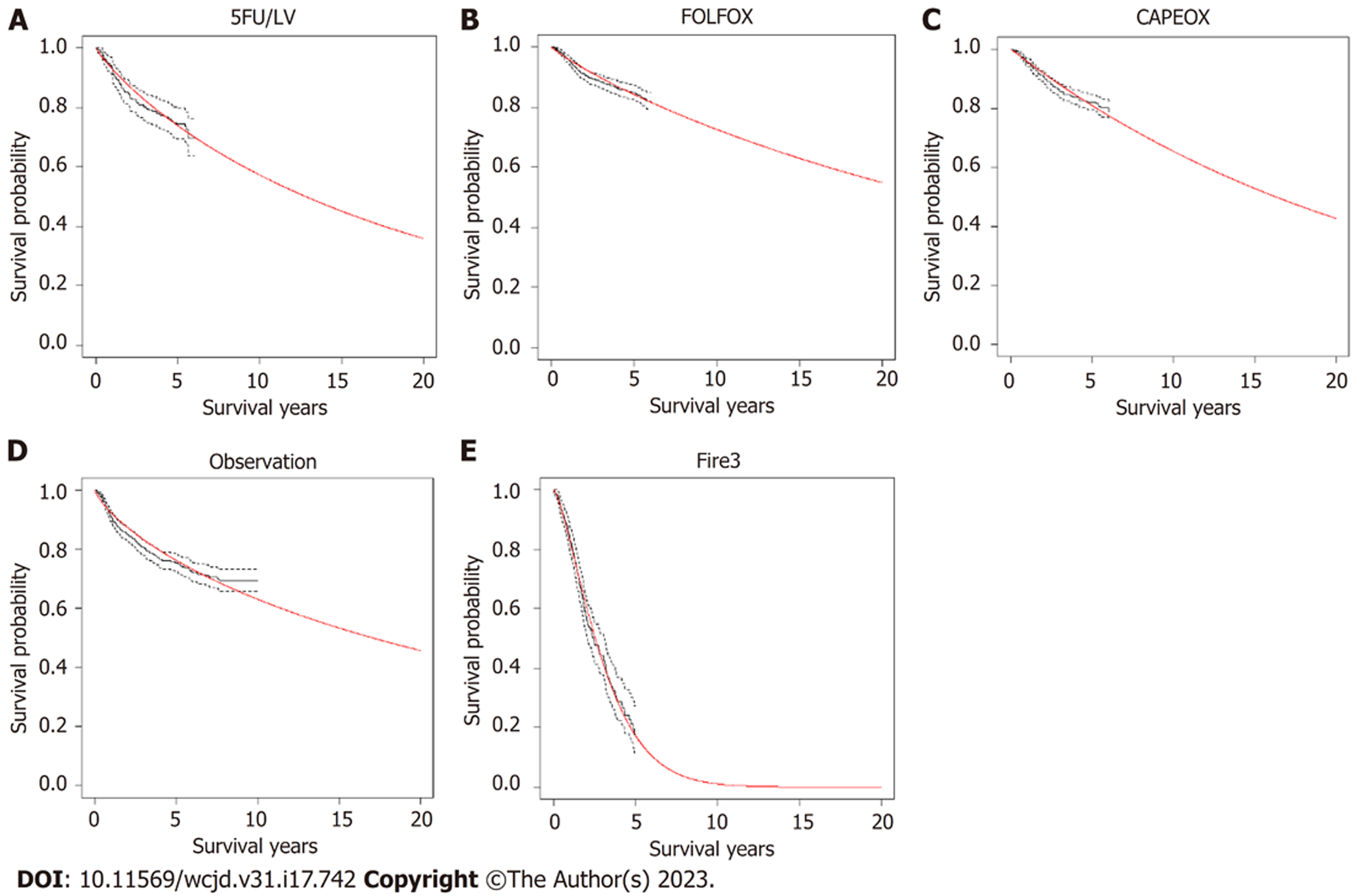
从无病状态到复发状态的转移概率根据Weibull分布模拟出曲线计算得到. Weibull模拟结果如图4所示, 与各个研究中DFS曲线相似.
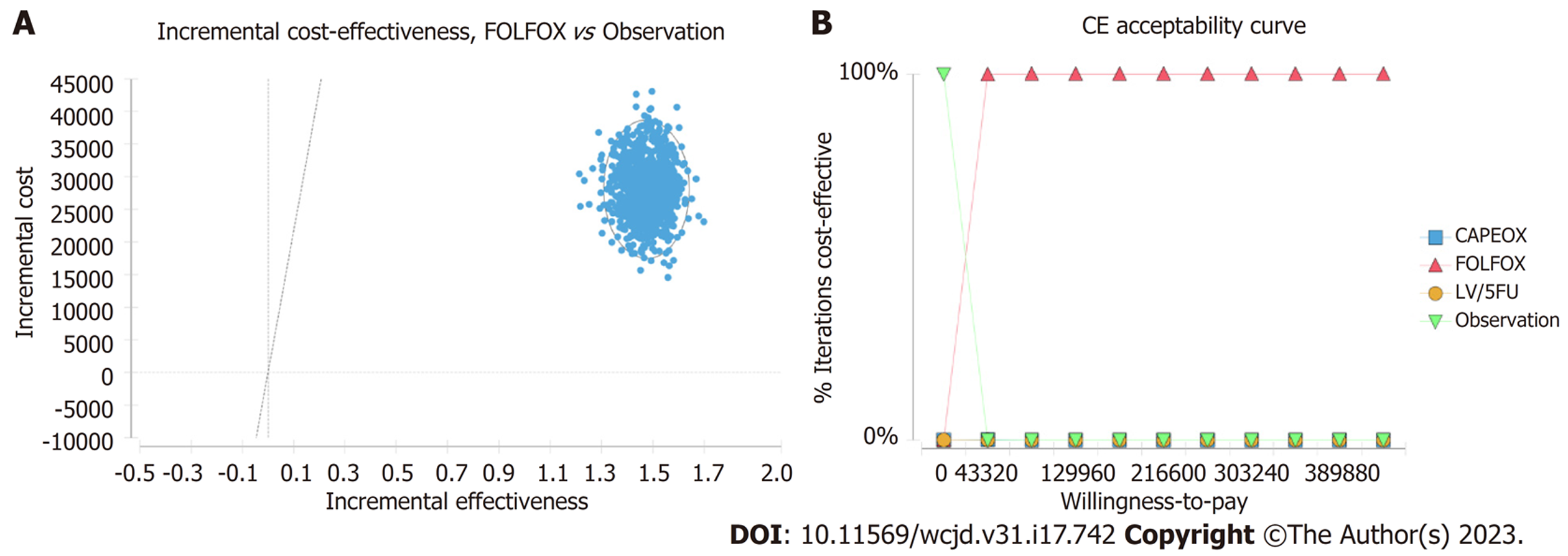
LV/5FU、FOLFOX、CAPEOX方案与观察组的总成本分别为86773.28元、76493.76元、61604.44元和48576.40元, 累计效用分别为7.77QALY、9.32QALY、8.62QALY和7.85QALY(表5). 在Ⅱ期结肠癌的化疗方案中, LV/5FU方案的增量效用成本比为负值, 属于绝对劣势方案. 如图5所示, 观察组、FOLFOX、CAPEOX方案在同一条直线上, 随着成本的增加, 所得到的效用值增大. FOLFOX方案的ICER值为18913.884元/QALY, 当WTP = 216600元/QALY, FOLFOX方案最具成本-效用.
| 变量 | LV/5FU | FOLFOX | CAPEOX | 观察组 |
| 总成本 | 86773.28 | 76493.76 | 61604.44 | 48576.40 |
| QALY | 7.77 | 9.32 | 8.62 | 7.85 |
| ICER | -478941.12 | 18913.88 | 16922.55 | 0 |
| WTP | 216600 | 216600 | 216600 | 216600 |
概率敏感性分析显示, FOLFOX方案相比于观察组具有成本-效用的概率是100%. 可接受曲线显示, 随着WTP的升高, FOLFOX方案具有成本-效用的概率越大, 观察组具有成本-效用的概率越小, 详见图6. 当WTP = 3GDP时, FOLFOX方案100%具有成本-效用.
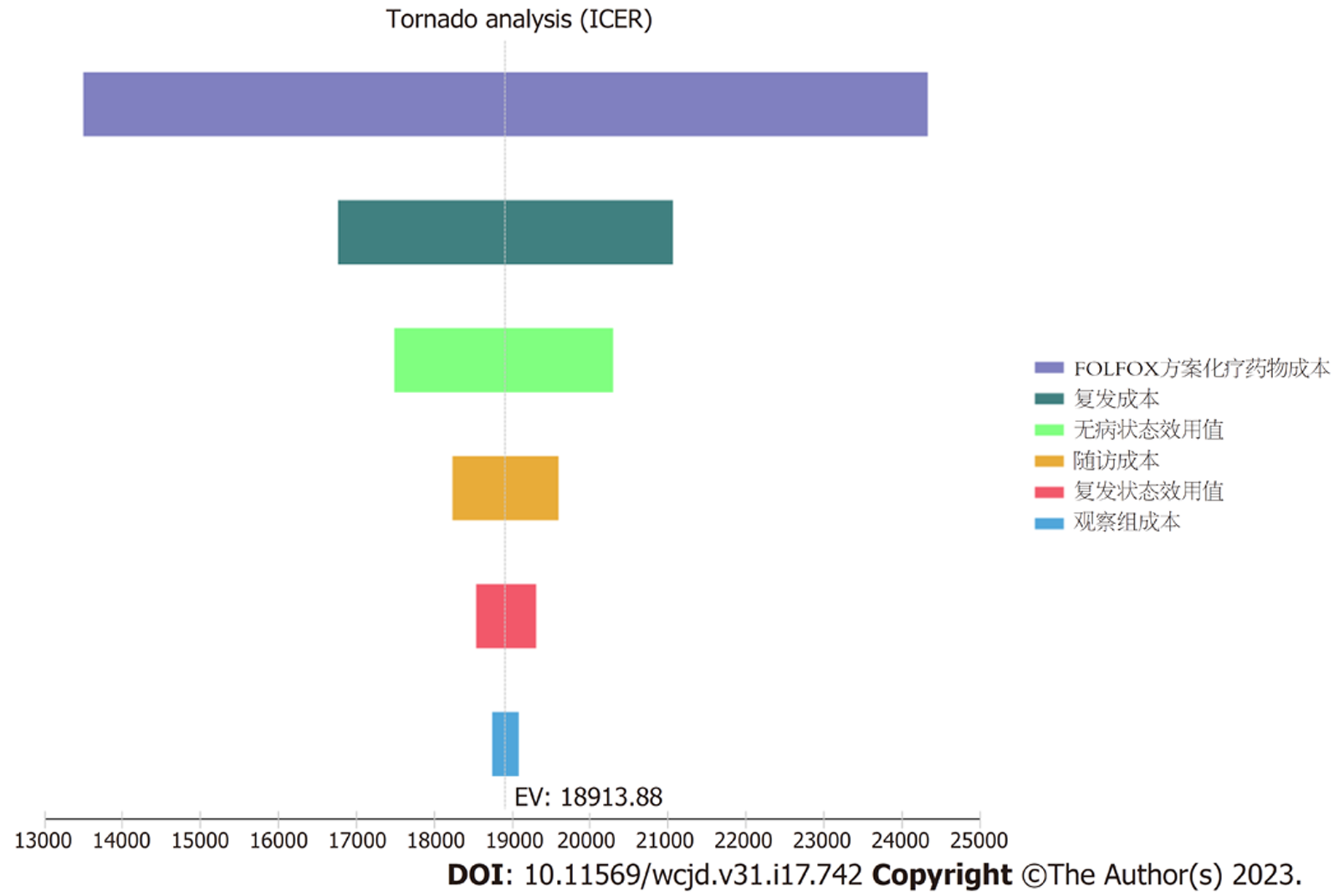
单因素敏感性分析显示, FOLFOX方案与观察组相比, 对结果影响最大的是FOLFOX方案的直接化疗费用, 其他影响模型的参数包括复发后的费用、随访期无病状态的效用值、随访费用、复发状态的效用值等, 各参数在其敏感性分析范围内变化对ICER值结果影响不大(图7).
Ⅱ期结肠癌患者是否化疗一直是争论的热点, 目前大部分研究得出的结论是具有高危因素的Ⅱ期结肠癌患者能通过辅助化疗受益[9,22,23]. 但是我们前期的研究表明, 化疗对于Ⅱ期结肠癌患者获益不明显, 并且甚至可能与较差的癌症特异性生存结果有关[24]. 目前应用于高危II期结肠癌的化疗方案主要有LV/5FU、FOLFOX、CAPEOX. 本研究运用Markov模型对高危II期结肠癌的化疗方案进行效价比分析, 以观察组作为对照, 结果显示LV/5FU方案的ICER值为负值, 属于绝对劣势方案, FOLFOX、CAPEOX方案相比观察组的ICER值分别为18913.88元/QALY和16922.55元/QALY. 由于在我们的模型中使用的一些参数具有不确定性, 我们对这些参数进行了敏感性分析. 单因素敏感性分析显示, 对模型影响最大的是FOLFOX方案的直接化疗药物成本. 概率敏感性分析显示, 相对于216600元/QALY的阈值, FOLFOX方案具有成本效果的概率为100%. 本研究采用Markov模型进行药物经济学评价, 将疾病按其对健康的影响分为若干种状态, 并以各个状态之间的转移几率来模拟疾病的发展, 并将其与各个状态的成本和效用值相结合, 从而得出疾病发展的结局和治疗费用.
本文利用R软件实现了原始文献中IPD的获取, 必须的原始资料包括K-M曲线, K-M曲线下方特定时间点对应的numbers at risk资料以及观察期内的总事件数[25]. 首先, 用Getdata软件提取不同时间点所对应的生存率, 再整理曲线下方不同月份所对应的numbers at risk数据, 将这两组数据总结成表, 利用R软件运行, 得到与原始曲线近乎一致的K-M曲线.
Xie等[26]对四川华西医院的Ⅲ期结肠癌患者进行回顾性研究, FOLFOX组与XELOX组1:1入组, 结果显示XELOX组的总成本为FOLFOX4的86.6%, 不良反应的发生率也低于FOLFOX组, 结果表明XELOX组更具成本-效用. 但其研究仅对成本进行比较, 两种化疗方案所带来的生存差异并未进行研究. Tse等[27]假设了在转移性结肠癌FOLFOX方案与XELOX方案疗效相当, 比较了两种方案化疗的总成本, 得出了XELOX方案更具更低的成本, 具体的成本-效用没有进行比较. Ayvaci等[15]参考了MOSAIC研究与QUASAR研究, 将全Ⅱ期结肠癌5FU/LV方案、FOLFOX方案与观察组进行比较分析, 结果显示5FU/LV方案的ICER值在不同年龄段均小于FOLFOX方案, 更具成本效益. 本研究首次将高危Ⅱ期结肠癌的三种基本化疗方案结合在一起, 与观察组进行比较, 结果显示, FOLFOX方案最具成本-效用. 将不同研究中的相同化疗方案数据整合, 减少了研究中的误差.
研究结果显示FOLFOX方案更具成本效益, 这与目前临床中大部分指南所推荐的方案存在偏差, 此结果产生原因有以下几个方面: (1)FOLFOX方案无病生存期优于CAPEOX方案; (2)药品成本来自于我国医保数据, 这与国外药品价格存在偏差, 计算出的总成本存在差别; (3)目前大多数Ⅱ期结肠癌效价比分析是以全Ⅱ期结肠癌患者为研究对象, 高危Ⅱ期结肠癌与全Ⅱ期结肠癌患者生存方面存在差异.
本研究也同样存在一些不足之处. 第一, 模型数据来源于国外临床研究, 不能详细了解每个病人的用药情况及个体差异, 通过Getdata及R软件模拟出曲线存在的一定的误差. 效用值得取值也来自于国外的文献报道, 与我国的真实情况也存在一定的差异. 第二, 间接化疗成本没有进行全面的统计, 通过估算得来, 与真实情况可能存在一定偏差, 今后将会进一步完善. 第三, 有部分不良反应未列入, 这是因为效价比分析研究的是增量成本, 不同方案间发生率差值较小的不良反应成本不会影响研究结论.
本研究从生存的角度和药物经济学的角度综合评价了Ⅱ期患者术后辅助化疗的价值. 研究证明, Ⅱ期结肠癌患者能从化疗中获益. 从中国医疗卫生角度出发, 在高危Ⅱ期结肠癌化疗方案中, FOLFOX方案ICER值低于国内3倍人均GDP, 具有较好的成本-效用, 推荐医疗决策者及临床医生进行使用.
关于Ⅱ期结肠癌, 是否需要辅助化疗仍处于争议之中, 化疗所造成的经济损失及生活质量下降不容忽视, 从药物经济学角度评价其作用至关重要.
关于Ⅱ期结肠癌各个化疗方案的成本-效用分析报道较少. 本研究结果有助于为Ⅱ期结肠癌患者治疗方案的选择提供数据支持.
证实高危Ⅱ期结肠癌患者可以从辅助化疗中获益, 明确最具成本-效用的化疗方案.
基于MOSAIC研究、IDEA研究及IMPACTB2研究, 应用TreeagePro2011软件建立Markov模型, 以质量调整生命年及增量成本-效用比对各个方案进行药物经济学评估, 通过敏感性分析证实研究结果的可信性.
亚叶酸/5-氟尿嘧啶/奥沙利铂(folinic acid/5-fluorouracil/oxaliplatin, FOLFOX)方案可改善高危Ⅱ期结肠癌患者的无病生存期, 其成本低于中国人群意愿支付阈值, 最具成本-效用; 敏感性分析结果提示FOLFOX方案相比于观察组具有成本效果的概率是100%.
FOLFOX方案推荐医疗决策者及临床医生进行使用.
目前对于各种抗肿瘤药物的研究层出不穷, 在关注其疗效的同时, 其造成的经济损失及毒副反应不容忽视, 在今后可继续通过药物经济学角度对抗肿瘤治疗进行分析.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020;70:7-30. [PubMed] [DOI] |
| 3. | Benson AB, Schrag D, Somerfield MR, Cohen AM, Figueredo AT, Flynn PJ, Krzyzanowska MK, Maroun J, McAllister P, Van Cutsem E, Brouwers M, Charette M, Haller DG. American Society of Clinical Oncology recommendations on adjuvant chemotherapy for stage II colon cancer. J Clin Oncol. 2004;22:3408-3419. [PubMed] [DOI] |
| 4. | Sargent D, Sobrero A, Grothey A, O'Connell MJ, Buyse M, Andre T, Zheng Y, Green E, Labianca R, O'Callaghan C, Seitz JF, Francini G, Haller D, Yothers G, Goldberg R, de Gramont A. Evidence for cure by adjuvant therapy in colon cancer: observations based on individual patient data from 20,898 patients on 18 randomized trials. J Clin Oncol. 2009;27:872-877. [PubMed] [DOI] |
| 5. | André T, Boni C, Mounedji-Boudiaf L, Navarro M, Tabernero J, Hickish T, Topham C, Zaninelli M, Clingan P, Bridgewater J, Tabah-Fisch I, de Gramont A; Multicenter International Study of Oxaliplatin/5-Fluorouracil/Leucovorin in the Adjuvant Treatment of Colon Cancer (MOSAIC) Investigators. Oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment for colon cancer. N Engl J Med. 2004;350:2343-2351. [PubMed] [DOI] |
| 6. | Iveson TS, Sobrero AF, Yoshino T. Prospective pooled analysis of four randomized trials investigating duration of adjuvant oxaliplatin-based therapy (3 vs 6 months) for patients with high-risk stage II colorectal cancer. J Clin Oncol. 2019;37:3501. |
| 7. | Quasar Collaborative Group; Gray R, Barnwell J, McConkey C, Hills RK, Williams NS, Kerr DJ. Adjuvant chemotherapy versus observation in patients with colorectal cancer: a randomised study. Lancet. 2007;370:2020-2029. [PubMed] [DOI] |
| 8. | Sargent D, Sobrero A, Grothey A, O'Connell MJ, Buyse M, Andre T, Zheng Y, Green E, Labianca R, O'Callaghan C, Seitz JF, Francini G, Haller D, Yothers G, Goldberg R, de Gramont A. Evidence for cure by adjuvant therapy in colon cancer: observations based on individual patient data from 20,898 patients on 18 randomized trials. J Clin Oncol. 2009;27:872-877. [PubMed] [DOI] |
| 9. | Tournigand C, André T, Bonnetain F, Chibaudel B, Lledo G, Hickish T, Tabernero J, Boni C, Bachet JB, Teixeira L, de Gramont A. Adjuvant therapy with fluorouracil and oxaliplatin in stage II and elderly patients (between ages 70 and 75 years) with colon cancer: subgroup analyses of the Multicenter International Study of Oxaliplatin, Fluorouracil, and Leucovorin in the Adjuvant Treatment of Colon Cancer trial. J Clin Oncol. 2012;30:3353-3360. [PubMed] [DOI] |
| 10. | Sargent DJ, Marsoni S, Monges G, Thibodeau SN, Labianca R, Hamilton SR, French AJ, Kabat B, Foster NR, Torri V, Ribic C, Grothey A, Moore M, Zaniboni A, Seitz JF, Sinicrope F, Gallinger S. Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer. J Clin Oncol. 2010;28:3219-3226. [PubMed] [DOI] |
| 11. | Efficacy of adjuvant fluorouracil and folinic acid in B2 colon cancer. International Multicentre Pooled Analysis of B2 Colon Cancer Trials (IMPACT B2) Investigators. J Clin Oncol. 1999;17:1356-1363. [PubMed] |
| 13. | Yang J, Han J, Zhang Y, Muhetaer M, Chen N, Yan X. Cost-effectiveness analysis of trastuzumab deruxtecan versus trastuzumab emtansine for HER2-positive breast cancer. Front Pharmacol. 2022;13:924126. [PubMed] [DOI] |
| 14. | Wen F, Yao K, Du ZD, He XF, Zhang PF, Tang RL, Li Q. Cost-effectiveness analysis of colon cancer treatments from MOSIAC and No. 16968 trials. World J Gastroenterol. 2014;20:17976-17984. [PubMed] [DOI] |
| 15. | Ayvaci MU, Shi J, Alagoz O, Lubner SJ. Cost-effectiveness of adjuvant FOLFOX and 5FU/LV chemotherapy for patients with stage II colon cancer. Med Decis Making. 2013;33:521-532. [PubMed] [DOI] |
| 16. | Diaby V, Adunlin G, Montero AJ. Survival modeling for the estimation of transition probabilities in model-based economic evaluations in the absence of individual patient data: a tutorial. Pharmacoeconomics. 2014;32:101-108. [PubMed] [DOI] |
| 17. | Zhang Q, Wu P, He X, Ding Y, Shu Y. Cost-Effectiveness Analysis of Camrelizumab vs. Placebo Added to Chemotherapy as First-Line Therapy for Advanced or Metastatic Esophageal Squamous Cell Carcinoma in China. Front Oncol. 2021;11:790373. [PubMed] [DOI] |
| 18. | Heinemann V, von Weikersthal LF, Decker T, Kiani A, Vehling-Kaiser U, Al-Batran SE, Heintges T, Lerchenmüller C, Kahl C, Seipelt G, Kullmann F, Stauch M, Scheithauer W, Hielscher J, Scholz M, Müller S, Link H, Niederle N, Rost A, Höffkes HG, Moehler M, Lindig RU, Modest DP, Rossius L, Kirchner T, Jung A, Stintzing S. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial. Lancet Oncol. 2014;15:1065-1075. [PubMed] [DOI] |
| 19. | Ayvaci MU, Alagoz O, Burnside ES. The Effect of Budgetary Restrictions on Breast Cancer Diagnostic Decisions. Manuf Serv Oper Manag. 2012;14:600-617. [PubMed] [DOI] |
| 20. | Camilleri-Brennan J, Steele RJ. The impact of recurrent rectal cancer on quality of life. Eur J Surg Oncol. 2001;27:349-353. [PubMed] [DOI] |
| 21. | Eichler HG, Kong SX, Gerth WC, Mavros P, Jönsson B. Use of cost-effectiveness analysis in health-care resource allocation decision-making: how are cost-effectiveness thresholds expected to emerge? Value Health. 2004;7:518-528. [PubMed] [DOI] |
| 22. | Casadaban L, Rauscher G, Aklilu M, Villenes D, Freels S, Maker AV. Adjuvant chemotherapy is associated with improved survival in patients with stage II colon cancer. Cancer. 2016;122:3277-3287. [PubMed] [DOI] |
| 23. | Lai Y, Wang C, Civan JM, Palazzo JP, Ye Z, Hyslop T, Lin J, Myers RE, Li B, Jiang B, Sama A, Xing J, Yang H. Effects of Cancer Stage and Treatment Differences on Racial Disparities in Survival From Colon Cancer: A United States Population-Based Study. Gastroenterology. 2016;150:1135-1146. [PubMed] [DOI] |
| 24. | Fu J, Wu L, Ge C, Xu T, Li D, Fu W, Wang L, Du J. De-escalating chemotherapy for stage II colon cancer? Therap Adv Gastroenterol. 2019;12:1756284819867553. [PubMed] [DOI] |
| 25. | Guyot P, Ades AE, Ouwens MJ, Welton NJ. Enhanced secondary analysis of survival data: reconstructing the data from published Kaplan-Meier survival curves. BMC Med Res Methodol. 2012;12:9. [PubMed] [DOI] |
| 26. | Xie Q, Wen F, Wei YQ, Deng HX, Li Q. Cost analysis of adjuvant therapy with XELOX or FOLFOX4 for colon cancer. Colorectal Dis. 2013;15:958-962. [PubMed] [DOI] |
| 27. | Tse VC, Ng WT, Lee V, Lee AW, Chua DT, Chau J, McGhee SM. Cost-analysis of XELOX and FOLFOX4 for treatment of colorectal cancer to assist decision-making on reimbursement. BMC Cancer. 2011;11:288. [PubMed] [DOI] |