修回日期: 2023-07-20
接受日期: 2023-08-03
在线出版日期: 2023-08-08
小肝癌(small hepatocellular carcinoma, SHCC)患者的治疗仍以手术为主, 早期治疗可明显改善患者的预后. 如何提高肝脏小病灶患者的SHCC的诊断率是临床医生面临的难题. 因此, 评估肝脏小病灶患者患小肝癌的风险并采取相应的干预措施对延长患者生存期至关重要.
本研究旨在通过临床常见指标初步建立肝脏小病灶术前评分系统, 并探索其在SHCC临床诊断中的应用价值.
回顾性分析2014-11/2022-12因肝脏小病灶在我院行手术治疗的243例患者的临床资料, 采用多因素Logistic回归分析筛选两组患者中具有显著性差异的变量, 并对根据筛选出的主要危险因素权重进行赋值, 建立肝脏小病灶术前评分系统, 最后采用受试者工作特征(receiver operating characteristic curve, ROC)曲线分析评估其诊断SHCC的效能.
Logistic回归分析显示, 合并病毒性肝炎、合并肝硬化、术前AFP水平升高、影像学诊断恶性肿瘤这4个变量与SHCC的发生具有显著性相关(P<0.05). ROC分析显示, 肝脏小病灶术前评分系统诊断恶性肿瘤的准确性为0.864, 临界值为3.5分, 再根据两组患者分值分布情况及ROC分析结果将患者发生SHCC的风险程度进行分级分析.
根据临床常用指标初步建立的肝脏小病灶术前评分系统对早期诊断肝脏小病灶良恶性具有较好的诊断效能.
核心提要: 根据临床常用指标初步建立的肝脏小病灶术前评分系统可以评估肝脏小病灶患者的小肝癌(small hepatocellular carcinoma, SHCC)患病风险并根据风险等级采取及时干预措施, 对早期预测SHCC并改善其预后具有重要临床意义.
引文著录: 王茜, 柴新群. 肝脏小病灶术前评分系统的建立及在小肝癌预测中的应用. 世界华人消化杂志 2023; 31(15): 638-646
Revised: July 20, 2023
Accepted: August 3, 2023
Published online: August 8, 2023
The treatment of small hepatocellular carcinoma (SHCC) is mainly based on surgical procedures, and early treatment can significantly improve the prognosis. How to improve the diagnostic rate of SHCC in patients with small liver lesions is a challenge faced by clinical doctors. Therefore, assessing the risk of SHCC in patients with small liver lesions and taking corresponding intervention measures are crucial for prolonging patient survival.
To evaluate the application value of a preoperative scoring system for small liver lesions established based on common clinical indicators in the clinical diagnosis of SHCC.
The clinical data of 243 patients with small liver lesions who underwent surgery at our hospital from November 2014 to December 2022 were retrospectively analyzed. Multivariate logistic regression analysis was used to screen the variables with significant differences between the two groups of patients, and the weights of the main risk factors were assigned according to the screened values. A preoperative scoring system for small liver lesions was established. Finally, receiver operating characteristic curve (ROC) analysis was performed to evaluate its efficacy in the diagnosis of SHCC.
Logistic regression analysis showed that four variables, including viral hepatitis, cirrhosis, preoperative AFP level elevation, and imaging diagnosis of malignant tumor, were significantly associated with the occurrence of SHCC (P < 0.05). ROC analysis showed that the accuracy of the preoperative scoring system for small liver lesions in the diagnosis of malignant tumors was 0.864, and the cut-off value was 3.5. Based on the distribution of scores and ROC analysis results of the two groups of patients, the risk of developing SHCC in patients can be graded and analyzed.
The preoperative scoring system of small liver lesions has good efficacy for early diagnosis of benign and malignant small liver lesions.
- Citation: Wang X, Chai XQ. Application of a preoperative scoring system for small liver lesions in predicting small hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2023; 31(15): 638-646
- URL: https://www.wjgnet.com/1009-3079/full/v31/i15/638.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i15.638
国家癌症中心公布的最新数据显示, 我国每年肝癌新发患者38万人左右, 死亡病例33.6万, 发病率居恶性肿瘤第4位, 死亡率居恶性肿瘤疾病第2位[1]. 由于该病发病隐匿, 早期多无明显症状, 大多数患者确诊已发展至中晚期, 治疗难度大且疗效差, 因此早期发现肝癌并及时治疗对改善患者预后非常重要. 小肝癌(small hepatocellular carcinoma, SHCC)一般指肿瘤直径小于3 cm的早期肝癌, 在中国, SHCC诊断标准为: 单个癌结节最大直径不超过3 cm; 多个癌结节数目不超过2个, 其最大直径总和小于3 cm[2]. 临床经验表明, 目前诊断微小肝癌和SHCC主要通过实验室结合影像学检查, 慢性肝炎及肝硬化病史是重要参考[3], 但存在一定的误诊、误治情况. 如何提高SHCC的诊断率, 避免肝脏良性肿瘤患者行不必要的肝脏手术、介入治疗、射频消融或经皮肝穿刺活检等有创操作, 提高肝脏良性肿瘤患者的生存质量, 目前仍是临床研究的一大难点. 本研究旨在通过243例肝脏小病灶患者的术前影像学检查、有无合并病毒性肝炎、有无合并肝硬化、术前血清AFP水平及病灶短期内有无增大初步建立术前评分系统, 综合评估肝脏小病灶患者肝脏肿瘤的良恶性以及是否需进行外科干预, 以期为肝脏小病灶的干预和治疗提供更精确的指导, 避免患者进行不必要的有创操作, 报告如下.
收集2014-11/2022-12我院因肝脏小病灶行手术治疗的243例患者作为研究对象, 经病理确诊肝脏恶性肿瘤185例(其中肝细胞癌172例, 胆管细胞癌11例, 混合型肝细胞癌-胆管细胞癌2例); 肝脏良性肿瘤58例(其中局灶结节性增生20例, 肝血管瘤11例, 肝硬化结节9例, 异型增生结节3例, 其他良性病变15例). 本研究获得华中科技大学同济医学院附属协和医院医学伦理委员会批准(编号: [2023]伦审0586字号).
纳入标准: (1)经过常规影像学检查发现的肝脏小病灶, 单个病灶最大直径低于3 cm; 多个病灶最大径之和低于3 cm, 数目低于2个; (2)经过手术处理有确切的病理诊断结果; (3)神志清醒, 智力正常, 可配合进行相关检查; (4)患者已获手术知情同意.
排除标准: (1)接受肝脏射频、微波消融或介入等治疗; (2)对造影剂过敏; (3)妊娠期及哺乳期妇女; (4)合并心、肺、肾等重要脏器严重疾病; (5)合并其他恶性肿瘤.
通过比较分析两组患者的一般临床资料包括年龄、性别、体质指数、肥胖(体质指数≥30 kg·m-2)、有无合并慢性疾病(高血压、糖尿病、冠心病等)、有无临床表现, 以及影像学检查、患者术前肝功能Child分级、术前AFP水平、有无合并病毒性肝炎、有无合并肝硬化、病灶短期内有无增大等, 采用多因素Logistic 回归分析筛选预测SHCC发生的主要危险因素. 根据上述多因素回归结果以及临床经验初步建立肝脏小病灶术前评分系统, 采用受试者工作特征(receiver operating characteristic, ROC)曲线分析评估本评分系统的诊断SHCC效能并获得最佳临界值, 根据分值分布情况及ROC分析结果将患者SHCC的发生风险进行分级分析.
(1)合并病毒性肝炎: 包括乙肝患者、乙肝病毒携带者、丙肝患者、丙肝病毒携带者等; (2)合并肝硬化: 包括病毒性肝硬化、酒精性肝硬化、血吸虫性肝硬化等; (3)病灶短期内增大: 根据实体瘤疗效评价标准(RECIST1.1)判定肝脏小病灶患者的病灶大小在1 mo-3 mo内较基线或最低值增大≥20%(直径绝对值至少增加5 mm)为病灶短期内增大阳性表现[4]; (4)术前AFP水平: 将术前AFP水平进行分级: 设定AFP<20 ng/L为阴性; 20 ng/L<AFP≤200 ng/L为阳性; AFP>200 ng/L为强阳性[5]; (5)影像学检查: 超声造影、增强CT、增强MRI检查均对SHCC均有较好诊断价值[6-8], 将影像学诊断结果进行分级评估, 增强CT/MRI或超声造影提示肝脏小病灶为良性病变设定为阴性, 增强CT/MRI或超声造影提示肿瘤性病变设定为阳性, 增强CT/MRI或超声造影提示恶性病变设定为强阳性.
统计学处理 采用SPSS 26.0统计软件进行数据处理. 计量资料以mean±SD表示, 组间比较采用t检验, 计数资料以n(%)表示, 组间比较用χ2检验. 多因素Logistic回归分析筛选主要危险因素, 纳入标准0.10, 剔除标准0.05, 采用逐步后退法. 根据Logistic回归分析结果及临床经验建立定肝脏小病灶术前评分系统, ROC分析评估诊断效能并获得最佳临界值, 以曲线下面积(area under the curve, AUC)表示准确性, aP<0.05为差异有统计学意义.
两组患者的一般临床资料比较, 除年龄、性别外, 余临床资料差异无统计学意义. 见表1.
| 资料 | 恶性组 | 良性组 | t/χ2值 | P值 | |
| 年龄 | 55.62±11.43 | 45.60±11.21 | 5.849 | <0.001 | |
| 性别 | 男 | 154(83.2) | 32(55.2) | 19.379 | <0.001 |
| 女 | 31(16.8) | 26(44.8) | |||
| 体质指数 | 23.53±3.12 | 24.11±3.41 | -1.22 | 0.226 | |
| 肥胖 | 4(2.2) | 5(8.6) | 3.512 | 0.061 | |
| 慢性疾病 | 35(18.9) | 8(13.8) | 0.797 | 0.372 | |
| 合并临床表现 | 60(32.4) | 16(27.6) | 0.482 | 0.487 | |
恶性肿瘤组合并病毒性肝炎、合并肝硬化、术前AFP水平升高、影像学诊断恶性肿瘤的发生率明显高于良性肿瘤组, 差异有统计学意义(aP<0.05). 见表2.
| 因素 | 恶性组 | 良性组 | χ2值 | P值 |
| 合并病毒性肝炎 | 157(84.9) | 16(27.6) | 70.3 | <0.001 |
| 合并肝硬化 | 131(70.8) | 14(24.1) | 40.0 | <0.001 |
| 术前AFP阳性 | 99(53.5) | 6(10.3) | 33.5 | <0.001 |
| 影像学诊断阳性 | 182(98.4) | 40(69.0) | 48.4 | <0.001 |
| 病灶短期内增大 | 5(2.7) | 2(3.4) | 0.0 | 1.000 |
Logistic回归分析显示, 合并病毒性肝炎、合并肝硬化、术前AFP水平升高、影像学诊断恶性肿瘤、年龄是SHCC发生的独立危险因素(aP<0.05), 而性别并非SHCC发生的独立危险因素. 根据上述分级标准将术前AFP水平及术前影像学诊断进行分级, 并分析不同等级与SHCC发生的相关性, 结果显示术前AFP水平及影像学诊断的分级水平越高, SHCC的发生率越高. 见表3.
| 因素 | β值 | Wald值 | P值 | OR值 | 95%CI |
| 年龄 | 0.71 | 23.118 | 0.00 | 1.074 | 1.043-1.105 |
| 性别 | 1.327 | 13.872 | 0.174 | 1.993 | 0.737-5.390 |
| 合并病毒性肝炎 | 1.705 | 14.969 | 0.000 | 5.501 | 2.319-13.048 |
| 合并肝硬化 | 0.850 | 3.667 | 0.047 | 2.340 | 0.980-5.586 |
| 术前AFP水平 | - | 6.166 | 0.046 | - | - |
| 阳性 | 0.974 | 3.117 | 0.047 | 2.649 | 0.898-7.812 |
| 强阳性 | 2.052 | 3.755 | 0.043 | 7.780 | 0.977-61.959 |
| 影像学诊断 | - | 12.097 | 0.002 | - | - |
| 阳性 | 2.239 | 7.694 | 0.006 | 9.388 | 1.929-45.688 |
| 强阳性 | 2.635 | 12.039 | 0.001 | 13.944 | 3.147-61.775 |
根据Logistic回归分析结果, SHCC发生的主要独立危险因素有合并病毒性肝炎、合并肝硬化、术前AFP阳性、影像学诊断阳性. 年龄虽为SHCC发生的独立危险因素, 但是与SHCC发生的相关性较低, 认为年龄并非SHCC发生的主要独立危险因素, 因此不纳入评分标准. 另外, 病灶短期内增大这一指标尽管在两组中差异无统计学意义, 原因是大部分患者为初诊且病例数少, 但根据临床经验仍判定其为SHCC发生的独立危险因素. 根据Logistic回归分析结果分析相关独立危险因素与SHCC发生的相关性, 并对筛选出的主要危险因素权重进行赋值, 总评分10分. 见表4.
| 因素 | 异常程度 | ||
| 0 | 1 | 2 | |
| 病毒性肝炎 | 无 | / | 有 |
| 肝硬化 | 无 | / | 有 |
| AFP | 正常范围 | <200 | >200 |
| 影像学诊断 | 良性 | 肿瘤性病变 | 恶性肿瘤 |
| 病灶短期内增大 | 无 | / | 有 |
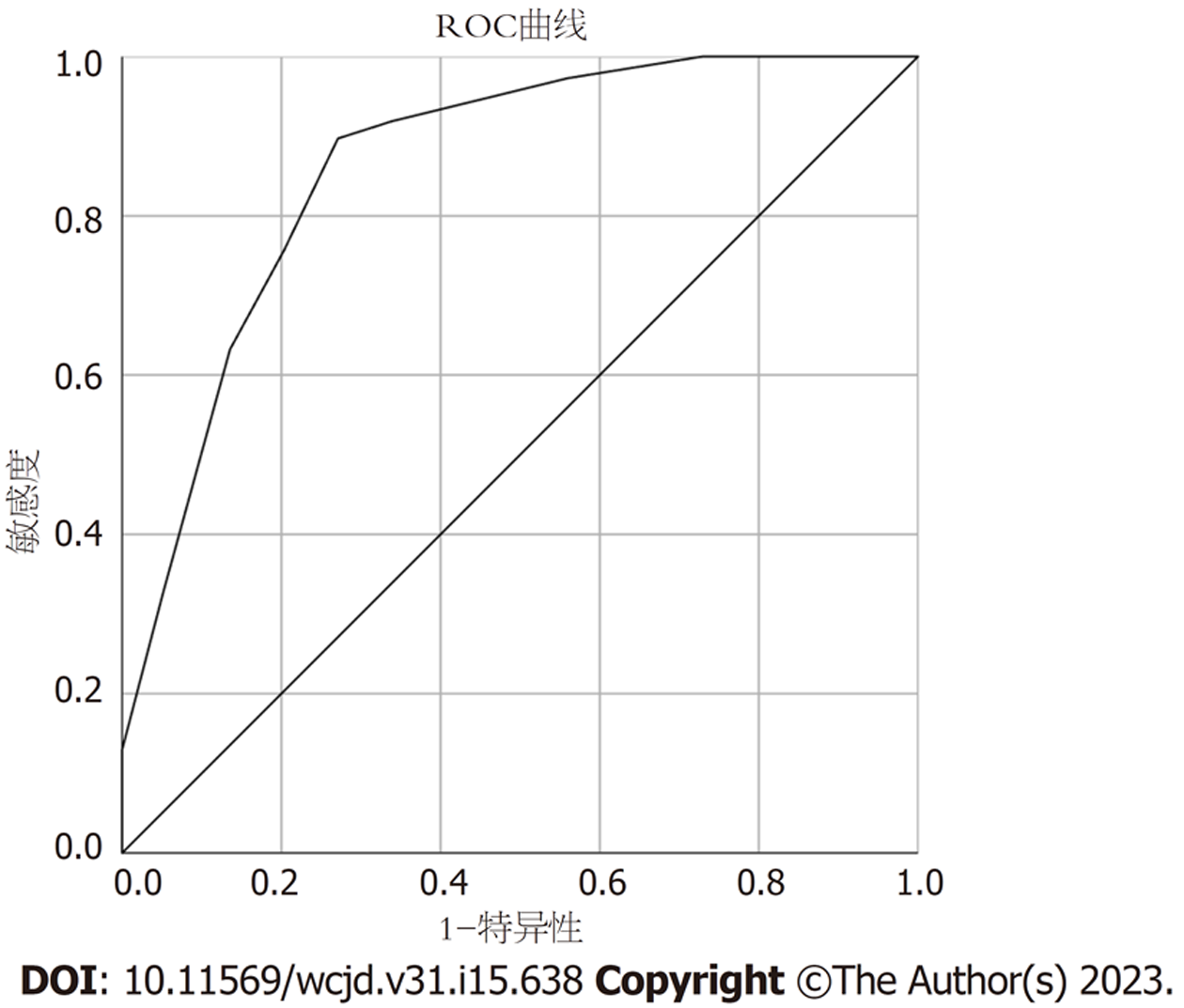
根据筛选主要危险因素权重进行赋值, 总评分10分. ROC分析显示, 肝脏小病灶术前评分系统诊断恶性肿瘤的准确性0.864, 95%CI: 0.805-0.922, aP<0.001, 敏感性为89.7%, 特异性为72.9%, 临界值为3.5分, 即大于等于4分即可高度怀疑为恶性肿瘤. 见图1.
根据评分系统将两组患者的信息进行统计. 见表5. 根据分值分布情况可以得出, 评分分值越高, 确诊恶性肿瘤的可能性越大. 根据ROC分析结果以及分值分布情况, 将患者发生SHCC的危险程度进行分级: 0-3分为低风险; 4-5分为中风险; 6-10分为高风险. 见表6.
| 分值 | 恶性肿瘤组 | 良性肿瘤组 |
| 0 | 0 | 15 |
| 1 | 5 | 10 |
| 2 | 10 | 13 |
| 3 | 4 | 3 |
| 4 | 26 | 4 |
| 5 | 23 | 5 |
| 6 | 57 | 5 |
| 7 | 36 | 3 |
| 8 | 24 | 0 |
| 合计 | 185 | 58 |
| 恶性肿瘤组 | 良性肿瘤组 | 合计 | |
| 低风险(0-3) | 19 | 41 | 60 |
| 中风险(4-5) | 49 | 9 | 58 |
| 高风险(6-10) | 117 | 8 | 125 |
根据该评分系统将SHCC的发病风险进行分级, 发生SHCC低风险组60例, 中风险组58例, 高风险组125例. 在低风险组中, 病理确诊恶性肿瘤19例, 良性肿瘤41例, 恶性肿瘤发生率为31.7%; 在中风险组中, 病理确诊恶性肿瘤49例, 良性肿瘤9例, 恶性肿瘤发生率为84.5%; 在高风险组中, 病理确诊恶性肿瘤117例, 良性肿瘤8例, 恶性肿瘤发生率为93.6%. 见表7.
| 金标准 | 术前评分系统 | 合计 | ||
| 低风险 | 中风险 | 高风险 | ||
| 病理 | ||||
| 恶性组 | 19 | 49 | 117 | 185 |
| 良性组 | 41 | 9 | 8 | 58 |
| 合计 | 60 | 58 | 125 | 243 |
SHCC是肝癌的早期阶段, 具有特殊的生物学行为及病理学特征[9]. SHCC患者早期无特征性临床表现, 部分患者体检时发现, 早期诊断有一定的困难, 多数患者确诊时已属进展期, 预后较差. SHCC患者早期确诊并接受有效治疗后, 能明显改善预后, 延长患者的生存期[3,10]. 因此早发现、早诊断对SHCC患者的诊治具有重要临床意义.
正常肝组织的血供是双重的, 一套营养血供系统, 由肝动脉供血; 一套功能血供系统, 由门静脉供血; 血供比例为: 肝动脉占20%-25%, 门静脉占70%-80%. 由于肝癌组织没有正常肝功能, 0.5 cm-3.0 cm大小的肝细胞癌主要由肝动脉供血, 因此在肝动脉期进行成像, 肿瘤与肝实质之间有明显差异, 易于检出和定性, 这是诸多影像学检查方法诊断SHCC的理论基础. 目前临床上对于肝脏小病灶的诊断仍多使用常规超声作为初筛检查, 根据美国肝病研究学会(AASLD)指南推荐诊断SHCC的一线影像学检查手段为增强CT或MRI检查, 超声造影为二线检查手段[8,11-13], 但是相关研究证实3种影像学检查方式对SHCC均有较好诊断价值.超声造影可以实时动态监控肝脏疾病微循环灌注情况, 有助于病灶性质的判断, 对局灶性病变有着较高的诊断准确率[14]; 增强CT可以明确肝脏病灶周边及内部血流分布、微血管分布密度等特征, 并对病灶性质进行评估; 增强MRI具有成像序列类型多样性、成像质量高及分辨率高等优势, 可提高早期微SHCC、SHCC的病灶检出效果, 综合提升临床诊断效果[15,16], 以上3种影像学检查方式在SHCC诊断中具有互补效果. 虽然常规影像学检查例如超声造影、增强CT、增强MRI诊断SHCC的灵敏度均较高, 超声造影诊断SHCC的灵敏度为97.4%, 增强CT诊断SHCC的灵敏度为95.5%, 增强MRI诊断SHCC的灵敏度为98.7%, 但SHCC的总体影像学早期诊断的灵敏度仅为47%, 在本研究中, 影像学诊断恶性肿瘤的敏感性高达98.3%, 但是特异性仅为31.0%, 证实仅凭影像学诊断不能临床确诊SHCC, 需结合其他检查进一步明确诊断.而肝细胞癌特异性肿瘤标志物如AFP虽作为原发性肝脏恶性肿瘤早期诊断的重要指标, 特异度可达93.3%, 但是在SHCC的早期诊断中假阴性率较高, 诊断的灵敏度仅为 52.9%[17-19]. 此外, 肝细胞癌是肝脏恶性肿瘤最常见类型, 慢性病毒性肝炎HBV及HCV为其公认的主要病因[20-22]. 相关研究发现, 慢性肝炎肝硬化与SHCC关系密切. 最初时患者主要为慢性病毒性肝炎起病, 若未及时控制, 随着病情进展逐渐发展为肝硬化, 而肝硬化再生结节的进展规律为从低级别不典型结节到高级别不典型结节, 最终形成SHCC, 在这个过程中肝血窦的逐渐毛细血管化, 使肝组织血供发生明显改变, 肝动脉供血逐渐增加, 门静脉供血则逐渐减少[23-26]. 因此目前临床上诊断微SHCC和SHCC主要通过实验室检查结合影像学检查, 慢性肝炎及肝硬化病史是重要参考. 相关医师的临床经验也会影响对SHCC的诊断, 造成一定的误诊、误治.
针对肝脏小病灶目前还没有统一的诊疗方案, 致使目前临床上对于肝脏小病灶的处置方式缺乏规范性, 既往报道显示经皮肝穿刺活检是临床诊断肝脏局灶性病变的金标准[27], 因而部分临床医生为了确定病理性质采用常规超声、增强CT/MRI等引导下行经皮肝穿刺活检. 值得注意的是该操作存在较多的严重并发症如肿瘤针道转移、出血、气胸等, 且大多数患者有肝硬化、门静脉高压、凝血功能障碍等合并症, 盲目进行经皮肝穿刺活检可能导致针道大出血, 严重时可危及患者生命. 此外, 常规影像学例如常规超声、增强CT/MRI受肿瘤类型(弥漫性或结节)、大小、位置、操作者的经验等限制, 可能导致穿刺活检结果呈现假阴性[28]. 另外, 部分临床医师会采用PET CT/MRI来鉴别肝脏小病灶的良恶性, 但利用正电子发射计算机断层扫描技术对肝脏恶性肿瘤进行检查, 分辨率较低, 成像清晰度较差, 因而使其在诊断肝脏恶性肿瘤敏感度相对较低, 尤其在SHCC中表现明显, 具有一定的局限性[29,30], 所以PET CT/MRI不建议作为SHCC的影像学诊断的常规检查.综上所述, 为避免肝脏良性肿瘤患者进行不必要的手术或者其他如微波消融、介入手术、经皮肝穿刺活检等有创操作, 也为防止部分肝脏恶性肿瘤患者因误诊而错失最佳治疗时机, 本研究通过临床常见指标, 初步建立肝脏小病灶术前评分系统, 用以早期鉴别肝脏肿瘤的良恶性, 探索其在SHCC预测的应用价值, 以期为肝脏小病灶的干预和治疗提供更精确的指导.
研究结果显示, 恶性肿瘤组的病毒性肝炎、肝硬化、AFP增高、影像学诊断恶性肿瘤的发生率明显高于良性肿瘤组(P<0.05). Logistic回归分析显示, 合并病毒性肝炎、合并肝硬化、术前AFP水平升高、影像学诊断恶性肿瘤是肝脏小病灶恶性肿瘤发生的主要独立危险因素(P<0.05). 此外, 虽有相关报道显示, 40岁-60岁的男性患者确为肝脏恶性肿瘤的高危人群[1,2], 本研究综合Logistic回归分析结果以及受样本量不足的影响, 认为年龄、性别并非肝脏小病灶恶性肿瘤发生的主要独立危险因素, 因此未纳入赋值标准.而病灶短期内增大这一指标尽管在两组中差异无统计学意义, 原因是大部分患者为初诊且病例数少, 根据临床经验仍判定其为SHCC发生的独立危险因素.根据筛选出的主要危险因素权重进行赋值, 总评分10分, ROC分析显示, 肝脏小病灶术前评分系统诊断恶性肿瘤的准确性为0.864, 敏感性为89.7%, 特异性为72.9%, 临界值为3.5分, 即大于等于4分即可高度怀疑为恶性肿瘤, 小于4分即考虑为良性肿瘤.
根据肝脏小病灶术前评分系统对肝脏小病灶患者进行评估, 总评分分值越高, 提示恶性肿瘤的可能性越大. ROC分析显示, 总评分≥4分即可高度怀疑为恶性肿瘤, 但考虑到临床相关因素, 仅凭总评分≥4分即诊断其为恶性肿瘤存在偏倚, 进行手术治疗或其他有创操作易导致误诊、误治, 因此根据两组患者的分值分布情况, 并结合ROC分析结果, 将患者SHCC的发病风险进行进一步细分, 共分为低风险、中风险、高风险三级. 低风险组评分为0-3分, 共61例, 其中恶性肿瘤19例, 良性肿瘤42例, SHCC的发生率为31.7%; 中风险组评分为4-5分, 共58例, 其中恶性肿瘤49例, 良性肿瘤9例, SHCC的发生率为84.5%; 高风险组评分为6-10分, 共125例, 其中恶性肿瘤117例, 良性肿瘤8例, SHCC的发生率为93.6%. 根据SHCC的发病风险等级进行对症处理, 低风险提示肝脏小病灶为恶性肿瘤的可能性较小, 建议定期观察, 不适随诊; 中风险提示肝脏小病灶为恶性肿瘤的可能性为中度, 可行手术治疗, 也可严密动态观察, 发现疾病出现进展及时处理; 高风险则提示肝脏小病灶为恶性肿瘤的可能性较大, 建议及时手术处理以改善预后. 此外, SHCC的病理分级与肝脏小病灶术前评分系统的分值无明显相关性, 差异无统计学意义. SHCC的病理分级指肝脏肿瘤细胞相比于正常细胞的异型程度, 准确评估SHCC的病理分级对制定个体化治疗方案具有重要作用. 相关研究证明[31,32], 肿瘤的大小、位置、血供、生长速度等与SHCC的临床病理分析呈正相关, 本研究旨在通过肝脏小病灶患者的术前影像学检查、有无合并病毒性肝炎、有无合并肝硬化、术前血清AFP水平及病灶短期内有无增大五项指标进行早期鉴别肝脏小病灶的良恶性, 与影响SHCC病理分级的相关危险因素并不重合, 因此肝脏小病灶术前评分系统对SHCC的早期诊断有重要的价值, 但与SHCC的病理分级无明显相关性.
目前临床上尚未有针对肝脏小病灶的诊疗规范, 本研究首次提出根据临床常见指标初步建立肝脏小病灶术前评分系统, 并证明该评分系统在临床上简单易行. 肝脏小病灶术前评分系统对早期鉴别肝脏小病灶的良恶性有较好的诊断效能, 根据患者总评分进行SHCC的患病风险评估并根据风险等级采取对症处理, 有利于早期发现SHCC, 也避免了肝脏良性肿瘤患者进行不必要的有创操作, 对改善患者预后及保障患者生命安全具有重要意义. 本研究不足是单中心回顾性分析, 样本量小且大部分患者为初诊, 收集的临床资料有限, 随访率较低, 因此还有待大样本、多中心、长期随访的前瞻性研究.
小肝癌(small hepatocellular carcinoma, SHCC)一般指肿瘤直径小于3 cm的早期肝癌, 目前临床上针对SHCC尚未出现标准化诊疗规范, 容易导致误诊、误治, 延误SHCC患者病情或对良性肝脏小病灶患者造成不必要的医源性损伤.
如何早期诊断SHCC并给予适当的干预措施是目前临床医生面临的难题.评估肝脏小病灶患者患恶性肿瘤的风险并制定相应的诊疗计划对改善SHCC患者预后至关重要.
通过临床常见指标初步建立肝脏小病灶术前评分系统, 并探索其在SHCC预测中的临床价值.
回顾性分析243例肝脏小病灶患者的临床资料, 采用多因素Logistic回归分析筛选出SHCC发生的主要独立危险因素, 并对根据筛选出的主要危险因素权重进行赋值, 初步建立肝脏小病灶术前评分系统, 最后采用受试者工作特征(receiver operating characteristic curve, ROC)曲线分析评估其诊断SHCC的效能.
合并病毒性肝炎、合并肝硬化、术前AFP水平升高、影像学诊断恶性肿瘤、病灶短期内增大是SHCC发生的主要独立危险因素. 根据上述因素初步建立的肝脏小病灶术前评分系统的ROC分析显示, 肝脏小病灶术前评分系统诊断恶性肿瘤的准确性为0.864, 再根据两组患者分值分布情况及ROC分析结果将患者发生SHCC的风险程度进行分级分析, 不同风险等级采取的处理不同.
肝脏小病灶术前评分系统对早期鉴别肝脏小病灶的良恶性有较好的诊断效能, 根据患者总评分进行SHCC的患病风险评估并根据风险等级采取对症处理, 有利于早期发现SHCC, 也避免了肝脏良性肿瘤患者进行不必要的有创操作, 对改善患者预后及保障患者生命安全具有重要意义.
本研究为单中心回顾性研究, 纳入的患者数量有限, 可能存在一定偏倚. 因此, 还有待进行大样本、多中心、长期随访的前瞻性研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖北省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Zheng R, Zhang S, Zeng H, Wang S, Sun K, Chen R, Li L, Wei W, He J. Cancer incidence and mortality in China, 2016. J Natl Cancer Cent. 2022;2:1-9. [DOI] |
| 6. | Kierans AS, Kang SK, Rosenkrantz AB. The Diagnostic Performance of Dynamic Contrast-enhanced MR Imaging for Detection of Small Hepatocellular Carcinoma Measuring Up to 2 cm: A Meta-Analysis. Radiology. 2016;278:82-94. [PubMed] [DOI] |
| 7. | Zheng SG, Xu HX, Liu LN. Management of hepatocellular carcinoma: The role of contrast-enhanced ultrasound. World J Radiol. 2014;6:7-14. [PubMed] [DOI] |
| 8. | Dumitrescu CI, Gheonea IA, Săndulescu L, Surlin V, Săftoiu A, Dumitrescu D. Contrast enhanced ultrasound and magnetic resonance imaging in hepatocellular carcinoma diagnosis. Med Ultrason. 2013;15:261-267. [PubMed] [DOI] |
| 9. | Kim SS, Baek GO, Son JA, Ahn HR, Yoon MK, Cho HJ, Yoon JH, Nam SW, Cheong JY, Eun JW. Early detection of hepatocellular carcinoma via liquid biopsy: panel of small extracellular vesicle-derived long noncoding RNAs identified as markers. Mol Oncol. 2021;15:2715-2731. [PubMed] [DOI] |
| 11. | Heimbach JK, Kulik LM, Finn RS, Sirlin CB, Abecassis MM, Roberts LR, Zhu AX, Murad MH, Marrero JA. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology. 2018;67:358-380. [PubMed] [DOI] |
| 12. | Omata M, Cheng AL, Kokudo N, Kudo M, Lee JM, Jia J, Tateishi R, Han KH, Chawla YK, Shiina S, Jafri W, Payawal DA, Ohki T, Ogasawara S, Chen PJ, Lesmana CRA, Lesmana LA, Gani RA, Obi S, Dokmeci AK, Sarin SK. Asia-Pacific clinical practice guidelines on the management of hepatocellular carcinoma: a 2017 update. Hepatol Int. 2017;11:317-370. [PubMed] [DOI] |
| 13. | Marrero JA, Kulik LM, Sirlin CB, Zhu AX, Finn RS, Abecassis MM, Roberts LR, Heimbach JK. Diagnosis, Staging, and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology. 2018;68:723-750. [PubMed] [DOI] |
| 17. | Becker-Assmann J, Fard-Aghaie MH, Kantas A, Makridis G, Reese T, Wagner KC, Petersen J, Buggisch P, Stang A, von Hahn T, Oldhafer KJ. [Diagnostic and prognostic significance of α-fetoprotein in hepatocellular carcinoma]. Chirurg. 2020;91:769-777. [PubMed] [DOI] |
| 18. | Chen L, Abou-Alfa GK, Zheng B, Liu JF, Bai J, Du LT, Qian YS, Fan R, Liu XL, Wu L, Hou JL, Wang HY; PreCar Team. Genome-scale profiling of circulating cell-free DNA signatures for early detection of hepatocellular carcinoma in cirrhotic patients. Cell Res. 2021;31:589-592. [PubMed] [DOI] |
| 20. | Petrick JL, Florio AA, Znaor A, Ruggieri D, Laversanne M, Alvarez CS, Ferlay J, Valery PC, Bray F, McGlynn KA. International trends in hepatocellular carcinoma incidence, 1978-2012. Int J Cancer. 2020;147:317-330. [PubMed] [DOI] |
| 21. | O'Rourke C, Jayaraman S, El-Maraghi RH, Singal AG, Kielar AZ. Chronic Liver Disease and Liver Cancer: What the Hepatologists, Oncologists, and Surgeons Want to Know from Radiologists. Magn Reson Imaging Clin N Am. 2021;29:269-278. [PubMed] [DOI] |
| 23. | Wang Y, Gao Y, Shi W, Zhai D, Rao Q, Jia X, Liu J, Jiao X, Du Z. Profiles of differential expression of circulating microRNAs in hepatitis B virus-positive small hepatocellular carcinoma. Cancer Biomark. 2015;15:171-180. [PubMed] [DOI] |
| 24. | Guan TP, Fang CH, Yang J, Xiang N, Chen QS, Zhong SZ. A Comparison between Three-Dimensional Visualization Guided Hepatectomy and Ultrasonography Guided Radiofrequency Ablation in the Treatment of Small Hepatocellular Carcinoma within the Milan Criteria. Biomed Res Int. 2016;2016:8931732. [PubMed] [DOI] |
| 26. | 肖 潇, 杨 均, 颜 綦先, 付 鑫, 李 宁, 魏 艳玲, 周 世亮, 彭 安国, 张 寅, 陈 东风, 胡 辂. TACE治疗53例Child C级肝硬化并发SHCC患者疗效评价. 实用肝脏病杂志. 2016;19:204-207. |
| 27. | Francque SM, De Pauw FF, Van den Steen GH, Van Marck EA, Pelckmans PA, Michielsen PP. Biopsy of focal liver lesions: guidelines, comparison of techniques and cost-analysis. Acta Gastroenterol Belg. 2003;66:160-165. [PubMed] |
| 28. | Şirli R, Sporea I, Popescu A, Dănilă M, Săndulescu DL, Săftoiu A, Moga T, Spârchez Z, Cijevschi C, Mihai C, Ioanițescu S, Nedelcu D, Iacob N, Miclăuș G, Brisc C, Badea R. Contrast-enhanced ultrasound for the assessment of focal nodular hyperplasia - results of a multicentre study. Med Ultrason. 2021;23:140-146. [PubMed] [DOI] |