修回日期: 2023-07-21
接受日期: 2023-08-03
在线出版日期: 2023-08-08
中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin, NGAL)在肝硬化合并急性肾损伤(acute kidney injury, AKI)患者中对于急性肾小管坏死(acute tubular necrosis, ATN)与其他类型的AKI有重要的鉴别诊断价值, 但血NGAL与尿NGAL直接相关, 现有研究中对于NGAL尿血比值在ATN的鉴别诊断中的作用的研究很少, 本试验意在评估其比值的临床作用.
分析血尿NGAL及其尿血比值在肝硬化合并AKI患者中对于ATN的鉴别诊断价值.
选取失代偿期肝硬化患者180例, 其中合并AKI患者98例, 根据AKI病因分成不同亚组, 包括33例肾前性氮质血症, 25例肝肾综合征急性肾损伤型及40例ATN, 探讨血尿NGAL及其尿血比值在不同类型AKI中鉴别作用.
尿NGAL对于肝硬化合并AKI患者中ATN的鉴别诊断价值较高, 受试者工作曲线下面积(area under the curve, AUC)是0.964, 诊断临界值为271.35 ng/mL时, 敏感度为87.5%, 特异性为96.6%. NGAL尿血比值对于ATN诊断价值也较高, AUC为0.953, 诊断临界值在2.96时, 敏感度为92.5%, 特异性为91.4%.
尿NGAL和NGAL尿血比值对于鉴别肝硬化合并AKI患者中ATN与其他类型AKI有重要价值, 值得进一步研究及临床推广.
核心提要: 现有研究证实, 中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin, NGAL)在肝硬化合并急性肾损伤(acute kidney injury, AKI)患者中对于急性肾小管坏死(acute tubular necrosis, ATN)与其他类型的AKI有重要的鉴别诊断价值, 但血NGAL与尿NGAL直接相关, 现有研究中对于NGAL尿血比值在ATN的鉴别诊断中的作用的研究很少, 本试验意在评估其比值在ATN中的鉴别诊断价值. 为临床的早期诊断及治疗探究新型指标, 改善患者预后.
引文著录: 龚艳清, 赵莹, 贾艳会, 李熳, 江勇. NGAL尿血比值在肝硬化急性肾损伤中的鉴别诊断价值. 世界华人消化杂志 2023; 31(15): 630-637
Revised: July 21, 2023
Accepted: August 3, 2023
Published online: August 8, 2023
Neutrophil gelatinase-associated lipocalin (NGAL) can be used for the differential diagnosis of acute kidney necrosis (ATN) and other types of acute kidney injury (AKI) in patients with liver cirrhosis complicated with AKI. However, serum NGAL is directly related to urine NGAL, and there are few existing studies on the role of urine /serum NGAL ratio in the differential diagnosis of ATN.
To assess the significance of serum and urine NGAL as well as urine/serum NGAL ratio in differentiating ATN from other types of AKI in cirrhosis.
A total of 180 patients with decompensated cirrhosis were included in the study, of whom 98 were complicated with AKI. According to the etiology of AKI, there were 33 patients with prerenal azotemia, 25 with hepatorenal syndrome-AKI, and 40 with ATN. The patients were divided into different subgroups to assess the value of NGAL in differentiating the types of AKI.
Urine NGAL and urine/serum NGAL ratio showed signi-ficant value in the differential diagnosis of ATN in patients with liver cirrhosis. At an optimal cut-off of 271.35 ng/mL, urine NGAL distinguished ATN from other types of AKI (area under the cuve [AUC] = 0.964; sensitivity, 87.5%; specificity, 96.6%). As well, at an optimal cut-off of 2.96, urine/serum NGAL ratio could also distinguish ATN from other types of AKI (AUC = 0.953, sensitivity 92.5% and specificity 91.4%).
Urine NGAL and urine/serum NGAL ratio have significant value in the differential diagnosis of ATN and other types of AKI in patients with liver cirrhosis, which is worthy of further study and clinical promotion.
- Citation: Gong YQ, Zhao Y, Jia YH, Li M, Jiang Y. Role of urine/serum NGAL ratio in differential diagnosis of acute kidney injury in patients with cirrhosis. Shijie Huaren Xiaohua Zazhi 2023; 31(15): 630-637
- URL: https://www.wjgnet.com/1009-3079/full/v31/i15/630.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i15.630
急性肾损伤(acute kidney injury, AKI)是失代偿期肝硬化患者最常见的并发症之一, 在住院患者中发病率可高达20%, 可增加患者死亡率, 与预后不良相关[1-3], 发生在肝硬化患者中的AKI主要分为肾前性氮质血症(prerenal azotemia, PRA)、肝肾综合征急性肾损伤型(hepatorenal syndrome-AKI, HRS-AKI)和急性肾小管坏死(acute tubular necrosis, ATN)三种类型, 其他类型相对少见, 虽然总体预后差, 仍然存在针对不同病因的有效治疗方式, 如PRA需通过利尿剂的停用及积极大量的液体复苏得到逆转, HRS-AKI对扩容无效, 主要的有效治疗药物为血管收缩剂联合白蛋白[4], 而严重的ATN则需肾脏代替治疗, 临床证实大量扩容或血管收缩剂的使用对ATN无效甚至有潜在危害, 加速疾病进展或造成死亡, 因此, 早期鉴别ATN对于选择正确的治疗时机和措施十分重要[5], 可避免不必要的医疗负担和不良预后. 临床上评估急性肾损伤的最常用的指标为血肌酐, 但因其自身局限性无法鉴别不同类型的AKI, 国际腹水俱乐部2015年指南(revised consensus recommendations of the International Club of Ascites, ICA2015)[6]提出希望探究出一些新型生物学标志物解决上述问题, 目前最受关注的是中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin, NGAL), 既往实验研究证实尿NGAL对于鉴别ATN及其他类型AKI有重要临床作用, 但血NGAL与尿NGAL直接相关, 现有研究中对于NGAL尿血比值在ATN的鉴别诊断中的作用的研究很少, 本试验意在探究其在ATN中的鉴别诊断价值. 现报道如下.
本试验纳入了2020-11/2022-01连续住院于天津市第三中心医院肝内科的630例肝硬化患者, 根据排除标准排除450例患者, 排除病例中以感染因素为首位(包括肺部感染、原发性腹膜炎、泌尿系统感染、肠道感染等), 共238例, 其次为既往明确慢性肾脏病病史共65例, 再次为临床资料不全58例, 其他为可疑存在肿瘤32例, 中途死亡或转诊31例, 其他原因26例, 最终选取肝硬化失代偿期患者180例作为研究对象, 其中包括98例AKI患者及82例非AKI患者, AKI患者中包括33例PRA, 25例HRS-AKI及40例ATN.其中包括98例AKI患者及82例非AKI患者, AKI患者中包括33例PRA, 25例HRS-AKI及40例ATN. 按照ICA2015的《肝硬化患者急性肾损伤的诊断和管理共识》[6]对肝硬化中AKI及PRA做出诊断, 按照2019年提出的对于ICA2015的补充更新共识[7]诊断HRS-AKI, AKI的鉴别诊断和治疗也根据其指南的流程进行, 并进行个体化调整.
AKI诊断标准: 血肌酐(serum creatinine, sCr)水平在48 h内升高≥0.3 mg/dL(26.5 μmol/L); 在前7 d内Scr水平比基线值(确定或推测)升高≥50%[6].
PRA诊断标准: Scr一过性升高, 符合AKI诊断标准, 之后停用利尿剂以及扩容治疗, 48 h内Scr下降至基线值0.3 mg/dL(26.5 μmol/L)以内, 一般是由于呕吐、腹泻、上消化道出血、利尿过度等引起血容量不足造成[6]; HRS-AKI诊断标准: 详见参考文献[7].
ATN的诊断标准: 同前人研究[8,9], 结合了临床及实验室数据, 满足以下4个标准中的3个: (1)滤过钠排泄分数(fraction excretion of urine sodium, FeNa)>2%; (2)尿渗透压<400 mOsm/L; (3)尿钠>40 mEq/L; (4)存在休克或使用肾毒性药物.
纳入标准: (1)住院的肝硬化患者; (2)对本研究知情同意, 通过医院医学伦理委员会的审核; (3)资料齐全, 有3 mo内血肌酐的基础值及诊断为AKI的24 h内常规化验检查结果. 排除标准: (1)肝肾移植史或急慢性肾脏代替治疗史; (2)有其他造成肾功能不全的原因, 如高血压肾病、间质性肾炎等; 进展期的慢性肾脏病(肌酐基础值≥4 mg/dL); (3)恶性肿瘤(肝癌超出米兰标准); (4)有泌尿系统及其他系统感染的证据; (5)不同意加入本研究者.
患者资料收集记录: 基础疾病(高血压、冠心病、糖尿病等)、肝硬化病因、并发症情况、年龄、性别, 实验室检查指标: 肝功能[白蛋白(albumin, ALB)、总胆红素(total bilirubin, Tbil)], 肾功能[尿素氮(urea nitrogen, BUN)、sCr、肾小球滤过率(glomerular filtration rate, GFR)], 尿白蛋白Albumin、FeNa, 血清钠, 凝血功能[国际标准化比值(international normalized ratio, INR)、凝血酶原活动度(prothrobin time activity percentage, PTA)], Child-Pugh评分, MELD评分.
标本采取与保存: AKI组患者在首次诊断为AKI后的第3天, 非AKI组患者在入院后的第3天, 均取晨起中段尿5 mL及空腹静脉血4 mL, 标本获得后均在半小时内离心, 血标本离心5 min(3000 rpm), 尿标本离心10 min(1000 rpm), 吸取上清液储存于-80 ℃冰箱.
标本的检测: 血液及尿液中的NGAL利用乳胶增强免疫透射比浊法在天津市第三中心医院检验科生化室于8200全自动生化分析仪上进行测定, 采用九强有限公司提供的NGAL试剂盒和校准品.
统计学处理 所用数据通过SPSS 20.0软件进行处理分析. 满足或接近正态分布的计量用平均数±标准差(mean±SD)表示, 两组间比较采用t检验, 多组间比较采用单因素方差分析, 非正态分布计量用中位数及四分位数表示, 两组间比较采用Wilcoxon秩和检验, 多组间比较采用Kruskal-Wallis秩和检验, 分类变量以例(%)表示, 组间比较采用卡方检验χ2, 计学显著性用aP<0.05或bP<0.001(P>0.05不注). 如同一表中另有一套P值, 则用cP<0.05和dP<0.001; 第三套为eP<0.05和fP<0.001等; 用受试者工作曲线(receiver operating characteristic curve, ROC曲线)探究诊断价值、诊断临界值及相应敏感度和特异性, 曲线下面积(area under the curve, AUC)值越接近1, 诊断价值越高, AUC值≤0.7提示诊断价值低.
鉴于临床上对于鉴别ATN的迫切需要, 我们将AKI组(98人)患者根据是否发生ATN分成ATN组(40例)及非ATN组(58例), ATN组与其他类型AKI组患者间年龄、男女比例、合并症发生率、肝硬化原因比例情况在两组间均不具有统计学差异, 并发症中ATN组中腹水发生率明显高于非AKI组. ATN组患者有较差的肾功能状况, 其中sCr、BUN、尿Albumin、FeNa在两组间具有统计学差异, ATN组有较差的肝功能, 体现在MELD评分.
通过Wilcoxon秩和检验发现血尿NGAL水平及NGAL尿血比值在ATN组均高于其他类型AKI组, 血NGAL(68.13 ng/mL vs 62.65 ng/mL, P>0.05), 尿NGAL(437.55 ng/mL vs 66.70 ng/mL, P<0.001); NGAL尿血比值中(7.19 vs 1.05, P<0.001)其中尿NGAL及NGAL尿血比值在两组间差异具有统计学意义. 详见表1.
| 生物标志物 | ATN(n = 40) | 其他类型AKI(n = 58) | P |
| 年龄(岁) | 63±12 | 62±11 | 0.090 |
| 男性比例n(%) | 23(57.5) | 32(55.2) | 0.130 |
| 合并症n(%) | |||
| 高血压 | 11(27.5) | 17(29.3) | 0.837 |
| 糖尿病 | 14(35.0) | 22(37.9) | 0.900 |
| 冠心病 | 6(15.0) | 9(15.5) | 0.088 |
| 肝硬化病因n(%) | |||
| 病毒性肝炎 | 16(40.0) | 24(41.4) | 0.162 |
| 酒精性肝病 | 10(25.0) | 14(24.1) | 0.135 |
| 病毒合并酒精性肝病 | 4(10.0) | 6(10.3) | 0.290 |
| 非酒精性脂肪性肝病 | 4(10.0) | 7(12.1) | 0.220 |
| 自身免疫性肝病 | 4(10.0) | 5(8.6) | 0.462 |
| 其他 | 2(5.0) | 2(3.4) | 0.068 |
| 肝硬化并发症n(%) | |||
| 腹水 | 36(90.0) | 45(77.6) | 0.014 |
| 肝性脑病 | 5(12.5) | 8(13.8) | 0.159 |
| 胃肠道出血 | 20(50.0) | 30(51.7) | 0.083 |
| 肾脏指标 | |||
| 肌酐(μmol/L) | 212.27±87.77 | 155.43±41.41 | <0.001 |
| 尿素氮(mmol/L) | 22.92±8.83 | 17.11±5.09 | <0.001 |
| 肾小球滤过率(mL/min) | 67 (62-105) | 82 (52-94) | 0.090 |
| 尿钠排泄分数(%) | 2.1(0.5,2.5) | 0.5(0.3,2.1) | 0.003 |
| 尿白蛋白(mg/dL) | 78(58,95) | 26(23,62) | <0.001 |
| 肝脏指标 | |||
| 白蛋白(g/L) | 29.23±4.14 | 33.02±8.56 | 0.110 |
| 总胆红素(μmol/L) | 109.10±52.37 | 45.33±177.71 | 0.192 |
| 国际标准化比值 | 1.54±0.42 | 1.80±0.78 | 0.341 |
| 凝血酶原活动度(%) | 42±19.87 | 57.40±28.40 | 0.890 |
| Child-Pugh评分 | 10.83±3.19 | 9.83±2.72 | 0.072 |
| 钠(mmol/L) | 130.47±5.52 | 131.52±9.24 | 0.112 |
| MELD评分 | 31±10.5 | 24±7.9 | <0.001 |
| 血NGAL(ng/mL) | 68.13±45.43 | 62.65(47.30-89.55) | >0.05 |
| 尿NGAL(ng/mL) | 437.55(301.43-838.03) | 66.70(41.15-92.20) | <0.001 |
| 尿/血NGAL | 7.19(5.33-11.66) | 1.05(0.56-1.81) | <0.001 |
本试验进一步根据AKI病因将失代偿期肝硬化患者分为3个亚组, 与非AKI组共同比较, 即非AKI组(82例), PRA组(33例)、HRS-AKI组(25例)及ATN组(40例), 通过Kruskal-Wallis秩和检验及两组间两两比较发现, 血尿NGAL浓度及尿血比值在任何类型AKI中浓度均明显大于非AKI组, 差异均有统计学意义. 血NGAL在HRS-AKI组表达大于ATN组, ATN组水平大于PRA组, (78.30 ng/mL vs 68.13 ng/mL vs 60.30 ng/mL), 而在不同类型AKI的两两成对比较中其差异均无统计学意义. 尿液NGAL水平及NGAL尿血比值均在ATN中水平最高, PRA组中水平最低, HRS-AKI组中水平介于前两者之间, 进一步通过两两成对比较发现, 两个指标在HRS组与PRA组表达差异均无统计学意义, 且部分数值存在重叠, 而两个指标在ATN组中数值明显大于PRA组及HRS组, 尿液NGAL(ATN 437.55 ng/mL vs PRA 60.90 ng/mL, ATN 437.55 ng/mL vs HRS-AKI 78.60 ng/mL), NGAL尿血比值(ATN 7.19 vs PRA 1.00, ATN 7.19 vs HRS-AKI 1.21), 差异均有统计学意义, 详见表2.
| 生物标志物 | 非AKI组(n = 82) | PRA(n = 33) | HRS-AKI(n = 25) | ATN(n = 40) |
| 血NGAL(ng/mL) | 9.05(3.68-19.73) | 60.30(48.05-76.35)b | 78.30(43.90-97.95)b | 68.13±45.43b |
| 尿NGAL(ng/mL) | 23.40(9.88-40.88) | 60.90(40.60-89.00)b | 78.60(42.45-123.20)b | 437.55(301.43-838.03)bdf |
| 尿/血NGAL | 1.87(1.21-4.18) | 1.00(0.59-1.64)b | 1.21(0.44-1.89)a | 7.19(5.33-11.66)bdf |
| 尿钠排泄分数(%) | 0.5(0.3-2.1) | 0.5(0.4-2.1) | 2.1(0.5,2.5)ce | |
| 尿白蛋白(mg/dL) | 25(22-34) | 29(24-92) | 78(58,95)de |
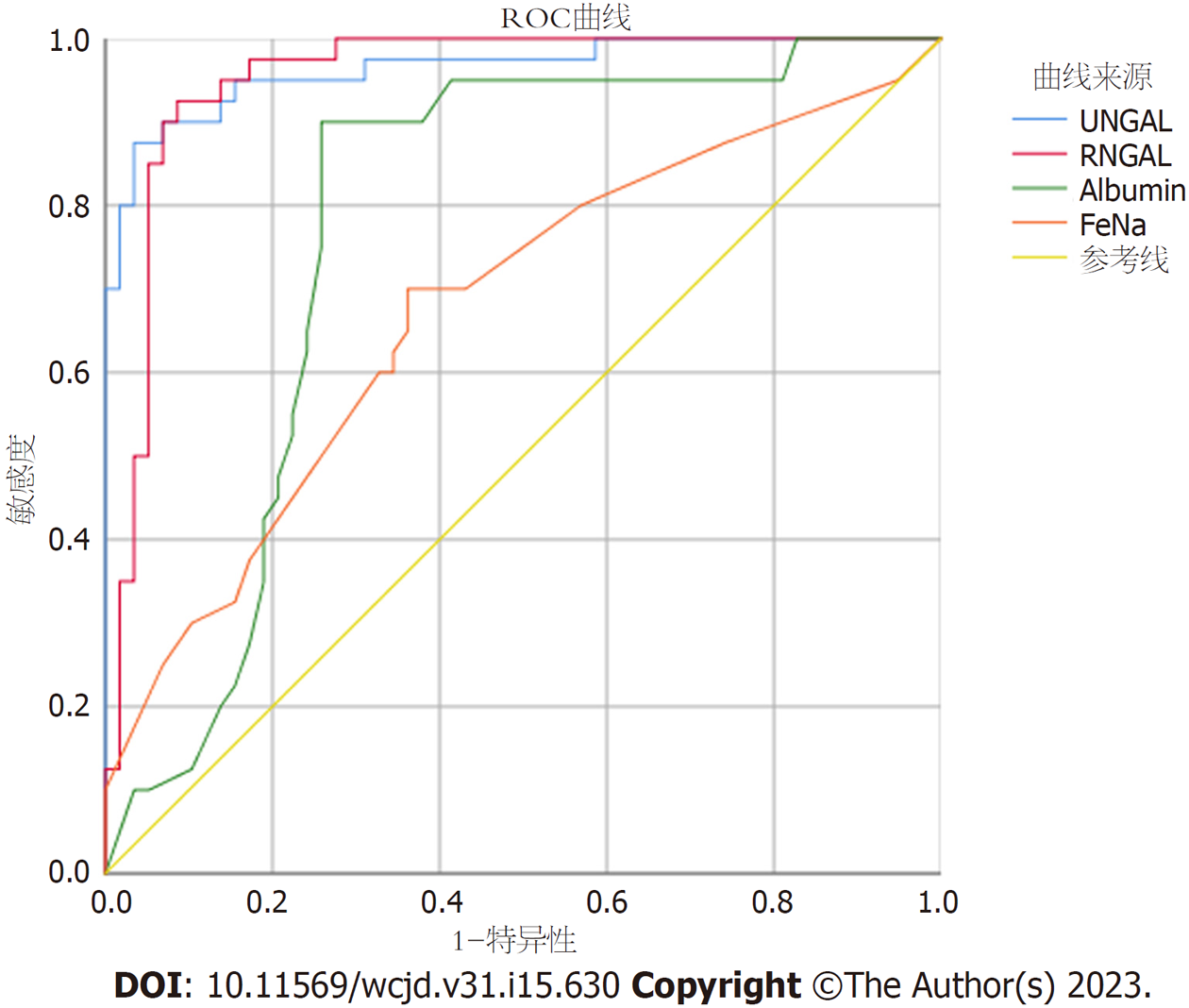
本试验进一步利用ROC曲线比较生物标志物及临床常用的评估肾小管及肾小球功能指标(FeNa及尿Albumin)对于ATN的诊断价值, 诊断价值最高的是尿NGAL, AUC是0.964, 诊断临界值为271.35 ng/mL时, 敏感度为87.5%, 特异性为96.6%.其次, NGAL尿/血比值对于ATN的诊断价值也较高(AUC = 0.953), 诊断临界值为2.96时, 敏感度为92.5%, 特异性为91.4%, 均高于FeNa%及尿白蛋白, 详见表3, ROC曲线图见图1.
| 生物标志物 | AUC | P | 截断点 | 特异度 | 敏感性 | 约登 |
| 尿NGAL(ng/mL) | 0.964 | <0.001 | 271.35 | 96.6% | 87.5% | 0.841 |
| NGAL尿/血 | 0.953 | <0.001 | 2.96 | 91.4% | 92.5% | 0.839 |
| 尿钠排泄分数(%) | 0.676 | 0.003 | 1.05 | 63.8% | 70.0% | 0.338 |
| 尿白蛋白(mg/dL) | 0.773 | <0.001 | 38.5 | 74.1% | 90.0% | 0.641 |
在2015年ICA对于肝硬化合并AKI的更新后的指南中, 依然根据血清肌酐的变化来诊断AKI[6], 而血肌酐会受体重、年龄、性别、饮食、药物等因素影响, 且在肝硬化患者中, 常受肌肉萎缩、水钠潴留等影响, 不能准确评估患者肾功能[10], 更不能区分肝硬化AKI的病因, 联合评估FeNa、尿中尿素氮排泄分数及尿显微镜学检查有助于鉴别AKI类型[11,12], 但临床上缺乏组织学诊断的验证, 因此, 近年来大量研究致力于探究新型肾脏标志物, 用于鉴别肝硬化不同类型AKI以协助诊治.
本试验选取近年来研究较多的NGAL, NGAL由肾脏髓袢升支粗段和收集管细胞产生, 当肾小管上皮细胞缺血后, NGAL表达增加, 进入血清和尿液, 可发挥促进肾小管细胞增殖等生理作用[13].
既往的研究中显示尿中肾小管损伤标志物NGAL的升高水平能预测不同类型的AKI, 在PRA中最低, HRS中稍高, ATN中最高, 这反应肝硬化中AKI发展的病理生理过程是一个连续过程[14,15], 且证实尿NGAL在鉴别ATN及其他类型AKI中有重大价值. Qasem等[16]证实尿NGAL在ATN中表达最高, 其次为HRS-1型, 在PRA组中表达最低; Belcher等[17]设计了多中心实验, 结果显示尿NGAL、IL-18、KIM-1、L-FABP和白蛋白在鉴别ATN和非ATN患者中均有较高价值, 其中uNGAL的ROC曲线下面积最大为0.78. 基于此项研究, ICA在发布新指南中也建议通过新型生物学标志物来加强鉴别诊断的特异性[18]. Ariza等[19]在探究了一系列生物标志物, 发现uNGAL对ATN的鉴别价值最高, 其他有鉴别意义的还包括IL-18、白蛋白、TFF-3和GST-π. 在一项对包括8项前瞻性研究中的1129例肝硬化患者的荟萃分析中发现[20], 尿NGAL、IL-18能较好的鉴别ATN和其他类型AKI, AUC值为0.89和0.88. 一项埃及的研究显示[21], 尿NGAL在以143 ng/mg creat为临界值时, 对iAKI和其他类型的AKI鉴别价值最高. Huelin等[9]在2019年实验选取连续住院的320例肝硬化合并AKI的患者, 分别在住院第1、3、7、14天中检测尿NGAL, 发现第3天的尿NGAL对ATN和其他类型AKI的鉴别诊断的准确性最高(AUC = 0.87), 临界值为220 µg/g肌酐. Udgirkar等[22]研究显示, 尿NGAL水平分别在>为299 ng/mL及>650 ng/mL时, 对于鉴别PRA与HRS和鉴别HRS和iAKI的敏感性及特异性均优于肌酐, 而检测值在299 ng/mL-650 ng/mL之间时提示为HRS而非PRA或iAKI. Allegretti等[23]在2021年的试验中显示尿NGAL在最佳临界值为244 ug/g creatinine时, 对ATN及其他类型AKI鉴别诊断价值最高, C值为0.762(95%可信度, 间隔0.682, 0.842). Gambino等[24]发现尿NGAL对于鉴别ATN有重要价值, 临界点在220 ng/mL时, 灵敏度为89%, 特异性为78%, AUC为0.854.
本次试验中结果与前人研究一致, 发现尿NGAL在不同原因AKI组中表达情况为ATN组>HRS-AKI组>PRA组(437.55 ng/mL vs 78.60 ng/mL vs 60.90 ng/mL), 其在ATN组明显高于非ATN组, 诊断临界值为271.35 ng/mL时诊断价值最高(AUROC = 0.964, 敏感度87.5%, 特异性96.6%), 40位ATN病人中有36个大于此数值. 诊断效能明显高于传统评估指标, 提示尿NGAL在ATN鉴别诊断中的作用不可忽视.其次, 本次试验结果以及既往研究结果[25]一致提示, 血清NGAL对于AKI不同类型的鉴别的结果不如尿NGAL那么理想, 原因不除外与以下相关, NGAL由多种人体细胞分泌, 如上皮细胞(肺、肠、前列腺、肾脏等)、中性粒细胞、单核/巨噬细胞、肝脏细胞[26], 很容易受包括感染、恶性肿瘤、慢性肝病、胰腺炎、慢性阻塞性肺病、子宫内膜增生, 尿路感染等因素影响[27,28], 造成其在肝脏病及肾脏病中诊断特异性低.
令人兴奋的是本次试验中发现ATN中NGAL的尿血比值明显高于非ATN组, (7.19 vs 1.05, P<0.001), 差异有统计学意义, 诊断临界值为2.96(AUROC = 0.953, 敏感度为92.5%, 特异性为91.4%), 此时40位ATN患者中有37位高于此值. 肾损伤发生后2 h-4 h血清和尿液中的NGAL水平开始升高, 是由于肾小球滤过率、肾小管重吸收以及肾小管上皮细胞分泌的改变引起的[28]. 有文献指出, 血清NGAL水平与尿NGAL水平直接相关, 检测血液NGAL可以校正血液升高对尿液检测值的影响[29], 故尿液NGAL/血清NGAL比值可能可以成为更好的评估肾损害的指标.
本试验的局限性: (1)单中心研究; (2)排除的样本较多, 样本量偏小; (3)以血肌酐而非肾脏穿刺作为AKI的诊断标准, 存在与实际情况相悖的可能.
总之, 亟需新的生物标记物用于肝硬化AKI的诊断及鉴别诊断, 尿NGAL和NGAL尿血比值对于鉴别肝硬化中ATN与其他类型AKI有重要的临床价值, 值得进一步研究及临床推广.
中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin, NGAL)在肝硬化合并急性肾损伤(acute kidney injury, AKI)的患者中对于急性肾小管坏死(acute tubular necrosis, ATN)有鉴别诊断价值, 查询文献可知, 国内外既往已有较多关于血和尿NGAL在ATN鉴别诊断中作用的相关研究. 综合相关研究结果, 目前各研究一致认为尿NGAL在ATN鉴别诊断中的价值更大. 究其原因如下: 尿NGAL的测定是无创的, 且受到的影响因素比较少; 其缺点是对于无尿的患者无法测定, 且利尿剂等可能影响其测定的准确性. 血NGAL的测定更容易获得检测标本; 缺点是需要抽血, 有一定创伤, 此外, 一些肾外疾病可能影响其浓度, 因而降低其特异性. 本研究选择将NGAL尿血比值作为一项指标进行相关探索性研究.
本试验在多项国内外研究的基础上, 探讨NGAL尿血比值能否成为早期鉴别肝硬化合并ATN患者的新型生物标志物.
探讨NGAL尿血比值在肝硬化合并AKI患者中对于ATN的鉴别诊断价值, 为临床的早期诊断及治疗探究新型指标, 改善患者预后.
选取失代偿期肝硬化患者180例, 其中合并AKI患者98例, 根据AKI病因分成不同亚组, 包括33例肾前性氮质血症, 25例肝肾综合征急性肾损伤型及40例ATN, 探讨血尿NGAL及其尿血比值在不同类型AKI中鉴别作用.
尿NGAL对于肝硬化合并AKI患者中ATN的鉴别诊断价值较高, 受试者工作曲线下面积(area ander the curve, AUC)是0.964, 诊断临界值为271.35 ng/mL时, 敏感度为87.5%, 特异性为96.6%. NGAL尿/血比值对于ATN诊断价值也较高, AUC为0.953, 诊断临界值在2.96时, 敏感度为92.5%, 特异性为91.4%.
本试验发现NGAL尿血比值对于鉴别肝硬化合并AKI患者中ATN与其他类型AKI也有重要价值, 为临床的诊治提供新的思路.
本试验的为单中心研究, 样本量偏小, 且以血肌酐而非肾脏穿刺作为AKI的诊断标准, 存在与实际情况相悖的可能, 存在明显局限性, 未来需进一步增加样本量, 多中心研究, 探究生物标志物尿血比值在临床中的应用价值.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Desai AP, Knapp SM, Orman ES, Ghabril MS, Nephew LD, Anderson M, Ginès P, Chalasani NP, Patidar KR. Changing epidemiology and outcomes of acute kidney injury in hospitalized patients with cirrhosis - a US population-based study. J Hepatol. 2020;73:1092-1099. [PubMed] [DOI] |
| 2. | Francoz C. Acute kidney injury in cirrhosis: An immediate threat but also a ticking time bomb. J Hepatol. 2020;72:1043-1045. [PubMed] [DOI] |
| 3. | Allegretti AS, Parada XV, Eneanya ND, Gilligan H, Xu D, Zhao S, Dienstag JL, Chung RT, Thadhani RI. Prognosis of Patients with Cirrhosis and AKI Who Initiate RRT. Clin J Am Soc Nephrol. 2018;13:16-25. [PubMed] [DOI] |
| 4. | Wong F, Pappas SC, Curry MP, Reddy KR, Rubin RA, Porayko MK, Gonzalez SA, Mumtaz K, Lim N, Simonetto DA, Sharma P, Sanyal AJ, Mayo MJ, Frederick RT, Escalante S, Jamil K; CONFIRM Study Investigators. Terlipressin plus Albumin for the Treatment of Type 1 Hepatorenal Syndrome. N Engl J Med. 2021;384:818-828. [PubMed] [DOI] |
| 5. | Allegretti AS. NGAL in AKI and cirrhosis-Ready for prime time? Hepatology. 2023;77:1472-1474. [PubMed] [DOI] |
| 6. | Angeli P, Gines P, Wong F, Bernardi M, Boyer TD, Gerbes A, Moreau R, Jalan R, Sarin SK, Piano S, Moore K, Lee SS, Durand F, Salerno F, Caraceni P, Kim WR, Arroyo V, Garcia-Tsao G; International Club of Ascites. Diagnosis and management of acute kidney injury in patients with cirrhosis: revised consensus recommendations of the International Club of Ascites. Gut. 2015;64:531-537. [PubMed] [DOI] |
| 7. | Angeli P, Garcia-Tsao G, Nadim MK, Parikh CR. News in pathophysiology, definition and classification of hepatorenal syndrome: A step beyond the International Club of Ascites (ICA) consensus document. J Hepatol. 2019;71:811-822. [PubMed] [DOI] |
| 8. | Huelin P, Piano S, Solà E, Stanco M, Solé C, Moreira R, Pose E, Fasolato S, Fabrellas N, de Prada G, Pilutti C, Graupera I, Ariza X, Romano A, Elia C, Cárdenas A, Fernández J, Angeli P, Ginès P. Validation of a Staging System for Acute Kidney Injury in Patients With Cirrhosis and Association With Acute-on-Chronic Liver Failure. Clin Gastroenterol Hepatol. 2017;15:438-445.e5. [PubMed] [DOI] |
| 9. | Huelin P, Solà E, Elia C, Solé C, Risso A, Moreira R, Carol M, Fabrellas N, Bassegoda O, Juanola A, de Prada G, Albertos S, Piano S, Graupera I, Ariza X, Napoleone L, Pose E, Filella X, Morales-Ruiz M, Rios J, Fernández J, Jiménez W, Poch E, Torres F, Ginès P. Neutrophil Gelatinase-Associated Lipocalin for Assessment of Acute Kidney Injury in Cirrhosis: A Prospective Study. Hepatology. 2019;70:319-333. [PubMed] [DOI] |
| 10. | Allegretti AS, Solà E, Ginès P. Clinical Application of Kidney Biomarkers in Cirrhosis. Am J Kidney Dis. 2020;76:710-719. [PubMed] [DOI] |
| 11. | Lima C, Macedo E. Urinary Biochemistry in the Diagnosis of Acute Kidney Injury. Dis Markers. 2018;2018:4907024. [PubMed] [DOI] |
| 12. | Gowda YHS, Jagtap N, Karyampudi A, Rao NP, Deepika G, Sharma M, Gupta R, Tandan M, Ramchandani M, John P, Kulkarni A, Kumar P, Bhaware B, Turpati MV, Reddy DN. Fractional Excretion of Sodium and Urea in Differentiating Acute Kidney Injury Phenotypes in Decompensated Cirrhosis. J Clin Exp Hepatol. 2022;12:899-907. [PubMed] [DOI] |
| 16. | Qasem AA, Farag SE, Hamed E, Emara M, Bihery A, Pasha H. Urinary biomarkers of acute kidney injury in patients with liver cirrhosis. ISRN Nephrol. 2014;2014:376795. [PubMed] [DOI] |
| 17. | Belcher JM, Sanyal AJ, Peixoto AJ, Perazella MA, Lim J, Thiessen-Philbrook H, Ansari N, Coca SG, Garcia-Tsao G, Parikh CR; TRIBE-AKI Consortium. Kidney biomarkers and differential diagnosis of patients with cirrhosis and acute kidney injury. Hepatology. 2014;60:622-632. [PubMed] [DOI] |
| 19. | Ariza X, Solà E, Elia C, Barreto R, Moreira R, Morales-Ruiz M, Graupera I, Rodríguez E, Huelin P, Solé C, Fernández J, Jiménez W, Arroyo V, Ginès P. Analysis of a urinary biomarker panel for clinical outcomes assessment in cirrhosis. PLoS One. 2015;10:e0128145. [PubMed] [DOI] |
| 20. | Puthumana J, Ariza X, Belcher JM, Graupera I, Ginès P, Parikh CR. Urine Interleukin 18 and Lipocalin 2 Are Biomarkers of Acute Tubular Necrosis in Patients With Cirrhosis: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2017;15:1003-1013.e3. [PubMed] [DOI] |
| 21. | Hamdy HS, El-Ray A, Salaheldin M, Lasheen M, Aboul-Ezz M, Abdel-Moaty AS, Abdel-Rahim A. Urinary Neutrophil Gelatinase-Associated Lipocalin in Cirrhotic Patients with Acute Kidney Injury. Ann Hepatol. 2018;17:624-630. [PubMed] [DOI] |
| 22. | Udgirkar S, Rathi P, Sonthalia N, Chandnani S, Contractor Q, Thanage R, Jain S. Urinary neutrophil gelatinase-associated lipocalin determines short-term mortality and type of acute kidney injury in cirrhosis. JGH Open. 2020;4:970-977. [PubMed] [DOI] |
| 23. | Allegretti AS, Parada XV, Endres P, Zhao S, Krinsky S, St Hillien SA, Kalim S, Nigwekar SU, Flood JG, Nixon A, Simonetto DA, Juncos LA, Karakala N, Wadei HM, Regner KR, Belcher JM, Nadim MK, Garcia-Tsao G, Velez JCQ, Parikh SM, Chung RT; HRS-HARMONY study investigators. Urinary NGAL as a Diagnostic and Prognostic Marker for Acute Kidney Injury in Cirrhosis: A Prospective Study. Clin Transl Gastroenterol. 2021;12:e00359. [PubMed] [DOI] |
| 24. | Gambino C, Piano S, Stenico M, Tonon M, Brocca A, Calvino V, Incicco S, Zeni N, Gagliardi R, Cosma C, Zaninotto M, Burra P, Cillo U, Basso D, Angeli P. Diagnostic and prognostic performance of urinary neutrophil gelatinase-associated lipocalin in patients with cirrhosis and acute kidney injury. Hepatology. 2023;77:1630-1638. [PubMed] [DOI] |
| 25. | Jaques DA, Spahr L, Berra G, Poffet V, Lescuyer P, Gerstel E, Garin N, Martin PY, Ponte B. Biomarkers for acute kidney injury in decompensated cirrhosis: A prospective study. Nephrology (Carlton). 2019;24:170-180. [PubMed] [DOI] |
| 26. | Nguyen MT, Devarajan P. Biomarkers for the early detection of acute kidney injury. Pediatr Nephrol. 2008;23:2151-2157. [PubMed] [DOI] |
| 27. | Xu MJ, Feng D, Wu H, Wang H, Chan Y, Kolls J, Borregaard N, Porse B, Berger T, Mak TW, Cowland JB, Kong X, Gao B. Liver is the major source of elevated serum lipocalin-2 levels after bacterial infection or partial hepatectomy: a critical role for IL-6/STAT3. Hepatology. 2015;61:692-702. [PubMed] [DOI] |
| 28. | Ostermann M, Philips BJ, Forni LG. Clinical review: Biomarkers of acute kidney injury: where are we now? Crit Care. 2012;16:233. [PubMed] [DOI] |
| 29. | Slack AJ, McPhail MJ, Ostermann M, Bruce M, Sherwood R, Musto R, Dew T, Auzinger G, Bernal W, O'Grady J, Heneghan MA, Moore K, Wendon JA. Predicting the development of acute kidney injury in liver cirrhosis--an analysis of glomerular filtration rate, proteinuria and kidney injury biomarkers. Aliment Pharmacol Ther. 2013;37:989-997. [PubMed] [DOI] |