修回日期: 2023-04-28
接受日期: 2023-05-24
在线出版日期: 2023-06-28
白藜芦醇不仅具有抗肿瘤作用, 其还能增强多种化疗药物的化疗敏感性, 但其对食管癌耐药细胞的顺铂敏感性的作用尚不清楚.
探讨白藜芦醇逆转食管癌细胞Eca109/DDP的耐药效应并从铁死亡的角度分析其潜在的作用机制.
采用MTT法确定白藜芦醇和顺铂的最佳作用时间和浓度;检测细胞增殖、细胞内丙二醛(malondialdehyde, MDA)、谷胱甘肽(glutathione, GSH)、活性氧(reactive oxygen species, ROS)及铁离子的水平; Western blot检测铁死亡相关调控因子酰基辅酶A合成酶长链家族成员4(acyl coenzyme A synthetase long chain family member 4, ACSL4)、铁蛋白重链(ferritin heavy chain, FTH)、谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)和肿瘤蛋白53(tumor protein 53, P53)的蛋白表达情况.
MTT检测结果显示, 相较于单用顺铂, 联用白藜芦醇对Eca109/DDP细胞的生长抑制作用较为显著(P<0.05). 此外, 白藜芦醇和顺铂联用可显著降低Eca109/DDP细胞克隆形成数(P<0.05), 增加细胞内铁离子、MDA和ROS水平(P<0.05), 降低GSH水平(P<0.05). 铁死亡抑制剂(ferrostatin-1, Fer-1)和铁离子螯合剂(deferoxamine, DFO)可部分逆转白藜芦醇对细胞增殖的抑制作用(P<0.05). Western blot的结果显示相较于其他组, 白藜芦醇和顺铂联用组的FTH和GPX4的蛋白表达显著降低(P<0.05), 而ACSL4和P53的蛋白表达显著增加(P<0.05).
白藜芦醇可通过铁死亡抑制Eca109/DDP细胞的增殖并逆转顺铂耐药.
核心提要: 在食管癌细胞Eca109/DDP中, 白藜芦醇对顺铂化疗具有增敏效应, 这种增敏作用与其促进铁死亡有关.
引文著录: 王陈等, 马柏强, 易弼顺. 白藜芦醇通过铁死亡途径逆转食管癌细胞Eca109/DDP化疗耐药. 世界华人消化杂志 2023; 31(12): 477-484
Revised: April 28, 2023
Accepted: May 24, 2023
Published online: June 28, 2023
Resveratrol not only has anti-tumor effects, but also can enhance the chemosensitivity of tumor cells to a variety of chemotherapeutic agents. However, its effect on cisplatin sensitivity of drug-resistant esophageal cancer cells remains unclear.
To investigate whether resveratrol reverses the drug resistance of esophageal cancer Eca109/DDP cells and to explore the potential mechanism involved from the perspective of ferroptosis.
The optimal treatment time and concentration of resveratrol and cisplatin were determined by MTT assay. Cell proliferation and the intracellular levels of malon-dialdehyde (MDA), glutathione (GSH), reactive oxygen species (ROS), and ferrous iron were detected. The protein expression of the ferroptosis-related molecules acyl coenzyme A synthetase long chain family member 4 (ACSL4), ferritin heavy chain (FTH), glutathione peroxidase 4 (GPX4), and tumor protein 53 (P53) was detected by Western blot assay.
MTT assay showed that compared with cisplatin alone, resveratrol combined with cisplatin significantly inhibited the growth of Eca109/DDP cells (P < 0.05). The combination of resveratrol and cisplatin not only reduced the number of colonies formed (P < 0.05), but also increased the levels of ferrous iron, MDA, and ROS (P < 0.05) and decreased the level of GSH (P < 0.05) in Eca109/DDP cells. The inhibitory effect of resveratrol on Eca109/DDP cell proliferation was partially reversed by ferrostatin-1 (Fer-1) and deferoxamine (DFO) (P < 0.05). Western blot analysis showed that compared with other groups, the protein expression of FTH and GPX4 in the resveratrol and cisplatin combination group was significantly decreased (P < 0.05), and the protein expression of ACSL4 and P53 was significantly increased (P < 0.05).
Resveratrol can inhibit cell proliferation and reverse cisplatin resistance by regulating ferroptosis in Eca109/DDP cells.
- Citation: Wang CD, Ma BQ, Yi BS. Resveratrol reverses drug resistance of esophageal cancer cell line Eca109/DDP via regulating ferroptosis. Shijie Huaren Xiaohua Zazhi 2023; 31(12): 477-484
- URL: https://www.wjgnet.com/1009-3079/full/v31/i12/477.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i12.477
食管癌是常见的消化系统恶性肿瘤之一, 据国家癌症中心发布的最新数据显示, 食管癌的发病率在恶性肿瘤中排第六位, 而死亡率居第四位[1]; 其中约90%的食管癌属于食管鳞癌, 由于早期症状不明显, 很多患者均存在诊断晚、治疗效果差的现象. 辅助化疗在食管癌的治疗中仍有着不可替代的作用, 获得性耐药的产生则成为影响化疗效果及患者长期生存的主要因素[2,3]. 肿瘤细胞获得性耐药的发生机制以及逆转耐药的新型药物研发依旧是目前的研究热点和重点[3]; 大量的临床实践表明中药在改善化疗药物的多药耐药现象, 缓解化疗所致的不良反应, 提升患者化疗完成度及治疗效果上具有明显的优势[3-5]. 白藜芦醇是一种非黄酮多酚类化合物, 广泛存在于天然植物及传统中药中; 作为一种天然的抗毒素, 白藜芦醇具有抗炎、抗氧化、抗肿瘤等多种药理学功效[6-8]. 早期有研究显示, 白藜芦醇可通过调节PI3K/AKT/mTOR信号通路逆转卵巢癌细胞化疗耐药[7]. 此外, 白藜芦醇可靶向miR-122-5p增加乳腺癌细胞MCF-7对阿霉素的敏感性[8]. 由此可见, 白藜芦醇可与多种化疗药物联用, 增加药物疗效; 然而目前并未有关于白藜芦醇对人食管癌细胞Eca109化疗耐药的影响及相关机制的报道. 本研究以人食管癌细胞Eca109及其顺铂耐药细胞系Eca109/DDP为观察对象, 评估白藜芦醇干预后Eca109/DDP细胞顺铂耐药性的变化, 并从细胞铁死亡的角度初步探究其可能的作用机制, 为白藜芦醇在食管癌化疗中的实践应用提供一定的理论基础.
人食管癌细胞Eca109及其顺铂耐药细胞系Eca109/DDP购自中科院上海生物化学与细胞生物学研究所; RPMI1640液体细胞培养基购自美国Hyclone公司; 白藜芦醇、铁死亡抑制剂(ferrostatin-1, Fer-1) 和铁离子螯合剂(deferoxamine, DFO)购自Sigma公司; 注射用顺铂购自齐鲁制药有限公司; 铁分析试剂盒购自美国Abnova公司; 酰基辅酶A合成酶长链家族成员4(acyl coenzyme A synthetase long chain family member 4, ACSL4)、铁蛋白重链(ferritin heavy chain, FTH)、谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)、肿瘤蛋白53(tumor protein 53, P53)和肌动蛋白β(β-actin)抗体均购自美国Abcam公司; 噻唑蓝(methyl thiazolyl tetrazolium, MTT)细胞增殖检测试剂盒以及丙二醛(malondialdehyde, MDA)、谷胱甘肽(glutathione, GSH)、活性氧(active oxygen species, ROS)检测试剂盒均购自上海碧云天生物技术有限公司; 其余试剂均为国产市售分析纯.
1.2.1 细胞培养: 食管癌细胞Eca109及其顺铂耐药细胞系Eca109/DDP常规培养于含10%胎牛血清和1%青-链霉素的RPMI1640液体细胞培养基中, 定期换液和传代. 为保证细胞的耐药性, Eca109/DDP细胞培养基中需间断性加入顺铂. 培养环境为: 37 ℃, 50 mL/L CO2.
1.2.2 MTT检测: 采用MTT法检测细胞经处理后增殖情况的变化, 将细胞接种至96孔板中(2×104个/mL), 给予相应的药物处理后, 加入MTT试剂, 培养箱中继续孵育4 h. 最后用酶标仪检测各孔在490 nm波长处的吸光度值(OD), 分析细胞的增殖情况. 每次实验设三个复孔取平均值, 同时设不含细胞的单孔作为空白对照. 实验重复三次. 不同实验分组设置如下:
检测顺铂对Eca109及Eca109/DDP细胞的半数抑制浓度(IC50), 顺铂的浓度梯度设置为0、3.125 μM、6.25 μM、12.5 μM、25 μM和50 μM.
检测白藜芦醇对食管癌耐药细胞Eca109/DDP的毒性作用, 白藜芦醇的浓度设置为0、15 μM、30 μM、60 μM、120 μM和240 μM.
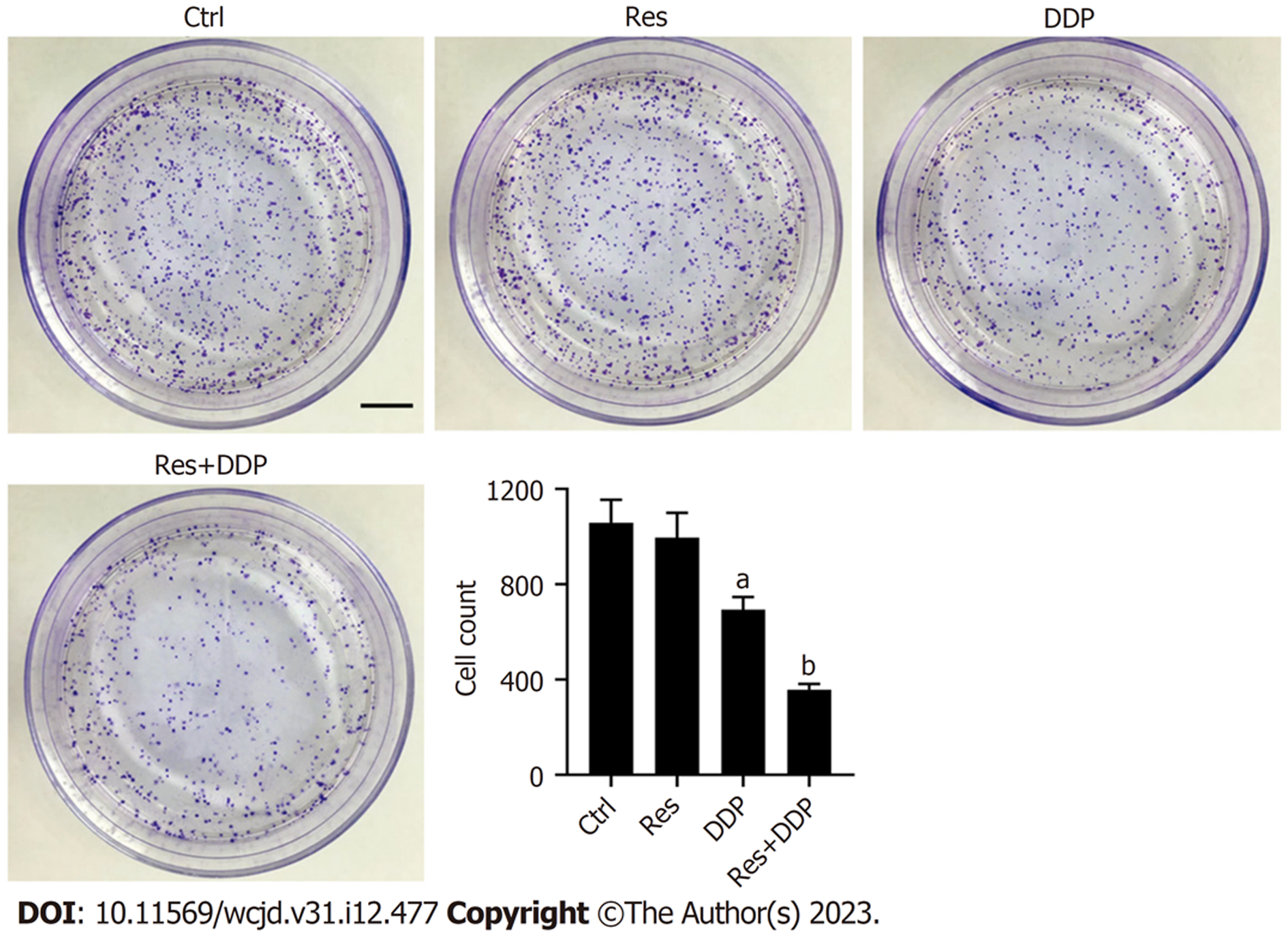
1.2.3 细胞集落形成检测: 采用细胞集落形成实验评估细胞的增殖情况. 将细胞铺板于6孔板(1000个/孔), 依据下述实验分组分别加药处理, 置于细胞培养箱继续培养2 wk. 吸弃培养液, PBS清洗后加多聚甲醛固定细胞集落, 而后加结晶紫染液染色, 将染色结果置于显微镜下拍照观察并计算细胞的集落形成数.
实验分组如下: 对照组(不加顺铂及白藜芦醇; Ctrl); 白藜芦醇组(白藜芦醇浓度为30 μM; Res); 顺铂组(顺铂浓度为12.5 μM; DDP); 顺铂及白藜芦醇联用组(顺铂浓度为12.5 μM, 白藜芦醇浓度为30 μM; Res+DDP).
1.2.4 细胞内MDA、GSH检测: 依据实验分组分别处理各组细胞, 按照试剂盒提供的操作说明书进行如下操作: 首先离心收集各组细胞经PBS清洗后, 重悬细胞. 超声破碎细胞并离心收集上清液, 依据说明说加入相应的工作液孵育, 酶标仪检测450 nm波长处的吸光度值. 绘制标准曲线并分析相应的检测指标. 实验分组同2.3.
1.2.5 二价铁离子(Fe2+)含量检测: 依据实验分组分别处理各组细胞, 按照试剂盒提供的操作说明书进行如下操作: 胰酶消化收集各组细胞, 离心后加Assay buffer重悬细胞. 涡旋化冰后再次离心收集上清液待检, 向待检样品中依次加入铁还原剂和探针, 孵育后经酶标仪检测593 nm波长处的吸光度值. 绘制标准曲线并分析各实验组铁离子的浓度. 实验分组同2.3.
1.2.6 ROS检测: 将细胞铺板于24孔板(2×104个/孔), 依据实验分组分别处理各组细胞, 并增加空白对照孔(仅溶剂)和阳性对照孔(加ROS对照试剂5 mg/mL Rosup), 更换细胞培养液, 避光加DCFH-DA染液染色30 min. 消化收集细胞, PBS洗涤并重悬, 于荧光显微镜下拍照观察并分析荧光强度. 实验分组同2.3.
1.2.7 western blot蛋白表达水平检测: 细胞经冰PBS洗涤后, 加RIPA裂解液收集各组细胞蛋白. 参考BCA蛋白定量试剂盒测定蛋白浓度, 而后上样进行SDS-PAGE凝胶电泳和电转, 将分离的目的蛋白转移至PVDF膜. 加入5%的脱脂乳粉于室温下封闭90 min. 依据说明书要求加入相应比例的一抗4 ℃孵育过夜, TBST洗涤后加入相对应的二抗室温孵育2 h. TBST洗涤, 暗室中经ECL化学发光法检测目的蛋白的表达情况并行灰度半定量分析. 实验分组同2.3.
统计学处理 所得数据录入GraphPad8.3软件中进行统计学分析. 实验结果以均数±标准差(mean±SD)表示, 多组间的比较采用方差分析, 各组均数间的两两比较用Bonferroni校正的t检验, P<0.05表示差异有显著性.
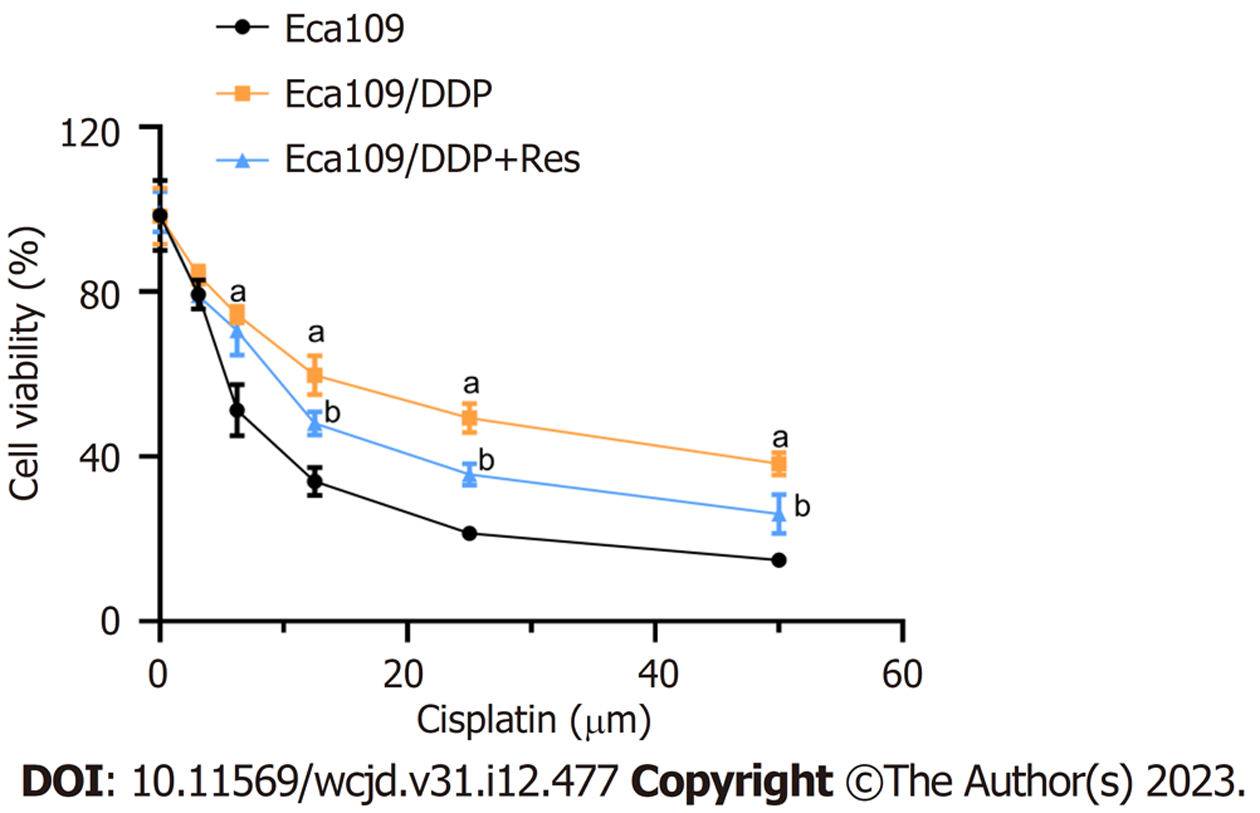
本研究首先采用MTT法确定Eca109/DDP细胞对顺铂的耐药性. 结果如图1所示, 顺铂可浓度依赖性抑制Eca109及Eca109/DDP细胞的增殖, 其中顺铂对Eca109细胞和Eca109/DDP细胞的IC50分别为(7.70±1.18) μM和(24.73±4.45) μM; Eca109/DDP细胞对顺铂具有明显的耐药性, 可用于后续实验分析.
CCK-8细胞活力检测的结果显示(表1), Eca109/DDP细胞经不同浓度的白藜芦醇处理24 h后, 细胞活力随白藜芦醇浓度的增加有所降低, 其中120 μM及240 μM的白藜芦醇可显著抑制细胞活力(P<0.05); 处理48 h后, 白藜芦醇浓度在60 μM、120 μM及240 μM时的作用较为显著(P<0.05). 选取无细胞毒性作用的浓度为白藜芦醇的耐药逆转浓度, 即30 μM.
为进一步验证白藜芦醇是否可逆转Eca109/DDP细胞的耐药性, 本研究采用MTT法检测30 μM白藜芦醇预孵之后, 顺铂对Eca109/DDP细胞的杀伤作用. 结果图1所示; 30 μM白藜芦醇预孵后, Eca109/DDP细胞对顺铂的敏感性显著增强, 且在顺铂浓度为12.5 μM时, 差异较为显著(P<0.05), 故而后续实验选用此浓度进行处理.
细胞克隆形成实验检测结果显示(图2), 相比于对照组, 单用顺铂处理(DDP组)细胞集落形成数由1058.27±95.82减少至693.69±53.25(P<0.05), 而白藜芦醇和顺铂联合处理组(Res+DDP组)细胞集落形成数进一步减少至357.78±23.24. 结果表明在Eca109/DDP细胞中, 白藜芦醇和顺铂联用可进一步增强顺铂对细胞的杀伤力.
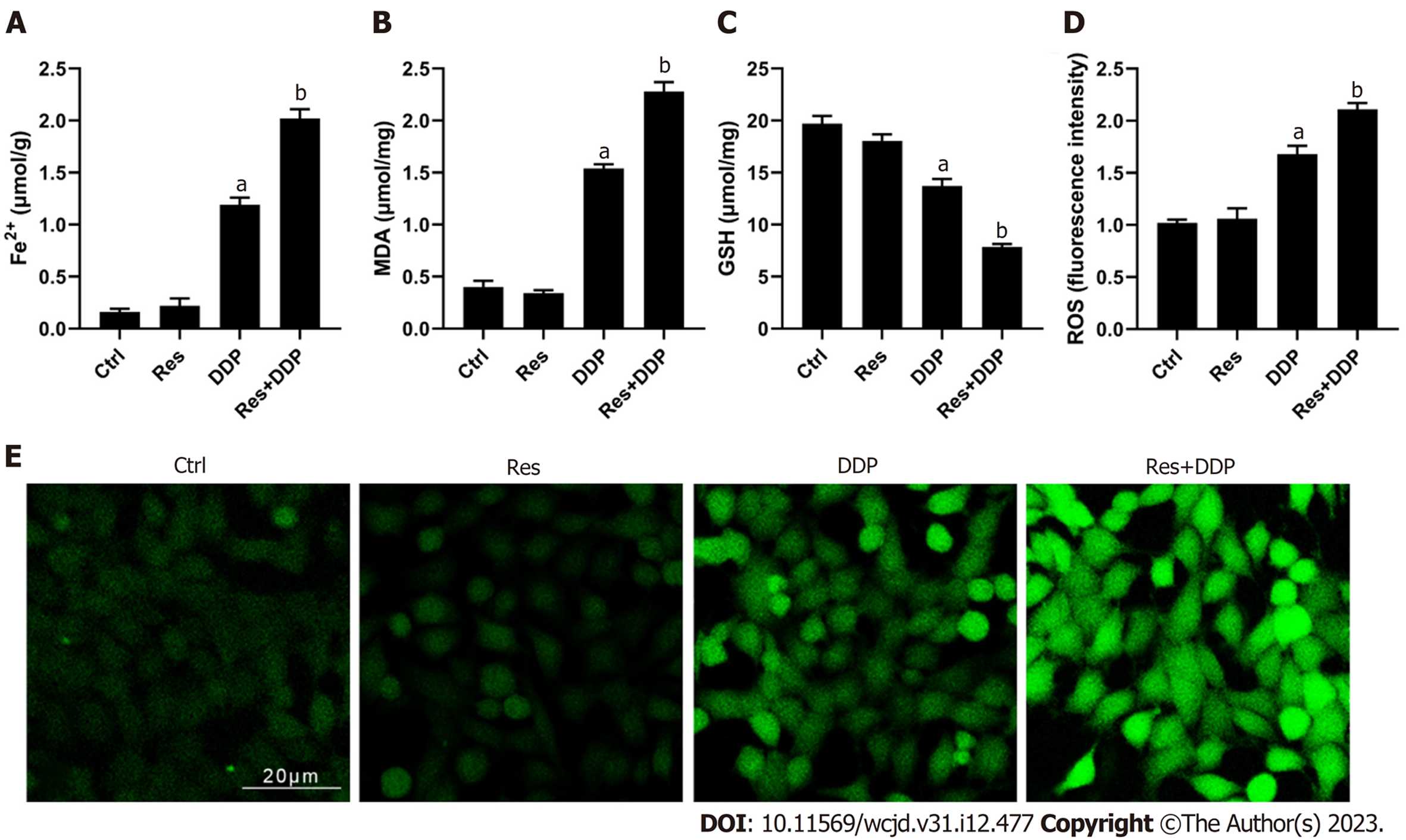
细胞铁死亡相关指标的检测结果显示(图3), 相比于对照组, 顺铂处理组(DDP组)细胞内二价铁离子的含量有所升高, 同时MDA和ROS水平显著升高(P<0.05), 而GSH水平显著降低. 加入30 μM的白藜芦醇预孵后, 细胞内二价铁离子的含量以及MDA和ROS水平显著高于DDP组; GSH水平则显著低于DDP组, 差异具有统计学意义(P<0.05). 结果说明白藜芦醇联用顺铂可显著促进Eca109/DDP细胞内铁离子的蓄积, 并诱导细胞铁死亡.
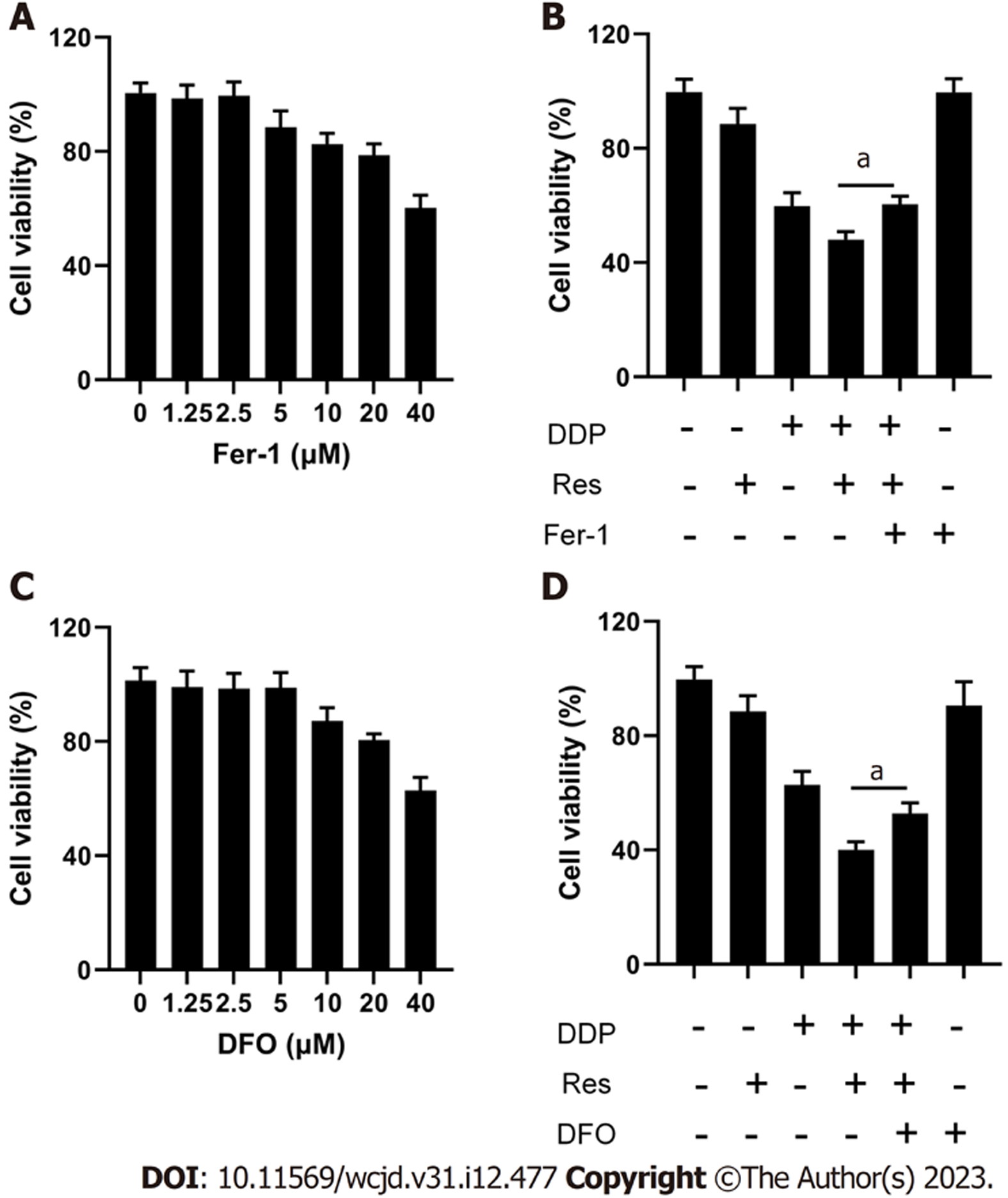
本部分实验通过Fer-1和DFO进一步验证白藜芦醇和顺铂联用逆转耐药性与铁死亡的相关性(图4), MTT细胞毒性检测结果显示Fer-1和DFO对Eca109/DDP细胞无明显损伤; 白藜芦醇和顺铂联用组(Res+DDP)细胞活力为(48.05±2.83)%, 加2.5 μM铁死亡抑制剂Fer-1或者2.5 μM铁离子螯合剂DFO干预, 细胞活力分别回升至(60.36±2.87)%和(57.70±2.74)%, 差异具有统计学意义(P<0.05). 结果表明, 白藜芦醇和顺铂联用所致的Eca109/DDP细胞增殖抑制作用可被铁死亡抑制剂Fer-1和铁离子螯合剂DFO部分逆转.
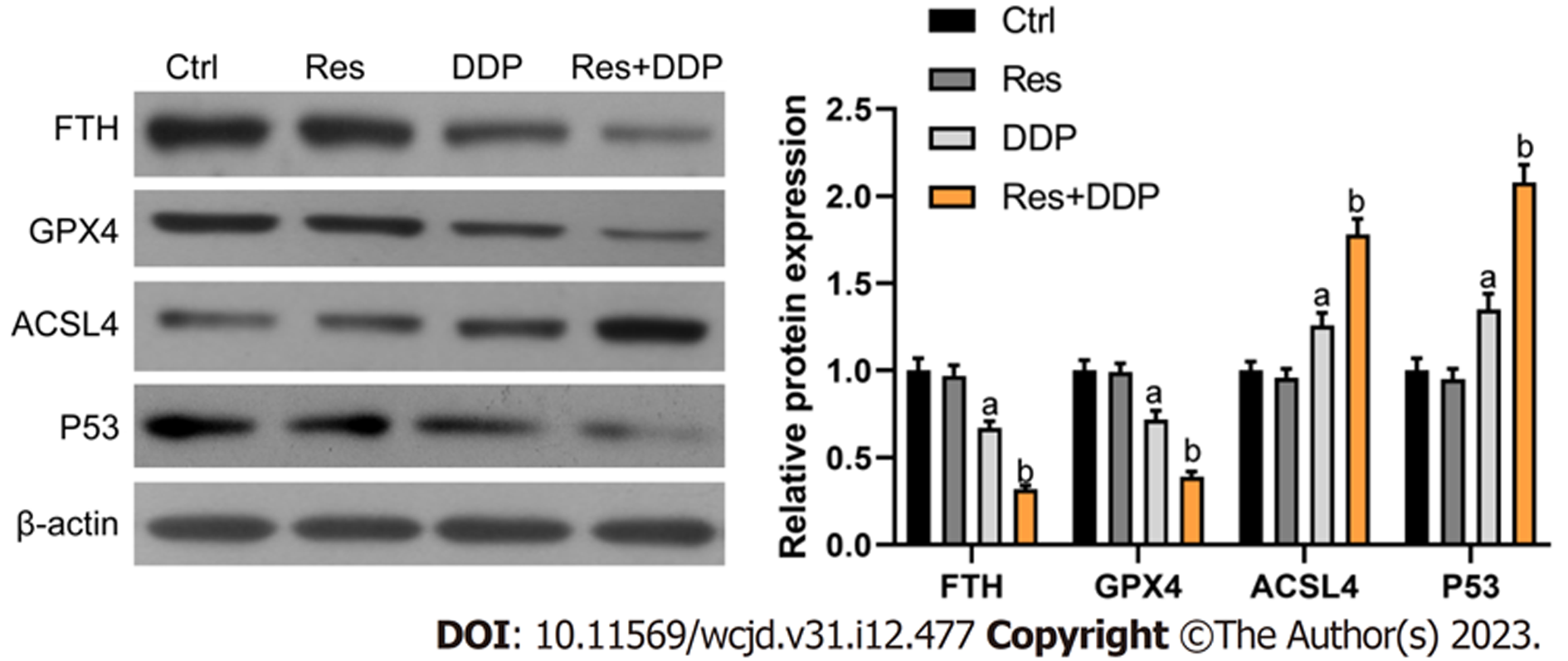
Western blot检测结果如图5所示, 相比于对照组, 顺铂处理组(DDP组)细胞内FTH及GPX4的蛋白表达有所降低(P<0.05); ACSL4及P53的蛋白表达则呈增加趋势(P<0.05). 白藜芦醇和顺铂联合处理组(Res+DDP组)细胞内FTH及GPX4的蛋白表达相比于DDP组显著降低(P<0.05); ACSL4及P53的蛋白表达相比于DDP组则进一步增加(P<0.05). 结果说明白藜芦醇可影响Eca109/DDP细胞内铁死亡相关调控因子的蛋白表达.
中药往往具有多种药理学功效, 且自身毒副作用较小, 在应对复杂疾病上具有天然的优势. 本研究探究了白藜芦醇对食管癌顺铂耐药细胞Eca109/DDP化疗耐药性的影响. MTT药敏实验结果显示白藜芦醇自身对食管癌细胞Eca109和Eca109/DDP的毒性较小, 联合应用白藜芦醇和顺铂可增加Eca109/DDP细胞对顺铂的敏感性, 具有一定的耐药逆转效应. 同时克隆形成实验的结果显示相较于单用顺铂, 白藜芦醇和顺铂联用可进一步抑制Eca109/DDP细胞克隆形成, 提升顺铂的作用效果. 结果提示, 白藜芦醇可逆转食管癌顺铂耐药细胞Eca109/DDP对顺铂的耐药性.
化疗药物对肿瘤细胞的杀伤作用主要体现在抑制肿瘤细胞的无限增殖, 诱导其多种模式的死亡上[9]. 细胞死亡的方式主要包括: 细胞凋亡、细胞焦亡、坏死性凋亡、铁死亡以及自噬等, 它们具有不同的形态和生化特征[9-11]. 本研究从铁死亡的角度初步探究了白藜芦醇逆转Eca109/DDP细胞顺铂耐药性的作用机制. 铁死亡是一种铁和脂质过氧化依赖性的细胞死亡模式, 其主要特征表现为细胞内铁离子蓄积通过芬顿反应生成大量的ROS, 同时伴随GSH耗竭, 导致细胞内脂质过氧化物水平升高, 最终诱发细胞死亡[12]. 目前有大量的文献报道, 在包括胃癌[13]、结直肠癌[14]以及食管癌[15]中, 诱导细胞铁死亡是改善肿瘤细胞放化疗耐药的重要策略. 本研究的检测结果显示, 白藜芦醇联用顺铂可促进Eca109/DDP细胞内铁离子的蓄积, 并诱导细胞铁死亡; 同时白藜芦醇和顺铂联用所致的Eca109/DDP细胞增殖抑制作用可被铁死亡抑制剂Fer-1和铁离子螯合剂DFO部分逆转. 结果表明, 白藜芦醇可通过铁死亡途径逆转食管癌顺铂耐药细胞Eca109/DDP的耐药性.
铁离子依赖性脂质过氧化是铁死亡发生的关键特征, 故而细胞内调节脂质过氧化和铁代谢的相关因子也是调节铁死亡的关键因子[12]. GPX4是含硒GPX家族的成员之一, 可通过催化谷胱甘肽还原反应, 抑制脂质过氧化物的蓄积, 是抵抗铁死亡的核心因素[16]; ACSL4则是长链脂酰CoA合成酶家族的成员之一, 可通过参与合成易被氧化的膜磷脂诱发铁死亡[17]. 另一方面, 铁蛋白则是胞内铁的主要储存形式, 由铁蛋白重链1和轻链组成, 对防止铁超载进而产生ROS具有重要的意义[18]. 除了依赖于GPX4的铁死亡途径外, P53信号也被证明通过SLC7A11以及ALOX12等途径参与调控铁死亡[19]. 本实验的检测结果显示, 白藜芦醇联用顺铂可显著降低Eca109/DDP细胞内FTH和GPX4的蛋白表达, 而增加ACSL4以及P53的蛋白表达水平, 这可能是其促进铁死亡的调控机制之一.
综上所述, 白藜芦醇联合顺铂使用可显著提高食管癌细胞Eca109/DDP对顺铂的敏感性, 其作用机制可能是通过影响细胞铁死亡相关调控因子FTH、GPX4、ACSL4和P53的表达, 促进细胞内二价铁离子的蓄积, 进而诱导细胞铁死亡.
诱导癌细胞铁死亡是改善包括食管癌在内的多种肿瘤细胞放化疗耐药的重要策略.
白藜芦醇被报道其可作为多种化疗药的增敏剂, 但其在食管癌耐药细胞的顺铂化疗中的作用以及其中是否涉及铁死亡途径并不清楚.
探讨白藜芦醇对食管癌耐药细胞的顺铂敏感性的影响, 并验证铁死亡途径在此过程中所起的作用.
白藜芦醇+顺铂处理Eca109/DDP细胞后, 检测细胞活性和集落形成以验证白藜芦醇对顺铂的增敏作用, 并检测铁死亡关键表征和调控因子的水平. 用铁死亡抑制剂和铁离子螯合剂处理细胞, 观察是否消除了白藜芦醇对顺铂的增敏作用.
白藜芦醇在增强Eca109/DDP细胞对顺铂敏感过程中伴随促进铁死亡, 抑制铁死亡能在一定程度上消除白藜芦醇对顺铂的增敏作用.
白藜芦醇可通过诱导细胞铁死亡来恢复食管癌顺铂耐药细胞Eca109/DDP对顺铂的敏感性.
白藜芦醇可能是改善食管癌耐药的潜在药剂.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): A
B级 (非常好): B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Qiu H, Cao S, Xu R. Cancer incidence, mortality, and burden in China: a time-trend analysis and comparison with the United States and United Kingdom based on the global epidemiological data released in 2020. Cancer Commun (Lond). 2021;41:1037-1048. [PubMed] [DOI] |
| 2. | Demarest CT, Chang AC. The Landmark Series: Multimodal Therapy for Esophageal Cancer. Ann Surg Oncol. 2021;28:3375-3382. [PubMed] [DOI] |
| 3. | Mwachiro M, White R. Management of Esophageal Cancer Treatment in Resource-Limited Settings. Thorac Surg Clin. 2022;32:397-404. [PubMed] [DOI] |
| 4. | Lohan-Codeço M, Barambo-Wagner ML, Nasciutti LE, Ribeiro Pinto LF, Meireles Da Costa N, Palumbo A. Molecular mechanisms associated with chemoresistance in esophageal cancer. Cell Mol Life Sci. 2022;79:116. [PubMed] [DOI] |
| 5. | Tang KY, Du SL, Wang QL, Zhang YF, Song HY. Traditional Chinese medicine targeting cancer stem cells as an alternative treatment for hepatocellular carcinoma. J Integr Med. 2020;18:196-202. [PubMed] [DOI] |
| 6. | Ren B, Kwah MX, Liu C, Ma Z, Shanmugam MK, Ding L, Xiang X, Ho PC, Wang L, Ong PS, Goh BC. Resveratrol for cancer therapy: Challenges and future perspectives. Cancer Lett. 2021;515:63-72. [PubMed] [DOI] |
| 7. | Muhanmode Y, Wen MK, Maitinuri A, Shen G. Curcumin and resveratrol inhibit chemoresistance in cisplatin-resistant epithelial ovarian cancer cells via targeting P13K pathway. Hum Exp Toxicol. 2022;41:9603271221095929. [PubMed] [DOI] |
| 8. | Zhang W, Jiang H, Chen Y, Ren F. Resveratrol chemosensitizes adriamycin-resistant breast cancer cells by modulating miR-122-5p. J Cell Biochem. 2019;120:16283-16292. [PubMed] [DOI] |
| 9. | Zhao S, Tang Y, Wang R, Najafi M. Mechanisms of cancer cell death induction by paclitaxel: an updated review. Apoptosis. 2022;27:647-667. [PubMed] [DOI] |
| 10. | Das S, Shukla N, Singh SS, Kushwaha S, Shrivastava R. Mechanism of interaction between autophagy and apoptosis in cancer. Apoptosis. 2021;26:512-533. [PubMed] [DOI] |
| 11. | 王 婷安, 吴 留成, 韦 尉元, 凌 通, 黄 名威, 覃 宇周. 铁死亡调控通路及其在肿瘤放化疗和免疫治疗抵抗中的研究进展. 中国癌症防治杂志. 2022;14:682-686. [DOI] |
| 12. | Valashedi MR, Najafi-Ghalehlou N, Nikoo A, Bamshad C, Tomita K, Kuwahara Y, Sato T, Roushandeh AM, Roudkenar MH. Cashing in on ferroptosis against tumor cells: Usher in the next chapter. Life Sci. 2021;285:119958. [PubMed] [DOI] |
| 13. | Ouyang S, Li H, Lou L, Huang Q, Zhang Z, Mo J, Li M, Lu J, Zhu K, Chu Y, Ding W, Zhu J, Lin Z, Zhong L, Wang J, Yue P, Turkson J, Liu P, Wang Y, Zhang X. Inhibition of STAT3-ferroptosis negative regulatory axis suppresses tumor growth and alleviates chemoresistance in gastric cancer. Redox Biol. 2022;52:102317. [PubMed] [DOI] |
| 14. | Zhang Q, Deng T, Zhang H, Zuo D, Zhu Q, Bai M, Liu R, Ning T, Zhang L, Yu Z, Zhang H, Ba Y. Adipocyte-Derived Exosomal MTTP Suppresses Ferroptosis and Promotes Chemoresistance in Colorectal Cancer. Adv Sci (Weinh). 2022;9:e2203357. [PubMed] [DOI] |
| 15. | Yao W, Wang J, Meng F, Zhu Z, Jia X, Xu L, Zhang Q, Wei L. Circular RNA CircPVT1 Inhibits 5-Fluorouracil Chemosensitivity by Regulating Ferroptosis Through MiR-30a-5p/FZD3 Axis in Esophageal Cancer Cells. Front Oncol. 2021;11:780938. [PubMed] [DOI] |
| 16. | Wang Z, Wu S, Zhu C, Shen J. The role of ferroptosis in esophageal cancer. Cancer Cell Int. 2022;22:266. [PubMed] [DOI] |
| 17. | Doll S, Proneth B, Tyurina YY, Panzilius E, Kobayashi S, Ingold I, Irmler M, Beckers J, Aichler M, Walch A, Prokisch H, Trümbach D, Mao G, Qu F, Bayir H, Füllekrug J, Scheel CH, Wurst W, Schick JA, Kagan VE, Angeli JP, Conrad M. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition. Nat Chem Biol. 2017;13:91-98. [PubMed] [DOI] |
| 18. | Hu W, Zhou C, Jing Q, Li Y, Yang J, Yang C, Wang L, Hu J, Li H, Wang H, Yuan C, Zhou Y, Ren X, Tong X, Du J, Wang Y. FTH promotes the proliferation and renders the HCC cells specifically resist to ferroptosis by maintaining iron homeostasis. Cancer Cell Int. 2021;21:709. [PubMed] [DOI] |
| 19. | Liu Y, Gu W. p53 in ferroptosis regulation: the new weapon for the old guardian. Cell Death Differ. 2022;29:895-910. [PubMed] [DOI] |