修回日期: 2023-04-02
接受日期: 2023-05-24
在线出版日期: 2023-06-08
多数肝癌患者就诊时已进展至中晚期, 安全有效的抗肿瘤治疗方式十分重要. 肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)可控制肿瘤增殖、侵袭, 仑伐替尼有抗血管生成作用, 二者联合应用可能对中晚期肝癌治疗效果更佳.
探究仑伐替尼联合TACE治疗中晚期肝癌的的疗效及对增殖指标细胞增殖核抗原67(proliferating cell nuclear antigen 67, Ki-67)、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、浸润转移指标高尔基体蛋白73(golgi protein 73, GP73)、磷脂酰肌醇蛋白聚糖(glypicans-3, GPC-3)水平的影响.
回顾性选取我院2018-01/2021-05中晚期肝癌患者102例作为研究对象, 根据临床病理特征差异给予不同治疗方案, 并分组, 各51例. 对照组采取TACE治疗, 观察组采取仑伐替尼联合TACE治疗. 比较两组疾病缓解率、治疗前后肿瘤标志物[糖类抗原199(carbohydrate antigen 199, CA199)、甲胎蛋白(alpha-fetoprotein, AFP)]、肝功能指标[谷草转氨酶(aspartate aminotransferase, AST)、谷丙转氨酶(alanine aminotransferase, ALT)、碱性磷酸酶(alkaline phosphatase, ALP)、总胆红素(total bilirubin, TBIL)]、血清Ki-67、PCNA、GP73、GPC-3水平及不良反应.
观察组疾病缓解率高于对照组(P<0.05); 两组治疗2 mo后血清AFP、CA199水平较治疗前下降, 观察组低于对照组(P<0.05); 治疗2 mo后两组血清Ki-67、PCNA、GP73、GPC-3低于治疗前, 观察组低于对照组(P<0.05); 治疗2 mo后观察组血清ALT、AST、ALP、TBIL水平与对照组差异无统计学意义; 观察组不良反应与对照组无明显差异; 随访12 mo, 观察组失访1例, 对照组失访2例. 观察组12 mo生存率高于对照组(P<0.05).
仑伐替尼联合TACE治疗中晚期肝癌能提高疾病缓解率, 降低血清Ki-67、PCNA、GP73、GPC-3、CA199及AFP水平, 减轻肿瘤恶性程度, 提高生存率, 且不增加肝功能损伤风险与药物不良反应.
核心提要: 本研究尝试探究仑伐替尼联合肝动脉化疗栓塞术治疗中晚期肝癌的疾病缓解率、不良反应的影响, 发现二者联合能提高中晚期肝癌疾病缓解率, 降低血清Ki-67、增殖细胞核抗原、高尔基体蛋白73、磷脂酰肌醇蛋白聚糖、肿瘤标志物(糖类抗原199及甲胎蛋白)水平, 提高生存率, 且不增加不良反应.
引文著录: 胡邵宁, 朱书渊, 魏燕斌. 仑伐替尼联合TACE治疗中晚期肝癌的疗效及对血清Ki-67、PCNA、GP73、GPC-3水平的影响. 世界华人消化杂志 2023; 31(11): 470-476
Revised: April 2, 2023
Accepted: May 24, 2023
Published online: June 8, 2023
Most liver cancer patients are diagnosed at mid-late stages, and safe and effective anti-tumor treatment is crucial. Transcatheter arterial chemoembolization (TACE) can control tumor proliferation and invasion, while lenvatinib has anti-angiogenic effects. The combination of the two may have better therapeutic effects on mid-late stage liver cancer.
To evaluate the efficacy of lenvatinib in combination with TACE in the treatment of mid-late stage hepatocellular carcinoma and explore their effect on the levels of proliferating cell nuclear antigen 67 (Ki-67), proliferating cell nuclear antigen (PCNA), Golgi protein 73 (GP73), and glypicans-3 (GPC-3), which are indicators of tumor cell proliferation, infiltration, and metastasis.
One hundred and two patients with mid-late stage hepatocellular carcinoma diagnosed at our hospital from January 2018 to May 2021 were retrospectively selected as study subjects and given different treatment regimens according to the differences in clinicopathological characteristics. The patients were divided into either a control group or an observation group, with 51 cases in each group. The control group was treated with TACE and the observation group was treated with lenvatinib combined with TACE. The disease remission rate, tumour markers [carbohydrate antigen 199 (CA199) and alpha-fetoprotein (AFP)], liver function indexes [aspartate aminotransferase (AST), alanine aminotransferase (ALT), alkaline phosphatase (ALP), and total bilirubin (TBIL)], serum Ki-67, PCNA, GP73, and GPC-3 levels, and adverse effects were compared between the two groups before and after treatment.
The disease remission rate in the observation group was significantly higher than that in the control group (P < 0.05). Serum AFP and CA199 levels decreased significantly in both groups after 2 mo of treatment compared with those before treatment, and the decrease was more significant in the observation group than in the control group (P < 0.05). Serum Ki-67, PCNA, GP73, and GPC-3 were significantly lower in both groups after 2 mo of treatment than those before treatment, and the decrease was more significant in the observation group than in the control group (P < 0.05). After 2 mo of treatment, there was no statistically significant difference in serum ALT, AST, ALP or TBIL levels between the two groups (P > 0.05). There was also no significant difference in the adverse reactions between the two groups (P > 0.05). At the 12 mo follow-up, there was one case of loss to follow-up in the observation group and two cases in the control group. The 12-mo survival rate of the observation group was signficantly higher than that of the control group (P < 0.05).
Lenvatinib in combination with TACE for the treatment of mid-late stage hepatocellular carcinoma improves disease remission rates, reduces serum Ki-67, PCNA, GP73, GPC-3, CA199, and AFP levels, reduces tumour malignancy, and improves survival rates without increasing the risk of liver function damage and adverse drug reactions.
- Citation: Hu SN, Zhu SY, Wei YB. Lenvatinib in combination with transcatheter arterial chemoembolization for treatment of mid-late stage hepatocellular carcinoma: Efficacy and impact on serum Ki-67, PCNA, GP73, and GPC-3 levels. Shijie Huaren Xiaohua Zazhi 2023; 31(11): 470-476
- URL: https://www.wjgnet.com/1009-3079/full/v31/i11/470.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i11.470
肝癌是临床常见消化道恶性肿瘤, 据统计, 肝癌发病率在所有恶性肿瘤中居于第三位, 死亡率居于第二位, 已成为全球范围内严重的公共卫生问题之一[1,2]. 早期肝癌无明显临床症状, 多数患者就诊时已进展至中晚期, 丧失最佳手术根治时间[3]. 近年来, 肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)成为临床治疗中晚期肝癌的主要手段, 可通过阻断肿瘤组织血供控制肿瘤增殖、侵袭, 从而达到抗肿瘤的目的[4]. 但研究表明[5,6], TACE术后出现的缺氧缺血现象会促使肿瘤新生血管形成, 增加肿瘤复发风险, 是TACE治疗失败的重要因素. 仑伐替尼属于抗血管生成药物, 可高选择性地结合生长因子受体, 竞争性抑制生长因子与其受体结合, 从而发挥抗肿瘤作用[7]. 目前关于仑伐替尼联合TACE的应用价值仍缺乏大量循证依据. 为此, 本研究尝试探究仑伐替尼联合TACE治疗中晚期肝癌的疾病缓解率、不良反应的影响. 报告如下.
回顾性选取我院2018-09/2021-08中晚期肝癌患者102例作为研究对象, 按照治疗方案不同分组, 各51例. 两组年龄、性别、肿瘤直径、巴塞罗那分期、肝功能Child-Pugh分级、远处转移、合并门脉癌栓、慢性肝炎等一般资料均衡可比(P>0.05), 见表1. 本研究经我院伦理委员会审批通过.
| 资料 | 观察组(n = 51) | 对照组(n = 51) | t/χ2 | P |
| 性别 | 0.382 | 0.537 | ||
| 男 | 31(60.78) | 34(66.67) | ||
| 女 | 20(39.22) | 17(33.33) | ||
| 年龄(岁) | 57.13±6.65 | 58.02±7.14 | 0.651 | 0.516 |
| 肿瘤直径(cm) | 6.28±0.61 | 6.19±0.57 | 0.770 | 0.443 |
| BCLC分期 | 0.158 | 0.691 | ||
| B期 | 22(43.14) | 24(47.06) | ||
| C期 | 29(56.86) | 27(52.94) | ||
| 肝功能Child-Pugh分级 | 0.166 | 0.685 | ||
| A级 | 30(58.82) | 32(62.75) | ||
| B级 | 21(41.18) | 19(37.25) | ||
| 远处转移 | 12(23.53) | 10(12.61) | 0.232 | 0.630 |
| 合并门脉癌栓 | 8(15.69) | 5(9.80) | 0.793 | 0.373 |
| 合并慢性肝炎 | 10(19.61) | 11(21.57) | 0.060 | 0.807 |
(1)纳入标准: 均基于《原发性肝癌诊疗规范(2017年版)》标准经影像学(腹部彩超、肝脏CT等)、病理学(穿刺活检)检查首次确诊为原发性肝癌; 预计生存期>6 mo; 符合TACE治疗指征; 患者及家属均知情, 自愿签订知情同意书; 治疗前肾功能正常; 临床资料完整; (2)排除标准: 伴有活动性出血者; 合并精神病史、认知异常者; 心脑肾肺等其他重要脏器功能异常者; 存在其他肿瘤者; 凝血功能异常者; 对本研究药物过敏或存在药物禁忌者.
(1)治疗方法根据临床病理特征制定: 对照组采取TACE治疗, 患者均取仰卧位, 常规消毒铺巾, 局麻, 采用改良Seldinger技术经右股动脉穿刺置管, 在导丝引导下将导管(5F)置入腹腔, 行肝动脉造影, 仔细观察肿瘤病灶部位、大小及血供等情况, 将洛铂(海南长安国际制药有限公司, 批准文号: 国药准字H20050308, 规格: 10 mg)40 mg、盐酸表柔比星(浙江海正药业股份有限公司, 批准文号: 国药准字H19990279, 规格: 10 mg)40 mg采用明胶海绵辅助栓塞处理. 术后下肢严格制动8 h, 卧床24 h, 密切监测患者生命体征. 观察组在对照组基础上给予仑伐替尼(Eisai GmbH, 批准文号: HJ20200044, 规格: 4 mg), 口服, 体质量<60 kg者起始剂量为8 mg/次, 1次/d, ≥60 kg者起始剂量为12 mg/次, 1次/d, 并根据患者实际情况合理调整剂量, 持续用药2 mo; (2)检测方法: 以化学发光法测定糖类抗原199(carbohydrate antigen 199, CA199)水平, 采用酶联免疫吸附法检测血清甲胎蛋白(alpha fetoprotein, AFP)、Ki-67、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、高尔基体蛋白73(golgi protein 73, GP73)、磷脂酰肌醇蛋白聚糖-3(glypicans-3, GPC-3)水平, 采用日本日立有限公司全自动生化分析仪(型号为7170A)检测血清谷草转氨酶(aspartate aminotransferase, AST)、谷丙转氨酶(alanine aminotransferase, ALT)、碱性磷酸酶(alkaline phosphatase, ALP)、总胆红素(total bilirubin, TBIL)水平.
肿瘤病灶消失, 维持时间>4 wk为完全缓解(complete remission, CR); 肿瘤病灶缩小≥50%, 维持时间>4 wk为部分缓解(partial remission, PR); 肿瘤病灶缩小<50%或增加<25%为稳定(stable disease, SD); 肿瘤病灶增加≥25%为进展(progressive disease, PD). 将CR、PR纳入疾病缓解率.
(1)两组疾病缓解率; (2)两组治疗前、治疗2 mo后肿瘤标志物血清AFP、CA199水平; (3)两组治疗前、治疗2 mo后肿瘤恶性程度指标血清Ki-67、PCNA、GP73、GPC-3水平; (4)两组治疗前、治疗2 mo后血清ALT、AST水平; (5)两组不良反应; (6)两组生存预后, 随访12 mo统计对比两组生存率.
统计学处理 采用统计学软件SPSS 22.0处理数据, 计量资料均确认具备方差齐性且近似服从正态分布, 以mean±SD描述, 组间比较采用独立样本t检验; 计数资料用n(%)表示, χ2检验. P<0.05表明差异有统计学意义.
观察组疾病缓解率高于对照组(P<0.05), 见表2.
| 组别 | 例数 | CR | PR | SD | PD | 疾病缓解率 |
| 观察组 | 51 | 1(1.96) | 36(70.59) | 9(17.65) | 5(9.80) | 37(72.55) |
| 对照组 | 51 | 0(0.00) | 27(52.94) | 15(29.41) | 9(17.65) | 27(52.94) |
| χ2 | 4.194 | |||||
| P | 0.041 |
两组治疗前血清AFP、CA199水平差异无统计学意义; 两组治疗2 mo后血清AFP、CA199水平较治疗前下降, 观察组低于对照组(P<0.05), 见表3.
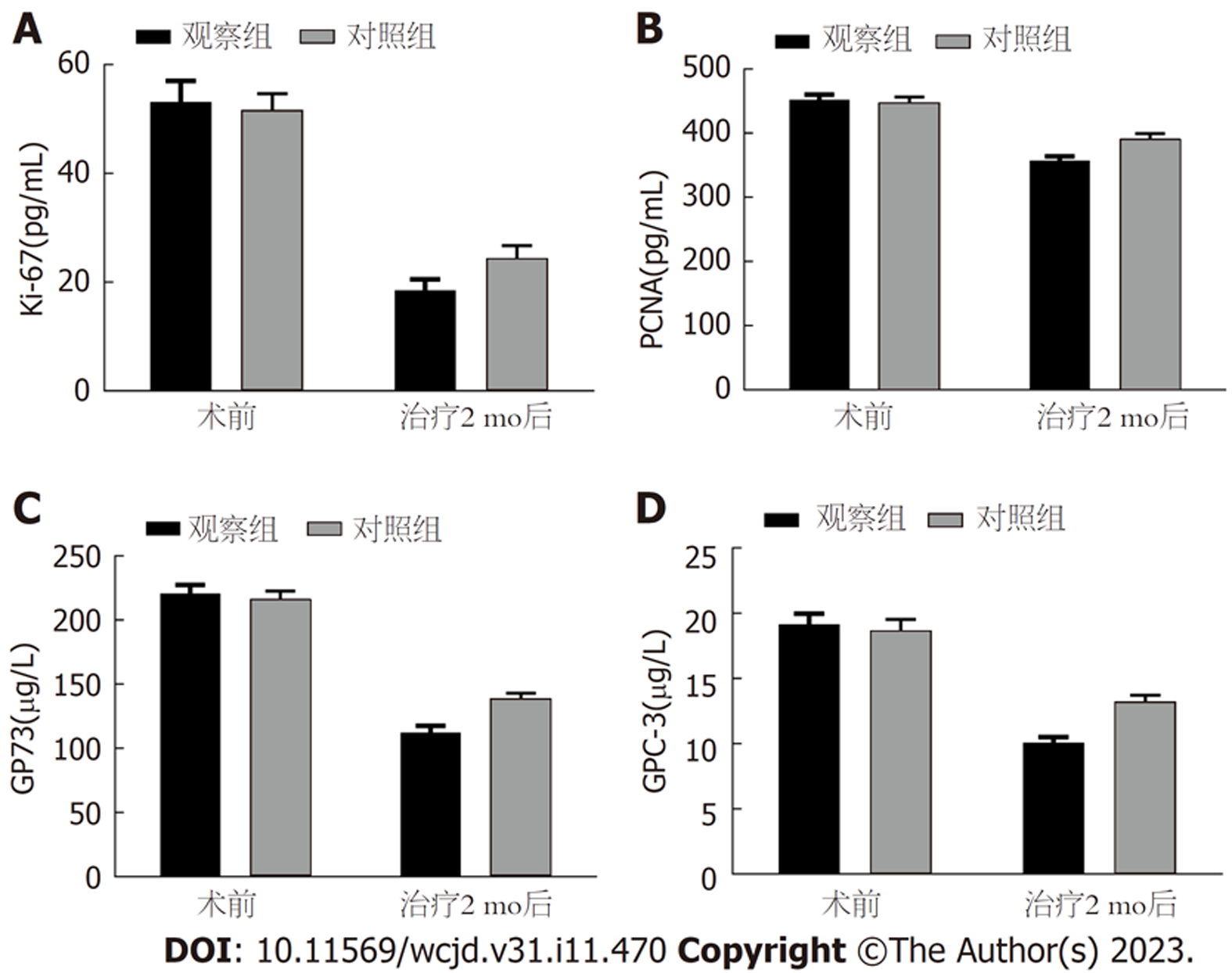
两组治疗前血清Ki-67、PCNA、GP73、GPC-3差异无统计学意义; 治疗2 mo后两组血清Ki-67、PCNA、GP73、GPC-3低于治疗前, 观察组低于对照组(P<0.05), 见表4、图1.
| 时间 | 组别 | 例数 | Ki-67(pg/mL) | PCNA(pg/mL) | GP73(μg/L) | GPC-3(μg/L) |
| 治疗前 | 观察组 | 51 | 53.16±13.79 | 452.38±28.15 | 220.78±23.34 | 19.15±2.89 |
| 对照组 | 51 | 51.72±10.56 | 448.19±30.07 | 216.59±21.52 | 18.68±3.04 | |
| t | 0.592 | 0.727 | 0.943 | 0.800 | ||
| P | 0.555 | 0.469 | 0.348 | 0.426 | ||
| 治疗2 mo后 | 观察组 | 51 | 18.51±7.10a | 357.22±23.34a | 112.36±18.76a | 10.10±1.47a |
| 对照组 | 51 | 24.39±8.32a | 392.05±26.17a | 138.77±15.32a | 13.24±1.68a | |
| t | 3.839 | 7.093 | 7.787 | 10.045 | ||
| P | <0.001 | <0.001 | <0.001 | <0.001 |
两组治疗前、治疗2 mo后血清ALT、AST、ALP、TBIL水平差异无统计学意义, 见表5.
| 组别 | 例数 | ALT(U/L) | AST(U/L) | ALP(U/L) | TBIL(μmol/L) | ||||
| 治疗前 | 治疗2 mo后 | 治疗前 | 治疗2 mo后 | 治疗前 | 治疗2 mo后 | 治疗前 | 治疗2 mo后 | ||
| 观察组 | 51 | 62.17±7.23 | 58.73±7.37 | 64.59±8.81 | 60.55±8.34 | 115.72±28.64 | 96.27±13.52 | 58.13±13.39 | 46.52±11.47 |
| 对照组 | 51 | 61.09±6.67 | 60.94±8.09 | 65.03±7.56 | 63.71±7.92 | 113.94±27.72 | 95.82±14.33 | 60.22±15.48 | 44.89±12.35 |
| t | 0.784 | 1.442 | 0.271 | 1.627 | 0.319 | 0.163 | 0.729 | 0.691 | |
| P | 0.425 | 0.152 | 0.787 | 0.107 | 0.750 | 0.871 | 0.468 | 0.491 | |
观察组不良反应与对照组无明显差异, 见表6.
| 组别 | 例数 | 恶心呕吐 | 便秘 | 食欲下降 | 肾功能异常 |
| 观察组 | 51 | 13(25.49) | 15(29.41) | 14(27.45) | 8(15.69) |
| 对照组 | 51 | 11(21.57) | 10(19.61) | 16(31.37) | 11(21.57) |
| χ2 | 0.218 | 1.325 | 0.189 | 0.582 | |
| P | 0.641 | 0.250 | 0.664 | 0.446 |
随访12 mo, 观察组失访1例, 对照组失访2例. 观察组12 mo生存率为86.00%(43/50)高于对照组69.39%(34/49)(χ2 = 3.951, P = 0.047).
肝癌具有发病率高、并发症多、预后差、死亡率高等特点, 相关资料显示, 我国每年约有11万人死于肝癌, 占全球范围内肝癌死亡人数的45%左右, 严重威胁我国居民生命健康及生存质量, 防治形势极为严峻[9,10]. 因此, 积极探索较为可靠、安全的治疗方案成为临床重要研究方向.
TACE是临床治疗中晚期肝癌的一线治疗方法, 对于无法进行手术切除治疗的中晚期肝癌患者而言, TACE可通过阻断肿瘤病灶血供达到控制肿瘤病情进展、延长生存期的目的[11]. 且相关研究表明[12], TACE可上调Fas在肝癌细胞中的表达, 抑制Bcl-xl表达, 从而加快肝癌细胞凋亡, 缩小肿瘤病灶. 但临床实践显示, 晚期肝癌患者经TACE治疗后仅少部分肿瘤病灶完全坏死, 多数肿瘤胞膜内外均可见存活的肿瘤细胞, 加之其在控制肿瘤新生血管方面作用欠佳, 导致术后肿瘤复发风险高, 需进行重复治疗, 极易损伤肝功能[13]. Makker等[14]报道证实, 仑伐替尼用于晚期子宫内膜癌具有良好治疗效果. 为此, 本研究尝试在TACE基础上给予仑伐替尼治疗中晚期肝癌患者, 结果显示, 观察组疾病缓解率显著高于对照组, 说明仑伐替尼联合TACE能显著提高治疗效果. 仑伐替尼属于新型靶向药物, 作为一种多靶点受体络氨酸激酶抑制剂, 对肿瘤血管生成相关通路具有控制作用, 其主要作用靶点包括cKIT、成纤维细胞生长因子受体1-4、血管内皮生长因子受体1-3等, 可经由以上靶点抑制肿瘤血管生成, 还可阻滞肿瘤细胞分裂、增殖, 从而加快肿瘤细胞坏死、凋亡, 达到抗肿瘤的目的, 有利于延长患者生存期[15,16]. AFP、CA199是临床常见肿瘤标志物, 可有效反映肿瘤发生发展情况[17]. Ki-67、PCNA、GP73、GPC-3作为细胞增殖相关, 可通过调节生长因子与受体之间的相互作用, 蛋白酶、胞外基质等结合, 影响信号传递, 对细胞生长、分化、肿瘤形成、转移发挥重要作用[18,19]. 本研究发现, 与TACE单独治疗相比, 仑伐替尼联合TACE治疗中晚期肝癌患者能显著降低血清AFP、CA199、Ki-67、PCNA、GP73、GPC-3水平, 提示两者联合在控制肿瘤进展、抑制肿瘤细胞生长方面具有明显优势. 分析原因, TACE能有效阻断病灶血流, 在此基础上, 仑伐替尼可有效抑制肿瘤新生血管生成, 控制肿瘤病灶侧支循环, 弥补TACE的局限性, 使得对肿瘤病灶血供的切断作用更为彻底有效, 从而致使肿瘤细胞无法增殖、侵袭, 进而明显降低肿瘤标志物水平[20,21]. 故仑伐替尼联合TACE在临床应用中具有较为突出的优势. 本研究结果还显示, 两者联合能够显著提高生存率, 与联合治疗时疗效增强有关.
此外, 除保障治疗效果外, 用药安全性亦是需要关注的重要因素[22,23]. 本研究结果显示, 治疗2 mo后, 两组血清ALT、AST、ALP、TBIL水平及不良发生率差异无统计学意义, 说明仑伐替尼联合TACE治疗不会增加肝功能损伤风险及药物不良反应. 但本研究中, 观察组胃肠道反应发生率高达29.41%, 提示临床在实际应用仑伐替尼中应重点关注胃肠道反应发生情况, 并及时采取对症处理措施, 控制胃肠道症状, 或视具体情况停药. 需注意的是, 若在服用仑伐替尼过程中患者出现动脉血栓栓塞, 则应永久停用仑伐替尼. 本研究局限性在于, 纳入样本少、随访时间短, 可能造成数据偏移, 需扩大样本量、延长随访时间, 以获取更为全面的数据支持.
综上可知, 仑伐替尼联合TACE治疗中晚期肝癌能提高疾病缓解率, 降低血清Ki-67、PCNA、GP73、GPC-3、CA199及AFP水平, 减轻肿瘤恶性程度, 提高生存率, 且不增加肝功能损伤风险与药物不良反应.
肝癌是全球最常见的恶性肿瘤之一, 病死率较高, 肝切除治疗后5年总存活率约50%, 但临床实际工作中仅10%-30%患者符合切除术指征.目前中晚期肝癌多采用放化疗、免疫治疗、靶向药物治疗等, 但单一方法疗效不理想. 本研究联合化疗、药物治疗, 旨在提高临床疗效.
探究仑伐替尼联合肝动脉化疗栓塞术(transcatheter arterial chemoembolization, TACE)治疗中晚期肝癌的的疗效, 拟分析该联合治疗方案对增殖指标Ki-67、增殖细胞核抗原(proliferating cell nuclear antigen, PCNA)、高尔基体蛋白73(golgi protein 73, GP73)、磷脂酰肌醇蛋白聚糖(glypicans-3, GPC-3)水平的影响, 从肿瘤增殖、浸润、转移方面观察对中晚期肝癌的治疗效果, 为临床治疗提供新思路.
观察仑伐替尼、TACE联合应用对中晚期肝癌肿瘤标志物、血清Ki-67、PCNA、GP73、GPC-3水平的影响, 发现该方案可有效降低上述指标水平, 在常规肿瘤标志物以外发现了抗肿瘤过程中的新型标志物.
研究中以治疗方案不同进行分组, 检测两组肿瘤标志物、肝功能及相关血清指标, 随访12 mo观察治疗后生存率, 创新性探究仑伐替尼联合TACE用于中晚期肝癌的影响.
研究结果表明仑伐替尼、TACE联合治疗确能提高中晚期肝癌疾病缓解率, 在不增加肝功能损伤及不良反应的前提下, 可有效调节病情进展过程中相关因子(AFP、CA199、Ki-67、PCNA、GP73、GPC-3)的异常表达; 对临床延长患者生存期具有重要指导意义.
研究在现有化疗、药物抗肿瘤的中晚期肝癌治疗方法基础上, 进行仑伐替尼、TACE联合的应用, 发现二者联合应用的效果优于单独化疗疗效, 为中晚期肝癌治疗提供了新思路, 从消杀恶性肿瘤细胞、一致肿瘤血管生成两个方面发挥协同作用, 可能对未来临床抗肿瘤工作具有一定指导作用.
未来进一步研究可吸取经验, 多渠道纳入病例, 进行大样本量研究, 病延长随访时间, 观察远期预后, 进一步证实抗血管药物与化疗联合方案的抗肿瘤效果.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): 0
D级 (一般): D, D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 2. | Yang WS, Zeng XF, Liu ZN, Zhao QH, Tan YT, Gao J, Li HL, Xiang YB. Diet and liver cancer risk: a narrative review of epidemiological evidence. Br J Nutr. 2020;124:330-340. [PubMed] [DOI] |
| 3. | 朱 泽民, 谢 智钦, 赵 志坚, 刘 智勇, 易 波, 唐 才喜. 阿帕替尼联合经导管肝动脉化疗栓塞治疗中晚期肝癌疗效及安全性的Meta分析. 中国普通外科杂志. 2019;28:798-808. [DOI] |
| 4. | 寸 江平, 姜 永能, 宗 璇, 万 程, 范 宏杰, 蔡 顺然. CalliSpheres微球联合空白微球TACE治疗中晚期肝癌的近期疗效及安全性研究. 介入放射学杂志. 2019;28:237-241. [DOI] |
| 6. | Liu K, Zhou C, Lv W, Cheng D, Lu D, Zhang Z, Xiao J, Zhang X, Fang W. Factors to transcatheter arterial chemoembolization Liver Cancer stage C. Minim Invasive Ther Allied Technol. 2020;29:49-55. [PubMed] [DOI] |
| 7. | 袁 冰, 张 金龙, 王 茂强, 王 燕, 阎 洁羽, 袁 凯, 王 修琪. TACE后应用仑伐替尼联合PD-1单抗治疗肝癌腹膜后淋巴结转移瘤一例. 中华转移性肿瘤杂志. 2019;2:40-41. [DOI] |
| 10. | 蔡 业冰, 任 家俊, 郝 风节, 叶 枫, 杨 宇尘, 龚 笑勇, 马 迪, 王 俊青, 陈 拥军. 人类假基因在以肝癌为主的肿瘤中的作用及研究进展. 诊断学理论与实践. 2019;18:590-594. [DOI] |
| 11. | Habibollahi P, Shamchi SP, Tondon R, Ecker BL, Gade TP, Hunt S, Soulen MC, Furth EE, Levine MH, Nadolski G. Combination of Neoadjuvant Transcatheter Arterial Chemoembolization and Orthotopic Liver Transplantation for the Treatment of Cirrhotomimetic Hepatocellular Carcinoma. J Vasc Interv Radiol. 2018;29:237-243. [PubMed] [DOI] |
| 13. | 胡 鸿, 廖 运国, 魏 欣, 唐 梓瑜, 邓 丹, 蒲 嘉骐, 钟 立明. 125I粒子植入或3DCRT联合TACE治疗晚期原发性肝癌患者临床疗效对比研究. 实用肝脏病杂志. 2020;23:268-271. [DOI] |
| 14. | Makker V, Taylor MH, Aghajanian C, Oaknin A, Mier J, Cohn AL, Romeo M, Bratos R, Brose MS, DiSimone C, Messing M, Stepan DE, Dutcus CE, Wu J, Schmidt EV, Orlowski R, Sachdev P, Shumaker R, Casado Herraez A. Lenvatinib Plus Pembrolizumab in Patients With Advanced Endometrial Cancer. J Clin Oncol. 2020;38:2981-2992. [PubMed] [DOI] |
| 15. | Kudo M, Finn RS, Qin S, Han KH, Ikeda K, Piscaglia F, Baron A, Park JW, Han G, Jassem J, Blanc JF, Vogel A, Komov D, Evans TRJ, Lopez C, Dutcus C, Guo M, Saito K, Kraljevic S, Tamai T, Ren M, Cheng AL. Lenvatinib versus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma: a randomised phase 3 non-inferiority trial. Lancet. 2018;391:1163-1173. [PubMed] [DOI] |
| 18. | 邬 谨鸿, 吴 晓凤, 钟 崇, 陈 湘宾. 软坚四逆散配合肝动脉化疗栓塞术治疗对原发性肝癌患者T淋巴细胞亚群、GP-73及GPC-3水平的影响. 广州中医药大学学报. 2022;39:19-24. [DOI] |
| 20. | 党 之俊, 温 树伟, 赵 玉山, 南 志宇. CalliSpheres载药栓塞微球联合仑伐替尼治疗原发性肝癌的效果及安全性分析. 中国临床实用医学. 2021;12:43-46. [DOI] |
| 21. | Zhao Y, Zhang YN, Wang KT, Chen L. Lenvatinib for hepatocellular carcinoma: From preclinical mechanisms to anti-cancer therapy. Biochim Biophys Acta Rev Cancer. 2020;1874:188391. [PubMed] [DOI] |