修回日期: 2023-05-04
接受日期: 2023-05-18
在线出版日期: 2023-06-08
临床上常规结核化疗方案治疗肠结核副作用较大. 附子理中丸是一种传统的治疗肠结核的中药. 研究其具体的生物学作用机制有助于肠结核的治疗的进一步研究.
基于网络药理学研究附子理中丸治疗肠结核的作用机制.
在TCMSP数据库中分别筛选附子理中丸5种主要药材的有效活性成分, 并从TCMSP及Drugbank数据库中收集有效成分的作用靶点; 在Genecards数据库收集肠结核相关的疾病靶点; 通过Venny 2.1.0在线网站取药物活性成分作用靶点与疾病靶点的重叠靶点作为药物治疗肠结核的潜在治疗靶点; 使用Cytoscape 3.9.1软件构建"药物-活性成分-靶点-疾病"网络; 在String在线数据库中构建药物潜在治疗靶点的蛋白质互作(protein-protein interaction, PPI)网络, 并通过Cytoscape 3.9.1软件进行拓扑学及可视化分析, 进一步选取核心作用靶点; 使用R4.1.2软件中的"clusterProfiler"程序包对潜在药物作用靶点进行京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)富集分析和基因本体论(Gene Ontology, GO)分析.
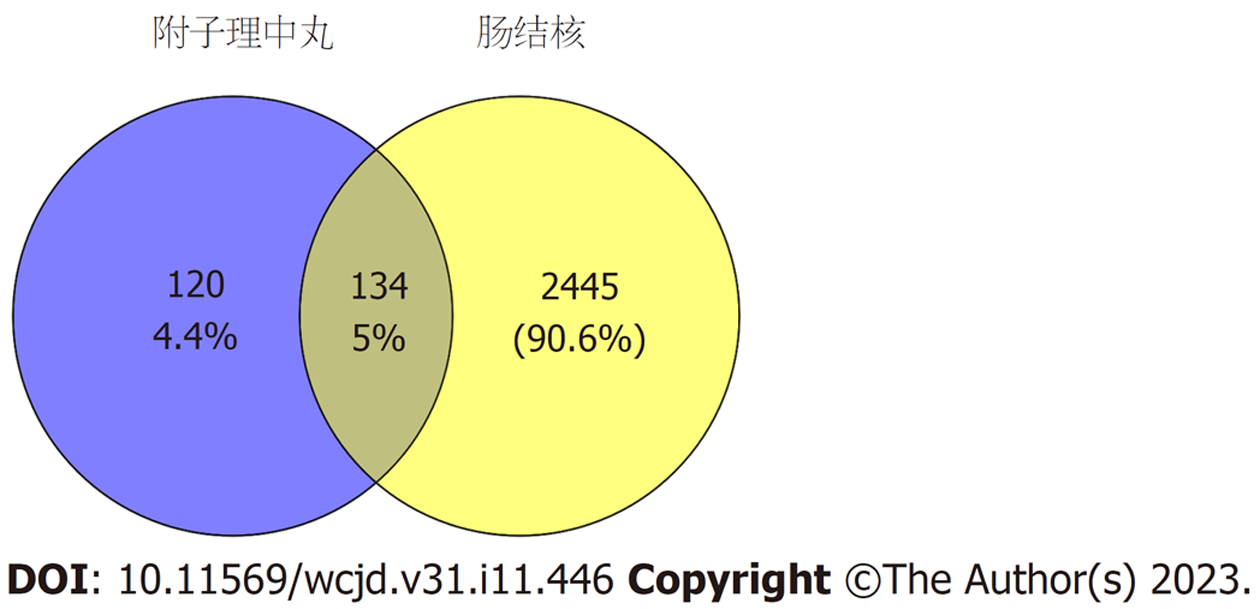
从公共数据库中一共收集了附子理中丸活性药物成分共108种, 药物作用靶点254个, 疾病靶点2579个; 筛选出的药物潜在治疗靶点一共134个, 核心靶点10个(AKT1、IL-6、TP53、VEGFA、IL1B、JUN、CASP3、PTGS2、PPARG、MAPK3); GO和KEGG富集分析提示附子理中丸治疗肠结核的生物学机制可能与细胞氧化应激、细胞因子参与的免疫调节相关, 可能参与的功能通路包括白介素17信号通路、氧化应激通路等.
附子理中丸治疗肠结核的作用机制与氧化应激、细胞因子参与的炎症或免疫调节相关, 为日后的临床或基础研究提供了研究方向.
核心提要: 本研究基于网络药理学分析, 构建了附子理中丸与肠结核蛋白互作网络, 并筛选出附子理中丸作用于肠结核的10个核心靶点, 通过京都基因和基因组百科全书富集分析和基因本体论分析发现了治疗作用机制与氧化应激、细胞因子参与的炎症或免疫调节相关.
引文著录: 苏敏, 钱纯, 张贞, 姜思宇, 李菁, 李云豪, 周辉. 附子理中丸治疗肠结核作用机制的网络药理学研究. 世界华人消化杂志 2023; 31(11): 446-455
Revised: May 4, 2023
Accepted: May 18, 2023
Published online: June 8, 2023
Conventional tuberculosis chemotherapy regimens used in clinical practice have significant side effects when treating intestinal tuberculosis (ITB). Fuzi Lizhong pills are a traditional Chinese medicine commonly used to treat ITB. Studying its exact mechanism of action can help further the research on the treatment of ITB.
To study the mechanism of Fuzi Lizhong pills for treatment of ITB based on network pharmacology.
The active components of five main medicinal materials of Fuzi Lizhong pills were screened from the TCMSP database, and the effective component-related targets were collected from the TCMSP and Drugbank databases. The targets related to ITB were collected from the Genecards database. Through the Venny2.1.0 online website, the overlapping targets of drug active components and disease targets were selected as potential therapeutic targets for the treatment of ITB. Cytoscape3.9.1 software was used to construct a network of "drug-active ingredients-targets-disease". The protein-protein interaction (PPI) network of drug potential therapeutic targets was constructed in the online database String. Then, the topology and visualization were analyzed with Cytoscape3.9.1 software, and the core targets were further selected. The potential therapeutic targets were analyzed by Kyoto Encyclopedia of Genes and Genomes (KEGG) and Gene Ontology (GO) enrichment analyses using the "clusterProfiler" package in R 4.1.2.
A total of 108 active drug components of Fuzi Lizhong pills, 254 drug action targets, and 2579 disease targets were screened from the public database. A total of 134 potential therapeutic targets and 10 core targets (AKT1, IL-6, TP53, VEGFA, IL1B, JUN, CASP3, PTGS2, PPARG, and MAPK3) were selected. GO and KEGG enrichment analyses suggested that the biological mechanism of Fuzi Lizhong pills for the treatment of ITB may be related to cellular oxidative stress, immune regulation involving cytokines, and functional pathways including the IL-17 signal pathway, oxidative stress pathway, and so on.
The mechanism of Fuzi Lizhong pills for treatment of ITB is related to oxidative stress and immune regulation of cytokines.
- Citation: Su M, Qian C, Zhang Z, Jiang SY, Li J, Li YH, Zhou H. Network pharmacology based research of mechanism of Fuzi Lizhong pills for treatment of intestinal tuberculosis. Shijie Huaren Xiaohua Zazhi 2023; 31(11): 446-455
- URL: https://www.wjgnet.com/1009-3079/full/v31/i11/446.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v31.i11.446
肠结核是由结核分枝杆菌引起的一类常见肺外结核病. 结核病是全球第三大致死性疾病, 尤其好发于发展中国家[1]. 在全球范围内, 肺外结核病占总结核病的20%, 而肠结核占所有肺外结核的10%[2]. 肠结核的临床表现主要是腹痛腹泻、腹部包块等, 且治疗预后较差, 常常引发肠狭窄、梗阻、穿孔出血等危及生命的并发症[2,3]. 类似传统的抗肺结核化疗方案虽能缓解症状, 但具体的治疗方案及疗程国际上仍无明确标准[4,5]. 而且长时间的使用抗结核化疗药物可引发不同程度的药物不良反应[6]. 随着祖国医学的日益发展, 越来越多的中医疗法或中药方剂在治疗肠结核上展现出了较好的疗效, 长时间使用也不会出现严重的药物不良反应[7,8].
附子理中丸是中医上常用于肠结核治疗的一种药物. 据《本草纲目》记载, 附子理中丸可以治疗"痈疮肿毒、腹中积滞、结核气痛、风寒痹痛"等症. 东汉张仲景所著《金匮要略》中提及附子理中丸可用于治疗"痰迷、寒结、满闷、疝瘕、腹中有热气、气滞疼痛". 一项现代临床研究表明[9], 附子理中丸联合抗结核药物治疗肠结核的疗效显著优于单纯应用抗结核药物. 但因为中药成分繁多, 具体的药物作用机制极其复杂, 目前尚无明确的研究能够解释附子理中丸治疗肠结核的作用机制. 为此, 本研究将基于网络药理学初步探索附子理中丸在肠结核治疗上的生物学作用机制, 为未来的临床或基础研究奠定理论基础.
1.1.1 公共数据集: 附子理中丸相关药物活性成分及作用靶蛋白下载自中药系统药理学数据库(TCMSP, https://old.tcmsp-e.com/tcmsp.php), 肠结核的相关疾病靶点下载自Genecards数据库(https://www.genecards.org/).
1.1.2 分析软件: 本研究所使用的数据分析均由基于R Studio平台的R4.1.2软件完成.
1.2.1 药物活性成分及靶点筛选: 应用TCMSP数据库分别检索附子理中丸中附子、干姜、党参、白术、甘草的有效成分. 口服生物利用度(oral bioavailability, OB)是指药物被人体循环吸收的速度和程度. 类药物(drug-like, DL)性质反映了具有特定官能团或包含相同或相似物理特征的药物的性质. 以口服OB≥30%、类药性DL≥0.18为条件筛选5中配方的药物活性成分. 然后获取TCMSP及Drugbank数据库(https://go.drugbank.com/)中药物成分的作用靶蛋白质, 并去除没有作用靶蛋白质的活性成分. 然后利用UniProt数据库(http://www.uniprot.org/uploadlists/), 将物种限定为"Homo sapiens"后把获取的靶蛋白质转换为统一的基因名称.
1.2.2 肠结核靶点筛选: Genecards数据库是一个提供基因组、蛋白质组、转录、遗传和功能方面的所有已知人类基因的平台. 在Genecards数据库中以关键词"intestinal tuberculosis"进行搜索, 收集肠结核相关的疾病靶点.
1.2.3 "成分-靶点-疾病"网络的构建: 将Genecards数据库中检索到的肠结核靶点与附子理中丸的活性成分作用靶点通过Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)取交集, 得到重叠的基因靶点, 视为药物潜在作用于肠结核的靶点. 最后, 在Cytoscape 3.9.1中构建"药物-活性成分-重叠靶点-疾病"网络图.
1.2.4 蛋白质互作(protein-protein interaction, PPI)网络的构建: 为了确定附子理中丸的潜在作用于肠结核的靶点以及它们之间的相互作用, 将选择的靶点导入到STRING网络平台( https://cn.string-db.org/)中, 构建蛋白质-PPI网络. 蛋白质类型设置为"Homo sapiens", 置信度设置为中等(0.400). 利用CytoNCA插件进行网络拓扑学分析, 并根据连接度(degree)大小对潜在作用靶点排序, 筛选出degree值前10的靶点作为附子理中丸治疗于肠结核的核心靶点, 并构建核心靶点关系图.
1.2.5 生物学功能富集分析: 为了进一步探索筛选出来的药物潜在作用靶点的相关生物学功能及功能通路, 使用R4.1.2软件中的"clusterProfiler"程序包对潜在作用靶点进行京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)富集分析和基因本体论(Gene Ontology, GO)分析, 其中GO分析包括生物过程(biological process, BP)、细胞成分(cellular component, CC)和分子功能(molecular function, MF)分析. 以P<0.05为标准, 由小到大排序选择P值前30的KEGG功能通路和GO分析中前10的MF、CC、BP过程, 然后使用"ggplot2"程序包进行可视化分析.
统计学处理 采用R4.1.2软件进行数据统计分析, 采用单因素方差分析组间差异, 组间两两比较用最小显著性差异法, P<0.05为差异有统计学意义.
在TCMSP数据库中经OB及DL值筛选并去除没有对应靶点的活性成分, 最终共纳入108种药物活性成分, 包括附子5种, 党参14种, 白术3种, 干姜4种, 甘草85种. 值得注意的是, 谷甾醇(sitosterol)同时存在于附子、干姜和甘草中, 7-甲氧基-2-甲基异黄酮(7-Methoxy-2-methyl isoflavone)在党参和甘草中也均存在. 最后从TCMSP及Drugbank数据库中获取上述活性成分的相关靶蛋白质, 经UniProt数据库转换为基因名, 最终获得附子理中丸的药物作用靶点一共254个.
从Genecards数据库中以"intestinal tuberculosis"为关键词直接获取肠结核相关疾病靶基因一共2579个. 然后利用Venny 2.1.0在线网站取附子理中丸的药物作用靶点与肠结核疾病靶点的重叠部分基因, 如图1所示. 最终获得134个重叠基因, 并被视作附子理中丸治疗肠结核的潜在作用靶点.
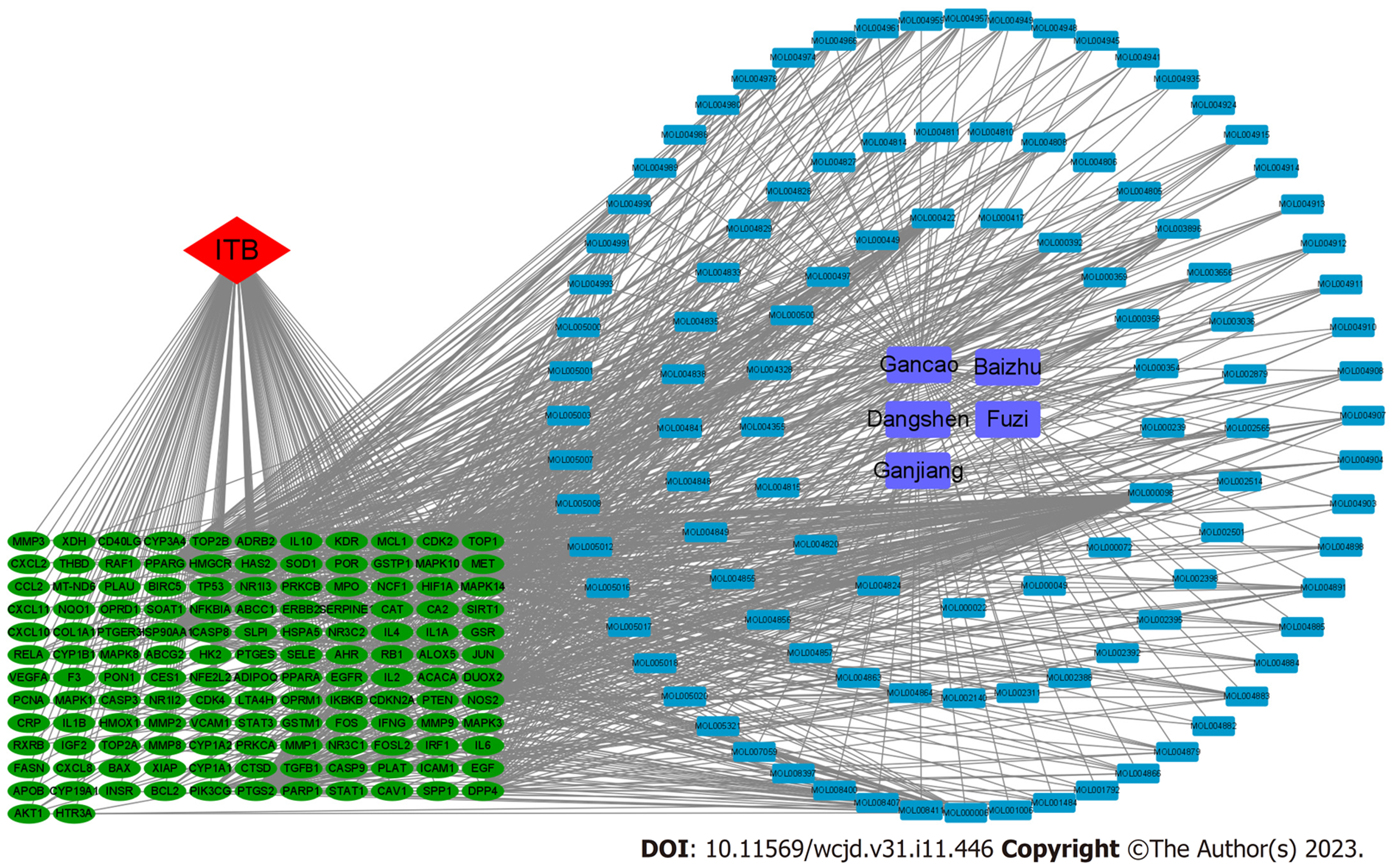
为了探索附子理中丸的活性成分、肠结核与潜在作用靶点的作用关系, 通过Ctoscape软件进行了"药物-活性成分-靶点-疾病"网络的可视化分析. 如图2所示. 通过Network Analyer计算, 一共有248个节点, 1041条边, 节点平均连接性为8.218, 网络密度为0.017, 说明了附子理中丸各成分对肠结核治疗是一个复杂的联合作用机制.
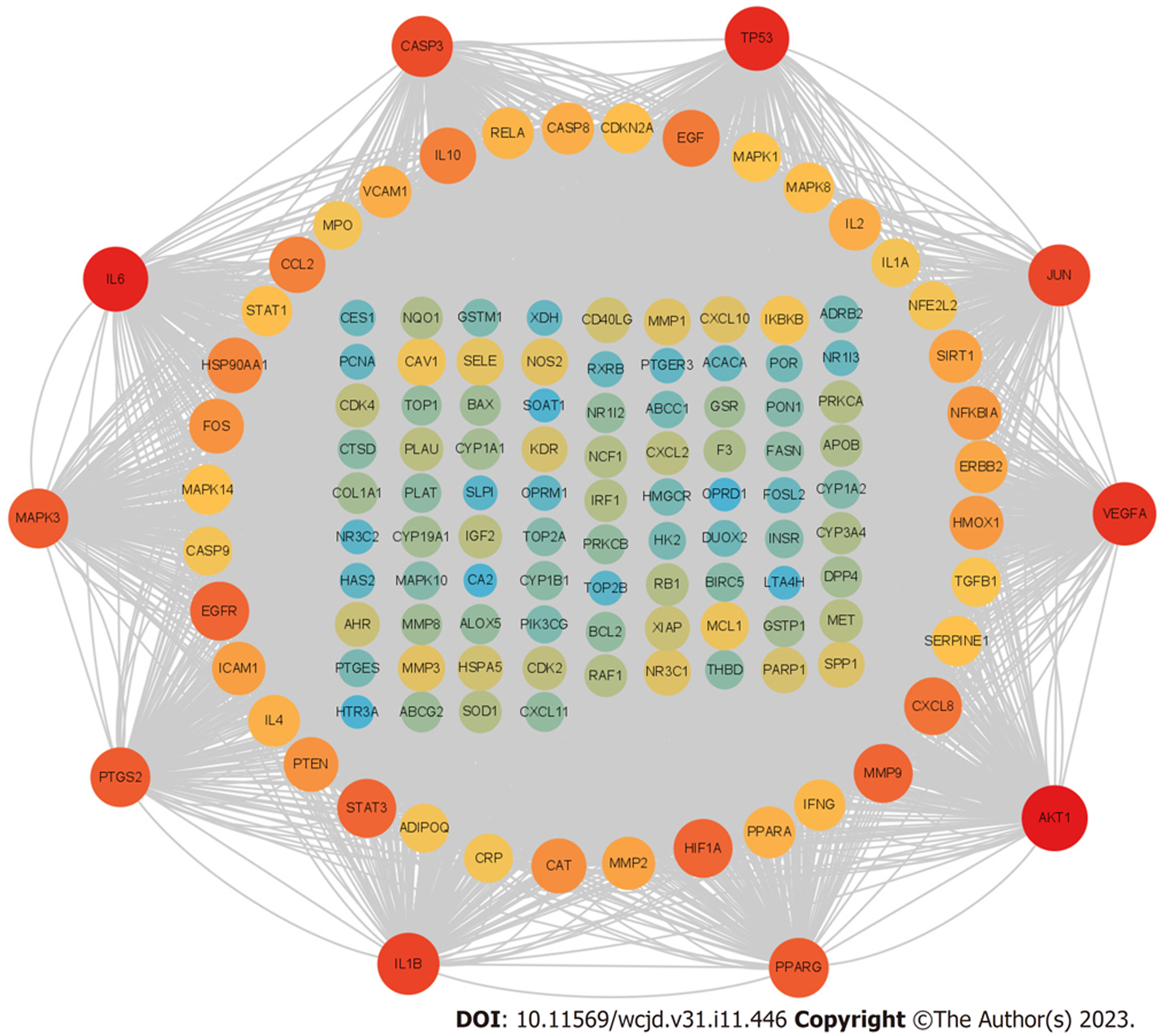
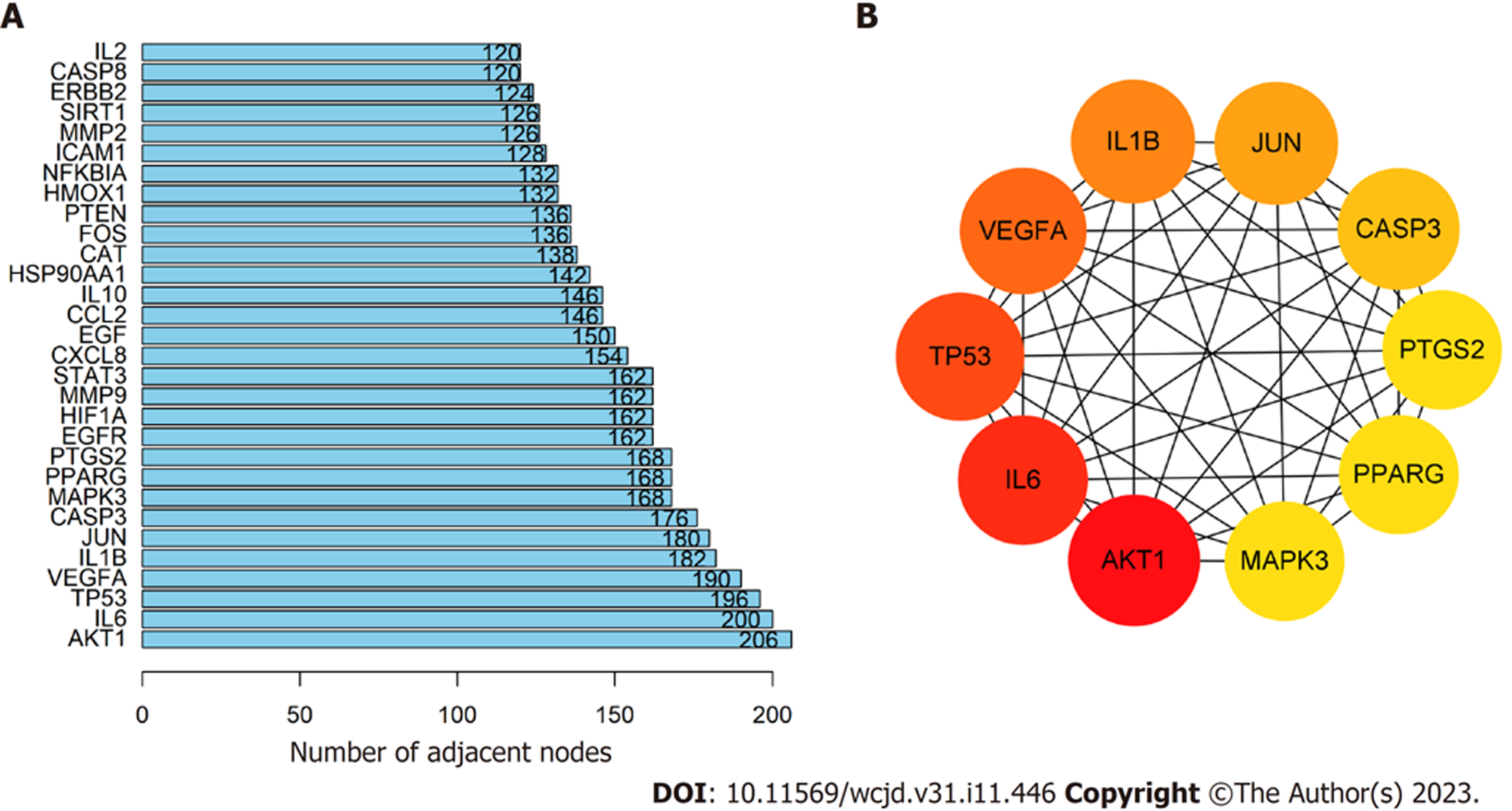
附子理中丸潜在作用于肠结核的134个靶点构成的PPI网络如图3所示, 去除一个与其他的靶点均为构成联系的基因(MT-ND6), 一共有133个节点, 5334条边. Network Analyer计算得出节点平均连接性、聚类系数和平均节点degree值分别为40.105、0.666、39.8. degree值反映了每个节点在网络中与其他节点的关联程度, 一定程度上代表了节点在整个网络的重要性. 图3中, 颜色越红, 大小越大的节点代表节点的degree值越大, 其中degree≥100的节点有49个. 图4A展示了degree值前30的靶点. 最后选取degree值前10的靶点作为附子理中丸作用于肠结核的核心靶点, 包括AKT1、IL-6、TP53、VEGFA、IL1B、JUN、CASP3、PTGS2、PPARG、MAPK3. 图4B展示了10个核心靶点的蛋白质互作关系.
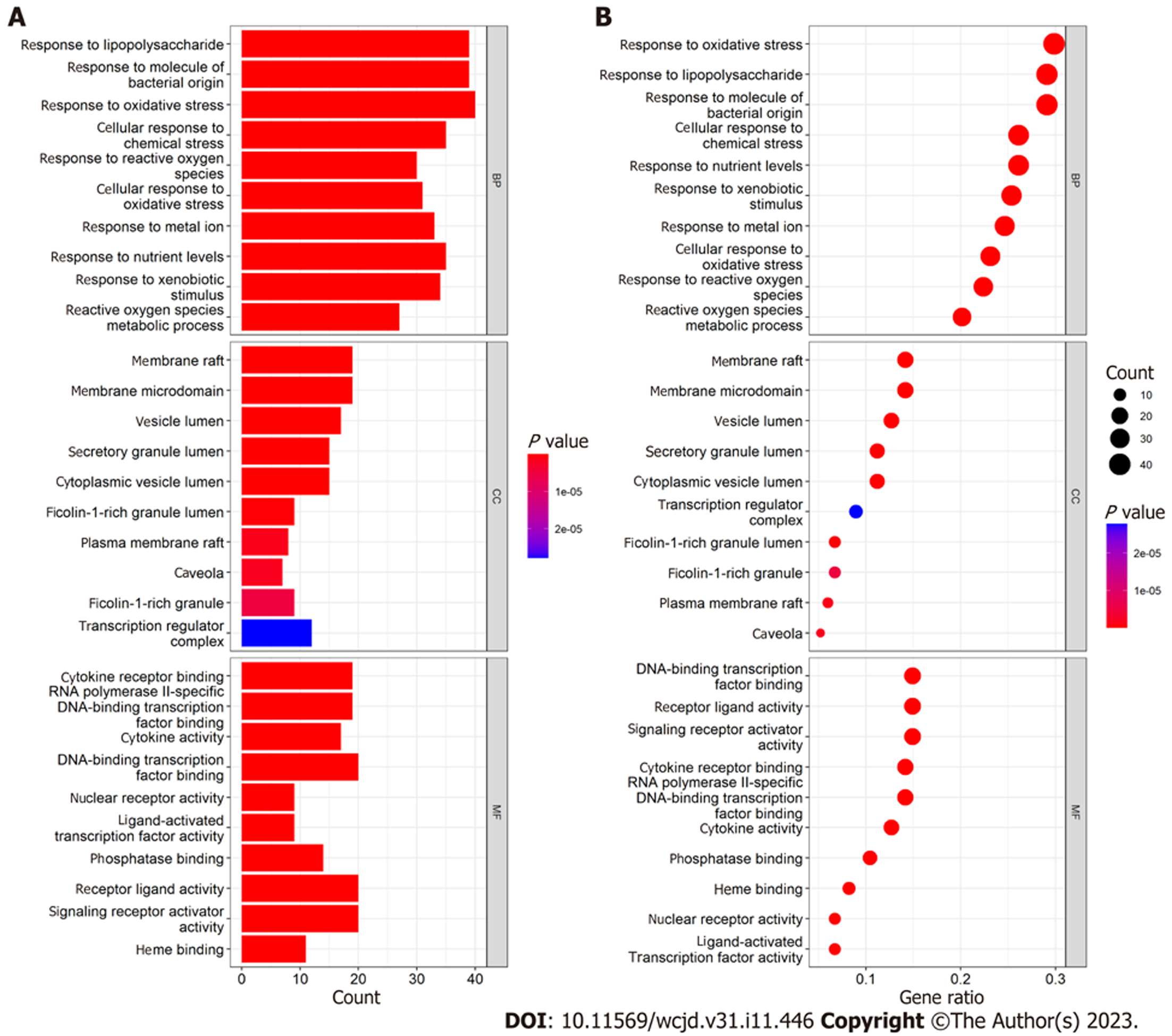
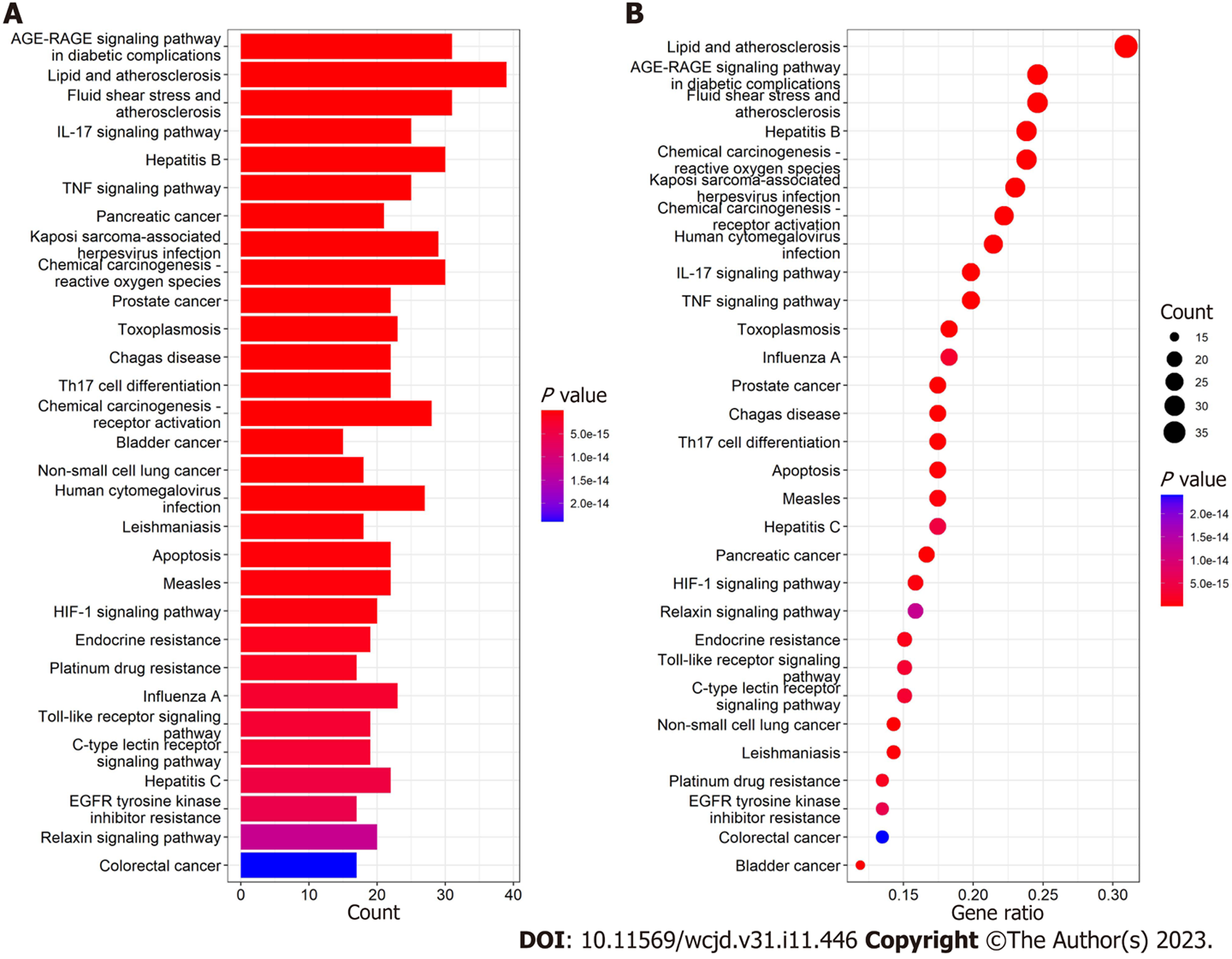
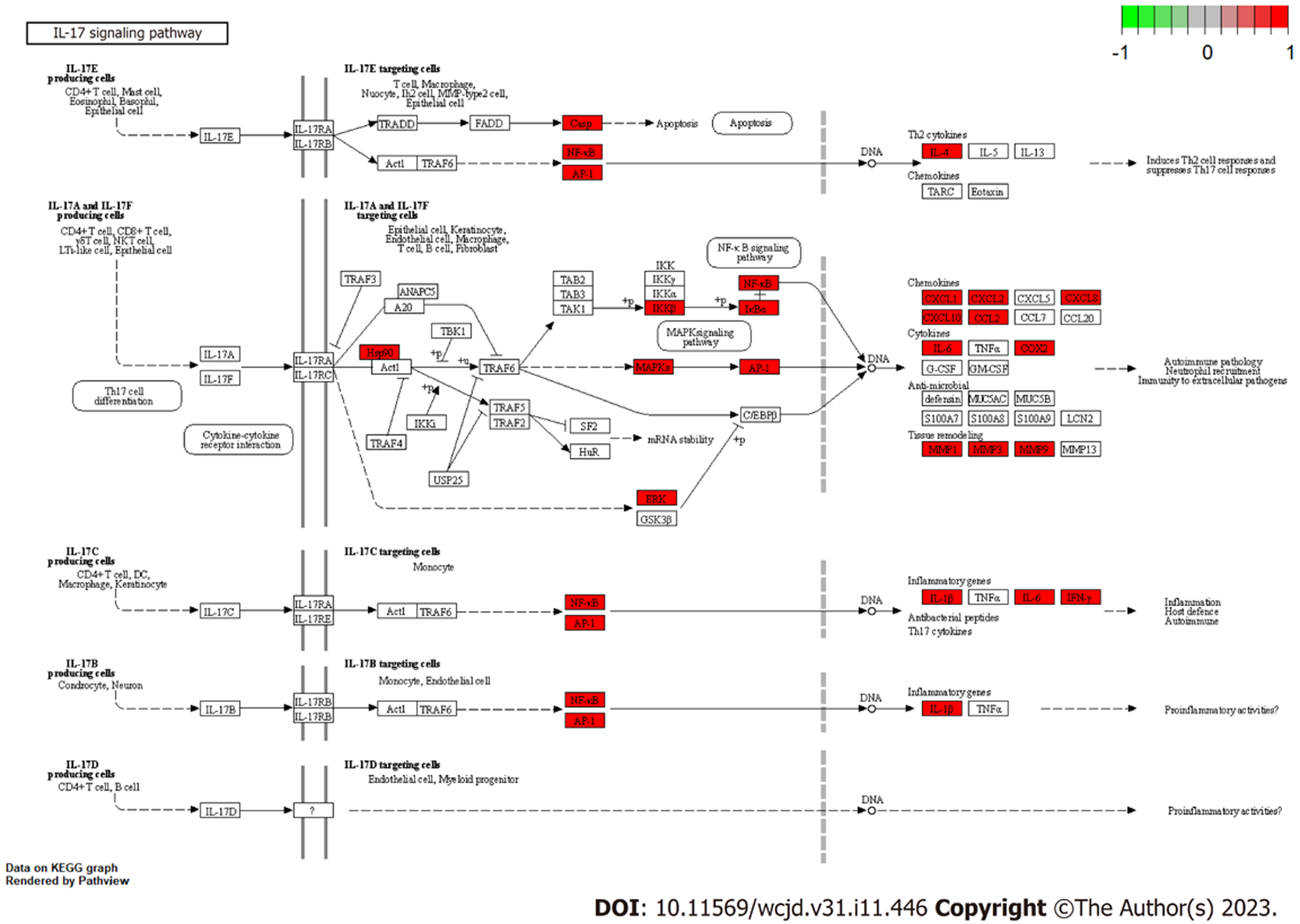
GO和KEGG富集分析用于探索附子理中丸对肠结核的潜在生物学作用机制. 以P<0.05为标准筛选出了GO及KEGG分析细胞成分或生物学过程的结果, 并以P值由低到高进行排序. 图5分别展示了GO分析中P值前10的BP、CC、MF结果. 可以发现生物过程主要包括细胞氧化应激、活性氧调节与异物刺激反应等, 细胞成分主要包括膜筏、膜微域、转录调节复合体等, 分子功能主要包括细胞因子活性、结合细胞因子、结合转录因子等. 如图6所示, KEGG富集结果提示了附子理中丸可能作用于肠结核的具体生物学通路. P值前30的KEGG富集分析条目主要涵盖了白细胞介素(interleukin, IL)-17信号通路、氧化应激、TNF信号通路等. 同时, 如图7所示, 通过R 4.1.2软件可视化进一步分析了IL-17信号通路的靶点调节关系, 可以发现IL-17参与了多条CD4+T细胞的细胞因子相关的免疫调节.
中药成分繁多, 药物作用机制复杂, 为了更好提高中药的疾病疗效, 药物的生物学作用机制研究极其重要. 本研究基于网络药理学探索了附子理中丸治疗肠结核的作用机制和生物学过程. 筛选了来源于开放数据库中的药物作用于肠结核的潜在作用靶点. 通过构建PPI网络及拓扑学分析, 明确了10种附子理中丸治疗肠结核的核心靶点, 并分析了靶点间的作用关系. 最后通过GO及KEGG富集分析发现了附子理中丸可能治疗肠结核的多个生物学过程和功能通路, 证明了附子理中丸治疗肠结核是有明确的生物学调控机制.
254个药物作用靶点和2579个疾病相关靶基因筛选的134个重叠基因是附子理中丸治疗肠结核的潜在作用靶点. 最终根据PPI分析的degree值前10的潜在作用靶点, 可被认为是附子理中丸作用于肠结核的核心靶点,包括AKT1、IL-6、TP53、VEGFA、IL1B、JUN、CASP3、PTGS2、PPARG、MAPK3. 了解其参与的生物学过程对于肠结核治疗作用机制具有重要意义. 作为degree值最高的靶点基因AKT1, 既往研究表明结核分枝杆菌的Rv1987蛋白可通过激活PI3K/AKT1/mTOR信号通路诱导巨噬细胞M2极化从而降低巨噬细胞的杀菌能力[10]. IL-6、IL1B参与了结核病的机体自身免疫调节[11-13]. 同时有研究表明IL-6、JUN和TP53与转录因子一起可以调节免疫反应, 其功能主要包括细胞外区域活化和感染过程中的蛋白质结合[14]. VEGFA被证明与肺外结核细菌传播密切相关. CASP3与细胞凋亡密切相关, 有报道也指出在结核患者血清中CASP3高表达以及参与组织炎症反应的调节[15,16]. PTGS2又名环氧合酶2, 目前也有不少研究报道了辅助环氧合酶2抑制剂治疗结核病效果良好[17,18], 其中雷公藤甲素被证明能够促进细胞因子IL-6的表达, 但降低了结核感染的巨噬细胞中PTGS2的表达[19]. 传统的抗结核药物利福平能够减少mRNA和蛋白质水平上对PPARG的诱导[20]. 同时, 既往的报道亦有指出在由于MAPK1/3信号通路的缺陷, IL17A无法增强自噬从而加重结核感染炎症反应[21]. 上述结论均说明了从附子理中丸潜在作用靶点筛选出的核心靶点均在肠结核的炎症或免疫调节上有着重要作用, 可以成为未来精准基因治疗的重要研究目标.
在GO和KEGG富集分析探索附子理中丸可能参与肠结核功能调节的通路研究中, 最终发现多个与肠结核治疗相关的生物过程. 其中多条GO分析条目均指出药物参与的生物过程可能与细胞氧化及活性氧相关, 分子功能与细胞因子的免疫调控作用密切相关. 既往的研究也指出活性氧在调控结核病发病机制中起着重要作用. 巨噬细胞激活可产生活性氧直接杀死驻留的细菌[22]. 也有研究证明了氧化应激参与结核炎症反应调控的作用[23,24]. KEGG富集分析指出了多条生物学通路, 其中也包括了细胞氧化应激通路, 证实了附子理中丸通过氧化应激通路调节结核炎症反应从而治疗肠结核的作用. 另外, 也有大量的靶点富集于IL-17信号通路, 以前的研究也证明了IL-17可以增强细胞自噬来控制结核杆菌的炎症反应[21]. 另外也有相关研究证明了IL-17相关通路与肠粘膜的免疫机制相关[24]. 在KEGG可视化IL-17相关通路图中也发现了IL-17可以介导CD4+T细胞参与多条信号通路, 联合IL-6、PTGS2等核心靶点发挥免疫调节作用. 所以上述结果均说明了附子理中丸治疗肠结核的作用机制与氧化应激、细胞因子参与的免疫调节相关.
综上所述, 本研究基于网络药理学研究了以附子、党参、白术、干姜、甘草为主要成分的附子理中丸治疗肠结核的生物学调控机制. 筛选出了药物潜在治疗作用的靶点, 并通过PPI分析选出了10个核心作用靶点. 既往的研究证明核心靶点均在肠结核的炎症或免疫调节上有着重要作用, 最后通过功能富集分析证明了附子理中丸通过细胞氧化及细胞因子介导的免疫调节发挥了治疗肠结核的作用, 并发现了IL-17信号通路在治疗上的重要价值. 因此本研究证明了附子理中丸在治疗肠结核中具有明确的炎症或免疫功能调控作用, 为日后的进一步临床或基础研究奠定了理论基础.
肠结核是一种常见肺外结核病. 临床上肠结核的治疗效果不佳, 长期使用抗结核化疗药物可引发药物不良反应. 随着中医治疗的发展, 越来越多的中药方剂在治疗肠结核上展现出了较好的疗效. 附子理中丸是一种经典的中药方剂, 了解其治疗肠结核的作用机制有利于中医治疗肠结核的发展.
探索附子理中丸治疗肠结核的作用机制, 利于临床应用.
利用网络药理学研究附子理中丸治疗肠结核的作用机制.
使用TCMSP及Drugbank数据库获取附子理中丸中有效成分和作用靶蛋白质. 利用Genecards数据库收集肠结核相关的疾病靶点. 对肠结核靶点与附子理中丸的活性成分作用靶点取交集, 得到重叠的基因靶点, 视为药物潜在作用于肠结核的靶点. 将筛选出的靶点导入STRING网络平台中, 构建蛋白质-蛋白质互作网络, 并进行网络拓扑学分析. 筛选出的连接度(degree)值前10的靶点可被视作附子理中丸治疗于肠结核的核心靶点. 对潜在作用靶点进行京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)富集分析和基因本体论(Gene Ontology, GO)分析探索附子理中丸治疗肠结核的潜在生物学机制.
本研究共获取了108种药物活性成分, 254个药物作用靶点和2579个疾病相关靶基因. 最终筛选出的附子理中丸在肠结核治疗中的10个核心作用靶点, 包括AKT1、IL-6、TP53、VEGFA、IL1B、JUN、CASP3、PTGS2、PPARG、MAPK3. GO分析和KEGG富集分析展示的生物学过程主要包括细胞氧化应激、活性氧调节与异物刺激反应等免疫调节过程,参与的生物学通路有白细胞介素(interleukin, IL)-17信号通路、氧化应激、TNF信号通路等. 所有的结果均证明附子理中丸治疗肠结核的作用机制均与炎症或免疫调节有关.
通过网络药理学综合分析, 发现了附子理中丸在肠结核治疗中发挥作用的10个关键基因, 并在后续分析中发现了附子理中丸通过细胞氧化及细胞因子介导的免疫调节发挥了治疗肠结核的作用, 其中IL-17信号通路、氧化应激通路在未来的研究中值得进一步探索.
本研究基于网络药理学分析了附子理中丸治疗肠结核的作用机制, 筛选了药物核心治疗靶点, 提供了附子理中丸治疗肠结核的生物学证据. 为未来进一步的细胞学或者动物模型验证药物生物学功能奠定了基础.
学科分类: 胃肠病学和肝病学
手稿来源地: 湖南省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Glaziou P, Falzon D, Floyd K, Raviglione M. Global epidemiology of tuberculosis. Semin Respir Crit Care Med. 2013;34:3-16. [PubMed] [DOI] |
| 2. | Maulahela H, Simadibrata M, Nelwan EJ, Rahadiani N, Renesteen E, Suwarti SWT, Anggraini YW. Recent advances in the diagnosis of intestinal tuberculosis. BMC Gastroenterol. 2022;22:89. [PubMed] [DOI] |
| 3. | Kwakkel G, Kollen BJ, van der Grond J, Prevo AJ. Probability of regaining dexterity in the flaccid upper limb: impact of severity of paresis and time since onset in acute stroke. Stroke. 2003;34:2181-2186. [PubMed] [DOI] |
| 4. | Choi EH, Coyle WJ. Gastrointestinal Tuberculosis. Microbiol Spectr. 2016;4. [PubMed] [DOI] |
| 5. | Gupta A, Pratap Mouli V, Mohta S, Kante B, Kalaivani M, Madhu D, Sahu P, Kumar S, Sharma R, Sahni P, Das P, Gupta SD, Makharia G, Kedia S, Ahuja V. Antitubercular Therapy Given to Differentiate Crohn's Disease From Intestinal Tuberculosis Predisposes to Stricture Formation. J Crohns Colitis. 2020;14:1611-1618. [PubMed] [DOI] |
| 9. | 吕 瑞萍. 中西医结合治疗肠结核临床疗效观察. 中国社区医师(医学专业). 2013;15:241. [DOI] |
| 10. | Sha S, Shi Y, Tang Y, Jia L, Han X, Liu Y, Li X, Ma Y. Mycobacterium tuberculosis Rv1987 protein induces M2 polarization of macrophages through activating the PI3K/Akt1/mTOR signaling pathway. Immunol Cell Biol. 2021;99:570-585. [PubMed] [DOI] |
| 11. | Pugazhendhi S, Jayakanthan K, Pulimood AB, Ramakrishna BS. Cytokine gene expression in intestinal tuberculosis and Crohn's disease. Int J Tuberc Lung Dis. 2013;17:662-668. [PubMed] [DOI] |
| 12. | Goovaerts O, Jennes W, Massinga-Loembé M, Ceulemans A, Worodria W, Mayanja-Kizza H, Colebunders R, Kestens L; TB-IRIS Study Group. LPS-binding protein and IL-6 mark paradoxical tuberculosis immune reconstitution inflammatory syndrome in HIV patients. PLoS One. 2013;8:e81856. [PubMed] [DOI] |
| 13. | Huang QP, Liao N, Zhao H, Chen ML, Xie ZF. Lack of Association Between the IL1B (-511 and +3954), IL1RN VNTR Polymorphisms and Tuberculosis Risk: A Meta-analysis. Lung. 2015;193:985-992. [PubMed] [DOI] |
| 14. | Yuan G, Bai Y, Zhang Y, Xu G. Data Mining Mycobacterium tuberculosis Pathogenic Gene Transcription Factors and Their Regulatory Network Nodes. Int J Genomics. 2018;2018:3079730. [PubMed] [DOI] |
| 15. | Zhang M, Zhou YY, Zhang YL. High Expression of TLR2 in the serum of patients with tuberculosis and lung cancer, and can promote the progression of lung cancer. Math Biosci Eng. 2019;17:1959-1972. [PubMed] [DOI] |
| 16. | Feng Y, Li M, Yangzhong X, Zhang X, Zu A, Hou Y, Li L, Sun S. Pyroptosis in inflammation-related respiratory disease. J Physiol Biochem. 2022;78:721-737. [PubMed] [DOI] |
| 17. | Jøntvedt Jørgensen M, Nore KG, Aass HCD, Layre E, Nigou J, Mortensen R, Tasken K, Kvale D, Jenum S, Tonby K, Dyrhol-Riise AM. Plasma LOX-Products and Monocyte Signaling Is Reduced by Adjunctive Cyclooxygenase-2 Inhibitor in a Phase I Clinical Trial of Tuberculosis Patients. Front Cell Infect Microbiol. 2021;11:669623. [PubMed] [DOI] |
| 18. | Jenum S, Tonby K, Rueegg CS, Rühwald M, Kristiansen MP, Bang P, Olsen IC, Sellæg K, Røstad K, Mustafa T, Taskén K, Kvale D, Mortensen R, Dyrhol-Riise AM. A Phase I/II randomized trial of H56:IC31 vaccination and adjunctive cyclooxygenase-2-inhibitor treatment in tuberculosis patients. Nat Commun. 2021;12:6774. [PubMed] [DOI] |
| 19. | Tamgue O, Chia JE, Brombacher F. Triptolide Modulates the Expression of Inflammation-Associated lncRNA-PACER and lincRNA-p21 in Mycobacterium tuberculosis-Infected Monocyte-Derived Macrophages. Front Pharmacol. 2021;12:618462. [PubMed] [DOI] |
| 20. | Gao T, Lai M, Zhu X, Ren S, Yin Y, Wang Z, Liu Z, Zuo Z, Hou Y, Pi J, Chen Y. Rifampicin impairs adipogenesis by suppressing NRF2-ARE activity in mice fed a high-fat diet. Toxicol Appl Pharmacol. 2021;413:115393. [PubMed] [DOI] |
| 21. | Tateosian NL, Pellegrini JM, Amiano NO, Rolandelli A, Casco N, Palmero DJ, Colombo MI, García VE. IL17A augments autophagy in Mycobacterium tuberculosis-infected monocytes from patients with active tuberculosis in association with the severity of the disease. Autophagy. 2017;13:1191-1204. [PubMed] [DOI] |
| 22. | Rauf A, Sohail MF, Sarwar HS, Naveed S, Batool S, Amin U, Ali I, Saleem W, Razzaq S, Rehman M, Shahnaz G. Tuberculosis Resistance and Nanoparticles: Combating the Dual Role of Reactive Oxygen Species in Macrophages for Tuberculosis Management. Crit Rev Ther Drug Carrier Syst. 2020;37:161-182. [PubMed] [DOI] |
| 23. | Amaral EP, Vinhaes CL, Oliveira-de-Souza D, Nogueira B, Akrami KM, Andrade BB. The Interplay Between Systemic Inflammation, Oxidative Stress, and Tissue Remodeling in Tuberculosis. Antioxid Redox Signal. 2021;34:471-485. [PubMed] [DOI] |
| 24. | Yu ZQ, Wang WF, Dai YC, Chen XC, Chen JY. Interleukin-22 receptor 1 is expressed in multinucleated giant cells: A study on intestinal tuberculosis and Crohn's disease. World J Gastroenterol. 2019;25:2473-2488. [PubMed] [DOI] |