修回日期: 2022-02-25
接受日期: 2022-03-26
在线出版日期: 2022-04-08
微卫星不稳定性(microsatellite instability, MSI)是由DNA错配修复蛋白表达阴性所导致, 是结直肠癌发生的重要途径之一. 同源异型框转录因子(caudal-related homeobox transcription factor 2, CDX-2)及p53在结直肠癌中均可发挥抑癌作用并与患者的部分临床病理特征相关.
探讨结直肠腺癌中错配修复蛋白(MLH1、MSH2、PMS2、MSH6)与CDX-2、p53的表达及其临床意义.
选取2017-01/2021-03扬州大学附属医院收治的结直肠腺癌患者175例, 采用免疫组化方法检测错配修复蛋白MLH1、MSH2、PMS2、MSH6及CDX-2、p53在结直肠腺癌中的表达情况, 各组中的分布差异采用χ2检验, 各指标间的相关性采用Spearman等级相关.
175例结直肠腺癌患者中四种错配修复蛋白表达阴性者39例(22.3%), 其中MSH2、MSH6、MLH1、PMS2的表达阴性者分别为12例(6.9%)、1例(0.6%)、17例(9.7%)、28例(16.0%); 其中91例结直肠腺癌中CDX-2表达阴性共34例(35.1%), 28例结直肠腺癌中p53表达阴性共7例(25%). 错配修复蛋白表达阴性与结直肠腺癌患者发病年龄、肿瘤部位及分化程度有显著性(P<0.05), 在患者性别、肿瘤浸润深度及淋巴结转移方面差异均无显著性. 错配修复蛋白与CDX-2、p53表达水平均无相关性.
错配修复蛋白的表达与结直肠癌发病年龄、肿瘤部位及分化程度有关. 检测错配修复蛋白对于结直肠腺癌的早期诊断、制定治疗方案及评估预后具有重要的临床意义.
核心提要: 本文初次报道应用免疫组织化学方法联合检测结直肠腺癌的4种错配修复蛋白及CDX-2、p53,并分析其与临床病理特征的相关性, 对结直肠癌的早期诊断、制定治疗方案及评估预后具有一定意义.
引文著录: 庞圆圆, 张晓媛, 王磊, 袁昕, 路国涛, 肖炜明. 错配修复蛋白与CDX-2、p53在结直肠腺癌中的表达及对临床病理特征的影响. 世界华人消化杂志 2022; 30(7): 318-326
Revised: February 25, 2022
Accepted: March 26, 2022
Published online: April 8, 2022
Microsatellite instability is caused by loss of expression of DNA mismatch repair (MMR) proteins, which are involved in one of significant pathways that lead to colorectal cancer development and progression. Both Cdx-2 and p53 play an inhibitory role in colorectal cancer and are related to some clinicopathological features.
To analyze the significance of expression of MMR proteins (MLH1, MSH2, PMS2, and MSH6), CDX-2, and p53 in colorectal adenocarcinoma.
A total of 175 patients with colorectal adenocarcinoma who were operated at the Affiliated Hospital of Yangzhou University from January 2017 to March 2021 were selected. The expression levels of MLH1, MSH2, PMS2, MSH6, CDX-2, and p53 in colorectal cancer were detected by immunohistochemical method. The association of the expression of the above proteins with clinicopathological features of colorectal adenocarcinoma was explored by chi-square test, and Spearman rank correlation was used for correlation analysis.
Among 175 colorectal adenocarcinoma patients, there were 39 patients with negative expression of all four MMR proteins (22.3%). The negative expression of MSH2, MSH6, MLH1, and PMS2 was found in 12 (6.9%), 1 (0.6%), 17 (9.7%), and 28 (16.0%) cases, respectively. Among 91 colorectal adenocarcinoma patients, 34 (35.1%) had negative expression of CDX-2, and 7 (25%) had negative expression of p53 in colorectal adenocarcinoma. The negative expression of MMR proteins was significantly correlated with the age of onset, tumor site, and degree of differentiation in colorectal adenocarcinoma patients (P < 0.05), but had no significant correlation with patient gender, tumor invasion depth, or lymph node metastasis (P > 0.05). There was no correlation between the expression of MMRs protein and that of CDX-2 and p53 (P > 0.05).
The expression of MMR proteins is related to the age of onset, tumor site, and degree of differentiation. The detection of MMR proteins has important clinical significance for the early diagnosis of colorectal adenocarcinoma, the formulation of therapeutic plan, and the assessment of prognosis.
- Citation: Pang YY, Zhang XY, Wang L, Yuan X, Lu GT, Xiao WM. Expression of mismatch repair proteins, CDX-2, and p53 in colorectal adenocarcinoma and their association with clinicopathological characteristics. Shijie Huaren Xiaohua Zazhi 2022; 30(7): 318-326
- URL: https://www.wjgnet.com/1009-3079/full/v30/i7/318.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i7.318
全球范围内, 结直肠癌是第三位最常见的恶性肿瘤, 也是第二位最常见的恶性肿瘤死亡原因. 据世界卫生组织(World Health Organization, WHO)癌症研究中心的GLOBOCAN项目估计, 2018年全球范围内结直肠癌新发病例数约为180万, 死亡人数约为88万[1]. Bufill[2]依据胚胎起源、生理解剖、内环境和分子生物学特征等差异提出, 应将结肠癌以结肠脾曲为界分为左、右结肠癌这两种不同的疾病. 研究发现, DNA错配修复(mismatch repair, MMR)蛋白在DNA复制过程中可以识别和修复错配的碱基对, 从而使DNA聚合酶和DNA连接酶能够重新合成和重新结合正确的DNA链. MMR蛋白表达阴性会导致遗传不稳定性, 引起短重复DNA序列长度的改变, 从而产生新的等位基因, 此现象被称为微卫星不稳定性(microsatellite instability, MSI)[3]. 近年来, 有不少学者针对MMR蛋白与结直肠癌之间的临床相关性展开研究, 认为MMR蛋白在结直肠癌的发生发展及其预后评估中起重要作用, 给临床医生提供了有价值的经验. 结直肠癌是一种组织形态学、临床和分子水平的异质性疾病. 可能通过以BRAF基因突变和高水平CpG岛甲基化表型为特征的"锯齿状"途径进展; 或是可能通过微卫星不稳定性进展, 并显示出肿瘤抑制因子同源异型框转录因子(caudal-related homeobox transcription factor 2, CDX-2)的显著缺失[4]. CDX-2是具有较高敏感性的肠上皮特异标志物, CDX-2表达下调与结肠癌分化不良和MMR缺陷相关[5]. 此外p53通过协调一系列广泛的DNA损伤修复机制来维持基因组稳定, 且MMR系统的MSH2[6]、MLH1[7]是p53介导的肿瘤抑制的关键组成部分, 因此本文就错配修复蛋白及CDX-2、p53在结直肠腺癌中的表达及对临床病理特征影响展开讨论.
收集2017-01/2021-03扬州大学附属医院收治的175例结直肠腺癌患者的临床资料.
入组标准: 经肠镜活检或术后病理明确诊断为原发性结直肠腺癌. 取材前或术前均未接受过放、化疗或靶向治疗, 且临床及病理资料完整.
排除标准: 排除既往有其他肿瘤病史; 排除术前接受过放、化疗或靶向治疗的患者; 排除合并特殊药物使用致可能对结果有影响的患者; 排除由于各种原因不能耐受手术或未在本院行手术治疗的患者; 其中男性113例, 女性62例; 年龄≤50岁16例, >50岁159例; 高/中分化153例, 低分化22例; 肿瘤病灶侵犯黏膜下层或固有肌层47例; 穿透固有肌层128例; 不伴淋巴结转移110例, 伴淋巴结转移65例; 左半结肠癌65例, 右半结肠癌47例, 直肠癌63例. 所有患者均签署知情同意书, 该项目已通过扬州大学附属医院伦理委员会审查, 意见号为: 2021-YKL4-28-008.
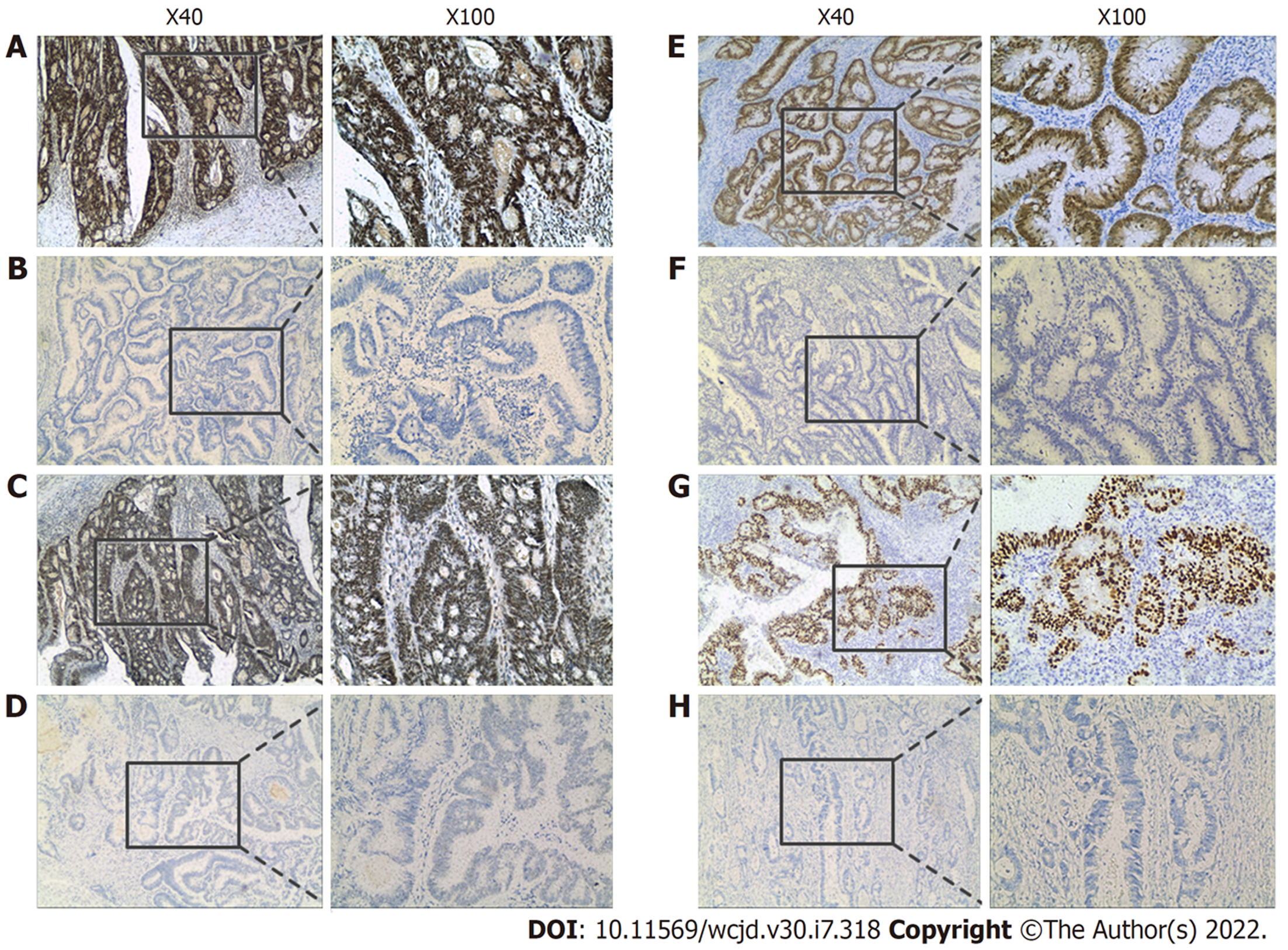
1.2.1 免疫组化: 所有患者病理组织均经本院病理科行免疫组织化学法检测, 结肠癌组织块行固定、脱水、石蜡包埋连续切片, 厚度约3 μm-5 μm, 经脱蜡复水、灭活内源性酶、抗原修复、封闭后, 采用二步法染色检测MLH1、MSH2、MSH6、PMS2及CDX-2、p53蛋白表达, 在进行阴性对照时改用PBS代替一抗. 将DAB显色后的玻片用清水冲洗后, 使用苏木素溶液进行细胞核复染. 脱水封片(图1).
错配修复蛋白MSH2、MSH6、MLH1和PMS2表达于肿瘤细胞、正常结直肠粘膜细胞、间质细胞及炎症细胞, 呈细胞核棕黄色颗粒[8]. 肿瘤细胞核呈棕黄色表达判读为阳性, 即判定为MMR蛋白表达正常, 定义为错配修复基因完整(pMMR组); 任意一项或多项不着色判读为阴性, 即判定为MMR蛋白表达阴性, 定义为错配修复基因表达阴性(dMMR组). 判定过程由2名高年资病理科医师双盲法独立进行. 随机选取5个400倍视野计算每100个细胞中表达呈阳性的细胞数, 取其平均值作为检测数值, 按阳性细胞比例数分为: (-), ≤10%; (+), 11%-25%; (+ +), 25%-50%; (+ + +), ≥50%; 有异议的病例, 提交1名上级医师重新判读.
病理分期按第8版AJCC分期标准进行病理分期. 统计并比较2组患者CDX-2、p53表达差异及年龄、性别、组织分化程度、浸润深度、有无淋巴结转移、肿瘤位置等临床病理特征差异.
统计学处理 采用SPSS 25软件进行统计学分析. MMR、CDX-2、p53表达与结直肠腺癌临床病理特征的差异进行χ2检验、校正χ2检验或Fisher精确检验. 以P<0.05为差异有统计学意义.
根据免疫组化分析结果, 175例结直肠腺癌患者中pMMR组136例, dMMR组39例, 表达阴性率达22.3%, 其中MSH2、MSH6、MLH1、PMS2的表达阴性者分别为12例(6.9%)、1例(0.6%)、17例(9.7%)、28例(16.0%).
本文共分析175例结直肠腺癌中MMR蛋白表达与临床病理特征的关系, MMR蛋白表达阴性与结直肠癌患者发病年龄、肿瘤位置及分化程度差异有显著性(P<0.05, 表1), 在患者性别、浸润深度及淋巴结转移方面差异均无显著性(P>0.05, 表1).
| 临床病理参数 | 病例数 | MMR表达 | χ2 | P | |
| dMMR | pMMR | ||||
| 性别 | |||||
| 男 | 113(64.6) | 23(20.4) | 90(79.6) | 0.687 | 0.407 |
| 女 | 62(35.4) | 16(25.8) | 46(74.2) | ||
| 年龄 | |||||
| ≤50 | 16(9.3) | 8(0.5) | 8(0.5) | 6.148a | 0.013a |
| >50 | 159(90.7) | 31(19.5) | 128(80.5) | ||
| 分化程度 | |||||
| 高/中分化 | 153(87.4) | 29(19.0) | 124(81.0) | 6.344a | 0.012a |
| 低分化 | 22(12.6) | 10(45.5) | 12(54.5) | ||
| 浸润深度 | |||||
| T1+T2 | 47(26.9) | 10(21.3) | 37(78.7) | 0.038 | 0.846 |
| T3+T4 | 128(73.1) | 29(22.7) | 99(77.3) | ||
| 淋巴结转移 | |||||
| 有 | 65(37.1) | 17(16.1) | 48(73.8) | 0.893 | 0.345 |
| 无 | 110(62.9) | 22(0.2) | 88(0.8) | ||
| 肿瘤位置 | |||||
| 右半结肠 | 47(26.9) | 18(38.3) | 29(61.7) | 9.533 | 0.009 |
| 左半结肠 | 65(37.1) | 11(16.9) | 54(83.0) | ||
| 直肠 | 63(36) | 10(15.9) | 53(84.1) | ||
本文共分析91例结直肠腺癌中MMR-CDX-2蛋白状态与临床病理特征的关系, CDX-2表达阴性共34例(35.1%), CDX-2表达阴性病例中MMR表达阴性率(8.82%)高于CDX-2表达病例中MMR表达阴性率(6.35%), 经统计学分析MMR表达与CDX-2表达无相关性(P>0.05, 表2).
| 肿瘤标记物 | 病例数 | MMR表达 | Spearman r值 | P | |
| dMMR | pMMR | ||||
| CDX-2 | |||||
| CDX-2+ | 63(64.9) | 4(6.3) | 59(93.7) | -0.046 | 0.657 |
| CDX-2- | 34(35.1) | 3(8.8) | 31(91.2) | ||
| p53 | |||||
| p53+ | 21(75) | 5(23.8) | 16(76.2) | -0.183 | 0.352 |
| p53- | 7(25) | 3(42.9) | 4(57.1) | ||
dMMR-CDX-2(+)蛋白组和dMMR-CDX-2(-)蛋白组相比, 两者在患者性别、发病年龄、肿瘤分化、浸润深度、淋巴结转移及肿瘤部位方面差异均无显著性(P>0.05, 表3). pMMR-CDX-2(+)蛋白组和pMMR-CDX-2(-)蛋白组相比, 两者在患者性别、发病年龄、肿瘤分化、浸润深度、淋巴结转移及肿瘤部位方面差异均无显著性(P>0.05, 表3).
| 临床病理参数 | dMMR | P | pMMR | P | |||
| CDX-2+ | CDX-2- | CDX-2+ | CDX-2- | ||||
| 性别 | |||||||
| 男 | 56(61.5) | 16(94.1) | 1(5.9) | 0.543b | 36(92.3) | 3(7.7) | 0.98a |
| 女 | 35(38.5) | 9(81.8) | 2(18.2) | 23(95.8) | 1(4.2) | ||
| 年龄 | |||||||
| ≤50 | 8(8.8) | 6(100) | 0(0) | 1b | 2(100) | 0(0) | 1b |
| >50 | 83(91.2) | 19(86.4) | 3(13.6) | 57(93.4) | 4(6.6) | ||
| 分化程度 | |||||||
| 高/中分化 | 79(86.8) | 18(85.7) | 3(14.3) | 0.551b | 55(94.8) | 3(5.2) | 0.288b |
| 低分化 | 12(13.2) | 7(100) | 0(0) | 4(80) | 1(20) | ||
| 浸润深度 | |||||||
| T1+T2 | 25(27.5) | 7(87.5) | 1(12.5) | 1b | 17(100) | 0(0) | 0.5a |
| T3+T4 | 66(72.5) | 18(90) | 2(10) | 42(91.3) | 4(8.7) | ||
| 淋巴结转移 | |||||||
| 有 | 37(35.9) | 11(91.7) | 1(8.3) | 1b | 24(96) | 1(4) | 1a |
| 无 | 66(64.1) | 14(87.5) | 2(12.5) | 47(94) | 3(6) | ||
| 肿瘤位置 | |||||||
| 右半结肠 | 29(31.9) | 10(83.3) | 2(6.7) | 0.489 | 16(94.1) | 1(5.9) | 0.695 |
| 左半结肠 | 28(30.7) | 7(87.5) | 1(12.5) | 18(90) | 2(10) | ||
| 直肠 | 34(37.4) | 8(100) | 0(0) | 25(96.2) | 1(3.8) | ||
本文共分析28例结直肠腺癌中MMR-p53蛋白状态与临床病理特征的关系, p53表达阴性共7例(25%), p53表达阴性病例中MMR表达阴性率(42.9%)高于p53表达病例中MMR表达阴性率(23.8%), 经统计学分析MMR表达与p53表达无相关性(P>0.05, 表2). dMMR-p53(+)蛋白组和dMMR-p53(-)蛋白组相比, 两者在患者性别、发病年龄、肿瘤分化、浸润深度、淋巴结转移及肿瘤部位方面差异均无显著性(P>0.05, 表4). pMMR-p53(+)蛋白组和pMMR-p53(-)蛋白组相比, 两者在患者性别、发病年龄、肿瘤分化、浸润深度、淋巴结转移及肿瘤部位方面差异均无显著性(P>0.05, 表4).
| 临床病理参数 | dMMR | P | pMMR | P | |||
| p53+ | p53- | p53+ | p53- | ||||
| 性别 | |||||||
| 男 | 18(64.3) | 3(50) | 3(50) | 0.464b | 8(66.7) | 4(33.3) | 0.117b |
| 女 | 10(35.7) | 2(100) | 0(0) | 8(100) | 0(0) | ||
| 年龄 | |||||||
| ≤50 | 2(7.1) | 1(100) | 0(0) | 1b | 0(0) | 1(100) | 0.2b |
| >50 | 26(92.9) | 4(57.1) | 3(42.9) | 16(84.2) | 3(15.8) | ||
| 分化程度 | |||||||
| 高/中分化 | 23(82.1) | 5(71.4) | 2(28.6) | 0.375b | 13(81.3) | 3(18.7) | 1b |
| 低分化 | 5(17.9) | 0(0) | 1(100) | 3(75) | 1(25) | ||
| 浸润深度 | |||||||
| T1+T2 | 10(35.7) | 3(100) | 0(0) | 0.196b | 6(85.7) | 1(14.3) | 1b |
| T3+T4 | 18(64.3) | 2(40) | 3(60) | 10(76.9) | 3(23) | ||
| 淋巴结转移 | |||||||
| 有 | 7(25) | 1(100) | 0(0) | 1b | 6(100) | 0(0) | 0.267b |
| 无 | 21(75) | 4(57.1) | 3(42.9) | 10(71.4) | 4(28.6) | ||
| 肿瘤位置 | |||||||
| 右半结肠 | 7(25) | 2(66.7) | 1(33.3) | 1b | 3(75) | 1(25) | 0.166 |
| 左半结肠 | 13(46.4) | 3(60) | 2(40) | 5(62.5) | 3(37.5) | ||
| 直肠 | 8(28.6) | 0(0) | 0(0) | 8(100) | 0(0) | ||
结肠癌的发生主要有两条途径: 染色体不稳定(chromosomal instability, CIN)和微卫星不稳定性(micro-satellite instability, MSI)[9], MSI是错配修复(mismatch repair, MMR)缺陷的重要标志, MMR系统对于纠正DNA复制过程中的DNA序列错配起着至关重要的作用. 这个修复系统主要由四种蛋白质(MLH1、MSH2、MSH6和PMS2)相互作用来检测错配并将其剪除, 从而使DNA聚合酶和DNA连接酶能够重新合成和重新结合正确的DNA链[10]. 其中PMS2和MSH6分别与MLH1和MSH2相互作用, 形成异源二聚体[11]. MMR蛋白其表达与其主要配对(即MLH1和MSH2)的结合密切相关. MSH2的表达阴性常常与MSH6的表达阴性相关, 这种模式高度提示MSH2胚系突变. 同样, MLH1的表达阴性通常与PMS2的表达阴性相关, 这种模式可能是MLH1胚系突变或MLH1基因启动子的获得性高甲基化所致. MSH6和PMS2的胚系突变通常分别与单独的MSH6和PMS2蛋白表达阴性有关[12].结合国内外关于MMR蛋白与结直肠癌相关性分析的文献, 亚洲国家报道的MMR蛋白表达阴性率约为5.6%-19.24%[4,20,22,24], 而本文涉及的肿瘤患者表达阴性率达22.3%, 基本符合, 由于各研究中MMR蛋白表达阴性率差异较大, 推断MMR蛋白表达阴性具有种族和地域差异性. 在多项涉及中国结直肠癌患者的研究中[13,14], MMR蛋白表达阴性率达6.7%-7.6%, 主要表现为MLH1、PMS2双表达阴性, 认为MMR蛋白表达阴性在结直肠癌患者发病年龄、肿瘤位置、肿瘤大小、分化类型、淋巴结转移、临床分期均有显著性差异, 而与患者性别方面无关. 提出MMR蛋白表达阴性在50岁以下、右半结肠、低分化腺癌、TNM分期Ⅰ+Ⅱ期的患者中有相对更高的发病率. 而也有作者认为结直肠癌MMR蛋白表达阴性与肿瘤位置、分化类型及组织学类型有关, 而与肿瘤浸润深度、淋巴结转移、临床分期无关[15]. 本研究中MMR蛋白表达阴性共39例(22.3%), 其中MSH2、MSH6、MLH1、PMS2的表达阴性分别为12例(6.9%)、1例(0.6%)、17例(9.7%)、28例(16.0%). 通过统计学分析得出, MMR蛋白表达阴性与结直肠癌患者发病年龄、肿瘤部位及分化程度差异有显著性(P<0.05), 好发于年龄≤50岁、右半结肠、低分化肿瘤患者, 而与患者性别、浸润深度及淋巴结转移无关. 本文结论与以上研究结论相一致.
CDX-2是肠特异性的核转录因子, 在小肠及结直肠上皮的发育中起着关键作用, CDX-2的表达几乎完全局限于胃肠道, 它在日常诊断程序中被用作识别肠源性肿瘤的标志物[16]. CDX-2表达降低与癌细胞的迁移和侵袭增加有关, 并可能通过破坏WNT通路信号在上皮间质转化中发挥作用[17]. 结直肠癌患者中, CDX-2表达与微卫星稳定性(microsatellite stable, MSS)患者的预后有一定的相关性, 主要表现为CDX-2表达阴性患者预后不佳, 而MSI-CDX-2表达阴性的患者发生远处转移的风险较低. CDX-2表达阴性可能只在MSS结直肠癌患者亚组中是一个较差的预后因素[5]. 此前多项研究[18,19]认为CDX-2表达阴性与肿瘤大小、位置、分化程度、浸润深度和淋巴浸润及神经侵袭相关; 提出CDX-2表达阴性患者在较大的原发灶、右半结肠、高分化、较深的浸润深度的患者中有相对更高的发病率, 转移灶中的CDX-2表达阴性与dMMR显著相关. MMR表达阴性与CDX-2在肿瘤中的表达降低显著相关; 且CDX-2表达阴性与生存率恶化相关, CDX-2的表达阴性是MMR表达阴性的敏感和特异性预测因子. 同时, 也有部分研究[20]认为CDX-2表达阴性与临床病理特征无明显相关性, PMS2表达阴性与CDX-2表达阴性显著相关. CDX-2表达阴性存在多种机制: DNA甲基化、杂合性缺失、基因位点扩增和MSI, 这些机制都已被报道可调节CDX2的表达[21]. CDX-2的蛋白低表达可能发生在无蒂锯齿状腺瘤(锯齿状通路的前体病变)后和进展为癌症之前, 其基因很少发生突变, 蛋白的低表达伴随着CDX-2 mRNA的低表达, 反映了转录水平下调, 这可能是CDX-2调节中最重要的因素. CDX2缺失与MMR缺乏、BRAFV600E突变和高CIMP表达有显著且特异的关联. 在多项研究中均有证据表明CDX-2可能在结直肠癌的MSI/锯齿状通路中发挥作用, 但该分子是否真的作为该通路内肿瘤进展的原因而非结果参与功能尚未确定[4,18]. 本研究发现dMMR病例中CDX-2表达阴性率(42.9%)高于pMMR病例中CDX-2表达阴性率(34.4%), 通过统计学分析得出, dMMR病例中CDX-2基因突变状态与患者各临床病理特征均无相关性(P>0.05), MMR表达阴性与CDX-2表达阴性无相关性(P>0.05), 这一结论与上述研究有所差异, 可能由于本组病理组织均采自原发灶, 且不能排除地区及种族差异性, 后续或可对转移灶批量行免疫组化染色及统计分析.
p53参与细胞增殖、分化、DNA损伤修复和凋亡的调节, 其突变被认为是结直肠腺瘤向癌发展中相对较晚的事件, 作为结直肠癌预后评估指标的作用仍有争议. MMR在p53抑制肿瘤发展中起重要的协调作用, 且MMR系统的MLH1基因作为p53下游靶基因参与抑制肿瘤的发展, MLH1的表达阴性或者p53基因的突变均会促进肿瘤的发展[7,22]. MLH1是p53介导的肿瘤抑制的关键贡献者, 一项涉及淋巴瘤及结直肠癌的研究中作者验证了p53的丢失不仅会导致MLH1的表达减少, 而且会导致DNA修复基因的表达减少, 并可能推动肿瘤的发生[7]. 在多项涉及结直肠癌患者的临床研究中[22-25], 认为MMR表达阴性与p53基因突变状态无相关性, 但对于dMMR病例中p53基因突变状态与患者各临床病理特征有无相关性仍存在争议, 同样, 也有研究认为[8]MMR蛋白表达阴性与p53基因突变状态有显著相关性, 以上研究皆认同p53表达水平对总生存率和无病生存率没有预后影响. 本研究通过统计学分析得出, dMMR病例中p53基因突变状态与患者各临床病理特征均无相关性(P>0.05), MMR表达阴性与p53基因突变无相关性(P>0.05), 这虽与上述研究部分结论一致, 但由于本文涉及临床病例中检测的局限性, 关于p53的数据共计28例, 因此得出的结论及临床意义存在一定的缺陷; 考虑到样本量原因, 且CDX-2及p53相关性统计学分析后无意义, 故本文未对其做进一步探讨, 必要时或可进一步扩大样本量行检验分析.
MSI的主要病理特征为粘液成分、肿瘤浸润性淋巴细胞(tumor-infiltrating lymphocytes, TIL)和克罗恩样淋巴细胞反应(Crohn's-like lymphocytic reaction, CLR), 而本文未讨论单纯型粘液腺癌, 是为本文的不足之处, 不排除因此对其余统计学结果产生偏倚.
综上所述, MMR蛋白表达与结直肠腺癌患者发病年龄、肿瘤部位及分化程度有关, 而与患者性别、浸润深度、淋巴结转移及p53、CDX-2表达无关. 检测MMR蛋白对结直肠腺癌的早期诊断、制定治疗方案及评估预后具有重要的临床意义.
结直肠癌为临床常见恶性肿瘤,错配修复蛋白及CDX-2、p53的表达阴性明确与其发生发展相关, 错配修复蛋白与CDX-2、错配修复蛋白与p53间存在相互关系. 本文探讨三者与结直肠腺癌患者临床病理特征的相关性, 以期对其相互关系做进一步验证.
随着结直肠癌患者的增多及年轻化, 本研究主题为利用统计学分析结直肠腺癌患者肿瘤原发灶中错配修复蛋白及CDX-2、p53及临床病理特征的相关性, 以期验证三者对何临床病理特征存在影响.
本研究主要目标为探讨结直肠腺癌患者肿瘤原发灶中错配修复蛋白及CDX-2、p53的表达与临床病理特征是否存在相关性, 旨在为结直肠癌的临床治疗和预后评价提供一个有效的参考依据.
选取175例扬州大学附属医院收治的结直肠腺癌患者, 采用免疫组化方法检测肿瘤原发灶中错配修复蛋白(MLH1、MSH2、PMS2、MSH6)及CDX-2、p53的表达情况, 采用χ2检验统计分析各组中的分布差异, 采用Spearman等级相关统计分析各指标间的相关性.
175例结直肠腺癌患者中四种错配修复蛋白表达阴性比例为22.3%, 其中MLH1、PMS2的表达阴性比例较高, 分别为9.7%及16.0%; 91例结直肠腺癌中CDX-2表达阴性比例为35.1%, 28例结直肠腺癌中p53表达阴性比例为25%. dMMR与结直肠腺癌患者发病年龄、肿瘤部位及分化程度有显著性, 在患者性别、肿瘤浸润深度及淋巴结转移方面差异均无显著性. 错配修复蛋白与CDX-2、p53表达水平相关性无显著性.
错配修复蛋白的表达与结直肠癌患者的临床病理特征-发病年龄、肿瘤部位及分化程度有关. 肿瘤原发灶中错配修复蛋白的检测对于结直肠腺癌的早期诊断、风险管理评估及预后评价具有一定的参考意义.
本研究收集的病例数有限, 研究结果可能存在一定偏倚, 后续工作中仍需纳入更多病例进一步验证. 未来我们将调整样本量, 同时分析肿瘤原发灶及转移灶, 探究错配修复蛋白及CDX-2、p53三者间的相关性, 并进行进一步机制分析.
学科分类: 胃肠病学和肝病学
手稿来源地: 江苏省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 2. | Bufill JA. Colorectal cancer: evidence for distinct genetic categories based on proximal or distal tumor location. Ann Intern Med. 1990;113:779-788. [PubMed] [DOI] |
| 3. | Gelsomino F, Barbolini M, Spallanzani A, Pugliese G, Cascinu S. The evolving role of microsatellite instability in colorectal cancer: A review. Cancer Treat Rev. 2016;51:19-26. [PubMed] [DOI] |
| 4. | Dawson H, Galván JA, Helbling M, Muller DE, Karamitopoulou E, Koelzer VH, Economou M, Hammer C, Lugli A, Zlobec I. Possible role of Cdx2 in the serrated pathway of colorectal cancer characterized by BRAF mutation, high-level CpG Island methylator phenotype and mismatch repair-deficiency. Int J Cancer. 2014;134:2342-2351. [PubMed] [DOI] |
| 5. | Olsen J, Eiholm S, Kirkeby LT, Espersen ML, Jess P, Gögenür I, Olsen J, Troelsen JT. CDX2 downregulation is associated with poor differentiation and MMR deficiency in colon cancer. Exp Mol Pathol. 2016;100:59-66. [PubMed] [DOI] |
| 6. | Williams AB, Schumacher B. p53 in the DNA-Damage-Repair Process. Cold Spring Harb Perspect Med. 2016;6. [PubMed] [DOI] |
| 7. | Janic A, Valente LJ, Wakefield MJ, Di Stefano L, Milla L, Wilcox S, Yang H, Tai L, Vandenberg CJ, Kueh AJ, Mizutani S, Brennan MS, Schenk RL, Lindqvist LM, Papenfuss AT, O'Connor L, Strasser A, Herold MJ. DNA repair processes are critical mediators of p53-dependent tumor suppression. Nat Med. 2018;24:947-953. [PubMed] [DOI] |
| 8. | Maraqa B, Al-Shbool G, Abu-Shawer O, Souleiman M, Alshakhatreh O, Al-Omari A, Abdelkhaleq H, Taqash A, Al-Hussaini M. Frequency of Mismatch Repair Protein (MMRP) Deficiency among Young Jordanians Diagnosed with Colorectal Carcinoma (CRC). Gastroenterol Res Pract. 2020;2020:5632984. [PubMed] [DOI] |
| 9. | Slik K, Turkki R, Carpén O, Kurki S, Korkeila E, Sundström J, Pellinen T. CDX2 Loss With Microsatellite Stable Phenotype Predicts Poor Clinical Outcome in Stage II Colorectal Carcinoma. Am J Surg Pathol. 2019;43:1473-1482. [PubMed] [DOI] |
| 10. | Zaanan A, Meunier K, Sangar F, Fléjou JF, Praz F. Microsatellite instability in colorectal cancer: from molecular oncogenic mechanisms to clinical implications. Cell Oncol (Dordr). 2011;34:155-176. [PubMed] [DOI] |
| 11. | Acharya S, Wilson T, Gradia S, Kane MF, Guerrette S, Marsischky GT, Kolodner R, Fishel R. hMSH2 forms specific mispair-binding complexes with hMSH3 and hMSH6. Proc Natl Acad Sci USA. 1996;93:13629-13634. [PubMed] [DOI] |
| 12. | Lynch HT, Lynch PM, Lanspa SJ, Snyder CL, Lynch JF, Boland CR. Review of the Lynch syndrome: history, molecular genetics, screening, differential diagnosis, and medicolegal ramifications. Clin Genet. 2009;76:1-18. [PubMed] [DOI] |
| 13. | 黎 相照, 刘 焕娇, 梁 敏仪, 陈 慧慧, 梁 莉. 微卫星不稳定性类型及临床病理特征: 基于1394例结直肠癌患者的标本检测. 南方医科大学学报. 2020;40:1645-1650. [DOI] |
| 14. | 谢 乐斯, 赵 盼, 周 虹, 王 炜, 项 晶晶. 错配修复蛋白表达及RAS基因突变与结直肠癌临床病理特征的关系. 临床与实验病理学杂志. 2021;37:44-48. [DOI] |
| 16. | Werling RW, Yaziji H, Bacchi CE, Gown AM. CDX2, a highly sensitive and specific marker of adenocarcinomas of intestinal origin: an immunohistochemical survey of 476 primary and metastatic carcinomas. Am J Surg Pathol. 2003;27:303-310. [PubMed] [DOI] |
| 17. | Funakoshi S, Kong J, Crissey MA, Dang L, Dang D, Lynch JP. Intestine-specific transcription factor Cdx2 induces E-cadherin function by enhancing the trafficking of E-cadherin to the cell membrane. Am J Physiol Gastrointest Liver Physiol. 2010;299:G1054-G1067. [PubMed] [DOI] |
| 18. | Dawson H, Koelzer VH, Lukesch AC, Mallaev M, Inderbitzin D, Lugli A, Zlobec I. Loss of Cdx2 Expression in Primary Tumors and Lymph Node Metastases is Specific for Mismatch Repair-Deficiency in Colorectal Cancer. Front Oncol. 2013;3:265. [PubMed] [DOI] |
| 19. | Korphaisarn K, Sukhokanjanachusak K, Pongpaibul A, Chinswangwatanakul V, Akewanlop C. Loss of CDX-2 expression is an independent poor prognostic biomarker in patients with early-stage deficient mismatch repair colorectal cancer. Asia Pac J Clin Oncol. 2021. [PubMed] [DOI] |
| 20. | Melincovici CS, Boşca AB, Şuşman S, Cutaş A, Mărginean M, Ilea A, Moldovan IM, Jianu EM, Neag MA, Bulboacă AE, Mihu CM. Assessment of mismatch repair deficiency, CDX2, beta-catenin and E-cadherin expression in colon cancer: molecular characteristics and impact on prognosis and survival - an immunohistochemical study. Rom J Morphol Embryol. 2020;61:715-727. [PubMed] [DOI] |
| 21. | Ishikawa T, Fujita T, Suzuki Y, Okabe S, Yuasa Y, Iwai T, Kawakami Y. Tumor-specific immunological recognition of frameshift-mutated peptides in colon cancer with microsatellite instability. Cancer Res. 2003;63:5564-5572. [PubMed] |
| 22. | 吕 晨曦, 王 德智, 金 鹏, 杨 欣艳, 盛 剑秋. 错配修复基因MLH1激活p53和线粒体凋亡通路参与雌激素诱导的结肠癌细胞凋亡. 胃肠病学. 2014;19:279-283. [DOI] |
| 23. | Kim HR, Kim HC, Yun HR, Kim SH, Park CK, Cho YB, Yun SH, Lee WY, Chun HK. An alternative pathway in colorectal carcinogenesis based on the mismatch repair system and p53 expression in Korean patients with sporadic colorectal cancer. Ann Surg Oncol. 2013;20:4031-4040. [PubMed] [DOI] |
| 24. | Huh JW, Kim HC, Kim SH, Park YA, Cho YB, Yun SH, Lee WY, Chun HK. Mismatch repair system and p53 expression in patients with T1 and T2 colorectal cancer: predictive role of lymph node metastasis and survival. J Surg Oncol. 2014;109:848-852. [PubMed] [DOI] |