修回日期: 2022-03-01
接受日期: 2022-03-21
在线出版日期: 2022-03-28
轮状病毒性肠炎(rotavirus enteritis, RVE)是全球范围内严重影响婴幼儿生命健康的重要疾病之一, 近年来临床逐渐认为肠道菌群紊乱在其发生过程中扮演重要角色. 但关于肠道菌群对RVE患儿病情程度、体液免疫的影响的验证数据尚少.
探讨RVE患儿肠道菌群与病情程度、肠道黏膜屏障功能及体液免疫的相关性.
选取我院2019-01/2021-05 RVE患儿131例, 根据病情程度分为轻症组(39例)、中症组(58例)、重症组(34例). 比较3组肠道菌群数量与失调分级分布情况, 分析肠道菌群数量、失调分级与病情程度的关系, 对比不同肠道菌群失调分级患儿肠道黏膜屏障功能指标[血清D-乳酸(D-lactic acid, D-LA)、二胺氧化酶(diamine oxidase, DAO)、内毒素(endotoxin, ET)]、体液免疫指标[血清免疫球蛋白A(immunoglobulin A, IgA)、免疫球蛋白G(immunoglobulin G, IgG)、免疫球蛋白M(immunoglobulin M, IgM)]水平, 分析肠道黏膜屏障功能、体液免疫与肠道菌群失调分级的相关性.
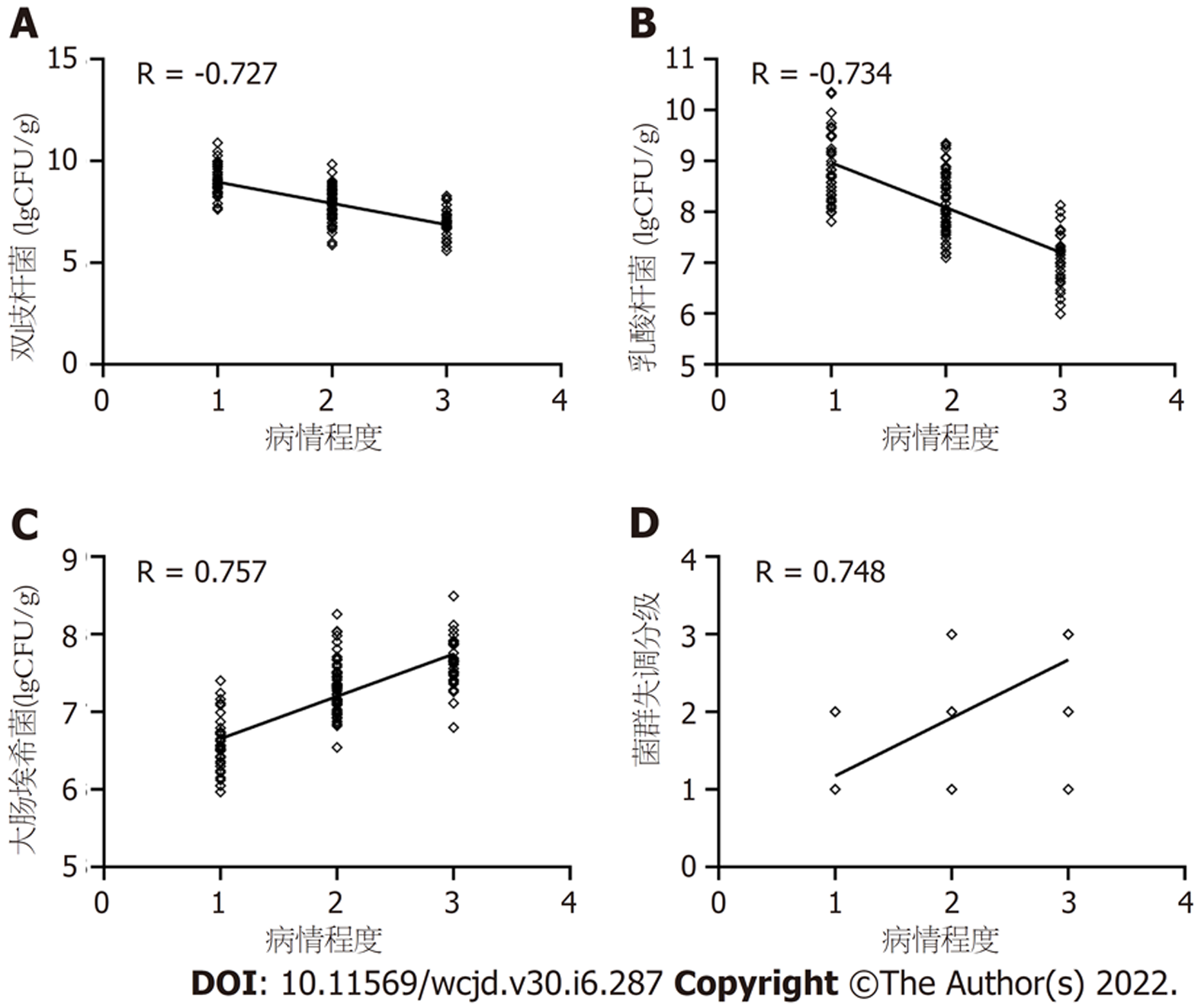
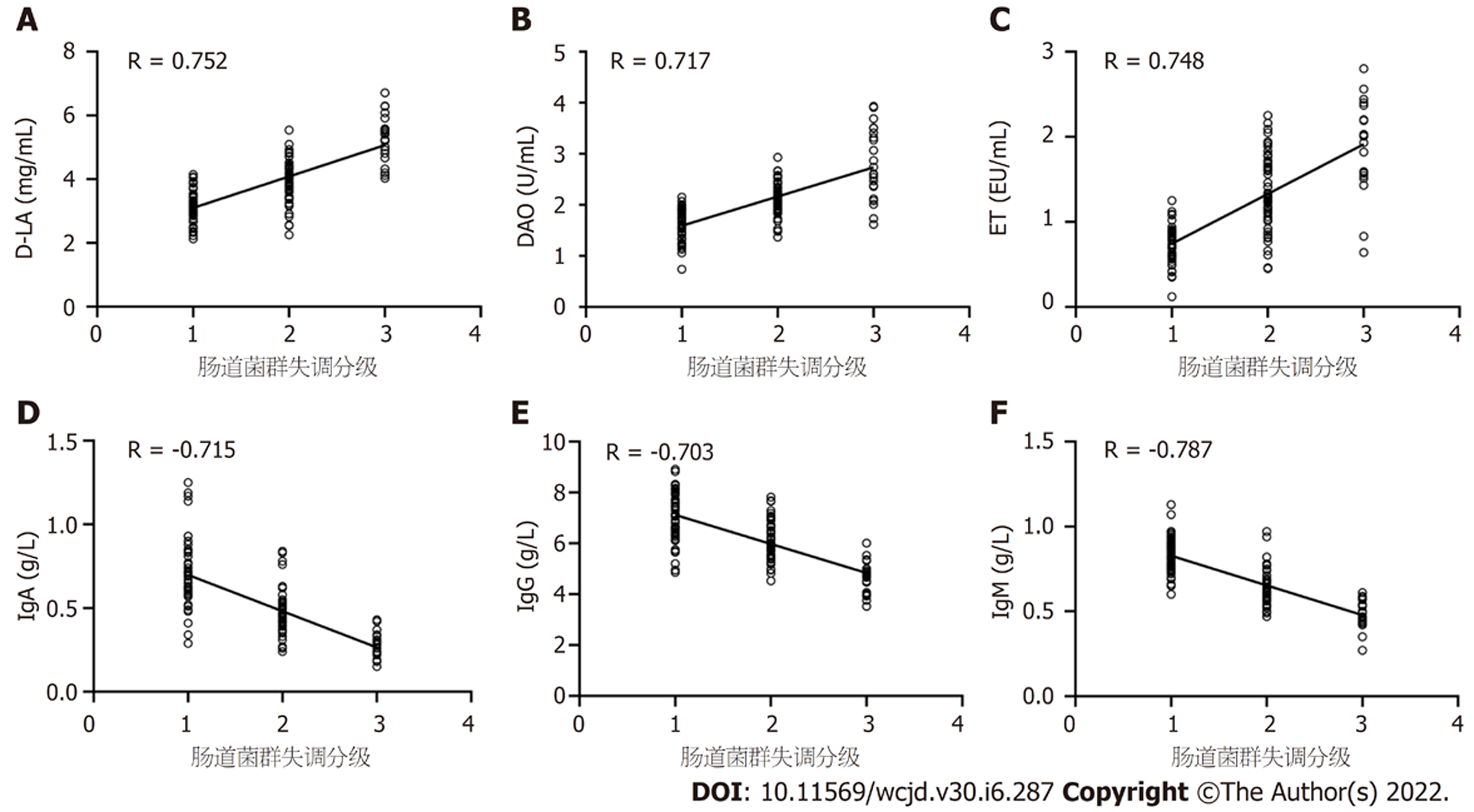
肠道双歧杆菌、乳酸杆菌数量与病情程度呈负相关, 肠道大肠埃希菌数量、菌群失调分级与病情程度呈正相关(r = -0.727、-0.734、0.757、0.748, P均<0.05); 血清D-LA、DAO、ET与肠道菌群失调分级呈正相关, 血清IgA、IgG、IgM与肠道菌群失调分级呈负相关(r = 0.752、0.717、0.748、-0.715、-0.703、-0.787, P均<0.05).
RVE患儿肠道菌群数量、失调分级与病情程度、肠道黏膜屏障功能、体液免疫显著相关, 为临床制定治疗方案提供借鉴依据.
核心提要: 目前国内外关于肠道菌群在轮状病毒性肠炎(rotavirus enteritis, RVE)中的相关机制仍未统一. 本文旨在研究RVE患儿肠道菌群与病情程度、肠道黏膜屏障功能、体液免疫之间的关系, 为临床判断病情程度、制定治疗方案提供新的思路与方向.
引文著录: 陈国琴, 王丽丽. 轮状病毒性肠炎患儿肠道菌群与病情程度、肠道黏膜屏障功能及体液免疫的相关性. 世界华人消化杂志 2022; 30(6): 287-294
Revised: March 1, 2022
Accepted: March 21, 2022
Published online: March 28, 2022
Rotavirus enteritis (RVE) is a disease that seriously affects the life and health of infants and young children worldwide. In recent years, it has been gradually recognized that intestinal flora disturbance plays an important role in the occurrence of RVE. However, there is little validation data on the effect of gut microbiota on the severity of illness and humoral immunity in children with RVE.
To analyze the correlation between intestinal flora and disease severity, intestinal mucosal barrier function, and humoral immunity in children with RVE.
A total of 131 children with RVE diagnosed at our hospital from January 2019 to May 2021 were selected and divided into a mild group (39 cases), a moderate group (58 cases), and a severe group (34 cases) according to the severity of the disease. The number of intestinal bacteria and the distribution of dysbiosis grades were analyzed, and the relationship of the number of intestinal bacteria and dysbiosis grades with disease severity was analyzed. The intestinal mucosal barrier function indicators [serum D-lactic acid (D-LA), diamine oxidase (DAO), and endotoxin (ET)] and humoral immune indexes [serum immunoglobulin (Ig)A, IgG, and IgM] levels in children with different intestinal flora dysbiosis grades were measured, and the correlation between intestinal mucosal barrier function, humoral immunity, and the grade of intestinal flora imbalance was analyzed.
The number of intestinal bifidobacteria and lactobacilli was negatively correlated with the severity of the disease, while the number of intestinal Escherichia coli and the grade of dysbacteriosis were positively correlated with the severity of the disease (r = -0.727, -0.734, 0.757, and 0.748, respectively, P < 0.05). Serum D-LA, DAO, and ET were positively correlated with the grade of intestinal flora imbalance, and serum IgA, IgG, and IgM were negatively correlated with the grade of intestinal flora dysbiosis (r = 0.752, 0.717, 0.748, -0.715, -0.703 , and -0.787, respectively, P < 0.05).
The number of intestinal bacteria and the grade of disorders in children with RVE are significantly correlated with the severity of the disease, intestinal mucosal barrier function, and humoral immunity.
- Citation: Chen GQ, Wang LL. Distribution of intestinal flora in children with rotavirus enteritis and its correlation with intestinal mucosal barrier function and humoral immunity. Shijie Huaren Xiaohua Zazhi 2022; 30(6): 287-294
- URL: https://www.wjgnet.com/1009-3079/full/v30/i6/287.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i6.287
轮状病毒性肠炎(rotavirus enteritis, RVE)具有起病急骤、病情进展迅速等特点, 多发于冬春季节, 流行病学调查显示, 全世界范围内约1.25亿婴幼儿感染轮状病毒, 不仅会诱发电解质紊乱、酸中毒等并发症, 还能导致循环系统、呼吸道损害, 严重时危及患儿生命安全[1]. 目前, 国外有研究表明, 肠道菌群组成的微小变化不会影响RVE患儿DSS结肠炎易感性[2]. 国内相关报道则指出, 肠道双歧杆菌、大肠杆菌及乳酸杆菌等肠道正常微生物菌群紊乱是RVE主要发病机制之一[3]. 说明肠道菌群在RVE中的机制尚未得到完全统一. 另外, 肠道黏膜屏障功能障碍、免疫功能紊乱在多种肠炎发病中的作用也越来越受到重视[4,5]. 但关于RVE患儿肠道菌群与病情程度、肠道黏膜屏障功能、体液免疫之间的关系仍缺乏大量循证依据, 故本研究对此进行探讨, 旨在为临床判断病情程度、制定针对性治疗方案提供数据支持. 报告如下.
选取我院2019-01/2021-05 RVE患儿131例, 根据病情程度分为轻症组(39例)、中症组(58例)、重症组(34例). 3组年龄、性别、病程、体质量差异无统计学意义, 有可比性, 见表1. 本研究经我院伦理委员会审批通过, 批号: QR58689.
| 组别 | 例数 | 年龄(岁) | 性别(男/女) | 病程(d) | 体质量(kg) |
| 轻症组 | 39 | 2.28±0.54 | 20/19 | 2.66±0.67 | 11.15±1.29 |
| 中症组 | 58 | 2.37±0.50 | 31/27 | 2.71±0.63 | 11.04±1.18 |
| 重症组 | 34 | 2.24±0.61 | 20/14 | 2.80±0.72 | 10.92±1.06 |
| F/χ2 | 0.699 | 0.440 | 0.410 | 0.342 | |
| P | 0.499 | 0.803 | 0.665 | 0.711 |
纳入标准: 大便均呈蛋花汤样或水样, 每天数次至数十次; 均经粪便轮状病毒抗原检测呈阳性, 粪便细菌培养呈阴性, 符合《儿科学》中轮状病毒性肠炎诊断标准及病情程度标准[6]; 患儿监护人均知情本研究, 签订知情承诺书.
排除标准: 因寄生虫感染、细菌性肠炎、痢疾等其他疾病所致的腹泻; 均为首次确诊, 参与本研究前未接受RVE相关治疗; 伴有严重心肝肾肺等重要脏器功能异常者; 存在肠组织解剖结构畸形者; 合并其他感染性疾病、自身免疫性疾病、先天性免疫缺陷性疾病者; 服用抗生素或益生菌者.
肠道菌群检测方法: 于患儿入院当日采集3 g湿粪便样本, 常规离心, 洗涤, 采用Sigma公司的DNA试剂盒提取样本中细菌总DNA, 将粪便细菌DNA样本与相应标准品, 对标准品进行5次以上的连续梯度稀释, 之后进行PCR扩增反应, 乳杆菌、双歧杆菌和大肠埃希菌引物序列分别为: F:5'-AGCAGTAGGGAATCTTCCA-3', R:5'-CACCGCTACACATGGAG-3'; F:5'-TCGCGTC(C/T)GGTGTGAAAG-3', R:5'-CCACATCCAGC(A/G)TCCAC-3'; F:5'-GTTAATACCTTTGCTCATTGA-3', R:5'-ACCAGGGTATCTTAATCCTGTT-3', 靶基因为16S rDNA, 经系统软件自动计算出Ct值, 绘出标准曲线, 使用Ct值与标准曲线定量测定乳杆菌、双歧杆菌和大肠埃希菌的拷贝数. 肠道菌群失调分级参考文献[7]制定: 粪便菌群总数及分布比例轻度改变, 革兰阴性杆菌数量增加, 革兰阳性杆菌数量减少, 革兰阳性球菌有所增加或正常, 酵母菌、梭菌比例呈轻度增加为1级; 粪便菌群数量、分布比例有明显变化, 革兰阴性杆菌数量增加, 革兰阳性杆菌数量减少, 革兰阳性球菌增加, 杆菌、球菌比例紊乱或倒置, 酵母菌、梭菌数量明显增加为2级; 粪便细菌总数明显减少, 菌群比例紊乱, 真菌或细菌为占优势, 少数菌群转变为优势菌群为3级. 分级越高, 表示肠道菌群失调越严重.
血清指标检测方法: 于患儿入院当日抽取清晨空腹静脉血3 mL, 离心处理, 离心半径为13.5 cm, 离心速率为3000 r/min, 离心时间为10 min, 取上清液, 保存于-70 ℃恒温冰箱内, 待检. 采用酶联免疫吸附法检测血清D-乳酸(D-lactic acid, D-LA)、二胺氧化酶(diamine oxidase, DAO)、免疫球蛋白A(immunoglobulin A, IgA)、免疫球蛋白G(immunoglobulin G, IgG)、免疫球蛋白M(immunoglobulin M, IgM)水平, 试剂盒购自上海酶联生物科技有限公司, 鲎试剂偶氮显色基质法检测血清内毒素(endotoxin, ET)水平, 试剂盒购自厦门市鲎试剂公司, 所有操作遵循试剂盒说明书.
(1)3组肠道菌群数量分布情况, 包括乳杆菌、双歧杆菌和大肠埃希菌数量; (2)3组肠道菌群失调分级分布情况; (3)肠道菌群数量、失调分级与病情程度的关系; (4)不同肠道菌群失调分级患儿肠道黏膜屏障功能指标血清D-LA、DAO、ET水平; (5)不同肠道菌群失调分级患儿体液免疫指标血清IgA、IgG、IgM水平; (6)血清D-LA、DAO、ET、IgA、IgG、IgM与肠道菌群失调分级的相关性.
统计学处理 采用统计学软件SPSS 22.0处理数据, 计量资料采取Bartlett方差齐性检验与夏皮罗-威尔克正态性检验, 均确认具备方差齐性且服从正态分布, 以均数±标准差(mean±SD)描述, 多组间比较采用单因素方差分析, 采用F检验, 进一步两两组间比较采用LSD-t检验, 两组间比较采用独立样本t检验; 计数资料用n(%)表示, χ2检验, 等级资料用u表示, Ridit检验; 相关性采用Spearman相关系数模型分析. P<0.05表明差异有统计学意义.
单因素方差分析, 3组双歧杆菌、乳酸杆菌、大肠埃希菌数量差异有统计学意义(P<0.05); 重症组双歧杆菌、乳酸杆菌数量低于中症组、轻症组, 中症组低于轻症组, 重症组大肠埃希菌数量高于中症组、轻症组, 中症组高于轻症组(P<0.05), 见表2.
Ridit检验分析, 重症组肠道菌群失调分级高于中症组、轻症组, 中症组高于轻症组(P<0.05), 见表3.
| 组别 | 例数 | 1级 | 2级 | 3级 |
| 轻症组 | 39 | 28(71.79) | 11(28.21) | 0(0.00) |
| 中症组 | 58 | 19(32.76) | 30(51.72) | 9(15.52) |
| 重症组 | 34 | 6(17.65) | 15(44.12) | 13(38.24) |
| u | 26.060 | |||
| P | <0.001 |
Spearman相关性分析, 肠道双歧杆菌、乳酸杆菌数量与病情程度呈负相关, 肠道大肠埃希菌数量、菌群失调分级与病情程度呈正相关(r = -0.727、-0.734、0.757、0.748, P均<0.05), 见图1.
单因素方差分析, 不同肠道菌群失调分级患儿血清D-LA、DAO、ET差异有统计学意义(P<0.05); 随着肠道菌群失调分级增加, 血清D-LA、DAO、ET呈不断升高趋势(P<0.05), 见表4.
单因素方差分析, 不同肠道菌群失调分级患儿血清IgA、IgG、IgM差异有统计学意义(P<0.05); 随着肠道菌群失调分级增加, 血清IgA、IgG、IgM呈不断降低趋势(P<0.05), 见表5.
Spearman相关性分析, 血清D-LA、DAO、ET与肠道菌群失调分级呈正相关, 血清IgA、IgG、IgM与肠道菌群失调分级呈负相关(r = 0.752、0.717、0.748、-0.715、-0.703、-0.787, P均<0.05), 见图2.
RVE是临床常见儿科肠道感染性疾病, 发生率仅次于呼吸道感染, 主要经由粪口与呼吸道传播, 会出现不同程度腹泻、发热等临床症状, 危害儿童身心健康[8,9]. 相关研究表明, 随着RVE病情不断进展, 可能引起全身性感染, 对机体呼吸、循环、神经系统产生严重不利影响, 若未得到及时有效救治, 则会显著增加预后不良及死亡风险[10]. 因此, 积极探索病情进展相关机制对采取针对性治疗方案改善预后至关重要. (r = -0.727、-0.734、0.757、0.748, P均<0.05); 血清D-LA、DAO、ET与肠道菌群失调分级呈正相关, 血清IgA、IgG、IgM与肠道菌群失调分级呈负相关(r = 0.752、0.717、0.748、-0.715、-0.703、-0.787, P均<0.05).
肠道菌群是维持肠道系统功能的重要物质, 大量临床实践证实, 肠道菌群紊乱在RVE发病与病情进展过程中扮演着关键角色[11,12]. 正常情况下, 肠道双歧杆菌、乳酸杆菌、大肠埃希菌处于动态平衡状态, 其中双歧杆菌、乳酸杆菌为益生菌, 双歧杆菌可提高机体对钙、磷、维生素D的吸收, 具有抗衰老、调节免疫、促进中枢神经系统发育完善等作用; 乳酸杆菌能抑制各种病原菌黏附于肠道上皮细胞, 抑制毒素增殖; 大肠埃希菌属于致病菌, 在发生肠道相关感染疾病时数量显著增加, 发挥促进疾病发生发展作用[13,14]. 蔡海芳[15]报道中显示, RVE患儿治疗前双歧杆菌、乳酸杆菌数量显著减少, 大肠埃希菌数量明显增加. 在此基础上, 本研究发现, 肠道双歧杆菌、乳酸杆菌数量与病情程度呈负相关, 肠道大肠埃希菌数量、菌群失调分级与病情程度呈正相关, 说明肠道菌群数量改变、失调分级与RVE病情程度联系紧密. 原因在于以下方面: 在RVE发生时, RV侵袭机体肠微绒毛柱状上皮细胞, 导致其出现空泡变性、坏死, 引发吸收障碍、腹泻, 还会造成双糖酶活性受到抑制、分泌量明显减少, 无法正常分解乳糖, 导致肠腔渗透液增高、渗透性腹泻, 破坏肠道厌氧环境, 形成利于需氧菌繁殖的内环境, 从而致使双歧杆菌、乳酸杆菌数量减少, 大肠埃希菌数量增加, 且随着病情进展这种改变会逐渐加重肠道菌群失调分级, 而肠道菌群失调加重又会促进病情进展, 最终形成恶性循环[16]. 因此, 肠道菌群数量改变、失调分级会对RVE病情程度产生明显影响, 临床需给予重视.
肠黏膜表面形成的肠道黏膜屏障是保障肠道菌群维持动态平衡的重要环节[17]. 本研究结果显示, 随着肠道菌群失调分级增加, 血清D-LA、DAO、ET呈不断升高趋势, 与肠道菌群失调分级呈正相关, 其中血清D-LA、DAO、ET是评估肠道黏膜屏障功能的主要指标, 水平异常升高提示肠道黏膜屏障损伤[18,19]. 本研究产生上述结果的原因结合Martens等[20]报道考虑是由于肠道菌群遭到破坏, 便会增加肠道黏膜通透性, 导致肠道黏膜屏障受损、大量肠液分泌, 进一步加重肠道菌群紊乱. 此外, RVE患儿常伴有免疫功能受损, 急性期常表现为体液免疫低下, 呈现明显免疫抑制[21]. 血清IgA、IgG、IgM是反映机体体液免疫情况的指标, 均属于抗感染抗体, 在机体内有害代谢物质增加时, 其表达水平呈下调趋势[22]. 本研究发现, 血清IgA、IgG、IgM与肠道菌群失调分级呈负相关, 主要是因为机体受到RVE病毒侵袭后, 肠道菌群中的致病菌大量增加, 免疫球蛋白为抵抗致病菌过度消耗, 导致其转换功能减弱、合成速度减缓、含量明显减少[23].
由上述研究结果可知, 纠正肠道菌群紊乱、修复肠道黏膜屏障、增强机体体液免疫功能有望成为治疗RVE患儿的重要途径, 可给予益生菌、肠道黏膜保护剂、免疫球蛋白联合治疗, 为提高治疗效果、促进病情改善创造有利条件. 本研究局限性在于: 未详细探讨益生菌、肠道黏膜保护剂、免疫球蛋白联合治疗RVE患儿的临床疗效, 今后应继续收集病例, 做进一步分析, 以获取更为全面的数据支持.
综上可知, 轮状病毒性肠炎患儿肠道菌群数量、失调分级与病情程度显著相关, 在肠道黏膜屏障功能障碍、体液免疫紊乱中发挥重要作用, 为临床制定治疗方案提供借鉴依据.
轮状病毒性肠炎(rotavirus enteritis, RVE)是婴幼儿发病率较高的疾病之一, 具有较大危害性, 是导致儿童营养不良和死亡的重要原因之一. 目前认为肠道菌群紊乱能加快RVE发生, 但关于肠道菌群对RVE患儿病情程度、体液免疫的影响的验证数据尚少.
关于肠道菌群与RVE患儿病情程度、肠道黏膜屏障功能、体液免疫之间的关系验证数据尚少, 本研究以此为目标入手, 通过观察不同病情程度RVE患儿肠道菌群数量、菌群失调分级分析肠道菌群与RVE患儿病情程度的关系, 还通过观察不同肠道菌群失调分级患儿肠道黏膜屏障功能、体液免疫指标水平分析肠道菌群与肠道黏膜屏障功能、体液免疫的关系, 为临床提供数据支持.
观察肠道菌群与RVE患儿病情程度、肠道黏膜屏障功能、体液免疫之间的关系.
连续纳入我院2019-01/2021-05 RVE患儿131例, 根据病情程度分为轻症组(39例)、中症组(58例)、重症组(34例), 进行前瞻性研究. 收集比较3组肠道菌群数量与失调分级分布情况, 采用Spearman相关性分析肠道菌群数量、失调分级与病情程度的关系, 对比不同肠道菌群失调分级患儿肠道黏膜屏障功能指标[血清D-乳酸(D-lactic acid, D-LA)、二胺氧化酶(diamine oxidase, DAO)、内毒素(endotoxin, ET)]、体液免疫指标[血清免疫球蛋白A(immunoglobulin A, IgA)、免疫球蛋白G(immunoglobulin G, IgG)、免疫球蛋白M(immunoglobulin M, IgM)]水平, 采用Spearman相关性分析肠道黏膜屏障功能、体液免疫与肠道菌群失调分级的相关性, 应用SPSS 22.0软件进行统计分析.
肠道双歧杆菌、乳酸杆菌数量与病情程度呈负相关, 肠道大肠埃希菌数量、菌群失调分级与病情程度呈正相关(P均<0.05); 血清D-LA、DAO、ET与肠道菌群失调分级呈正相关, 血清IgA、IgG、IgM与肠道菌群失调分级呈负相关(P均<0.05).
轮状病毒性肠炎患儿肠道菌群数量、失调分级与病情程度、肠道黏膜屏障功能障碍、体液免疫紊乱显著相关, 在其疾病发展过程中发挥重要作用.
随着肠道菌群紊乱在轮状病毒性肠炎中的作用机制逐渐明确, 临床可通过检测肠道菌群具体细菌种类数量、菌群失调分级为采取合理、适量的益生菌类药物提供可靠依据, 意味着轮状病毒性肠炎患儿的治疗得到进一步改善, 也预示着安全、高效治愈轮状病毒性肠炎是可以轻松实现的.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C, C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Gupta V, Aggarwal P, Kumar B, Nair NP, Thiyagarajan V, Lingam R. Rotavirus Gastroenteritis in Eastern Uttar Pradesh, India. Indian J Pediatr. 2021;88:66-71. [PubMed] [DOI] |
| 2. | Hamza KH, Dunér E, Ulmert I, Arias A, Sorobetea D, Lahl K. Minor alterations in the intestinal microbiota composition upon Rotavirus infection do not affect susceptibility to DSS colitis. Sci Rep. 2021;11:13485. [PubMed] [DOI] |
| 8. | Sakpaisal P, Silapong S, Yowang A, Boonyasakyothin G, Yuttayong B, Suksawad U, Sornsakrin S, Lertsethtakarn P, Bodhidatta L, Crawford JM, Mason CJ. Prevalence and Genotypic Distribution of Rotavirus in Thailand: A Multicenter Study. Am J Trop Med Hyg. 2019;100:1258-1265. [PubMed] [DOI] |
| 10. | Burnett E, Tate JE, Kirkwood CD, Nelson EAS, Santosham M, Steele AD, Parashar UD. Estimated impact of rotavirus vaccine on hospitalizations and deaths from rotavirus diarrhea among children <5 in Asia. Expert Rev Vaccines. 2018;17:453-460. [PubMed] [DOI] |
| 12. | Sebastián Domingo JJ, Sánchez Sánchez C. From the intestinal flora to the microbiome. Rev Esp Enferm Dig. 2018;110:51-56. [PubMed] [DOI] |
| 13. | Parker EPK, Praharaj I, Zekavati A, Lazarus RP, Giri S, Operario DJ, Liu J, Houpt E, Iturriza-Gómara M, Kampmann B, John J, Kang G, Grassly NC. Influence of the intestinal microbiota on the immunogenicity of oral rotavirus vaccine given to infants in south India. Vaccine. 2018;36:264-272. [PubMed] [DOI] |
| 17. | Wu Y, Tang L, Wang B, Sun Q, Zhao P, Li W. The role of autophagy in maintaining intestinal mucosal barrier. J Cell Physiol. 2019;234:19406-19419. [PubMed] [DOI] |
| 18. | 李 瑶, 黄 金莉, 黄 娟, 李 华军. 肠道菌群与肠道屏障互作在炎症性肠病中的作用研究进展. 胃肠病学和肝病学杂志. 2021;30:10-15. [DOI] |
| 20. | Martens EC, Neumann M, Desai MS. Interactions of commensal and pathogenic microorganisms with the intestinal mucosal barrier. Nat Rev Microbiol. 2018;16:457-470. [PubMed] [DOI] |
| 23. | Baker JM, Tate JE, Leon J, Haber MJ, Pitzer VE, Lopman BA. Postvaccination Serum Antirotavirus Immunoglobulin A as a Correlate of Protection Against Rotavirus Gastroenteritis Across Settings. J Infect Dis. 2020;222:309-318. [PubMed] [DOI] |