修回日期: 2021-10-01
接受日期: 2022-02-28
在线出版日期: 2022-03-08
胃癌筛查是早期诊断胃癌的一种有效手段, 国内外研究发现胃癌与癌前病变患者血清胃泌素-17(gastrin 17, G-17)、胃蛋白酶原(pepsinogen, PG)Ⅰ、Ⅱ、幽门螺杆菌(Helicobacter pylori, H. pylori)-免疫球蛋白G(immunoglobulin G, IgG)(Hp-IgG)抗体水平存在明显差异, 推测其能应用于胃癌的诊断及病情评估.
探究G-17、PGⅠ、PGⅡ、Hp-IgG水平对胃癌与癌前病变的筛查价值及与肿瘤浸润深度的关系.
选取2019-08/2021-03我院90例胃癌患者作为研究组, 另选同期90例胃癌前病变患者作为对照A组、90例健康体检者作为对照B组. 比较3组一般资料、血清G-17、PGⅠ、PGⅡ水平、Hp-IgG阳性率, 并比较Hp-IgG阳性与阴性患者血清G-17、PGⅠ、PGⅡ水平, 分析血清G-17、PGⅠ、PGⅡ水平与Hp-IgG阳性的关系, 分析各指标诊断胃癌的价值及与胃癌肿瘤浸润深度的关系.
研究组血清G-17、PGⅡ水平、Hp-IgG阳性率均>对照A组>对照B组, 血清PGⅠ水平<对照A组<对照B组(P<0.05); 研究组Hp-IgG阳性患者血清G-17、PGⅡ水平均高于阴性患者, 血清PGⅠ水平低于阴性患者(P<0.05); 血清G-17、PGⅡ水平与Hp-IgG阳性呈正相关, 血清PGⅠ与Hp-IgG阳性呈负相关(P<0.05); 血清G-17、PGⅠ、PGⅡ、Hp-IgG阳性诊断胃癌的曲线下面积(area under curve, AUC)分别为0.828、0.845、0.821、0.650, 各指标联合诊断的AUC最大, 为0.887, 最佳诊断敏感度、特异度分别为80.03%、84.46%; 血清G-17、PGⅡ水平、Hp-IgG阳性率均随胃癌肿瘤浸润深度增加逐渐升高, 血清PGⅠ水平随胃癌肿瘤浸润深度增加逐渐降低(P<0.05); 胃癌肿瘤浸润深度与血清G-17、PGⅡ、Hp-IgG阳性呈正相关, 与血清PGⅠ呈负相关(P<0.05).
血清G-17、PGⅠ、PGⅡ水平、Hp-IgG检测在胃癌与癌前病变筛查方面具有一定诊断价值, 且与胃癌肿瘤浸润深度密切相关.
核心提要: 胃癌肿瘤浸润深度与血清胃泌素-17(gastrin 17, G-17)、胃蛋白酶原(pepsinogen, PG)Ⅱ、幽门螺杆菌(Helicobacter pylori, H. pylori)-免疫球蛋白G(immuno-globulin G, IgG)阳性呈正相关, 与血清PGⅠ呈负相关, 证明以上指标检测在胃癌与癌前病变筛查方面具有一定诊断价值, 且与胃癌肿瘤浸润深度密切相关.
引文著录: 盛倩, 章国东, 温敏雅. 血清G-17、PGⅠ、PGⅡ、Hp-IgG检测对胃癌与癌前病变的筛查价值及与肿瘤浸润深度关系. 世界华人消化杂志 2022; 30(5): 235-241
Revised: October 1, 2021
Accepted: February 28, 2022
Published online: March 8, 2022
Screening for gastric cancer is an effective method for early diagnosis of gastric cancer. Studies at home and abroad have found significant differences in serum gastrin-17, pepsinogen Ⅰ, Ⅱ and Helicobacter pylori (H. pylori) IgG (Hp-IgG) antibody levels between patients with gastric cancer and precancerous lesions. It is speculated that screening can be used in the diagnosis and evaluation of gastric cancer.
To explore the screening of gastric cancer and precancerous lesions by serum gastrin-17 (G-17), pepsinogen (PG) I, PG II, Hp-IgG antibody levels value and its relationship with the depth of tumor invasion.
From August 2019 to March 2021, 90 patients with gastric cancer in our hospital were selected as the research group, 90 patients with gastric precancerous lesions during the same period were selected as the control group A, and 90 healthy subjects were selected as the control group B. Compare 3 groups of general information, serum G-17, PG Ⅰ, PG Ⅱ levels, Hp-IgG positive rate, compare serum G-17, PG Ⅰ, PG Ⅱ levels of Hp-IgG positive and negative patients, and analyze serum G-17, PG Ⅰ, PG Ⅱ The relationship between the level and Hp-IgG positive, analyze the value of each index in the diagnosis of gastric cancer and the relationship with the depth of gastric cancer tumor invasion.
Serum G-17, PGII levels and Hp-IgG positive rate in the study group were all > control group A > control group B, serum PG Ⅰ level < control group A < control group B (P < 0.05); the serum G-17 and PGⅡ levels of Hp-IgG positive patients in the study group Both were higher than in negative patients, and serum PG Ⅰ levels were lower than in negative patients (P < 0.05); serum G-17 and PG Ⅱ levels were positively correlated with Hp-IgG positive, and serum PG Ⅰ was negatively correlated with Hp-IgG positive (P < 0.05); The area under curve (AUC) of serum G-17, PG Ⅰ, PG Ⅱ, and Hp-IgG positive diagnosis of gastric cancer were 0.828, 0.845, 0.821, 0.650, respectively. The combined diagnosis of each index had the largest AUC, which was 0.887. The best diagnostic sensitivity and specificity The levels were 80.03% and 84.46%, respectively; serum G-17, PG Ⅱ levels, and Hp-IgG positive rates gradually increased with the increase of gastric cancer tumor invasion depth, and serum PG Ⅰ levels gradually decreased with the increase of gastric cancer tumor invasion depth (P < 0.05); The depth of gastric cancer tumor invasion was positively correlated with serum G-17, PG Ⅱ, Hp-IgG positive, and negatively correlated with serum PG Ⅰ (P < 0.05).
Serum levels of G-17, PG Ⅰ, PG Ⅱ, and Hp-IgG have certain diagnostic value in the screening of gastric cancer and precancerous lesions, and are closely related to the depth of gastric cancer tumor invasion.
- Citation: Sheng Q, Zhang GD, Wen MY. Value of serum G-17, PGⅠ, PGⅡ, Hp-IgG in the screening of gastric cancer and precancerous lesions and its relationship with the depth of tumor invasion. Shijie Huaren Xiaohua Zazhi 2022; 30(5): 235-241
- URL: https://www.wjgnet.com/1009-3079/full/v30/i5/235.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i5.235
胃癌为临床最常见恶性肿瘤之一, 积极防治胃癌一直是临床研究的重点和热点[1]. 国内专家共识明确指出, 慢性萎缩性胃炎和上皮内瘤变等均属于癌前病变, 具有罹患胃癌的风险, 正确应对和处理胃癌前病变, 对降低我国胃癌发病率意义重大[2]. 胃泌素-17(gastrin 17, G-17)是与胃癌发生发展密切相关的重要胃肠激素, 胃窦黏膜萎缩会引起G-17水平明显下调, 但当胃部细胞发生恶性病变时, G-17水平会显著升高, 可应用于胃癌与癌前病变的鉴别诊断[3]. 国内外大量研究指出, 胃蛋白酶原(pepsinogen, PG)是临床检测胃部疾病的主要生物标志物, PGⅠ、PGⅡ水平变化可反映胃黏膜功能障碍和部分病变, 与胃癌的发生发展密切相关[4,5]. 此外, 幽门螺杆菌(Helicobacter pylori, H. pylori)感染在胃癌的发生发展机制中扮演重要角色, H. pylori-免疫球蛋白G(immunoglobulin G, IgG)(Hp-IgG)抗体检测也是胃癌早期筛查的常用方法[6]. 为进一步提高胃癌与癌前病变的筛查价值, 本研究尝试探讨血清G-17、PGⅠ、PGⅡ、Hp-IgG联合的筛查价值及与肿瘤浸润深度的关系. 报告如下.
选取2019-08/2021-03我院90例胃癌患者作为研究组, 纳入标准: ①参照胃癌诊断指南诊断为胃癌[7]; ②入组前未接受手术、放化疗等相关治疗; ③首次确诊; ④无其他原发性恶性肿瘤; ⑤自主行为能力良好, 能配合完成研究; ⑥知晓本研究, 已签署同意书. 依据1:1配对设计原则, 另选同期90例胃癌前病变患者作为对照A组, 纳入标准: ①参照胃癌前病变相关指南[8]诊断为胃癌前病变; ②入组前未接受相关治疗; ③无其他消化系统疾病; ④无其他原发性恶性肿瘤; ⑤自主行为能力良好, 能配合完成研究; ⑥知晓本研究, 已签署同意书. 另选同期90例健康体检者作为对照B组, 纳入标准: ①于我院进行健康体检, 未发现明显异常; ②无如何消化系统疾病、恶性肿瘤; ③自主行为能力良好, 能配合完成研究; ④知晓本研究, 已签署同意书. 3组排除标准: ①血液系统疾病患者; ②严重心脑血管疾病、肝肾功能不全者; ③自身免疫性疾病患者; ④感染性疾病患者; ⑤近3个月内服用过抗生素、质子泵抑制剂、抗酸药等药物者.
所有患者均于入院当天采集空腹状态下外周静脉血5 mL, 以3500 r/min转速离心处理5 min, 取血清, 采用胶乳免疫比浊法测定血清PGⅠ、PGⅡ水平, 试剂盒为北京北方生物技术研究所有限公司; 采用酶联免疫吸附法进行血清G-17水平检测及Hp-IgG测定, G-17检测试剂盒购自郑州安图生物工程股份有限公司, Hp-IgG检测试剂盒为上海双赢生物科技有限公司, 当血清中Hp-IgG滴度≥10 U/mL时, 即可判断Hp-IgG阳性. 以上检测操作均由专业检测人员严格按照试剂盒说明书完成.
(1)3组一般资料(性别、年龄、体质量指数、吸烟史、饮酒史、合并症、职业)、血清G-17、PGⅠ、PGⅡ水平、Hp-IgG阳性率; (2)研究组Hp-IgG阳性与阴性患者血清G-17、PGⅠ、PGⅡ水平, 分析血清G-17、PGⅠ、PGⅡ水平与Hp-IgG阳性的关系, 并分析血清G-17、PGⅠ、PGⅡ、Hp-IgG诊断胃癌的价值; (3)研究组不同肿瘤浸润深度[9]患者血清G-17、PGⅠ、PGⅡ水平、Hp-IgG阳性率, 分析各指标与胃癌肿瘤浸润深度的关系.
统计学处理 数据处理采用SPSS 22.0软件, 计数资料以例数描述, 采用χ2检验; 计量资料采取Bartlett方差齐性检验与Kolmogorov-Smirnov正态性检验, 均确认具备方差齐性且服从正态分布, 以mean±SD描述, 多组间比较采用单因素方差分析, 进一步两两组间比较采用SNK-q检验, 两组间比较采用独立样本t检验; 相关性分析采用Spearman相关系数模型; 诊断效能分析采用受试者工作特征(receiver operating characteristic, ROC)曲线; P<0.05为差异有统计学意义.
3组性别、年龄、体质量指数、吸烟史、饮酒史、合并症、职业比较, 差异无统计学意义; 研究组血清G-17、PGⅡ水平、Hp-IgG阳性率均较对照A组、对照B组高, 血清PGⅠ水平较对照A组、对照B组低(P<0.05); 对照A组血清G-17、PGⅡ水平、Hp-IgG阳性率均较对照B组高, 血清PGⅠ水平较对照B组低(P<0.05). 见表1.
| 项目 | 研究组(n = 90) | 对照A组(n = 90) | 对照B组(n = 90) | t/χ2 | P |
| 性别(男/女) | 56/34 | 50/40 | 53/37 | 0.826 | 0.662 |
| 年龄(岁) | 57.32±8.87 | 55.61±7.96 | 54.97±8.21 | 1.903 | 0.151 |
| 体质量指数(kg/m2) | 21.85±1.94 | 22.13±2.07 | 22.40±2.23 | 1.568 | 0.210 |
| 吸烟史(有/无) | 35/55 | 30/60 | 28/62 | 1.279 | 0.528 |
| 饮酒史(有/无) | 43/47 | 36/54 | 34/56 | 2.040 | 0.361 |
| 合并症 | |||||
| 高血压 | 18(20.00) | 15(16.67) | - | 0.334 | 0.563 |
| 糖尿病 | 9(10.00) | 6(6.67) | - | 0.654 | 0.419 |
| 高脂血症 | 20(22.22) | 18(20.00) | - | 0.133 | 0.715 |
| 职业 | 0.399 | 0.819 | |||
| 体力劳动 | 41(45.56) | 45(50.00) | 47(52.22) | 0.830 | 0.660 |
| 脑力劳动 | 35(38.89) | 33(36.67) | 30(33.33) | 0.609 | 0.738 |
| 无业 | 14(15.56) | 12(13.33) | 13(14.44) | 0.180 | 0.914 |
| G-17(pmol/L) | 22.73±6.74b | 14.92±3.17d | 8.13±2.04 | 241.653 | <0.001 |
| PGⅠ(ng/mL) | 72.16±10.59b | 109.53±31.26d | 175.36±40.25 | 272.059 | <0.001 |
| PGⅡ(ng/mL) | 21.82±2.31b | 18.76±1.54d | 10.24±1.39 | 1008.555 | <0.001 |
| Hp-IgG阳性率 | 73(81.11)b | 44(48.89)d | 13(14.44) | 80.140 | <0.001 |
研究组Hp-IgG阳性患者血清G-17、PGⅡ水平均较阴性患者高, 血清PGⅠ水平较阴性患者低(P<0.05). 见表2.
经Spearman相关性分析显示, 血清G-17、PGⅡ水平与Hp-IgG阳性呈正相关, PGⅠ与Hp-IgG阳性呈负相关(P<0.05). 见表3.
| 指标 | G-17 | PGⅠ | PGⅡ | |
| Hp-IgG阳性 | r | 5.834 | -5.127 | 6.175 |
| P | 0.001 | 0.003 | <0.001 | |
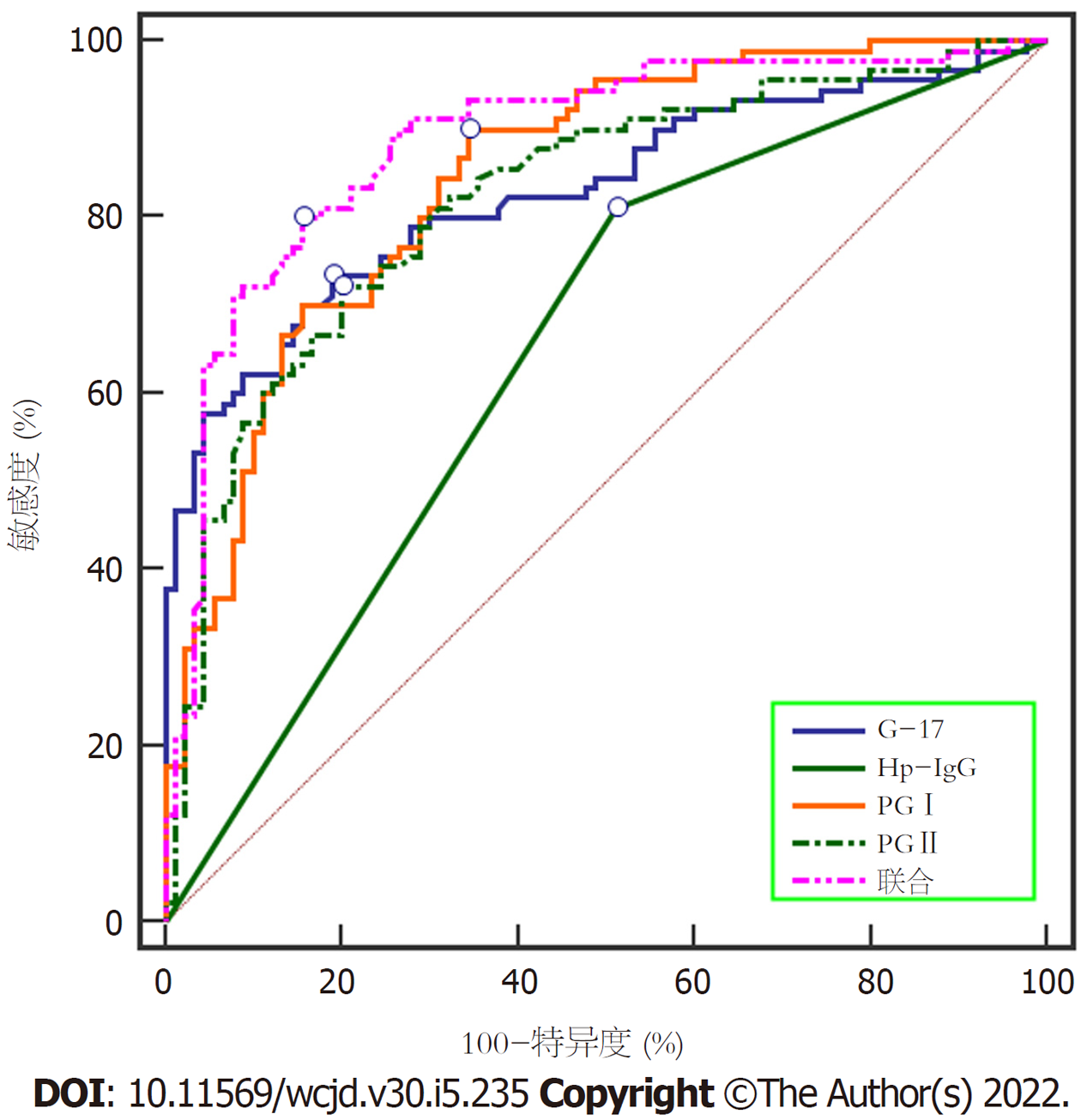
以研究组患者为血清G-17、PGⅠ、PGⅡ水平、Hp-IgG阳性率为阳性样本, 对照A组各指标为阴性样本, 绘制各指标诊断胃癌的ROC曲线, 结果显示血清G-17、PGⅠ、PGⅡ、Hp-IgG阳性诊断胃癌的曲线下面积(area under curve, AUC)分别为0.828、0.845、0.821、0.650, 各指标联合诊断的AUC最大为0.887. 见表4、图1.
| 指标 | AUC | 95%CI | Z统计 | 截断值 | 敏感度(%) | 特异度(%) | P |
| G-17 | 0.828 | 0.767-0.889 | 10.554 | 17.83 pmol/L | 73.35 | 81.12 | <0.001 |
| PGⅠ | 0.845 | 0.789-0.901 | 12.105 | 92.23 ng/mL | 90.13 | 65.57 | <0.001 |
| PGⅡ | 0.821 | 0.759-0.883 | 10.124 | 20.04 ng/mL | 72.20 | 79.98 | <0.001 |
| Hp-IgG | 0.650 | 0.584-0.716 | 4.458 | 阳性 | 81.12 | 48.89 | <0.001 |
| 联合预测 | 0.887 | 0.837-0.937 | 15.119 | - | 80.03 | 84.46 | <0.001 |
胃癌具有发病率高、恶性程度高、预后差的特点, 已成为威胁人类生命健康的重大全球健康问题, 其早期诊断和治疗对改善患者预后至关重要[10]. 目前, 胃癌筛查是早期诊断胃癌的一种有效手段, 早期胃癌患者的确诊主要依靠病理检查, 但其成本高且为创伤性检查, 临床应用具有一定局限性[11]. 而血清学指标具有检测便捷、疾病相关性强、可重复性高等优势, 已逐渐应用于胃癌筛查中.
相关研究指出, G-17是一种主要由胃幽门部G细胞分泌的胃肠激素, 具有促进胃肠道分泌、胃窦和胃体收缩的作用, 其水平变化可反映胃窦分泌功能, 对胃窦萎缩、胃癌等疾病的发生有提示作用[12]. 本研究以胃癌和癌前病变为切入点进行试验设计, 通过对比分析发现胃癌患者的血清G-17水平明显高于癌前病变患者, 且均高于健康人群. 分析其原因: 慢性萎缩性胃炎和上皮内瘤变等癌前病变可引起胃窦黏膜萎缩, 致使胃泌素细胞数量减少, 其合成、分泌的G-17含量减少, 而G-17可直接进入血液系统, 最终引起血清G-17水平降低, 但随着胃黏膜病变程度的进展, 胃酸的分泌减少, G-17分泌随之增多, 导致胃癌患者血清G-17水平明显升高[13,14]. 文献报道的血清G-17诊断胃癌的AUC为0.801, 具有良好诊断价值[15]. 本研究中血清G-17诊断胃癌的AUC为0.828, 与上述报道相近, 进一步证实血清G-17可作为诊断胃癌的标志物. PG检测在胃癌的诊断中也具有较高的应用价值, 被认为是"血清学活检", PG是一种主要由胃细胞分泌的天冬氨酸蛋白酶, 可分为两种生化和免疫活性不同的亚群, 即PGⅠ和PGⅡ, 血清PGⅠ主要由胃底腺细胞分泌, 能够反映胃黏膜腺体萎缩程度, PGⅡ主要由幽门腺、贲门腺分泌, 其水平变化主要与胃底腺管萎缩、肠上皮化生、恶性肿瘤等有关[16]. 本研究结果中, 胃癌患者的PGⅡ水平明显高于癌前病变患者, 而血清PGⅠ水平低于癌前病变患者, 且均于健康人群存在明显差异, 提示胃癌患者血清PGⅠ水平下调、PGⅡ水平上调. 但也有研究指出, 早期胃癌患者血清PGⅠ水平高于癌前病变及良性病变患者, 而血清PGⅡ水平低于癌前病变及良性病变患者, 但组间比较差异均无统计学意义[17]. 与本研究存在一定差异, 但临床多项研究[18,19]均显示胃癌患者血清PGⅠ水平明显升高, 血清PGⅡ水平明显降低, 支持本研究结果结论. 其原因在于确诊的胃癌患者胃黏膜腺体萎缩程度更高, G 细胞数量显著降低, 导致G-17合成、分泌量减少, 血清G-17水平明显降低, 且会引起导致PGⅠ分泌量减少, 而PGⅡ分泌细胞分布相对较广, 血清水平往往受胃癌的影响较小. 且本研究ROC分析结果显示, 血清PGⅠ和PGⅡ诊断胃癌的AUC分别为0.845、0.821, 而杨国敬等[20]研究结果中, 血清PGⅠ和PGⅡ诊断胃癌的AUC分别为0.832、0.681, 与本研究结果略有不同, 其原因可能与检测方法不同有关. 另有研究[21]发现, 血清PGⅠ、PGⅡ水平与H. pylori感染等因素有关, 因此血清PG常需与其生物学指标联合应用.
此外, H. pylori感染是细胞分裂的一项启动因素, 可促进胃黏膜细胞活跃增生, 增加DNA突变风险, 且H. pylori的代谢产物氨和磷脂酶会破坏胃黏膜, 导致致癌因子在胃黏膜上皮细胞中直接发挥作用, 诱发胃细胞发生癌变[22]. 本研究进一步对胃癌与癌前病变的血清Hp-IgG阳性率进行检测, 发现胃癌患者的Hp-IgG阳性率明显升高, 且均高于健康人群, 提示胃癌患者普遍存在H. pylori感染, 且Hp-IgG阳性在胃癌诊断方面具有一定价值, 进一步证实H. pylori感染与胃癌的发生发展密切相关. 且已确诊的胃癌患者胃体预防H. pylori感染的能力降低, H. pylori更易在胃部定植、生长, 可进一步提高Hp-IgG阳性率. 本研究通过相关性分析, 发现Hp-IgG阳性与胃癌患者血清G-17、PGⅠ、PGⅡ水平密切相关, 由此可见H. pylori感染可影响G-17、PGⅠ、PGⅡ的表达, 可能也是其促进胃癌发生发展的机制之一. 且本研究发现胃癌肿瘤浸润深度与血清G-17、PGⅡ、Hp-IgG阳性呈正相关, 与血清PGⅠ呈负相关, 可见各指标与胃癌的进展密切相关, 早期检测各指标不仅能对胃癌进行诊断, 同时能在一定程度上反映胃癌肿瘤浸润深度.
综上可知, 胃癌患者血清G-17、PGⅡ水平、Hp-IgG阳性率明显高于癌前病变患者, PGⅠ水平明显低于癌前病变患者, 可作为胃癌筛查诊断的标志物, 尤其是联合诊断具有较高诊断价值, 且与胃癌肿瘤浸润深度密切相关. 但本研究存在样本量较少的不足, 研究结果可能存在一定误差, 仍需通过大样本研究进一步验证.
胃癌具有发病率高、恶性程度高、预后差的特点, 已成为威胁人类生命健康的重大全球健康问题, 其早期诊断和治疗对改善患者预后至关重要. 目前, 胃癌筛查是早期诊断胃癌的一种有效手段, 早期胃癌患者的确诊主要依靠病理检查, 但其成本高且为创伤性检查, 临床应用具有一定局限性.
为进一步提高胃癌与癌前病变的筛查价值, 本研究尝试探讨血清胃泌素-17(gastrin 17, G-17)、胃蛋白酶原(pepsinogen, PG)Ⅰ、PGⅡ、幽门螺杆菌(Helicobacter pylori, H. pylori)-免疫球蛋白G(immunoglobulin G, IgG) (Hp-IgG)联合的筛查价值及与肿瘤浸润深度的关系.
血清学指标具有检测便捷、疾病相关性强、可重复性高等优势, 已逐渐应用于胃癌筛查中, 本研究旨在探讨血清G-17、PGⅠ、PGⅡ、Hp-IgG水平对胃癌与癌前病变的筛查价值及与肿瘤浸润深度的关系.
选取我院90例胃癌患者作为研究组, 另选同期90例胃癌前病变患者作为对照A组、90例健康体检者作为对照B组. 比较3组一般资料、血清G-17、PGⅠ、PGⅡ水平、Hp-IgG阳性率, 并比较Hp-IgG阳性与阴性患者血清G-17、PGⅠ、PGⅡ水平, 分析血清G-17、PGⅠ、PGⅡ水平与Hp-IgG阳性的关系, 分析各指标诊断胃癌的价值及与胃癌肿瘤浸润深度的关系.
研究组血清G-17、PGⅡ水平、Hp-IgG阳性率均>对照A组>对照B组, 血清PGⅠ水平<对照A组<对照B组, 研究组Hp-IgG阳性患者血清G-17、PGⅡ水平均高于阴性患者, 血清PGⅠ水平低于阴性患者, 血清G-17、PGⅡ水平与Hp-IgG阳性呈正相关, 血清PGⅠ与Hp-IgG阳性呈负相关, 血清G-17、PGⅠ、PGⅡ、Hp-IgG阳性诊断胃癌的曲线下面积(area under curve, AUC)分别为0.828、0.845、0.821、0.650, 各指标联合诊断的AUC最大, 血清G-17、PGⅡ水平、Hp-IgG阳性率均随胃癌肿瘤浸润深度增加逐渐升高,血清PGⅠ水平随胃癌肿瘤浸润深度增加逐渐降低, 胃癌肿瘤浸润深度与血清G-17、PGⅡ、Hp-IgG阳性呈正相关, 与血清PGⅠ呈负相关.
胃癌患者血清G-17、PGⅡ、Hp-IgG阳性率明显高于癌前病变患者, PGⅠ水平明显低于癌前病变患者, 可作为胃癌筛查诊断的标志物, 尤其是联合诊断具有较高诊断价值, 且与胃癌肿瘤浸润深度密切相关.
虽然本研究证实PGⅠ、G-17、PGⅡ、Hp-IgG水平与胃癌的进展密切相关, 早期检测各指标不仅能对胃癌进行诊断, 同时能在一定程度上反映胃癌肿瘤浸润深度, 但目前仅可作为辅助诊断方式, 建议开展多中心、大样本前瞻性随机对照试验对本研究结果加以证实. 相信在不久的将来, PGⅠ、G-17、PGⅡ、Hp-IgG等指标联合检测可作为胃癌癌前病变重要检查手段.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Wang FH, Shen L, Li J, Zhou ZW, Liang H, Zhang XT, Tang L, Xin Y, Jin J, Zhang YJ, Yuan XL, Liu TS, Li GX, Wu Q, Xu HM, Ji JF, Li YF, Wang X, Yu S, Liu H, Guan WL, Xu RH. The Chinese Society of Clinical Oncology (CSCO): clinical guidelines for the diagnosis and treatment of gastric cancer. Cancer Commun (Lond). 2019;39:10. [PubMed] [DOI] |
| 2. | 国家消化系疾病临床医学研究中心(上海), 国家消化道早癌防治中心联盟,中华医学会消化病学分会幽门螺杆菌学组, 中华医学会健康管理学分会, 中国医师协会内镜医师分会消化内镜专业委员会, 中国抗癌协会肿瘤内镜专业委员会. 中国胃黏膜癌前状态和癌前病变的处理策略专家共识(2020年). 中华消化杂志. 2020;40:731-741. [DOI] |
| 5. | Kim YJ, Chung WC. Is serum pepsinogen testing necessary in populationbased screening for gastric cancer? Korean J Intern Med. 2020;35:544-546. [PubMed] [DOI] |
| 6. | MAki M, SOderstrOm D, Paloheimo L, Hendolin P, Suovaniemi O, SyrjAnen K. Helicobacter pylori (Hp) IgG ELISA of the New-Generation GastroPanel® Is Highly Accurate in Diagnosis of Hp-Infection in Gastroscopy Referral Patients. Anticancer Res. 2020;40:6387-6398. [PubMed] [DOI] |
| 7. | 中华人民共和国国家卫生健康委员会. 胃癌诊疗规范(2018年版). 中华人民共和国国家卫生健康委员会. 2018;. [DOI] |
| 8. | Pimentel-Nunes P, Libanio D, Marcos-Pinto R, Areia M, Leja M, Esposito G, Garrido M, Kikuste I, Megraud F, Matysiak-Budnik T, Annibale B, Dumonceau JM, Barros R, Flejou JF, Carneiro F, van Hooft JE, Kuipers EJ, Dinis-Ribeiro M. Management of epithelial precancerous conditions and lesions in the stomach (MAPS II): European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter and Microbiota Study Group (EHMSG), European Society of Pathology (ESP), and Sociedade Portuguesa de Endoscopia Digestiva (SPED) guideline update 2019. Endoscopy. 2019;51:365-388. [PubMed] [DOI] |
| 9. | De Manzoni G, Marrelli D, Baiocchi GL, Morgagni P, Saragoni L, Degiuli M, Donini A, Fumagalli U, Mazzei MA, Pacelli F, Tomezzoli A, Berselli M, Catalano F, Di Leo A, Framarini M, Giacopuzzi S, Graziosi L, Marchet A, Marini M, Milandri C, Mura G, Orsenigo E, Quagliuolo V, Rausei S, Ricci R, Rosa F, Roviello G, Sansonetti A, Sgroi G, Tiberio GA, Verlato G, Vindigni C, Rosati R, Roviello F. The Italian Research Group for Gastric Cancer (GIRCG) guidelines for gastric cancer staging and treatment: 2015. Gastric Cancer. 2017;20:20-30. [PubMed] [DOI] |
| 11. | 唐 承璐, 朱 庆曦, 韩 菊平, 吕 小红. 胃蛋白酶原及幽门螺杆菌抗体检测在早期胃癌筛查中的价值. 湖南师范大学学报(医学版). 2019;16:99-102. [DOI] |
| 12. | Lin Z, Bian H, Chen C, Chen W, Li Q. Application of serum pepsinogen and carbohydrate antigen 72-4 (CA72-4) combined with gastrin-17 (G-17) detection in the screening, diagnosis, and evaluation of early gastric cancer. J Gastrointest Oncol. 2021;12:1042-1048. [PubMed] [DOI] |
| 14. | Zhao WX, Liu ZF, Li XL, Li Z. Correlations of serum homocysteine, VEGF and gastrin 17 with gastric cancer and precancerous lesions. Eur Rev Med Pharmacol Sci. 2019;23:4192-4198. [PubMed] [DOI] |
| 15. | 余 海涛, 李 涛, 徐 元宏, 陈 正徐, 胡 召锁. 胃蛋白酶原、胃泌素-17和幽门螺杆菌IgG抗体对胃癌筛查的价值探讨. 现代消化及介入诊疗. 2021;26:379-382. [DOI] |
| 16. | Wang Y, Zhu Z, Liu Z, Zhao Z, Xue X, Li X, Li P, Rong G, Ma Y. Diagnostic value of serum pepsinogen I, pepsinogen II, and gastrin-17 levels for population-based screening for early-stage gastric cancer. J Int Med Res. 2020;48:300060520914826. [PubMed] [DOI] |
| 17. | 黄 任祥, 刘 宇辉, 余 中贵. 血清胃泌素-17、胃蛋白酶原联合幽门螺杆菌检测在老年人胃癌癌前病变及早期胃癌筛查中的价值. 实用老年医学. 2021;35:180-183, 188. [DOI] |