修回日期: 2021-10-26
接受日期: 2022-02-22
在线出版日期: 2022-02-28
结直肠癌在发病初期并无明显的临床症状, 在临床确诊时往往已处于病理晚期, 发生了远处转移. 结直肠癌最常见的远处转移器官是肝脏, 研究发现, 采用生物靶向药物联合FOLFIRI方案对发生肝转移患者可取得良好的疗效.
探讨西妥昔单抗不同给药策略在RAS野生型结直肠癌(colorectal cancer, CRC)肝转移患者中的应用价值及安全性.
选取2017-07/2019-03我院74例采用FOLFOX化疗方案治疗的RAS野生型CRC肝转移患者作为研究对象, 根据西妥昔单抗给药策略分为2组, 每组37例. 单周组: 首次予以400 mg/m2西妥昔单抗, 静脉滴注120 min, 后续每周予以250 mg/m2西妥昔单抗, 1周/次; 双周组: 予以500 mg/m2西妥昔单抗治疗, 每2周重复. 观察对比两组疾病缓解率、毒副反应发生率、生存质量改善率、生存情况及治疗前后基质金属蛋白酶(matrix metalloproteinase, MMPs)、miR-106b-5p、前列腺癌相关非编码RNA转录物1(PCAT-1)表达.
双周组疾病缓解率78.38%高于单周组54.05%(P<0.05); 双周组白细胞和/或中性粒细胞减少、口腔黏膜炎及痤疮样皮疹发生率均高于单周组(P<0.05); 双周组MMP-2、MMP-9相对表达量均较单周组显著下降, 基质金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinase, T1MP)表达量较单周组明显升高(P<0.05); 单周组与双周组的miR-106b-5p、PCAT-1相对表达量均较治疗前显著下降, 且双周组下降幅度更大(P<0.05); 双周组生存质量改善有效率72.97%高于单周组48.65%(P<0.05); 两组无进展生存时间相比, 差异无统计学意义(P>0.05).
西妥昔单抗双周给药治疗RAS野生型CRC肝转移患者缓解率、生存质量改善情况优于每周给药, 但会增加患者不良反应发生率, 实际可根据患者耐受情况选择治疗方案.
核心提要: 用西妥昔单抗双周给药对发生肝转移的结直肠癌患者进行治疗的效果确切, 可进一步控制其病情, 延缓其肿瘤的进展, 该策略可为合适的RAS野生型结直肠癌(colorectal cancer, CRC)肝转移患者争取更多治疗机会, 以带来更多生存获益.
引文著录: 王超, 李胜强, 赵岩. 西妥昔单抗不同给药策略对RAS野生型CRC肝转移患者缓解率及MMPs、miR-106b-5p、PCAT-1、不良反应的影响. 世界华人消化杂志 2022; 30(4): 204-211
Revised: October 26, 2021
Accepted: February 22, 2022
Published online: February 28, 2022
Colorectal cancer (CRC) has no obvious clinical symptoms at the initial stage of the disease, and it is often diagnosed at an advanced stage of pathology, with distant metastasis. The most common target organ of distant metastasis in CRC is the liver, and patients with liver metastasis have been shown to be well treated with biologic targeted agents in combination with FOLFIRI regimen.
To evaluate the efficacy and safety of different administ-ration strategies of cetuximab in patients with RAS wild-type CRC with liver metastasis.
From July 2017 to March 2019, 74 patients with RAS wild-type CRC liver metastases treated with the FOLFOX regimen at our hospital were selected as the research subjects. According to the cetuximab administration strategy used, they were divided into either a weekly group or a bi-weekly group, with 37 cases in each group. The weekly group was initially given 400 mg/m2 cetuximab by intravenous infusion over 120 min, followed by 250 mg/m2 cetuximab once every week. The bi-weekly group was given 500 mg/m2 cetuximab once every 2 wk. The disease remission rate, the incidence of toxic and side effects, the improvement of quality of life, the survival, and the expression of matrix metalloproteinases (MMPs), miR-106b-5p, and prostate cancer-related non-coding RNA transcript 1 (PCAT-1) before and after treatment were compared between the two groups.
The disease remission rate in the biweekly group was significantly higher than that of the weekly group (78.38% vs 54.05%, P < 0.05). The incidence of leukopenia and/or neutropenia, oral mucositis, and acne-like rash in the biweekly group was significantly higher than that of the weekly group (P < 0.05). The relative expression of MMP-2 and MMP-9 in the biweekly group was significantly lower than that in the weekly group, but the expression of tissue inhibitor of matrix metalloproteinases (T1MP) was significantly higher than that in the weekly group (P < 0.05). The relative expression of miR-106b-5p and PCAT-1 after treatment was significantly lower in both groups, and the decrease was significantly greater in the bi-weekly group (P < 0.05). The effective rate of improving the quality of life was significantly higher in the bi-weekly group than in the weekly group (72.97% vs 48.65%, P < 0.05), though there was no statistically significant difference in the progression-free survival time between the two groups (P > 0.05).
Cetuximab biweekly treatment of RAS wild-type CRC patients with liver metastases has better remission rate and quality of life improvement than weekly administration, but it increases the incidence of adverse reactions in patients. The administration strategy can be selected according to the patient's tolerance.
- Citation: Wang C, Li SQ, Zhao Y. Effects of different administration strategies of cetuximab on remission rate, MMPs, miR-106b-5p, PCAT-1, and adverse reactions in patients with RAS wild-type CRC liver metastasis. Shijie Huaren Xiaohua Zazhi 2022; 30(4): 204-211
- URL: https://www.wjgnet.com/1009-3079/full/v30/i4/204.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i4.204
结直肠癌(colorectal cancer, CRC)为消化系统常见恶性肿瘤, 据统计, 全球每年新发病例超过100万例, 死亡人数超60万例, 病死率居第4位, 巨大疾病负担已构成全球公共卫生问题[1-3]. 美国NCCN指南[4]中对Ras野生型晚期CRC患者一线推荐使用西妥昔单抗联合化疗, 标准用法为西妥昔单抗每周给药, 但临床实践过程中发现, 单周治疗需反复多次住院, 一定程度上增加患者时间、经济成本. 部分Ⅱ期单臂研究及国外随机对照研究表明西妥昔单抗双周方案效果良好, 可能成为西妥昔单抗另一种治疗方式[5,6]. 基于欧美CRC患者的治疗方案对亚洲人群是否同样受用, 还需大量研究证实, 本文首次探讨西妥昔单抗不同给药策略对RAS野生型CRC肝转移患者缓解率及基质金属蛋白酶(matrix metalloproteinase, MMPs)、miR-106b-5p、前列腺癌相关非编码RNA转录物1(PCAT-1)、不良反应的影响. 具体分析如下.
选取2017-07/2019-03我院74例采用FOLFOX化疗方案治疗的RAS野生型CRC肝转移患者作为研究对象, 根据西妥昔单抗给药策略不同, 分为2组, 每组37例. 两组患者年龄、体质量、性别、肝转移灶数目、分化程度、肿瘤直径及病变部位均衡可比(P>0.05), 见表1.
| 项目 | 双周组(n = 37) | 单周组(n = 37) | t/χ2 | P |
| 年龄(岁) | 41-68(54.68±5.94) | 43-69(56.80±5.11) | 1.646 | 0.104 |
| 体质量(kg) | 43-77(60.25±7.12) | 45-76(62.03±6.59) | 0.138 | 0.891 |
| 性别(男/女) | 20/17 | 16/21 | 0.866 | 0.352 |
| 肝转移灶数目(个) | ||||
| 1 | 6(16.22) | 7(18.92) | 0.359 | 0.720 |
| 2-4 | 21(56.76) | 17(45.95) | ||
| >4 | 10(27.02) | 13(35.14) | ||
| 分化程度 | ||||
| 高分化 | 8(21.62) | 11(29.73) | 0.637 | 0.425 |
| 中低分化 | 29(78.38) | 26(70.27) | ||
| 肿瘤直径(cm) | ||||
| <3 | 23(62.16) | 19(51.35) | 0.881 | 0.348 |
| ≥3 | 14(37.84) | 18(48.65) | ||
| 病变部位 | ||||
| 结肠 | 15(40.54) | 20(54.05) | 1.355 | 0.244 |
| 直肠 | 22(59.46) | 17(45.95) |
纳入标准: 符合《CRC肝转移诊断和综合治疗指南(V2013)》[7]; 经病理学或细胞学证实为结直肠腺癌, 基因型为RAS野生型, 且经组织活检证实存在肝转移; 预期生存期≥3个月; 患者自愿签署化疗和靶向治疗知情同意书.
排除标准: 合并溃疡性结肠炎; 合并克罗恩病; 存在化疗禁忌者; 同时合并其他恶性肿瘤; 治疗依从性差; 合并严重感染; 入组前曾接受过放疗或者化疗等辅助治疗者; 手术治疗后患者; 治疗期间出现严重不良反应, 患者无法耐受或者治疗期间死亡.
1.2.1 单周组: 首次予以西妥昔单抗(Merck Europe B.V., 批准文号: S20171039)400 mg/m2, 静脉滴注120 min, 后续每周予以250 mg/m2, 静脉滴注60 min, 1周/次.
1.2.2 双周组: 予以500 mg/m2西妥昔单抗治疗, 每2周重复1次. mFOLFOX6方案: 第1 d静脉注射奥沙利铂85 mg/m²、亚叶酸钙400 mg/m², 第1 d静脉推注氟尿嘧啶400 mg/m², 后以2400 mg/m²持续泵注46 h, 2周为1个周期, 行4个周期化疗后由外科评定是否可以手术.
(1)疾病缓解率: 依照实体瘤疗效评价标准(RE-CIST)1.1版, 评价西妥昔单抗近期疗效, 分为完全缓解、部分缓解、病情稳定、病情进展. 以完全缓解+部分缓解计算客观缓解率; (2)不良反应发生率: 参照《WHO抗癌药物急性及亚急性毒性反应分级标准》对不良反应进行分级, 分为Ⅰ-Ⅳ[8]; (3)生存质量改善情况: 参照KPS功能状态评分量表评估患者生存质量改善情况, 得分越高, 健康状况越好, 其中KPS提高10分以上为提高, 提高、下降不足10分为稳定, 下降10分以上为下降, 其中提高、稳定为改善[9]; (4)生存情况: 无进展生存时间为自开始化疗开始至肿瘤进展或死亡的时间.
两组治疗前、治疗4个周期后MMPs及miR-106b-5p、PCAT-1表达. 采集患者治疗前、治疗4个周期后空腹静脉血5 mL, 以3000 r/min离心10 min, 取上层血清, 保存于-80 ℃环境下待检. (1)MMPs表达, 采用Westem blot法检测其MMP-2、MMP-9、TIMP-1含量, 提取蛋白后, 用BCA蛋白质测定试剂盒定量测定细胞蛋白浓度. 通过SDS-PAGE分离后, 将蛋白转移至PVDF膜中, BSA液封闭30 min, 4 ℃孵育过夜后, 用含有的TBST溶液洗膜3次, 每次10 min, 在室温下孵育二抗(1:5000), 封闭1 h. 使用ECL显影液检测目标蛋白 的表达水平, gapdh用于蛋白内参对照. 实验重复3次; (2)miR-106b-5p、PCAT-1表达, 提取血清中总RNA, 采用反转录试剂盒将RNA反转录合成cDNA, miR-106b-5p反转录反应条件为37 ℃ 60 min, 95 ℃ 5 min, 以cDNA为模板采用荧光定量PCR法测定血清miR-106b-5p水平, 引物序列为5′-AAACUGCUGACAGUGCAG-3′; 反应条件为95 ℃ 3 min, 95 ℃ 10 s, 60 ℃ 30 s, 共50个循环; PCAT-1反应条件: 42 ℃ 60 min, 70 ℃ 5 min, 以cDNA为模板采用荧光定量PCR法测定血清PCAT-1水平, 引物序列为5-GACAGCTGACATAGGCACCC-3′; 反应条件: 95 ℃ 10 min, 95 ℃ 15 s, 62 ℃ 31 s, 72 ℃ 30 s, 共40个循环. 选U6为内参基因, 计算miR-106b-5p水平、PCAT-1水平, 试剂盒均购自美国赛默飞公司, 血清miR-106b-5p、PCAT-1相对表达量以2﹣△△Ct表示.
统计学处理 采用SPSS 22.0对数据进行分析, 计量资料以平均数±标准差表示为mean±SD表示, 使用t检验, 计数资料n(%)表示, 使用χ2检验, P<0.05表示差异有统计学意义.
双周组疾病缓解率78.38%高于单周组54.05%, 差异有统计学意义(P<0.05). 表2.
| 组别 | 例数 | 完全缓解 | 部分缓解 | 稳定 | 疾病进展 | 缓解率 |
| 双周组 | 37 | 1(2.70) | 28(75.68) | 6(16.22) | 2(5.41) | 29(78.38) |
| 单周组 | 37 | 0(0.00) | 20(54.05) | 14(37.84) | 3(8.11) | 20(54.05) |
| χ2 | 4.893 | |||||
| P | 0.027 |
双周组白细胞和/或中性粒细胞减少、口腔黏膜炎及痤疮样皮疹发生率均高于单周组, 差异有统计学意义(P<0.05). 表3.
| 不良反应 | 双周组(n = 37) | 单周组(n = 37) | χ2 | P | ||||
| Ⅰ-Ⅱ级 | Ⅲ-Ⅳ级 | 合计 | Ⅰ-Ⅱ级 | Ⅲ-Ⅳ级 | 合计 | |||
| 白细胞和/或中性粒细胞减少 | 24 | 4 | 28(75.68) | 17 | 2 | 19(51.35) | 4.723 | 0.030 |
| 血小板减少 | 16 | 3 | 19(51.35) | 11 | 6 | 17(45.95) | 0.216 | 0.642 |
| 恶心、呕吐 | 23 | 1 | 24(64.86) | 23 | 1 | 24(64.86) | 0.000 | 1.000 |
| 腹泻 | 2 | 1 | 3(8.11) | 2 | 2 | 4(10.81) | 0.000 | 1.000 |
| 肝功能异常 | 7 | 0 | 7(18.92) | 4 | 1 | 5(13.52) | 0.099 | 0.753 |
| 食欲不振 | 23 | 1 | 24(64.86) | 22 | 1 | 23(62.16) | 0.058 | 0.809 |
| 神经毒性 | 9 | 2 | 11(29.73) | 9 | 0 | 9(24.32) | 0.274 | 0.601 |
| 手足综合征 | 4 | 2 | 6(16.22) | 4 | 0 | 4(10.81) | 0.463 | 0.497 |
| 口腔黏膜炎 | 12 | 1 | 13(35.14) | 5 | 0 | 5(13.51) | 4.698 | 0.030 |
| 甲沟炎 | 3 | 1 | 4(10.81) | 4 | 2 | 6(16.22) | 0.463 | 0.497 |
| 痤疮样皮疹 | 23 | 7 | 31(83.78) | 20 | 2 | 22(59.46) | 5.385 | 0.020 |
两组治疗前MMP-2、MMP-9、金属蛋白酶组织抑制因子-1(tissue inhibitor of metalloproteinase-1, T1MP-1)表达量相比, 差异均无统计学意义, 治疗后, 双周组MMP-2、MMP-9表达量均低于单周组, T1MP-1表达量高于单周组, 差异有统计学意义(P<0.05). 表4.
两组治疗前miR-106b-5p、PCAT-1相对表达量相比, 差异无统计学意义, 治疗后, 双周组miR-106b-5p、PCAT-1相对表达量均低于单周组, 差异有统计学意义(P<0.05). 表5.
双周组生存质量改善率72.97%高于单周组48.65%, 差异有统计学意义(P<0.05). 表6.
| 组别 | 例数 | 提高 | 稳定 | 下降 | 改善率 |
| 双周组 | 37 | 9(24.32) | 18(48.65) | 10(27.03) | 27(72.97) |
| 单周组 | 37 | 7(18.92) | 11(29.73) | 19(51.35) | 18(48.65) |
| χ2 | 4.593 | ||||
| P | 0.032 |
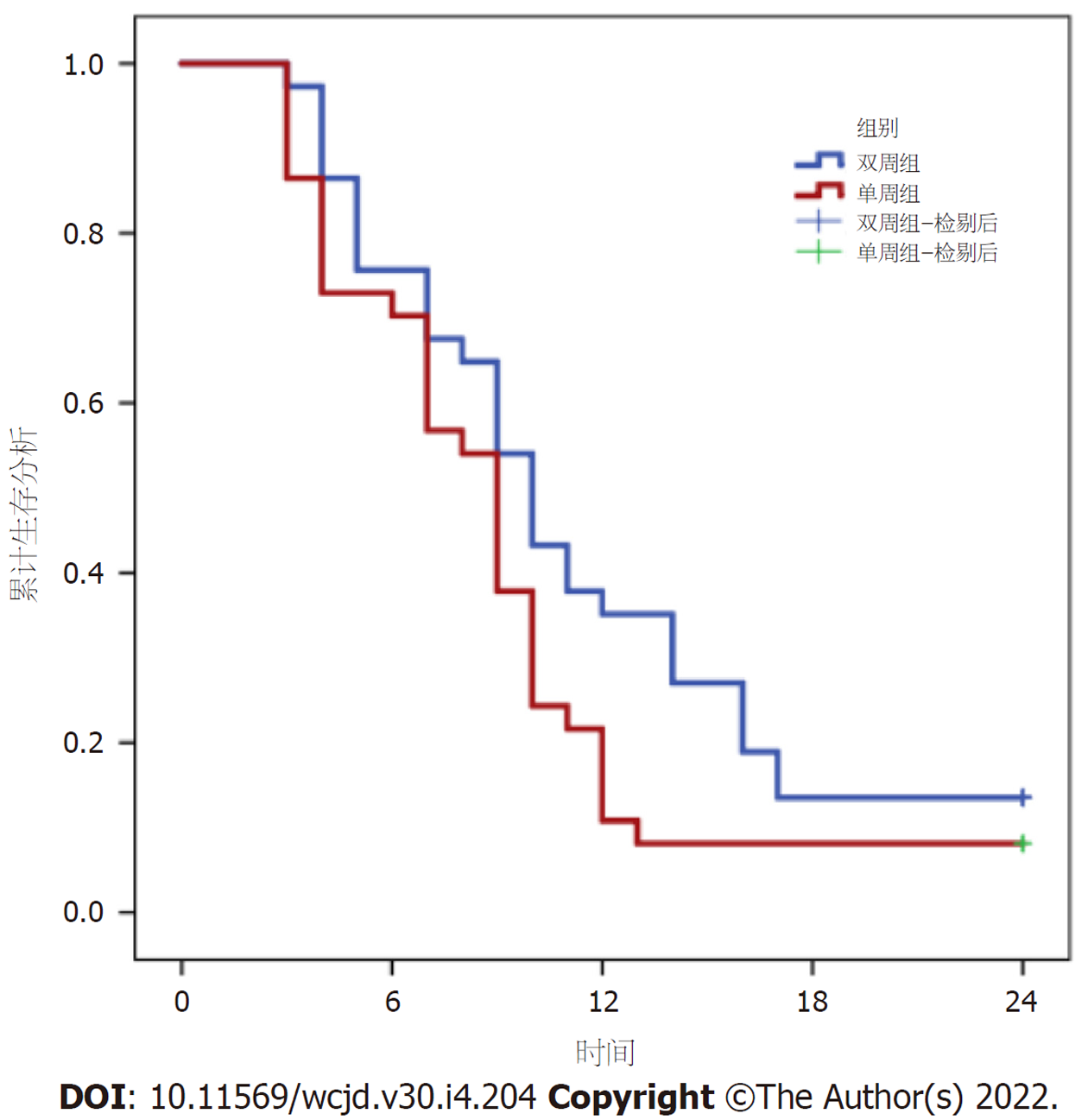
双周组无进展生存时间为10.4个月, 单周组无进展生存时间为8.9个月. 两组无进展生存时间相比, 差异无统计学意义(χ2 = 3.104, P = 0.078). 图1.
随着CRC普查工作开展, 以及肿瘤标志物应用, CRC检出率得到明显提升, 但部分患者确诊时已处于中晚期, 其中约50%发生肝转移, 丧失手术治疗时机, 经转化治疗可促使部分患者获得手术机会, 进而实现长期生存[10,11].
近年来, 分子靶向治疗药物西妥昔单抗的临床应用是转移性CRC治疗领域一大热点, 西妥昔单抗联合化疗已成为目前RAS野生型转移性CRC标准一线治疗策略, 可促进患者缓解率及生存率明显提升[12,13]. 西妥昔单抗常规给药方法为单周方案, 即首次给予400 mg/m2, 此后每周给予25 mg/m2, 因西妥昔单抗具有较长半衰期与非线性药代动力学特点, 有研究提出[14], 西妥昔单抗双周给药在药效学、药代动力学、安全性等方面同单周用药相似, 是一种更为便捷的用药方案. 目前, 国内对于西妥昔单抗单周与双周用药方案的对比研究尚少, 本研究收集了2018-07/2020-03在我院采用FOLFOX化疗方案治疗的RAS野生型CRC肝转移的74例患者作为研究对象进行分析发现, , 双周组疾病缓解率78.38%、生存质量改善有效率72.97%较单周组54.05%、48.65%高. 因西妥昔单抗半衰期较长, 故双周方案给药可达到同每周给药相似血浆浓度时间曲线下面积和最低血药浓度, 西妥昔单抗作为人鼠嵌合IgG1单克隆抗体, 可同表皮生长因子受体EGFR的胞外激酶特异性结合, 进而阻断内源性配体介导的EGFR信号传导通路, 诱导肿瘤凋亡[15]. K-ras基因是编码EGFR信号转导通路RAS蛋白的基因, 在RAS野生型肿瘤中, 该蛋白受到严格调控, 而西妥昔单抗可有效阻断其下游信号传导, 进而抑制RAS野生型CRC肝转移患者肿瘤细胞增殖、生长和诱导凋亡[16]. 俞悦等[17]研究发现, 西妥昔单抗双周给药治疗KRAS/RAS野生型转移性CRC疗效确切, 客观缓解率(76.3%)较单周组(54.8%)高, 同本研究结果相似.
既往随机对照试验重点评价西妥昔单抗联合化疗为Ras野生型CRC患者带来的额外生存获益, 对于分子靶向药物疗效预测的分子标志物研究报道较少. 本研究尝试从分子标志物方面入手, 对照性研究西妥昔单抗儋州与双周方案对Ras野生型CRC患者分子标志物水平的影响. 以往, 临床通过糖类抗原19-9(carbohydrate antigen 19-9, CA19-9)、癌胚抗原(carcinoembryonic antigen, CEA)等常规肿瘤标志物判定恶性肿瘤发展及治疗效果,应用价值已经大量临床试验证实, 缺乏创新性. Pan等[18]研究指出, miR-106b-5p具有调控肿瘤细胞生长、转化、侵袭、迁移等功能, 在大肠癌等多种恶性肿瘤中呈高表达. PCAT-1位于染色体8q24, 是发挥癌基因功能的一类长链非编码RNA, 倪慧等[19]研究发现, PCAT-1在CRC组织中表达水平显著升高. 由本研究结果显示, 经西妥昔单抗治疗的RAS野生型CRC肝转移患者, 双周组miR-106b-5p、PCAT-1相对表达量低于单周组, 表明西妥昔单抗双周给药策略可有效抑制肿瘤细胞分泌产生循环IncRNA, 调节miR-106b与其相关的靶基因表达, 进而调控CRC细胞的增殖、侵袭、凋亡, 但具体作用机制还需进一步深入探究. 基质MMP是可降解细胞外基质的蛋白水解酶, 能够促进癌细胞转移, 而基质金属蛋白酶组织抑制因子(T1MP)对MMP产生拮抗作用, MMP-2、MMP-9表达与直肠癌病情进展、肿瘤浸润生长呈正相关[20,21]. 本研究对RAS野生型CRC肝转移患者实施西妥昔单抗双周给药可显著减少基质金属蛋白酶表达活性, 抑制间质细胞MMP-2、MMP-9合成及分泌, 进而阻止CRC患者肿瘤远处转移和向周围组织侵袭, 为RAS野生型CRC肝转移患者争取获取手术机会. 此外, 双周组白细胞和/或中性粒细胞减少、口腔黏膜炎及痤疮样皮疹发生率较单周组高, 虽经对症处理后均好转, 未影响治疗, 但临床应用过程中针对合并多种基础疾病、营养状况差、高龄等机能状况低下的RAS野生型CRC肝转移患者, 还需谨慎选择治疗方案, 以减少不良反应发生率.
总之, 与每周给药相比, 西妥昔单抗双周给药可为患者提供更高的疾病缓解率和生存获益, 虽然这一治疗策略目前未被视为常规手段, 但随着新证据出现和治疗优势人群筛选更加精准化, 该策略可为合适的RAS野生型CRC肝转移患者争取更多治疗机会, 以带来更多生存获益.
美国NCCN指南中对Ras野生型晚期结直肠癌(colorectal cancer, CRC)患者一线推荐使用西妥昔单抗联合化疗, 标准用法为西妥昔单抗每周给药, 但临床实践过程中发现, 单周治疗需反复多次住院, 一定程度上增加患者时间、经济成本.
探寻西妥昔单抗单周给药和双周给药在RAS野生型结直肠癌肝转移患者中的应用价值及安全性.
找出西妥昔单抗单周给药和双周给药策略对RAS野生型CRC肝转移患者缓解率及基质金属蛋白酶(matrix metalloproteinase, MMPs)、miR-106b-5p、前列腺癌相关非编码RNA转录物1(PCAT-1)、不良反应的影响.
单周组首次予以400 mg/m2西妥昔单抗, 静脉滴注120 min, 后续每周予以250 mg/m2西妥昔单抗, 1周/次; 双周组予以500 mg/m2西妥昔单抗治疗, 每2周重复.
双周组疾病缓解率高于单周组(P<0.05); 双周组白细胞和/或中性粒细胞减少、口腔黏膜炎及痤疮样皮疹发生率均高于单周组(P<0.05); 双周组MMP-2、MMP-9相对表达量均较单周组显著下降, 基质金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinase, T1MP)表达量较单周组明显升高(P<0.05); 单周组与双周组的miR-106b-5p、PCAT-1相对表达量均较治疗前显著下降, 且双周组下降幅度更大(P<0.05); 双周组生存质量改善有效率高于单周组(P<0.05); 两组无进展生存时间相比, 差异无统计学意义.
西妥昔单抗双周给药治疗RAS野生型CRC肝转移患者缓解率、生存质量改善情况优于每周给药, 但会增加患者不良反应发生率, 实际可根据患者耐受情况选择治疗方案.
虽然西妥昔单抗双周给药策略目前未被视为常规手段, 但随着新证据出现和治疗优势人群筛选更加精准化, 该策略可为合适的RAS野生型CRC肝转移患者争取更多治疗机会, 以带来更多生存获益.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Lech G, Słotwiński R, Słodkowski M, Krasnodębski IW. Colorectal cancer tumour markers and biomarkers: Recent therapeutic advances. World J Gastroenterol. 2016;22:1745-1755. [PubMed] [DOI] |
| 3. | 高 炜, 黄 莎, 杨 建伟, 林 锦源, 吴 光峰, 黄 凤. RAS野生型转移性结直肠癌化疗联合贝伐单抗快速进展后二线联合西妥昔单抗对比贝伐单抗疗效临床研究. 中外医疗. 2019;38:1-5. [DOI] |
| 4. | Benson AB, Venook AP, Al-Hawary MM, Cederquist L, Chen YJ, Ciombor KK, Cohen S, Cooper HS, Deming D, Engstrom PF, Grem JL, Grothey A, Hochster HS, Hoffe S, Hunt S, Kamel A, Kirilcuk N, Krishnamurthi S, Messersmith WA, Meyerhardt J, Mulcahy MF, Murphy JD, Nurkin S, Saltz L, Sharma S, Shibata D, Skibber JM, Sofocleous CT, Stoffel EM, Stotsky-Himelfarb E, Willett CG, Wuthrick E, Gregory KM, Gurski L, Freedman-Cass DA. Rectal Cancer, Version 2.2018, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2018;16:874-901. [PubMed] [DOI] |
| 5. | Kotake M, Aoyama T, Munemoto Y, Doden K, Kataoka M, Kobayashi K, Nishimura G, Fujita H, Nakamura K, Takehara A, Tanaka C, Sakamoto J, Nagata N, Oba K, Kondo K. Multicenter phase II study of infusional 5-fluorouracil (5-FU), leucovorin, and oxaliplatin, plus biweekly cetuximab as first-line treatment in patients with metastatic colorectal cancer (CELINE trial). Oncol Lett. 2017;13:747-753. [PubMed] [DOI] |
| 6. | Hazama S, Maeda H, Iwamoto S, Kim HM, Takemoto H, Kobayashi K, Sakamoto J, Nagata N, Oba K, Mishima H. A Phase II Study of XELOX and Cetuximab as First-Line Therapy in Patients With KRAS Wild Type Metastatic Colorectal Cancer (FLEET2 Study). Clin Colorectal Cancer. 2016;15:329-336. [PubMed] [DOI] |
| 8. | 闫 立辉, 盛 春晓, 苏 海刚, 杨 宇, 徐 野, 佟 欣宇, 曲 丹. 华蟾素胶囊联合奥沙利铂+卡培他滨治疗晚期胃癌的效果及对患者免疫功能的影响. 实用癌症杂志. 2019;34:821-824. [DOI] |
| 10. | Wrobel P, Ahmed S. Current status of immunotherapy in metastatic colorectal cancer. Int J Colorectal Dis. 2019;34:13-25. [PubMed] [DOI] |
| 14. | Cremolini C, Rossini D, Dell'Aquila E, Lonardi S, Conca E, Del Re M, Busico A, Pietrantonio F, Danesi R, Aprile G, Tamburini E, Barone C, Masi G, Pantano F, Pucci F, Corsi DC, Pella N, Bergamo F, Rofi E, Barbara C, Falcone A, Santini D. Rechallenge for Patients With RAS and BRAF Wild-Type Metastatic Colorectal Cancer With Acquired Resistance to First-line Cetuximab and Irinotecan: A Phase 2 Single-Arm Clinical Trial. JAMA Oncol. 2019;5:343-350. [PubMed] [DOI] |
| 16. | 钟 丽萍, 李 丹, 朱 丽珍, 房 雪峰, 肖 乾, 丁 克峰, 袁 瑛. 西妥昔单抗治疗转移性结直肠癌患者预后列线图预测模型研究. 中华胃肠外科杂志. 2020;23:701-708. [DOI] |
| 17. | 俞 悦, 张 雯, 孙 永琨, 杨 林, 崔 成旭, 曾 益新, 周 爱萍. 比较西妥昔单抗双周与每周方案联合FOLFOX/XELOX一线治疗KRAS/RAS野生型转移性结直肠癌的回顾性研究. 中国肿瘤临床. 2018;45:1210-1214. [DOI] |
| 18. | Pan M, Chen Q, Lu Y, Wei F, Chen C, Tang G, Huang H. MiR-106b-5p regulates the migration and invasion of colorectal cancer cells by targeting FAT4. Biosci Rep. 2020;40. [PubMed] [DOI] |