修回日期: 2022-01-12
接受日期: 2022-01-20
在线出版日期: 2022-02-08
上消化道内镜检查是判断肝硬化患者食管胃底静脉曲张的金标准.对于高风险食管胃底静脉曲张尚缺乏有效无创预测模型.
构建并验证乙肝代偿期肝硬化患者发生高风险食管胃底静脉曲张的模型.
回顾性分析2018-01/2020-12于天津市北辰医院和武警特色医学中心收治的276例乙肝代偿期肝硬化患者常规实验室检查和超声检查临床资料. 其中81例高风险静脉曲张患者, 195例非高风险静脉曲张.采用Logistic回归分析影响乙肝代偿期肝硬化患者发生高风险食管胃底静脉曲张的独立危险因素, 并使用这些因素构建预测模型. 使用受试者工作特征曲线(receiver operating characteristic, ROC)验证所构建模型的预测效能.
Logistic回归显示白蛋白(albumin, ALB)水平(OR = 0.825, 95%CI: 0.779-0.873, P = 0.000)、血小板(platelet, PLT)水平(OR = 0.934, 95%CI: 0.895-0.975, P = 0.001)、门静脉宽度(OR = 1.481, 95%CI: 1.141-1.922, P = 0.002)是乙肝代偿期肝硬化患者高风险静脉曲张发生的危险因素. 预测模型: Y = -0.192×ALB(g/L)-0.068×PLT计数(109/L)+0.39×门静脉宽度(mm)+6.87. 该模型预测高风险食管胃底静脉曲张的ROC曲线下面积为0.976, 最佳诊断切点为0.767, 此时的敏感度为0.968, 特异度为0.882.
基于PLT、ALB和门静脉宽度的高风险食管胃底静脉曲张预测模型具有较高诊断效能,值得今后进一步研究和推广.
核心提要: 乙肝代偿期肝硬化患者中高风险食管胃底静脉曲张诊断主要依靠上消化道内镜检查, 目前仍缺乏有效无创预测手段. 本文旨在研究乙肝代偿期肝硬化患者中高风险食管胃底静脉曲张的无创检查预测方法, 通过血清学和超声参数构建预测高风险食管胃底静脉曲张的预测模型.
引文著录: 荣亚梅, 张洪文, 张君虹, 刘澎, 高海德. 乙肝代偿期肝硬化患者高风险食管胃底静脉曲张预测模型的构建: 一项病例对照研究. 世界华人消化杂志 2022; 30(3): 152-157
Revised: January 12, 2022
Accepted: January 20, 2022
Published online: February 8, 2022
Upper gastrointestinal endoscopy is the gold standard for judging esophageal and gastric varices in patients with liver cirrhosis. There is no effective noninvasive prediction model for high-risk esophageal and gastric fundus varices.
To construct and validate a prediction model of high-risk esophageal varices in patients with compensated cirrhosis.
The clinical data of 276 patients with compensated hepatitis B cirrhosis treated from January 2018 to December 2020 at Tianjin Beichen Hospital and Armed Police Special Medical Center were analyzed retrospectively. A total of 81 patients with high-risk varices and 195 patients with non-high-risk varices were included. Logistic regression analysis was used to identify the independent risk factors for high-risk esophageal and gastric varices in patients with compensated hepatitis B cirrhosis, and a predictive model was constructed using these factors. Receiver operating characteristic (ROC) curve analysis was performed to verify the prediction efficiency of the constructed model.
Logistic regression showed that albumin (ALB) level (odds ratio [OR] = 0.825, 95% confidence interval [CI]: 0.779-0.873, P = 0.000), platelet (PLT) count (OR = 0.934, 95%CI: 0.895-0.975, P = 0.001), and portal vein width (OR = 1.481, 95%CI: 1.141-1.922, P = 0.002) were risk factors for high risk varicose veins in patients with compensated hepatitis B cirrhosis. The equation of the prediction model constructed based on these factors was: Y = -0.192 × ALB (g/L) -0.068 × PLT count (109/L) + 0.393 × portal vein width (mm) + 6.87. The area under the ROC curve of the model for predicting high-risk esophagogastric varices was 0.976. The best diagnostic cut-off point was 0.767, and the sensitivity and specificity were 0.968 and 0.882, respectively.
The prediction model of high-risk esophagogastric varices based on PLT, ALB, and portal vein width has high diagnostic efficiency.
- Citation: Rong YM, Zhang HW, Zhang JH, Liu P, Gao HD. Prediction model of high risk esophageal and gastric varices in patients with compensated hepatitis B cirrhosis: A case-control study. Shijie Huaren Xiaohua Zazhi 2022; 30(3): 152-157
- URL: https://www.wjgnet.com/1009-3079/full/v30/i3/152.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i3.152
食管胃底静脉曲张是肝硬化患者的严重并发症, 并可能因其破裂出血而危及患者生命[1]. 有报道称[2-4], 肝硬化患者食管静脉曲张的患病率约为60%-80%, 首次发现静脉曲张1年内出血发生率约为12%, 这其中5%为低风险静脉曲张, 15%为高风险静脉曲张. 上消化道内镜(胃镜)检查通常用于诊断和鉴别肝硬化患者是否存在食管胃底静脉曲张, 并可评估其出血风险、进行预防性治疗[5,6]. 由于胃镜检查为侵入性检查, 临床上并非全部代偿期肝硬化患者都可以接受. 此外, 由于我国乙型肝炎病毒(hepatitis B virus, HBV)感染导致的代偿性肝硬化人群基数众多, 对全部患者进行胃镜筛查较为困难. 尽管大部分代偿性肝硬化患者没有静脉曲张或仅有低风险静脉曲张, 但对于高风险静脉曲张患者其破裂出血风险高, 危及患者生命[7]. 因此, 急需一种非侵袭性方法来识别HBV代偿性肝硬化患者高风险食管静脉曲张. 在过去的几年中, 已经建立了多个非侵袭性方法来识别存在食管胃底静脉曲张患者. 其中基于Baveno Ⅵ共识的瞬时弹性成像和超声脾脏硬度对食管胃底静脉曲张的预测效能已得到认可[8]. 此外, 基于血小板(platelet, PLT)、白蛋白(albumin, ALB)等预测模型也在不同肝硬化患者的静脉曲张预测中报道了一定优势[9,10]. 但由于肝脏瞬时弹性成像结果受到患者转氨酶、胆红素水平和腹壁脂肪影响教大, 同时其在非肝病科和多数基层医院肝脏瞬时弹性成像技术普及性受限. 此外, 目前也尚无针对乙肝代偿期肝硬化群体的预测高风险静脉曲张存在的模型, 基于此我们开发一种针对结合影像学和血清学的无创高风险静脉曲张预测模型, 以期增加对代偿期肝硬化高风险食管静脉曲张的筛查方法.
回顾性分析2018-01/2020-12于天津市北辰医院和武警特色医学中心就诊的乙肝相关代偿期肝硬化患者的临床资料. 纳入标准: (1)血清乙型肝炎表面抗原阳性>6个月; (2)抗病毒药物治疗6个月以上; (3)年龄≥18岁; (4)超声检查和胃镜检查间隔时间不超过3个月. 排除标准如下: (1)存在肝硬化失代偿表现, 如严重黄疸、腹水、肝性脑病、食管胃底静脉曲张破裂出血及治疗史、门静脉或脾静脉血栓形成、脾切除术、脾栓塞、经颈静脉肝内门体分流术等; (2)肝细胞癌或肝移植史. 本研究获得了我院伦理委员会批准(TJBCYYLL-2020041).
采取回顾性病例对照方法进行本研究. 收集资料前使用G Power 3样本量软件计算样本量,检验水准α为0.05, 把握度1-β为0.95, 选择双尾t检验计算,计算得每组最小样本量为76.
收集患者的年龄、性别等一般资料, 收集实验室检查中的PLT、ALB、肌酐、总胆红素、谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、凝血酶原时间、国际标准化比值(international normalized ratio, INR). 根据患者临床和生化资料计算常见肝脏评分指标如MELD评分[R = 9.6×ln肌酐(mg/dL)+3.8×ln胆红素(mg/dL)+11.2×ln INR+6.4]、APRI[(AST除以AST参考值上限×100]/PLT计数(109/L)]、FIB-4[年龄(岁)×AST(U/L)/PLT计数(109/L)×ALT(U/L)的平方根].
收集患者超声报告资料, 收集超声报告参数中的脾静脉宽度、门静脉宽度. 根据超声检查结果判断患者是否存在代偿期肝硬化, 超声表现为肝脏表面结节不规则, 超声检查边缘变钝定义为存在肝硬化[13]. 对于具有多次超声检查患者, 上述参数收集以末次检查结果纳入本研究.
收集患者胃镜检查结果, 我院胃镜均由具有10年以上经验的内镜医生使用奥林巴斯CV-290胃镜进行检查. 根据Baveno Ⅵ共识标准记录食管胃底静脉曲张分级: G1: 静脉曲张呈直线或略有迂曲, 无红色征; 食管充气后曲张静脉可变扁平; G2: 静脉曲张呈蛇形迂曲, 呈直线或略迂曲伴有红色征. 食管充气后曲张静脉在食管内仍可见; G3: 曲张静脉呈蛇形、串珠、结节、或瘤状, 呈红色征; 充气后静脉曲张仍可见. 将GI定义为低风险静脉曲张, G2和G3定义为高风险静脉曲张[7].
统计学处理 使用SPSS 23对研究全部数据进行统计分析. 患者年龄、生化检查等计量资料使用Kolmogorov-Smirnov法进行分布检验, 满足正态分布的采用mean±SD进行描述, 两组差异使用t检验. 性别、Child-Pugh分级等计数资料用n(%)进行描述, 组间差异采用χ2检验, 理论频数<5时使用Fisher精确概率法. 以发生高风险静脉曲张为因变量使用多变量Logistic回归分析探索可能的影响因素, 并使用所得因素和对应参数构建预测模型. 使用受试者工作特征曲线(receiver operating characteristic, ROC)分析用所构建预测高风险静脉曲张模型的诊断性能, 使用Youden指数确定最佳诊断界值及对应的敏感度和特异度. P<0.05定义为差异有统计学意义.
共纳入276例乙肝代偿期肝硬化患者临床资料, 根据胃镜检查其中152例(55.07%)患者无静脉曲张, 43例(15.57%)患者为低风险静脉曲张, 81例(29.34%)患者为高风险静脉曲张. 在临床生化和超声资料对比方面, 高风险静脉曲张组较非高风险静脉曲张组具有更高的胆红素水平、更长的凝血酶原时间, 更低的ALB水平(P<0.05). 在常见肝脏纤维化和预后评分方面, 高风险静脉曲张组的MELD评分、APRI、FIB-4评分均较高(P<0.05). 详见表1.
| 项目 | 非高风险静脉曲张 | 高风险静脉曲张 | χ2/统计值 | P值 |
| n | 195 | 81 | ||
| 男性(n, %) | 139(71.28%) | 49(60.49%) | χ2 = 3.067 | 0.080 |
| 年龄(岁) | 51.34±11.73 | 50.28±10.46 | t = 0.705 | 0.481 |
| 肌酐(μmol/L) | 70.46±20.83 | 68.79±19.42 | t = 0.618 | 0.537 |
| 总胆红素(μmol/L) | 16.34±5.61 | 22.57±7.87 | t = 7.418 | 0.000 |
| 白蛋白(g/L) | 47.52±8.15 | 42.34±9.68 | t = 4.543 | 0.000 |
| 血小板(109/L) | 108.76±41.08 | 51.76±18.61 | t = 11.978 | 0.000 |
| 谷丙转氨酶(IU/L) | 27.05±6.72 | 28.49±9.45 | t = 1.430 | 0.154 |
| 谷草转氨酶(IU/L) | 29.38±9.77 | 31.61±11.84 | t = 1.619 | 0.107 |
| 凝血酶原时间(秒) | 12.11±1.08 | 13.39±4.36 | t = 3.835 | 0.000 |
| INR | 1.02±0.37 | 1.11±0.34 | t = 1.883 | 0.061 |
| Child-Pugh分级(n, %) | χ2 = 32.923 | <0.001 | ||
| A | 193(98.97%) | 65(80.25%) | ||
| B | 2(1.03%) | 16(19.75%) | ||
| MELD评分 | 7.17±2.31 | 10.05±3.11 | t = 8.479 | <0.001 |
| APRI | 0.66±0.22 | 1.92±0.54 | t = 27.584 | <0.001 |
| FIB-4 | 2.61±0.97 | 6.48±2.79 | t = 17.077 | <0.001 |
| 门静脉直径(mm) | 12.36±3.03 | 14.07±3.06 | t = 4.257 | <0.001 |
| 脾静脉直径(mm) | 8.01±2.14 | 9.49±3.87 | t = 4.057 | <0.001 |
以乙肝代偿期肝硬化患者高风险静脉曲张为因变量, 以表1中单因素有意义的因素为自变量, 使用Logistic回归模型分析可能影响高风险静脉曲张的因素. 结果可见患者的ALB水平降低(OR = 0.825, 95%CI: 0.779-0.873, P = 0.000)、PLT水平降低(OR = 0.934, 95%CI: 0.895-0.975, P = 0.001)、门静脉宽度增加(OR = 1.481, 95%CI: 1.141-1.922, P = 0.002)是影响乙肝代偿期肝硬化患者高风险静脉曲张发生的危险因素,详见表2.
| 影响因素 | β | SE | Wald值 | P值 | OR | 95%CI |
| 白蛋白(g/L) | -0.192 | 0.029 | 44.004 | 0.000 | 0.825 | 0.779-0.873 |
| 血小板(109/L) | -0.068 | 0.022 | 9.632 | 0.001 | 0.934 | 0.895-0.975 |
| 门静脉宽度(mm) | 0.393 | 0.133 | 8.719 | 0.002 | 1.481 | 1.141-1.922 |
| Logistic回归截距 | 6.87 |
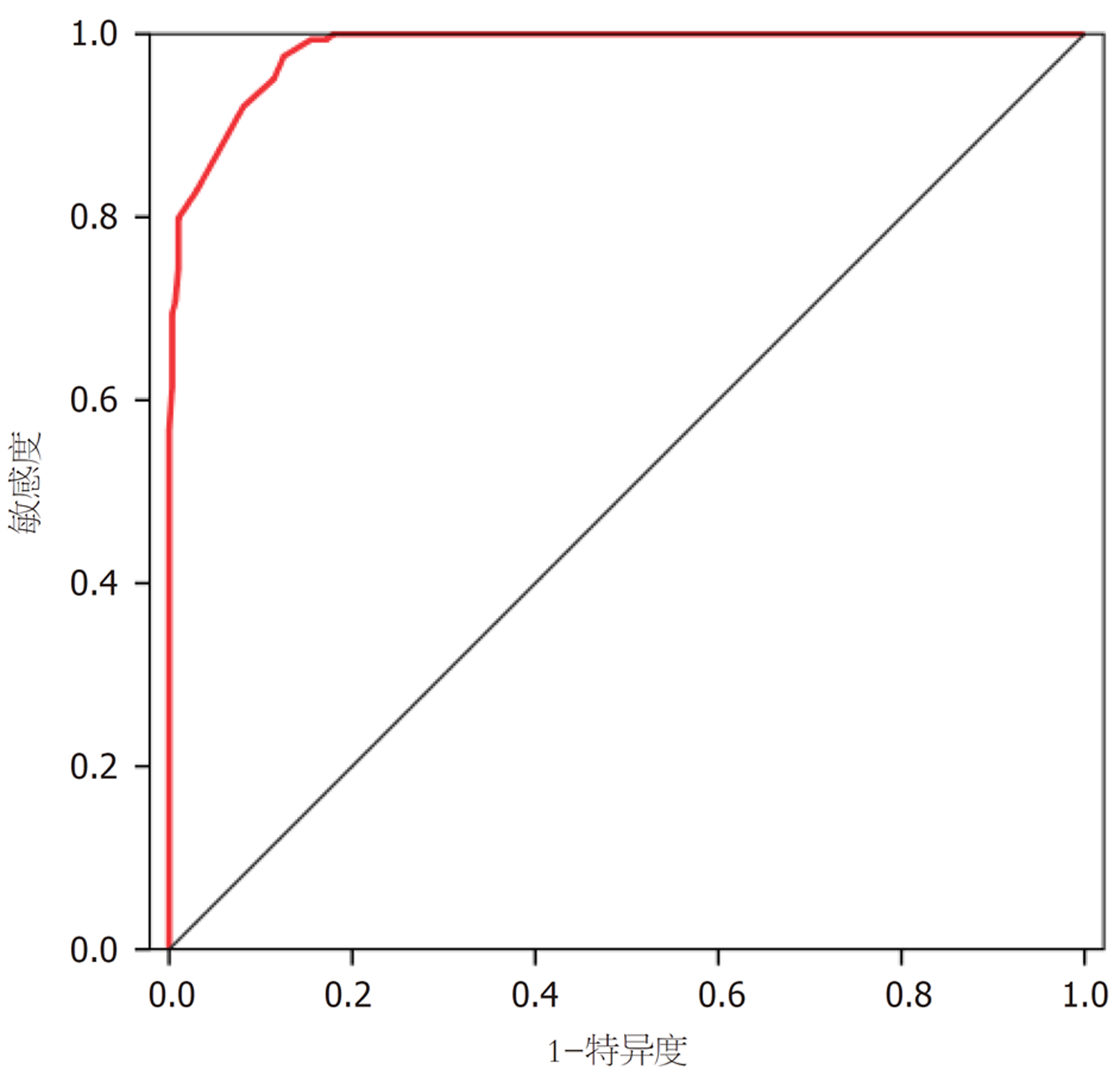
根据结果2.2部分所得出乙肝代偿期肝硬化患者高风险静脉曲张危险因素和对应参数构建预测模型如下: Y = -0.192×ALB(g/L)-0.068×PLT(109/L)+0.393×门静脉宽度(mm)+6.87. 计算全部患者的预测模型Y赋值, 使用该赋值构建预测乙肝代偿期肝硬化患者高风险食管胃底静脉曲张的ROC曲线, 可见其曲线下面积为0.976, 最佳诊断切点为Y = 0.767, 此时的敏感度为0.968, 特异度为0.882. 详见图1.
慢性乙型肝炎病毒感染是造成我国肝硬化的主要原因[11]. 由于研究已经证实, 代偿期肝硬化患者也可发生食管胃底静脉曲张破裂出血, 因此如何识别具有高风险的食管胃底静脉曲张对患者临床管理至关重要. 本研究基于此, 开发并验证了一种基于血清学和超声的针对乙肝代偿期肝硬化患者高风险食管胃底静脉曲张的预测模型. 本研究首先对比了高风险和低风险食管胃底静脉曲张的临床资料, 并使用Logistic回归分析构建了基于PLT、ALB和门静脉宽度的预测模型.
ALB是肝硬化合成功能下降的直接表现, ALB降低反应肝脏实质存在纤维化和功能障碍, 多处于失代偿期. 而ALB降低和食管胃底静脉曲张都是肝纤维化和肝硬化的反应. 因此, 已经有研究提示了ALB水平与乙肝肝硬化患者出血风险和预后相关[12]. 近年来关于ALB预测食管静脉曲张的研究的报道不断增加. 国外同样有研究证明[13], ALB是静脉曲张存在的独立影响因素. 这些结果表明ALB可能是预测高风险食管胃底静脉曲张的潜在变量.
门脉高压是食管胃底静脉曲张形成的原始驱动因素. 众所周知, 门静脉宽度伴随着门静脉高压症进展而增加. 国内有学者曾报道, 门静脉宽度大于11.5 mm可作为预测肝硬化患者食管胃底静脉曲张的重要参数[14].
肝硬化患者外周血PLT计数降低是门脉高压造成脾功能亢进的直接表现. Baveno Ⅵ共识建议将PLT作为关键变量与瞬时弹性成像参数相结合, 以筛选高风险食管胃底静脉曲张[8]. Baveno Ⅵ标准所提出的肝脏瞬时弹性成像硬度值<20 kPa和PLT>150×109/L是目前被广泛接受的无创高风险食管胃底静脉曲张筛查方法[8]. 几项大样本研究证实, 该标准可减少约15-35%代偿期肝硬化患者的胃镜检查[15,16]. 但真实世界中, 该标准仍存在>5%的误诊率[15,17]. 由于肝脏瞬时弹性成像目前尚不能在部分医院实现, 因此本研究所得模型具有一定优势. 所纳入PLT、ALB、门静脉宽度均为可及性较强、经济方便的常用临床参数.
既往也有多个研究表明, 使用ALB、PLT结合其他参数对高风险食管胃底静脉曲张预测具有较高效能. 而PLT联合患者脾厚径作为预测高风险食管胃底静脉曲张的效能也得到证实[18,19]. Calvaruso等人[9]研究证实, 通过ALB<36 g/L和PLT<120×109/L两项指标联合, 可识别超过30%的高风险食管胃底静脉曲张患者免于进行胃镜检查. Jangouk等人[20]报道, PLT>150×109/L或MELD = 6可以减少30-54%代偿期肝硬化患者的胃镜检查, 并可预测高风险食管胃底静脉曲张发生. Tosetti等人[21]在乙肝代偿期肝硬化经治患者中也证实PLT>150×109/L或MELD = 6可作为需进行内镜治疗的食管胃底静脉曲张患者识别参数. 与上述这些研究相比, 本研究所得出的模型理论上可减少约97%的代偿期肝硬化患者进行胃镜筛查, 识别高风险食管胃底静脉曲张发生准确度更高.
当然本研究存在一定局限性. (1)本研究构建模型是基于超声和胃镜检查进行, 代偿期肝硬化缺少肝穿证实; (2)尽管超声、胃镜的操作和诊断受到操作员经验影响可能造成一定偏差, 如经门静脉测量切面按照门静脉与右助缘下第一肝门纵断面, 在距第一肝门1 cm-2 cm处为标准测量切面进行超声测量, 但可能由于操作者不同造成一定诊断结果偏倚; (3)纳入的乙肝相关肝硬化患者绝大多数为Child-Pugh A级, 该模型其他分级或病因患者的判断效能仍需要进一步探索; (4)本研究模型能否对其他病因的肝硬化代偿期患者有较高预测效能, 尤其是自身免疫性肝病的诊断价值, 仍需要多中心的前瞻性研究和验证队列进一步研究和探索.
综上所述, 我们开发的基于PLT、ALB和门静脉宽度的针对代偿期肝硬化患者高风险食管胃底静脉曲张预测模型具有较高诊断效能.该模型基于常规实验室和超声检查, 参数可及性较高, 因此具有一定优势. 然而本研究为病例对照研究,只能得出研究指标与结论的相关关系, 因此今后值得进一步进行前瞻性大样本的多中心队列研究进一步验证和开发更精准的预测模型.
乙肝代偿性肝硬化患者发生高风险食管静脉曲张后存在破裂出血风险, 影响患者预后.识别肝硬化患者高风险食管静脉曲张的重要方法仍然依靠胃镜筛查.
目前已经有多个非侵袭性方法诊断食管胃底静脉曲张, 但对于高风险食管胃底静脉曲张的无创诊断仍需要进一步探讨, 本研究主要探索一种新的无创预测模型.
建立乙肝代偿性肝硬化高风险食管静脉曲张的无创预测模型,并验证其效能.
根据胃镜报告的乙肝代偿性肝硬化高风险食管静脉曲张为金标准, 以血清学和超声学报告参数为自变量, 构建预测诊断的Logistic模型, 使用受试者工作曲线预测模型准确度.
血清血小板、白蛋白和超声门静脉宽度是高风险食管胃底静脉曲张患者的危险因素. 基于上述三个指标构建的预测模型受试者工作特征曲线(receiver operating characteristic, ROC)下面积为0.976.
基于血清血小板、白蛋白和超声门静脉宽度的预测模型对高风险食管胃底静脉曲张诊断效能较高.
本研究所构建的代偿期肝硬化患者高风险食管胃底静脉曲张预测模型具有较高诊断效能, 是对胃镜检查的很好补充, 易于在肝硬化人群中进行初步筛查, 值得今后进一步研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 2. | Simonetto DA, Liu M, Kamath PS. Portal Hypertension and Related Complications: Diagnosis and Management. Mayo Clin Proc. 2019;94:714-726. [PubMed] [DOI] |
| 3. | Stanley AJ, Laine L. Management of acute upper gastrointestinal bleeding. BMJ. 2019;364:l536. [PubMed] [DOI] |
| 4. | Lee EW, Shahrouki P, Alanis L, Ding P, Kee ST. Management Options for Gastric Variceal Hemorrhage. JAMA Surg. 2019;154:540-548. [PubMed] [DOI] |
| 7. | 苏 争艳, 孙 超, 蒋 肸慧, 王 雅, 邓 优, 王 邦茂, 姜 葵. 三种评分系统在肝硬化食管胃底静脉曲张破裂出血患者风险评估中的应用. 中华消化内镜杂志. 2020;37:105-110. [DOI] |
| 9. | Calvaruso V, Cacciola I, Licata A, Madonia S, Benigno R, Petta S, Bronte F, Conte E, Malizia G, Bertino G, Distefano M, Montineri A, Digiacomo A, Alaimo G, Cacopardo B, Davì A, Guarneri L, Scalisi I, Colletti P, Cartabellotta F, Portelli V, Prestileo T, Averna A, Iacobello C, Mondello L, Scifo G, Russello M, Squadrito G, Raimondo G, Cammà C, Craxì A, Di Marco V; RESIST-HCV (Rete Sicilia Selezione Terapia-HCV). Is Transient Elastography Needed for Noninvasive Assessment of High-Risk Varices? The REAL Experience. Am J Gastroenterol. 2019;114:1275-1282. [PubMed] [DOI] |
| 10. | 黄 理, 陈 丽芬, 蓝 婧, 蓝 婧, 黄 霜湘, 江 秋维, 杨 月华. 肝硬化食管静脉曲张内镜下治疗后早期再出血的危险因素研究. 现代消化及介入诊疗. 2019;24:95-98. [DOI] |
| 13. | Roccarina D, Rosselli M, Genesca J, Tsochatzis EA. Elastography methods for the non-invasive assessment of portal hypertension. Expert Rev Gastroenterol Hepatol. 2018;12:155-164. [PubMed] [DOI] |
| 14. | 郭 芸蕾, 鲁 晓岚, 程 妍, 史 海涛, 谢 丹红, 李 红, 董 蕾. 肝脾硬度联合门静脉宽度评估肝硬化食管胃底静脉曲张出血风险. 中华肝脏病杂志. 2016;24:56-61. [DOI] |
| 15. | Lee HA, Kim SU, Seo YS, Lee YS, Kang SH, Jung YK, Kim MY, Kim JH, Kim SG, Suk KT, Jung SW, Jang JY, An H, Yim HJ, Um SH. Prediction of the varices needing treatment with non-invasive tests in patients with compensated advanced chronic liver disease. Liver Int. 2019;39:1071-1079. [PubMed] [DOI] |
| 16. | Augustin S, Pons M, Maurice JB, Bureau C, Stefanescu H, Ney M, Blasco H, Procopet B, Tsochatzis E, Westbrook RH, Bosch J, Berzigotti A, Abraldes JG, Genescà J. Expanding the Baveno VI criteria for the screening of varices in patients with compensated advanced chronic liver disease. Hepatology. 2017;66:1980-1988. [PubMed] [DOI] |
| 17. | Moctezuma-Velazquez C, Saffioti F, Tasayco-Huaman S, Casu S, Mason A, Roccarina D, Vargas V, Nilsson JE, Tsochatzis E, Augustin S, Montano-Loza AJ, Berzigotti A, Thorburn D, Genesca J, Abraldes JG. Non-Invasive Prediction of High-Risk Varices in Patients with Primary Biliary Cholangitis and Primary Sclerosing Cholangitis. Am J Gastroenterol. 2019;114:446-452. [PubMed] [DOI] |
| 18. | Dong TS, Kalani A, Aby ES, Le L, Luu K, Hauer M, Kamath R, Lindor KD, Tabibian JH. Machine Learning-based Development and Validation of a Scoring System for Screening High-Risk Esophageal Varices. Clin Gastroenterol Hepatol. 2019;17:1894-1901.e1. [PubMed] [DOI] |
| 19. | 郭 茂东, 胡 亮, 陈 燕萍, 陈 燕萍, 施 昕, 叶 晓华, 王 群英, 张 芸芸, 丁 进. 肝硬化患者高危食管静脉曲张列线图预测模型的构建研究. 中国全科医学. 2021;24:3848-3855. [DOI] |
| 20. | Jangouk P, Turco L, De Oliveira A, Schepis F, Villa E, Garcia-Tsao G. Validating, deconstructing and refining Baveno criteria for ruling out high-risk varices in patients with compensated cirrhosis. Liver Int. 2017;37:1177-1183. [PubMed] [DOI] |
| 21. | Tosetti G, Primignani M, La Mura V, D'Ambrosio R, Degasperi E, Mezzina N, Viganò M, Rumi M, Fracanzani AL, Lombardi R, Fargion S, Fraquelli M, Aghemo A, Lampertico P. Evaluation of three "beyond Baveno VI" criteria to safely spare endoscopies in compensated advanced chronic liver disease. Dig Liver Dis. 2019;51:1135-1140. [PubMed] [DOI] |