修回日期: 2022-10-27
接受日期: 2022-12-21
在线出版日期: 2022-12-28
早期准确诊断、评估药物性肝损伤(drug-induced liver injury, DILI)病情对临床治疗具有重要指导意义. DILI机制复杂, 涉及多种物质, 铁蛋白(serum ferritin, SF)、单核细胞趋化蛋白-1(monocyte chemotactic protein-1, MCP-1)、高迁移率族蛋白-1(high mobility group protein-1, HMGB1)在肝损伤时明显升高, 可能与DILI有关.
探讨外周血SF、MCP-1、HMGB1诊断DILI的价值.
选取2018-01/2021-02我院收治的184例DILI患者, 其中94例轻度患者(轻度组)、52例中度患者(中度组)、38例重度患者(重度组), 并选取同期酒精性肝病、非酒精性脂肪肝病患者70例作为非DILI肝病组以及体检中心70例健康人群作为对照组, 比较各组SF、MCP-1、HMGB1水平, 应用皮尔森(Pearson)分析SF、MCP-1、HMGB1与谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin, TBIL)、碱性磷酸酶(alkaline phosphatase, ALP)关系, 斯皮尔曼(Spearman)分析SF、MCP-1、HMGB1与DILI严重程度关系, 采用多分类Logistic回归方程分析DILI严重程度的相关影响因素, 应用受试者工作特征曲线(receiver operating characteristic, ROC)及ROC下面积(area under the curve, AUC)分析各指标及联合诊断DILI的价值.
ALT、AST、TBIL、ALP: 重度组>中度组>轻度组>对照组(P<0.05); SF、MCP-1、HMGB1: 重度组>中度组>轻度组>对照组, 两两比较差异均有统计学意义(P<0.05); SF、MCP-1、HMGB1高水平者与低水平者DILI严重程度分布比较, 差异有统计学意义(P<0.05); SF、MCP-1、HMGB1与ALT、AST、TBIL、ALP呈正相关(P<0.05); SF(r = 0.665, P<0.001)、MCP-1(r = 0.693, P<0.001)、HMGB1(r = 0.728, P<0.001)与DILI严重程度正相关; 多分类Logistic回归方程分析显示, 将ALT、AST、TBIL、ALP控制后, SF、MCP-1、HMGB1仍是DILI病情程度的相关影响因素(P<0.05); SF、MCP-1、HMGB1诊断DILI的AUC分别为0.870、0.803、0.859, SF、MCP-1联合HMGB1诊断DILI的AUC为0.926; SF、MCP-1、HMGB1及联合鉴别重度DILI的AUC分别为0.888、0.774、0.807、0.948.
外周血SF、MCP-1、HMGB1与DILI及其严重程度有关, 在DILI诊断及病情评估呈现出较高应用价值, 可作为诊断和评估DILI病情程度的生物标志物, 为临床提供参考信息.
核心提要: 外周血铁蛋白、单核细胞趋化蛋白-1、高迁移率族蛋白-1与药物性肝损伤(drug-induced liver injury, DILI)的严重程度相关, 且联合应用可作为诊断和评估DILI病情程度的生物标志物, 为临床上DILI的诊断与治疗提供参考.
引文著录: 鲁欢乐, 倪红妙, 张宇东, 刘媛. 单核细胞趋化蛋白-1、高迁移率族蛋白-1联合外周血铁蛋白在诊断和评估药物性肝损伤中的价值. 世界华人消化杂志 2022; 30(24): 1086-1094
Revised: October 27, 2022
Accepted: December 21, 2022
Published online: December 28, 2022
Early and accurate diagnosis and assessment of drug-induced liver injury (DILI) are of important significance for its clinical management. The mechanism of DILI is complex and involves a variety of molecules. Serum ferritin (SF), monocyte chemotactic protein-1 (MCP-1), and high mobility group protein-1 (HMGB1) are significantly elevated in liver injury and may be associated with DILI.
To investigate the diagnostic value of peripheral blood SF, MCP-1, and HMGB1 in DILI.
One hundred and eighty-four patients with DILI admitted to our hospital from January 2018 to February 2021, including 94 mild patients (mild group), 52 moderate patients (moderate group), and 38 severe patients (severe group), 70 patients with alcoholic liver disease or non-alcoholic fatty liver disease treated in the same period (non-DILI liver disease group), and 70 healthy volunteers attending the physical examination (control group) were included in this study. Serum SF, MCP-1, and HMGB1 levels were compared among the groups. Pearson correlation analysis was performed to determine the relationship between serum SF, MCP-1, and HMGB1 and alanine aminotransferase (ALT), aspartate aminotransferase (AST), total bilirubin (TBIL), and alkaline phosphatase (ALP). Spearman correlation analysis was performed to explore the relationship between serum SF, MCP-1, and HMGB1 and the severity of DILI. Multivariate logistic regression was used to identify the factors related to the severity of DILI, and receiver operating characteristic (ROC) curve analysis was applied to assess the performance of each index and their combination in the diagnosis of DILI.
ALT, AST, TBIL, and ALP, as well as serum SF, MCP-1, and HMGB1, were highest in the severe group, followed by the moderate group, mild group, and control group (P < 0.05 for all pairwise comparisons). The distribution of DILI severity between patients with high and low levels of serum SF, MCP-1, and HMGB1 was significantly different (P<0.05). Serum SF (r = 0.665, P < 0.001), MCP-1 (r = 0.693, P < 0.001), and HMGB1 (r = 0.728, P < 0.001) were positively correlated with the severity of DILI. Multivariate logistic regression analysis showed that after adjusting for ALT, AST, TBIL, and ALP, serum SF, MCP-1, and HMGB1 were still factors significantly influencing the severity of DILI (P < 0.05). The area under the ROC curve (AUC) of serum SF, MCP-1, or HMGB1 alone for diagnosing DILI was 0.870, 0.803, and 0.859, respectively, and the AUC of their combination for diagnosing DILI was 0.926. For diagnosing severe DILI, the AUC of SF, MCP-1, or HMGB1 alone was 0.888, 0.774, and 0.807, respectively, and the AUC of their combination was 0.948.
Peripheral blood SF, MCP-1, and HMGB1 are related to DILI and its severity, and have high application value in DILI diagnosis and disease evaluation. They can be used as biomarkers to diagnose and evaluate the severity of DILI.
- Citation: Lu HL, Ni HM, Zhang YD, Liu Y. Value of combined detection of peripheral blood monocyte chemotactic protein-1, high mobility group protein-1, and ferritin in diagnosis and assessment of drug-induced liver injury. Shijie Huaren Xiaohua Zazhi 2022; 30(24): 1086-1094
- URL: https://www.wjgnet.com/1009-3079/full/v30/i24/1086.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i24.1086
药物性肝损伤(drug-induced liver injury, DILI)是由各种药物及其代谢产物诱发的肝损伤, 是最常见和最严重的一种药物不良反应, 可导致急性肝衰竭, 甚至死亡, 迄今仍缺乏特效治疗手段, 因此研究客观、特异、简便诊断和病情评估方法意义重大[1]. 现阶段DILI的诊断常依据患者用药史、肝功能检测、临床症状体征、肝组织活检等, 存在流程繁琐、特异性低、有一定创伤等缺点, 在DILI患者初步筛查中应用受限, 故有必要研究便捷性的诊断方法. 血清铁蛋白(serum ferritin, SF)是评估机体铁储存量的有效指标, 根据既往资料[2], SF在肝损伤患者中水平高于无肝损伤者. 单核细胞趋化蛋白-1(monocyte chemotactic protein-1, MCP-1)在放射性肝损伤小鼠中水平升高, 可反映小鼠肝损伤情况[3]. 高迁移率族蛋白-1(high mobility group protein-1, HMGB1)在利福平致肝损伤小鼠中水平升高, 阻断HMGB1可通过抑制HMGB1-内质网应激途径减轻利福平导致的小鼠肝损伤[4]. 故推测SF、MCP-1、HMGB1可能与DILI有关, 并有助于DILI的诊断, 但现阶段关于这方面的临床报道鲜见, 基于此本研究对此进行探讨, 旨在为临床诊治DILI提供参考, 报告如下.
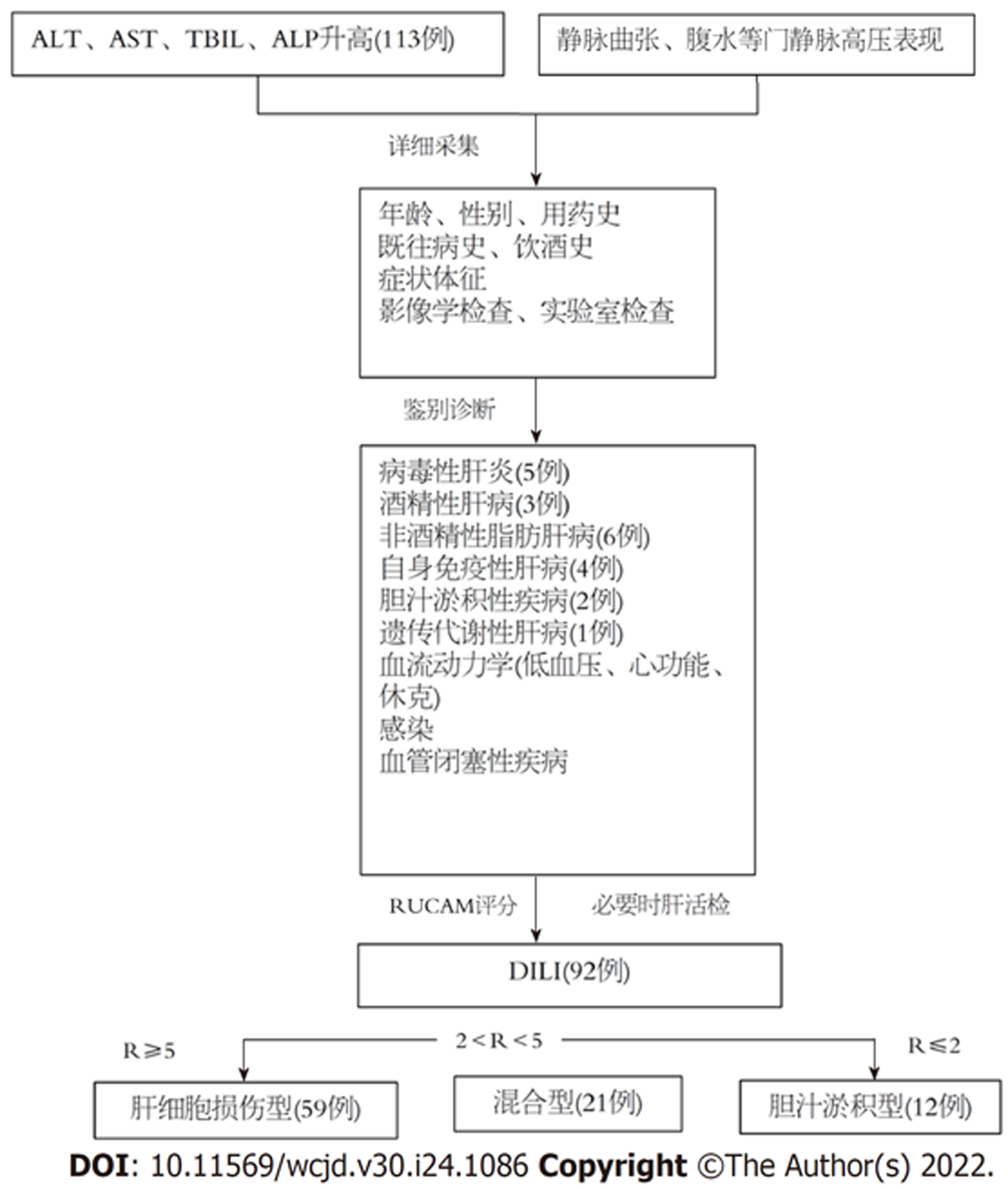
选取2018-01/2021-02我院收治的184例DILI患者作为研究对象进行前瞻性研究, 其中154例可明确用药名称, 30例未能明确具体用药. 导致DILI的药物种类有中草药32例(主要有蜂胶糖脂舒软胶囊、维C银翘片、雷公藤多甙片、小柴胡), 保健品类66例(主要有健脑类、益肾类等), 解热镇痛消炎药30例(主要有对乙酰氨基酚、安乃近、布洛芬、别嘌醇), 抗生素22例(主要有阿奇霉素、头孢类抗菌素、克林霉素), 抗肿瘤药4例(环磷酰胺), 除保健品类40例患者说明存在过量服用外, 剩余患者均主诉遵医嘱或售卖商家建议的剂量用药, 未过量用药. 纳入标准: (1)DILI的诊断参考《药物性肝损伤诊治指南》[5]中标准(见图1); (2)首次确诊; (3)入组前无相关治疗史; (4)年龄≥18岁. 排除标准: (1)肝癌患者; (2)用药前肝功能异常者; (3)用药前有病毒性肝炎、自身免疫性肝炎者. 并选取同期酒精性肝病(16例)、非酒精性脂肪肝病(54例)患者70例作为非DILI肝病组以及体检中心70例健康人群作为对照组. 本研究获医院伦理委员会审核通过, 患者及家属充分知情, 自愿加入, 并签署书面知情同意书.
1.2.1 DILI严重程度分级: 参考《药物性肝损伤诊治指南》[5]将DILI严重程度分为0-5级, 其中1级为轻度患者(轻度组), 2级为中度患者(中度组), 3级为重度患者(重度组).
1.2.2 检测方法: DILI患者在治疗前、治疗后, 对照组在入院后清晨采集空腹肘部静脉血5 mL, 应用酶联免疫吸附法检测SF、MCP-1、HMGB1水平, SF试剂盒购于天津洁瑞医学生物工程有限公司, MCP-1试剂盒购于上海瑞番生物科技有限公司, HMGB1试剂盒购于深圳市科润达生物工程有限公司; 采用全自动生化分析仪(美国贝克曼DXC800)检测丙氨酸氨基转移酶(alanine aminotransferase, ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin, TBIL)、碱性磷酸酶(alkaline phosphatase, ALP)水平; 采用血凝仪检测凝血酶原时间, 计算国际标准化比值(international normalized ratio, INR).
1.2.3 治疗方法及转归: 《药物性肝损伤诊治指南》[5], 停用可疑肝损伤药物, 避免再次使用同类药物, 并权衡停药后对肝损伤加重的风险, 根据DILI的类型选取药物治疗, 重症患者必要时考虑肝移植. 本研究中, 轻度和中度患者经对应治疗后, 肝功能逐渐恢复正常, 重度患者中5例接受肝移植后无病死发生, 肝功能逐渐改善, 14例经综合评估后, 在患者充分知情前提下, 给予药物治疗, 肝功能明显改善.
(1)比较各组一般资料; (2)比较各组SF、MCP-1、HMGB1水平. (3)分析SF、MCP-1、HMGB1与ALT、AST、TBIL、ALP关系; (4)分析各指标与DILI严重程度关系; (5)分析DILI严重程度的相关影响因素; (6)各指标及联合诊断DILI的价值.
统计学处理 采用SPSS 22.0处理数据, 样本量的选取依据多个样本均数比较所需样本含量计算方法, 利用SPSS 22.0软件计算得出, 计量资料符合正态分布的以mean±SD表示, 多组间比较以单因素方差分析, 两两比较以LSD-t检验,组间以独立样本t检验, 计数资料用n(%)表示, 行χ2检验, 应用Pearson分析SF、MCP-1、HMGB1与ALT、AST、TBIL、ALP关系, 应用Spearman分析SF、MCP-1、HMGB1与DILI严重程度关系, 采用多分类Logistic回归方程分析DILI严重程度的相关影响因素, 应用受试者工作特征曲线(receiver operating characteristic, ROC)及ROC下面积(area under the curve, AUC)分析SF、MCP-1、HMGB1及联合诊断DILI的价值. P<0.05为差异有统计学意义.
各组年龄、性别、饮酒史、吸烟史、体质量指数、慢性病史、DILI分型比较, 差异无统计学意义; ALT、AST、TBIL、ALP、INR: 重度组>中度组>轻度组和非DILI肝病组>对照组(P<0.05). 见表1.
| 资料 | 重度组 | 中度组(n = 52) | 轻度组(n = 94) | 非DILI肝病组(n = 70) | 对照组(n = 70) | F/χ2 | P |
| 年龄(岁) | 41.15±10.26 | 39.88±9.57 | 40.73±10.18 | 41.08±10.57 | 40.24±11.08 | 0.071 | 0.975 |
| 性别(男/女) | 20/18 | 24/28 | 50/44 | 34/36 | 32/38 | 1.318 | 0.858 |
| 饮酒史 | 22(57.89) | 28(53.85) | 50(53.19) | 33(47.14) | 30(42.86) | 3.283 | 0.512 |
| 吸烟史 | 16(42.11) | 18(34.62) | 44(46.81) | 30(42.86) | 28(40.00) | 0.700 | 2.193 |
| 体质量指数(kg/m2) | 23.48±1.25 | 23.57±1.38 | 23.39±1.44 | 23.36±1.30 | 23.16±1.17 | 0.532 | 0.661 |
| 慢性病史 | |||||||
| 高血压 | 4(10.53) | 8(15.38) | 6(6.38) | 7(10.00) | - | 3.089 | 0.378 |
| 冠心病 | 2(5.26) | 4(7.69) | 8(8.51) | 5(7.14) | - | 0.429 | 0.934 |
| 糖尿病 | 8(21.05) | 10(19.23) | 12(12.77) | 14(20.00) | - | 2.215 | 0.529 |
| 高脂血症 | 6(15.79) | 2(3.85) | 14(14.89) | 15(21.43) | - | 7.504 | 0.057 |
| COPD | 4(10.53) | 2(3.85) | 6(6.38) | 6(8.57) | - | 1.817 | 0.611 |
| ALT(U/L) | 388.15±49.60abc | 150.87±37.24ab | 48.11±9.32a | 49.25±12.82 | 23.35±6.71 | 948.772 | <0.001 |
| AST(U/L) | 297.36±38.82abc | 128.64±29.55ab | 37.98±10.19a | 39.05±13.48 | 25.06±7.29 | 834.308 | <0.001 |
| TBIL(μmol/L) | 49.27±8.52abc | 23.45±3.79ab | 12.34±2.26a | 12.85±2.48 | 6.55±2.03 | 510.442 | <0.001 |
| ALP(U/L) | 203.68±24.59abc | 134.48±18.59ab | 96.67±20.58a | 99.57±22.71 | 71.66±16.37 | 204.962 | <0.001 |
| INR | 1.62±0.18 | 1.49±0.22 | 1.32±0.15 | 1.30±0.16 | 1.04±0.13 | 62.710 | <0.001 |
| DILI分型 | |||||||
| 肝细胞型 | 22(57.89) | 32(61.54) | 64(68.09) | - | - | 0.717 | 0.699 |
| 胆汁淤积型 | 4(10.53) | 12(23.08) | 8(8.51) | - | - | 3.265 | 0.195 |
| 混合型 | 12(31.58) | 8(15.38) | 22(23.40) | - | - | 1.653 | 0.438 |
治疗前SF、MCP-1、HMGB1: 重度组>中度组>轻度组>非DILI肝病组>对照组, 两两比较差异均有统计学意义(P<0.05); 重度组、中度组、轻度组治疗后SF、MCP-1、HMGB1均低于治疗前(P<0.05). 见表2.
| 组别 | 例数 | SF(μg/L) | MCP-1(pg/mL) | HMGB1(ng/mL) | |||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | ||
| 重度组 | 38 | 466.38±150.03abc | 285.63±93.01d | 495.33±162.47abc | 301.41±115.06d | 11.26±3.05abc | 7.73±2.05d |
| 中度组 | 52 | 237.89±61.15ab | 151.35±47.28d | 294.05±77.18ab | 190.66±49.25d | 6.87±2.11ab | 2.60±0.86d |
| 轻度组 | 94 | 186.97±52.33a | 144.24±39.66d | 223.65±66.28a | 181.03±45.48d | 4.25±1.37a | 2.54±0.82d |
| 非DILI肝病组 | 70 | 150.33±47.82 | - | 186.44±48.67 | - | 2.88±0.84 | - |
| 对照组 | 70 | 136.68±40.57 | - | 170.54±52.39 | - | 2.46±0.79 | - |
| F | 87.492 | 45.688 | 63.430 | 23.459 | 113.870 | 143.327 | |
| P | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | |
以DILI患者治疗前各指标为源数据, 应用Pearson进行相关性分析, 结果显示, SF、MCP-1、HMGB1与ALT(r = 0.895、0.768、0.863, P均<0.001)、AST(r = 0.804、0.804、0.866, P均<0.001)、TBIL(r = 0.789、0.794、0.752, P均<0.001)、ALP(r = 0.812、0.722、0.834, P均<0.001)呈正相关(P<0.05).
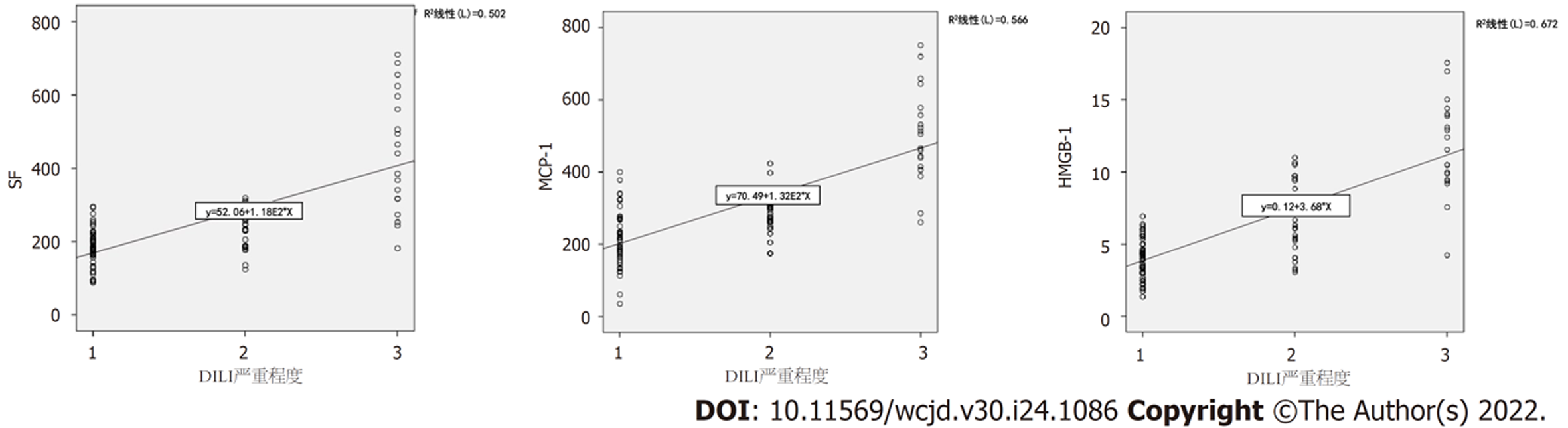
以DILI患者治疗前各指标为源数据, 应用Spearman进行相关性分析, 结果显示, 治疗前SF(r = 0.665, P<0.001)、MCP-1(r = 0.693, P<0.001)、HMGB1(r = 0.728, P<0.001)与DILI严重程度正相关. 见图2.
以DILI严重程度为因变量(轻度、中度、重度依次赋值1、2、3), 纳入各组比较P<0.05的指标作为自变量(SF、MCP-1、HMGB1低水平赋值1, 高水平赋值2), 应用多分类Logistic回归方程分析, 结果显示, 将ALT、AST、TBIL、ALP、INR控制后, 治疗前SF、MCP-1、HMGB1仍是DILI病情程度的相关影响因素(P<0.05). 见表3.
| 影响因素 | β | SE | Wald χ2 | P | OR | 95%CI |
| SF | 0.982 | 0.291 | 11.382 | <0.001 | 2.669 | 1.258-5.663 |
| MCP-1 | 0.821 | 0.192 | 18.293 | <0.001 | 2.273 | 1.003-5.152 |
| HMGB1 | 0.855 | 0.206 | 17.217 | <0.001 | 2.351 | 2.147-2.574 |
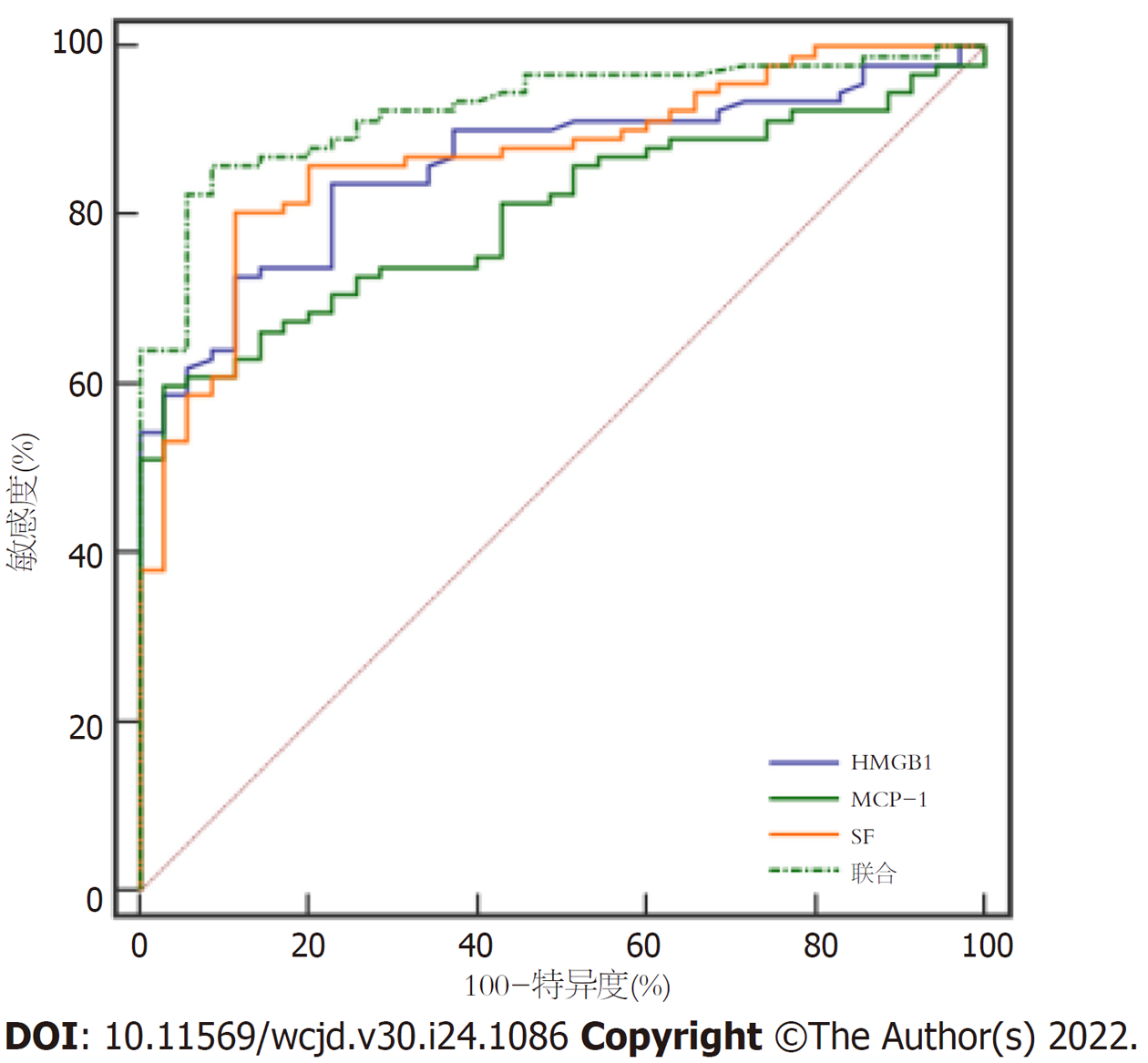
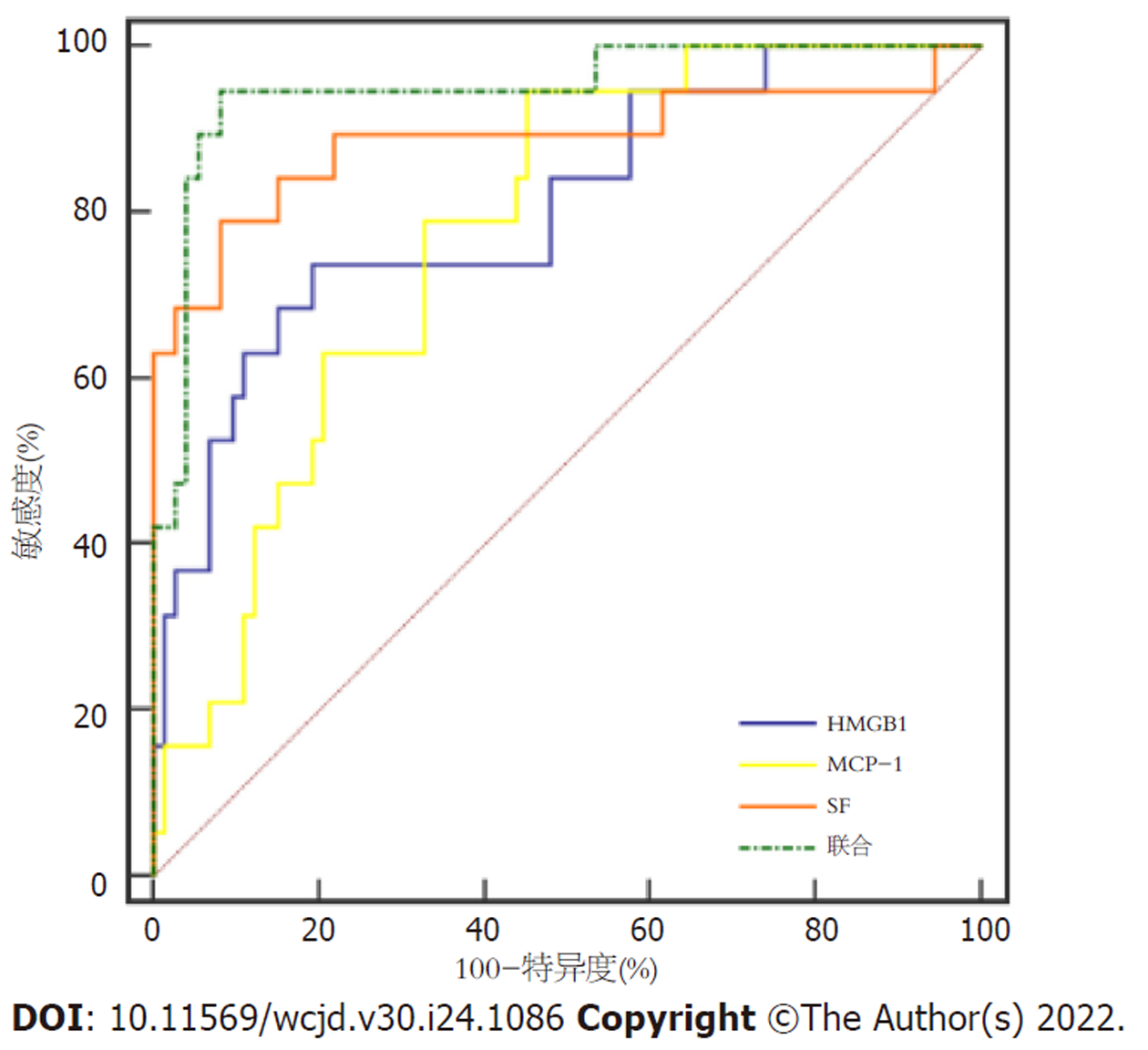
以DILI患者治疗前各指标为阳性样本, 以对照组为阴性样本, 绘制各指标的ROC曲线, 并应用Logistic二元回归拟合构建各指标联合的ROC诊断模型, 结果显示, 治疗前SF、MCP-1联合HMGB1诊断DILI及鉴别重度DILI的AUC最大, 见图3和图4、表4.
| 指标 | AUC | 95%CI | P | Cut-off值 | 敏感度(%) | 特异度(%) |
| 诊断DILI | ||||||
| SF | 0.870 | 0.798-0.923 | <0.001 | >169.21 μg/L | 80.43 | 88.57 |
| MCP-1 | 0.803 | 0.723-0.868 | <0.001 | >246.82 pg/mL | 59.78 | 97.14 |
| HMGB1 | 0.859 | 0.787-0.915 | <0.001 | >3.83 ng/mL | 72.83 | 88.57 |
| 联合 | 0.926 | 0.866-0.965 | <0.001 | 85.87 | 91.43 | |
| 鉴别重度DILI | ||||||
| SF | 0.888 | 0.774-1.000 | <0.001 | >302.93 μg/L | 78.95 | 91.78 |
| MCP-1 | 0.774 | 0.671-0.878 | <0.001 | >370.86 pg/mL | 94.74 | 54.79 |
| HMGB1 | 0.807 | 0.689-0.924 | <0.001 | >8.62 ng/mL | 73.68 | 80.82 |
| 联合 | 0.948 | 0.889-1.000 | <0.001 | 94.74 | 91.78 |
ALT、AST、TBIL、ALP是传统肝功能指标, 发生肝损伤时, 其活性可明显升高, 因此被视为诊断DILI的常用参考指标. 但由于ALT、AST、TBIL、ALP亦可能在进行性肌营养不良、心肌梗死等疾病中升高, 并易受饮食、睡眠等因素影响, 导致诊断特异性不足, 临床应用受限, 所以研究新的诊断标志物是必要的[6]. 本研究显示, SF、MCP-1、HMGB1与ALT、AST、TBIL、ALP呈正相关, 表明SF、MCP-1、HMGB1与传统肝功能指标变化趋势一致, 可能在评估DILI中的具有一定实际.
其中SF是机体储存铁的一种形式, 常由肝细胞合成, 之后储存于肝实质细胞的胞浆中, 生理状态下, 血清中含量较少. 既往研究显示[7,8], 铁过载是肝移植患者肝脏缺血再灌注损伤的相关危险因素, 并能区分肺炎患者是否发生肝损伤. 本研究显示, DILI患者SF较健康体检者升高, 且随着DILI严重程度加重, 逐渐升高, 与刘萍萍等[9]报道相似, 证实SF与DILI的发生及严重程度有关. DILI患者存在肝细胞炎性反应, 激活巨噬细胞后, 增加了SF合成, 且肝细胞碎屑性坏死、变性坏死等, 可使胞浆中SF释放入血, 从而引起外周血SF水平升高. 当SF>169.21 μg/L, 诊断SF的AUC为0.870, 敏感度为80.43%, 特异度为88.57%, 呈现出较高的诊断效能, 能为临床诊断DILI提供客观参考依据. 由于DILI患者SF越高, 病情程度越严重, 故临床应加强对高水平患者病情评估、监测及干预, 避免发生急性肝衰竭、死亡, 以改善患者预后.
MCP-1是一种趋化因子, 由内皮细胞、成骨细胞、平滑肌细胞等分泌, 可作用于单核细胞和巨噬细胞[10,11]. 本研究显示, 与健康体检人群相比, DILI患者MCP-1较高, 提示MCP-1与DILI有关, 且MCP-1越高, DILI越严重. Li等[12]报道, 肝细胞损伤时, MCP-1水平升高, 且MCP-1可介导炎症反应的扩大, 采用一定措施抑制MCP-1合成和释放, 则能减轻急性肝衰竭病情. 敲除MCP-1趋化性细胞因子受体2后, 可保护肝细胞免受氧化应激、炎症反应的损伤[13]. 佐证了MCP-1在肝损伤中所起的作用. MCP-1结合趋化性细胞因子受体2后, 具有吸附单核细胞移动的功能, 并能调控血管内皮细胞黏附分子表达, 使激活的单核/巨噬细胞在肝损伤部位聚集, 引起肝细胞的炎症损伤, MCP-1水平越高, 肝炎性损伤越严重, 因此与DILI患者病情程度有关[14]. 当MCP-1>246.82 pg/mL时, 诊断DILI的AUC为0.803, 敏感度为59.78%, 97.14%, 呈现出一定诊断价值, 可为临床提供参考信息.
HMGB1广泛存在于细胞质、细胞外、细胞核, 不同位置发挥不同的生物学功能, 在细胞坏死时可被动释放至外周循环, 免疫细胞活化时可主动分泌至外周循环, 因此外周血中HMGB1是细胞炎症和坏死的指标[15]. 本研究显示, DILI患者HMGB1高于对照组, 且HMGB1与DILI严重程度呈正相关, 表明HMGB1有助于DILI的诊断和病情程度的评估. Starkey Lewis等[16]研究显示, 乙酰氨基酚用药过量后, 可导致急性肝损伤, 并伴有HMGB1水平的升高, 本研究观点与之相似. HMGB1参与DILI的机制可能有: (1)HMGB1能趋化中性粒细胞向炎症部位的聚集, 扩大炎性反应, 介导肝细胞的损害、凋亡; (2)HMGB1肽链上包含3个对氧化还原反应敏感的半胱氨酸残基, 可介导氧化反应, 引起肝细胞的氧化应激损伤[17,18]. 当HMGB1>3.83 ng/mL, 诊断DILI的AUC为0.859, 敏感度为72.83%, 特异度为88.57%, 能为临床诊断提供量化的数据参考.
另SF、MCP-1联合HMGB1诊断DILI的AUC最大, 故建议临床联合检测三者对DILI进行诊断, 以提高诊断准确性. 其原因可能是, SF、MCP-1联合HMGB1涵盖了DILI发生的更多机制, 所以联合应用时诊断价值更高. 同时三者联合鉴别重度DILI的AUC亦最大, 提示联合检测三者能提高对重度DILI的鉴别价值, 从而为临床诊治提供可靠的参考. 本研究不足之处在于, DILI包括肝细胞型、胆汁淤积型、混合型, 不同类型的DILI患者, 三个指标间有无差异本研究未进行统计分析尚不明确, 亦需后续进行分类比较进行证实.
综上, 外周血SF、MCP-1、HMGB1与DILI及其严重程度有关, 在DILI诊断及病情评估呈现出较高应用价值, 可作为诊断和评估DILI病情程度的生物标志物, 为临床提供参考信息.
现阶段全球上市药物中有>1100种药物具有潜在肝毒性, 使药物性肝损伤(drug-induced liver injury, DILI)的病因、机制、诊断和治疗在全球越来越受到重视, 但由于其诱因较多, 发病机制复杂等, 导致临床快速诊断困难.
当前DILI仍无特效治疗手段, 并缺乏客观、特异、便捷的诊断指标和病情标志物, 本研究旨在为DILI的初步筛查诊断和病情评估提供一种便捷方法, 为临床诊治DILI提供客观参考依据.
本研究主要探讨血清铁蛋白(serum ferritin, SF)、单核细胞趋化蛋白-1(monocyte chemotactic protein-1, MCP-1)、高迁移率族蛋白-1(high mobility group protein-1, HMGB1)与DILI严重程度的关系及三者联合应用的诊断价值, 为DLILI初步的无创筛查诊断和肝损伤程度的快速评估提供参考.
本研究采用前瞻性研究方法, 可减少数据的偏倚, 并运用皮尔森(Pearson)/斯皮尔曼(Spearman)进行相关性分析, 说明SF、MCP-1、HMGB1与病情程度关系, 同时多分类Logistic回归方程能阐明SF、MCP-1、HMGB1对DILI严重程度的独立影响效应和标志物的潜质, 且本研究首次采用受试者工作特征曲线(receiver operating characteristic, ROC)分析获取的各诊断参数能为临床提供量化的诊断参考.
本研究发现SF、MCP-1、HMGB1在DILI中表达明显异常, 并随着DILI严重程度加重逐渐递增, 校正了各混杂因素后, 三者仍是DILI病情程度的相关影响因素, 可作为诊断及病情评估的指标.
DILI的快速、无创、准确诊断迄今仍是消化内科的难点和棘手问题, 本研究创新性发现了外周血SF、MCP-1、HMGB1可作为DILI的生物标志物, 在DILI的诊断与病情评估中呈现出巨大的潜在应用前景.
本研究设置非DILI肝病组和健康人群作为对照, 通过庞大的数据统计分析, 体现SF、MCP-1、HMGB1在DILI中的敏感性和特异性, 但纳入样本量较少, 下一步仍需积累更多的病例, 进行进一步的验证.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Hoofnagle JH, Björnsson ES. Drug-Induced Liver Injury - Types and Phenotypes. N Engl J Med. 2019;381:264-273. [PubMed] [DOI] |
| 2. | 张 祥波, 费 云霞, 何 韬, 高 岭, 张 雨婷, 高 依丹, 李 鸽, 王 洁, 茹 清静, 汪 浩秋, 陈 公英. 登革热急性发热期血清铁蛋白水平与肝脏损害的相关性分析. 中华肝脏病杂志. 2021;29:265-270. [DOI] |
| 3. | 胡 伟, 张 栋梁, 周 耿瑶, 张 进学, 衣 鑫, 谢 建刚, 张 圆, 杨 琨, 庄 然. CD226基因敲除加重小鼠放射性肝损伤的发生. 细胞与分子免疫学杂志. 2019;35:46-51. |
| 6. | 田 丽, 朱 国斌. 非ST段抬高急性冠脉综合征病人血浆单胺氧化酶与GRACE评分的相关性. 中西医结合心脑血管病杂志. 2020;18:4032-4035. [DOI] |
| 7. | Cao P, Wu Y, Wu S, Wu T, Zhang Q, Zhang R, Wang Z, Zhang Y. Elevated serum ferritin level effectively discriminates severity illness and liver injury of coronavirus disease 2019 pneumonia. Biomarkers. 2021;26:207-212. [PubMed] [DOI] |
| 8. | Yamada N, Karasawa T, Wakiya T, Sadatomo A, Ito H, Kamata R, Watanabe S, Komada T, Kimura H, Sanada Y, Sakuma Y, Mizuta K, Ohno N, Sata N, Takahashi M. Iron overload as a risk factor for hepatic ischemia-reperfusion injury in liver transplantation: Potential role of ferroptosis. Am J Transplant. 2020;20:1606-1618. [PubMed] [DOI] |
| 10. | Kim HL, Kim NS, Cho HY, Park SJ, Lee CK, Choi I, Lee SW. Ultravist Induces the Expression of MCP-1 and VCAM-1 in IL-4-Stimulated HUVECs. Biol Pharm Bull. 2019;42:915-922. [PubMed] [DOI] |
| 11. | Das P, Pal S, Oldfield CM, Thillai K, Bala S, Carnevale KA, Cathcart MK, Bhattacharjee A. A PKCβ-LYN-PYK2 Signaling Axis Is Critical for MCP-1-Dependent Migration and Adhesion of Monocytes. J Immunol. 2021;206:181-192. [PubMed] [DOI] |
| 12. | Li H, Zhao XK, Cheng YJ, Zhang Q, Wu J, Lu S, Zhang W, Liu Y, Zhou MY, Wang Y, Yang J, Cheng ML. Gasdermin D-mediated hepatocyte pyroptosis expands inflammatory responses that aggravate acute liver failure by upregulating monocyte chemotactic protein 1/CC chemokine receptor-2 to recruit macrophages. World J Gastroenterol. 2019;25:6527-6540. [PubMed] [DOI] |
| 13. | Luciano-Mateo F, Cabré N, Fernández-Arroyo S, Baiges-Gaya G, Hernández-Aguilera A, Rodríguez-Tomàs E, Mercado-Gómez M, Menendez JA, Camps J, Joven J. Chemokine (C-C motif) ligand 2 gene ablation protects low-density lipoprotein and paraoxonase-1 double deficient mice from liver injury, oxidative stress and inflammation. Biochim Biophys Acta Mol Basis Dis. 2019;1865:1555-1566. [PubMed] [DOI] |
| 15. | Wen Q, Liu J, Kang R, Zhou B, Tang D. The release and activity of HMGB1 in ferroptosis. Biochem Biophys Res Commun. 2019;510:278-283. [PubMed] [DOI] |
| 16. | Starkey Lewis P, Campana L, Aleksieva N, Cartwright JA, Mackinnon A, O'Duibhir E, Kendall T, Vermeren M, Thomson A, Gadd V, Dwyer B, Aird R, Man TY, Rossi AG, Forrester L, Park BK, Forbes SJ. Alternatively activated macrophages promote resolution of necrosis following acute liver injury. J Hepatol. 2020;73:349-360. [PubMed] [DOI] |
| 17. | Huang Y, Zang K, Shang F, Guo S, Gao L, Zhang X. HMGB1 mediates acute liver injury in sepsis through pyroptosis of liver macrophages. Int J Burns Trauma. 2020;10:60-67. [PubMed] |
| 18. | Shen CH, Ma ZY, Li JH, Li RD, Tao YF, Zhang QB, Wang ZX. Glycyrrhizin improves inflammation and apoptosis via suppressing HMGB1 and PI3K/mTOR pathway in lipopolysaccharide-induced acute liver injury. Eur Rev Med Pharmacol Sci. 2020;24:7122-7130. [PubMed] [DOI] |