修回日期: 2022-09-27
接受日期: 2022-10-20
在线出版日期: 2022-11-28
本研究旨在探究影响急性胰腺炎进程的潜在分子机制. 通过功能缺失实验分析H19敲低对细胞功能的影响. 并通过生物信息学预测以及实验验证确定H19与miR-30a-5p的互作关系. 我们推测H19可能通过靶向miR-30a-5p来促进急性胰腺炎进程.
研究lncRNA H19靶向miR-30a-5p对雨蛙肽诱导的急性胰腺炎细胞凋亡、炎症因子分泌和自噬的影响.
培养人胰腺AR42J细胞, 雨蛙肽诱导建立胰腺损伤细胞模型. 将实验分为雨蛙肽+si-NC组、雨蛙肽+si-H19组、雨蛙肽+miR-NC组、雨蛙肽+miR-30a-5p组、雨蛙肽+si-H19+anti-miR-NC组、雨蛙肽+si-H19+anti-miR-30a-5p组. 实时荧光定量PCR(RT-qPCR)检测细胞中H19和miR-30a-5p表达水平; 流式细胞术检测细胞凋亡; 酶联免疫吸附实验检测细胞中肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1β(interleukin-1β, IL-1β)和白介素-6(interleukin-6, IL-6)水平; 蛋白质印迹(Western blot)法检测细胞自噬相关的微管相关蛋白1轻链3(microtubule-associated protein1 light chain 3, LC3)-Ⅰ、LC3-Ⅱ蛋白表达. 双荧光素酶实验检测细胞中H19和miR-30a-5p靶向结合关系.
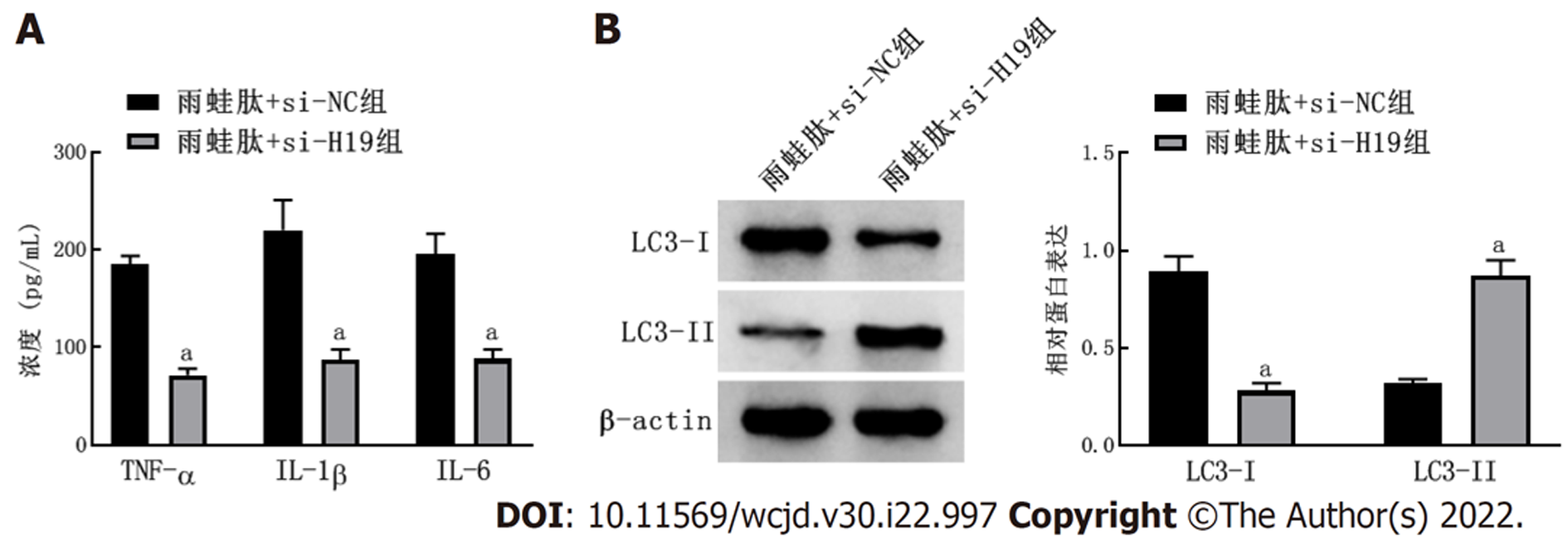
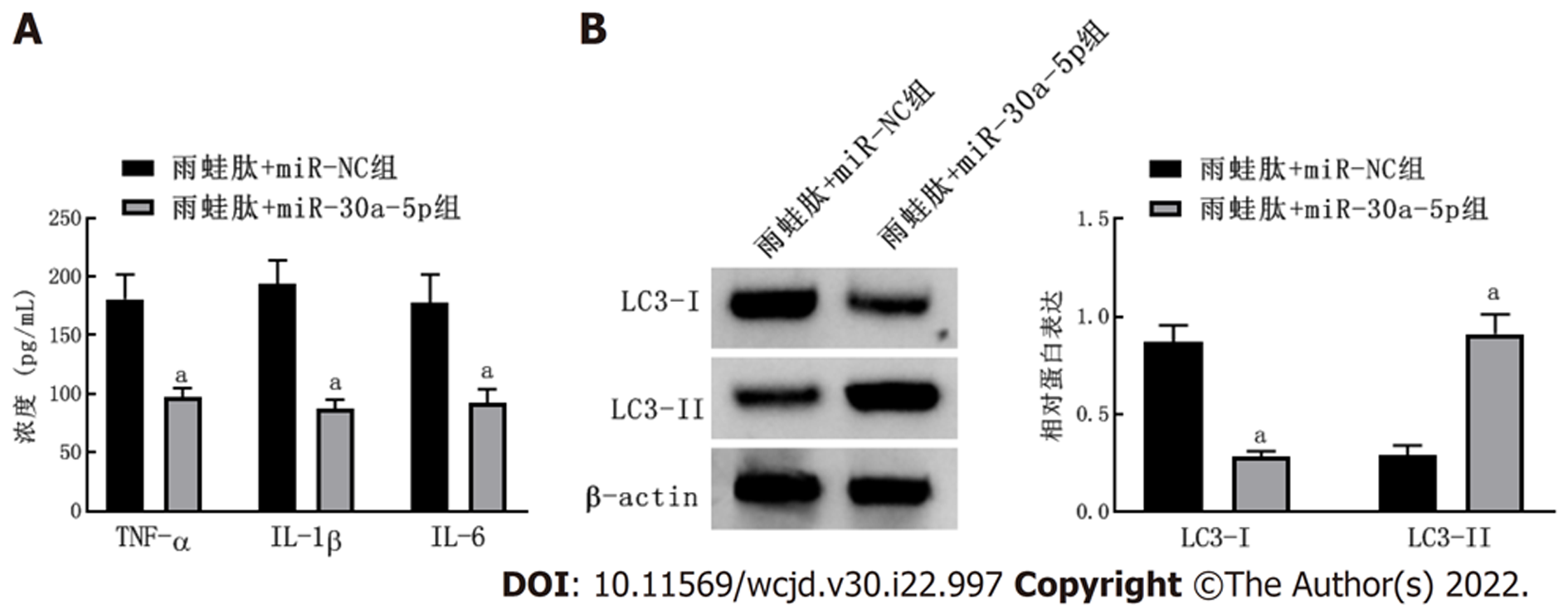
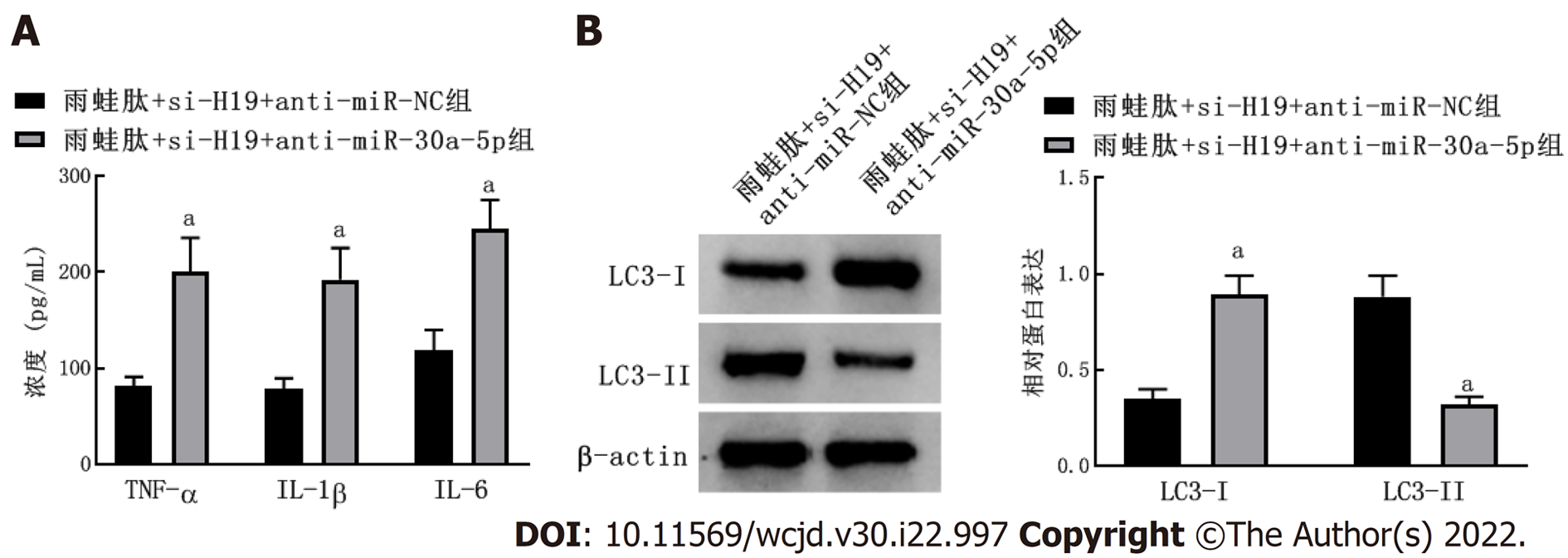
与正常胰腺细胞比较, 雨蛙肽诱导损伤的胰腺炎细胞中H19表达水平显著升高, miR-30a-5p表达水平显著降低(P<0.05). 与雨蛙肽+si-NC组比较, 雨蛙肽+si-H19组H19表达水平显著降低; 细胞存活率显著升高; TNF-α、IL-1β和IL-6水平显著降低; LC3-Ⅰ蛋白表达显著降低、LC3-Ⅱ蛋白表达显著升高(P<0.05). 与雨蛙肽+miR-NC组比较, 雨蛙肽+miR-30a-5p组miR-30a-5p表达水平显著升高; 细胞存活率显著升高; TNF-α、IL-1β和IL-6水平显著降低; LC3-Ⅰ蛋白表达显著降低、LC3-Ⅱ蛋白表达显著升高(P<0.05). 与雨蛙肽+si-H19+anti-miR-NC比较, 雨蛙肽+si-H19+anti-miR-30a-5p组miR-30a-5p表达显著降低; 细胞存活率显著降低; TNF-α、IL-1β和IL-6水平显著升高; LC3-Ⅰ蛋白表达显著升高、LC3-Ⅱ蛋白表达显著降低(P<0.05).
下调H19通过靶向miR-30a-5p来抑制雨蛙肽诱导的急性胰腺炎细胞凋亡、炎症因子分泌和自噬.
核心提要: H19在雨蛙肽诱导的胰腺炎细胞损伤模型中表达水平显著升高, 且其敲低可以抑制雨蛙肽诱导的细胞凋亡、炎症因子分泌和自噬. 此外, H19可以靶向miR-30a-5p, 且anti-miR-30a-5p可以逆转H19敲低对细胞损伤的抑制作用.
引文著录: 王春晖, 潘卓, 唐忠明. lncRNA H19靶向miR-30a-5p对雨蛙肽诱导的急性胰腺炎细胞凋亡、炎症因子分泌和自噬的影响. 世界华人消化杂志 2022; 30(22): 997-1003
Revised: September 27, 2022
Accepted: October 20, 2022
Published online: November 28, 2022
We hypothesized that H19 might promote the progression of acute pancreatitis by targeting miR-30a-5p.
To investigate the effect of lncRNA H19 targeting miR-30a-5p on cell apoptosis, secretion of inflammatory factors, and autophagy in a caerulein-induced acute pancreatitis cell model.
Human pancreatic AR42J cells were cultured and treated with caerulein to establish a pancreatic injury cell model. The cells were divided into cerulean + si-NC group, cerulean + si-H19 group, cerulean + miR-NC group, cerulean + miR-30a-5p group, cerulean + si-H19 + anti-miR-NC group, and cerulean + si-H19 + anti-miR-30a-5p group. Real-time fluorescence quantitative PCR was used to detect the expression levels of H19 and miR-30a-5p in cells; flow cytometry was used to detect apoptosis; enzyme-linked immunosorbent assay (ELISA) was used to detect TNF-α, IL-1β, and IL-6 levels; Western blot was used to detect autophagy-related microtubule-associated protein 1 light chain 3-Ⅰ(LC3-Ⅰ) and microtubule-associated protein 1 light chain 3-Ⅱ (LC3-Ⅱ) protein expression; dual luciferase assay was used to detect the target relationship between H19 and miR-30a-5p in cells.
Compared with normal pancreatic cells, H19 expression was increased and miR-30a-5p expression was decreased in pancreatitis cells induced by caerulein (P < 0.05). Compared with the cerulean + si-NC group, H19 expression was reduced, the cell survival rate was increased, the levels of TNF-α, IL-1β, and IL-6 were reduced, and LC3-Ⅰ protein expression was reduced and LC3-Ⅱ protein expression was increased in the cerulein+si-H19 group (P < 0.05). Compared with the caerulein + miR-NC group, miR-30a-5p expression was increased, the cell survival rate was increased, the levels of TNF-α, IL-1β, and IL-6 were decreased, and LC3-Ⅰ protein expression was reduced and LC3-Ⅱ protein expression was increased in the caerulein + miR-30a-5p group (P < 0.05). Compared with the cerulean + si-H19 + anti-miR-NC group, the expression of miR-30a-5p was significantly reduced, the cell survival rate was reduced, the levels of TNF-α, IL-1β, and IL-6 were increased, and LC3-Ⅰ protein expression was increased and LC3-Ⅱ protein expression was decreased in the cerulean + si-H19 + anti-miR-30a-5p group (P < 0.05).
Down-regulation of H19 inhibits the apoptosis, secretion of inflammatory factors, and autophagy in the acute pancreatitis cell model induced by caerulein by targeting miR-30a-5p.
- Citation: Wang CH, Pan Z, Tang ZM. Effect of lncRNA H19 targeting miR-30a-5p on cell apoptosis, secretion of inflammatory factors, and autophagy in caerulein-induced acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2022; 30(22): 997-1003
- URL: https://www.wjgnet.com/1009-3079/full/v30/i22/997.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i22.997
急性胰腺炎是胰腺的一种炎症性疾病, 轻症以胰腺水肿和出血为主, 重症可出现组织坏死, 预后较差[1,2]. 长链非编码RNA(long non-coding RNA, lncRNA)是一类不编码蛋白的RNA分子, 广泛参与细胞分化、增殖、凋亡和炎症等调控过程[3,4]. 如lncR-RGD1566401的上调表达能够促进大鼠急性胰腺炎AR42J细胞凋亡[5]. LncRNA浆细胞瘤多样异位基因1(plasmacytoma variant translocation 1, PVT1)可通过调控微小RNA(miR)-30a-5p表达, 促进胰腺腺泡细胞自噬, 加重急性胰腺炎[6]. LncRNA核内富集转录物1(nuclear enriched abundant transcript 1, NEAT1)下调可通过海绵miR-365a-3p缓解雨蛙肽诱导的腺泡细胞炎症损伤[7].
已有研究报道lncRNA H19在急性胰腺炎中异常表达, 与疾病严重程度有关[8]. 但lncRNA H19在胰腺腺泡细胞损伤中的作用及机制还有待进一步探究. 本研究利用雨蛙肽诱导胰腺AR42J细胞构建体外急性胰腺炎细胞模型, 以期揭示lncRNA H19在细胞损伤中的调控作用机制.
人胰腺AR42J细胞购自中科院上海细胞库; 改良Eagle培养基(dulbecco's modified eagle medium, DMEM)培养基购自美国Sigma公司; 胎牛血清(fetal bovine serum, FBS)购自美国Promega公司; 雨蛙肽购自美国BD公司; 脂质体Lipofectamine 2000购自美国Invitrogen公司; TRIzol试剂购自大连宝生物科技有限公司; 膜联蛋白V异硫氰酸荧光素(Annexin V fluorescein isothiocyanate, Annexin V-FITC)/碘化丙啶(propidium iodide, PI)凋亡试剂盒购自美国Cell Signaling公司; 肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1β(interleukin-1β, IL-1β)和白介素-6(interleukin-6, IL-6)检测试剂盒购自上海酶联生物科技有限公司; 二辛可宁酸(bicinchoninic acid, BCA)试剂盒购自北京天根生化科技公司.
1.2.1 细胞培养及处理: 胰腺AR42J细胞用含10% FBS的DMEM培养基培养, 置于37 ℃、5% CO2条件中, 待细胞融合至60%-90%时, 更换含有浓度100 nM雨蛙肽的培养基继续培养24 h, 建立胰腺损伤细胞模型.
细胞转染和分组: 使用Lipofectamine 2000转染试剂, 根据试剂说明书, 分别将终浓度为30 nM-50 nM的si-NC、si-H19、miR-NC、miR-30a-5p、si-H19与anti-miR-NC、si-H19与anti-miR-30a-5p转染AR42J细胞. 转染48 h后, 更换常规培养基培养24 h, 然后再更换含100 nM雨蛙肽的培养基培养24 h, 根据转染基因不同, 分别将细胞记为雨蛙肽+si-NC组、雨蛙肽+si-H19组、雨蛙肽+miR-NC组、雨蛙肽+miR-30a-5p组、雨蛙肽+si-H19+anti-miR-NC组、雨蛙肽+si-H19+anti-miR-30a-5p组.
1.2.2 RT-qPCR检测H19和miR-30a-5p表达水平: 采用TRIzol试剂提取各组细胞总RNA, 反转录试剂盒将RNA反转录为cDNA. 使用SYBR Green qPCR Master Mix试剂盒进行RT-PCR反应. 循环条件为95 ℃ 5 min, 95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s, 共40个循环, 60 ℃延长5 min. 2-ΔΔCt方法计算H19和miR-30a-5p相对表达水平.
1.2.3 流式细胞术检测细胞凋亡: 各组细胞培养48 h后用预冷的PBS漂洗2次, 与500 μL的结合缓冲液混匀. 先加入10 μL的Annexin V-FITC, 再加入5 μL的PI, 混匀后避光孵育10 min. 用流式细胞仪检测细胞凋亡率.
1.2.4 ELISA试剂盒检测TNF-α、IL-1β和IL-6水平: 采用酶联免疫吸附实验(enzyme linked immunosorbent assay, ELISA)试剂检测TNF-α、IL-1β和IL-6水平, 按照试剂盒附带的说明书进行实验步骤.
1.2.5 双荧光素酶报告实验检测H19和miR-30a-5p的靶向关系: 将含有miR-30a-5p结合位点的H19野生型(wild-type, WT)序列或突变型(mutant-type, MUT)序列克隆到荧光素酶报告质粒, 构建成荧光素酶报告基因载体WT-H19和MUT-H19. 将miR-30a-5p、miR-NC分别与WT-H19或者MUT-H19共转染至雨蛙肽诱导AR42J细胞, 测定各组细胞的荧光素酶活性. 并将si-NC、si-H19、pcDNA-NC、pcDNA-H19分别转染至雨蛙肽诱导AR42J细胞中, 参照RT-qPCR步骤检测细胞miR-30a-5p表达水平.
统计学处理 采用SPSS 20.0软件进行统计学分析, 计量资料用平均数±标准差(mean±SD)表示, 两组比较行t检验, 多组间比较采用单因素方差分析, 组间两两比较采用LSD-t检验. 统计学显著性用aP<0.05表示, 同一表中另一套P值, 则用cP<0.05.
与正常胰腺细胞比较, 雨蛙肽诱导损伤的胰腺炎细胞中H19表达水平显著升高, miR-30a-5p表达水平显著降低(P<0.05). 见表1.
与雨蛙肽+si-NC组比较, 雨蛙肽+si-H19组H19表达水平显著降低; 细胞存活率显著升高; TNF-α、IL-1β和IL-6水平显著降低; 微管相关蛋白1轻链3(microtubule-associated protein1 light chain 3, LC3)-I蛋白表达显著降低、LC3-II蛋白表达显著升高(P<0.05). 见表2和图1.
与雨蛙肽+miR-NC组比较, 雨蛙肽+miR-30a-5p组miR-30a-5p表达水平显著升高; 细胞存活率显著升高; TNF-α、IL-1β和IL-6水平显著降低; LC3-I蛋白表达显著降低、LC3-Ⅱ蛋白表达显著升高(P<0.05). 见表3和图2.
LncBase Predicted v.2预测H19和miR-30a-5p之间存在结合位点, 见图3. 双荧光素酶报告显示, 与转染miR-NC比较, 转染miR-30a-5p可降低WT-H19的相对荧光素酶活性(P<0.05), 而对MUT-H19的相对荧光素酶活性无显著影响(P>0.05), 见表4.
| 组别 | 荧光素酶活性 | |
| WT-H19 | MUT-H19 | |
| 雨蛙肽+miR-NC | 1.02±0.09 | 1.01±0.09 |
| 雨蛙肽+miR-30a-5p | 0.37±0.04a | 1.00±0.10 |
| t | 15.884 | 0.553 |
| P | 0.000 | 0.749 |
RT-qPCR检测显示, 与雨蛙肽+si-NC组比较, 雨蛙肽+si-H19组细胞miR-30a-5p表达水平显著升高(P<0.05); 与雨蛙肽+pcDNA-NC组比较, 雨蛙肽+pcDNA-H19组细胞miR-30a-5p表达水平显著降低(P<0.05), 见表5.
与雨蛙肽+si-H19+anti-miR-NC比较, 雨蛙肽+si-H19+anti-miR-30a-5p组miR-30a-5p表达显著降低; 细胞存活率显著降低; TNF-α、IL-1β和IL-6水平显著升高; LC3-Ⅰ蛋白表达显著升高、LC3-Ⅱ蛋白表达显著降低(P<0.05). 见表6和图4.
急性胰腺炎是一种比较常见的消化系统疾病, 成年人发病概率比较高, 根据病理分型可分为间质水肿型和坏死型两种. 引起该病的病因非常多, 在我国最常见的是胆石症、酒精和高脂血症[9,10].
LncRNA H19在急性胰腺炎患者的血清中表达升高, 且对于急性胰腺炎诊断和严重程度的预判具有一定临床价值[11]. 重症急性胰腺炎大鼠胰腺中miR-30a-5p表达显著降低[12]. 本实验研究发现, 与正常胰腺细胞比较, 雨蛙肽诱导急性胰腺炎细胞中H19表达水平显著升高, miR-30a-5p表达水平显著降低. 此外, 有研究表明沉默lncRNA H19可减少雨蛙素诱导的胰腺腺泡细胞凋亡, 其可能成为治疗急性胰腺炎的潜在有效靶点[13]. 本实验研究表明, 与雨蛙肽+si-NC组比较, 雨蛙肽+si-H19组H19表达水平显著降低; 细胞存活率显著升高; TNF-α、IL-1β和IL-6水平显著降低; LC3-I蛋白表达显著降低、LC3-Ⅱ蛋白表达显著升高.
miRNA是一类长度约19-22个核苷酸的非编码RNA, 是重要的转录后调控因子[14,15]. 已经有研究报道, miR-155抑制剂能够降低重症急性胰腺炎大鼠炎症因子, 减轻重症急性胰腺炎急性肺损伤[16]. 急性胰腺炎患者外周血miR-16和miR-192表达及其与病情严重程度密切相关[17]. miR-7a-5p可促进急性胰腺炎腺泡细胞凋亡并降低细胞增殖能力[18]. 本实验研究结果, 与雨蛙肽+miR-NC组比较, 雨蛙肽+miR-30a-5p组miR-30a-5p表达水平显著升高; 细胞存活率显著升高; TNF-α、IL-1β和IL-6水平显著降低; LC3-I蛋白表达显著降低、LC3-Ⅱ蛋白表达显著升高.
本实验研究显示, 与雨蛙肽+si-H19+anti-miR-NC比较, 雨蛙肽+si-H19+anti-miR-30a-5p组miR-30a-5p表达显著降低; 细胞存活率显著降低; TNF-α、IL-1β和IL-6水平显著升高; LC3-Ⅰ蛋白表达显著升高、LC3-Ⅱ蛋白表达显著降低. 有类似的研究报道与本实验一致. LncRNA β-1,3半乳糖基转移酶-反义5(β-1,3-galactosyltransferase 5-AS1, B3GALT5-AS1)靶向miR-361-3p调节大鼠胰腺腺泡细胞增殖及凋亡[19]. miR-141-3p靶向调控CUE结构域蛋白2(CUE domain-containing protein 2, CUEDC2)基因影响雨蛙素诱导的大鼠胰腺腺泡细胞损伤[20]. miR-7靶向特异性蛋白3(specific protein 3, Sp3)影响急性胰腺炎腺泡细胞增殖和凋亡[21].
综上所述, 下调H19靶向上调miR-30a-5p抑制雨蛙肽诱导的急性胰腺炎细胞凋亡、炎症因子分泌和自噬.
急性胰腺炎是一种死亡率较高的严重疾病, 严重威胁着人类健康. 探究影响急性胰腺炎进程的分子机制, 有望为其治疗提供理论依据.
许多长链非编码RNA被证实参与了急性胰腺炎进程, 但是H19在急性胰腺炎进程中的作用和潜在分子机制值得进一步揭示. 对H19作用的探究可能为其成为急性胰腺炎的治疗靶点提供证据.
本研究希望通过揭示调控急性胰腺炎进程的潜在分子机制, 为急性胰腺炎的治疗提供有效分子靶点.
雨蛙肽诱导建立胰腺损伤细胞模型. 通过细胞计数实验和流式细胞术检测细胞活力和凋亡; 酶联免疫吸附实验评估炎症因子的分泌; 蛋白质印迹法检测细胞自噬相关蛋白表达. 双荧光素酶实验检测细胞中H19和miR-30a-5p靶向结合关系.
H19敲低可以改善雨蛙肽诱导的急性胰腺炎细胞凋亡、炎症和自噬. H19可以靶向miR-30a-5p, 且其敲低对雨蛙肽诱导的急性胰腺炎细胞损伤的影响可以被miR-30a-5p抑制剂所逆转.
H19通过靶向miR-30a-5p促进雨蛙肽诱导的急性胰腺炎细胞损伤, 表明其可能对急性胰腺炎进程有促进作用.
H19可能是急性胰腺炎治疗的潜在分子靶点. 未来可以在临床水平以及动物水平进一步证实H19/miR-30a-5p调控急性胰腺炎进程的结论.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Paragomi P, Phillips AE, Machicado JD, Lahooti A, Kamal A, Afghani E, Pothoulakis I, Reynolds SL, Mays M, Conwell DL, Lara LF, Singh VK, Papachristou GI. Post-Acute Pancreatitis Pancreatic Exocrine Insufficiency: Rationale and Methodology of a Prospective, Observational, Multicenter Cohort Study. Pancreas. 2021;50:147-152. [PubMed] [DOI] |
| 3. | Nojima T, Proudfoot NJ. Mechanisms of lncRNA biogenesis as revealed by nascent transcriptomics. Nat Rev Mol Cell Biol. 2022;23:389-406. [PubMed] [DOI] |
| 4. | Senmatsu S, Hirota K. Roles of lncRNA transcription as a novel regulator of chromosomal function. Genes Genet Syst. 2021;95:213-223. [PubMed] [DOI] |
| 5. | 张 旭, 付 强, 秦 涛, 刘 传江, 胡 明星, 张 宏伟. 长链非编码RNA RGD1566401在大鼠急性胰腺炎中对外分泌细胞凋亡的作用. 中华实验外科杂志. 2018;35:100-102. [DOI] |
| 6. | Hu F, Tao X, Zhao L, Guo F, Zhou Q, Song H, Xiang H, Shang D. LncRNA-PVT1 aggravates severe acute pancreatitis by promoting autophagy via the miR-30a-5p/Beclin-1 axis. Am J Transl Res. 2020;12:5551-5562. [PubMed] [DOI] |
| 7. | Shao A, Hu W, Li C, Yang Y, Zhu J. Downregulation of lncRNA NEAT1 Relieves Caerulein-Induced Cell Apoptosis and Inflammatory Injury in AR42J Cells Through Sponging miR-365a-3p in Acute Pancreatitis. Biochem Genet. 2022;. [PubMed] [DOI] |
| 8. | Song G, Zhou J, Song R, Liu D, Yu W, Xie W, Ma Z, Gong J, Meng H, Yang T, Song Z. Long noncoding RNA H19 regulates the therapeutic efficacy of mesenchymal stem cells in rats with severe acute pancreatitis by sponging miR-138-5p and miR-141-3p. Stem Cell Res Ther. 2020;11:420. [PubMed] [DOI] |
| 9. | Li L, Li YQ, Sun ZW, Xu CM, Wu J, Liu GL, Bakheet AM, Chen HL. Qingyi decoction protects against myocardial injuries induced by severe acute pancreatitis. World J Gastroenterol. 2020;26:1317-1328. [PubMed] [DOI] |
| 10. | Olesen SS, Harakow A, Krogh K, Drewes AM, Handberg A, Christensen PA. Hypertriglyceridemia is often under recognized as an aetiologic risk factor for acute pancreatitis: A population-based cohort study. Pancreatology. 2021;21:334-341. [PubMed] [DOI] |
| 12. | 项 红, 胡 凤林, 陶 旭锋, 齐 心, 张 金楠, 尚 东. 茵陈蒿汤调控lncRNA PVT1/miRNA-30a-5p信号通路对重症急性胰腺炎大鼠模型的保护作用. 临床肝胆病杂志. 2021;37:147-152. [DOI] |
| 14. | Woods BJ, Van Vactor D. miRNA: local guardians of presynaptic function in plasticity and disease. RNA Biol. 2021;18:1014-1024. [PubMed] [DOI] |
| 15. | Wang X, He Y, Mackowiak B, Gao B. MicroRNAs as regulators, biomarkers and therapeutic targets in liver diseases. Gut. 2021;70:784-795. [PubMed] [DOI] |
| 16. | 邱 兆磊, 王 振杰, 程 峰, 宋 琦, 姜 海, 杜 召辉, 张 福龙, 赵 亨, 王 世杰, 邵 志林, 陈 硬, 王 如意. microRNA-155对重症急性胰腺炎大鼠急性肺损伤作用的研究. 右江民族医学院学报. 2020;42:151-154. [DOI] |
| 17. | 刘 兴涛, 王 天舒, 覃 海森, 曹 举潮, 黄 帅. 急性胰腺炎患者外周血miRNA-16和miRNA-192表达及其与病情严重程度的相关性. 岭南急诊医学杂志. 2021;26:348-351. [DOI] |