修回日期: 2022-08-20
接受日期: 2022-10-20
在线出版日期: 2022-11-08
五味子甲素(schizandrin A, SchA)在多种肿瘤中具有抗癌和逆转多药耐药性的作用, 但其对奥沙利铂(oxaliplatin, L-OHP)在结直肠癌细胞的作用并不清楚.
探讨SchA是否能增强L-OHP对结直肠癌细胞的杀伤作用, 并分析其机制.
将结直肠癌细胞分为对照组、SchA处理组、L-OHP处理组和SchA+L-OHP联合处理组. 用噻唑蓝(methyl thiazolyl tetrazolium, MTT)法检测细胞活力; 流式细胞术法检测细胞凋亡; 活性氧簇(reactive oxygen species, ROS)探针检测细胞ROS含量; 5,5',6,6'-四氯-1,1',3,3'-四乙基苯并咪唑羰花青碘化物(1,1',3,3'-tetraethyl-5,5',6,6'-tetrachloroimidacarbocyanine iodide, JC-1)探针评估线粒体膜电位变化; Western blot检测 B-细胞淋巴瘤-2(B-cell lymphoma 2, Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)、细胞色素c(cytochrome c, Cyt c)和劈开的半胱氨酸蛋白酶-3(cleaved cysteine proteinase-3, cleaved caspase-3)的表达.
与L-OHP处理组比较, SchA +L-OHP联合处理组的结直肠癌细胞的细胞活力明显降低, 细胞凋亡明显增加. SchA能增强L-OHP导致的结直肠癌细胞内ROS蓄积、Bax和cleaved caspase-3表达、线粒体Cyt c释放, 并降低Bcl-2表达.
SchA增强L-OHP对结直肠癌细胞的杀伤作用, 其机制可能与增强细胞内ROS蓄积以及促凋亡相关蛋白表达相关.
核心提要: 约有30%-50%的结直肠癌患者对其一线化疗药物奥沙利铂(oxaliplatin, L-OHP)不敏感, 因此需寻求L-OHP增敏的策略. 本研究显示五味子甲素能通过增加L-OHP诱导的结直肠癌细胞内活性氧簇蓄积和线粒体相关凋亡途径的信号活性来增强L-OHP对细胞的杀伤作用.
引文著录: 易弼顺, 马柏强, 李冰震, 邢永俊. 五味子甲素增强奥沙利铂对结直肠癌细胞的杀伤作用. 世界华人消化杂志 2022; 30(21): 956-963
Revised: August 20, 2022
Accepted: October 20, 2022
Published online: November 8, 2022
Schizandrin A (SchA) has anticancer and multidrug resistance-reversing effects in a variety of tumors, but its effect on oxaliplatin (L-OHP) in colorectal cancer cells is not clear.
To investigate whether SchA can enhance the killing effect of L-OHP on colorectal cancer cells, and to analyze the possible mechanism involved.
Colorectal cancer cells were divided into control group, SchA treatment group, L-OHP treatment group, and SchA + L-OHP treatment group. Cell viability was detected by MTT assay. Cell apoptosis was detected by flow cytometry. The contents of reactive oxygen species (ROS) in cells was detected using a ROS probe. Mitochondrial membrane potential was evaluated by using the 1,1',3,3'-tetraethyl-5,5',6,6'-tetrachloroimidacarbocyanine iodide (JC-1) probe. Western blot was used to detect the expression of B-cell lymphoma 2 (Bcl-2), Bcl-2 associated X protein (Bax), cytochrome c (Cyt c), and cleaved cysteine proteinase-3 (caspase-3) in the cells.
Compared with the L-OHP treatment group, the viability of colorectal cancer cells in the SchA + L-OHP treatment group was significantly decreased, while apoptosis was significantly increased. SchA could enhance ROS accumulation, Bax and cleaved caspase-3 expression, and mitochondrial Cyt c release, and decrease Bcl-2 expression in colorectal cancer cells induced by L-OHP.
SchA enhances the killing effect of L-OHP on colorectal cancer cells, and the mechanism may be related to the enhancement of intracellular ROS accumulation and the expression of apoptosis-related proteins.
- Citation: Yi BS, Ma BQ, Li BZ, Xing YJ. Schizandrin A enhances killing effect of oxaliplatin on colorectal cancer cells. Shijie Huaren Xiaohua Zazhi 2022; 30(21): 956-963
- URL: https://www.wjgnet.com/1009-3079/full/v30/i21/956.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i21.956
结直肠癌是当今世界最常见的癌症之一, 其发病率和死亡率呈上升趋势[1,2]. 据报道, 全球每年约有90万人死于结直肠癌[3]. 在中国, 结直肠癌的发病率约为14.2/10万, 死亡率约为7.4/10万, 结直肠癌病死率为14.0%[4]. 约70%以上的结直肠癌患者在就诊时即处于进展期, 化疗是结直肠癌的基本治疗方法[5,6], 其中奥沙利铂(oxaliplatin, L-OHP)是结直肠癌化疗的一线药物[7]. 其中约有30%-50%的结直肠患者对L-OHP化疗应答效果不理想, 导致复发甚至病情恶化[8], 因此, 寻找提高L-OHP敏感性的策略已成为化疗亟待解决的问题.
据报道[9], 源自中草药的天然活性成分对预防和治疗癌症有益. 五味子甲素(schizandrin A, SchA)是一种从北五味子干燥果实中提取的木脂素类化合物, 其具有抗炎、免疫调节和肝肾保护等功效[10-12]. 据最近报道[13-16], SchA(剂量>30 μM)在结肠癌、乳腺癌和肺癌等多种肿瘤中具有抗癌以及逆转p-糖蛋白介导的癌细胞的多药耐药性的作用. 但另有研究发现[17], 其在小剂量(<20 μM)时能增强乳腺癌阿霉素(doxorubicin, DOX)耐药细胞MCF-7/DOX对DOX敏感, 但其并不影响肝癌DOX耐药细胞(BEL-7402/DOX和HepG2/DOX)以及白血病DOX耐药细胞(K-562/DOX)的DOX敏感性. 因此, 若要阐明SchA的抗肿瘤作用和其对化疗药物的相互作用应采用不同种类的肿瘤细胞以及不同的SchA剂量范围. 本研究主要评估小剂量SchA对L-OHP在结直肠癌细胞的抗肿瘤活性的影响.
1.1.1 主要试剂: SchA试剂(纯度98%, 货号: R094260)购自上海易恩化学技术有限公司; L-OHP试剂(纯度98%, 货号: BD146411)购自上海毕得医药科技股份有限公司; 噻唑蓝(methyl thiazolyl tetrazolium, MTT)试剂盒(货号: T6126)购自上海麦克林生化科技有限公司; 异硫氰酸荧光素标记膜联蛋白V/碘化丙啶(fluorescein isothiocyanate labeled annexin V/Propidium iodide, Annexin V-FITC/PI)试剂盒(货号: KGA107)、活性氧簇(reactive oxygen species, ROS)活性氧检测试剂盒 H2DCFDA(货号: KGAF018)和5,5',6,6'-四氯-1,1',3,3'-四乙基苯并咪唑羰花青碘化物(1,1',3,3'-tetraethyl-5,5',6,6'-tetrachloroimidacarbocyanine iodide, JC-1)探针线粒体膜电位检测试剂盒(货号: KGA603)购自江苏凯基生物技术股份有限公司; 细胞裂解液(货号: P0013C)、细胞线粒体蛋白分离试剂盒(货号: C3601)、极超敏电化学发光(electro-chemi-luminescence, ECL)试剂盒(货号: P0018FM)、辣根过氧化物酶标记山羊抗兔IgG(H+L)二抗(货号: A0208)、劈开的半胱氨酸蛋白酶-3(cleaved cysteine proteinase-3, cleaved caspase-3)抗体(货号: AC033)、细胞色素c(cytochrome c, Cyt c)(货号: AF2047)、环氧合酶Ⅳ(cyclooxygenase Ⅳ, COX Ⅳ)(货号: AF6549)和β-肌动蛋白(β-actin; 货号: AF5003)抗体购自上海碧云天生物科技有限公司; B细胞淋巴瘤-2(B cell lymphoma-2, Bcl-2)抗体(货号: BS1511)和Bcl-2相关X蛋白(Bcl-2 associated X protein, Bax)抗体(货号: BS6420)均购自南京巴傲得生物科技有限公司.
1.1.2细胞培养: 结直肠癌细胞系(SW480和HT-29)购自中国科学院上海细胞库, 将其置于含10%胎牛血清(美国PAA公司)的达尔伯克改良伊格尔培养基(dulbecco's modified eagle medium, DMEM)细胞培养液(美国Corning公司)中培养, 培养条件为37 ℃和5% CO2.
1.2.1 MTT实验检测细胞活性: 当SW480和HT-29细胞处于对数生长期时, 将细胞分别铺在96孔(每孔5000个细胞)板中, 分别给予不同浓度[(0、0.5、1、2、4、8、16) μmol/L]L-OHP、不同浓度[(0、2、4、8、10、20) μmol/L]SchA或2 μmol/L L-OHP联合不同浓度[(4、8、10、20) μmol/L]SchA处理24 h. 每孔加入10 μL MTT试剂, 37 ℃孵育4 h, 加入二甲基亚砜溶解结晶后, 酶标仪检测各孔450 nm波长处的吸光度值.
1.2.2 流式细胞术检测细胞凋亡: SW480和HT-29细胞分别给予2 μmol/L L-OHP联合10 μmol/L SchA处理24 h. 消化收集细胞, 按照Annexin V-FITC/PI试剂盒的说明书步骤, 分别避光孵育Annexin V-FITC和PI试剂各10 min, 最后上流式细胞仪检测细胞凋亡情况.
1.2.3 H2DCFDA探针检测ROS蓄积: SW480和HT-29细胞分别给予2 μmol/L L-OHP联合10 μmol/L SchA处理24 h, 用磷酸盐缓冲液(phosphate buffer solution, PBS)洗涤2次, 按照ROS活性氧检测试剂盒H2DCFDA的说明书步骤, 分别避光孵育 H2DCFDA试剂30 min, PBS洗涤2次后, 荧光显微镜下观察, 并统计荧光强度.
1.2.4 JC-1探针评估线粒体膜电位: SW480和HT-29细胞分别给予2 μmol/L L-OHP联合10 μmol/L SchA处理24 h, 用PBS洗涤2次, 按照JC-1探针线粒体膜电位检测试剂盒的说明书步骤, 分别避光孵育JC-1染色试剂20 min, PBS洗涤2次后, 荧光显微镜下观察, 并分别统计绿色/红色荧光强度. 线粒体膜电位以绿色/红色荧光强度的倒数表示.
1.2.5 Western blot分析: SW480和HT-29细胞分别给予2 μmol/L L-OHP联合10 μmol/L SchA处理24 h. 用细胞裂解液裂解细胞并提取总蛋白, 用细胞线粒体蛋白分离试剂盒分别提取细胞浆蛋白与线粒体蛋白. 取蛋白按照常规Western blot步骤进行转印. 将已转印蛋白的聚偏二氟乙烯膜用5%脱脂奶粉封闭30 min后, 分别室温孵育一抗(Bcl-2、Bax、Cyt c、cleaved caspase-3、COX Ⅳ和β-actin; 均1:2000稀释)2 h, 洗膜后, 孵育1:2000稀释的辣根过氧化物酶标记山羊抗兔IgG(H+L)二抗1 h, 再次洗膜后, 用ECL显影系统显像, 并以β-actin为总蛋白和浆蛋白的内参, 以COX Ⅳ为线粒体蛋白的内参, 定量目的条带的相对表达量.
统计学处理 数据表示为3个独立实验的平均值±标准差(mean±SD). 使用SPSS 20.0软件进行统计学分析. 通过使用单因素方差分析分析组之间的差异, 然后对均数进行Tukey-ramer多重比较检验, P<0.05则认为差异具备统计学意义.
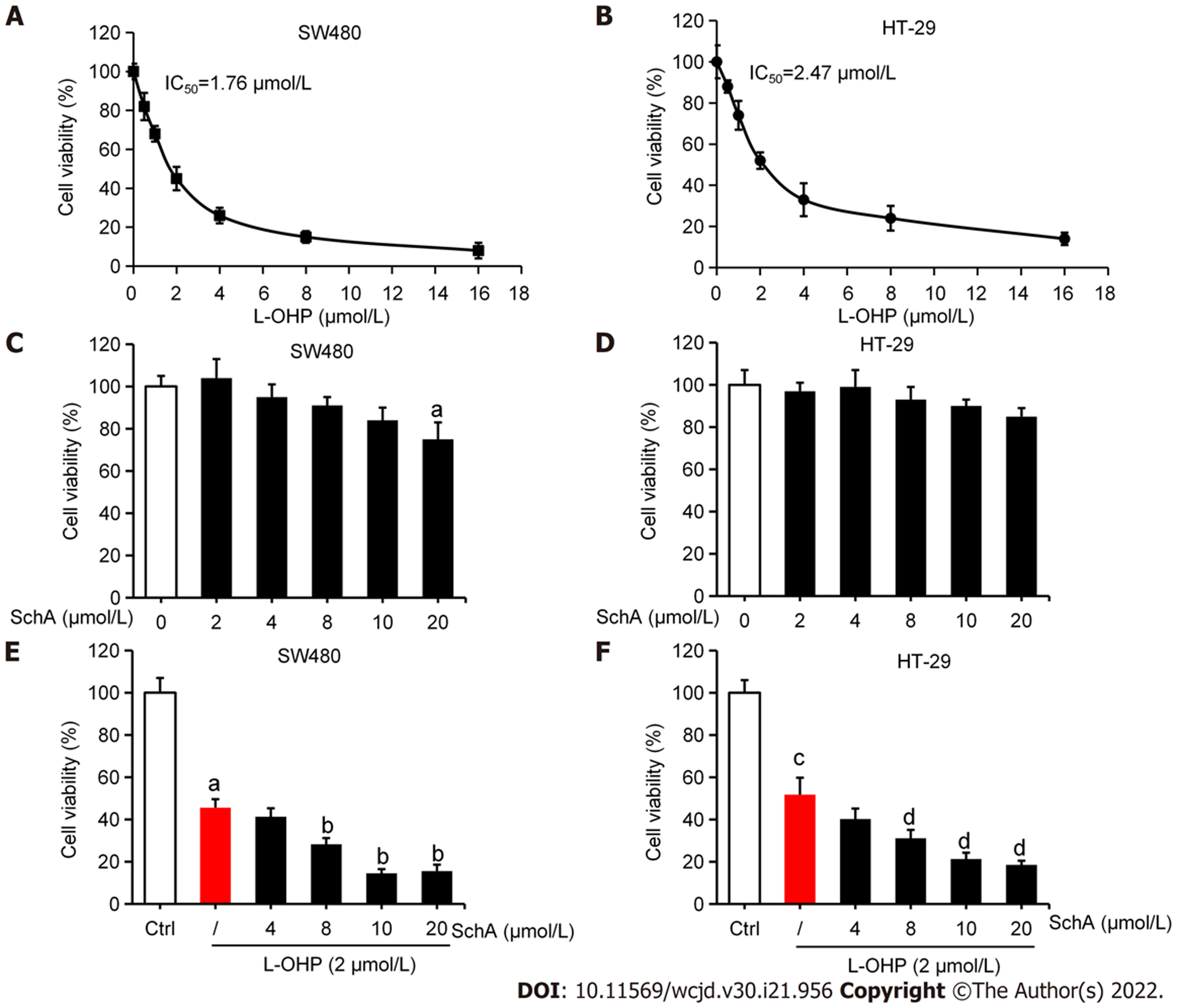
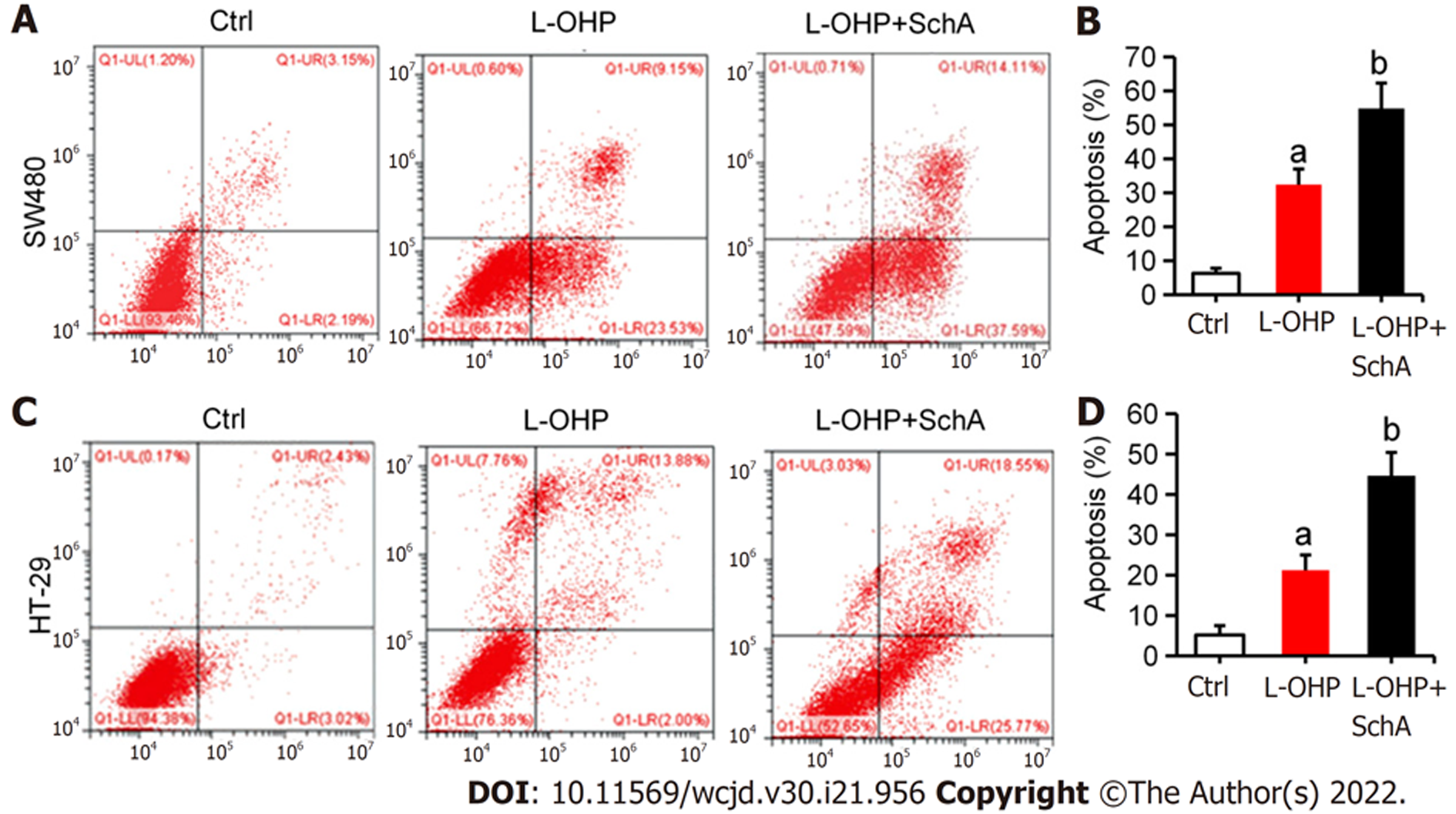
为研究SchA是否影响结直肠细胞的L-OHP敏感性, 本研究首先用梯度浓度的L-OHP处理SW480和HT-29 结直肠癌细胞24 h, 发现L-OHP可浓度依赖性抑制SW480和HT-29的细胞活性, SW480细胞L-OHP的IC50 = 1.76 μmol/L, HT-29细胞L-OHP的IC50 = 2.47 μmol/L(图1A和B). 用梯度浓度的SchA处理SW480和HT-29细胞, 发现在(0-10) μmol/L浓度范围内SchA不影响此俩者的细胞活性(图1C和D). 将SchA[(4-20) μmol/L]和L-OHP(2 μmol/L)联合处理SW480和HT-29 细胞24 h, 用MTT检测, 结果发现, 与单用L-OHP处理组比较, SchA浓度为(8-20) μmol/L时的联合用药组中SW480(图1E)和HT-29(图1F)的细胞活性均明显降低(均P<0.05). 进一步将SchA(10 μmol/L)和L-OHP(2 μmol/L)联合处理SW480和HT-29细胞24 h, 流式细胞术结果显示, 与单用L-OHP处理组比较, SchA能增强L-OHP诱导的SW480(图2A和B)和HT-29(图2C和D)细胞凋亡(均P<0.05). 综上, SchA能增强L-OHP对结直肠癌细胞的杀伤作用.
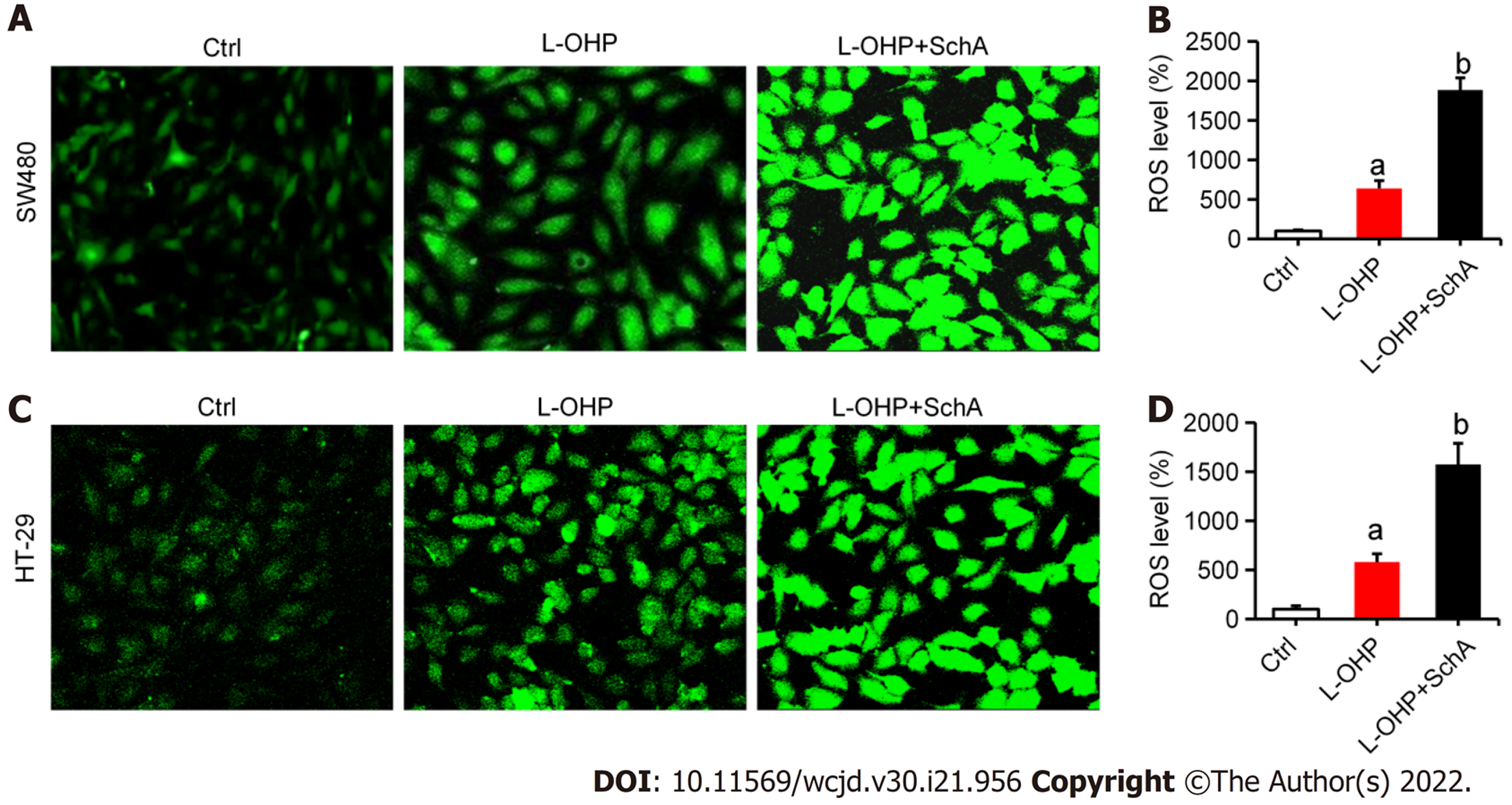
ROS探针结果显示, 与对照组比较, L-OHP(2 μmol/L)能增加SW480(图3A和B)和HT-29(图3C和D)细胞中ROS蓄积水平(均P<0.05), SchA(10 μmol/L)能进一步增强L-OHP诱导的ROS蓄积(均P<0.05).
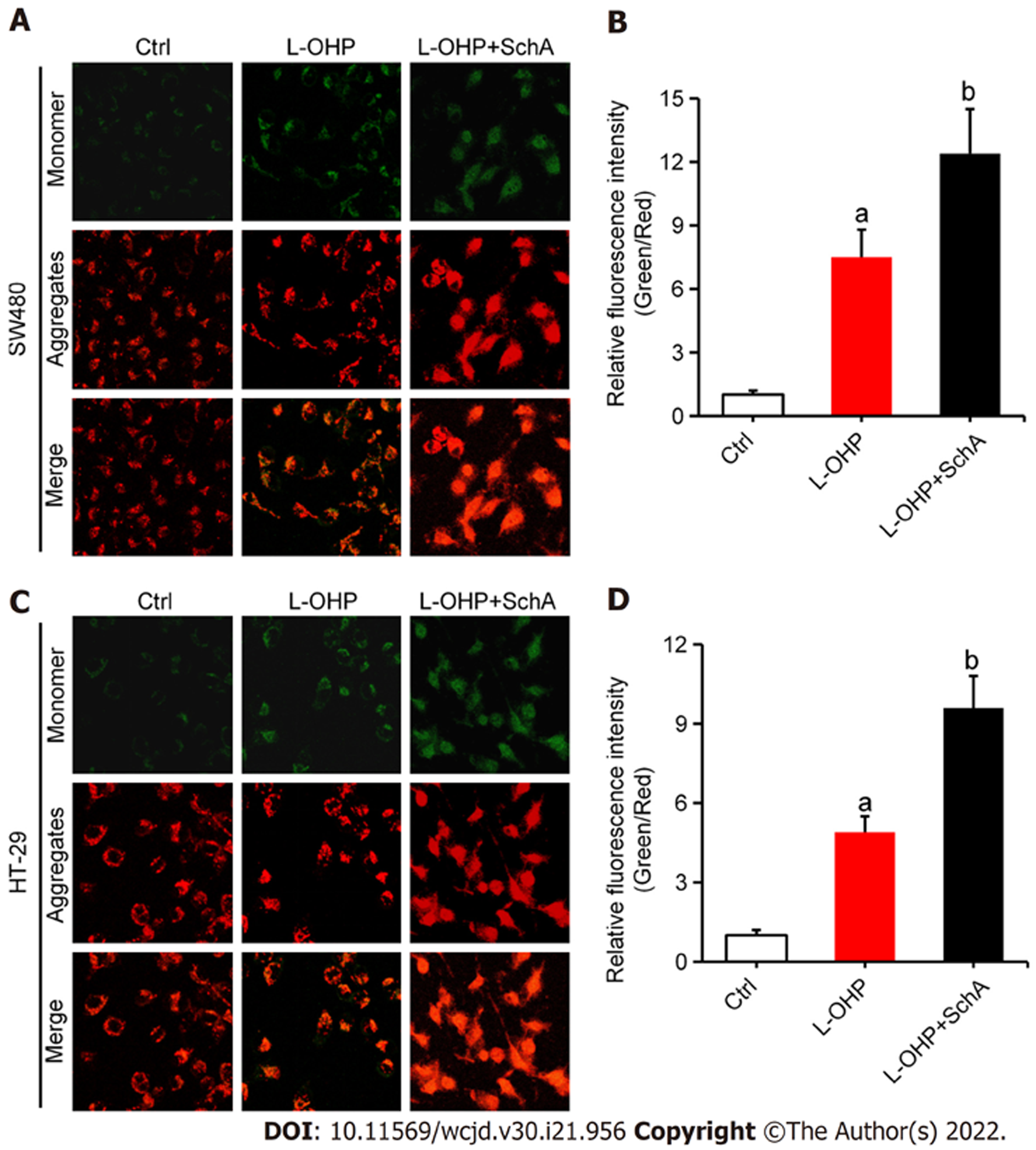
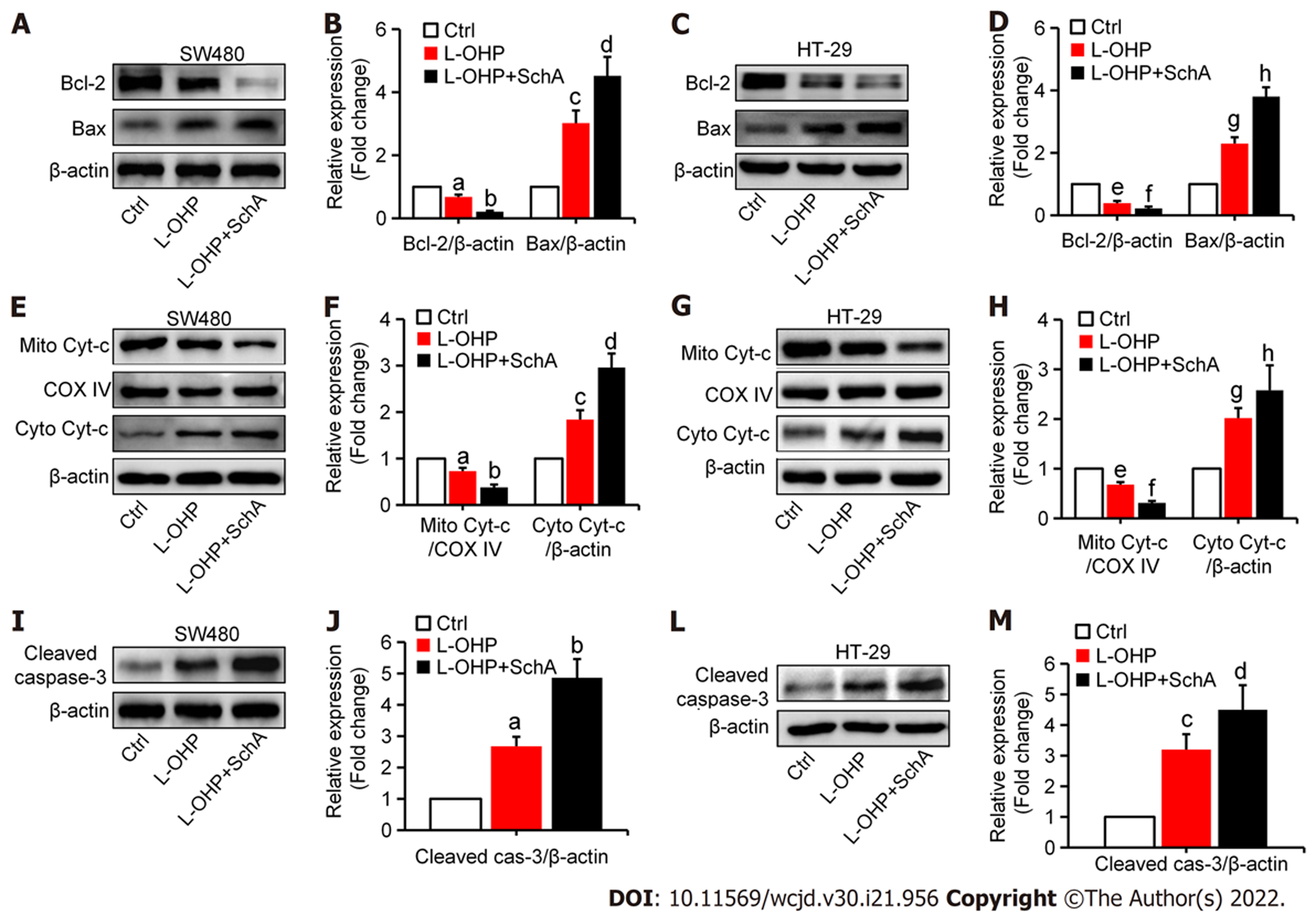
JC-1探针结果(图4)显示, 与对照组比较, L-OHP(2 μmol/L)能降低SW480(图4A和B)和HT-29(图4C和D)细胞中线粒体膜电位水平(均P<0.05); 与单用L-OHP处理组比较, SchA(10 μmol/L)与L-OHP(2 μmol/L)联合处理组的SW480(图3B和4A)和HT-29(图3D和4C)细胞中线粒体膜电位水平更低(均P<0.05). 进一步用Western blot检测线粒体凋亡相关蛋白的表达, 结果(图5)显示, 与对照组比较, L-OHP(2 μmol/L)能降低SW480(图5A, B, E, F, I, J)和HT-29(图5C, D, G, H, L, M)细胞中Bcl-2和线粒体Cyt c表达水平并增加Bax、细胞浆Cyt c和cleaved caspase-3表达水平(均P<0.05); 与单用L-OHP处理组比较, SchA(10 μmol/L)与L-OHP(2 μmol/L)联合处理组SW480(图5A, B, E, F, I, J)和HT-29(图5C, D, G, H, L, M)细胞中Bcl-2和线粒体Cyt c表达水平明显降低且Bax、细胞浆Cyt c和cleaved caspase-3表达水平明显增高(均P<0.05).
结直肠癌是我国最常见的癌症之一. 近几十年来, L-OHP一直被用作结直肠癌治疗的一线药物[7]. 临床使用发现, L-OHP对部分转移性或耐药性的结直肠癌患者的客观缓解率并不理想[8]. 因此, 提高L-OHP的化疗敏感性至关重要. 近些年, 研究显示许多来源于天然中草药的小分子化合物能在肿瘤的放化疗中发挥增敏效应[18,19]. SchA是一种从北五味子提取的活性化合物, 累积的证据表明它对多种癌细胞具有抗肿瘤活性[12-16], 且已被发现能增强阿霉素和吉非替尼等药物效应[17,20]. 然而, SchA对结直肠癌细胞的L-OHP敏感性的影响以及机制并不清楚. 本研究显示了低剂量(不影响结直肠细胞活性的剂量)的SchA即可表现出增强结直肠癌细胞对L-OHP的敏感性, 提示了SchA在结直肠癌细胞中的L-OHP增敏效应.
本研究探索了SchA对L-OHP的增敏的机制. 众所周知, 化疗药物常通过促使过量ROS生成来诱导肿瘤细胞的凋亡, 同样高水平的ROS也能提高化疗药物的杀伤效果[21]. 且已有直接的证据表明增强ROS生成水平能增加L-OHP对结直肠癌细胞诱导的凋亡[22-24]. 本研究结果也显示, 相对于单用L-OHP处理组, 在SchA+L-OHP联用组结直肠细胞中ROS生成水平上升伴随着凋亡增加, 这一结果提示, SchA在结直肠癌细胞中对L-OHP的增敏效应是通过增强其诱导ROS介导的凋亡来实现的. 本研究进一步对SchA增强L-OHP诱导ROS介导下游的结直肠癌细胞凋亡的途径进行了探索. 线粒体凋亡途径是细胞凋亡的主要途径之一. 过量ROS蓄积可诱导线粒体膜电位下降、Cyt c释放最终导致凋亡的发生[22-24,25,26]. 本研究显示, SchA在结直肠癌细胞中能促进L-OHP诱导凋亡, 表现为更低的线粒体膜电位(绿/红荧光高)、Cyt c释放增多、Bax和cleaved caspase-3表达增加以及Bcl-2表达降低, 说明SchA能增强L-OHP诱导的线粒体凋亡信号.
总之, 本研究表明SchA能增强L-OHP对结直肠癌细胞的杀伤作用, 其机制可能与增加ROS生成以及启动线粒体凋亡相关信号有关.
奥沙利铂(oxaliplatin, L-OHP)是结直肠癌患者的一线化疗药物, 但约30%-50%的患者对L-OHP敏感性不理想, 因此, 急需寻找能提高结直肠癌的L-OHP敏感性的策略.
据报道, 五味子甲素(schizandrin A, SchA)在不同种类的肿瘤细胞中可能具有化疗增敏作用, 而目前并不清楚其是否在结直肠癌中具有化疗增敏作用.
本研究评估SchA对结直肠癌L-OHP敏感性的影响.
用噻唑蓝法筛选SW480和HT-29细胞的L-OHP的处理浓度后, 再分别选用L-OHP以及SchA+L-OHP处理SW480和HT-29细胞24 h. 分别检测处理后的结直肠癌细胞的细胞活力、细胞凋亡、细胞内活性氧簇(reactive oxygen species, ROS)含量、线粒体膜电位以及凋亡相关蛋白表达.
SchA能增加L-OHP对结直肠癌细胞的杀伤效力和细胞内ROS蓄积并增强细胞中线粒体凋亡信号活性.
SchA能增强结直肠癌细胞对L-OHP敏感性.
SchA可能是潜在的可应用于结直肠癌患者L-OHP化疗的增敏剂.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394-424. [PubMed] [DOI] |
| 2. | Inadomi J, Jung B. Colorectal Cancer-Recent Advances and Future Challenges. Gastroenterology. 2020;158:289-290. [PubMed] [DOI] |
| 3. | Downing A, Hall P, Birch R, Lemmon E, Affleck P, Rossington H, Boldison E, Ewart P, Morris EJA. Data Resource Profile: The COloRECTal cancer data repository (CORECT-R). Int J Epidemiol. 2021;50:1418-1418k. [PubMed] [DOI] |
| 4. | Zhu J, Tan Z, Hollis-Hansen K, Zhang Y, Yu C, Li Y. Epidemiological Trends in Colorectal Cancer in China: An Ecological Study. Dig Dis Sci. 2017;62:235-243. [PubMed] [DOI] |
| 5. | Kim JH. Chemotherapy for colorectal cancer in the elderly. World J Gastroenterol. 2015;21:5158-5166. [PubMed] [DOI] |
| 6. | Dekker E, Tanis PJ, Vleugels JLA, Kasi PM, Wallace MB. Colorectal cancer. Lancet. 2019;394:1467-1480. [PubMed] [DOI] |
| 7. | Cassidy J, Clarke S, Díaz-Rubio E, Scheithauer W, Figer A, Wong R, Koski S, Lichinitser M, Yang TS, Rivera F, Couture F, Sirzén F, Saltz L. Randomized phase III study of capecitabine plus oxaliplatin compared with fluorouracil/folinic acid plus oxaliplatin as first-line therapy for metastatic colorectal cancer. J Clin Oncol. 2008;26:2006-2012. [PubMed] [DOI] |
| 8. | Ergun Y, Acikgoz Y, Bal O, Ucar G, Dirikoc M, Caliskan Yildirim E, Akdeniz N, Uncu D. KRAS codon 12 and 13 mutations may guide the selection of irinotecan or oxaliplatin in first-line treatment of metastatic colorectal cancer. Expert Rev Mol Diagn. 2019;19:1131-1140. [PubMed] [DOI] |
| 9. | Xiang Y, Guo Z, Zhu P, Chen J, Huang Y. Traditional Chinese medicine as a cancer treatment: Modern perspectives of ancient but advanced science. Cancer Med. 2019;8:1958-1975. [PubMed] [DOI] |
| 10. | Jeong MJ, Kim SR, Jung UJ. Schizandrin A supplementation improves nonalcoholic fatty liver disease in mice fed a high-fat and high-cholesterol diet. Nutr Res. 2019;64:64-71. [PubMed] [DOI] |
| 11. | Zhou F, Wang M, Ju J, Wang Y, Liu Z, Zhao X, Yan Y, Yan S, Luo X, Fang Y. Schizandrin A protects against cerebral ischemia-reperfusion injury by suppressing inflammation and oxidative stress and regulating the AMPK/Nrf2 pathway regulation. Am J Transl Res. 2019;11:199-209. [PubMed] |
| 12. | Cui L, Zhu W, Yang Z, Song X, Xu C, Cui Z, Xiang L. Evidence of anti-inflammatory activity of Schizandrin A in animal models of acute inflammation. Naunyn Schmiedebergs Arch Pharmacol. 2020;393:2221-2229. [PubMed] [DOI] |
| 13. | Chen BC, Tu SL, Zheng BA, Dong QJ, Wan ZA, Dai QQ. Schizandrin A exhibits potent anticancer activity in colorectal cancer cells by inhibiting heat shock factor 1. Biosci Rep. 2020;40. [PubMed] [DOI] |
| 14. | Chen L, Ren LQ, Liu Z, Liu X, Tu H, Huang XY. Bio-informatics and in Vitro Experiments Reveal the Mechanism of Schisandrin A Against MDA-MB-231 cells. Bioengineered. 2021;12:7678-7693. [PubMed] [DOI] |
| 15. | Zhu L, Wang Y, Lv W, Wu X, Sheng H, He C, Hu J. Schizandrin A can inhibit nonsmall cell lung cancer cell proliferation by inducing cell cycle arrest, apoptosis and autophagy. Int J Mol Med. 2021;48. [PubMed] [DOI] |
| 16. | Huang M, Jin J, Sun H, Liu GT. Reversal of P-glycoprotein-mediated multidrug resistance of cancer cells by five schizandrins isolated from the Chinese herb Fructus Schizandrae. Cancer Chemother Pharmacol. 2008;62:1015-1026. [PubMed] [DOI] |
| 17. | Zhang ZL, Jiang QC, Wang SR. Schisandrin A reverses doxorubicin-resistant human breast cancer cell line by the inhibition of P65 and Stat3 phosphorylation. Breast Cancer. 2018;25:233-242. [PubMed] [DOI] |
| 18. | Wu X, Li Q, Feng Y, Ji Q. Antitumor Research of the Active Ingredients from Traditional Chinese Medical Plant Polygonum Cuspidatum. Evid Based Complement Alternat Med. 2018;2018:2313021. [PubMed] [DOI] |
| 19. | Ye YT, Zhong W, Sun P, Wang D, Wang C, Hu LM, Qian JQ. Apoptosis induced by the methanol extract of Salvia miltiorrhiza Bunge in non-small cell lung cancer through PTEN-mediated inhibition of PI3K/Akt pathway. J Ethnopharmacol. 2017;200:107-116. [PubMed] [DOI] |
| 20. | Xian H, Feng W, Zhang J. Schizandrin A enhances the efficacy of gefitinib by suppressing IKKβ/NF-κB signaling in non-small cell lung cancer. Eur J Pharmacol. 2019;855:10-19. [PubMed] [DOI] |
| 21. | Kleih M, Böpple K, Dong M, Gaißler A, Heine S, Olayioye MA, Aulitzky WE, Essmann F. Direct impact of cisplatin on mitochondria induces ROS production that dictates cell fate of ovarian cancer cells. Cell Death Dis. 2019;10:851. [PubMed] [DOI] |
| 22. | Yue T, Zuo S, Bu D, Zhu J, Chen S, Ma Y, Ma J, Guo S, Wen L, Zhang X, Hu J, Wang Y, Yao Z, Chen G, Wang X, Pan Y, Wang P, Liu Y. Aminooxyacetic acid (AOAA) sensitizes colon cancer cells to oxaliplatin via exaggerating apoptosis induced by ROS. J Cancer. 2020;11:1828-1838. [PubMed] [DOI] |
| 23. | Cao P, Xia Y, He W, Zhang T, Hong L, Zheng P, Shen X, Liang G, Cui R, Zou P. Enhancement of oxaliplatin-induced colon cancer cell apoptosis by alantolactone, a natural product inducer of ROS. Int J Biol Sci. 2019;15:1676-1684. [PubMed] [DOI] |
| 24. | Kim BR, Jeong YA, Jo MJ, Park SH, Na YJ, Kim JL, Jeong S, Yun HK, Kang S, Lee DH, Oh SC. Genipin Enhances the Therapeutic Effects of Oxaliplatin by Upregulating BIM in Colorectal Cancer. Mol Cancer Ther. 2019;18:751-761. [PubMed] [DOI] |
| 25. | Wang X, Lu X, Zhu R, Zhang K, Li S, Chen Z, Li L. Betulinic Acid Induces Apoptosis in Differentiated PC12 Cells Via ROS-Mediated Mitochondrial Pathway. Neurochem Res. 2017;42:1130-1140. [PubMed] [DOI] |
| 26. | Cui L, Bu W, Song J, Feng L, Xu T, Liu D, Ding W, Wang J, Li C, Ma B, Luo Y, Jiang Z, Wang C, Chen J, Hou J, Yan H, Yang L, Jia X. Apoptosis induction by alantolactone in breast cancer MDA-MB-231 cells through reactive oxygen species-mediated mitochondrion-dependent pathway. Arch Pharm Res. 2018;41:299-313. [PubMed] [DOI] |