修回日期: 2021-10-21
接受日期: 2022-01-12
在线出版日期: 2022-01-28
白果内酯对胃溃疡胃黏膜损伤有一定的保护作用, 但其具体的作用机制尚不清楚.
探讨白果内脂通过NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)通路改善乙醇诱导胃溃疡的分子机制.
将60只SD大鼠随机分为空白组(A组, 不做处理), 模型组(B组, 乙醇诱导的急性胃溃疡模型), 对照组(C组, 20 mg/ mL奥美拉唑), 低剂量组(D组, 1 mg/mL 白果内酯)、中剂量组(E组, 2.5 mg/mL 白果内酯)和高剂量组(F组, 5 mg/mL 白果内酯), 每组10只, 比较不同组别大鼠的胃液pH值、胃泌素、胃蛋白酶以及溃疡指数(ulcer index, UI)等, 采用Elisa方法检测大鼠腹主动脉血清以及眼眶血清中的NLRP3、半胱氨酸蛋白酶-1(Caspase-1)、IL-18和IL-1β、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)和还原型谷胱甘肽(reduced glutathione, GSH)含量. 采用实时荧光定量PCR、免疫印迹(WB)法以及免疫荧光法检测胃组织中NLRP3相关通路中NLRP3、白介素-18(IL-1β)、IL-1β、Caspase-1和调亡相关斑点样蛋白(apoptosis associated blotch-like protein, ASC)的表达量变化.
B组UI、胃泌素、总酸度和胃蛋白酶总活性均明显高于A组(P<0.01), C组, E组和F组的UI、总酸度和胃蛋白酶总活性均低于B组(P<0.01). C组, D组, E组和F组大鼠血清中SOD值和GSH值较B组明显升高(P<0.01). B组大鼠MDA值、NLRP3、Caspase-1、IL-18、IL-1β、Caspase-1和ASC蛋白的mRNA水平和蛋白表达量均明显高于A组(P<0.01). C组, D组, E组和F组大鼠胃组织中MDA值、NLRP3、Caspase-1、IL-18、IL-1β、Caspase-1和ASC蛋白的mRNA水平和蛋白表达量均低于B组(P<0.01).
白果内脂可通过NLRP3通路抗炎机制达到胃溃疡的保护作用.
核心提要: 乙醇诱导的胃溃疡溃疡指数胃泌素、总酸度和胃蛋白酶总活性、MDA值、NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)、Caspase-1、IL-18、IL-1β、Caspase-1和调亡相关斑点样蛋白(apoptosis associated blotch-like protein, ASC)蛋白的mRNA水平和蛋白表达量均明显较正常大鼠升高. 表明, 胃溃疡会引起胃蛋白酶总活性和炎性因子分泌量增加. 经不同剂量白果内酯治疗后的乙醇诱导胃溃疡大鼠胃泌素、总酸度、胃蛋白酶总活性、MDA值、NLRP3、Caspase-1、IL-18、IL-1β、Caspase-1和ASC蛋白的mRNA水平和蛋白表达量均明显较未治疗模型组降低. 说明剂量白果内酯可使乙醇诱导的胃溃疡胃蛋白酶总活性降低, 炎性因子分泌量降低, 进而达到胃溃疡的保护作用.
引文著录: 刘广宁, 门炜. 白果内酯通过NLRP3相关通路发挥对乙醇致大鼠胃溃疡的保护作用. 世界华人消化杂志 2022; 30(2): 77-87
Revised: October 21, 2021
Accepted: January 12, 2022
Published online: January 28, 2022
Ginkgolide has a protective effect on gastric ulcer gastric mucosa damage, but the exact mechanism involved is still not clear.
To investigate the molecular mechanism of ginkgolide for protecting against ethanol-induced gastric ulcer by detecting the expression of proteins related to the nod-like receptor thermal protein domain associated protein 3 (NLRP3) pathway.
Sixty SD rats were randomly divided into a blank group (group A, rats with no treatment), a model group (group B, rats treated with ethanol), control group (group C, rats treated with ethanol and 20 mg/ mL omeprazole), low-dose ginkgolide group (group D, rats treated with ethanol and 1 mg/mL ginkgolide), medium-dose ginkgolide group (group E, rats treated with ethanol and 2.5 mg/mL ginkgolide), and high-dose ginkgolide group (group F, rats treated with ethanol and 5 mg/mL ginkgolide), with ten rats in each group. Gastric pH, gastrin, pepsin, and ulcer index (UI) of rats in different groups were compared. The contents of NLRP3, caspase-1, IL-18, IL-1β, superoxide dismutase (SOD), malondialdehyde (MDA), and reduced glutathione (GSH) in serum were determined by ELISA. The expression levels of NLRP3, interleukin (IL)-18, IL-1β, caspase-1, and apoptosis associated blotch-like protein (ASC) in gastric tissues were detected by real-time fluorescence quantitative PCR, Western blot (WB), and immunofluorescence assay.
UI, gastrin, total acidity, and total pepsin activity in group B were significantly higher than those in group A (P < 0.01), while UI, total acidity, and total pepsin activity in groups C, E, and F were significantly lower than those in group B (P < 0.01). Serum levels of SOD and GSH in groups C, D, E, and F were significantly higher than those in group B (P < 0.01). Serum MDA and the mRNA and protein expression of NLRP3, caspase-1, IL-18, IL-1β, and ASC in gastric tissue in group B were significantly higher than those in group A (P < 0.01). Serum MDA and the mRNA and protein expression of NLRP3, caspase-1, IL-18, IL-1β, and ASC in gastric tissue of rats in groups C, D, E, and F were significantly lower than those in group B (P < 0.01).
Ginkgolide protects against ethanol-induced gastric ulcer through the NLRP3 pathway.
- Citation: Liu GN, Men W. Ginkgolide protects against ethanol-induced gastric ulcer in rats through NLRP3 related pathway. Shijie Huaren Xiaohua Zazhi 2022; 30(2): 77-87
- URL: https://www.wjgnet.com/1009-3079/full/v30/i2/77.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i2.77
胃溃疡(gastric ulcer, GU)是常见的慢性消化系统疾病, 由于胃黏膜被消化液消化引起的黏膜肌层组织损伤现象[1]. 过量饮酒会引起腹部烧灼样疼痛, 呕吐及呕血等急性胃溃疡临床症状[2]. 几年来随着生活水平的提高, 饮酒人数逐年增加, 导致胃溃疡患者的新发病例也明显上升[3]. 目前研究结果表明, 胃溃疡患者的胃黏膜的防御系统遭到破坏后会引发机体内发生溃疡相关的炎症反应, 使得核转录因子NF-κB表达量明显升高, 同时血清中会释放大量促炎性细胞因子[4]. 胃溃疡的发生主要与MAPK通路、ERK通路、EGFR/ERK信号转导途径以及bFGF因子活化等有关[5-7]. NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)是机体免疫系统的重要组成部分, 在机体发生病变或应激刺激后在炎症反应和细胞死亡过程中发挥着重要的作用[8]. NLRP3炎症体复合物主要由NOD样受体(NOD-like receptor, NLRs)家族成员NLRP3、接头蛋白ASC和效应蛋白半胱氨酸蛋白酶-1 (Caspase-1)组成, 当机体受到外界刺激时, CARD(caspase- activating and recruitment domain)感受器信号传递给ASC蛋白, 激活Caspase-1, 进而活化的IL-1β, 最终使上皮细胞释放大量炎症因子[9]. 有研究指出, NLRP3相关通路在肠道菌群平衡, 肠炎及肠道肿瘤等肠道疾病的发生发展中发挥着重要的作用[10]. 但目前关于NLRP3相关通路在胃溃疡中的相关作用及其机制研究较少.
目前主要采用药物对胃溃疡患者进行治疗, 常用的药物有奥美拉唑和兰索拉唑等质子泵抑制剂、H2受体拮抗剂、幽门螺旋杆菌抗生素等[11]. 但这些药物对胃溃疡的治疗效果有限, 还存在明显的副作用. 白果内酯(bilobalide, BI)是提取自银杏叶的萜内酯类化合物, 白果内酯对精神病和神经系统疾病的治疗具有显著的作用, 同时还可降低脑出血及脑水肿发生的概率[12]. 同时有研究指出, 白果内酯通过抑制活性氧和含氮物质的表达量使得结肠炎大鼠血清中的TNF-α明显降低, 最终使炎症反应受到抑制, 对结肠黏膜具有一定的保护作用[13]. 胃溃疡胃黏膜损伤主要是通过炎症因子及氧化应激途径进行调控的, 白果内酯对胃溃疡胃黏膜损伤有一定的保护作用[14], 但其具体作用机制还有待进一步研究.
综上所述, 我们推测在肠道疾病中发挥重要作用的NLRP3相关通路在胃溃疡中发挥着重要的作用, 且白果内酯对炎症因子的调控可能与胃溃疡的保护作用具有一定的相关性. 基于这种推测, 本文以60只SD大鼠为研究对象, 构建了乙醇诱导的急性胃溃疡模型, 研究白果内脂通过NLRP3相关通路对乙醇诱导的急性胃溃疡的作用及其具体的分子机制, 以为胃溃疡的治疗提供可参考的理论依据.
1.1.1 实验动物及分组: 选择60只6-7周龄的健康SD大鼠, 体重208-254 g, 雌雄各半; 每笼5只饲养于SPF级实验动物房, 室温25 ℃±2 ℃, 相对湿度55%左右, 12昼夜交替, 自由饮水和饮食. 所有大鼠适应性饲养1 wk后进行试验. 随机分为六组: 空白组(A组), 模型组(B组), 对照组(C组), 低剂量组(D组)、中剂量组(E组)和高剂量组(F组), 每组10只, A组大鼠不作任何处理, B组建立乙醇诱导的急性胃溃疡模型, C组大鼠造模后采用奥美拉唑进行治疗, D组、E组和F组大鼠均在造模后采用不同剂量的白果内酯进行治疗. 本试验所有动物程序均经实验动物管理委员会批准, 实验方法均按照批准指南进行.
乙醇诱导的急性胃溃疡模型建立及试验动物处理方法: 实验前对所有大鼠禁食24 h, 禁水4 h. 以0.2 mL/kg的剂量对大鼠进行灌胃, 灌胃成功5 min内可见大鼠出现全身瘫软、精神紧张、呼吸心跳加速等症状. 灌胃4 h内禁食禁水, 4 h后可见大鼠出现身体瘫软症状, 则表明急性胃溃疡模型构建成功.
术后常规饲养1 d后开始给药, C组以灌胃的方式给予浓度为20 mg/mL 的奥美拉唑(omeprazole, OME)进行治疗. BI注射液临床成人用量为 30-50 mg/(人d), 按50 mg/(人d)计算, 分别对大鼠给与临床成人用量的2倍(1 mg/mL), 5倍(2.5 mg/mL)和10倍(5 mg/mL)进行试验. D组给予浓度为1 mg/mL的BI进行治疗, E组给予浓度为2.5 mg/mL的BI进行治疗; F组给予浓度为5 mg/mL的BI进行治疗. 所有动物均为每日给药1次, 连续给药14 d.
溃疡指数计算及生化指标检测: 造模成功3 h后, 用3%的戊巴比妥以1 g/kg剂量经腹腔注射麻醉处死大鼠, 腹正中切口进入腹腔分离胃, 用注射器将胃液吸出, 采用0.5-5.0的精密pH试纸测定胃酸pH值. 以放射免疫分析法采用胃泌素检测试剂盒(上海抚生实业有限公司)对不同组别大鼠胃泌素进行检测. 采用胃蛋白酶检测试剂盒(上海信裕生物科技有限公司)检测胃蛋白酶活性.
造模成功后4 h, 采用眼眶取血的方法收集标本, 于4 ℃, 于4摄氏度, 3500 rpm条件下离心20 min, 收集上清, 分别采用不同的试剂盒根据具体操作步骤检测血清中超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(monochrome display adapter, MDA)和还原型谷胱甘肽(glutathione, GSH)含量. SOD、MDA和GSH检测试剂盒均购自南京建成生物工程研究所. 采用无菌釆血管取不同组别大鼠腹主动脉血约5 mL, 于室温条件下放置20 min使血液自然凝固, 于3000 rpm/min条件下20 min取血清, 依据Elisa检测试剂盒(武汉基因美生物科技有限公司)于450 nm波长下分别检测血清中NLRP3、Caspase-1、IL-18及IL-1β的表达量.
分离胃后用生理盐水冲洗胃腔内及粘膜上的血迹, 将胃平铺于滤纸上,观察胃黏膜溃疡、糜烂及出血点发生的部位. 参考Wang等(2020)[15]方法按照溃疡或糜烂面积大小计算溃疡指数(ulcer index, UI), 3个点状溃疡(粘膜缺损小于1 mm)计1分; 游标卡尺测量条状出血溃疡面宽为1 mm者计1分, 2 mm者计2分, 3 mm者计3分. 点状溃疡和条状出血溃疡面之和即为UI.
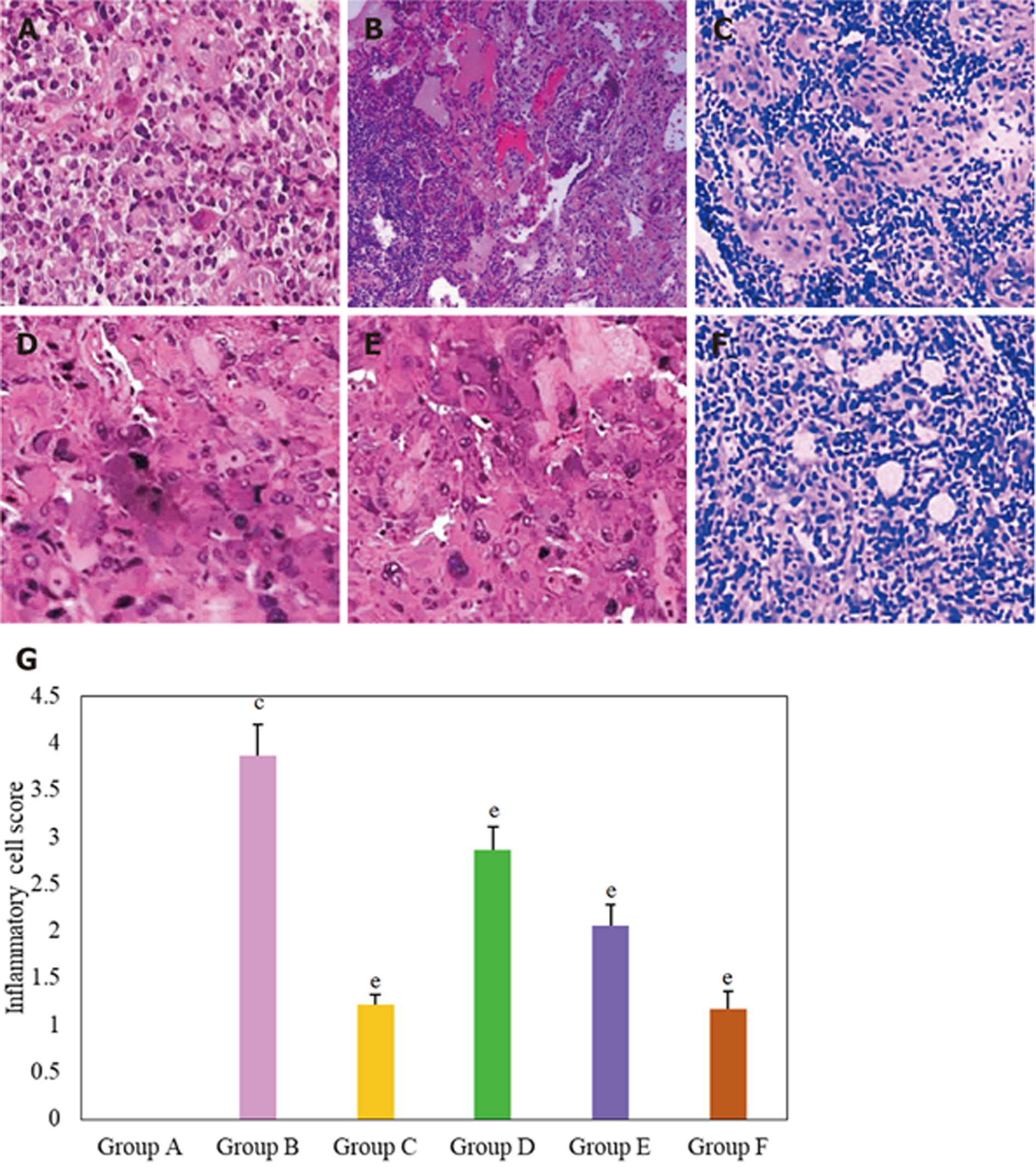
大鼠胃组织病理学观察: 收集部分胃组织采用HE染色法其进行形态观察. 将胃组织采用福尔马林进行固定, 石蜡包埋, 连续切片4 um, 置于二甲苯30 min脱蜡-不同梯度酒精水化50 min-苏木精冲洗20 min-水洗后伊红染色2 min-梯度酒精脱水30 min-二甲苯透明20 min后, 采用中性树胶封片, 在光镜下观察卫组织病理改变. 采用经典的病理炎症细胞评分[16]对胃组织白细胞浸润程度进行评价, 白细胞浸润程度分为5个等级, 0-1为无细胞或少数细胞, 2为一环1个细胞, 3为一环2-4个细胞, 4为一圈细胞超过4个细胞层.
NLRP3相关通路因子实时荧光定量PCR检测: 取约20 g的胃组织, 放入匀浆器中, 尽量剪碎, 采用TRIzol法提取胃组织中的总RNA, 对提取的总RNA进行琼脂糖凝胶电泳检测后, 采用Hifair® Ⅲ 1st Strand cDNA Synthesis SuperMix for qPCR反转录试剂盒(Takara公司)进行反转录. 依据NCBI中各基因的mRNA序列合成不同因子的引物序列. NLRP3基因实时荧光定量PCR引物: NL-F: 5'-CTGCATGCCGTATCTGGTTG-3'; NL-R: 5'-GGTACCCCATAGACTGGCAC-3'. IL-1β基因实时荧光定量PCR引物. IL-F: 5'-AGGCTGACAGACCCCAAAAG-3'; IL-R: 5'-CTCCACGGGCAAGACATAGG-3'. 以β-actin作为内参, β-actin基因的引物Fa: 5'-ACAACCTTCTTGCAGCTCCTC-3'; Ra: 5'-CTGACCCATACCCACCATCAC-3'. 每个样品作三个复孔, 退火温度为60 ℃, 退火时间15 s, 30个循环. 采用2-ΔΔct法计算各因子的相对表达量.
免疫印迹(western blot, WB)法检测NLRP3相关通路因子表达量: 取收集的胃组织放入匀浆器中, 尽量剪碎, 加入1 mL提前配置好的裂解液(RIPA蛋白裂解液:蛋白酶抑制剂PMSF = 1:100)进行研磨, 使组织充分裂解以提取总蛋白. 提取的总蛋白采用比辛尼酸法测定蛋白含量. 采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离细胞蛋白, 采用湿转法将蛋白转移至聚偏二氟乙烯膜上, 然后用5%的脱脂牛奶进行封闭. 分别加入以1:1000比例稀释好的NLRP3、白介素-18(IL-1β)、Caspase-1、调亡相关斑点样蛋白(apoptosis-associated speck-like protein, ASC)和β-actin的抗体, 于4 ℃孵育过夜. 用TBST彻底洗涤3次, 10 min/次, 加入辣根过氧化物酶偶联的二抗室温下孵育2 h; 用TBST彻底洗涤3次, 10 min/次, 加入显色液, 在显影仪上自动曝光, 拍照进行灰度扫描. 根据灰度值分析蛋白表达量.
免疫荧光法检测NLRP3蛋白表达量: 将不同组别大鼠胃组织, 依次用预冷的PBS和预冷的4%多聚甲醛进行灌注, 固定胃组织脱水并切片(约5-7 μm). 室温下干燥30 min, 用PBS洗涤3次后用5%牛血清(含0.3%Triton X-100)进行1 h封闭. 加入FITC标记的羊抗小鼠抗IgG荧光抗体, 低温孵育过夜. 用PBS洗涤3次, 加入荧光标记的二抗在室温下孵育2 h. Iba-1染色10 min, 封片. 采用激光扫描共焦显微镜拍照.
统计学处理 采用SPSS 19.0进行数据统计与分析, 计量资料以均数±标准差(mean±SD)表示, 服从正态分布的计量资料采用单因素方差分析法(ANOVA), 差齐时两组间比较采用LSD法, 方差不齐则采用Dunnett T3法检验; 不服从正态分布的计量资料采用秩和检验. 计数资料采用百分率表示, P<0.05为差别有统计学意义.
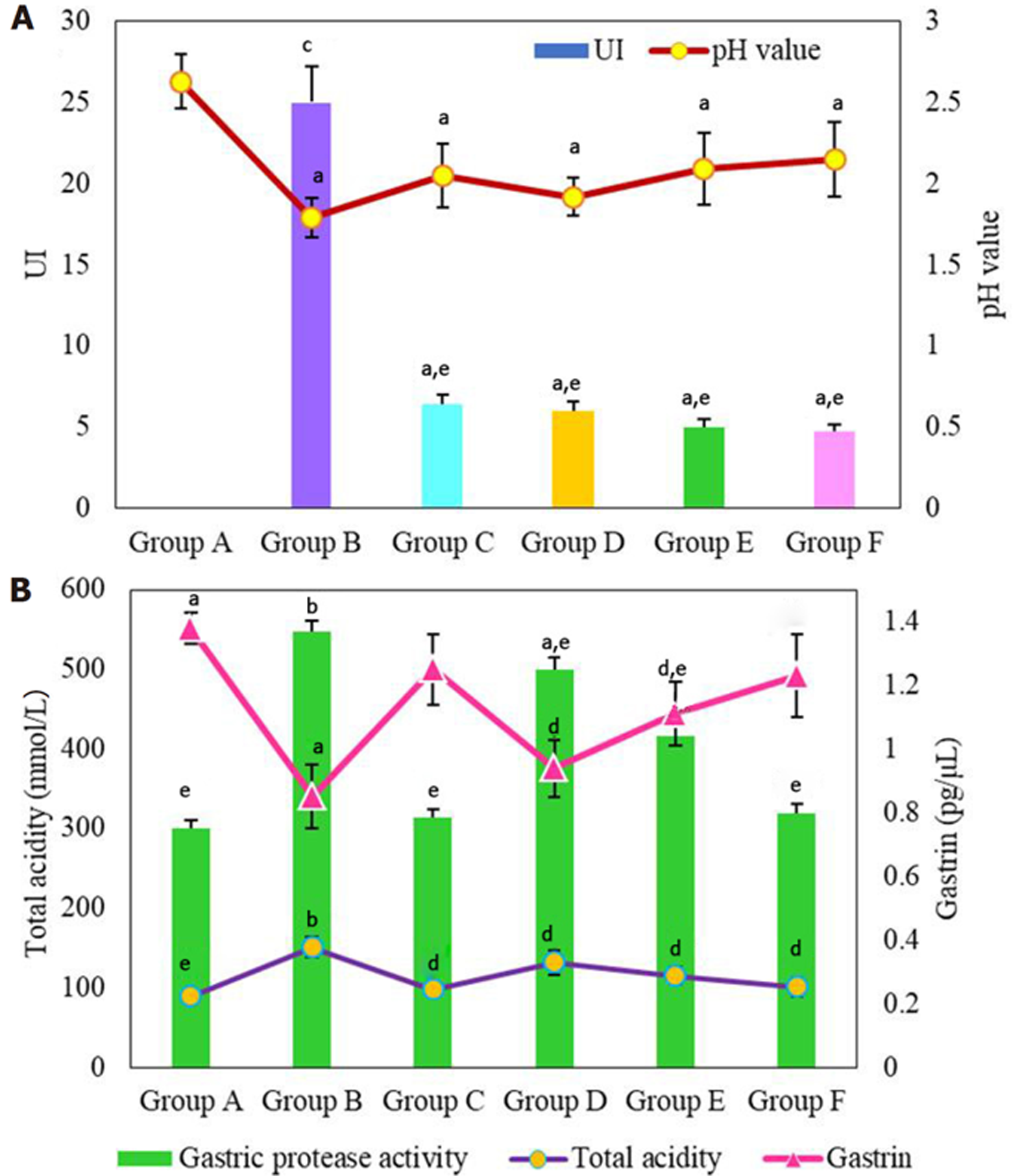
对不同组别大鼠UI进行比较分析(图1A), B组UI与A组相比具有极显著性差异(P<0.001), C组, D组, E组和F组的UI与A组相比具有统计学差异(P<0.05), 与B组相比具有显著性差异(P<0.01). B组, C组, D组, E组和F组大鼠的胃液pH值与A组相比具有统计学差异(P<0.05).
进一步对不同组别大鼠的胃泌素、总酸度以及胃蛋白酶活性进行检测与分析(图1B), A组胃泌素高于B组异(P<0.05). C组, D组, E组和F组大鼠的胃泌素明显低于B组, 组间相比具有统计学差异(P<0.05). B组大鼠的总酸度和胃蛋白酶总活性均明显高于A组, 二者相比均具有显著性差异(P<0.01). C组和E组和F组大鼠的总酸度和胃蛋白酶总活性与B组相比均具有显著性差异(P<0.01). D组大鼠的总酸度和胃蛋白酶总活性与B组相比具有统计学差异(P<0.05).
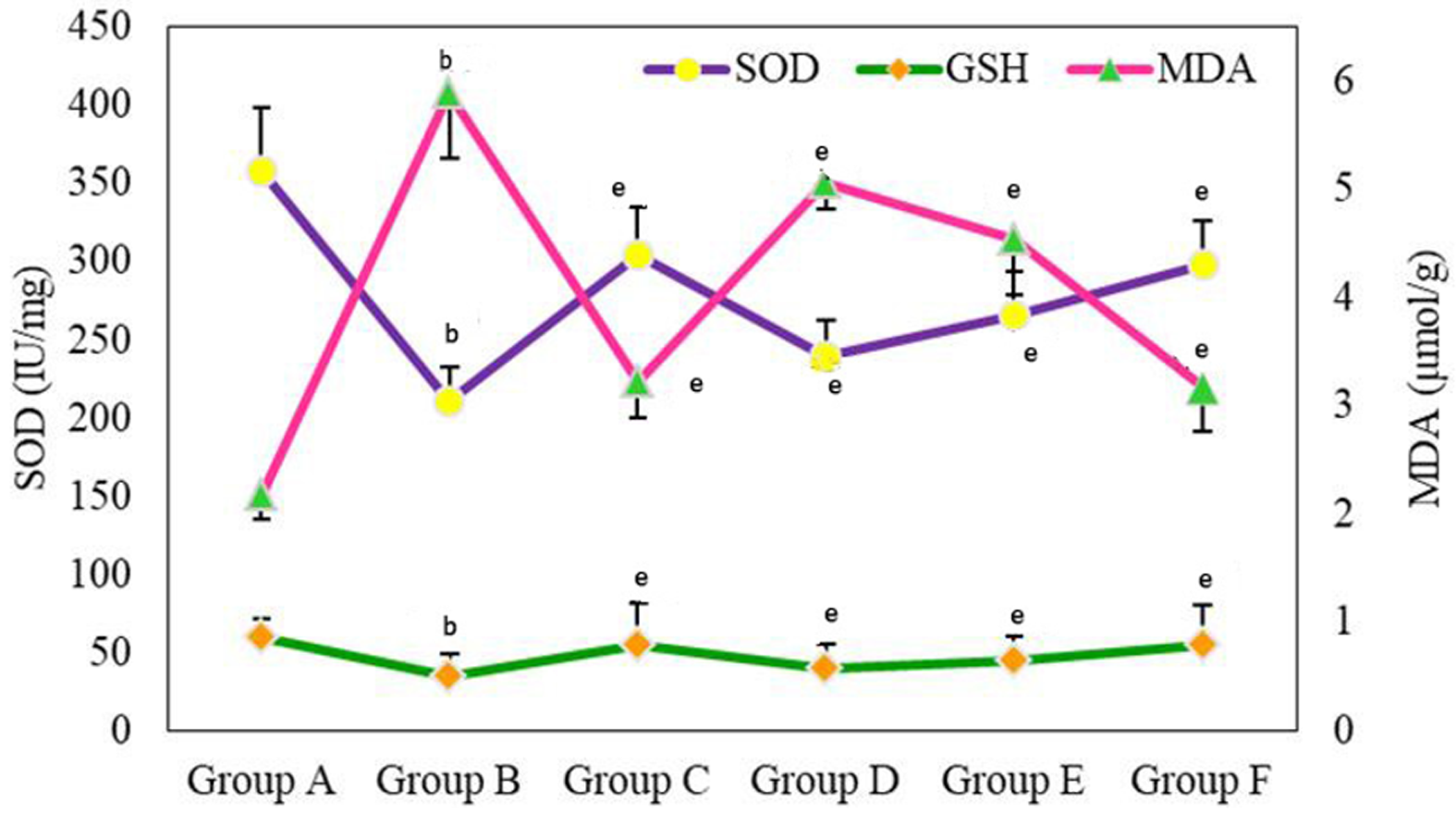
对不同组大鼠血清中SOD、MDA和GSH含量进行检测, 结果如图2所示, A组的SOD值明显高于B组, 二者相比具有显著性差异(P<0.01), 经给药治疗后, C组, D组, E组和F组大鼠血清中SOD值较B组明显升高(P<0.01). A组的GSH值明显高于B组, 二者相比具有显著性差异(P<0.01), 经给药治疗后的C组, D组, E组和F组大鼠血清中GSH值较B组明显升高, 组间相比均具有显著性差异(P<0.01). B组大鼠MDA值明显高于A组, 二者相比具有显著性差异(P<0.01), C组, D组, E组和F组大鼠血清中MDA与B组相比明显降低(P<0.01).
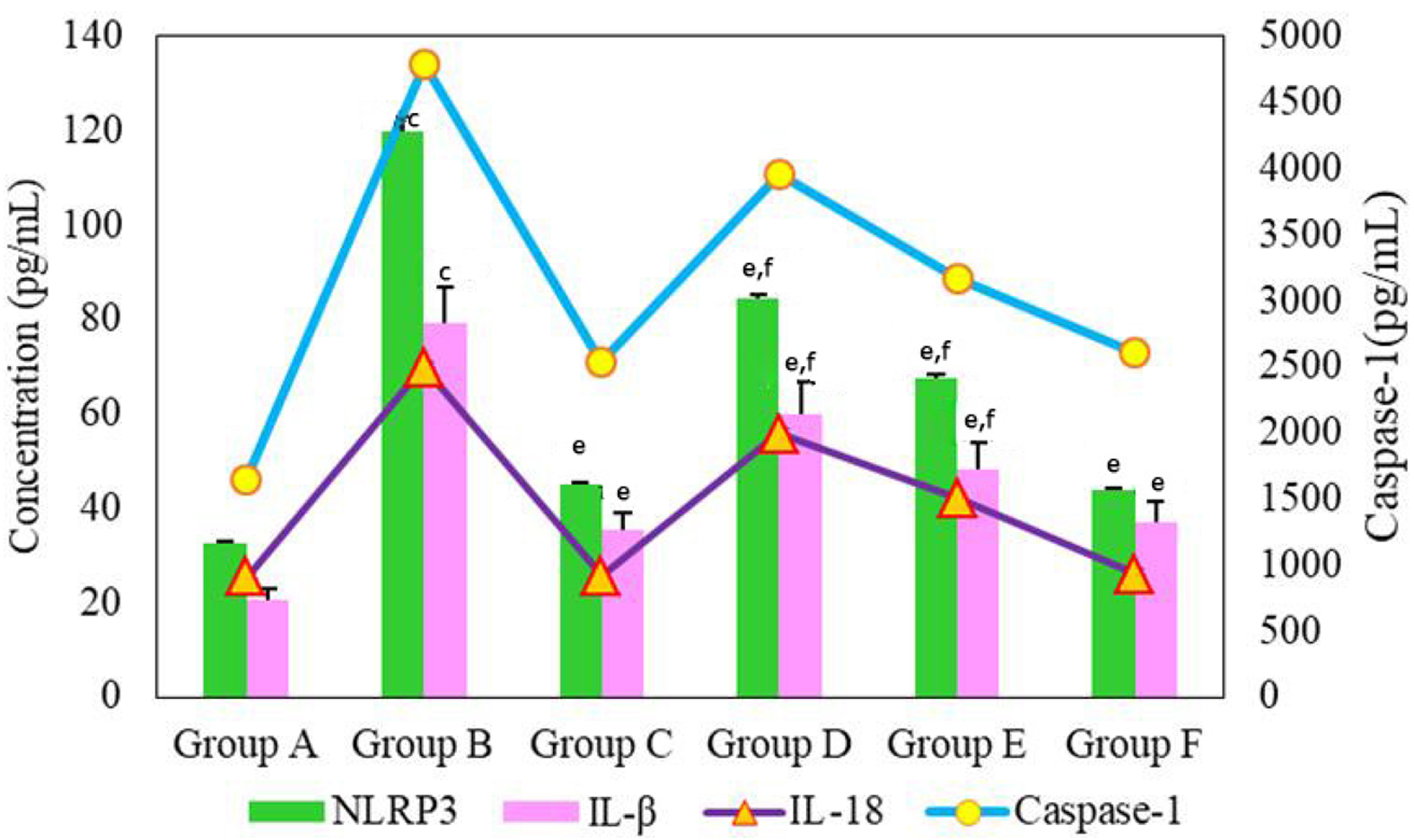
对不同组大鼠血清中NLRP3、Caspase-1、IL-18及IL-1β含量检测结果进行分析(图3), B组大鼠血清中NLRP3的含量明显高于A组, 二者相比具有极显著性差异(P<0.001). C组, D组, E组和F组大鼠血清中NLRP3含量均低于B组相比均明显降低(P<0.01). D组和E组大鼠血清中NLRP3含量与C组相比均具有统计学差异(P<0.05). B组大鼠血清中Caspase-1的含量明显高于A组(P<0.001). C组, D组, E组和F组大鼠血清中Caspase-1含量均低于B组相比均明显降低(P<0.01). D组, E组大鼠血清中Caspase-1含量与F组和C组相比均具有统计学差异(P<0.05), C组和F组大鼠血清中Caspase-1含量相比无统计学差异. B组大鼠血清中IL-18及IL-1β含量均高于A组(P<0.001). C组, D组, E组和F组大鼠血清中IL-18及IL-1β含量均低于B组(P<0.01). D组, E组大鼠血清中IL-18及IL-1β含量与F组和C组相比均具有统计学差异(P<0.05), C组和F组大鼠血清中IL-18及IL-1β含量相比无统计学差异.
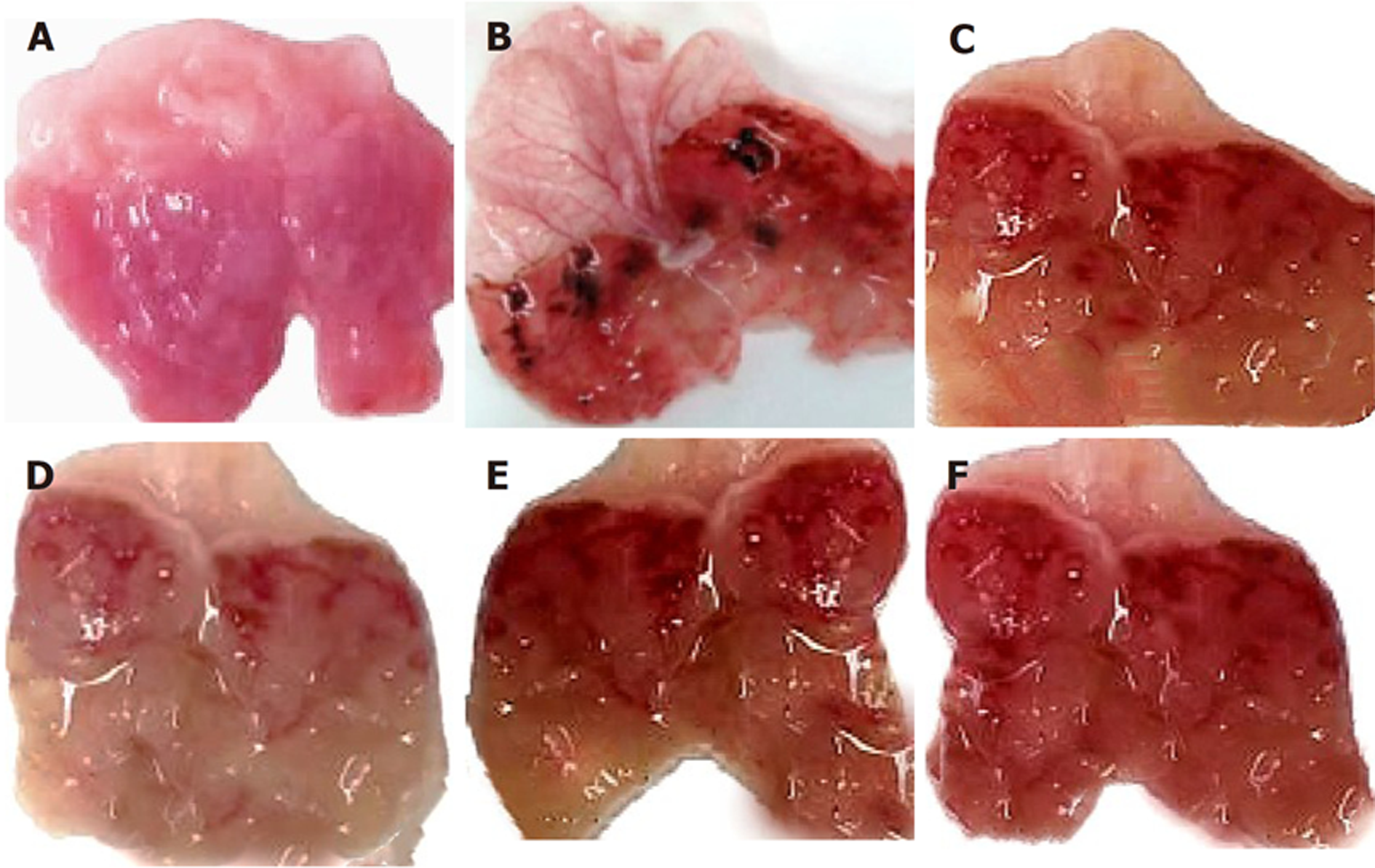
对不同组大鼠的胃黏膜组织形态进行观察(图4), A组大鼠胃壁完整、未见明显损伤, B组大鼠胃部可见明显的充血肿胀, C组, D组, E组和F组大鼠损伤程度明显较B组减轻.
对不同组大鼠胃组织病理学检测结果进行分析(图5), A组大鼠胃组织HE染色后可见胃黏膜结构整齐, 未见炎细胞浸润; B组大鼠胃组织HE染色可见胃黏膜上皮层缺失, 部分胃上皮细胞脱落, 出现明显的炎症细胞浸润现象, C组, D组, E组和F组大鼠经治疗后胃上皮细胞脱落数量及炎症细胞浸润均减少. 对不同组别大鼠炎症细胞评分结果进行分析, B组大鼠炎症细胞评分值明显高于A组, 二者相比具有极显著性差异(P<0.001), C组, D组, E组和F组大鼠炎症细胞评分值明显低于B组, 组间相比均具有显著性差异(P<0.01).
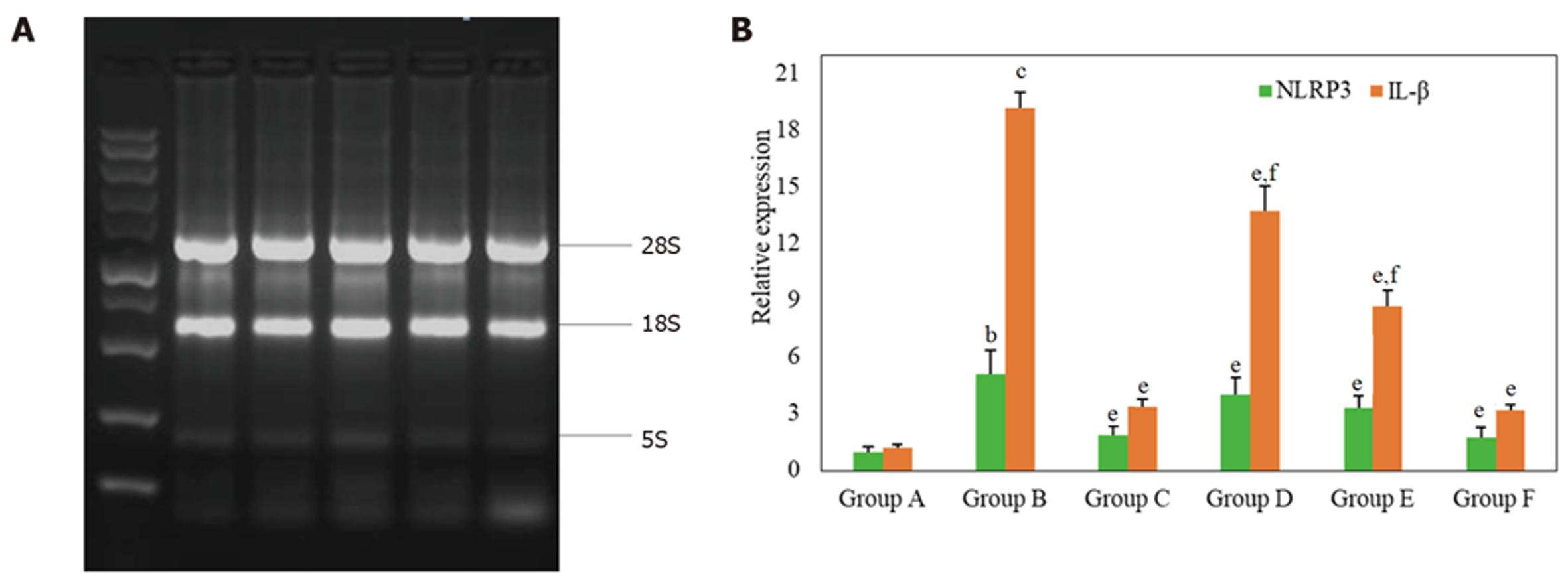
对提取的RNA进行电泳检测与分析(图6A), 提取的RNA均有明显的28S和18S RNA条带, 条带清晰可见未见明显的降解, 表明提取的RNA完整, 进一步对不同组别大鼠组织中NLRP3和IL-1β的表达量进行比较分析(图5B), B组大鼠胃组织中NLRP3的mRNA相对表达量明显高于A组(P<0.01). C组, D组, E组和F组大鼠胃组织中NLRP3的mRNA相对表达量与B组相比均明显降低(P<0.01). B组大鼠胃组织中IL-1β的mRNA相对表达量明显高于A组(P<0.001). C组, D组, E组和F组大鼠胃组织中IL-1β的mRNA相对表达量与B组相比均明显降低(P<0.01), D组, E组和F组大鼠胃组织中IL-1β的mRNA相对表达量与C组相比具有统计学差异(P<0.05).
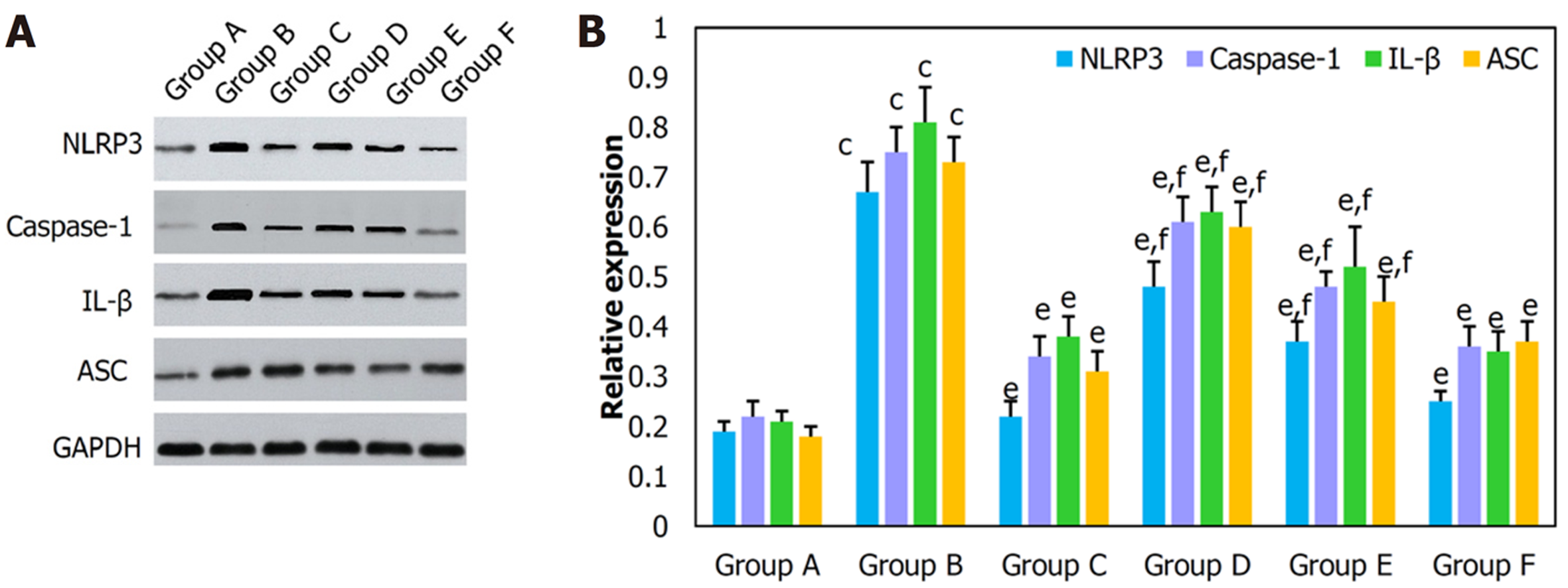
采用WB对不同组别大鼠胃组织中NLRP3、IL-1β、Caspase-1和ASC表达量进行分析(图7), A组大鼠胃组织中NLRP3、IL-1β、Caspase-1和ASC表达量均明显低于B组(P<0.001). 经治疗后C组, D组, E组和F组大鼠胃组织中NLRP3、IL-1β、Caspase-1和ASC表达量均明显低于B组(P<0.01). D组, E组大鼠胃组织中NLRP3、IL-1β、Caspase-1和ASC表达量与F组和C组相比具有统计学差异(P<0.05), F组和C组胃组织中NLRP3、IL-1β、Caspase-1和ASC表达量与F组和C组相比无统计学差异(P>0.05).
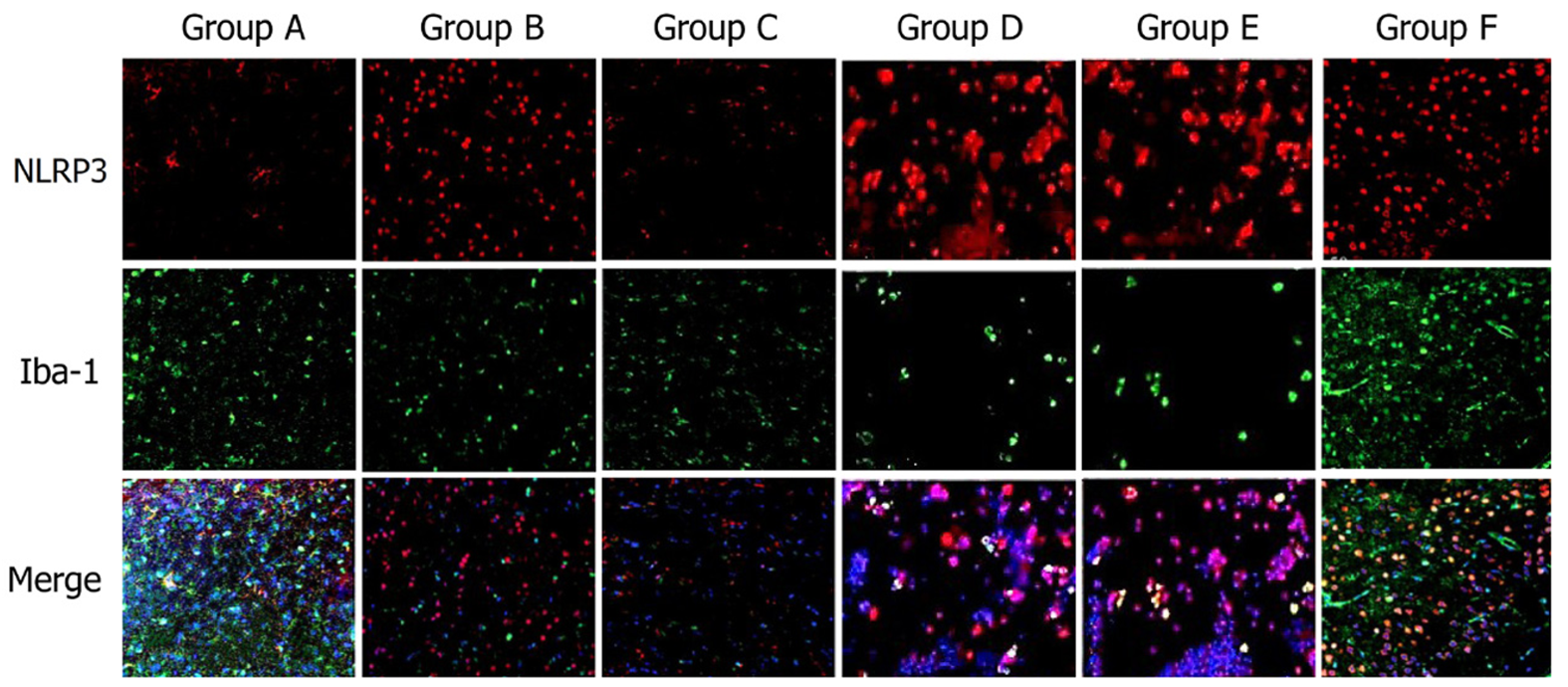
采用免疫荧光染色法对不同组别大鼠胃组织中NLRP3表达量进行分析(图8), A组大鼠胃组织中几乎没有NLRP3表达, B组大鼠胃组织可见大量NLRP3表达, 经给药后的D组和E组大鼠胃组织中NLRP3表达量明显降低, C组和F组大鼠胃组织中NLRP3表达量与A组相似, 表达量较低.
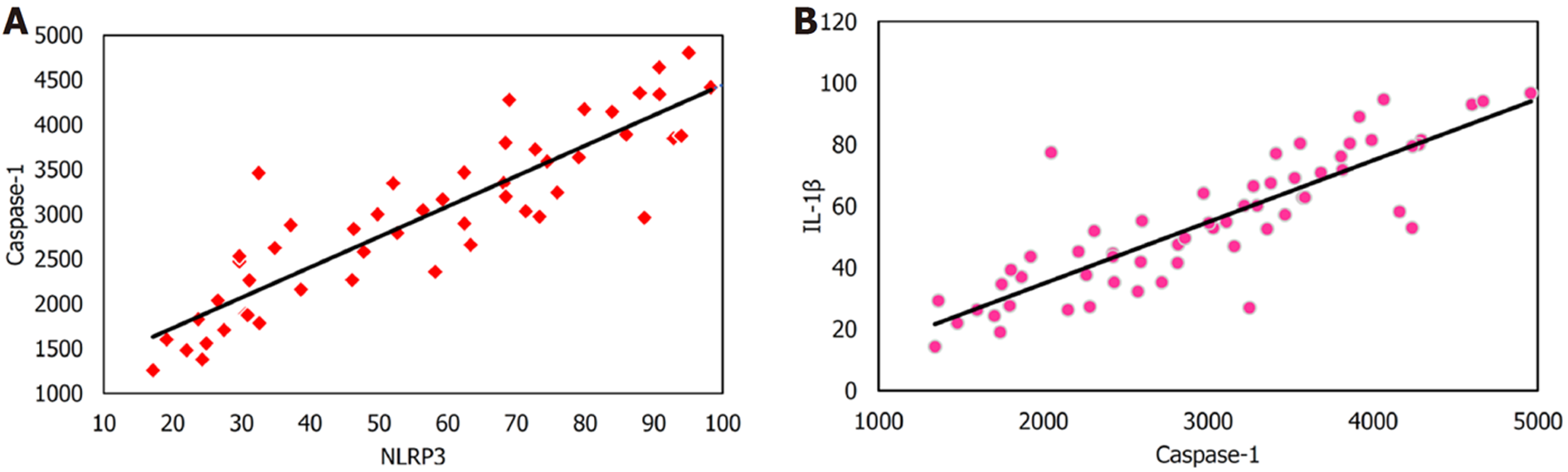
不同组别大鼠的NLRP3 相关通路因子间相关性进行分析(图9), Caspase-1表达量对着NLRP3表达量的增加而增加, 即Caspase-1表达量与NLRP3表达量呈明显正相关(R = 0.845, P<0.01); IL-1β表达量随着 Caspase-1 表达量的增加而增加, 即IL-1β表达量与Caspase-1表达量呈明显正相关(R = 0.903, P<0.01).
胃溃疡是由氧自由基等多种因素引发的一种常见胃肠道疾病[17]. 大量乙醇摄入是引发胃溃疡的原因之一[18], 乙醇对胃黏膜的损伤是一个复杂的过程, 大量摄入乙醇会使胃黏膜上皮细胞和粘液层受损[19], 胃黏膜血流动力学的改变[20], 同时还可诱导胃黏膜合成和分泌多种炎症及氧化应激等细胞因子, 进一步加剧胃黏膜的损伤[21]. 本文采用白果内脂对乙醇有道的大鼠胃溃疡进行治疗, 研究结果发现, B组UI与A组相比具有极显著性差异(P<0.001), C组, D组, E组和F组的UI与B组相比具有显著性差异P<0.01). B组, C组, D组, E组和F组大鼠的胃液pH值与A组相比具有统计学差异(P<0.05). A组胃泌素明显低于B组(P<0.05). B组大鼠的总酸度和胃蛋白酶总活性均明显高于A组(P<0.01). C组和E组和F组大鼠的总酸度和胃蛋白酶总活性与B组相比均具有显著性差异(P<0.01). 这些结果表明, 经乙醇诱导胃溃疡大鼠胃黏膜指数、总酸度以及胃蛋白酶活性明显升高, 胃液pH值和胃泌素明显降低. 表明灌入的乙醇直接破坏了大鼠胃表面的保护屏障, 导致胃黏膜损伤[22]. 乙醇诱导的胃溃疡粘膜损伤病理特点与人体大量摄入酒精导致的胃黏膜损伤相似[23], 且这种造模方法简便, 速度快, 重复性好[24]. 同时可以看出, C组, D组, E组和F组的UI和胃液pH值与B组相比均有明显的改善, 表明采用不同的药物治疗后可改善乙醇诱导胃溃疡引发的胃黏膜指数、总酸度以及胃蛋白酶活性升高, 胃液pH值和胃泌素降低现象.
NLRP3炎症体复合体由NLRP3、ASC和Caspase-1组成, NLRP3主要作为感受器发挥作用[25], 将信号传递给效应蛋白Caspase-1, 活化的IL-1β和IL-18, 进而调控慢性炎症[26]. ASC接头蛋白促进NLRP3炎症体的激活[27]. 而且IL-1β和IL-18的表达与免疫调节具有相关性[28], IL-1β和IL-18等炎症因子的过量表达, 会引起机体免疫调节紊乱[29]. 文中进一步对BI对问溃疡的治疗效果及其对应的分子机制进行探讨, 研究结果发现, B组大鼠血清中NLRP3、Caspase-1、IL-18及IL-1β含量均高于A组(P<0.01). D组, E组大鼠血清中NLRP3、Caspase-1、IL-18及IL-1β含量与F组和C组相比均具有统计学差异(P<0.05). B组大鼠胃组织中NLRP3和IL-1β的mRNA相对表达量明显高于A组(P<0.01). C组, D组, E组和F组大鼠胃组织中NLRP和IL-1β的mRNA相对表达量与B组相比均明显降低(P<0.01). 这些结果表明乙醇的摄入使大鼠血清及胃组织中的NLRP3、Caspase-1、IL-18及IL-1β表达均明显升高, 经白果内脂治疗后, 大鼠血清及胃组织中的NLRP3、Caspase-1、IL-18及IL-1β表达量下调. 说明白果内脂通过调控炎症反应相关分子NLRP3、Caspase-1、IL-18及IL-1β的表达量对对乙醇诱导的胃溃疡发挥了保护作用. Abdellatif等(2019)[30]研究指出, 罗格列酮通过炎症因子的调控参与了乙醇引发的胃溃疡的调控过程, 本文研究结果与其相似. Caspase-1蛋白是NLRP3相关通路中促炎性细胞因子的调控因子[31]. 同时有研究指出炎症因子的表达量与溃疡的严重程度呈正相关性[32]. 文中结果发现, 乙醇诱导胃溃疡大鼠胃黏膜指数升高, 炎症因子NLRP3、Caspase-1、IL-18及IL-1β的表达量升高, 而经BI和OME治疗的大鼠胃黏膜指数下降, 且其NLRP3、Caspase-1、IL-18及IL-1β表达量较B组明显下降, 这与目前炎症因子的表达量与溃疡的相关性结果一致. A组大鼠胃组织中NLRP3、IL-1β、Caspase-1和ASC表达量均明显低于B组(P<0.001). C组, D组, E组和F组大鼠胃组织中NLRP3、IL-1β、Caspase-1和ASC表达量均明显低于B组(P<0.01). 可以看出, 在检测的所有指标中F组明显优于阳性对照C组, 具有潜在的应用价值. NLRP3相关通路因子参与了白果内脂对胃溃疡的保护, 通过抗炎作用达到改善胃溃疡的作用.
本文通过构建乙醇诱导的急性胃溃疡模型, 并采用不同剂量的白果内脂进行治疗, 探讨白果内脂改善胃溃疡的分子机制. 结果发现, 给药白果内脂后, 乙醇诱导的急性胃溃疡大鼠血清及胃组织中的NLRP3、Caspase-1、IL-18、IL-1β及ASC因子及蛋白的表达量明显降低, 有效改善了胃溃疡. 但是本文还存在一些不足之处, 本文仅对白果内脂对乙醇诱导的急性胃溃疡保护的NLRP3相关通路因子进行了研究, 未对其它通路进行分析, 尚不明确白果内脂是否通过其它通路对乙醇诱导的急性胃溃疡产生了相应的保护机制, 在今后的工作中将进一步对胃溃疡保护相关通路进行研究, 以完善白果内脂的作用机制. 综上所述, NLRP3相关通路因子参与了白果内脂对胃溃疡的保护, NLRP3相关通路通过抗炎作用达到改善胃溃疡的作用.
目前研究发现白果内脂可能对胃溃疡具有一定的保护作用, 但其作用机制尚不明确, NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3, NLRP3)相关通路在肠炎及肠道肿瘤等肠道疾病中具有重要的作用, 但其在胃溃疡中的相关作用研究较少.
基于目前研究我们推测在肠道疾病中发挥重要作用的NLRP3相关通路可能在胃溃疡发生发展中发挥着一定的作用, 且白果内酯对炎症因子的调控可能与胃溃疡的保护作用具有一定的相关性.
研究白果内脂通过NLRP3相关通路对乙醇诱导的急性胃溃疡的作用及其具体的分子机制, 以为胃溃疡的治疗提供可参考的理论依据.
本文以60只SD大鼠为研究对象, 构建了乙醇诱导的急性胃溃疡模型, 以奥美拉唑作为阳性对照, 分析不同剂量白果内酯对急性胃溃疡的胃液pH值、胃泌素、胃蛋白酶、溃疡指数(ulcer index, UI)、NLRP3、Caspase-1、IL-18、IL-1β、超氧化物歧化酶、丙二醛(malondialdehyde, MDA)和还原型谷胱甘肽等因子含量的影响.
醇诱导的急性胃溃疡模型大鼠UI、胃泌素、总酸度和胃蛋白酶总活性、MDA值、NLRP3、Caspase-1、IL-18、IL-1β、Caspase-1和ASC蛋白的mRNA水平和蛋白表达量均明显升高. 经奥美拉唑和不同剂量白果内酯治疗后的乙醇诱导胃溃疡大鼠胃泌素、总酸度、胃蛋白酶总活性、MDA值、NLRP3、Caspase-1、IL-18、IL-1β、Caspase-1和ASC蛋白的mRNA水平和蛋白表达量均明显较未治疗模型组降低.
白果内脂可通过NLRP3通路抗炎机制达到胃溃疡的保护作用.
本文为胃溃疡的治疗提供了新思路, 在今后的工作中将进一步分析白果内脂对乙醇诱导的急性胃溃疡保护作用除了NLRP3通路是否还有其他通路参与.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 1. | Mahmoud YI, Abd El-Ghffar EA. Spirulina ameliorates aspirin-induced gastric ulcer in albino mice by alleviating oxidative stress and inflammation. Biomed Pharmacother. 2019;109:314-321. [PubMed] [DOI] |
| 2. | Mousa AM, El-Sammad NM, Hassan SK, Madboli AENA, Hashim AN, Moustafa ES, Bakry SM, Elsayed EA. Antiulcerogenic effect of Cuphea ignea extract against ethanol-induced gastric ulcer in rats. BMC Complement Altern Med. 2019;19:345. [PubMed] [DOI] |
| 3. | Ichida T, Ueyama S, Eto T, Kusano F, Sakai Y. Randomized Controlled Trial Comparing the Effects of Vonoprazan Plus Rebamipide and Esomeprazole Plus Rebamipide on Gastric Ulcer Healing Induced by Endoscopic Submucosal Dissection. Intern Med. 2019;58:159-166. [PubMed] [DOI] |
| 4. | Bush J, van den Boom R, Franklin S. Comparison of aloe vera and omeprazole in the treatment of equine gastric ulcer syndrome. Equine Vet J. 2018;50:34-40. [PubMed] [DOI] |
| 5. | Slomiany BL, Slomiany A. Induction in gastric mucosal prostaglandin and nitric oxide by Helicobacter pylori is dependent on MAPK/ERK-mediated activation of IKK-β and cPLA2: modulatory effect of ghrelin. Inflammopharmacology. 2013;21:241-51. [PubMed] [DOI] |
| 6. | Wu H, Ming W, Tan J, Lu Q, Mulmi Shrestha S, Li N, Wu G, Zhang Z, Shi R. Role of MKP-5-p38/MAPK pathway in Clopidogrel-induced gastric mucosal epithelial cells apoptosis and tight junction dysfunction. Am J Transl Res. 2020;12:1741-1753. [PubMed] |
| 7. | Qian Y, Zhang J, Fu X, Yi R, Sun P, Zou M, Long X, Zhao X. Preventive Effect of Raw Liubao Tea Polyphenols on Mouse Gastric Injuries Induced by HCl/Ethanol via Anti-Oxidative Stress. Molecules. 2018;23:2848. [PubMed] [DOI] |
| 8. | Luan J, Zhang X, Wang S, Li Y, Fan J, Chen W, Zai W, Wang S, Wang Y, Chen M, Meng G, Ju D. NOD-Like Receptor Protein 3 Inflammasome-Dependent IL-1β Accelerated ConA-Induced Hepatitis. Front Immunol. 2018;9:758. [PubMed] [DOI] |
| 9. | Sheeja K, Lakshmi S. Nod-like receptor protein 3 inflammasome in head-and-neck cancer. J Cancer Res Ther. 2020;16:405-409. [PubMed] [DOI] |
| 10. | Pellegrini C, Antonioli L, Calderone V, Colucci R, Fornai M, Blandizzi C. Microbiota-gut-brain axis in health and disease: Is NLRP3 inflammasome at the crossroads of microbiota-gut-brain communications? Prog Neurobiol. 2020;191:101806. [PubMed] [DOI] |
| 11. | Xie C, Liu L, Zhu S, Wei M. Effectiveness and safety of Chinese medicine combined with omeprazole in the treatment of gastric ulcer: A protocol for systematic review and meta-analysis. Medicine (Baltimore). 2021;100:e25744. [PubMed] [DOI] |
| 12. | Bu S, Yuan CY, Xue Q, Chen Y, Cao F. Bilobalide Suppresses Adipogenesis in 3T3-L1 Adipocytes via the AMPK Signaling Pathway. Molecules. 2019;24. [PubMed] [DOI] |
| 13. | Zhang H, Wang Y, Su Y, Fang X, Guo W. The alleviating effect and mechanism of Bilobalide on ulcerative colitis. Food Funct. 2021;12:6226-6239. [PubMed] [DOI] |
| 14. | Hui S, Fangyu W. Protective effects of bilobalide against ethanol-induced gastric ulcer in vivo/vitro. Biomed Pharmacother. 2017;85:592-600. [PubMed] [DOI] |
| 15. | Wang LJ, Xue T, Wu YQ, Zhao JY, Wang TN, Li JT, Fu CL, Ma JJ, Zhang LP, Shao YX, Yang YC, Zhou ZX, Ma HF. [Effect of acupuncture on intestinal flora in rats with stress gastric ulcer]. Zhongguo Zhen Jiu. 2020;40:526-532. [PubMed] [DOI] |
| 16. | Rahman Z, Dwivedi DK, Jena GB. Ethanol-induced gastric ulcer in rats and intervention of tert-butylhydroquinone: Involvement of Nrf2/HO-1 signalling pathway. Hum Exp Toxicol. 2020;39:547-562. [PubMed] [DOI] |
| 17. | Liu J, Sun D, He J, Yang C, Hu T, Zhang L, Cao H, Tong AP, Song X, Xie Y, He G, Guo G, Luo Y, Cheng P, Zheng Y. Gastroprotective effects of several H2RAs on ibuprofen-induced gastric ulcer in rats. Life Sci. 2016;149:65-71. [PubMed] [DOI] |
| 18. | Tamaddonfard E, Erfanparast A, Farshid AA, Imani M, Mirzakhani N, Salighedar R, Tamaddonfard S. Safranal, a constituent of saffron, exerts gastro-protective effects against indomethacin-induced gastric ulcer. Life Sci. 2019;224:88-94. [PubMed] [DOI] |
| 19. | Kangwan N, Pintha K, Lekawanvijit S, Suttajit M. Rosmarinic Acid Enriched Fraction from Perilla frutescens Leaves Strongly Protects Indomethacin-Induced Gastric Ulcer in Rats. Biomed Res Int. 2019;2019:9514703. [PubMed] [DOI] |
| 20. | Aboul Naser A, Younis E, El-Feky A, Elbatanony M, Hamed M. Management of Citrus sinensis peels for protection and treatment against gastric ulcer induced by ethanol in rats. Biomarkers. 2020;25:349-359. [PubMed] [DOI] |
| 21. | Fahmi AA, Abdur-Rahman M, Aboul Naser AF, Hamed MA, Abd-Alla HI, Nasr MI. Pulicaria crispa mitigates gastric ulcer induced by ethanol in rats: role of treatment and auto healing. Biomarkers. 2019;24:286-294. [PubMed] [DOI] |
| 22. | Kwon DA, Kim YS, Baek SH, Kim SK, Kim HK, Jo SK, Jung U, Park HR, Lee HS. Protective effects of a standardized extract (HemoHIM) using indomethacin- and ethanol/HCl-induced gastric mucosal injury models. Pharm Biol. 2019;57:543-549. [PubMed] [DOI] |
| 23. | Beiranvand M, Bahramikia S. Ameliorating and protective effects mesalazine on ethanol-induced gastric ulcers in experimental rats. Eur J Pharmacol. 2020;888:173573. [PubMed] [DOI] |
| 24. | Sistani Karampour N, Arzi A, Rezaie A, Pashmforoosh M, Kordi F. Gastroprotective Effect of Zingerone on Ethanol-Induced Gastric Ulcers in Rats. Medicina (Kaunas). 2019;55. [PubMed] [DOI] |
| 25. | Ising C, Venegas C, Zhang S, Scheiblich H, Schmidt SV, Vieira-Saecker A, Schwartz S, Albasset S, McManus RM, Tejera D, Griep A, Santarelli F, Brosseron F, Opitz S, Stunden J, Merten M, Kayed R, Golenbock DT, Blum D, Latz E, Buée L, Heneka MT. NLRP3 inflammasome activation drives tau pathology. Nature. 2019;575:669-673. [PubMed] [DOI] |
| 26. | Zhen Y, Zhang H. NLRP3 Inflammasome and Inflammatory Bowel Disease. Front Immunol. 2019;10:276. [PubMed] [DOI] |
| 27. | Mridha AR, Wree A, Robertson AAB, Yeh MM, Johnson CD, Van Rooyen DM, Haczeyni F, Teoh NC, Savard C, Ioannou GN, Masters SL, Schroder K, Cooper MA, Feldstein AE, Farrell GC. NLRP3 inflammasome blockade reduces liver inflammation and fibrosis in experimental NASH in mice. J Hepatol. 2017;66:1037-1046. [PubMed] [DOI] |
| 28. | Song N, Li T. Regulation of NLRP3 Inflammasome by Phosphorylation. Front Immunol. 2018;9:2305. [PubMed] [DOI] |
| 29. | Sharif H, Wang L, Wang WL, Magupalli VG, Andreeva L, Qiao Q, Hauenstein AV, Wu Z, Núñez G, Mao Y, Wu H. Structural mechanism for NEK7-licensed activation of NLRP3 inflammasome. Nature. 2019;570:338-343. [PubMed] [DOI] |
| 30. | Abdellatif KRA, Fadaly WAA, Kamel GM, Elshaier YAMM, El-Magd MA. Design, synthesis, modeling studies and biological evaluation of thiazolidine derivatives containing pyrazole core as potential anti-diabetic PPAR-γ agonists and anti-inflammatory COX-2 selective inhibitors. Bioorg Chem. 2019;82:86-99. [PubMed] [DOI] |
| 31. | Li N, Zhou H, Wu H, Wu Q, Duan M, Deng W, Tang Q. STING-IRF3 contributes to lipopolysaccharide-induced cardiac dysfunction, inflammation, apoptosis and pyroptosis by activating NLRP3. Redox Biol. 2019;24:101215. [PubMed] [DOI] |
| 32. | Xie L, Guo YL, Chen YR, Zhang LY, Wang ZC, Zhang T, Wang B. A potential drug combination of omeprazole and patchouli alcohol significantly normalizes oxidative stress and inflammatory responses against gastric ulcer in ethanol-induced rat model. Int Immunopharmacol. 2020;85:106660. [PubMed] [DOI] |