修回日期: 2022-07-22
接受日期: 2022-09-20
在线出版日期: 2022-09-28
溶瘤病毒作为治疗癌症的新手段, 具有疗效快, 靶向性强, 无细胞毒性等特点, H101作为商品化上市的溶瘤病毒表现出了稳定的抗癌特效, 为中晚期胃癌患者的腹膜转移治疗提供了可能.
探讨H101对胃癌细胞增殖、迁移、凋亡的调控作用及其相关机制研究.
将BGC-823和SGC-7901两种胃癌细胞系培养在6孔板中, 分别加入感染复数(multiplicity of infection, MOI)值为1、5、10、15的H101, 作用48 h后, 用MTS法检测细胞的存活率, 免疫印迹法(western blot, WB)检测腺病毒早期区1(adenovirus early region 1, E1A)的表达. 选取SGC-7901细胞, 用划痕法检测各组细胞48 h的迁移率, Hoechst33342染液, 观察H101作用48 h后凋亡小体的形成情况. Western blot检测细胞凋亡相关蛋白的表达.
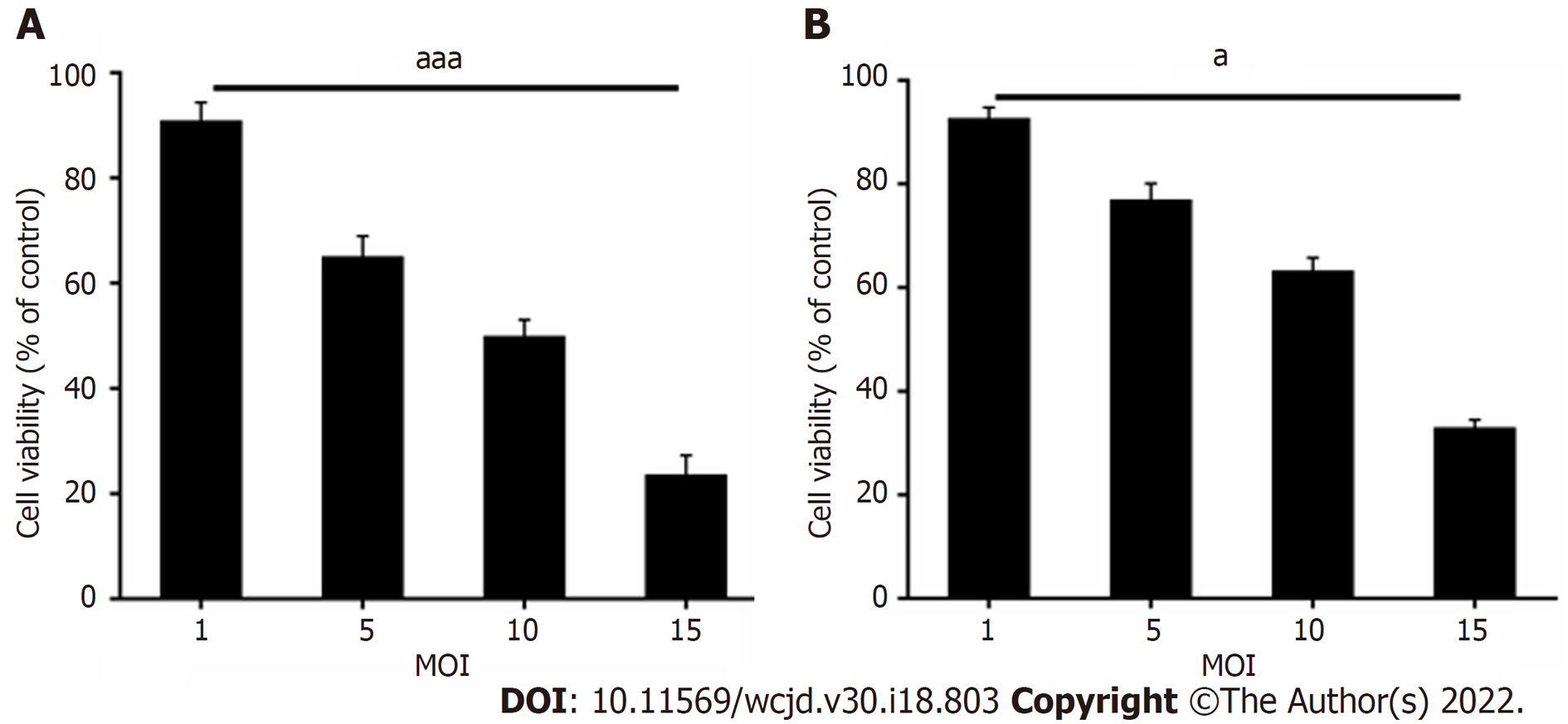
WB结果显示, H101中的EIA表达量比对照组更高, 差异具有统计学意义(P<0.05). MTS结果显示与MOI值为1时相比, MOI值为15的时候, H101在体外可以明显杀伤BGC-823和SGC-79012种胃癌肿瘤细胞(P<0.05). 在增殖实验中发现相对于BGC-823细胞, SGC-7901细胞对H101的敏感性更差, 因此选取敏感性相对较差的SGC-7901细胞作为研究重点. 48 h后, 与对照组和MOI = 1组的迁移距离相比, MOI = 5组, MOI = 10组和MOI = 15组的迁移距离明显更低, (P均<0.05). 与MOI = 1组相比, MOI = 5、MOI = 10和MOI = 15组的凋亡小体数量更多(P均<0.05), 与对照组和MOI = 1组相比, MOI = 5、MOI = 5和MOI = 10组的B淋巴细胞瘤-2蛋白(B-cell lymphoma-2, Bcl-2)表达量较低(P均<0.05), 而凋亡蛋白(BCL2-associated X, Bax)、半胱氨酸蛋白酶-3(cysteinyl aspartate specific proteinase-3, Caspase-3)表达量均更高(P均<0.05).
H101能够抑制胃癌细胞的增殖、迁移, 提高细胞凋亡相关蛋白的表达量, 加速细胞的凋亡.
核心提要: 溶瘤病毒在一定的感染复数(multiplicity of infection, MOI)值下, 通过影响Caspase信号通路的相关蛋白, 对胃癌细胞作用48 h能够有效抑制胃癌细胞的增值和转移, 并促进癌细胞的凋亡.
引文著录: 邵苏, 徐鹏飞, 占小平. H101对胃癌细胞增殖、迁移、凋亡的调控作用及其相关机制研究. 世界华人消化杂志 2022; 30(18): 803-809
Revised: July 22, 2022
Accepted: September 20, 2022
Published online: September 28, 2022
As a new means of cancer treatment, oncolytic virus has the characteristics of rapid efficacy, strong targeting, and no cytotoxicity. H101, as a commercially marketed oncolytic virus, has shown stable anticancer effect, which provides a possibility for the treatment of peritoneal metastasis in patients with advanced gastric cancer.
To investigate the effects of H101 on proliferation, migration, and apoptosis of gastric cancer cells and the underlying mechanisms.
The gastric cancer cell lines BGC-823 and SGC-7901were cultured in 6-well plates, and H101 with multiplicity of infection (MOI) values of 1, 5, 10, and 15 were added, respectively. After treatment for 48 h, MTS method was used to detect the cell survival rate, and Western blot was used to detect the expression of E1A. SGC-7901 cells were then selected and cell mobility was detected by the scratch test. Hoechst33342 dye was used to observe the formation of apoptotic bodies after treatment with H101 for 48 h. The expression of apoptosis-related proteins was detected by Western blot.
Western blot analysis showed that EIA expression in cells treated with H101 was significantly higher than that in the control group (P < 0.05). MTS assay showed that H101 with an MOI value of 15 could more significantly kill BGC-823 and SGC-79012 cells in vitro than in that with an MOI value of 1 (P < 0.05). After 48 h, the migration distance of cells in the MOI = 5, MOI = 10, and MOI = 15 groups was significantly lower than that of the control group and MOI = 1 group (P < 0.05). Compared with the MOI = 1 group, the MOI = 5, MOI = 10, and MOI = 15 groups had significantly more apoptotic bodies (P < 0.05), and the expression levels of Bcl-2, Bax, and Caspase were significantly higher in the MOI = 5, MOI = 5, and MOI = 10 groups than in the control group and MOI = 1 group (P < 0.05).
H101 can inhibit the proliferation and migration of gastric cancer cells, increase the expression of apoptosis-related proteins, and accelerate the apoptosis of gastric cancer cells.
- Citation: Shao S, Xu PF, Zhan XP. Effects of H101 on proliferation, migration, and apoptosis of gastric cancer cells and underlying mechanisms. Shijie Huaren Xiaohua Zazhi 2022; 30(18): 803-809
- URL: https://www.wjgnet.com/1009-3079/full/v30/i18/803.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i18.803
胃癌(gastric cancer, GC)是消化系统常见的恶性肿瘤. 据美国癌症学会2018年全球癌症统计数据报告, 2018年全球胃癌发病率第6位, 死亡率第2位. 据中国癌症中心2019年发布的年度报告, 在我国胃癌高居恶性肿瘤发病率第2位,死亡率第3位[1,2]. 胃癌患者由于缺乏有效筛查手段, 通常在被诊断时就是晚期阶段, 或已发生远处转移而失去手术根治的机会. 胃癌腹膜转移是晚期胃癌患者首要死亡原因之一, 也是临床胃癌治疗的难点. 对于胃癌腹膜转移的患者, 化疗药物是治疗的首要选择. 面临着毒副作用大、治愈率低、易出现药物耐受等问题[3,4]. 溶瘤病毒作为有效抗癌剂, 在治疗胃癌的腹膜转移, 加快肿瘤的消退速度中展现了不错的效果. 但是给药方式也是治疗胃癌中非常重要的环节, 相比较其他给药方式, 反复腹膜内给药更适应临床环境[5]. 在临床试验中, H101在显示了良好的抗肿瘤疗效和安全性, 其上市后临床应用显示对头颈部肿瘤、肝癌、胰腺癌等消化道肿瘤均有良好的治疗效果[6,7]. H101是第一个在全球批准上市的溶瘤病毒类抗肿瘤新药, 但是目前尚无将其用于治疗胃癌腹膜转移模型的相关报道. 因此, 本研究通过溶瘤病毒H101对胃癌细胞的体外作用, 观察其对胃癌细胞的影响, 并探讨发生机制, 以期为胃癌腹膜转移患者的治疗提供依据.
BGC-823细胞系(ATCC), SGC-7901(ATCC), MTS检测试剂盒(Abcam), Hoechst33342荧光染料(北京索莱宝), 鼠抗人E1A、B淋巴细胞瘤-2蛋白(B-cell lymphoma-2, Bcl-2)、凋亡蛋白(BCL2-associated X, Bax)、半胱氨酸蛋白酶-3(cysteinyl aspartate specific proteinase, Caspase-3)的特异性抗体(Abcam), 羊抗鼠辣根过氧化物酶标记的二抗(Abcam), H101(上海三维生物技术有限公司, 规格: 5.0×1011/支).
1.2.1 MTS检测细胞活率: 取对数生长期的胃癌细胞, 消化收集细胞, 调整细胞浓度, 接种至96孔板, 每孔103个细胞, 贴壁过夜; 加入不同浓度的H101[感染复数(multiplicity of infection, MOI)值分别为1、5、10、15], 继续培养48 h, 加入MTS, 继续培养4 h后用酶标仪检测吸光值. 将不加H101的对照组看做100%, 各个浓度组的吸光度与对照组的比值, 即为细胞存活率. MOI值 = 病毒滴度×病毒体积/细胞个数.
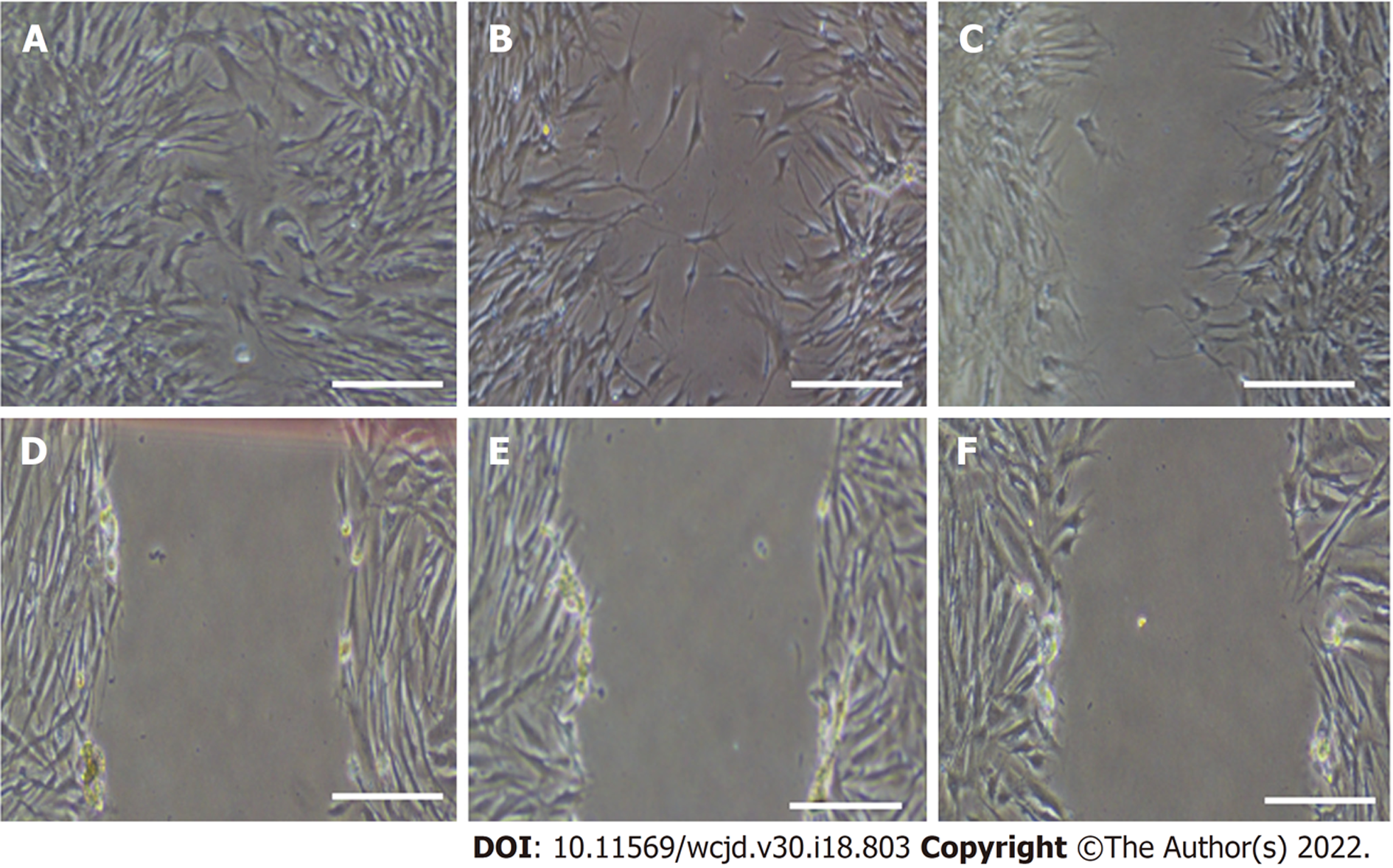
1.2.2 细胞划痕实验: 先用marker笔在6孔板背后, 用直尺比着, 均匀地划横线, 大约每隔0.5 cm-1 cm一道, 横穿过孔. 每孔至少穿过5条线. 每孔加入约5×105个细胞, 培养过夜. 第二天用枪头比着直尺, 尽量垂直于背后的横线划痕. 用PBS洗细胞3次, 去除划下的细胞, 加入不同浓度的H101(MOI值分别为1、5、10、15)和无血清培养基. 放入37 ℃, 5% CO2培养箱培养, 48 h后取样, 拍照, 每孔随机选择5处计算划痕宽度, 取平均值.
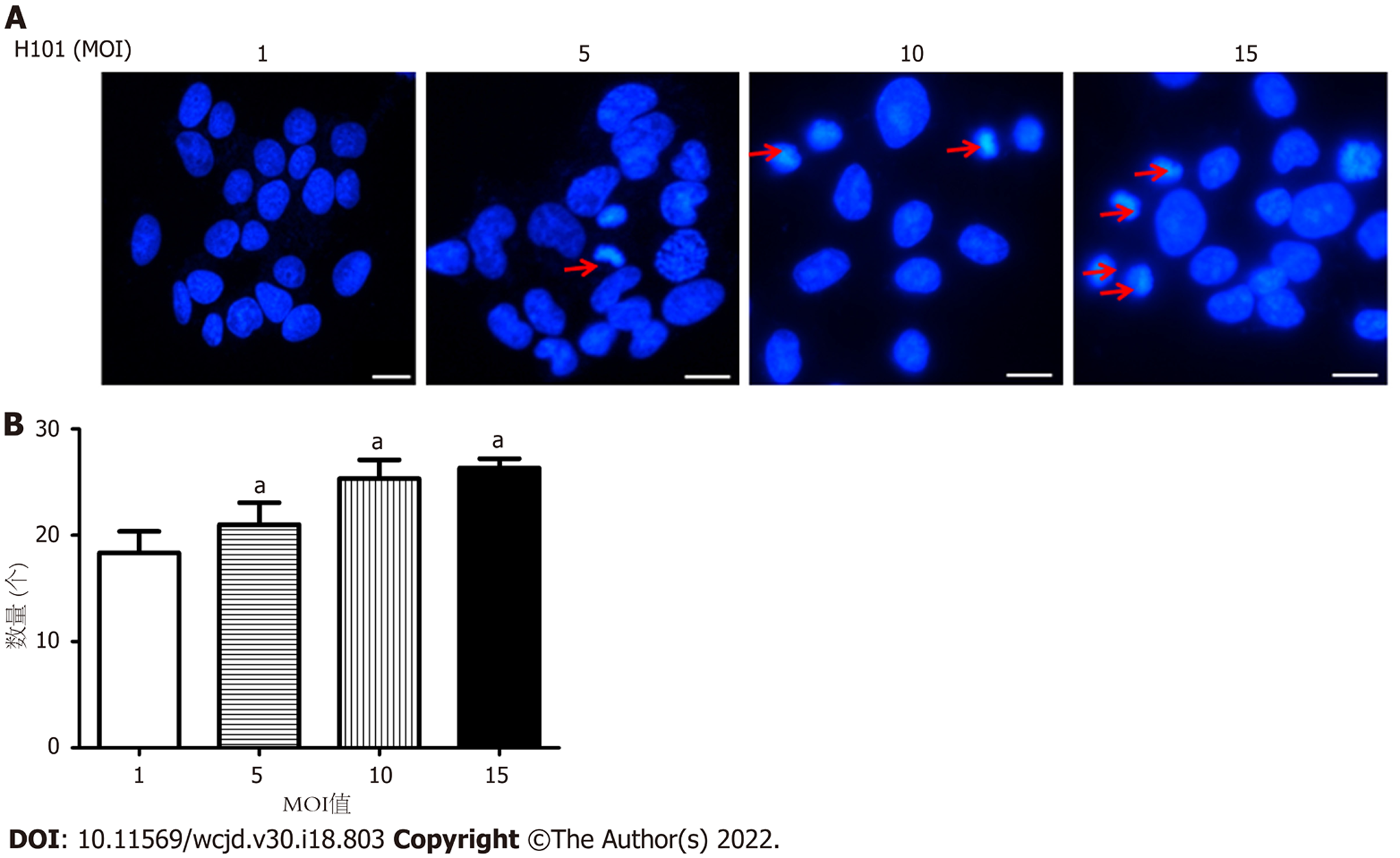
1.2.3 Hoechst33342染色检测细胞凋亡: 胃癌细胞BGC-823接种于24孔细胞板的细胞爬片上, 每孔2×104个细胞, 加入不同浓度的溶瘤腺病毒H101(MOI值分别为1、5、10、15)处理48 h. 向24孔板中加入Hoechst33342染液, 避光室温染色10 min, 滴加含有DAPI(4,6-diamino-2-phenyl indole)的封片剂于载玻片上, 随后放上细胞爬片进行封片操作, 荧光显微镜下观察, 结果显示H101可以有效诱导凋亡小体的形成.
1.2.4 Western blot检测细胞相关蛋白的表达: 取对数生长期的胃癌细胞, 消化收集细胞, 调整细胞浓度, 接种至6孔板, 每孔105个细胞, 贴壁过夜; 加入不同浓度的H101(MOI值分别为1、5、10、15)继续培养48 h; 利用RIPA(Radio Immunoprecipitation Assay)裂解液提取细胞总蛋白, 进行Western blot, 检测Bcl-2、Bax和Caspase-3通路的表达调控作用.
统计学处理 用SPSS 25.0统计学软件分析, 计量资料用mean±SD表示, 方差齐性行F检验, 符合正态分布行t检验, 其余行校正t检验. 计数资料用%表示, 行χ2检验, P<0.05表示有统计学意义.
溶瘤腺病毒H101处理48 h后, 把对照组看做100%, MTS结果显示与MOI值为1时相比, MOI值为15的时候, H101在体外可以明显杀伤BGC-823和SGC-79012种胃癌肿瘤细胞, 差异具有统计学意义(PBGC-823 = 0.024, PSGC-79012 = 0.004), 如图1. Western blot检测E1A表达情况, 进而验证H101可以在胃癌细胞中有效复制(图2). 在增殖实验中发现相对于BGC-823细胞, SGC-7901细胞对H101的敏感性更差, 因此选取敏感性较差的SGC-7901细胞作为研究重点.
48 h后, 与对照组的迁移距离(0.42±0.07) mm和MOI = 1组的迁移距离(0.38±0.08) mm相比, MOI = 5组, MOI = 10组和MOI = 15组的迁移距离(0.25±0.05) mm, (0.15±0.04) mm, (0.16±0.04) mm明显更低,, (PMOI5 = 0.032, PMOI10 = 0.022, PMOI15 = 0.026), 如图3.
48 h后, 与MOI = 1组相比, MOI = 5、MOI = 10和MOI = 15组的凋亡小体数量更多(PMOI5 = 0.044, PMOI10 = 0.035, PMOI15 = 0.021), 如图4.
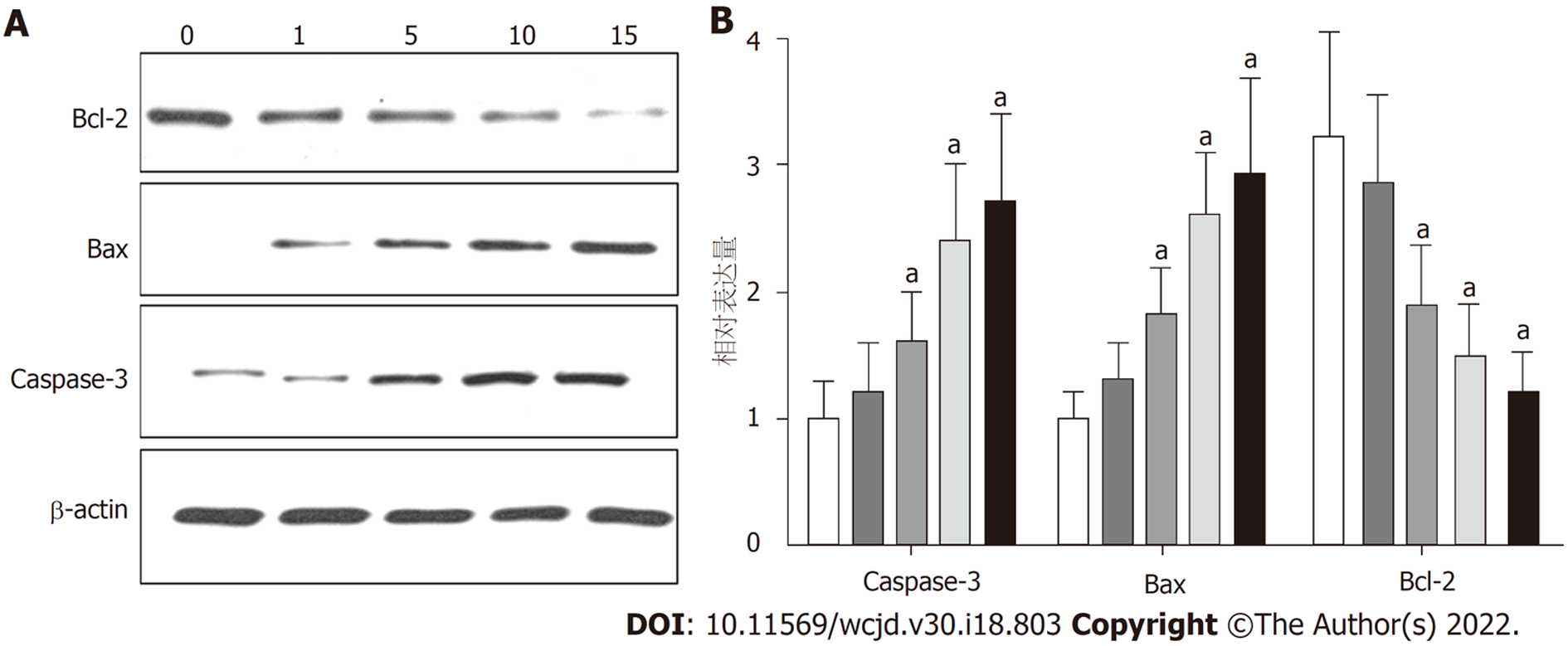
与对照组和MOI = 1组相比, MOI = 5、MOI = 5和MOI = 10组的Bcl-2表达量较低(PMOI5 = 0.035, PMOI10 = 0.028, PMOI15 = 0.016); 而Bax表达量更高(PMOI5 = 0.036, PMOI10 = 0.021, PMOI15 = 0.019); Caspase-3表达量更高(PMOI5 = 0.035, PMOI10 = 0.027, PMOI15 = 0.011), 如图5.
胃癌腹膜转移的具体机制尚未完全明确, 目前大多数学者较为认同的发病机制为"种子土壤"学说[8,9]. 早期胃癌腹膜转移无明显的症状, 很难被检测. 晚期的腹膜转移容易被检测, 但术后效果差. 常用的腹膜转移检测方法有影像学检查、腹腔冲洗液细胞学检查、标记物检测等, 但都不能作为唯一的诊断依据, 需要多种方法共同诊断做出精确的判断[10,11]. 由于胃癌患者发生腹膜转移治疗效果不佳且预后效果差, 因此腹膜转移的发生机制、诊断以及治疗方案问题亟待解决. 研究显示, 化疗、腹腔灌注化疗、腹腔热灌注化疗、免疫治疗及手术等多种方法联合进行预防式治疗及治疗, 提高患者的生存质量. 溶瘤病毒(oncolytic virus, OV)是指一类天然或者经过基因改造后可以特异性靶向和杀死癌细胞的病毒, 同时它还能激发免疫反应, 吸引更多免疫细胞来继续杀死残余癌细胞[12,13]. 相较于其他肿瘤免疫疗法, 溶瘤病毒具有杀伤效率高、靶向性好、副作用小、多种肿瘤杀伤途径以避免耐药性以及成本低廉等优点[14,15]. 因此, 溶瘤病毒疗法作为一种新型癌症治疗策略, 在癌症治疗领域受到越来越多的关注. 目前已在多种体内肿瘤模型和临床试验中得到证实溶瘤病毒在肿瘤治疗中具有良好的安全性和耐受性.
H101为的线性双链DNA病毒, 删除了E1B-55KD基因和E3部分基因片段的人5型腺病毒. E1B-55KD可以抑制p53, 利于病毒复制、并协助晚期mRNA的出核转录翻译, 删除后P53将导致细胞周期停滞或诱导凋亡, 阻碍病毒复制并影响晚期mRNA出核. 肿瘤细胞由于遗传的不稳定性, 细胞核的核孔变大, 弥补E1B-55KD的作用, 即使病毒删除了E1B-55KD, 病毒晚期mRNA的出核仍不受影响, 可顺利完成复制. E3主要是破坏宿主的免疫防御机制, 删除后将会增强溶瘤反应, 提高免疫诱导能力, 杀死肿瘤细胞, 诱导全身、长期特异性抗肿瘤免疫反[16,17]. Kawaguchi等[18]将溶瘤病毒作为有效抗癌剂治疗胃癌腹膜转移, 发现肿瘤消退程度增加, 同时也验证了相比于其他给药方式, 反复腹膜内给药更适应临床环境. 在临床试验中, H101在显示了良好的抗肿瘤疗效和安全性, 其上市后临床应用显示对头颈部肿瘤、肝癌、胰腺癌等消化道肿瘤、宫颈癌、其它肿瘤伴恶性胸腹腔积液等均有良好的治疗效果[19,20]. 本研究通过对不同浓度H101对胃癌细胞的作用发现, 在MOI值大于5的时候能明显抑制胃癌细胞的生长, 并诱导胃癌细胞凋亡, 当MOI值大于10的时候抑制胃癌细胞增殖和迁移, 促进细胞凋亡的效果达到最大化, 表现出了强烈的抗胃癌肿瘤作用. 在增殖实验中发现相对于BGC-823细胞, SGC-7901细胞对H101的敏感性更差, 因此选取敏感性较差的SGC-7901细胞作为研究重点.
Caspase-3作为caspase级联反应下游最关键的凋亡执行者, 在很大程度上依赖于cyt-c的释放, 而bcl-2和bax基因是目前已知的细胞凋亡中最重要的调节基因, 可以通过线粒体途径介导cyt-c等物质的释放. bcl-2和bax不仅可以作为Caspase-3的上游调控机制, 参与对Caspase-3的调节, 还可以作为Caspase-3的直接底物作用于Caspase-3的下游[21,22]. 本研究通过不同MOI值的H101对胃癌细胞的作用发现与对照组和MOI = 1组相比, MOI = 5、MOI = 5和MOI = 10组的Bcl-2均更低, 而Bax、Caspase-3表达量均更高. 表明高浓度的H101可以调节凋亡蛋白Bcl-2、Bax、Caspase-3的表达.
综上所述, H101能够抑制胃癌细胞的增殖、迁移, 提高细胞凋亡相关蛋白的表达量, 加速细胞的凋亡.
胃癌作为发病率较高的消化道肿瘤, 以手术治疗为主, 但是在发病的中晚期癌细胞易发生腹膜的转移, 手术无法根除, 死亡风险提升.
胃癌患者发生腹膜转移的发生机制和治疗方案问题亟待解决. 晚期患者手术无法根除, 化疗效果不理想, 加重身体负担, 溶瘤病毒不仅可以靶向杀死癌细胞, 还能激发免疫反应.
溶瘤病毒H101作为稳定的上市产品在治疗多种癌症方面都取得一定的疗效, 本研究旨在探讨H101对胃癌细胞的体外生存影响以及相关发生机制.
本研究主要通过体外细胞培养, MTS检测细胞活率, 划痕检测细胞迁移, WB法检测蛋白表达等方法进行, 数据分析采用统计学软件SPSS 25.0.
处理48 h后, 感染复数(multiplicity of infection, MOI)值为15的时候, H101在体外可以明显杀伤BGC-823和SGC-7901胃癌细胞, SGC-7901细胞对H101的敏感性更差; MOI = 5组, MOI = 10组和MOI = 15组的迁移距离更低, 凋亡小体数量更多, B淋巴细胞瘤-2蛋白(B-cell lymphoma-2, Bcl-2)表达量较低, 凋亡蛋白(BCL2-associated X, Bax)和半胱氨酸蛋白酶-3(cysteinyl aspartate specific proteinase, Caspase-3)表达量更高.
H101在抑制胃癌细胞的增殖、迁移的同时, 还能通过调节Caspase相关的凋亡蛋白的表达, 进而促进胃癌细胞的凋亡.
本研究主要从体外细胞层面探讨研究H101对胃癌的抑制效果, 但是治疗是在体内进行, 因此为了进一步证实研究结论的正确性仍需开动物实验、临床试验等数据的支持.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D, D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 2. | Smyth EC, Nilsson M, Grabsch HI, van Grieken NC, Lordick F. Gastric cancer. Lancet. 2020;396:635-648. [PubMed] [DOI] |
| 3. | Thrift AP, El-Serag HB. Burden of Gastric Cancer. Clin Gastroenterol Hepatol. 2020;18:534-542. [PubMed] [DOI] |
| 4. | Tan Z. Recent Advances in the Surgical Treatment of Advanced Gastric Cancer: A Review. Med Sci Monit. 2019;25:3537-3541. [PubMed] [DOI] |
| 5. | Zhang H, Li Y, Wang HB, Zhang A, Chen ML, Fang ZX, Dong XD, Li SB, Du Y, Xiong D, He JY, Li MZ, Liu YM, Zhou AJ, Zhong Q, Zeng YX, Kieff E, Zhang Z, Gewurz BE, Zhao B, Zeng MS. Ephrin receptor A2 is an epithelial cell receptor for Epstein-Barr virus entry. Nat Microbiol. 2018;3:1-8. [PubMed] [DOI] |
| 6. | Wei D, Xu J, Liu XY, Chen ZN, Bian H. Fighting Cancer with Viruses: Oncolytic Virus Therapy in China. Hum Gene Ther. 2018;29:151-159. [PubMed] [DOI] |
| 7. | Duan Y, Bai H, Li X, Wang D, Wang Y, Cao M, Zhang N, Chen H, Wang Y. Oncolytic Adenovirus H101 Synergizes with Radiation in Cervical Cancer Cells. Curr Cancer Drug Targets. 2021;21:619-630. [PubMed] [DOI] |
| 8. | Chen D, Liu Z, Liu W, Fu M, Jiang W, Xu S, Wang G, Chen F, Lu J, Chen H, Dong X, Li G, Chen G, Zhuo S, Yan J. Predicting postoperative peritoneal metastasis in gastric cancer with serosal invasion using a collagen nomogram. Nat Commun. 2021;12:179. [PubMed] [DOI] |
| 9. | Dong D, Tang L, Li ZY, Fang MJ, Gao JB, Shan XH, Ying XJ, Sun YS, Fu J, Wang XX, Li LM, Li ZH, Zhang DF, Zhang Y, Li ZM, Shan F, Bu ZD, Tian J, Ji JF. Development and validation of an individualized nomogram to identify occult peritoneal metastasis in patients with advanced gastric cancer. Ann Oncol. 2019;30:431-438. [PubMed] [DOI] |
| 10. | Kodera Y. Gastric cancer with minimal peritoneal metastasis: is this a sign to give up or to treat more aggressively? Nagoya J Med Sci. 2013;75:3-10. [PubMed] |
| 11. | Riihimäki M, Hemminki A, Sundquist K, Sundquist J, Hemminki K. Metastatic spread in patients with gastric cancer. Oncotarget. 2016;7:52307-52316. [PubMed] [DOI] |
| 12. | Riihimäki M, Hemminki A, Sundquist K, Sundquist J, Hemminki K. Metastatic spread in patients with gastric cancer. Oncotarget. 2016;7:52307-52316. [PubMed] [DOI] |
| 13. | Raja J, Ludwig JM, Gettinger SN, Schalper KA, Kim HS. Oncolytic virus immunotherapy: future prospects for oncology. J Immunother Cancer. 2018;6:140. [PubMed] [DOI] |
| 14. | Taguchi S, Fukuhara H, Todo T. Oncolytic virus therapy in Japan: progress in clinical trials and future perspectives. Jpn J Clin Oncol. 2019;49:201-209. [PubMed] [DOI] |
| 15. | Fu LQ, Wang SB, Cai MH, Wang XJ, Chen JY, Tong XM, Chen XY, Mou XZ. Recent advances in oncolytic virus-based cancer therapy. Virus Res. 2019;270:197675. [PubMed] [DOI] |
| 16. | Li Y, He J, Qiu C, Shang Q, Qian G, Fan X, Ge S, Jia R. The oncolytic virus H101 combined with GNAQ siRNA-mediated knockdown reduces uveal melanoma cell viability. J Cell Biochem. 2019;120:5766-5776. [PubMed] [DOI] |
| 17. | Zhang R, Cui Y, Guan X, Jiang X. A Recombinant Human Adenovirus Type 5 (H101) Combined With Chemotherapy for Advanced Gastric Carcinoma: A Retrospective Cohort Study. Front Oncol. 2021;11:752504. [PubMed] [DOI] |
| 18. | Kawaguchi K, Etoh T, Suzuki K, Mitui MT, Nishizono A, Shiraishi N, Kitano S. Efficacy of oncolytic reovirus against human gastric cancer with peritoneal metastasis in experimental animal model. Int J Oncol. 2010;37:1433-1438. [PubMed] [DOI] |
| 19. | Ma J, Li N, Zhao J, Lu J, Ma Y, Zhu Q, Dong Z, Liu K, Ming L. Histone deacetylase inhibitor trichostatin A enhances the antitumor effect of the oncolytic adenovirus H101 on esophageal squamous cell carcinoma in vitro and in vivo. Oncol Lett. 2017;13:4868-4874. [PubMed] [DOI] |
| 20. | Lu W, Zheng S, Li XF, Huang JJ, Zheng X, Li Z. Intra-tumor injection of H101, a recombinant adenovirus, in combination with chemotherapy in patients with advanced cancers: a pilot phase II clinical trial. World J Gastroenterol. 2004;10:3634-3638. [PubMed] [DOI] |
| 21. | Zhang Y, Yang X, Ge X, Zhang F. Puerarin attenuates neurological deficits via Bcl-2/Bax/cleaved caspase-3 and Sirt3/SOD2 apoptotic pathways in subarachnoid hemorrhage mice. Biomed Pharmacother. 2019;109:726-733. [PubMed] [DOI] |
| 22. | Changizi Z, Moslehi A, Rohani AH, Eidi A. Chlorogenic acid induces 4T1 breast cancer tumor's apoptosis via p53, Bax, Bcl-2, and caspase-3 signaling pathways in BALB/c mice. J Biochem Mol Toxicol. 2021;35:e22642. [PubMed] [DOI] |