修回日期: 2022-04-15
接受日期: 2022-05-25
在线出版日期: 2022-06-08
胃癌浆膜类型是指癌组织浸润到浆膜层引起的变化类型, 术中观察到的浆膜类型直接影响胃癌患者预后. 不同浆膜类型胃癌患者预后存在明显的差异性, 但是临床上对于其危险因素缺乏统一标准. 同时, 控制营养状态评分(control nutritional status, CONUT)作为胃癌预后的风险因素, 但对不同浆膜类型患者预后的影响尚不可知.
研究影响不同浆膜类型胃癌患者预后的危险因素, 控制营养状态评分对预后的影响.
将2015-01/2017-01在我院胃肠外科进行胃癌根治术的326例患者纳入本次研究. 参照分型和观察浆膜形状将所有纳入患者分为4组, 分别为正常型和反应型(86例)、结节型(88例)、腱状型(67例)、多彩弥漫型(85例), 随访至患者死亡或随访至2022-01, 记录患者临床和病理指标, 采用Cox模型预后生存分析探究影响不同浆膜类型胃癌患者的预后危险因素.
Cox模型预后生存分析结果显示正常型和反应型、结节型患者其生存因素为TNM分期、CONUT(P<0.05); 腱状型生存因素为肿瘤分化和TNM分期(P<0.05); 多彩弥漫型生存因素为肿瘤分化、TNM分期、淋巴结转移(P<0.05). 正常型和反应型、结节型CONUT低分和高分患者5年生存率具有统计学意义(P<0.05), 腱状型和多彩弥漫型CONUT低分和高分患者5年生存率均无统计学意义.
不同浆膜类型胃癌患者具有不同的生存影响因素, 在临床上可根据患者的不同影响因素预测不同浆膜类型患者的预后; 术前控制营养状态评分作为评估不同浆膜类型胃癌患者预后的指标之一, 可提示该患者预后稍差.
核心提要: 胃癌是我国发病率较高的恶性肿瘤之一, 早期症状不明显, 多数患者确诊时已经是进展期胃癌, 患者术后5年生存率为90.0%, 但是进展期胃癌5年生存率<30.0%. 胃癌的预后与浆膜类型、营养状态存在紧密联系, 分析不同浆膜类型胃癌患者生存影响因素, 阐述营养状态对预后的影响, 可为临床治疗提供参考依据.
引文著录: 吴辰, 魏云海, 沈小英, 尹磊, 汪伟民. 不同浆膜类型胃癌患者预后的影响因素及CONUT的评估分析. 世界华人消化杂志 2022; 30(11): 477-483
Revised: April 15, 2022
Accepted: May 25, 2022
Published online: June 8, 2022
Serosal type of gastric cancer refers to the changes caused by the infiltration of cancer tissue into the serosal layer. The serosal type observed during operation directly affects the prognosis of patients with gastric cancer. There are significant differences in the prognosis of patients with different serosal types of gastric cancer, but there is no unified standard for its risk factors in the clinic. Controlling nutritional status (CONUT) score is a risk factor for the prognosis of gastric cancer, but its impact on the prognosis of patients with different serosal types of gastric cancer is unknown.
To identify the risk factors affecting the prognosis of patients with different serosal types of gastric cancer, and to control the effect of CONUT score on the prognosis.
A total of 326 patients who underwent radical gastrectomy at the Department of Gastrointestinal Surgery of our hospital from January 2015 to January 2017 were included in this study. According to the classification and observation of serous shape, all patients were divided into four groups: Normal and reactive type (86 cases), nodular type (88 cases), tendon type (67 cases), and colorful diffuse type (85 cases). The patients were followed until death or January 2022. The clinical and pathological indexes were recorded and Cox model prognostic survival analysis was performed to explore the prognostic risk factors for patients with different serous types of gastric cancer.
Cox prognostic survival analysis showed that the survival factors for normal, reactive, and nodular patients were TNM stage and CONUT (P < 0.05); those for tendon type were tumor differentiation and TNM stage (P < 0.05); and those for colorful diffuse type were tumor differentiation, TNM stage, and lymph node metastasis (P < 0.05). In patients with normal and reactive type, and nodular type, the 5-year survival rate was statistically significant between patients with low and high CONUT score (P < 0.05), while in patients with tendon type and colorful diffuse type, the 5-year survival rate did not differ significantly between patients with low score and high CONUT score (P > 0.05).
Patients with different serosal types of gastric cancer have different survival influencing factors. Clinically, the prognosis of patients with different serosal types can be predicted according to their different influencing factors. Preoperative CONUT score, as one of the indicators to evaluate the prognosis of patients with different serosal types of gastric cancer, indicates a slightly worse prognosis.
- Citation: Wu C, Wei YH, Shen XY, Yin L, Wang WM. Prognostic factors for gastric cancer patients with different serosal types. Shijie Huaren Xiaohua Zazhi 2022; 30(11): 477-483
- URL: https://www.wjgnet.com/1009-3079/full/v30/i11/477.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i11.477
胃癌是临床上十分常见的肿瘤疾病, 胃癌死亡率位居我国消化道恶性肿瘤的首位, 每年约有20万人死于胃癌, 在全部恶性肿瘤死亡率中占1/4, 且每年新增胃癌人数达两万人[1]. 胃癌的早期症状不明显, 随着病情的不断发展会出现消化不良及胃痛等胃部症状 [2]. 防止癌细胞扩散的最后一道屏障是胃壁的浆膜层, 临床上判断进展期胃部肿瘤患者手术治疗后的重要指标是胃壁浆膜面是否受到侵袭. 浆膜类型对胃癌的分期有直接影响, 对胃癌的预后效果也有一定的作用[3]. 控制营养状态评分主要对血清总胆固醇水平、外周血管淋巴细胞总数和血清蛋白水平进行计算, 是一种简单、便捷、全面评估机体营养状态, 在多种临床疾病的预后均有很好的预测作用[4]. 但我国尚无不同浆膜型胃癌患者的生存预后分析及在不同控制营养状态评分(control nutritional status, CONUT)的生存状况研究. 本文旨在研究不同浆膜类型胃癌患者预后的危险因素及分析在不同CONUT评分的生存状况.
将2015-01/2017-01在我院胃肠外科进行胃癌根治术的326例患者纳入本次研究. 入组标准: (1)术中观察浆膜类型清晰可见[5]; (2)经病理确诊为原发性胃癌, 且癌细胞无病灶转移患者; (3)无血液系统疾病和肝肾方面的疾病; (4)患者及家属知情同意并配合治疗者. 排除标准: (1)心肺功能异常患者; (2)有术前辅助化疗史病人; (3)病理显示有合并其他肿瘤患者; (4)依从性较差, 严重精神疾病, 不配合治疗者. 其中男154例, 女172例, 年龄(42-69)岁, 平均(67.56±9.56)岁. 将所有纳入标准患者分为4组, 分别为正常型和反应型(86例)、结节型(88例)、腱状型(67例)、多彩弥漫型(85例). 本次研究已取得我院伦理委员会的批准, 并获取所选患者及家属同意, 均已签订知情同意书.
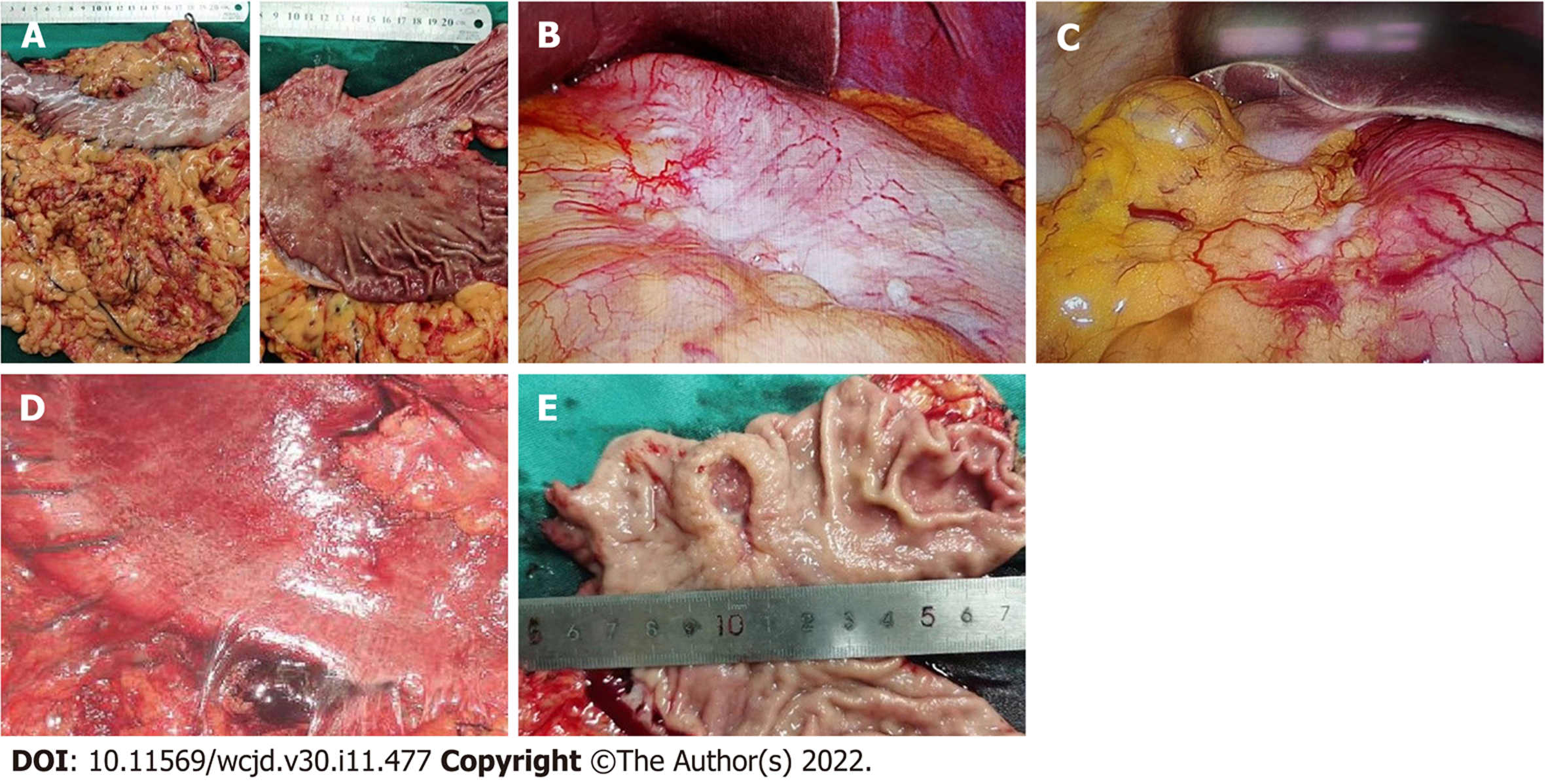
记录患者血清总胆固醇水平、外周血管淋巴细胞总数、血清蛋白水平及并计算控制营养状态评分; 收集所有患者的年龄、性别、身体质量指数、手术方式、切除范围、浆膜类型等各项临床或病理指标. 五种浆膜类型的主要表现为: (1)正常型: 浆膜的形态、颜色与正常浆膜无太大差别, 其边界不清[6]; (2)反应型: 浆膜主要颜色为灰白色或暗红色, 表面平滑或有少许粗糙感[7]; (3)结节型: 浆膜有数个黄豆粒大小的突起[8]; (4)腱状型: 与腱膜相似, 浆膜光滑, 边界不清[9]; (5)多彩弥漫型: 颜色呈暗红色或深灰色, 在浆膜面上密布有小颗粒, 弥漫于浆膜, 边界消失[10,11], 图1. CONUT标准通过血清总胆固醇水平、外周血管淋巴细胞总数和血清蛋白水平进行赋值评分. 血清总胆固醇≥180 mg/dL计为0分, (140-179) mg/dL计为1分, (100-139) mg/dL计为2分, <100 mg/dL计为3分; 外周血管淋巴细胞总数≥1600个/mL计为0分, (1200-1599)个/mL计为1分, (800-1199)个/mL计为2分, <800个/mL计为3分; 血清白蛋白≥3.50 g/dL计为0分, (3.00-3.49) g/dL计为2分, (2.50-2.99) g/dL计为4分, <2.50 g/dL计为6分. 由此累计总分12分, 0-1分提示机体正常营养状态, CONUT≥2分即表示机体可能存在营养不良, 评分越高, 营养状态越差. 使用电话随访或医院随访记录对患者生存数据进行记录, 随访至患者死亡或随访至2022-01.
统计学处理 本研究数据均采用SPSS 21.0软件包进行分析, 计量数据均采用mean±SD表示, 以t检验进行组间数据的比较, 所有计数数据均采用[n(%)]表示, 以χ²检验两组间数据的比较; 采用Kaplan-Meier法, 分析患者的生存时间情况, 采用Cox比例风险模型, 分析患者预后影响因素. P<0.05视为差异具有统计学意义.
Cox模型预后生存分析结果显示正常型和反应型、结节型患者其生存影响因素为TNM分期及CONUT(P<0.05); 腱状型生存影响因素为肿瘤分化和TNM分期(P<0.05); 多彩弥漫型生存影响因素为肿瘤分化、TNM分期、淋巴结转移(P<0.05). 表1-4.
| 正常型和反应型(86人) | 例数 | 多因素 | 单因素 | |||||
| HR值 | 95%CI | P值 | HR值 | 95%CI | P值 | |||
| 肿瘤分化 | 低 | 55 | 3.132 | 1.545-3.967 | 0.036 | 3.254 | 1.271-3.706 | 0.274 |
| 高+中 | 31 | 1.000 | ||||||
| TNM分期 | 3+4 | 58 | 4.743 | 1.956-7.043 | 0.037 | 3.467 | 2.071-5.904 | 0.015 |
| 1+2 | 28 | 1.000 | ||||||
| 血管侵犯 | 有 | 44 | 1.343 | 0.454-2.765 | 0.305 | |||
| 无 | 42 | 1.000 | ||||||
| 淋巴结转移 | 有 | 50 | 2.634 | 1.065-3.978 | 0.046 | 1.887 | 0.985-3.376 | 0.346 |
| 无 | 36 | 1.000 | ||||||
| CONUT | ≥3 | 49 | 2.454 | 1.165-4.376 | 0.037 | 2.467 | 1.137-3.938 | 0.046 |
| <3 | 37 | 1.000 | ||||||
| 结节型(88人) | 例数 | 单因素 | 多因素 | |||||
| HR值 | 95%CI | P值 | HR值 | 95%CI | P值 | |||
| 肿瘤分化 | 低 | 53 | 3.945 | 1.145-4.465 | 0.041 | 3.945 | 2.878-4.268 | 0.422 |
| 高+中 | 35 | 1.000 | ||||||
| TNM分期 | 3+4 | 59 | 5.443 | 2.065-7.365 | 0.046 | 4.168 | 3.240-6.195 | 0.026 |
| 1+2 | 29 | 1.000 | ||||||
| 血管侵犯 | 有 | 48 | 2.943 | 0.827-3.054 | 0.418 | |||
| 无 | 40 | 1.000 | ||||||
| 淋巴结转移 | 有 | 50 | 3.443 | 1.043-5.747 | 0.038 | 0.897 | 0.334-2.352 | 0.416 |
| 无 | 28 | 1.000 | ||||||
| CONUT | ≥3 | 49 | 3.143 | 1.086-4.633 | 0.042 | 3.054 | 1.350-4.687 | 0.049 |
| <3 | 39 | 1.000 | ||||||
| 腱状型(67人) | 例数 | 单因素 | 多因素 | |||||
| HR值 | 95%CI | P值 | HR值 | 95%CI | P值 | |||
| 肿瘤分化 | 低 | 42 | 5.498 | 2.684-5.802 | 0.067 | 6.284 | 3.657-6.877 | 0.047 |
| 高+中 | 25 | 1.545 | ||||||
| TNM分期 | 3+4 | 42 | 6.354 | 3.098-9.419 | 0.041 | 5.924 | 2.671-7.997 | 0.048 |
| 1+2 | 23 | 1.000 | ||||||
| 血管侵犯 | 有 | 37 | 3.598 | 0.846-4.899 | 0.598 | |||
| 无 | 30 | 1.000 | ||||||
| 淋巴结转移 | 有 | 41 | 4.498 | 2.353-6.065 | 0.050 | 1.897 | 1.270-4.528 | 0.647 |
| 无 | 26 | 1.000 | ||||||
| CONUT | ≥3 | 40 | 3.899 | 2.657-6.987 | 0.046 | 4.68 | 2.954-6.021 | 0.057 |
| <3 | 27 | 1.000 | ||||||
| 多彩弥漫型(85人) | 例数 | 单因素 | 多因素 | |||||
| HR值 | 95%CI | P值 | HR值 | 95%CI | P值 | |||
| 肿瘤分化 | 低 | 52 | 6.684 | 3.942-9.650 | 0.047 | 4.984 | 4.887-7.540 | 0.044 |
| 高+中 | 33 | 1.000 | ||||||
| TNM分期 | 3+4 | 50 | 4.764 | 2.154-6.012 | 0.042 | 4.852 | 3.742-8.984 | 0.034 |
| 1+2 | 35 | 1.000 | ||||||
| 血管侵犯 | 有 | 42 | 0.985 | 0.935-5.914 | 0.681 | |||
| 无 | 43 | 1.000 | ||||||
| 淋巴结转移 | 有 | 48 | 2.654 | 1.544-7.814 | 0.032 | 1.655 | 1.385-1.986 | 0.045 |
| 无 | 37 | 1.000 | ||||||
| CONUT | ≥3 | 47 | 2.484 | 1.451-7.371 | 0.048 | 4.822 | 2.137-7.938 | 0.073 |
| <3 | 38 | 1.000 | ||||||
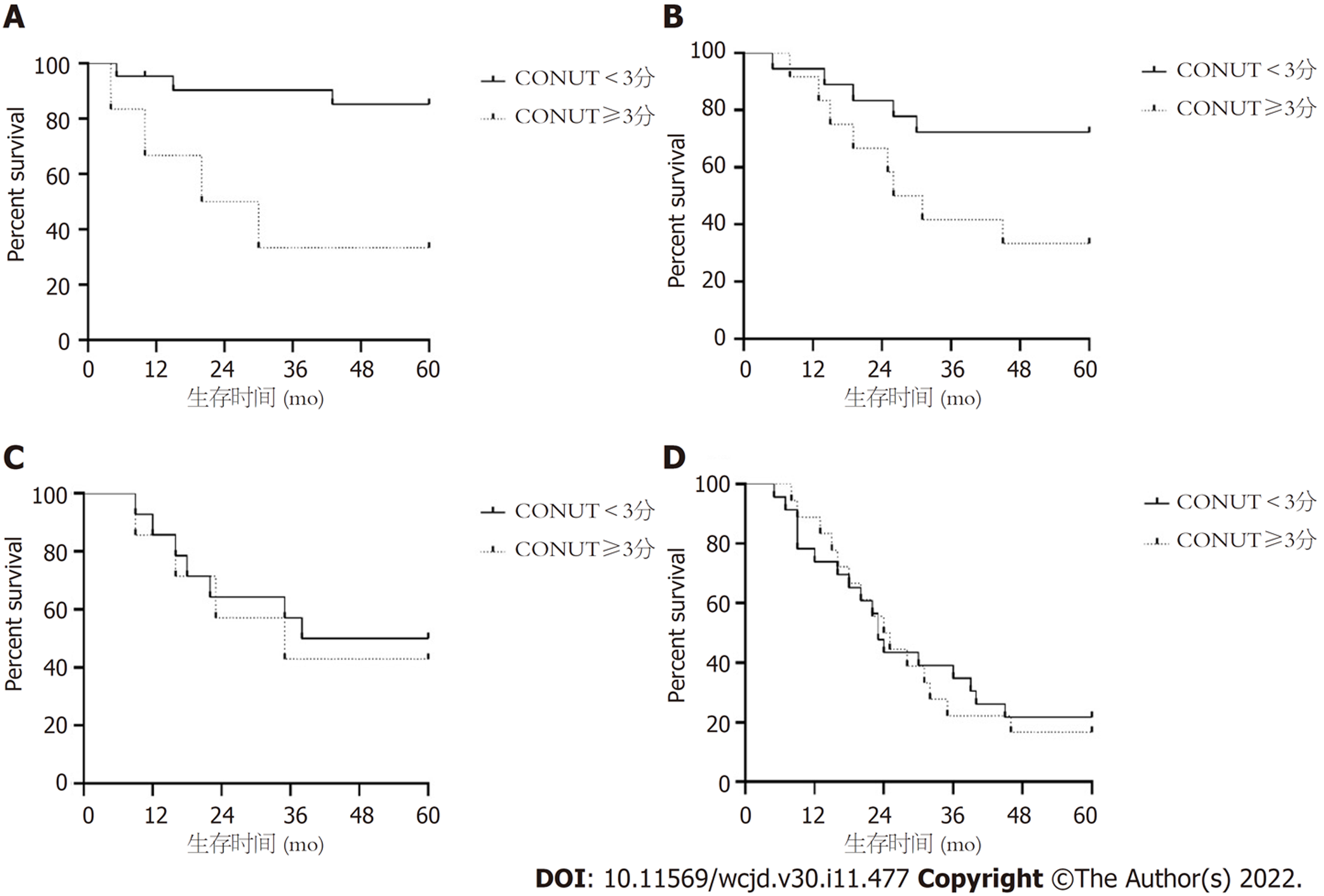
正常型和反应型、结节型CONUT低分和高分患者5年生存率具有统计学意义(P<0.05), 腱状型和多彩弥漫型CONUT低分和高分患者5年生存率均无统计学意义. 表5、图2.
| 营养状态 | 正常型和反应型 | 结节型 | 腱状型 | 多彩弥漫型 | ||||
| <3 | ≥3 | <3 | ≥3 | <3 | ≥3 | <3 | ≥3 | |
| 例数 | 37 | 49 | 39 | 49 | 27 | 40 | 38 | 47 |
| 5年生存人数 | 26 | 15 | 25 | 15 | 13 | 16 | 7 | 8 |
| 5年生存率 | 70.27% | 30.61% | 64.10% | 30.61% | 48.15% | 40.00% | 18.42% | 17.02% |
| χ2 | 6.657 | 4.456 | 0.086 | 0.116 | ||||
| P | 0.007 | 0.034 | 0.767 | 0.732 | ||||
胃癌为世界上常见的癌症, 因其早期无明显症状, 且大对数患者在被确诊为胃癌的时候癌症已经发展到了中晚期, 具有非常高死亡率[12]. 根治胃癌的主要临床方法为肿瘤切除手术, 但仍有20%-40%的患者术后复发[13]. 随着医疗条件的不断进步, 临床上对于胃癌预后有了进一步的改善, 早期确诊胃癌并及时治疗患者5年的生存率可达90%, 但是中晚期胃癌确诊患者术后5年生存率却只有30%[14,15].
临床研究发现[16,17], 不同浆膜类型对胃癌分期的判断可以有效弥补TNM分期, 通过观察胃部不同的浆膜特征, 将浆膜分为五种类型, 分别为: 正常型、反应型、结节型、腱状型、多彩弥漫型. 本次研究将正常型和反应型纳为一组, 其他根据各类型分为3组. 结合本次研究结果发现, 显示正常型和反应型、结节型患者其生存影响因素为TNM分期及CONUT(P<0.05); 腱状型生存影响因素为肿瘤分化和TNM分期(P<0.05); 多彩弥漫型生存影响因素为肿瘤分化、TNM分期、淋巴结转移(P<0.05). 临床上, 在判断癌组织变化时浆膜类型作为一重要指标对提高患者预后具有重要意义, 并且胃癌的预后与术中肿瘤的切除程度以及淋巴结清扫程度有着密切关系[18]. 同时, 本文也分析了不同浆膜类型胃癌患者在不同CONUT评分的生存状况, 发现正常型和反应型、结节型CONUT低分和高分患者5年生存率具有统计学意义(P<0.05), 腱状型和多彩弥漫型CONUT低分和高分患者5年生存率均无统计学意义. CONUT评分作为客观评估人体营养状态的指标,与目前公认的SGA、FNA主观营养评估工具相比, 该评分具有更高的敏感性和特异性[19]. 本文显示胃癌患者预后与CONUT评分具有密切关系, 可能与CONUT评分的3个构成要素相关. 胆固醇可反映能源储备, 通过多种信号通路影响肿瘤的发生、发展[20]; Kang等[21]研究表明, 低胆固醇水平是胃癌发生的重要危险因素. 淋巴细胞计数则反映肿瘤患者的免疫水平, 低淋巴细胞水平的胃癌患者会因免疫力低下从而导致肿瘤复发及扩散[22]. 白蛋白水平作为机体营养状态的指标, 反映肝功能及免疫反应水平, 低白蛋白血症患者, 因其营养状态、肝功能及免疫功能的问题, 而使得胃癌患者产生的不良预后[23], 上述机制或许能够解释本研究所观察到的结果. 不仅如此通过本实验以及大量相关研究发现[24], 胃癌的预后情况也受到术前营养状况的影响, 表现为术前身体质量指数水平低, 血清白蛋白水平的持续下降及贫血的发生, 并且贫血为胃癌患者最为常见的并发症, 可造成局部肿瘤出现缺血缺氧导致基因发生异常表达, 降低患者机体免疫能力不利于预后.
综上所述, 不同浆膜类型胃癌患者具有不同的生存影响因素, 在临床上可根据患者的不同影响因素预测不同浆膜类型患者的预后; 术前控制营养状态评分作为评估不同浆膜类型胃癌患者预后的指标之一, 可提示该患者预后稍差. 但本次研究也有相对的局限性, 比如治疗地区单一、选择样本过程中会出现偏差等, 还需通过长期积累和进一步的分析.
胃癌患者的预后受到手术过程中肿瘤组织切除范围、淋巴结清扫范围的影响, 而浆膜类型是癌组织变化情况的中重要的判断标准. 同时, 不同浆膜类型患者预后亦与营养状态存在紧密的联系, 分析不同浆膜类型胃癌患者预后的影响因素及与患者营养状态的关系, 能指导患者围术期诊疗.
分析不同浆膜类型胃癌患者预后的影响因素, 并完成单因素及多因素Logistic回归分析, 进一步阐明患者营养状态对预后的影响.
研究影响不同浆膜类型胃癌患者预后的危险因素, 控制营养状态评分对预后的影响.
选择研究时间段内我院胃肠外科胃癌根治术患者为对象.观察浆膜类型将患者常规分为正常型和反应型、结节型、腱状型、多彩弥漫型, 并对患者进行远期随访或随访至患者死亡, 记录患者临床和病理指标, 采用Cox模型预后生存分析探究影响不同浆膜类型胃癌患者的预后危险因素.
Cox模型预后生存分析结果表明: 正常型和反应型、结节型患者其生存因素为TNM分期、控制营养状态评分(control nutritional status, CONUT)(P<0.05); 腱状型生存因素为肿瘤分化和TNM分期(P<0.05); 多彩弥漫型生存因素为肿瘤分化、TNM分期、淋巴结转移(P<0.05). 正常型和反应型、结节型CONUT低分和高分患者5年生存率具有统计学意义(P<0.05), 腱状型和多彩弥漫型CONUT低分和高分患者5年生存率无明显差异.
从本研究中可得出以下结论: 不同浆膜类型胃癌患者具有不同的生存影响因素,可根据患者预后可能的影响因素采取相应的措施干预. 同时, 术前控制营养状态评分可作为评估不同浆膜类型胃癌患者预后的指标之一.
从本研究结果看出, 不同浆膜类型胃癌患者生存期受到的影响因素较多, 且不同因素能相互作用及影响. 因此, 浆膜类型胃癌治疗过程中应针对上述可能的因素采取相应的措施干预, 强化患者营养干预. 后续研究需进一步增加样本量, 进一步明确患者不同浆膜类型胃癌患者生存预后的影响因素, 明确患者营养状态对不同不同浆膜类型胃癌患者生存预后的影响, 以指定相应措施, 改善患者预后.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): 0
科学编辑: 张砚梁 制作编辑:张砚梁
| 4. | Yoshida N, Baba Y, Shigaki H, Harada K, Iwatsuki M, Kurashige J, Sakamoto Y, Miyamoto Y, Ishimoto T, Kosumi K, Tokunaga R, Imamura Y, Ida S, Hiyoshi Y, Watanabe M, Baba H. Preoperative nutritional assessment by controlling nutritional Status (CONUT) and postoperative complications for gastric cancer. Nippon Shokaki Geka Gakkai Zasshi. 2014;47:305-312. [DOI] |
| 5. | Kuroda D, Sawayama H, Kurashige J, Iwatsuki M, Eto T, Tokunaga R, Kitano Y, Yamamura K, Ouchi M, Nakamura K, Baba Y, Sakamoto Y, Yamashita Y, Yoshida N, Chikamoto A, Baba H. Controlling Nutritional Status (CONUT) score is a prognostic marker for gastric cancer patients after curative resection. Gastric Cancer. 2018;21:204-212. [PubMed] [DOI] |
| 6. | Akgün Çağlıyan G, Hacıoğlu S, Ünver Koluman B, İlkkılıç K, Nar R, Başer MN, Bozdemir A, Şenol H, Şen Türk N, Erol V, Yılıdırım O, Çağlıyan Ö, Güler N. Is CONUT score a prognostic index in patients with diffuse large cell lymphoma? Turk J Med Sci. 2021;51:2112-2119. [PubMed] [DOI] |
| 7. | Takagi K, Buettner S, Ijzermans JNM, Wijnhoven BPL. Systematic Review on the Controlling Nutritional Status (CONUT) Score in Patients Undergoing Esophagectomy for Esophageal Cancer. Anticancer Res. 2020;40:5343-5349. [PubMed] [DOI] |
| 8. | Salinas M, Flores E, Blasco A, López-Garrigós M, Puche C, Asencio A, Leiva-Salinas C. CONUT: a tool to assess nutritional status. First application in a primary care population. Diagnosis (Berl). 2021;8:373-376. [PubMed] [DOI] |
| 9. | Tsunematsu M, Haruki K, Fujiwara Y, Furukawa K, Onda S, Matsumoto M, Gocho T, Shiba H, Yanaga K. Preoperative controlling nutritional status (CONUT) score predicts long-term outcomes in patients with non-B non-C hepatocellular carcinoma after curative hepatic resection. Langenbecks Arch Surg. 2021;406:99-107. [PubMed] [DOI] |
| 10. | Wang A, Sun B, Wang M, Shi H, Huang Z, He T, Li Q, Deng J, Fu W, Jiang Y. Predictive value of CONUT score combined with serum CA199 levels in postoperative survival of patients with pancreatic ductal adenocarcinoma: a retrospective study. PeerJ. 2020;8:e8811. [PubMed] [DOI] |
| 16. | 闫 恩慧, 孟 刚. 胃浆膜弹力纤维层在胃癌病理分期及预后判断中的意义. 临床与实验病理学杂志. 2018;34:734-738. [DOI] |
| 17. | Karimi Jaberi M, Gholami A, Cheraghian B, Abolghasemi J, Solaymani-Dodaran M, Madani AH, Ashouri Y, Darabi M, Moosapoor S, Asadi-Lari M. Survival rate of patients with gastric cancer in Hormozgan Province, Iran. Med J Islam Repub Iran. 2019;33:74. [PubMed] [DOI] |
| 19. | Basta G, Chatzianagnostou K, Paradossi U, Botto N, Del Turco S, Taddei A, Berti S, Mazzone A. The prognostic impact of objective nutritional indices in elderly patients with ST-elevation myocardial infarction undergoing primary coronary intervention. Int J Cardiol. 2016;221:987-992. [PubMed] [DOI] |
| 20. | Kuzu OF, Noory MA, Robertson GP. The Role of Cholesterol in Cancer. Cancer Res. 2016;76:2063-2070. [PubMed] [DOI] |
| 21. | Kang R, Li P, Wang T, Li X, Wei Z, Zhang Z, Zhong L, Cao L, Heckman MG, Zhang YW, Xu H, Huang C, Bu G, Chen XF. Apolipoprotein E epsilon 2 allele and low serum cholesterol as risk factors for gastric cancer in a Chinese Han population. Sci Rep. 2016;6:19930. [PubMed] [DOI] |
| 22. | Saito H, Kono Y, Murakami Y, Shishido Y, Kuroda H, Yamamoto M, Fukumoto Y, Osaki T, Ashida K, Fujiwara Y. Prognostic Significance of Pre- and Postoperative Lymphocyte Counts in Patients with Gastric Cancer. Dig Surg. 2019;36:137-143. [PubMed] [DOI] |
| 23. | Wu N, Chen G, Hu H, Pang L, Chen Z. Low pretherapeutic serum albumin as a risk factor for poor outcome in esophageal squamous cell carcinomas. Nutr Cancer. 2015;67:481-485. [PubMed] [DOI] |