修回日期: 2021-11-21
接受日期: 2021-12-20
在线出版日期: 2022-01-08
门静脉血栓(portal vein thrombosis, PVT)的早期诊断仍是临床上一个难题, 急需要发现可早期预测诊断的无创指标.
探讨门静脉宽度与PVT形成之间的关系.
收集418例乙肝肝硬化患者.根据是否发生PVT分为PVT组(n = 66)和非PVT组(n = 352)组. 比较两组患者的一般资料差异, 使用多因素Logistic回顾分析影响PVT发生的危险因素. 通过受试者工作特征(receiver operating characteristic, ROC)曲线评估不同危险因素预测PVT的效能.
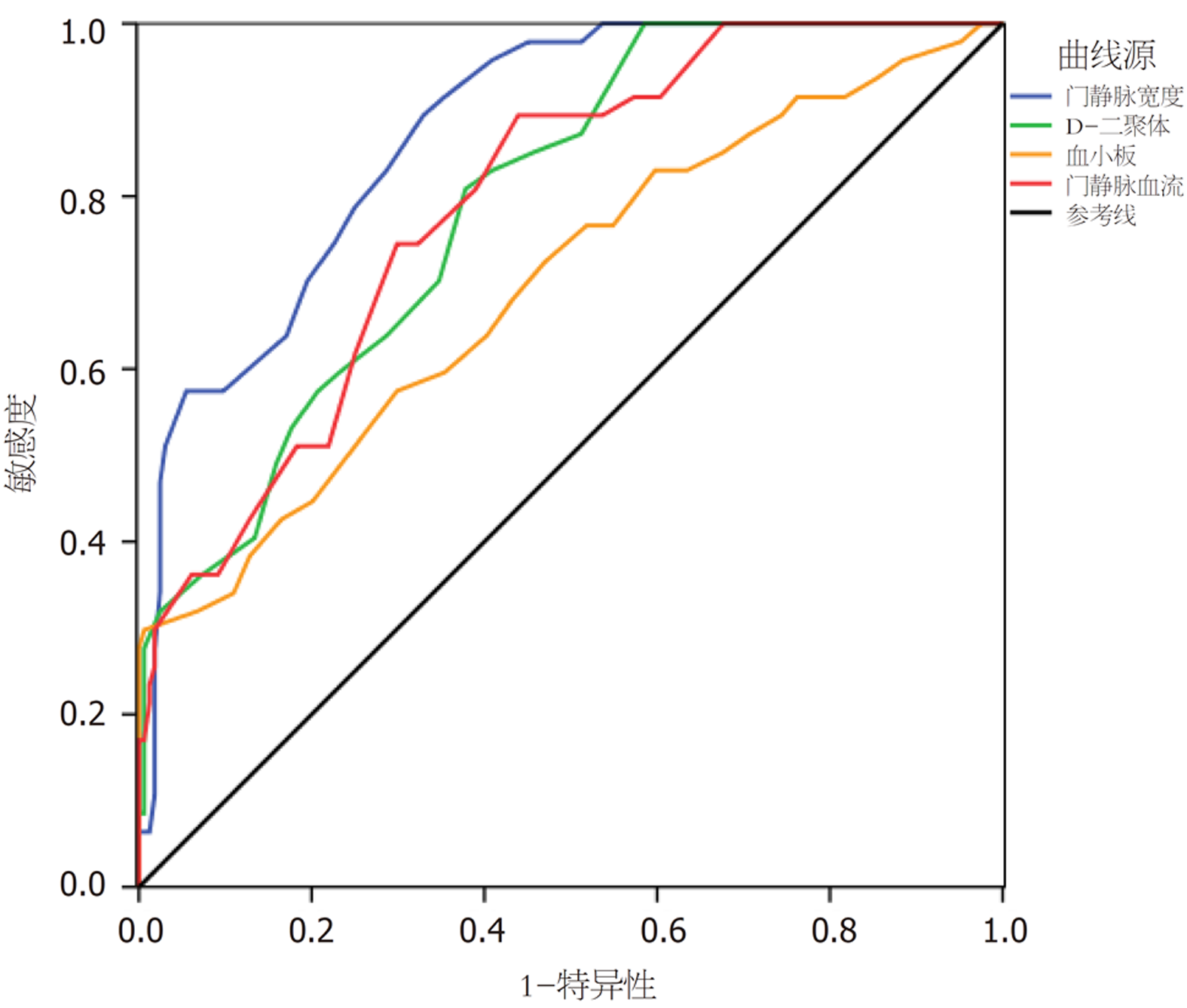
与非PVT组患者相比, PVT组患者的Child-Pugh评分更高、Child-Pugh A级比例更低、血小板水平更高、D-二聚体水平更高、门静脉宽度更宽、门静脉血流更慢, 上述差异均存在统计学意义(P<0.05). Logistic回归显示门静脉宽度(OR = 3.941, P = 0.001)、门静脉血流(OR = 0.841, P = 0.007)、血小板水平(OR = 1.024, P = 0.008)和D-二聚体水平(OR = 2.383, P = 0.000)是肝硬化患者发生PVT的独立危险因素.门静脉宽度诊断PVT的ROC曲线下面积最大为0.874, 最佳诊断值为>12.5 mm, 此时的预测敏感性和特异性分别为78%和82%.
门静脉直径增加是肝硬化患者PVT发生的危险因素, 对PVT诊断具有一定价值.
核心提要: 慢性乙型病毒性肝炎肝硬化患者门静脉血栓(portal vein thrombosis, PVT)的发生比例较高. 本研究从我院收治的慢乙肝肝硬化患者的临床资料中分析得出血小板水平、D-二聚体水平、门静脉宽度、门静脉血流与患者PVT发生密切相关, 且这四个危险因素都体现了潜在的PVT预测诊断价值, 值得今后进一步研究.
引文著录: 赵静, 李建如, 张爱军, 李晓蕾, 梁剑, 郑爱平. 乙肝肝硬化患者门静脉宽度与门静脉血栓形成的关系. 世界华人消化杂志 2022; 30(1): 24-29
Revised: November 21, 2021
Accepted: December 20, 2021
Published online: January 8, 2022
The early diagnosis of portal vein thrombosis (PVT) is still a difficult clinical problem. There is an urgent need to find noninvasive indexes that can predict PVT.
To investigate the relationship between portal vein width and PVT.
A total of 418 patients with hepatitis B cirrhosis were collected. They were divided into a PVT group (n = 66) and a non-PVT group (n = 352) according to whether PVT occurred. The general data of the two groups were compared, and the risk factors affecting PVT were analyzed retrospectively by multivariate logistic regression. The effectiveness of different risk factors in predicting PVT was evaluated by receiver operating characteristic (ROC) curve analysis.
Compared with the non-PVT group, the PVT group had a significantly higher Child-Pugh score, lower rate of Child-Pugh A class, higher platelet count and D-dimer level, wider portal vein width, and slower portal vein blood flow (P < 0.05). Logistic regression showed that portal vein width (odds ratio [OR] = 3.941, P = 0.001), portal vein blood flow (OR = 0.841, P = 0.007), platelet count (OR = 1.024, P = 0.008), and D-dimer level (OR = 2.383, P = 0.000) were independent risk factors for PVT in patients with liver cirrhosis. The maximum area under the ROC curve of portal vein width in the diagnosis of PVT was 0.874, and the best diagnostic threshold was > 12.5 mm, with a predictive sensitivity and specificity of 78% and 82%, respectively.
The increase of portal vein diameter is a risk factor for PVT in patients with liver cirrhosis.
- Citation: Zhao J, Li JR, Zhang AJ, Li XL, Liang J, Zheng AP. Relationship between portal vein width and portal vein thrombosis in patients with hepatitis B cirrhosis. Shijie Huaren Xiaohua Zazhi 2022; 30(1): 24-29
- URL: https://www.wjgnet.com/1009-3079/full/v30/i1/24.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i1.24
尽管门静脉血栓(portal vein thrombosis, PVT)在普通人群中发生率不足1%, 但在肝硬化患者中其发生率却高达0.6%-15.8%[1]. 研究已经证实, 存在PVT的肝硬化患者的失代偿肝硬化发生率、食管静脉曲张破裂出血、移植死亡率、肝动脉血栓形成等不良预后明显增加[2-4]. 因此, 早期发生PVT并尽早干预会对患者带来获益.目前, 诊断PVT主要依靠CT加三维血管成像(CT angiography, CTA)等影像学检查.但由于CTA成本高、使用的造影剂易造成肾脏损伤等影响[5]. 因此, CTA不适合肝硬化高危人群的筛查.目前超声检查被广泛用于PVT的高危人群筛查, 根据报道其诊断准确率为88%-98%[6,7]. 该方法还可测量门静脉的门静脉宽度、血流速度、充盈缺损等其他参数.研究表明, 门静脉扩张在肝硬化中往往是持续存在的, 而扩张的门静脉易产生内皮细胞损伤[8], 增加血栓形成风险.但门静脉宽度对肝硬化患者PVT形成的影响现在仍未确定. 基于此, 本研究探讨门静脉宽度对肝硬化患者PVT发生和预后的影响, 以期为患者早期诊断和干预提供新的策略.
回顾性分析2018-01/2021-06在我院住院治疗的418例乙肝肝硬化患者临床资料.纳入标准: (1)患者肝硬化诊断符合中华医学会肝病学分会《肝硬化诊治指南》[9]; (2)患者接受了肝脏超声检查; (3)住院期间进行了门静脉CTA检查; (4)Child-Pugh分级为A或B级. 排除标准如下: (1)存在肝癌等恶性肿瘤; (2)活动性出血; (3)急性感染; (4)血液增殖性疾病,接受抗血小板或抗凝治疗; (5)食管胃底静脉曲张内镜治疗史, 脾切除术等腹部手术史, 接受过经颈静脉肝内门腔静脉分流术. 本研究经过了我院伦理委员会审核, 并获得了患者知情同意豁免.
根据CTA检查报告是否存在PVT, 将全部患者分为PVT组和非PVT组.
收集患者的年龄、性别、血小板计数、D-二聚体、总胆固醇、甘油三酯和低密度脂蛋白水平、肝功能等其他生化参数. 收集患者肝脏超声报告结果中门静脉宽度和血流速度. 其中超声检查中对门静脉直径测量, 由2名工作5年以上超声医生进行测量.
统计学处理 所有分析均使用SPSS 22进行统计分析. 连续变量使用平均值±标准差进行描述, 组间差异使用t检验. 分类变量使用频数和比例进行描述, 组间差异使用χ2检验, 当理论频数<5时使用Fisher精确检验. 使用多因素Logistic回顾评估影响PVT发生的危险因素. 通过受试者工作特征(receiver operating characteristic, ROC)曲线评估不同危险因素预测PVT的敏感性和特异性, 并通过Youden指数确定最佳诊断值. P<0.05被认为具有统计学意义.
纳入418例患者中PVT组66例, 非PVT组352例. 与非PVT组患者相比, PVT组患者的Child-Pugh评分更高、Child-Pugh A级比例更低、血小板水平更高、D-二聚体水平更高、门静脉宽度更宽、门静脉血流更慢, 上述差异均存在统计学意义(P<0.05). PVT组56例患者存在2处及以上静脉血管发生血栓.两组间其他一般资料差异无统计学意义, 详见表1.
| 项目 | PVT组(n = 66) | 非PVT组(n = 352) | 统计值 | P值 |
| 年龄(岁) | 54.72±10.54 | 55.85±11.61 | 0.736 | 0.462 |
| 性别(n, %) | ||||
| 男性 | 39 (59.09) | 217 (61.65) | 0.153 | 0.696 |
| 女性 | 27 (40.91) | 44 (38.35) | ||
| Child-Pugh 评分(分) | 6.41±1.15 | 5.81±0.96 | 4.509 | 0.000 |
| Child-Pugh分级(n, %) | ||||
| A | 37 (56.06) | 272 (77.49) | 12.973 | 0.000 |
| B | 29 (43.94) | 79 (22.51) | ||
| 实验室检查 | ||||
| 血小板(×109) | 128.46±44.18 | 79.55±22.82 | 13.365 | 0.000 |
| D-二聚体(mg/L) | 2.44±0.93 | 1.07±0.82 | 12.186 | 0.000 |
| 总胆固醇(mmol/L) | 3.66±1.06 | 3.56±0.93 | 0.784 | 0.434 |
| 甘油三酯(mmol/L) | 0.85±0.31 | 0.92±0.36 | 1.480 | 0.140 |
| 低密度脂蛋白(mmol/L) | 1.91±0.47 | 1.82±0.52 | 1.309 | 0.191 |
| 超声检查结果 | ||||
| 门静脉宽度(mm) | 14.02±3.03 | 10.81±1.12 | 15.042 | 0.000 |
| 门静脉血流(cm/s) | 16.62±5.74 | 19.05±2.93 | 5.146 | 0.000 |
| PVT位置(n, %) | ||||
| 门静脉主干 | 49 (74.24) | |||
| 门静脉右支 | 26 (39.39) | |||
| 门静脉左支 | 25 (37.88) | |||
| 脾静脉 | 11 (16.67) | |||
| 肠系膜上静脉 | 12 (18.18) |
以患者发生PVT为因变量, 以Child-Pugh评分、血小板水平、D-二聚体水平、门静脉宽度、门静脉血流为自变量构建PVT发生的危险因素Logistic回归分析.结果可见, 门静脉宽度(OR = 3.941, P = 0.001)、门静脉血流(OR = 0.841, P = 0.007)、血小板水平(OR = 1.024, P = 0.008)和D-二聚体水平(OR = 2.383, P = 0.000)是肝硬化患者发生PVT的独立危险因素, 详见表2.
| 因素 | β | SE | Wald值 | P值 | OR | 95%CI |
| Child-Pugh评分 | 0.440 | 0.415 | 1.122 | 0.430 | 1.552 | 0.688-3.501 |
| 血小板水平 | 0.024 | 0.009 | 6.944 | 0.008 | 1.024 | 1.006-1.042 |
| D-二聚体水平 | 0.868 | 0.211 | 16.937 | 0.000 | 2.383 | 1.576-3.604 |
| 门静脉宽度 | 1.371 | 0.416 | 10.868 | 0.001 | 3.941 | 1.744-8.907 |
| 门静脉血流 | -0.173 | 0.065 | 7.097 | 0.007 | 0.841 | 0.740-0.955 |
慢性乙型肝炎病毒感染是造成我国肝硬化的最常见原因. 而乙肝病毒也被认为是导致PVT发生的危险因素[10]. 由于大部分PVT早期没有明显症状, 因此在PVT发生早期易被漏诊、误诊[11]. 然而由于PVT严重影响肝硬化患者的预后. 因此, 筛选PVT的早期发生的危险因素对预测诊断和及时干预至关重要.
肝硬化中PVT的发展是多因素的, 例如凝血抗凝系统功能紊乱、患者高凝状态、门静脉高压引起的血流淤滞、血管壁内皮损伤等[7,12]. 本项研究中, 纳入的患者均来自医院收治的慢性乙肝肝硬化患者, 比较了伴或不伴有PVT的肝硬化患者生化资料和超声影像学参数. 通过对418例的肝硬化患者的资料回顾, 研究得出乙肝肝硬化患者的门静脉宽度、门静脉血流、血小板计数和D-二聚体是PVT发生的危险因素.
关于肝硬化患者的报道中, 也有其他一些危险因素被证实与PVT的发生、发展存在关系[11,13-15]. 有国外研究报道, 血脂水平升高与静脉血栓形成有关[16]. 然而在本研究中, 并未发现患者血脂水平与PVT间的相关性, 这可能与纳入患者基础疾病、人种差异存在关系. 本研究经过回归分析仅得出门静脉血流、血小板计数、Child-Pugh评分、D-二聚体和门静脉宽度与PVT的关系. 其中门脉血流与PVT发生呈负相关, 门静脉血流缓慢时会增加血小板与血管壁间的接触机会和时间, 这有利于血栓形成.既往报道, 门静脉血流<15 cm/s是PVT的发生的危险因素[17]. 而本研究经过ROC曲线证实, 在乙肝肝硬化患者中门静脉血流<18.5 cm/s已经是PVT的危险因素.
与既往报告不同[18], 我们在本研究中没有发现Child-Pugh评分与PVT发展之间存在显著关联, 这可能与本研究纳入患者多为代偿期患者, Child-Pugh评分相对较低有一定关系. 而根据报道, 对于终末期肝病患者, PVT发生率高达40%[11]. 这部分患者的Child-Pugh评分则相对较高.而本研究人群中Child-Pugh分级多为A或B级. PVT组血小板水平未见较正常范围升高, 而是较正常水平无明显下降, 非PVT组血小板较正常水平明显下降. 血小板数量减少表明肝硬化程度较重, 有可能门静脉压力更高, 血流速度更慢,更易导致患者发生门静脉血栓[18]. D-二聚体是血栓形成的主要指标, D-二聚体的检测目前已广泛应用于静脉血栓形成的预测和诊断.本研究证实了, 血小板计数、D-二聚体与PVT之间的相关性.
肝硬化导致的门静脉高压会持续导致门静脉扩张. 门静脉扩张将进一步损害内皮细胞, 从而促进血栓的形成[11]. 迄今为止, 关于肝硬化门静脉宽度与PVT发生关系的临床研究相对较少. 本研究证实了, 门静脉宽度与PVT之间存在显着相关性, 且其预测PVT的ROC曲线下面积高于其他危险因素. 提示对于肝硬化患者可以通过超声筛查PVT高危患者, 对早期疾病、干预改善肝硬化患者预后提供帮助. 本研究证实, 当门静脉宽度>12.5 mm时对PVT预测具有较高的敏感性, 由于纳入PVT患者多存在门静脉系统中多处血栓, 因此在实际应用中即使对于门静脉宽度>12.5 mm但在门静脉主干并未发现血栓的患者, 也应提高警惕, 增加对门静脉系统其它血管分支的筛查.
本研究存在以下局限性: (1)受限于回顾性研究设计和资料完整性, 未考虑乙肝抗病毒治疗的时间、药物影响, 并未考虑肝硬化的病程长短和肝硬化程度, 未讨论门静脉不同宽度与血流速度、血小板数量是否相关; (2)纳入患者多为代偿期肝硬化, 以Child-Pugh A或B级为主, 是否具有结果外推性仍需要进一步研究; (3)PVT临床表现差异很大,受限于PVT患者病例数, 并未根据PVT解剖-功能分类法Sarin分类法进一步分类研究; (4)此外, 未进行长时间随访不同PVT患者预后差异. 因此, 今后仍需要针对不同原因肝硬化患者进行前瞻性大样本研究分层讨论不同患者的上述问题, 以进一步明确门静脉宽度与肝硬化患者PVT关系.
综上所述, 门静脉宽度增加是乙肝肝硬化患者PVT发生的危险因素, 门静脉宽度>12.5 mm对预测诊断患者PVT发生具有较高效能. 对于门静脉宽度与肝硬化PVT发生的动态随访研究仍值得今后进一步探讨.
乙肝肝硬化患者门静脉血栓(portal vein thrombosis, PVT)发生率较普通人群明显增高. PVT一旦发生严重影响患者预后, 但对于PVT的早期识别较为困难.
目前对于肝硬化患者PVT诊断主要依靠CT加三维血管成像和超声诊断的直接证据, 对于PVT的早期诊断尚缺少有效手段. 基于此, 本研究探讨了PVT发生的危险因素, 及其预测诊断的效能.
探索乙肝肝硬化患者PVT的危险因素, 分析危险因素预测诊断PVT的最佳诊断界值和敏感度、特异度.
根据患者是否发生PVT将患者分为PVT组和非PVT组, 比较两组患者之前临床资料和影像学资料. 使用多因素Logistic回顾分析影响PVT发生的危险因素.
门静脉宽度增加、门静脉血流缓慢、血小板水平升高和D-二聚体水平升高乙肝是肝硬化患者发生PVT的独立危险因素. 门静脉宽度诊断PVT的受试者工作特征曲线下面积最大.
门静脉直径增加是肝硬化患者PVT发生的危险因素, 对PVT诊断具有一定价值.
门静脉直径增加对于PVT的诊断具有较高效能, 今后值得进一步随访门静脉直径变化对无PVT患者的PVT发生情况预测价值.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): D, D, D
E级 (差): 0
科学编辑: 刘继红 制作编辑:张砚梁
| 2. | Stine JG, Shah PM, Cornella SL, Rudnick SR, Ghabril MS, Stukenborg GJ, Northup PG. Portal vein thrombosis, mortality and hepatic decompensation in patients with cirrhosis: A meta-analysis. World J Hepatol. 2015;7:2774-2780. [PubMed] [DOI] |
| 3. | 黄 晓铨, 倪 礼爰, 姜 思雨, 夏 睿琦, 马 丽黎, 王 剑, 李 锋, 陈 世耀. 门静脉血栓影响内镜治疗预防乙型肝炎肝硬化食管胃静脉曲张破裂再出血的疗效. 中华肝脏病杂志. 2020;28:747-752. [DOI] |
| 4. | Stine JG, Pelletier SJ, Schmitt TM, Porte RJ, Northup PG. Pre-transplant portal vein thrombosis is an independent risk factor for graft loss due to hepatic artery thrombosis in liver transplant recipients. HPB (Oxford). 2016;18:279-286. [PubMed] [DOI] |
| 5. | Riva N, Ageno W. Clinical manifestations and imaging tools in the diagnosis of splanchnic and cerebral vein thromboses. Thromb Res. 2018;163:252-259. [PubMed] [DOI] |
| 7. | Cagin YF, Bilgic Y, Berber İ, Yildirim O, Erdogan MA, Firat F, Arslan AK, Colak C, Seckin Y, Harputluoglu M. The risk factors of portal vein thrombosis in patients with liver cirrhosis. Exp Ther Med. 2019;17:3189-3194. [PubMed] [DOI] |
| 8. | Dong G, Huang X, Jiang S, Ni L, Chen S. Simvastatin Mitigates Apoptosis and Transforming Growth Factor-Beta Upregulation in Stretch-Induced Endothelial Cells. Oxid Med Cell Longev. 2019;2019:6026051. [PubMed] [DOI] |
| 11. | Intagliata NM, Caldwell SH, Tripodi A. Diagnosis, Development, and Treatment of Portal Vein Thrombosis in Patients With and Without Cirrhosis. Gastroenterology. 2019;156:1582-1599.e1. [PubMed] [DOI] |
| 13. | Faccia M, Ainora ME, Ponziani FR. Portal vein thrombosis in cirrhosis: Why a well-known complication is still matter of debate. World J Gastroenterol. 2019;25:4437-4451. [PubMed] [DOI] |
| 14. | Roncati L, Manenti A, Gallo G, Bernardelli G, Farinetti A. Prognostic Elements of Portal Vein Thrombosis. Ann Vasc Surg. 2020;65:e307-e308. [PubMed] [DOI] |
| 16. | Morelli VM, Lijfering WM, Rosendaal FR, Cannegieter SC. Lipid levels and risk of recurrent venous thrombosis: results from the MEGA follow-up study. J Thromb Haemost. 2017;15:695-701. [PubMed] [DOI] |
| 17. | Stine JG, Wang J, Shah PM, Argo CK, Intagliata N, Uflacker A, Caldwell SH, Northup PG. Decreased portal vein velocity is predictive of the development of portal vein thrombosis: A matched case-control study. Liver Int. 2018;38:94-101. [PubMed] [DOI] |
| 18. | Mikuła T, Kozłowska J, Stańczak W, Sapuła M, Różyk A, Wiercińska-Drapało A. Serum ADAMTS-13 Levels as an Indicator of Portal Vein Thrombosis. Gastroenterol Res Pract. 2018;2018:3287491. [PubMed] [DOI] |