修回日期: 2021-01-23
接受日期: 2021-04-02
在线出版日期: 2021-05-08
结肠癌属于发病率均较高的癌症, 化疗仍是其只要治疗手段, 奥沙利铂作为第三代铂类化疗药物在治疗肠癌方面有较好的的疗效, 但受基因易感性的影响, 不同基因型的人群对药物的敏感性不同, 因而治疗效果也有较大差异.
探究结肠癌患者谷胱甘肽巯基转移酶P1(Glutathione S-transferase pi 1, GSTP1)基因多态性与奥沙利铂敏感性和中医证型的相关性.
选取我院2015-01/2020-06结肠癌患者246例, 均行奥沙利铂方案化疗, 化疗前检测GSTP1基因Ile105Val位点多态性, 化疗3个周期后评价疗效. 比较不同化疗疗效患者临床资料、GSTP1基因型分布情况, 分析奥沙利铂化疗疗效的影响因素, 并统计结肠癌患者中医证型分布情况, 评价GSTP1基因型与中医证型、证素的关系.
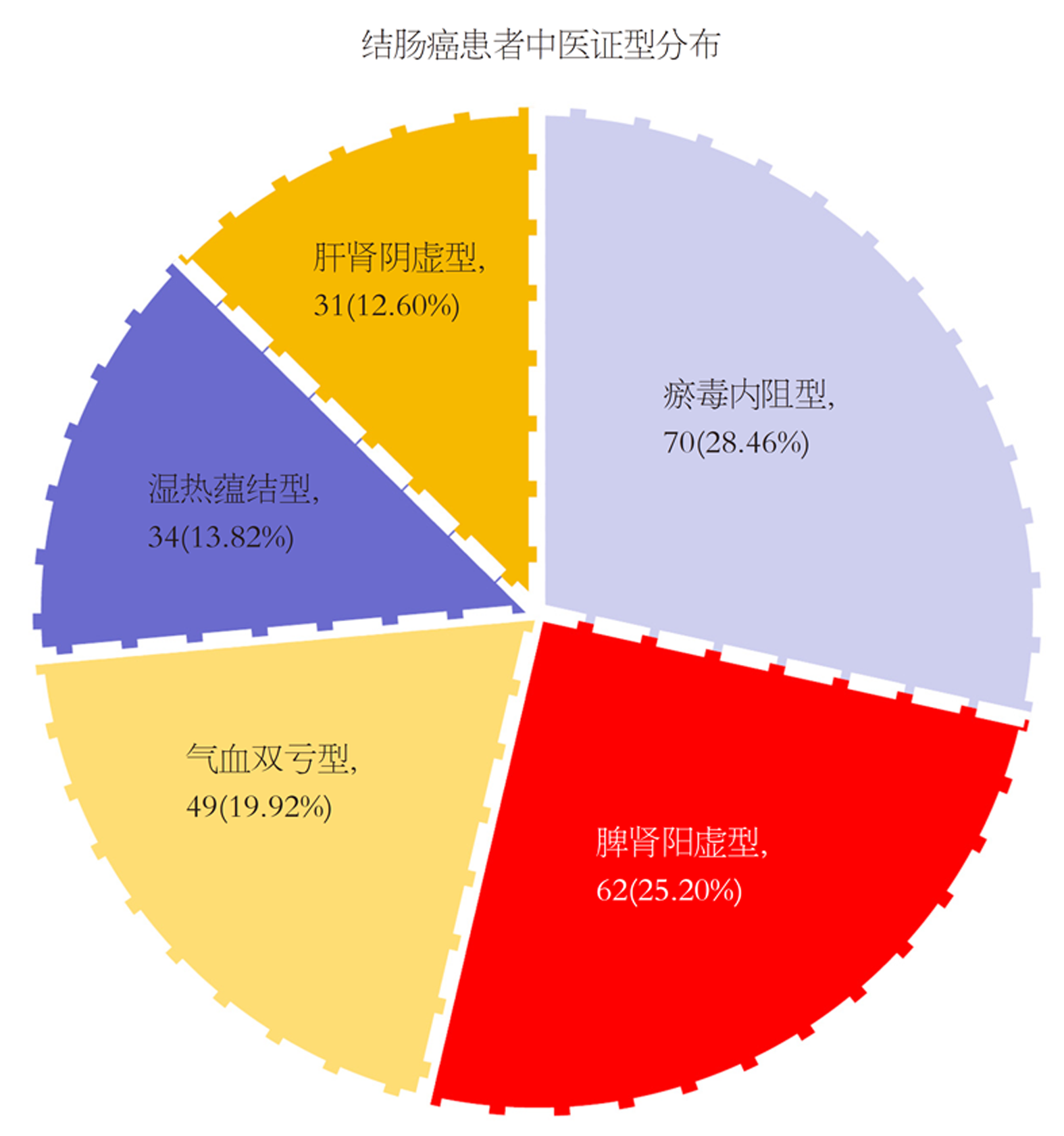
GSTP1基因Ile105Val位点存在多态性, 符合哈迪-温伯格(Hardy-Weinberg)遗传平衡定律检验, 具有人群代表性(P>0.05). 246例结肠癌患者经奥沙利铂方案化疗3个周期后, 总有效率为43.90%(108/246). 临床分期Ⅳ期、中高分化、淋巴结转移、GSTP1基因型AG、GG是结肠癌患者奥沙利铂化疗效果的重要影响因素(P<0.05). 118例结肠癌患者中医证型分布情况: 瘀毒内阻型>脾肾阳虚型>气血双亏型>湿热蕴结型>肝肾阴虚型. 瘀毒内阻型、气血双亏型患者GSTP1基因型分布比较, 差异有统计学意义(P<0.05); 不同GSTP1基因型分布患者中医证型分布比较, 差异有统计学意义(P<0.05); 不同GSTP1基因型患者中医病位证素脾、肺、肾分布差异有统计学意义(P<0.05).
结肠癌患者GSTP1基因多态性与奥沙利铂敏感性、中医证型均存在一定相关性, 因此检测GSTP1基因多态性, 有助于评价患者接受以奥沙利铂为基础药物化疗的治疗效果, 判断中医证型, 从而为结肠癌个体化治疗提供科学指导.
核心提要: 本研究从化疗药物和中医证型两方面来探讨GSTP1基因多态性与结肠癌治疗的相关性, 通过中西医结合的方式发现GSTP1基因多态性对奥沙利铂的敏感性和中医证型均密切相关.
引文著录: 查华英, 吴岩, 尚洛南, 孙方. 结肠癌患者谷胱甘肽巯基转移酶P1(GSTP1)基因多态性与奥沙利铂敏感性和中医证型的相关性研究. 世界华人消化杂志 2021; 29(9): 488-495
Revised: January 23, 2021
Accepted: April 2, 2021
Published online: May 8, 2021
Colon cancer has a high incidence, and chemotherapy is still the only treatment for it. Oxaliplatin, as a third generation platinum chemotherapy drug, has a good efficacy in the treatment of colorectal cancer. However, due to the influence of genetic susceptibility, people with different genotypes have different sensitivities to oxaliplatin. As a result, the therapeutic effect varies greatly among different patients.
To explore the association of glutathione sulfhydryl transferase P1 (GSTP1) gene polymorphism with sensitivity to oxaliplatin and traditional Chinese medicine (TCM) syndrome types in colon cancer patients.
A total of 246 colon cancer patients who received chemotherapy with oxaliplatin-based regimens at our hospital from January 2015 to June 2020 were selected. The Ile105Val polymorphism of GSTP1 gene was detected before chemotherapy, and the curative effect was evaluated after three cycles of chemotherapy. The clinical data and the distribution of GSTP1 genotypes of patients with different chemotherapy effects were compared, and the factors affecting the efficacy of oxaliplatin chemotherapy were analyzed. The distribution of TCM syndrome types of colon cancer patients was also calculated, and the relationship between GSTP1 genotype and TCM syndrome types and syndrome elements was evaluated.
There was a polymorphism in the Ile105Val locus of the GSTP1 gene, which conformed to the Hardy-Weinberg equilibrium law and was representative of the population (P > 0.05). After three cycles of oxaliplatin chemotherapy in 246 patients with colon cancer, the total effective rate was 43.90% (108/246). Clinical stage Ⅳ, moderate/well differentiation lymph node metastasis, and GSTP1 genotypes AG and GG were important factors influencing the effect of oxaliplatin chemotherapy in colon cancer patients (P < 0.05). The distribution of TCM syndromes in 118 patients with colon cancer was as follows: Stasis-toxin internal resistance type > Spleen and kidney Yang deficiency type > Qi and blood deficiency type > Damp-heat accumulation type > Liver and kidney Yin deficiency type. There was a statistically significant difference in the distribution of GSTP1 genotypes in patients with blood stasis internal resistance type and Qi and blood deficiency type (P < 0.05). There was a statistically significant difference in the distribution of TCM syndrome types among patients with different GSTP1 genotypes (P < 0.05). The distribution of spleen, lung, and kidney elements of TCM syndromes in patients with different GSTP1 genotypes was significantly different (P < 0.05).
There is an association between the GSTP1 gene polymorphism and sensitivity to oxaliplatin and TCM syndrome types in colon cancer patients. Therefore, the detection of GSTP1 gene polymorphism is helpful to evaluate the therapeutic effect in patients receiving oxaliplatin as the basic drug chemotherapy, determine the type of TCM syndrome, and provide scientific guidance for individualized treatment of colon cancer.
- Citation: Cha HY, Wu Y, Shang LN, Sun F. Association of glutathione thioltransferase P1 (GSTP1) gene polymorphism with sensitivity to oxaliplatin and traditional Chinese medicine syndrome types in colon cancer patients. Shijie Huaren Xiaohua Zazhi 2021; 29(9): 488-495
- URL: https://www.wjgnet.com/1009-3079/full/v29/i9/488.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i9.488
流行病学调查显示, 结肠癌是全球第3大常见恶性肿瘤, 其发生率随饮食结构改变不断增长, 且5年生存率仅为50.0%[1-3]. 以奥沙利铂为基础的化疗方案治疗晚期结肠癌有效率为20.0%-30.0%, 但其易产生外周神经炎等不良反应, 影响患者生存质量, 甚至中断治疗进程[4,5]. 目前, 中医药已成为结肠癌患者综合治疗的一个有效组成部分, 在增强免疫功能、降低毒副反应、提高患者对化疗耐受性、预防复发转移等方面具有一定作用, 但中晚期结肠癌的中医证型缺乏统一的辨证标准[6]. 另外, 生物医学研究已表明[7], DNA损伤修复、药物代谢及解毒等基因存在单核苷酸多态是药物治疗疗效及耐受性个体差异的重要影响因素. 谷胱甘肽巯基转移酶P1(glutathione S-transferase P1, GSTP1)是人类谷胱甘肽S转移酶家族主要成员, 有学者认为, 其不仅与化疗药物代谢具有密切联系, 也与结直肠癌发病及易感性有关[8], 然而关于其与结肠癌患者中医证型的相关性仍缺乏循证依据, 有待进一步深入探讨. 基于此, 本研究尝试分析结肠癌患者GSTP1基因多态性与奥沙利铂敏感性和中医证型的相关性. 详情如下.
选取我院2017-01/2020-06结肠癌患者118例, 均行奥沙利铂方案化疗, 其中女49例, 男69例, 年龄40-65岁, 平均(53.25±3.69)岁. 本研究经我院医学伦理委员会批准, 所有研究对象均签署知情同意书.
纳入标准: (1)均符合《2014 JSCCR指南: 结直肠癌的治疗》[9]中结肠癌诊断标准, 并经手术病理组织学检查证实; (2)符合奥沙利铂方案化疗适应证; (3)临床分期ⅢB-Ⅳ期; (4)中医证型标准: 参照《实用中医肿瘤学》[10]和《中医内科学》[11]进行中医辨证分型, 并均符合下述2项主症或1项主症、1项次症、舌脉标准: ①气血双亏型. 主症: 腹痛绵绵, 或腹内结块, 肛门重坠, 大便带血, 泄泻; 次症: 形瘦纳少, 面色苍白, 唇甲不华; 舌质淡, 苔薄白, 脉细弱无力; ②湿热蕴结型. 主症: 腹部阵痛, 下利赤白, 里急后重, 大便干稀不调, 肛门灼热; 次症: 口干、发热、纳差、小便黄; 舌质红, 苔黄腻, 脉滑数; ③肝肾阴虚型. 主症: 腹痛隐隐, 腹内结块, 便秘, 大便带血为主症; 次症: 腰膝酸软, 头晕耳鸣, 口咽干燥, 盗汗, 形瘦纳差; 舌红少苔, 脉弦细数; ④瘀毒内阻型. 主症: 腹胀刺痛拒按, 下利紫黑脓血, 量多; 次症: 痛处拒按, 烦热口渴, 唇甲青紫或有肌肤甲错; 舌质黯或有瘀斑、瘀点, 苔黄, 脉涩; ⑤脾肾阳虚型. 主症: 腹痛喜温喜按, 下利清谷, 五更泄泻, 见大便带血; 次症: 面色苍白或萎黄, 少气无力, 畏寒肢冷, 腰酸膝冷; 舌质淡胖有齿痕, 苔薄白, 脉沉细弱.
排除标准: (1)合并肝肾等其他重要脏器器质性病变者; (2)预计生存期<6 mo; (3)存在奥沙利铂、亚叶酸钙、5-氟尿嘧啶等药物过敏史者; (4)凝血机制紊乱或活动性出血者; (5)精神失常者.
1.2.1 临床资料收集: 自制临床资料调查问卷(经预试验, 本问卷内部一致性信度Cronbach's α系数为0.85, 内容效度为0.92), 收集患者年龄、性别、肿瘤直径、卡氏评分(karnofsky performance scale, KPS)、临床分期、分化程度、淋巴结转移等资料, 其中KPS评分包括功能状况、体力状况两部分, 总分0-100分, 得分与生活质量呈正相关.
1.2.2 奥沙利铂方案化疗: (1)67例采用改良FOLFOX4方案: d1, 静脉滴注奥沙利铂(海南锦瑞制药有限公司, 国药准字H20143023, 规格: 50 mg)130 mg/m2, 持续静脉滴注120 min; d1-5, 静脉滴注亚叶酸钙[江苏奥赛康药业有限公司, 国药准字H20060198, 规格: 50 mg(按亚叶酸计)]130 mg/m2, 持续静脉滴注120 min, 同时静脉滴注5-氟尿嘧啶(远大医药黄石飞云制药有限公司, 国药准字H20051138, 规格: 0.5 g)300 mg/m2, 持续静脉滴注240 min, 21 d为1个周期. (2)51例采用Xelox方案: d1, 静脉滴注奥沙利铂130 mg/m2, 持续静脉滴注120 min; d1-14, 口服卡培他滨(正大天晴药业集团股份有限公司, 国药准字H20143044, 规格: 0.5 g)250 mg/m2, 2次/d, 21 d为1个周期.
1.2.3 GSTP1基因多态性检测: 所有研究对象化疗前均留取2 mL静脉血, 置于乙二胺四乙酸抗凝管中, 严格按照赛默飞世尔科技(中国)有限公司提供的血液基因组DNA提取试剂盒说明书提取样本DNA, 采用北京海天友诚科技有限公司提供的752N型紫外分光光度计测定DNA纯度. GSTP1基因片段PCR扩增引物由上海生工生物工程技术服务有限公司合成, 引物序列如下: 上游引物: 5'-ACCCCAGGGCTCTATGGGAA-3'; 下游引物: 5'-TGAGGGCACAAGAAGCCCCT-3'; 探针引物1(FAM): 5'-GCAAATACATCTCCCTCA-3'; 探针引物2(HEX): 5'-GCAAATACGTCTCCCTCA-3'. PCR扩增体系: 总共25 μL, 分别为Nucleasee-free Water 9.25 μL, GSTP1上、下游引物、探针引物各0.5 μL, Premix Taq 12 μL, 基因组DNA 1 μL, 二甲基亚砜1.25 μL. PCR反应条件: 94 ℃预变性5 min; 72 ℃ 2 min; 94 ℃变性30 s, 63.4 ℃低温复性30 s, 72 ℃退火延伸30 s, 共40个循环. 每个循环结束时, 自动检测荧光信号. 分型结果由仪器自动生成.
1.2.4 质量控制: 上述操作均由接受专业培训后质检人员进行统计与检测, 并签署患者信息保密书, 以保证数据安全性, 保护患者隐私问题.
化疗3个周期后所有患者均接受CT检查, 采用单径测量法测定肿瘤直径、垂直径, 并参照RECIST标准[12]评估两组治疗效果. 完全缓解(complete response, CR): 肿瘤完全消失, 维持≥4 wk; 部分缓解(partial response, PR): 肿瘤最大直径与最大垂直径乘积减少>50.0%, 并维持≥4 wk; 疾病稳定(stable disease, SD): 介于PR、疾病进展(progressive disease, PD); PD: 肿瘤最大直径与最大垂直径乘积增加>25.0%, 或出现新病灶. 总有效率 = (CR+PR+SD)/总例数×100%.
1.4 观察指标 (1)统计GSTP1基因型分布情况; (2)分析奥沙利铂化疗疗效, 并比较不同化疗疗效患者临床资料; (3)比较不同化疗疗效患者GSTP1基因型分布情况; (4)分析结肠癌患者奥沙利铂化疗疗效的影响因素; (5)统计结肠癌患者中医证型分布情况; (6)分析GSTP1基因型与中医证型的关系; (7)GSTP1基因型与中医病位证素的关系.
统计学处理 采用统计学软件SPSS 22.0处理数据, 计量资料采取Bartlett方差齐性检验与夏皮罗-威尔克正态性检验, 均确认具备方差齐性且近似服从正态布, 以mean±SD描述, 两组间比较采用独立样本t检验; 计数资料用n(%)表示、χ2检验, 等级资料用u表示、Ridit检验; 影响因素采用Logistic多因素回归分析. 均采用双侧检验, α = 0.05.
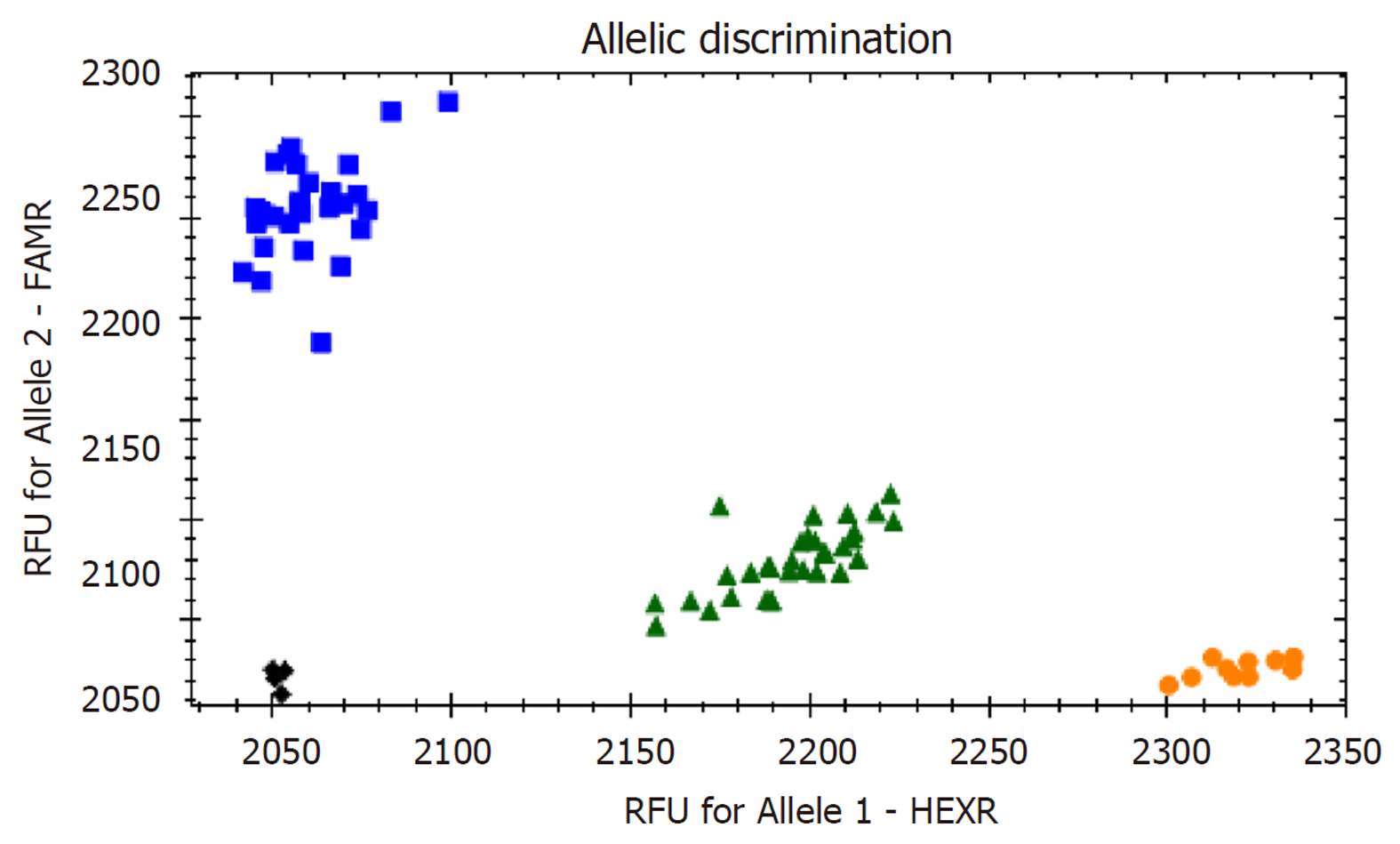
GSTP1基因Ile105Val位点经Taqman-PCR法检测显示: 野生纯合型(AA)、突变杂合型(AG)、突变纯合型(GG), PCR扩增目的片段经琼脂糖凝胶电泳鉴定后, 随机选取10%样本进行基因测序验证, 使用BioEdit version 5.0.6软件查看测序结果, 证实GSTP1基因Ile105Val位点存在多态性. PCR产物电泳图见图1. 本研究246例样本中, 共检测到140例AA, 82例AG, 24例GG, 多态性分布符合Hardy-Weinberg遗传平衡定律检验, 具有人群代表性(P>0.05).
246例结肠癌患者经奥沙利铂方案化疗3个周期后, CR 0例, PR 58例, SD 50例, PD 138例, 总有效率为43.90%(108/246). 有效患者年龄、性别、肿瘤直径、KPS评分与无效患者差异无统计学意义; 有效患者临床分期、分化程度、淋巴结转移与无效患者差异有统计学意义(P<0.05), 见表1.
| 资料 | 有效患者(n = 108) | 无效患者(n = 138) | t/χ2 | P值 |
| 年龄(岁) | 53.38±7.19 | 54.22±6.28 | 0.977 | 0.330 |
| 性别 | ||||
| 男 | 58(53.70) | 77(55.80) | 0.107 | 0.743 |
| 女 | 50(46.30) | 61(44.20) | ||
| 肿瘤直径(cm) | ||||
| ≤3 | 39(36.11) | 47(34.06) | 0.112 | 0.738 |
| >3 | 69(63.89) | 91(65.94) | ||
| 临床分期 | ||||
| ⅢB期 | 60(52.56) | 45(32.61) | 13.040 | <0.001 |
| Ⅳ期 | 48(47.44) | 93(67.39) | ||
| 分化程度 | ||||
| 中高分化 | 67(62.04) | 57(41.30) | 10.418 | 0.001 |
| 低分化 | 41(37.96) | 81(58.70) | ||
| 淋巴结转移 | ||||
| 无 | 55(50.93) | 40(28.99) | 12.304 | 0.001 |
| 有 | 53(49.07) | 98(71.01) | ||
| KPS评分(分) | ||||
| 60-70 | 43(39.81) | 58(42.03) | 0.123 | 0.726 |
| >70 | 65(60.19) | 80(57.97) |
Ridit检验, 有效患者GSTP1基因型分布情况与无效患者存在显著差异(P<0.05), 见表2.
| 组别 | 例数 | AA | AG | GG |
| 有效患者 | 108 | 36(33.33) | 54(50.00) | 18(16.67) |
| 无效患者 | 138 | 104(75.36) | 28(20.29) | 6(4.35) |
| u | 5.829 | |||
| P | <0.001 | |||
以奥沙利铂化疗疗效为因变量(有效 = 0, 无效 = 1), 以临床分期、分化程度、淋巴结转移、GSTP1基因型作为自变量(临床分期: ⅢB期 = 1, Ⅳ期 = 2; 分化程度: 低分化 = 1, 中高分化 = 2; 淋巴结转移: 否 = 0, 是 = 1; GSTP1基因型引入哑变量赋值: AA = 1, AG = 2, GG = 3), Logistic回归分析, Ⅳ期结肠癌患者发生奥沙利铂化疗无效的风险可能是ⅢB期患者的2.730倍; 中高分化结肠癌患者发生奥沙利铂化疗无效的风险可能是低分化患者的0.558倍; 有淋巴结转移的结肠癌患者发生奥沙利铂化疗无效的风险可能是无淋巴结转移的4.570倍; GSTP1基因型AG的结肠癌患者发生奥沙利铂化疗无效的风险可能是AA患者的0.470倍, GSTP1基因型GG的结肠癌患者发生奥沙利铂化疗无效的风险可能是AA患者的0.502倍(P<0.05), 见表3.
| 变量 | β | S.E. | Wald χ2 | P | OR | 95%CI |
| 临床分期 | ||||||
| ⅢB期 | 1.000 | |||||
| Ⅳ期 | 1.072 | 0.314 | 11.651 | <0.001 | 2.921 | 1.813-4.705 |
| 分化程度 | ||||||
| 低分化 | 1.000 | |||||
| 中高分化 | -0.555 | 0.178 | 9.710 | <0.001 | 0.574 | 0.362-0.911 |
| 淋巴结转移 | ||||||
| 无 | 1.000 | |||||
| 有 | 1.543 | 0.452 | 11.658 | <0.001 | 4.680 | 2.428-9.021 |
| GSTP1基因型 | ||||||
| AA | 1.000 | |||||
| AG | -0.742 | 0.201 | 12.889 | <0.001 | 0.486 | 0.317-0.745 |
| GG | -0.644 | 0.197 | 10.683 | <0.001 | 0.525 | 0.334-0.826 |
瘀毒内阻型、气血双亏型患者GSTP1基因型分布存在显著差异(P<0.05), 脾肾阳虚型、湿热蕴结型、肝肾阴虚型患者GSTP1基因型分布差异无统计学意义; 不同GSTP1基因型分布患者中医证型分布差异有统计学意义(P<0.05); 见表4.
| 中医证型 | AA(n = 140) | AG(n = 82) | GG(n = 24) | χ2 | P |
| 瘀毒内阻型 | 19(13.57) | 36(43.90) | 15(62.50) | 38.509 | <0.001 |
| 脾肾阳虚型 | 38(27.14) | 22(26.83) | 2(8.33) | 4.018 | 0.134 |
| 气血双亏型 | 41(29.29) | 6(7.32) | 2(8.33) | 17.884 | <0.001 |
| 湿热蕴结型 | 24(17.14) | 9(10.98) | 1(4.17) | 3.733 | 0.155 |
| 肝肾阴虚型 | 18(12.86) | 9(10.98) | 4(16.67) | 0.565 | 0.754 |
| χ2 | 20.804 | 48.262 | 35.104 | ||
| P | <0.001 | <0.001 | <0.001 |
由于中晚期结肠癌患者病灶通常无法彻底切除, 姑息性切除适应证少, 故化疗是其治疗首选方案, 但化疗方案较多, 并非所有患者均能从特定化疗方案中获益[13,14], 因此, 明确影响结肠癌化疗疗效因素, 有助于指导临床拟定针对性化疗方案.
GSTP1属Ⅱ相代谢酶, 可结合亲电子细胞毒药物, 提高亲电子细胞毒药物水溶性, 调控化疗药物代谢[15-17], Ile105Val是其最为常见的一种多态, 可降低GSTP1酶稳定性及催化活性. 本研究中, 246例结肠癌患者GSTP1基因Ile105Val位点符合Hardy-Weinberg遗传平衡, 可见纳入患者具有良好群体代表性. 另外, 闫晋等[18]研究证实, 与突变型编码的GSTP1酶解毒活性比较, GSTP1 Ile105Va野生型编码的GSTP1酶解毒活性可上调2-3倍. 本研究经Logistic多因素回归分析, GSTP1基因型AG、GG是结肠癌患者奥沙利铂化疗效果的保护因素, 这可能归因于GSTP1酶作为调控铂类药物代谢的重要酶, 其突变后可明显减弱GSTP1酶结合奥沙利铂的能力, 抑制奥沙利铂代谢排出, 进而增强机体对铂类药物的敏感性. 由此可见, GSTP1基因可能是结肠癌奥沙利铂敏感性的标志之一. 但McLeod等[19]通过520例晚期大肠癌患者却发现, GSTP1 GG基因型患者因神经毒性可能终止FOLFOX方案化疗进程, 与本研究结果存在一定差异, 可能与种族、地域不同有关. 另外, 在评估奥沙利铂化疗疗效的同时还应将临床分期、分化程度、淋巴结转移等因素纳入考虑范围内, 以减少研究结果偏移.
目前结肠癌中医证型尚无统一标准. 方汉钦[20]研究认为, 结肠癌临床分期为Ⅲ期、Ⅳ期患者以虚证多见, 主要表现为气滞血瘀证. 另有学者指出[21], 大肠癌证候演变多是由实转虚, 随病情演变, 正邪胶着日久, 肿瘤末期脏腑机能损伤, 气血津液损伤, 故虚证是大肠癌晚期常见证型. 本研究将结肠癌分为5种中医证型, 其中证型分布以虚证为多见, 尤以脾肾阳虚型多见, 实证分布以瘀毒内阻型最为多见, 考虑其原因可能与结肠癌病理机制存在一定相关性, 本虚标实是结肠癌病机, 素体亏虚是其内因, 邪气外侵是其外因, 正气虚衰, 致使邪气留滞不去, 脾虚运化无力, 痰湿结聚体内, 气血运化不畅, 日久化热, 与瘀、毒搏结日久而致病. 另有学者通过分析GSTP1遗传多态性型发现[22], AA、AG及GG 3种基因型患者兼夹脾证素频率逐一减小, 说明GSTP1基因多态性可能影响结直肠癌术后患者气虚证兼夹. 本研究结果表明, GSTP1基因AG、GG患者中医证型以瘀毒内阻型为多, 且不同GSTP1基因型分布患者中医证型分布、中医病位证素脾、肺、肾分布比较, 差异有统计学意义, 由此推测, 结肠癌患者GSTP1基因多态性与中医证型存在一定相关性, 这可能与不同GSTP1基因型对基因产物酶活性或代谢底物亲和性的影响不一, 从而诱导患者出现不同中医证型易患趋势有关, 同时, 不同中医证型奥沙利铂化疗敏感性不一可能也是上述结果出现的原因之一.
综上可知, 结肠癌患者GSTP1基因多态性与奥沙利铂敏感性和中医证型均存在一定相关性, 因此检测GSTP1基因多态性, 有助于评价患者接受以奥沙利铂为基础药物化疗的治疗效果, 判断中医证型, 从而为结肠癌个体化治疗提供科学指导.
目前对于结肠癌的治疗, 比较有效的还是常规手术和药物化疗, 但是由于受遗传因素的影响, 基因型不同人群可能对化学药物的敏感性不同. 同时, 中医对癌症的辅助治疗也可能受到遗传因素的作用, 而产生不同的治疗效果.
本研究试图探讨遗传因素之基因多态性对化疗药物敏感性和中医证型之间的联系, 为结肠癌患者的更有效治疗提供基因分型的依据和化疗药物的使用指导.
本研究旨在通过对GSTP1基因进行分型, 建立结肠癌患者对奥沙利铂敏感性和中医证型关系的模型, 从而确定不同基因型的患者对同样化疗药物以及中医证型的敏感程度, 为结肠癌患者的靶向治疗提供借鉴和依据.
本研究主要采用数据分析的方法, 分析结肠癌患者奥沙利铂化疗疗效的影响因素, 统计并分析GSTP1基因型与中医证型和中医病位证素的关系, 分别从中医和西医两方面来阐述GSTP1基因型对肠癌患者治疗效果的影响.
GSTP1基因型AG的结肠癌患者发生奥沙利铂化疗无效的风险可能是AA患者的0.470倍, GSTP1基因型GG的结肠癌患者发生奥沙利铂化疗无效的风险可能是AA患者的0.502倍. 不同GSTP1基因型分布患者中医证型分布, 中医病位证素脾、肺、肾分布均有显著差异.
结肠癌患者GSTP1基因多态性与奥沙利铂敏感性有关, 和中医证型也有一定的相关性, 有助于评价患者是否适用于接受奥沙利铂等铂类物化疗药进行治疗, 判断中医证型, 指导结肠癌的个体化治疗.
本研究是基于统计学方法建立模型来研究, 同时大部分患者均来自周边, 因此受到地域和样本量等因素的影响, 要反映整体中国或汉族人群的情况, 还有待进一步扩大其他地域的样本量来进一步验证.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C
D级 (一般): D
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 2. | Benson AB, Venook AP, Al-Hawary MM, Cederquist L, Chen YJ, Ciombor KK, Cohen S, Cooper HS, Deming D, Engstrom PF, Garrido-Laguna I, Grem JL, Grothey A, Hochster HS, Hoffe S, Hunt S, Kamel A, Kirilcuk N, Krishnamurthi S, Messersmith WA, Meyerhardt J, Miller ED, Mulcahy MF, Murphy JD, Nurkin S, Saltz L, Sharma S, Shibata D, Skibber JM, Sofocleous CT, Stoffel EM, Stotsky-Himelfarb E, Willett CG, Wuthrick E, Gregory KM, Freedman-Cass DA. NCCN Guidelines Insights: Colon Cancer, Version 2.2018. J Natl Compr Canc Netw. 2018;16:359-369. [PubMed] [DOI] |
| 3. | 丛 熙, 樊 建慧. P-糖蛋白对结肠癌多药耐药的影响. 中国生物化学与分子生物学报. 2019;35:19-26. [DOI] |
| 5. | 胡 晓云, 吴 志堃, 陈 瑜, 魏 敏杰, 吴 慧哲. 大肠癌DNA修复通路基因和ABCG2基因的多态性与奥沙利铂化疗的环境因素及预后的相关性. 中国药理学与毒理学杂志. 2019;33:148. |
| 9. | Watanabe T, Itabashi M, Shimada Y, Tanaka S, Ito Y, Ajioka Y, Hamaguchi T, Hyodo I, Igarashi M, Ishida H, Ishihara S, Ishiguro M, Kanemitsu Y, Kokudo N, Muro K, Ochiai A, Oguchi M, Ohkura Y, Saito Y, Sakai Y, Ueno H, Yoshino T, Boku N, Fujimori T, Koinuma N, Morita T, Nishimura G, Sakata Y, Takahashi K, Tsuruta O, Yamaguchi T, Yoshida M, Yamaguchi N, Kotake K, Sugihara K; Japanese Society for Cancer of the Colon and Rectum. Japanese Society for Cancer of the Colon and Rectum (JSCCR) Guidelines 2014 for treatment of colorectal cancer. Int J Clin Oncol. 2015;20:207-239. [PubMed] [DOI] |
| 13. | 肖 鹏, 梅 家转, 白 桦, 栗 敏, 刘 桂举, 李 瑞君, 沈 杰. 细胞色素P450 1A1基因多态性对奥沙利铂联合卡培他滨方案治疗结直肠癌患者临床疗效的影响. 中国临床药理学与治疗学. 2018;23:159-164. [DOI] |
| 14. | 陈 琦, 程 景洪, 周 芯茹, 孟 凡义, 孔 洁红, 汪 维鹏, 张 洪建. PD-L1基因多态性与结直肠癌患者奥沙利铂化疗疗效和安全性的相关性研究. 现代生物医学进展. 2018;18:1828-1832. [DOI] |
| 15. | Bhat A, Masood A, Wani KA, Bhat YA, Nissar B, Khan NS, Ganai BA. Promoter methylation and gene polymorphism are two independent events in regulation of GSTP1 gene expression. Tumour Biol. 2017;39:1010428317697563. [PubMed] [DOI] |
| 16. | Nissar S, Sameer AS, Rasool R, Chowdri NA, Rashid F. Promoter methylation and Ile105val polymorphism of GSTP1 gene in the modulation of colorectal cancer risk in ethnic Kashmiri population. Indian J Cancer. 2019;56:248-253. [PubMed] [DOI] |
| 17. | Rajesh D, Balakrishna S, Azeem Mohiyuddin SM, Suryanarayana R, Kutty AVM. Novel association of oral squamous cell carcinoma with GSTP1 Arg187Trp gene polymorphism. J Cell Biochem. 2019;120:5906-5912. [PubMed] [DOI] |
| 19. | McLeod HL, Sargent DJ, Marsh S, Green EM, King CR, Fuchs CS, Ramanathan RK, Williamson SK, Findlay BP, Thibodeau SN, Grothey A, Morton RF, Goldberg RM. Pharmacogenetic predictors of adverse events and response to chemotherapy in metastatic colorectal cancer: results from North American Gastrointestinal Intergroup Trial N9741. J Clin Oncol. 2010;28:3227-3233. [PubMed] [DOI] |