修回日期: 2021-02-24
接受日期: 2021-03-15
在线出版日期: 2021-04-08
长链非编码RNA(long non-coding RNA, lncRNA)肿瘤蛋白翻译调节因子1-反义RNA1(tumor protein translationally controlled regulator 1-antisence RNA 1, TPT1-AS1)TPT1-AS1可通过不同的作用方式影响肿瘤的侵袭转移, 但其在肝癌中的具体作用和相关作用机制还有待进一步的实验验证.
探讨lncRNA TPT1-AS1在肝癌中的表达及其对肝癌细胞侵袭迁移能力的影响.
实时荧光定量PCR检测肝癌组织及肝癌细胞系(Huh7、SMMC-7721、HCCLM3和HepG2)中lncRNA TPT1-AS1的表达. 靶向TPT1-AS1的小分子干扰RNA (siRNA targeted for TPT1-AS1, si-TPT1-AS1)转染后, 经Transwell实验和划痕实验检测HepG2细胞侵袭及迁移能力的变化; Western blot评估上皮-间充质转分化进程(epithelial-mesenchymal transition, EMT)以及磷酸肌醇3激酶(phosphotylinosital 3 kinase, PI3K)/蛋白激酶B(protein kinase B, PKB/AKT)信号通路的活性.
肝癌组织及肝癌细胞系(Huh7、SMMC-7721、HCCLM3和HepG2)中均可检测到lncRNA TPT1-AS1的高表达. 转染siRNA-TPT1-AS1可抑制肝癌细胞HepG2的侵袭及迁移, 同时抑制HepG2细胞的EMT进程. 此外, 下调lncRNA TPT1-AS1可抑制MMP-9的表达及PI3K/AKT信号通路的活性.
LncRNA TPT1-AS1在肝癌中高表达. 敲减lncRNA TPT1-AS1可抑制肝癌细胞HepG2的侵袭迁移, 其作用机制可能与下调PI3K/AKT信号通路的活性以及下游基质金属蛋白酶9(matrix metalloproteinase 9, MMP-9)的表达, 进而抑制细胞的EMT进程有关.
核心提要: 长链非编码RNA(long non-coding RNA, lncRNA)肿瘤蛋白翻译调节因子1-反义RNA1(tumor protein translationally controlled regulator 1-antisence RNA 1, TPT1-AS1)在肝癌中表达上调. 敲除TPT1-AS1抑制HepG2细胞的EMT进程、迁移和侵袭, 并减弱其PI3K/AKT信号活性.
引文著录: 刘清秀, 汪晓梅, 吕娇健, 卢毅, 赵园, 樊晓鹏. 敲减LncRNA TPT1-AS1抑制肝癌细胞侵袭及迁移. 世界华人消化杂志 2021; 29(7): 340-346
Revised: February 24, 2021
Accepted: March 15, 2021
Published online: April 8, 2021
The long non-coding RNA (lncRNA) TPT1-AS1 has been proved to affect the migration and invasion of tumor cells by different means, but its specific role and related mechanisms in hepatic carcinoma still need further research.
To investigate the expression of TPT1-AS1 in hepatocarcinoma tissues and cell lines and explore its biological role in the invasion and migration of hepatocarcinoma cells.
Real-time quantitative PCR was used to measure lncRNA TPT1-AS1 expression in hepatocarcinoma tissue and cell lines (Huh7, SMMC-7721, HCCLM3, and HepG2). After being transfected with small interfering RNA (siRNA-TPT1-AS1), the invasion and migration of HepG2 cells were detected by transwell assay and wound healing assay. Western blot was used to measure the epithelial-mesenchymal transition (EMT) process and the activity of the PI3K/AKT pathway.
TPT1-AS1 was up-regulated in hepatopcarcinoma tissues and cell lines Huh7, SMMC-7721, HCCLM3, and HepG2. Transfection with siRNA-TPT1-AS1 noticeably restrained HepG2 cell invasion and migration, and suppressed the EMT process. Furthermore, TPT1-AS1 knockdown reduced MMP-9 expression and inhibited the activation of the PI3K/AKT pathway.
TPT1-AS1 is up-n regulated in hepatic carcinoma. Knockdown of TPT1-AS1 inhibits the invasion and migration of HepG2 cells via mechanisms that may be associated with reducing the activity of PI3K/AKT pathway and the expression of its downstream gene MMP-9, and inhibiting the EMT process.
- Citation: Liu QX, Wang XM, Lv JJ, Lu Y, Zhao Y, Fan XP. Knockdown of long non-coding RNA TPT1-AS1 inhibits invasion and migration of hepatocarcinoma cells. Shijie Huaren Xiaohua Zazhi 2021; 29(7): 340-346
- URL: https://www.wjgnet.com/1009-3079/full/v29/i7/340.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i7.340
长链非编码RNA(long non-coding RNA, lncRNA)是一类RNA转录的产物, 其转录本长度大于200 nt, 但不具备编码蛋白质的功能. LncRNA可通过多种方式影响基因的表达, 从而参与调控细胞的转分化、代谢以及增殖凋亡等生物学行为; 此外lncRNA还可调控细胞内以及细胞间复杂的信号通路, 进而影响肿瘤的发生发展进程[1,2]. 研究证实在包括胃癌、肝癌、肺癌以及乳腺癌等多类肿瘤中存在lncRNA的异常表达[3-6]. 肝癌是发病率和死亡率均高的常见恶性肿瘤之一, 其早期的诊疗手段依旧十分有限, 而lncRNA作为近年来备受关注的"明星分子", 有望为肝癌的诊疗以及靶点药物的设计提供新的思路和方法. 目前已有多项研究证实lncRNA可通过抑癌或促癌作用参与调控肝癌的发生发展. 如Wu等[7]的研究结果显示lncRNA MT1JP在肝癌组织中表达降低, 且可通过下调AKT抑制肝癌的进展. Lin等[8]的研究结果则显示lncRNA CRNDE可通过调控miR-33a-5p/CDK6轴在肝癌中发挥促癌作用.
肿瘤蛋白翻译调节因子1-反义RNA1(tumor protein translationally controlled regulator 1-antisence RNA 1, TPT1-AS1)位于13号染色体. 既往研究发现[9-11], TPT1-AS1在胃癌、卵巢癌以及结直肠癌等恶性肿瘤中异常高表达, 并可促进上述肿瘤细胞的增殖、迁移和侵袭; 但考虑到lncRNA作用的复杂性, lncRNA TPT1-AS1在肝癌中的具体作用和相关作用机制尚不清楚, 还需大量的实验验证. 本研究首先通过实时荧光定量PCR检测肝癌中lncRNA TPT1-AS的表达情况, 之后利用小分子干扰RNA下调肝癌细胞中lncRNA TPT1-AS的表达, 初步分析其对肝癌细胞侵袭及迁移能力的影响, 并通过western bot等检测手段进一步探讨其可能的作用机制, 以期为肝癌的诊疗提供潜在的靶点和一定的实验依据.
肝癌细胞系(Huh7、SMMC-7721、HCCLM3和HepG2)及人永生化肝细胞LO2均购自中科院上海细胞库; 胎牛血清(fetal bovine serum, FBS)、 I 减血清培养基(I reduced serum medium modification of Eagle's minimal essential medium, Opti-MEM)培养基、达尔伯克氏改良伊格尔氏培养基(Dulbecco's modification of Eagle's medium, DMEM)培养基均购自美国Gibco公司; Trizol试剂、LipofectAMINE2000购自美国Invitrogen公司; 靶向TPT1-AS1的小分子干扰RNA (siRNA targeted for TPT1-AS1, si-TPT1-AS1) 及其阴性对照小分子干扰RNA (siRNA targeted for negative control sequence, si-NC)由广州锐博生物技术有限公司合成; PrimeScriptTM RT Master Mix kit及SYBR-Green PCR Master Mix kit购自TaKaRa公司; 二辛可宁酸(bicinchoninic acid, BCA)蛋白定量试剂盒购自上海碧云天生物技术有限公司; 上皮钙黏蛋白(E-cadherin)、神经-钙粘蛋白(N-cadherin)、波形蛋白(vimentin)、基质金属蛋白酶9(matrix metalloproteinase 9, MMP-9)、和三磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体均购自美国Abcam公司; 磷酸肌醇3激酶(phosphotylinosital 3 kinase, PI3K)、磷酸化PI3K(phospho-PI3K, p-PI3K)抗体购自上海泊湾生物科技有限公司; 蛋白激酶B(protein kinase B, PKB/AKT)、磷酸化AKT(phospho-AKT, p-AKT)抗体购自美国Affinity Biosciences公司; 其余试剂均为国产市售分析纯.
1.2.1 临床标本收集: 收集2017-12/2019-12丽水市人民医院普外科肝胆病区行肝癌切除手术患者的癌组织及其配对的癌旁正常组织. 所有纳入研究的12例病例均经我院病理科确证为肝细胞癌, 配对癌旁组织中无癌细胞, 距离癌组织边缘2.0 cm以上, 且所选病例术前并未接受过放化疗和介入等治疗. 本研究所有的临床标本均经患者签署知情同意书并获得丽水市人民医院伦理委员会批准. 标本离体后迅速取材并并置于冻存管中放入液氮, 于-80 ℃超低温冰箱中保存备用.
1.2.2 细胞培养、分组及转染: 肝癌细胞系(Huh7、SMMC-7721、HCCLM3和HepG2)及人永生化肝细胞LO2均常规培养于含10% FBS的DMEM完全培养基中, 培养条件为37 ℃、含5%CO2的恒温细胞培养箱, 每2 d更换培养基一次, 每4-5 d细胞生长达80%左右时经0.25%的胰酶消化传代.
取对数生长期的HepG2细胞接种至6孔板中(接种密度为2×105个/mL), 并将细胞分为空白对照组(control, Ctrl)、阴性对照组(si-NC)和转染组(si-TPT1-AS1). 待细胞生长至约70%融合时进行转染. 将si-TPT1-AS1/si-NC和LipofectAMINE2000分别加入到Opti-MEM培养基中混匀, 室温孵育5 min, 然后将已经添加si-TPT1-AS1/si-NC的培养基与已经添加LipofectAMINE2000分别轻柔混合, 室温继续孵育25 min. 最后将混合物分别加至预设分组的各组细胞中, 置于37 ℃、含5%CO2的恒温细胞培养箱中连续培养6 h, 更换为完全细胞培养基继续培养48 h. 检测转染效率并进行后续实验分析.
1.2.3 划痕实验: 取对数生长期的HepG2细胞接种至6孔板中(预先用记号笔在培养板的背面画直线作为参考线), 接种密度为2×105个/mL. 依据实验分组转染si-NC或si-TPT1-AS1后, 将细胞板重新置于细胞培养箱中继续培养至细胞生长达到约90%融合. 用灭菌枪头依据参考线垂直在孔底划上划痕, PBS清洗后加入完全细胞培养基继续置于培养箱中培养. 分别在0 h和48 h时用倒置相差显微镜随机选取6个视野观察并采集细胞图像, 检测划痕的修复情况并衡量细胞的迁移能力.
1.2.4 Transwell实验: 预先将人工基底膜(Matrigel)基质胶解冻并用无血清的DMEM培养基按1:8的比例稀释, 之后用Matrigel胶均匀包被transwell小室的微孔膜上, 37 ℃孵育2 h. 用无血清培养基将各组细胞制成1×104个/mL的细胞悬浮液, 然后每组细胞取100 μL细胞悬浮液分别接种至transwell小室的上室, 在下室中加入700 μL完全细胞培养基, 置于细胞培养箱中继续培养48 h. 取出小室后用棉签轻柔擦除微孔膜上层的细胞, PBS清洗2次后加95%的乙醇固定微孔膜下层的细胞, 之后用体积分数为0.5%的结晶紫染液染色, PBS漂洗后, 于倒置显微镜下观察并计数穿膜细胞(每组取6个视野的均值) .
1.2.5 实时荧光定量PCR: 依据Trizol试剂盒说明书所提供的方法抽提组织或细胞总RNA, 经PrimeScriptTM RT Master Mix kit催化合成cDNA后, 采用SYBR-Green PCR Master Mix Kit经ABI PRISM 7700系统检测lncRNA TPT1-AS1的表达. lncRNA TPT1-AS1的正向引物序列为5'-AGGAGGCTATCCTTGCCCATC-3', 反向引物序列为5'-AATTGGAGGCCAGTGCTCTGAA-3'; GAPDH作为内参, 正向引物序列为5'-GCGACACCCACTCCTCCA CCTTT-3'; 反向引物序列为5'-TGCTGTAGCCAAATTCGTTGTCATA-3'. 反应参数设置: 95 ℃变性60 sec, 45个循环(94 ℃ 30 sec, 62 ℃ 45 sec). 结果采用2-△△CT法分析LncRNA TPT1-AS1的相对表达量.
1.2.6 Western blot: 各组细胞经过相应的处理后, 加RIPA裂解液于冰上裂解30 min并用橡胶刮轻柔刮取细胞蛋白. 采用BCA蛋白定量试剂盒定量后调整每组上样蛋白总量至60 μg, 加入蛋白上样缓冲液煮沸变性后行十二烷基硫酸钠(sodium dodecyl sulfate, SDS)凝胶电泳. 电泳结束后采用200 mA恒流电将蛋白转移至PVDF膜. 用质量分数为5%的脱脂牛奶室温封闭膜2 h. 依据各抗体说明书的要求加入一抗4 ℃孵育过夜, 洗膜缓冲液(tris-buffered saline with tween 20,TBST)震荡洗涤5 min×3次; 加入对应的二抗室温孵育2 h, TBST震荡洗涤10 min×3次, 将含蛋白的聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜转移至暗室中利用电化学发光法显影, 定影并冲洗胶片. 所得结果采用Image J行灰度半定量分析.
统计学处理 实验数据均录入SPSS 19.0软件中行统计学分析. 计量资料以均数±标准差(mean±SD)表示, 两组计量资料的统计学差异分析采用t检验, 多组计量资料间的统计学比较采用方差分析, P<0.05表示结果有统计学差异.
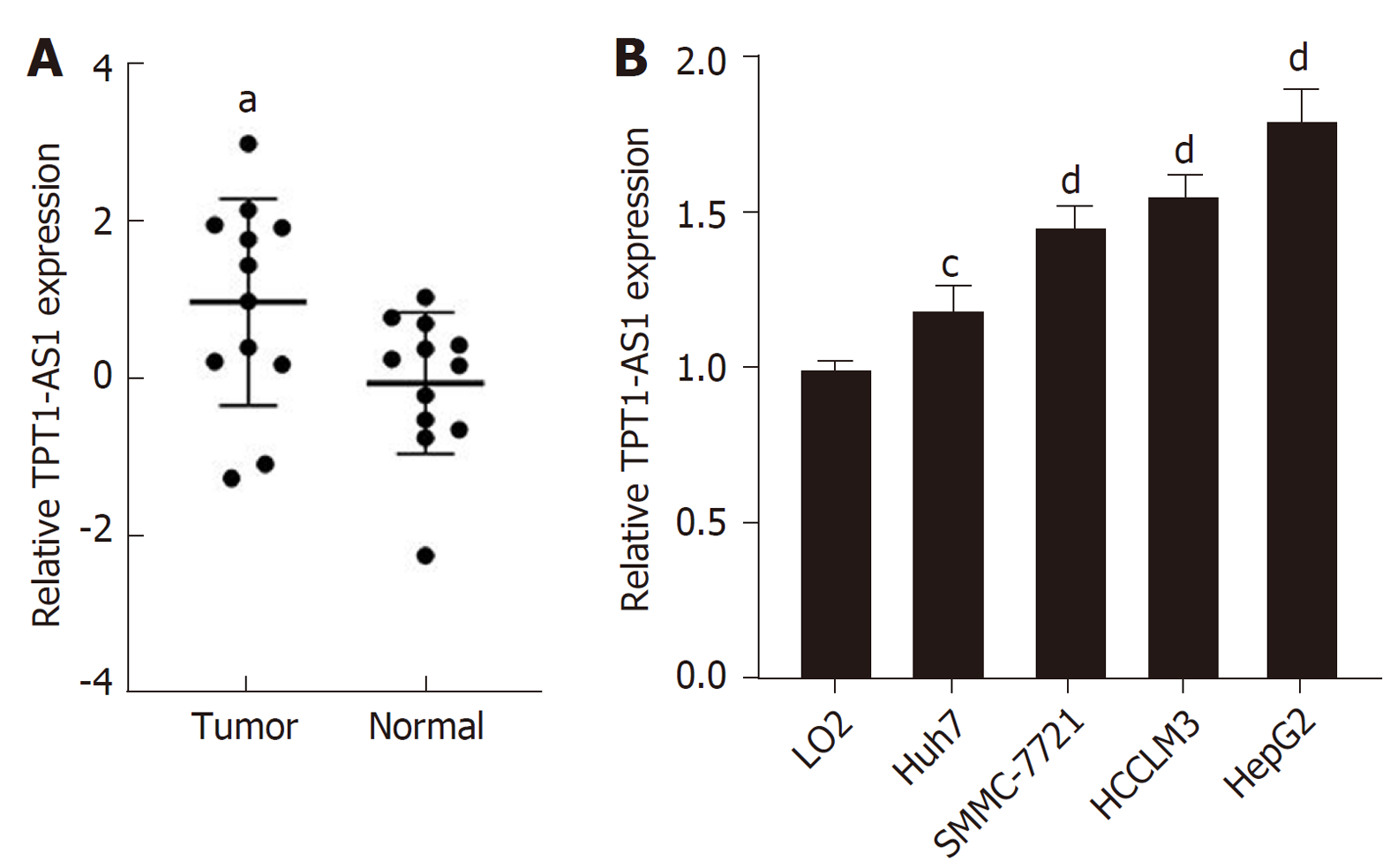
实时荧光定量PCR检测结果显示 (图1A和B), 在12例肝癌患者中, 相较于配对癌旁正常组织, 肝癌组织中lncRNA TPT1-AS1的表达显著升高(P = 0.036)(图1A); 在6次独立细胞实验中, 相较于人永生化肝细胞LO2, 肝癌细胞系Huh7、SMMC-7721、HCCLM3和HepG2中lncRNA TPT1-AS1的表达均出现不同程度的升高(图1B).
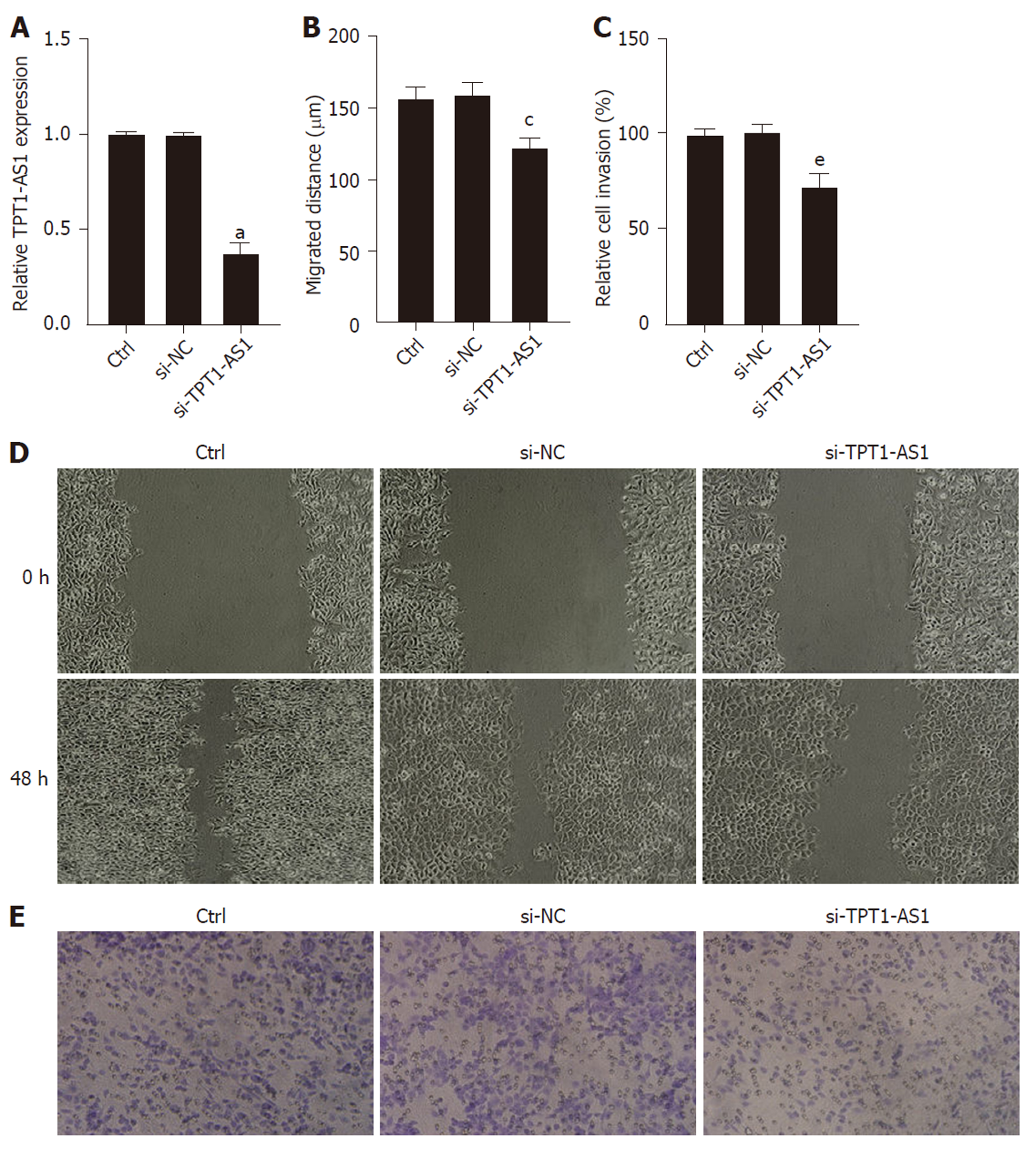
转染效率检测如图2A所示, 在6次独立细胞实验中, 转染siRNA-TPT1-AS1之后HepG2细胞中lncRNA TPT1-AS1的表达降低至对照组的0.38±0.05倍, 可用于后续实验.
划痕实验的结果如图2B和D所示, 在6次独立细胞实验中, Ctrl、si-NC和siRNA-TPT1-AS1组的迁移距离(μm)分别为: 156.2±9.31、161.3±10.03和122.6±6.47. 同样, Transwell实验的结果显示(图2C和E) , siRNA-TPT1-AS1组HepG2细胞的侵袭率显著降低至(73.12±5.99)%(P<0.05). 结果显示siRNA-TPT1-AS1可抑制肝癌细胞HepG2的侵袭及迁移.
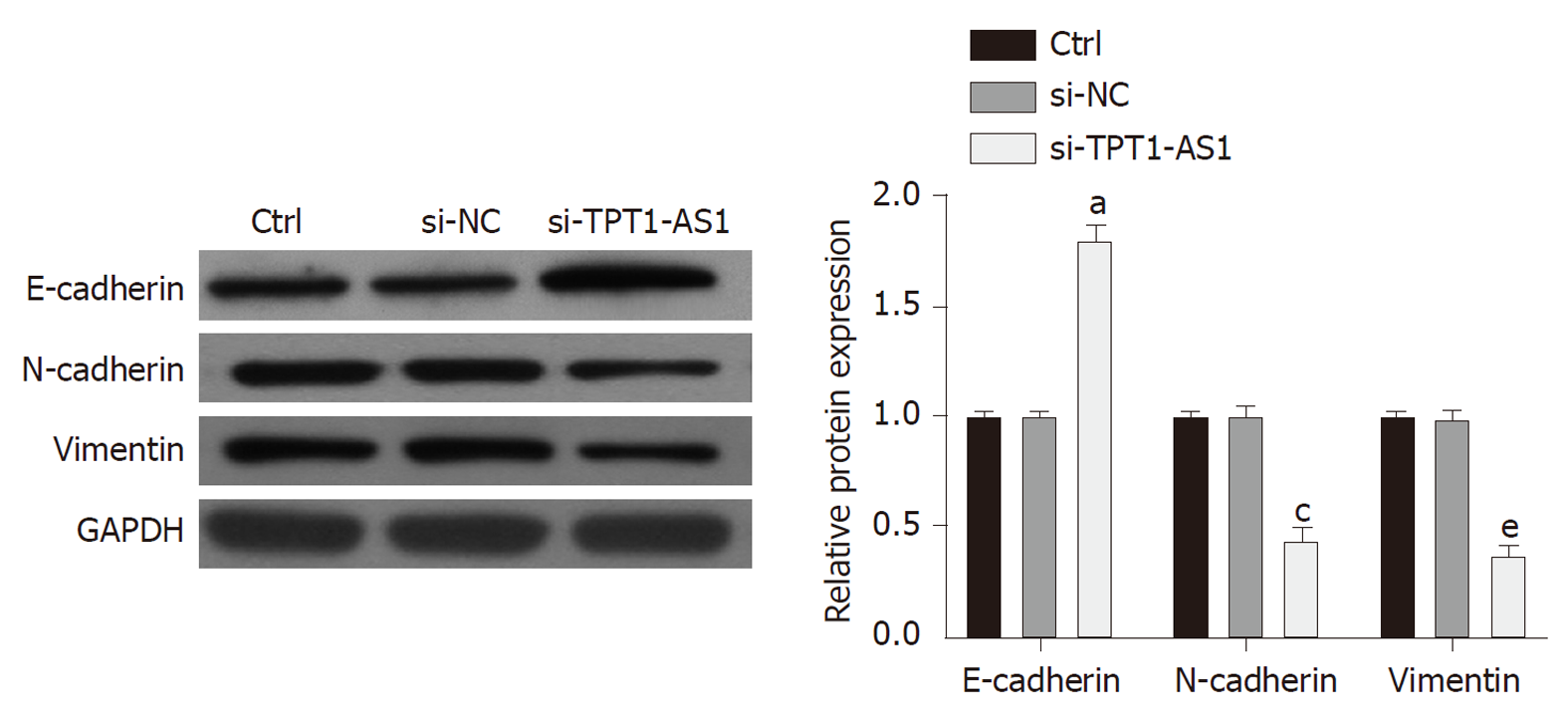
Western blot的检测结果如图3所示, 在6次独立细胞实验中, 转染siRNA-TPT1-AS1之后, HepG2细胞中上皮细胞标记物E-cadherin的表达显著增加(P<0.05), 而间质细胞标记物N-cadherin和vimentin的表达明显减少(P<0.05). 结果显示siRNA-TPT1-AS1可抑制肝癌细胞HepG2的EMT进程.
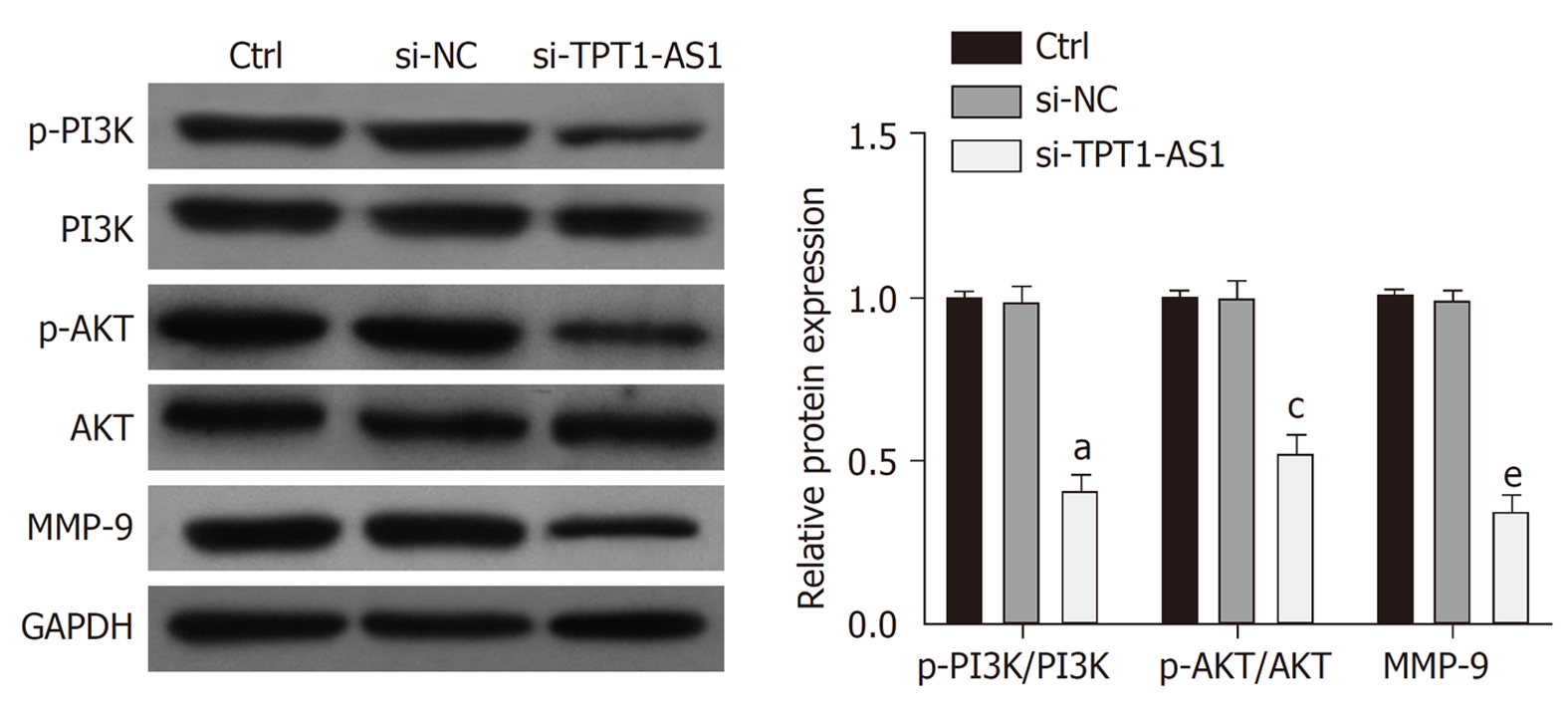
本实验检测了细胞中PI3K/AKT信号通路的活性, 结果显示(图4), 在6次独立细胞实验中, 相对于Ctrl组, 转染siRNA-TPT1-AS1后, MMP-9、p-PI3K/PI3K和p-AKT/AKT的蛋白表达水平显著降低(P<0.05). 说明在HepG2细胞中转染siRNA-TPT1-AS1可明显抑制PI3K/AKT信号通路的活性以及下游MMP-9的表达.
研究表明, lncRNA TPT1-AS1作为一个新的长链非编码RNA, 在不同的肿瘤中可通过不同的方式影响肿瘤的发生发展; 但其在肝癌中的作用尚不清楚. 本实验通过实时荧光定量PCR初步检测了肝癌中lncRNA TPT1-AS1的表达, 结果显示在肝癌组织及肝癌细胞中, lncRNA TPT1-AS1的表达均出现不同程度的升高. 这一结果提示, lncRNA TPT1-AS1可能在肝癌进展中发挥重要作用.
既往研究显示[9-11]lncRNA TPT1-AS1可影响胃癌、卵巢癌以及结直肠癌等恶性肿瘤的转移, 本实验通过下调lncRNA TPT1-AS1的表达, 系统的研究了其对肝癌细胞HepG2侵袭及迁移能力的影响, 并进一步探讨了其作用机制. 划痕实验和Transwell细胞侵袭实验的结果显示, 转染siRNA-TPT1-AS1可抑制肝癌细胞HepG2的侵袭及迁移. 上皮-间充质转分化(epithelial-mesenchymal transition, EMT)与肿瘤的侵袭迁移密切相关, 如lncRNA TUG1即是通过miR-137/AKT2轴影响肝癌细胞的EMT进程, 进而促进肝癌细胞的侵袭及迁移[12]. LncRNA HEIH则可通过miR-119a-3p影响肝癌细胞Huh7和Hep3B中vimentin、MMP-2以及MMP-3的表达, 进而调控细胞的增殖及迁移[13]. 我们的研究发现, 转染siRNA-TPT1-AS1之后, HepG2细胞中上皮细胞标志物(E-cadherin)表达升高而间质细胞标记物(N-cadherin, vimentin)的表达则明显下降, 提示下调lncRNA TPT1-AS1可抑制肝癌细胞HepG2的EMT进程.
细胞中有多条信号通路可影响肿瘤细胞的EMT进程、迁移与侵袭, 其中PI3k/Akt信号通路是一条多功能的经典信号通路, PI3K激活后磷酸化并激活AKT, 将其定位在质膜中, 进而通过AKT将信号传递到下游不同的靶点, 影响肿瘤细胞的增殖凋亡、侵袭迁移以及分化等生理过程[14,15]. Liu等[16]的研究显示, 在结直肠癌中, PI3K/AKT信号通路被激活后可促进核转录因子κB(nuclear transcription factor kappa-B, NF-κB)p65的活化及转位, 进而诱导EMT的发生. 在肝癌HepG2和HCCLM3细胞中, PI3K及AKT的磷酸化也是调控细胞EMT进程并影响细胞侵袭迁移的一个重要原因[17]. 故而本研究检测了lncRNA TPT1-AS1对PI3K/AKT信号通路的影响, 结果发现, 转染siRNA-TPT1-AS1后, p-PI3K/PI3K和p-AKT/AKT的蛋白表达水平显著降低. Zhu等[18]研究表明PI3K/AKT的抑制剂LY294002可抑制瘢痕疙瘩成纤维细胞中MMP-2与MMP-9的表达. Li等[19]的研究也显示Bmi-1的过表达通过介导PTEN/PI3k/Akt和上调MMP-2和MMP-9的表达参与了肝细胞癌的转移和侵袭, 提示MMP-2与MMP-9可能受到PI3k/Akt信号通路调节. 本实验的检测结果也证实在肝癌细胞HepG2中转染siRNA-TPT1-AS1可抑制MMP-9的表达. 以上结果提示下调lncRNA TPT1-AS1可能通过抑制HepG2细胞中PI3K/AKT信号通路的活性以及下游MMP-9的表达, 减少胞外基质的降解, 进而抑制细胞的EMT进程; 但是PI3K/AKT信号通路在其中的具体作用以及是否涉及其他信号通路和靶点还有待进一步深入的研究.
综上所述, lncRNA TPT1-AS1在肝癌组织及细胞中高表达, 敲减lncRNA TPT1-AS1可抑制肝癌细胞HepG2的侵袭迁移, 其作用机制可能与抑制PI3K/AKT信号通路的活性以及下游MMP-9的表达, 进而影响细胞的EMT进程有关.
长链非编码RNA(long non-coding RNA, lncRNA)在肝癌中可发挥抑癌或促癌作用, 其有望成为肝癌诊疗的新靶点.
LncRNA TPT1-AS1在多种恶性肿瘤中异常高表达, 并可促进肿瘤细胞的增殖、迁移和侵袭. 但, TPT1-AS1对肝癌细胞迁移和侵袭的影响尚不清楚.
研究TPT1-AS1对肝癌细胞迁移以及侵袭的影响, 以及潜在的机制.
用RT-qPCR检测肝癌组织与配对的癌旁组织样本、肝癌细胞系以及肝细胞LO2中lncRNA TPT1-AS1的表达. 以HepG2细胞为研究对象, 敲除TPT1-AS1后, 检测细胞迁移、侵袭、EMT进程以及PI3K/AKT信号活性.
分别与癌旁组织或肝细胞LO2比较, lncRNA TPT1-AS1在肝癌组织样本和肝癌细胞系中表达增高. 敲除TPT1-AS1后, HepG2细胞的迁移、侵袭、EMT进程以及PI3K/AKT信号活性均降低.
敲除TPT1-AS1能抑制肝癌细胞的迁移、侵袭、EMT进程以及PI3K/AKT信号活性.
靶向抑制TPT1-AS1可能是潜在的肝癌的治疗策略.
学科分类: 胃肠病学和肝病学
手稿来源地: 浙江省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C, C
D级 (一般): 0
E级 (差): E
科学编辑: 张砚梁 制作编辑:张砚梁
| 1. | Renganathan A, Felley-Bosco E. Long Noncoding RNAs in Cancer and Therapeutic Potential. Adv Exp Med Biol. 2017;1008:199-222. [PubMed] [DOI] |
| 2. | Peng WX, Koirala P, Mo YY. LncRNA-mediated regulation of cell signaling in cancer. Oncogene. 2017;36:5661-5667. [PubMed] [DOI] |
| 3. | Lim LJ, Jin Y, Yang H, Chung AYF, Goh BKP, Chow PKH, Chan CY, Blanks WK, Cheow PC, Lee SY, Lim TKH, Chong SS, Ooi LLPJ, Lee CG. Network of clinically-relevant lncRNAs-mRNAs associated with prognosis of hepatocellular carcinoma patients. Sci Rep. 2020;10:11124. [PubMed] [DOI] |
| 4. | Liu Y, Sharma S, Watabe K. Roles of lncRNA in breast cancer. Front Biosci (Schol Ed). 2015;7:94-108. [PubMed] |
| 5. | Chen R, Li WX, Sun Y, Duan Y, Li Q, Zhang AX, Hu JL, Wang YM, Gao YD. Comprehensive Analysis of lncRNA and mRNA Expression Profiles in Lung Cancer. Clin Lab. 2017;63:313-320. [PubMed] [DOI] |
| 6. | Li Y, Ma D, Li T, Yin Y. Identification of functional long non-coding RNAs in gastric cancer by bioinformatics analysis. Int J Exp Pathol. 2020;101:96-105. [PubMed] [DOI] |
| 7. | Wu JH, Xu K, Liu JH, Du LL, Li XS, Su YM, Liu JC. LncRNA MT1JP inhibits the malignant progression of hepatocellular carcinoma through regulating AKT. Eur Rev Med Pharmacol Sci. 2020;24:6647-6656. [PubMed] [DOI] |
| 8. | Lin C, Xiang Y, Sheng J, Liu S, Cui M, Zhang X. Long non-coding RNA CRNDE promotes malignant progression of hepatocellular carcinoma through the miR-33a-5p/CDK6 axis. J Physiol Biochem. 2020;76:469-481. [PubMed] [DOI] |
| 9. | Tang J, Huang F, Wang H, Cheng F, Pi Y, Zhao J, Li Z. Knockdown of TPT1-AS1 inhibits cell proliferation, cell cycle G1/S transition, and epithelial-mesenchymal transition in gastric cancer. Bosn J Basic Med Sci. 2021;21:39-46. [PubMed] [DOI] |
| 10. | Wu W, Gao H, Li X, Zhu Y, Peng S, Yu J, Zhan G, Wang J, Liu N, Guo X. LncRNA TPT1-AS1 promotes tumorigenesis and metastasis in epithelial ovarian cancer by inducing TPT1 expression. Cancer Sci. 2019;110:1587-1598. [PubMed] [DOI] |
| 11. | Zhang Y, Sun J, Qi Y, Wang Y, Ding Y, Wang K, Zhou Q, Wang J, Ma F, Zhang J, Guo B. Long non-coding RNA TPT1-AS1 promotes angiogenesis and metastasis of colorectal cancer through TPT1-AS1/NF90/VEGFA signaling pathway. Aging (Albany NY). 2020;12:6191-6205. [PubMed] [DOI] |
| 12. | Li W, Ge J, Xie J, Yang J, Chen J, He T. LncRNA TUG1 Promotes Hepatocellular Carcinoma Migration and Invasion Via Targeting miR-137/AKT2 Axis. Cancer Biother Radiopharm. 2020;. [PubMed] [DOI] |
| 13. | Wu MM, Shen WD, Zou CW, Chen HJ, Guo HM. LncRNA-HEIH suppresses hepatocellular carcinoma cell growth and metastasis by up-regulating miR-199a-3p. Eur Rev Med Pharmacol Sci. 2020;24:6031-6038. [PubMed] [DOI] |
| 14. | Xia P, Xu XY. PI3K/Akt/mTOR signaling pathway in cancer stem cells: from basic research to clinical application. Am J Cancer Res. 2015;5:1602-1609. [PubMed] |
| 15. | Rahmani F, Ziaeemehr A, Shahidsales S, Gharib M, Khazaei M, Ferns GA, Ryzhikov M, Avan A, Hassanian SM. Role of regulatory miRNAs of the PI3K/AKT/mTOR signaling in the pathogenesis of hepatocellular carcinoma. J Cell Physiol. 2020;235:4146-4152. [PubMed] [DOI] |
| 16. | Liu W, Wang S, Sun Q, Yang Z, Liu M, Tang H. DCLK1 promotes epithelial-mesenchymal transition via the PI3K/Akt/NF-κB pathway in colorectal cancer. Int J Cancer. 2018;142:2068-2079. [PubMed] [DOI] |
| 17. | Sun C, Zhang Z, He P, Zhou Y, Xie X. Involvement of PI3K/Akt pathway in the inhibition of hepatocarcinoma cell invasion and metastasis induced by SASH1 through downregulating Shh-Gli1 signaling. Int J Biochem Cell Biol. 2017;89:95-100. [PubMed] [DOI] |
| 18. | Zhu W, Wu X, Yang B, Yao X, Cui X, Xu P, Chen X. miR-188-5p regulates proliferation and invasion via PI3K/Akt/MMP-2/9 signaling in keloids. Acta Biochim Biophys Sin (Shanghai). 2019;51:185-196. [PubMed] [DOI] |
| 19. | Li X, Yang Z, Song W, Zhou L, Li Q, Tao K, Zhou J, Wang X, Zheng Z, You N, Dou K, Li H. Overexpression of Bmi-1 contributes to the invasion and metastasis of hepatocellular carcinoma by increasing the expression of matrix metalloproteinase (MMP)2, MMP-9 and vascular endothelial growth factor via the PTEN/PI3K/Akt pathway. Int J Oncol. 2013;43:793-802. [PubMed] [DOI] |